1 Stoffe und Atome - Klett3. gasförmig sind: Kohlenstoffdioxid, Sauerstoff, Helium b) Der...
Transcript of 1 Stoffe und Atome - Klett3. gasförmig sind: Kohlenstoffdioxid, Sauerstoff, Helium b) Der...
-
Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz 1
1 Stoffe und Atome
1.1 Auf den Stoff kommt es an
Zu den AufgabenA1 a) Eistee, Cola light, Fanta, Sprite enthalten Citronensäure.Viele Marmeladen und Puddingpulver enthalten Citronensäure. Citronensäure und deren Salze sind als Zusatzstoffe bei der ökologischen Wurstherstellung erlaubt. In einigen Fleischwaren sind Salze der Citronensäure enthalten.
b) Tomatenketchup1. Beispiel: Tomaten, Branntweinessig, Zucker, Salz, Gewürzextrakt (enthält Sellerie), Gewürze2. Beispiel: 76 % Tomatenmark, Branntweinessig, Glucose-Fructose-Sirup, Zucker, modifizierte Stärke, Speisesalz, Verdickungsmittel Xanthan, natürliches Aroma3. Beispiel: 58 % Tomatenmark, Wasser, Zucker, modifizierte Stärke, Branntweinessig, Speisesalz, Senf, Gewürze
Zusatzinformationen: Citronensäure (Zitronensäure) und ihre Salze werden zur Konservierung, zur Homogenisierung als Schmelzsalz, als Säuerungsmittel und Komplexbildner für Lebensmittel verwendet. Citronensäure wird Limonaden und Eistee zugesetzt, in Fruchtsäften kommt sie auch natürlich vor. In der EU ist Citronensäure als Lebensmittelzusatzstoff unter der Nummer E 330 in den meisten Lebensmitteln unbegrenzt zugelassen. Eine Ausnahme bilden zum Beispiel Schokoladenerzeugnisse und Fruchtsäfte, für die nur eine begrenzte Zulassung vorliegt, und einige Lebensmittel, wie zum Beispiel Honig, Milch und Butter, für die keine Zulassung vorliegt.
Der Lebensmittelzusatzstoff E 330 wird meist von Schimmelpilzen hergestellt. Es gibt Hinweise darauf, dass durch E 330 Metall-Ionen, wie z. B. Aluminium-Ionen, besser ins Blut aufgenommen werden. Zudem können Aluminium-Ionen möglicherweise mithilfe von E 330 die Blut-Hirn-Schranke besser passieren. Es wird diskutiert, dass sich die Aluminium-Ionen als Folge davon im Gehirn ablagern. Es gibt den Verdacht, dass ein Zusammenhang der Ablagerung von Aluminium-Ionen im Gehirn mit Demenzerkrankungen besteht.
A2
Gegenstand Stoffe Eigenschaften
Pullover Baumwolle saugt Wasser auf
Gummistiefel Gummi weist Wasser ab
Messer Stahl hart, glänzend, lässt sich schleifen
Kunststofftrinkbecher Kunststoff, PE, PP leicht, leitet schlecht die Wärme, bruchsicher
Holzlöffel Holz leitet schlecht die Wärme
Griff eines Schraubendrehers Holz, Kunststoff leitet den elektrischen Strom nicht
Kupferkabel Kupfer leitet gut den elektrischen Strom
Eiswürfel Wasser farblos, geruchlos, schmilzt bei Zimmertemperatur
Steckbausteine Kunststoff glänzt, glatt, formstabil
A3 a) Bekannte Stoffe, die bei Zimmertemperatur (20 °C) und Normdruck (1013 hPa) 1. fest sind: Zucker, Salz, Mehl2. flüssig sind: Wasser, Alkohol, Essig, Cola3. gasförmig sind: Kohlenstoffdioxid, Sauerstoff, Helium
b) Der Aggregatzustand eines Stoffes hängt von der Temperatur und dem Druck ab. Das Feuerzeug - gas wird unter dem Druck, der im Feuerzeug bei Zimmertemperatur vorliegt, flüssig.
DO01756204_k01_L.indd 1 17.05.2016 17:29:31
-
2 Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz
1 Stoffe und Atome
Hinweis: Es gibt Gasfeuerzeuge, die fast nur Isobutan mit sehr geringen Anteilen weiterer Kohlenwasserstoffe enthalten, und Gasfeuerzeuge, die im Wesentlichen ein Gemisch aus Butan, Isobutan und Propan enthalten.
c) Das feste Wachs schmilzt, steigt im Docht auf und verdampft. Das gasförmige Wachs verbrennt.
A4 Das Stück Würfelzucker auf dem Boden des Becherglases löst sich allmählich auf. Die Zucker- teilchen wandern in die Lücken zwischen den Wasserteilchen, zunächst in der Umgebung des Würfelzuckerstückes. Nach und nach wandern die Zuckerteilchen weiter, bis sie gleichmäßig im Wasser verteilt sind.
A5 Beim Zünden von Silvesterraketen sollte unbedingt eine Schutzbrille getragen werden, um die Augen zu schützen. Es kommt auch beim Einsatz von amtlich zugelassenen Raketen immer wieder zu unbeabsichtigten Explosionen. Böller können zu früh explodieren. Sicherheitsabstände werden nicht eingehalten.
A6 Es verbirgt sich der Stoff Kohlenstoffdioxid. Seine Teilchen (Moleküle) sind aus einem Kohlenstoff-Atom und zwei Sauerstoff-Atomen aufgebaut.
A7 Kalium: von arabisch al-qali, aus Pflanzenasche gewinnbarChlor: von griechisch chlorós, gelblich grün (wegen der gelbgrünen Farbe von Chlorgas)Brom: von griechisch bromós, Gestank (aufgrund des beißenden Geruchs von Bromdämpfen)Nickel: Benannt nach dem bösen Erdgeist „Nickel“. Man verwechselte oft Nickel mit Silber und machte dafür den Erdgeist verantwortlich.
A8 a) Rosinen auslesen, b) Salzwasser und Sand durch Dekantieren oder besser Filtrieren trennen, c) Salzwasser eindampfen.
ZusatzinformationJöns Jakob Berzelius geboren 20. August 1779 in Väversunda, Östergötland, Schwedengestorben 7. August 1848 in Stockholm
Berzelius verlor im Alter von vier Jahren seinen Vater. Er studierte Medizin an der Universität Uppsala, wo er eine Abschlussarbeit über die Effekte von galvanischer Elektrizität auf Patienten anfertigte.Seine ersten chemischen Erfahrungen sammelte er durch die Analyse von Mineralwässern. Dies führte zu einer unbezahlten Stelle am Kolleg für Medizin in Stockholm, wo er im Hause von Wilhelm Hisinger, einem reichen wissenschaftlichen Amateur, wohnte und mit ihm zusammen elektrochemische Studien durchführte. Berzelius beschwerte sich später, dass Humphry Davy davon den meisten Vorteil hatte.
1810 bekam er eine feste Stelle am Karolinska Institutet. Dort gelangte er zur Meisterschaft in allen damaligen chemischen Disziplinen. Er publizierte eine Tabelle der Atommassen (Atom-gewichte), begründete die chemische Elementaranalyse und führte die auch heute gebräuchliche Symbolschreibweise ein: Die Elemente werden durch den oder die beiden Anfangsbuchstaben des griechischen oder lateinischen Namens des Elementes gebildet.Berzelius führte grundlegende Begrifflichkeiten der organischen Chemie ein und prägte unter anderem die Begriffe Allotropie, Isomerie und Katalysator. Berzelius vertrat die Auffassung, dass organische Verbindungen nur von lebenden Organismen aufgebaut werden können.Zudem gehen auf ihn Bestimmungen der Atomgewichte sowie die Entdeckung der Elemente Cer (1803), Selen (1817), Lithium (ebenfalls 1817, zusammen mit Johan August Arfwedson) und Thorium (1828) zurück.
DO01756204_k01_L.indd 2 17.05.2016 17:29:31
-
Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz 3
1 Stoffe und Atome
Als Persönlichkeit wurde Berzelius als sehr temperamentvoll und leicht reizbar beschrieben. Berzelius war Lehrer, Kollege und Freund von Friedrich Wöhler.
1.2 Stoffe und Stoffeigenschaften
Zu den VersuchenV1 In B4 sind Batterien als Stromquelle dargestellt. Der Vorteil gegenüber einem Netzgerät ist, dass die Spannung feststehend klein ist und das Glühlämpchen bei passender Wahl nicht durch- brennt. Benutzt man ein Netzgerät, so besteht die Gefahr, dass Schüler die Spannung erhöhen, wenn bei einem Experiment das Lämpchen nicht aufleuchtet. Bei einem Folgeexperiment mit einem leitfähigen Stoff brennt das Lämpchen dann durch. Ein Nachteil beim Einsatz einer Batterie besteht natürlich darin, dass die Batterien im Laufe der Zeit entladen werden und vor dem Einsatz geprüft werden müssen.
V2 Als Hilfsmittel eignen sich Magnete, wie sie bei Schrankmöbeln als Türmagnete Verwendung finden. Sie sind recht stark und ziehen auch schwach magnetisierbare Gegenstände an.
Zu den AufgabenA1 Wörter, die den Begriff „Stoff“ enthalten, sind z. B. Sauerstoff, Feststoff, Wollstoff, Nährstoff, Rohstoff, Ballaststoff …
A2 Als gemeinsame Eigenschaften von Metallen können genannt werden: Oberflächenglanz (evtl. erst nach Bearbeitung der Oberfläche), elektrische Leitfähigkeit (Ausnahme: Graphit ist kein Metall und leitet dennoch den elektrischen Strom), Verformbarkeit.
A3 Man nimmt eine bestimmte Portion Wasser, z. B. 100 ml, und setzt portionsweise abgewogene Mengen an Citronensäure, z. B. jeweils 5 g, zu, bis diese sich auch nach Rühren nicht mehr löst. Durch Verzehnfachen der gerade noch löslichen Masse, kann man dann die Löslichkeit von Citronensäure in 1 l Wasser bestimmen (750 g/l bei 20 °C).Andere Möglichkeit: Man wiegt ein Becherglas mit z. B. 100 ml Wasser. Dann setzt man portions-weise so lange Citronensäure zu, bis sie sich auch durch Rühren nicht mehr löst und wiegt das Gefäß samt Inhalt erneut. Die Differenz der Massen entspricht (ungefähr) der Masse an gelöster Citronensäure.
1.3 Dichte
Um Schülerinnen/Schüler an den Begriff der Dichte heranzuführen, kann man Körper aus ver- schiedenen Stoffen, z. B. aus Eisen und Aluminium, vorstellen. Daraus ergibt sich als erste Annäherung die häufige Schülerantwort: „Eisen ist schwerer als Aluminium“. Für eine begriffliche Ausschärfung ergibt sich dann, dass für einen aussagefähigen Vergleich gleich große Körper, d. h. Körper gleichen Volumens, vorliegen müssen. Um einen charakteristischen Zahlenwert zu erhalten, wird die Masse der Körper durch die Anzahl der Kubikzentimeter dividiert. So erhält man die Masse eines Kubikzentimeters. Dabei kann es aber nicht bleiben, denn dann wäre die Dichte eine spezielle Masse einer bestimmten Stoffportion.Sie kann aber an jeder beliebigen Portion eines Stoffes ermittelt werden, wenn Masse und Volumen des betreffenden Körpers bekannt sind. Der Wert des Quotienten für Körper aus dem gleichen Stoff ist immer gleich. Die Dichte ist eine Quotientengröße aus Masse und Volumen. Masse und Volumen sind Größen, die davon abhängen, wie groß, „ausgedehnt“, eine Stoffportion ist. Sie werden deshalb als extensive Größen bezeichnet. Der Quotient aus beiden, die Dichte, ist von der Ausdehnung der Stoffportion unabhängig und wird auf den Stoff bezogen. Es ist eine intensive Größe.
DO01756204_k01_L.indd 3 17.05.2016 17:29:31
-
4 Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz
1 Stoffe und Atome
Hilfreich kann in diesem Zusammenhang der Bezug zu einem Problem des Alltags sein. Im Käseregal liegen abgepackte Stücke zweier Käsesorten mit aufgedruckter unterschiedlicher Masse und dem ebenfalls unterschiedlichen Geldbetrag, der zu zahlen ist. Welche der beiden Käsesorten ist die billigere? Um dies festzustellen, müsste der Kunde entweder nach Stücken gleicher Masse suchen oder rechnerisch den Quotienten aus dem Geldbetrag und der Masse je eines Käsestückes bilden. Diese Rechenoperation ist aber überflüssig, wenn der spezifische Preis z. B. in der Einheit ¤/kg aufgedruckt ist.
Zu den VersuchenV1 Falls Metallquader vorliegen, lassen sich mithilfe einer Schieblehre deren Kantenlängen bestimmen und die Volumina berechnen. Anderenfalls wird das Volumen wie in B4 durch Wasserverdrängung ermittelt. Geeignet sind Aluminiumprofile aus dem Baumarkt mit einem passenden Durchmesser. Wichtig ist es in diesem Fall, den Schülern vorher das genaue Ablesen des Volumens in einem Messzylinder zu erklären. Das zweimalige Ablesen des Volumens stellt eine recht große Fehlerquelle dar. Indem man den Durchschnittswert aller Ergebnisse der Schülergruppen ermittelt, kommt man aber zu einem recht guten Ergebnis.
V2 Die Ausführung des Versuchs ist im Schülerbuch auf S. 19 oben beschrieben.
Zu den AufgabenA1 Die Masse der Alkoholportion ergibt sich aus der Differenz der beiden Wägungen:112,5 g – 73 g = 39,5 gDivision der Masse der Alkoholportion durch ihr Volumen führt zur Dichte des Alkohols:
m_ V=r
39,5 g
___ 50 cm3 = 0,79 g/cm3
Alkohol hat die Dichte 0,79 g __ cm3 .
A2Dichte (Eisen) =
Masse (Eisen) ________ Volumen (Eisen) r =
m_ V
Volumen (Eisen) = Masse (Eisen)
_______ Dichte (Eisen) V = m
_ r
Volumen (Eisen) = 3 g _____ 7,87 g/cm3
Volumen (Eisen) = 3 __ 7,87 cm3 = 0,38 cm3
A3 Archimedes bestimmte das Volumen der Krone durch Wasserverdrängung. Als nächstes bestimmte er auf die gleiche Weise das Volumen eines Goldbarrens gleicher Masse. Ergeben sich gleiche Volumina, bedeutet dies, dass die Dichte des Kronenmaterials der Dichte von Gold entspricht (19,3 g/cm3 bei 20 °C). Die Krone besteht (unter Berücksichtigung der damals verarbei-teten Metalle) dann aus reinem Gold.
1.4 Schmelz- und Siedetemperatur
Bei Schülern entsteht manchmal der Eindruck, dass ein Stoff, dessen Temperatur oberhalb der Schmelztemperatur und unterhalb der Siedetemperatur liegt, ausschließlich als Flüssigkeit vorliegt. Es gibt eine Reihe von Beobachtungen, die diese Vorstellung am Beispiel des Wassers widerlegen. Das Verdunsten von Wasser zeigt an, dass gasförmiges Wasser auch unterhalb der Siedetempe-ratur (100 °C bei Normdruck) vorliegen kann. Die Sublimation zeigt, dass sogar unter halb von 0 °C
DO01756204_k01_L.indd 4 17.05.2016 17:29:32
-
Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz 5
1 Stoffe und Atome
Wasser gasförmig sein kann. Eine Kondensation kann auch weit unter der Temperatur von 100 °C erfolgen, wie die Bildung von Nebel belegt. Diese Phänomene sind nur mit dem Begriff des Dampfdruckes richtig zu erklären, der im Kap. 1.8 angesprochen wird.
Zum VersuchV2 Die Erstellung einer Erstarrungskurve kann sowohl mit Stearinsäure als auch mit Cetylalkohol vorgenommen werden. Allerdings liegt die Stearinsäure häufig nicht in genügend reinem Zustand vor, um eine Erstarrungstemperatur zu erreichen, die der Stoffkonstanten entspricht. Mit Cetyl - alkohol (hsm = 49 °C) lassen sich gute Werte erzielen. Die Temperaturmessung sollte auf jeden Fall so lange fortgesetzt werden, bis nach der Plateauphase ein deutliches Absinken der Temperatur festzustellen ist.
ZusatzversuchEine lohnende Alternative zu den angegebenen Versuchen ist die Aufnahme eines Erstarrungs-diagramms von Wasser. Man benötigt hierzu ein Digitalthermometer mit großer, von den Schülerinnen und Schülern beobachtbarer Anzeige, ein kleines Reagenzglas (6 mm × 60 mm), eine Stoppuhr und eine Kältemischung. Die Kältemischung besteht aus einer konzentrierten wässrigen Lösung von Natriumchlorid (Spülmaschinensalz), die man über Nacht ins Eisfach des Kühl-schranks stellt. Man erhält so eine Lösung, deren Temperatur zwischen –12 und –18 °C liegt (je nach Kühlschrankeinstellung). Man füllt das kleine Reagenzglas etwa halbvoll mit Wasser, steckt den Thermofühler hinein und hält es in die Kältemischung, während man mit dem Fühler ständig umrührt (Vermeidung von Unterkühlung). Zu diesem Zeitpunkt wird die Uhr gestartet, und die Schülerinnen und Schüler nehmen in Abständen von z. B. 20 s Tempe raturwerte auf, die sie in eine Wertetabelle eintragen. Die Temperatur sinkt zunächst (erwar tungsgemäß) ab, bleibt dann aber über längere Zeit konstant und sinkt erst weiter ab, wenn der Fühler sich im Reagenzglas nicht mehr bewegen lässt. Die erhaltenen Werte werden von den Schülerinnen und Schülern in ein Diagramm übertragen. Sie erhalten so eine Abkühlungs kurve. Die entsprechende Schmelzkurve kann man gleich anschließend aufnehmen lassen. Man führt den Versuch in gleicher Weise durch, nur dass man jetzt das kalte Reagenzglas mit der Hand umschließt und so langsam aufwärmt.
Zur AufgabeA1
fest Schwefel, Blei, Kochsalz, Eisen
flüssig Ether, Alkohol, Quecksilber, Benzol, Glycerin
gasförmig Sauerstoff
Man beachte aber, dass die Flüssigkeiten Ether, Alkohol usw. einen Dampfdruck haben, sodass deren Moleküle etc. auch in der Gasphase vertreten sind. Ether, Alkohol, Quecksilber und Benzol sind bei Zimmertemperatur auch gasförmig.
1.5 Praktikum Experimente zu Cola-Getränken
Zu den VersuchenV1 HinweiszurDurchführung: Zum Ausrühren des Kohlenstoffdioxids empfiehlt sich der Einsatz eines Handrührgeräts. Es zeigt sich, dass das abgestandene Cola-Getränk eine höhere Dichte als das frische Cola-Getränk hat.
V2 HinweiszurDurchführung: Der Versuch sollte vor seinem Einsatz ausprobiert werden. Die Brause tabletten der verschiedenen Hersteller haben eine unterschiedliche Masse und entwickeln nicht die gleiche Kohlenstoffdioxidportion.
Temperatur in °C
Zeit in min
100
80
60
40
20
0
B1 Zu V2 Erstarrungsdiagramm von Cetylalkohol
DO01756204_k01_L.indd 5 17.05.2016 17:29:32
-
6 Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz
1 Stoffe und Atome
Vom Autor ist der Versuch mit „ja! - Vitamin C – Brausetabletten“, hergestellt für die REWE Handelsgruppe GmbH, 50603 Köln, und mit „Calcium – Brausetablette mit Orangengeschmack“, dm-Drogeriemarkt, durchgeführt worden.Eine „ja! - Vitamin C – Brausetablette“ wiegt ca. 6 g. Wenn von dieser Brausetablette eine halbe Tablette mit der Masse 3 g eingesetzt wird, so erhält man neben dem gelösten Kohlenstoffdioxid noch ca. 80 ml Kohlenstoffdioxid-Gas. Dieses bedeutet, dass mit der zweiten Hälfte der Brause-tablette das Kohlenstoffdioxid die gesamte Flüssigkeit aus dem Messzylinder verdrängt und das Volumen des Kohlenstoffdioxids nicht mehr erfasst werden kann.Als günstig hat es sich erwiesen, zunächst eine Tablettenportion mit der Masse von 1,5 g ein-zusetzen. Es ist dann eine sehr lebhafte Gasentwicklung zu beobachten, Gasblasen steigen auf, aber im Messzylinder ist zunächst kaum ein Gasvolumen beobachtbar. Am Ende erhält man 10 bis 20 ml gasförmiges Kohlenstoffdioxid. Legt man danach wieder eine Brausetablettenportion mit der Masse 1,5 g unter den Messzylinder, so ist wiederum eine starke Gasentwicklung zu beobachten, proportional dazu nimmt das Gasvolumen im Messzylinder zu. Am Ende erhält man ca. 60 ml Kohlenstoffdioxid.Die Calcium-Brausetabletten mit Orangengeschmack wiegen ca. 4 g.Gibt man eine halbe Tablette mit der Masse von 2 g unter den Messzylinder, so ist auch hier eine lebhafte Gasentwicklung zu beobachten, im Messzylinder ist zunächst kein bzw. ein sehr geringes Gasvolumen beobachtbar. Am Ende erhält man neben dem gelösten Kohlenstoffdioxid 10 bis 20 ml gasförmiges Kohlenstoffdioxid. Gibt man danach die zweite Hälfte der Tablette in den Messzylinder, so beträgt das Gasvolumen am Ende 70 bis 80 ml.Bei den Experimenten erhält man nicht immer genau die gleichen Gasvolumina, weil auch ein wenig Gas aus dem Messzylinder in das Wasser der Kunststoffwanne entweicht.Aus den Experimenten geht aber eindeutig und eindrucksvoll hervor, dass sich das zunächst gebildete Kohlenstoffdioxid im Wasser löst. Erst wenn die Lösung gesättigt ist, verdrängt das gasförmige Kohlenstoffdioxid die Sperrflüssigkeit. Im Hinblick auf die Betrachtung von „kohlensäurehaltigen“ Getränken lässt sich mit diesem Versuch demonstrieren, dass Kohlenstoffdioxid, ein Gas, sich gut in Wasser löst.
V3 Daten aus einem Versucha) Herstellung der Eichgeraden
Masse des Messzylinders, leer 36,41 g 43,52 g 52,53 g 37,57 g
Masse des zugegebenen Zuckers 4 g 8 g 12 g 16 g
Masse des Messzylinders mit 100 ml Zuckerlösung
137,39 g 146,07 g 156,80 g 143,28 g
Masse der Zuckerlösung 100,98 g 102,56 g 104,27 g 105,71 g
Dichte der Zuckerlösung 1,010 g/ml 1,026 g/ml 1,043 g/ml 1,057 g/ml
DO01756204_k01_L.indd 6 17.05.2016 17:29:32
-
Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz 7
1 Stoffe und Atome
b) Dichte des Cola-Getränkesr (Cola) = 1,036 g/mlDichtediagramm und Bestimmung des Zuckergehaltes des Cola-Getränkes:
4 8 12 16 20
1,06
1,05
1,04
1,03
1,02
1,01
Dichte in g/ml
Massenkonzentration des Zuckers in g/(100 ml)
x
x
x
x
Die Auswertung ergibt einen Zuckergehalt von ca. 10,5 g/(100 ml).In Nährwerttabellen werden Werte zwischen 10,6 und 11,0 g/(100 ml) angegeben.
Der Graph verläuft nicht durch den Ursprung, da bei den Messbedingungen die Dichte des Wassers kleiner ist als 1,00 g/ml.
1.7 Diffusion und Kugelteilchenmodell
Zu den VersuchenV1 Vom Kaliumpermanganatkristall steigen zunächst violette Schlieren auf (Einsetzen der Dif - fusion durch die Brown’sche Molekularbewegung). Nach ca. 5 Stunden ist das gesamte Kalium-permanganat gleichmäßig verteilt.
V2 Im heißen Wasser ist die Diffusion der Früchteteefarbstoffe schneller als im kalten Wasser. Daher hat das heiße Wasser schneller eine homogene Färbung als das kalte Wasser.
Zur AufgabeA1 Die Wasserteilchen trennen die einzelnen Kaliumpermanganat-Teilchen von ihrem Verband ab und setzen sich dazwischen.
DO01756204_k01_L.indd 7 17.05.2016 17:29:32
-
8 Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz
1 Stoffe und Atome
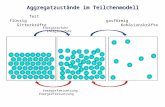
1.8 Teilchenmodell und Aggregatzustand
Nachdem im Kapitel 1.7 das Teilchenmodell aus der Diffusion abgeleitet worden ist, werden in diesem Kapitel die Anziehungskräfte zwischen den kleinsten Teilchen behandelt. Man sollte deutlich machen, dass das Kraftfeld eines Teilchens unabhängig von anderen Teilchen gedacht werden kann. Die Anziehungs kraft zwischen je zwei Teilchen hängt stark von deren Entfernung ab und wird mit zunehmender Entfernung der Teilchen voneinander geringer.Außerdem können die Anziehungskräfte zwischen den Teilchen bei höherer Geschwindigkeit der Teilchen überwunden werden in einem Sinne, der weiter unten näher erläutert wird.
Im Unterricht kann gelegentlich von Schülerinnen/Schülern die folgende Frage gestellt werden: Ein Teilchen, das aufgrund seiner hohen Geschwindigkeit aus der flüssigen Phase austritt und sich dann in der Gasphase befindet, müsste doch im Durchschnitt eine höhere Geschwindigkeit haben als die zurückgebliebenen Teilchen der flüssigen Phase. Müsste das Gas nicht folglich eine höhere Temperatur als die Flüssigkeit haben? Indem das Teilchen gegen die Anziehungskräfte der anderen den Teilchenverband verlässt, wird ein Teil der kinetischen Energie des Teilchens aufgezehrt. Stattdessen gewinnt es an potentieller Energie. Im thermischen Gleichgewicht unterscheiden sich Teilchen der flüssigen und der gas- förmigen Phase nicht in ihrer mittleren kinetischen, sondern in der potentiellen Energie. Gas und Flüssigkeit haben die gleiche Temperatur.Diese Überlegung gilt in entsprechender Form auch für andere Phasenübergänge.
Die folgende Überlegung kann das veranschaulichen: Ein Stein, der gegen die Anziehungskraft der Erde hochgeworfen wird, verliert ständig an kinetischer und gewinnt an potentieller Energie. Bei einer bestimmten Höhe ist die kinetische Energie vollständig aufgezehrt und der Stein fällt zur Erde zurück. Dabei wiederum nimmt seine potentielle Energie ab und die kinetische zu. Würde dem Stein eine so hohe Anfangsgeschwindigkeit gegeben, dass er genügend Energie hat, um das Gravitationsfeld der Erde zu überwinden, so würde er sich mit der Restenergie, die ihm trotz seines Aufstiegs verblieben ist, den Weltraum durchwandern.
Der obige Zusammenhang erklärt auch, warum während des Siedens oder Schmelzens die Temperatur konstant bleibt: Die zugeführte Wärme wird aufgewendet, um die potentielle Energie der Teilchen zu erhöhen. Ihre kinetische Energie und damit die Temperatur des Stoffes werden nicht verändert. Eis und Wasser von je 0 °C unterscheiden sich nicht in der kinetischen, sondern in der potentiellen Energie der Moleküle.Für Schüler ist allerdings irritierend, dass im Schmelzexperiment die Temperatur doch nicht konstant bleibt. Das liegt daran, dass zu viel Wärme in kurzer Zeit zugeführt wird, die neben dem Schmelzprozess auch die Erwärmung der schon entstandenen Flüssigkeit bewirkt.
Zu den VersuchenV1 Die kleinsten Teilchen des Wassers werden durch die zugeführte Wärme in immer stärkere Bewegung versetzt. Ihre mittlere Entfernung wächst, sie beanspruchen daher immer mehr Raum. Das Volumen der Wasserdampfportion wird größer.
V2 Im gasförmigen Zustand ist zwischen den kleinsten Teilchen viel leerer Raum, den sie durch ihre Bewegung beanspruchen. Durch Druck von außen wird der Raum, in dem sich die Teilchen bewegen können, kleiner. Der Anteil des leeren Raums nimmt also ab. Im flüssigen Zustand sind die kleinsten Teilchen nah beieinander, sie können aufgrund ihrer Bewegung lediglich ständig die Plätze wechseln. Im Versuch (b) ist das Volumen der Luft nur etwa halb so groß wie in (a). Deshalb fällt die Volumenverringerung auch entsprechend geringer aus.
DO01756204_k01_L.indd 8 17.05.2016 17:29:32
-
Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz 9
1 Stoffe und Atome
Zu den AufgabenA1 Gasförmiges Wasser wird ohne Beteiligung des flüssigen Zustandes zu Eis. In feuchter Luft sind die Teilchen des Wassers mit denen der Luft vermischt. Beim Abkühlen verringern sich die Teilchenabstände, der leere Raum zwischen ihnen wird kleiner. Die Anziehungskräfte werden größer. Bei einer Temperatur unter 0 °C entstehen durch Resublimation kleine Kristalle, die unter Anlagerung weiterer Wasserteilchen zu sichtbaren Kristallen heranwachsen.
A2 Beim Zusammendrücken des Kolbenprobers wird der Raum für die Bewegung der Teilchen des Butans kleiner. Die Anziehungskräfte zwischen den Teilchen werden größer. Es entstehen Tröpfchen flüssigen Butans.
A3 Erstarren:– die Geschwindigkeit der Teilchen des flüssigen Wassers wird geringer, – die Anziehungskräfte zwischen ihnen können besser wirksam werden, – die Teilchen werden auf Gitterplätzen eingebunden und können nur noch Vibrations-
bewegungen ausführen.
Kondensieren:– die Geschwindigkeit der Teilchen des Wasserdampfes wird geringer, – die Anziehungskräfte zwischen ihnen können besser wirksam werden,– die Eigenbewegung der Teilchen ist aber immer noch so groß, dass sie sich ständig wieder
voneinander lösen und die Plätze tauschen können.
Resublimieren:– die Geschwindigkeit der Teilchen wird geringer,– die Anziehungskräfte zwischen ihnen können besser wirksam werden, – die Anziehungskräfte sind aber bereits so groß, dass die Teilchen auf Gitterplätzen ein-
gebunden werden und nur noch Vibrationsbewegungen ausführen können.
1.10 Die Verbrennung – eine chemische Reaktion
Zu den VersuchenV1 Das Teelicht erlischt nach einiger Zeit, da durch die Verbrennung von Kerzenwachs Luft verbraucht wurde und nicht nachströmen konnte. Verwendet man ein größeres Glas, brennt die Kerze länger, weil eine größere Luftportion zur Verfügung steht.Hinweis: Die Kerze verbraucht Sauerstoff, bis der Anteil für die Verbrennung von Kerzenwachs nicht mehr ausreicht. Nach dem Erlöschen der Flamme beträgt der Volumenanteil des Sauerstoffs im Glas noch etwa 14 – 16 %. Im Glas ist stattdessen ein größerer Anteil an Kohlenstoffdioxid enthalten. Der Volumenanteil an Kohlenstoffdioxid entspricht dem des verbrauchten Sauerstoffs. Literatur:E. Wiederholt, „Bemerkungen und ergänzende Versuche zur Untersuchung der Luft mit einer Kerze“, PdN-Ch. Nr. 6, 1991, S. 44 – 46.
V2 Wird ein Becherglas, welches kaltes Wasser enthält, mit der rauschenden Brennerflamme erhitzt, so beschlägt die Außenwand zu Beginn. Der Beschlag verschwindet aber schnell wieder. Bei der Verbrennung von Erdgas entstehen gasförmige Verbrennungsprodukte, die an der kalten Wand des Becherglases kondensieren und bei weiterem Erhitzen wieder verdampfen.
DO01756204_k01_L.indd 9 17.05.2016 17:29:32
-
10 Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz
1 Stoffe und Atome
Zu den AufgabenA1 Bei der Verbrennung entsteht der neue Stoff Kohlenstoffdioxid, der im Gegensatz zu Holz bei Raumtemperatur gasförmig ist. Außerdem unterscheidet sich die Farbe von Holz und den Verbrennungsrückständen.
A2 Auflösen einer Braustablette: man erkennt am Sprudeln, dass ein neuer, gasförmiger Stoff entsteht.Braten eines Spiegeleis: die Farbe verändert sich.Braunwerden eines aufgeschnittenen Apfels: die Farbe verändert sich.Verderb von Lebensmitteln: der Geruch verändert sich.
1.11 Verbrennung von Metallen
Zu den VersuchenV1 Man beobachtet, dass die Eisenwolle mit jedem Luftstoß aufleuchtet und die Farbe der Eisenwolle sich von Hellgrau nach Blauschwarz verändert.
V2 Die Masse der Eisenwolle ist niedriger als die des Reaktionsproduktes. Es gilt aber wie für alle chemischen Reaktionen das Gesetz der Erhaltung der Masse. Beide Aussagen scheinen im Widerspruch zu stehen. Es muss also hier darauf rückgeschlossen werden, dass die Masse der Sauerstoffteilchen, die als Bestandteile der Luft von der Waage nicht erfassbar waren, nach der Reaktion mit Eisen im festen Endprodukt auch enthalten ist.
V3 Um die Reaktion zu starten, muss stark erhitzt werden. Dazu verwendet man ein Quarzrohr. Das Reaktionsrohr wird in der Mitte mit Stahlwolle, die zuvor mit Aceton entfettet wurde, und an den Enden mit Steinwolle dicht ausgefüllt. Das Volumen der Luft im Rohr ist damit vernachlässig-bar. Durch die Steinwolle werden die Schlauchstücke (bzw.: wird ein Rohr mit einem Durchmesser von 20 cm verwendet, kann man Stopfen verwenden) vor zu hohen Temperaturen geschützt. Anstelle von Eisenwolle gelingt der Versuch auch bei Verwendung von gekörntem Kupfer, welches ebenfalls eine große Oberfläche besitzt, sich dicht einfüllen lässt und trotzdem noch eine gute Durchlässigkeit für Luft ermöglicht.
a) Das Restvolumen beträgt nach dem Erkalten ca. 80 ml.b) Ein brennender Holzspan erlischt sofort im Restgas.
Soll dieses Experiment im Schülerpraktikum durchgeführt werden, so empfiehlt es sich nicht, mit teuren Kolbenprobern aus Glas zu arbeiten. Außerdem hat man sie möglicherweise auch nicht in genügender Stückzahl verfügbar. Anstelle davon ist für Schüler das z. B. über die Firma August Hedinger Chemikalien und Lehrmittel (Stuttgart) erhältliche System mit Teilen aus der Medizin-technik (MedTech) und Spritzen aus Kunststoff sehr gut brauchbar (siehe Abbildung). Man kann die Teile in größerer Stückzahl natürlich auch vom Medizintechnikfachhandel direkt und günstig beziehen.
DO01756204_k01_L.indd 10 17.05.2016 17:29:33
-
Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz 11
1 Stoffe und Atome
Zur AufgabeA1 Reaktionen von Stoffportionen, die in Gegenwart von Luft reagieren, sind umso heftiger, je größer ihre Zerteilung ist. Mit der zunehmenden Heftigkeit nehmen die Abgabe von Wärme und damit die Temperatur zu. Die Temperatur bei der Reaktion einer Stoffportion wird auch erhöht, wenn die Luftzufuhr verstärkt wird. Eisenwolle glüht in einem Reaktionsrohr heller auf, je stärker Luft durchgesaugt wird.
1.13 Metalle reagieren mit Sauerstoff
Zum VersuchV1 Das Magnesiumband verbrennt in reinem Sauerstoff so heftig, dass der verbrennende Teil oft abfällt und das Band dann nicht mehr weiterbrennt. Eine Verbesserung erreicht man, wenn man 3 bis 4 Bandstücke miteinander verdrillt. Der Boden des Standzylinders sollte mit Sand bedeckt sein, sonst kann die starke Erwärmung durch herabfallende Stücke zur Zerstörung des Glases führen. Dazu kann es auch kommen, wenn das verbrennende Magnesiumband die Glaswand berührt. Der Versuch lässt sich auch in einer Orangensaft- oder Milchflasche durchführen.Es sollte niemand direkt in die Flamme schauen.Auch bei der Verbrennung von Eisenwolle muss der Boden des Standzylinders mit Sand bedeckt sein. Glühende Partikel, die an die Zylinderwand sprühen, hinterlassen im Glas häufig bleibende Spuren, sodass sich der Einsatz der genannten Alternativen empfiehlt.
1.14 Verbindungen und elementare Stoffe
Zum ElementbegriffIn Kap. 1.14 wird ein auf den Stoff bezogener Elementbegriff eingeführt. Eine Definition wie „Elemente sind Reinstoffe, die sich nicht in andere Stoffe zerlegen lassen“ würde bei konsequen-ter Anwendung dazu zwingen, Modifikationen von Elementen z. B. Graphit und Diamant als ver- schiedene Elemente anzusehen. Der Elementbegriff sollte bevorzugt auf die Atomart angewendet werden. Unter einem Element versteht man eine Atomart, die in der Zahl ihrer Protonen überein-stimmt. Damit werden Stoffebene und Teilchenebene deutlich voneinander unterschieden. Der auf die Atomart bezogene Elementbegriff führt dann auch nicht zu Widersprüchen bei Begriffen wie „Kohlenstoffkreislauf“ oder „Stickstoffkreislauf“. Der Kohlenstoffkreislauf und der Stickstoff-kreislauf sind keine Stoffkreisläufe, sondern allenfalls Kreisläufe von Elementen. Kohlenstoff ist trotz des unglücklichen Namens kein Stoff, sondern ein Element, also eine Atomart. Es gibt keinen Stoff Kohlenstoff. Elementare Stoffe mit der Atomart Kohlenstoff sind: Graphit, Diamant, Fullerite. Die chemischen Elemente verändern sich bei keiner chemischen Reaktion; die elementa-ren Stoffe dagegen überdauern keine chemische Reaktion unverändert, in die sie involviert sind. In Verbindungen sind wohl die Elemente enthalten, nicht aber die elementaren Stoffe.
Für Reinstoffe, die sich nicht in andere Stoffe zerlegen lassen, wird der Begriff „elementare Stoffe“ bevorzugt.
Zum VersuchV1 Die Zersetzung von Silberoxid beginnt schon bei 230 °C. Wird zu stark erhitzt, backt das gebildete Silber zusammen und haftet so fest am Glas, dass es nicht herausgeschüttelt werden kann. Wird das Silberoxidpulver mit der gerade entleuchteten Flamme befächelt, so bleibt weiß- graues Silberpulver zurück. Gibt man dieses in eine kleine Vertiefung eines Stückchens Holzkohle (Lötrohrkohle) und schmilzt das Pulver mit der Lötrohrflamme, erhält man eine silbern glänzende Kugel, die sich platt klopfen und aushämmern lässt.
DO01756204_k01_L.indd 11 17.05.2016 17:29:33
-
12 Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz
1 Stoffe und Atome
Bei der Zerlegung von 500 mg Silberoxid entstehen 26 ml Sauerstoff bei 22 °C und 101,3 kPa. Auch wenn für die Zerlegung ein kurzes Reagenzglas (Volumen ca. 28 ml) eingesetzt wird, gelingt der Sauerstoffnachweis nur in diesem, da über Wasser haupts. die verdrängte Luft vorhanden ist.
Zur AufgabeA1
Eisenoxid Eisen + SauerstoffKupferoxid Kupfer + Sauerstoff
Verbindung elementare Stoffe
1.15 Chemische Reaktion und die Masse der Stoffe
Zu den VersuchenV1 Geeignet ist ein Erlenmeyerkolben mit Stopfenbett 29. Die Elektroden werden mit glühender Spitze durch den Gummistopfen gebohrt und sitzen dicht. Die Stahlwolle wird fest verdrillt auf die Elektroden geschoben. Da die Reaktion in reinem Sauerstoff kurz und heftig ist, wird nur ein Teil der Luft im Kolben verdrängt. Auch der Sauerstoffgehalt der Luft allein reicht aus. Obwohl bei der Reaktion Sauerstoff verbraucht wird, steigt der Druck im Koben durch die Reaktionswärme kurz an. Der Stopfen muss daher fest sitzen.
V2 Es sollten nicht mehr als drei Streichhölzer verwendet werden, weil sich sonst der Stopfen lockern kann und Rauch austritt.
Zur AufgabeA1 Es gilt das Gesetz von der Erhaltung der Masse.m(Silberoxidportion) – m(Silberportion) = m(Sauerstoffportion)464 mg – 432 mg = 32 mgDie Masse der entstehenden Sauerstoffportion beträgt 32 mg.
1.16 Nichtmetalle reagieren mit Sauerstoff
Zu den VersuchenV1 a) Man beobachtet, dass Schwefel mit leuchtend blauer Flamme in Sauerstoff verbrennt.b) Beim Eintauchen einer Rose/Nelke sieht man bei geöffnetem Deckel Nebel entweichen. Die Blüte wird bald farblos.
V2 Man beobachtet, dass die Holzkohle stark aufglüht. Beim Schütteln mit Kalkwasser ist zu- nächst eine milchige (weiße) Trübung zu beobachten. Dass es sich um eine Suspension (und nicht um eine Emulsion) handelt, erkennt man entweder beim Bewegen der Flüssigkeit an feinen weißen Krümeln, die an der Glaswand beim Abfließen hängen bleiben oder nach kurzem Stehen - lassen am weißen Feststoff (Niederschlag) auf dem Boden des Gefäßes. Die Kalkwasserprobe zeigt, dass beim Verbrennen von Holzkohle Kohlenstoffdioxid entsteht.
V3 Beim Umgießen des Kohlenstoffdioxids in die Glaswanne sollte man das Gas in die Ecke gießen, in der die kleinste Kerze brennt. Man beobachtet, dass zuerst die kürzeste Kerze erlischt und zuletzt die längste.
DO01756204_k01_L.indd 12 17.05.2016 17:29:33
-
Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz 13
1 Stoffe und Atome
Zu den AufgabenA1 Das Reaktionsschema für die Reaktion von Graphit mit Sauerstoff lautet:Kohlenstoff + Sauerstoff KohlenstoffdioxidA2 Die enthaltenen Schwefel-Verbindungen würden beim Verbrennen zu gasförmigen Schwefel-Sauerstoff-Verbindungen reagieren. Diese schaden aber der Umwelt.
A3 Die Zusammensetzung der („normalen“) Luft – in Volumenanteilen – ist: 21 % Sauerstoff, 78 % Stickstoff, 1 % Edelgase, 0,038 % Kohlenstoffdioxid (Kap. 1.11).
Ein Vergleich der Zusammensetzung des Tabakrauchs mit der Luft zeigt, dass der Sauerstoffanteil des Tabakrauchs nur etwa die Hälfte des Anteils der Luft beträgt. Dies rührt daher, dass zur Verbrennung des Tabaks Sauerstoff benötigt wird. Der Kohlenstoffdioxidanteil des Tabakrauchs ist wesentlich höher als der der Luft. Tabak besteht im Wesentlichen aus Kohlenstoff-Verbindungen. Bei der (vollständigen) Verbrennung von Kohlenstoff-Verbindungen entsteht Kohlenstoffdioxid (CO2). Weil das Sauerstoffangebot der Luft aber für eine vollständige Verbrennung nicht ausreicht, ist auch ein hoher Anteil des giftigen Kohlenstoffmonooxids (CO) im Tabakrauch enthalten.
Ein Teil der Gesundheitsgefährdung, die vom Rauchen ausgeht, ist auf das Kohlenstoffmonooxid zurückzuführen. (Anmerkung: Neben Kohlenstoffmonooxid enthält die Gasphase des Tabak-rauches als gesundheitsgefährdende Stoffe u.a. Stickstoffoxide, Nitrosamine, Blausäure, Formalde hyd und andere Aldehyde. Die Partikelphase enthält Wasserdampf, Nikotin und Teer, in dem mehrere Krebs erzeugende Stoffe wie Benzpyren enthalten sind. Beim Rauchen entstehen ca. 2000 verschiedene Stoffe.) Die Assoziationen, die Schüler mit dem Rauchen und der „verrauch-ten“ Luft verbinden, werden naturgemäß sehr unterschiedlich sein. Sicher werden hier eher gefühlsmäßige Äußerungen vor „wissenschaftlichen“ Äußerungen überwiegen.
A4 Die Vergiftung beginnt mit Kopfschmerz, Schwindel, Übelkeit, Brechreiz. Später folgen Benommenheit, Bewusstlosigkeit und schließlich der Tod.
ZusatzinformationAsche besteht einerseits aus den zurückgebliebenen Mineralsalzen, andererseits auch aus Carbonaten, die sich aus Metalloxiden und dem beiderVerbrennungentstandenenKohlenstoffdioxid gebildet haben (z. B. „Pottasche“, Kaliumcarbonat). In diesem Sinne kann zumindest ein Teil der Asche als Verbrennungsprodukt der Verbrennung von Holz usw. angesehen werden. Es wird mitunter der Eindruck erweckt, die Verbrennungsprodukte Wasser und Kohlenstoffdioxid entweichen vollständig, als Asche bleiben nur die Bestandteile der Pflanze zurück, die nicht brennbar sind.
1.17 Atome
Zu den AufgabenA1 Elemente, die nach Ländern benannt wurden, sind Gallium (Ga) und Francium (Fr, Frankreich), Germanium (Ge, Deutschland), Indium (In, Indien) und Polonium (Po, Polen). Bei Recherche im Internet würde man auch noch Ruthenium (Ru, von lat. ruthenia, Russland) finden.
A2
Element Helium Titan Chrom Gold Platin
Zeichen He Ti Cr Au Pt
Atommasse 4,00 u 47,87 u 52,00 u 196,97 u 195,08 u
DO01756204_k01_L.indd 13 17.05.2016 17:29:33
-
14 Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz
1 Stoffe und Atome
1.19 Elementare Stoffe und Verbindungen im Atommodell
Zu den AufgabenA1
a) Wasserstoff-Teilchen b) Kohlenstoffmonooxid-Teilchen c) Schwefel-Teilchen
H H
H H
H H
H
H H
C O
C O
C O
C O
C O
O
S O
S
S
S
S
OO
O
OO O
OO
O
OOS S S S S
S S S S S
S S S S S
S S S
S S S
elementarer Stoff,Molekül
Verbindung,Molekül
elementarer Stoff,hier durch Atome dargestellt
A2a) Helium (He)b) Sauerstoff (O2)c) Dies ist nicht möglich, weil Verbindungen stets aus zwei Atomsorten aufgebaut sind. Vonein-ander getrennte Atome verschiedener Atomsorten würden jedoch ein Gemisch und keine Verbindung darstellen.d) Kohlenstoffdioxid (CO2)
A3 Wasserstoff (H2), Stickstoff (N2), Chlor (Cl2).
A4
Bildung von Kohlenstoffdioxid
Vor der Reaktion (Kohlenstoff und Sauerstoff) nach der Reaktion (Kohlenstoffdioxid)
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
O O
O O
O O
O O
O O
O OO O
O C O
O C O
O C O
O C O
C O
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
O O
O O
O O
O O
O O
O OO O
O C O
O C O
O C O
O C O
C O
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
O O
O O
O O
O O
O O
O OO O
O C O
O C O
O C O
O C O
C O
Formel C O2 CO2
A5 Gold und Blei sind elementare Stoffe. Um sie ineinander umzuwandeln, müsste man also die Atome in eine andere Atomsorte überführen. Durch chemische Reaktionen ist dies aber nicht möglich, da lediglich die Verknüpfungen der Atome untereinander verändert werden.
A6 Bei einer chemischen Reaktion entstehen keine neuen Atome und es werden auch keine vernichtet. Da sich die Atome aus den Eduktteilchen (vor der Reaktion) lediglich zu neuen Produktteilchen (nach der Reaktion) zusammensetzen, bleibt die Gesamtmasse aller Atome und somit auch aller beteiligten Stoffe gleich.
DO01756204_k01_L.indd 14 17.05.2016 17:29:35
-
Elemente Chemie Arbeitsbuch 1 | Rheinland-Pfalz 15
1 Stoffe und Atome
ZusatzinformationBei der Teilchendarstellung in den "Kreisgrafiken" der Kap. 1.19, 1.20, 1.22 liegt das Haupt-augenmerk darauf, dass gleiche bzw. unterschiedliche Teilchen miteinander verbunden sind. Bei unterschiedlichen Teilchen ist auch noch das Verhältnis dargestellt. Im ersten Fall liegt ein elementarer Stoff vor, im zweiten eine Verbindung. Bei den genannten Teilchendarstellungen sind die Teilchenabstände die Aggregatzustände betreffend nur in geringem Maße berücksichtigt. Auch S8-Ringe werden nicht dargestellt. Die beiden letztgenannten Punkte sind daher unter dem Stichwort "Didaktische Reduktion" zu verbuchen.
1.21 Das Periodensystem der Elemente
Zu den AufgabenA1 Das Element Stickstoff steht in der 5. Hauptgruppe, 2. Periode. Die Ordnungszahl ist 7, die Atommasse beträgt 14 u.Das Element Magnesium steht in der 2. Hauptgruppe, 3. Periode. Die Ordnungszahl ist 12, die Atommasse beträgt 24,3 u.
A2 Das PSE in B3 enthält nur die Hauptgruppenelemente. Z. B. der Sprung von Calcium (Ord-nungszahl 20) zu Gallium (Ordnungszahl 31) kann dadurch erklärt werden, dass die dazwischen-liegenden zehn Nebengruppenelemente von Scandium bis Zink nicht dargestellt werden. Im vollständigen PSE (s. Bucheinband) steigt die Ordnungszahl dagegen stets um eins.
A3 Vorgefertigte Modelle mit Bauanleitung erhält man bei Spektrum der Wissenschaft, Verlags-gesellschaft mbH z. B. im Lesershop: „Papiermechanik Periodensystem“ und auch „Papiermechanik Moleküle, Atome, Quanten“. Die Kurzform des Periodensystems enthält die meisten wichtigen Elemente und ist besonders übersichtlich. Die Langform ist vollständig.
DO01756204_k01_L.indd 15 17.05.2016 17:29:35