Alkohole und Phenole Übersicht, Nomenklatur Bisher hauptsächlich ...
Transcript of Alkohole und Phenole Übersicht, Nomenklatur Bisher hauptsächlich ...
132
Alkohole und Phenole Übersicht, Nomenklatur Bisher hauptsächlich Kohlenwasserstoffe, jetzt immer mehr funktionalsierte Verbindungen:
R H R OH
H OH OH Hydroxylgruppe, aber - Nomenklatur
CH
H
H
H CH
H
H
OH
Methan MethanoloderHydroxymethan
OH
Cycloheptanol - Konstitutionsisomerie
OH
OH
1-Propanoloder1-Hydroxypropan
2-Propanoloder2-Hydroxypropan
Wie in anderen Fällen unterscheidet man:
ROH
primärerAlkohol
ROH
sekundärerAlkohol
R'R
OH
tertiärerAlkohol
R' R"
133
Mehrwertige Alkohole: Verbindungen mit zwei oder mehr OH-Gruppen
HO OH
1,2-EthandioloderGlycoloderEthylenglycol
OHOHOH
1,2,3-PropantrioloderGlycerin
Physikalische Eigenschaften, Wasserstoffbrückenbindung Siedepunkte/Schmelzpunkte Siedepunkt regelmäßig zunehmend (Homologie): ab C12 fest
Normale primäre Alkohole (n-Alkanole) CnH2n+2O
Sdp. [°C]
C1 Methanol H3C OH
65
C2 Ethanol H3C CH2 OH
78
C3 Propanol H3C CH2 CH2 OH
97
C4 Butanol H3C (CH2)2 CH2 OH 118
C5 Pentanol H3C (CH2)3 CH2 OH 138
C6 Hexanol H3C (CH2)4 CH2 OH 156
C7 Heptanol H3C (CH2)5 CH2 OH 175
C8 Octanol H3C (CH2)6 CH2 OH 195
⋅ ⋅ ⋅
(Schmp.)
C16 Hexadecanol H3C (CH2)14 CH2 OH 49
Verzweigungsgrad: Abnahme Siedepunkt
134
Isomerie der Alkohole
Sdp. [°]
H3C CH2 CH2 OH
1-Propanol bzw. 1-Hydroxypropan (n-Propylalkohol)
97
H3C CH CH3OH
2-Propanol (Isopropylalkohol)
82
H3C CH2 CH2 CH2 OH
1-Butanol (n-Butylalkohol)
118
H3C CH2 COH
CH3
H
2-Butanol (sec-Butylalkohol)
99
H3C CH CH2CH3
OH
2-Methylpropanol (Isobutylalkohol)
108
H3C C OHCH3
CH3
1,1-Dimethylethanol (tert-Butylalkohol)
83
135
Siedepunkte der Alkohole anormal hoch
Vergleich der physikalischen Eigenschaften von Verbindungen mit ähnlicher Molmasse
Bezeichnung Struktur Molmasse Dipolmoment [D] Siedepunkt [�C]
n-Pentan H3C CH2 CH2 CH2 CH3 72 0 36
Diethylether H3C CH2 O CH2 CH3 74 1.18 35
1-Chlor-propan H3C CH2 CH2 Cl
79 2.10 47
Butyraldehyd H3C CH2 CH2
O
H
72 2.72 76
1-Butanol H3C CH2 CH2 CH2 OH
74 1.63 118
Propionsäure H3C CH2 COOH
74 1.68 141
Grund: Wasserstoffbrückenbindung
HO
HO H
HO
H
H
RO
HO H
RO
R
H
Wasser und Alkohole bis C3 beliebig mischbar
Stärke der Wasserstoffbrückenbindung:
Bindungsenergie O-H…O = 12 kJ/mol
Vergleich C-H = 413 kJ/mol
136
Allgemein H-Brücke:
X H Yδ- δ-δ+
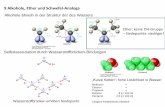
X, Y müssen elektronegative Elemente sein (O, N), C-H keine H-Brücke Je acider X-H und je basischer Y, desto stärker (aber nur, wenn noch kein Protonenübergang!) Lineare Geometrie X-H-Y am besten. Synthese von Alkoholen a) Durch Addition Alkene aus Petrochemie vielfältig verfügbar, daher Addition von Wasser direkt oder indirekt besonders wichtig Ausgangsmaterial Olefine:
günstig aufgrund der Regioselektivität. Säurekatalysierte Hydratisierung: unsauber Siehe Kapitel Alkene Oxymercurierung: "sauber"
Hg(OAc)2
NaOHOH
HgOAc
Reduktion
OH
H
137
Hydroborierung/Oxidation Reagens:
BH
BH
H
H
H
H
OB
H
H
H
O2
Reaktion:
BH
H
H
O
3B
H 3syn-Additionvon H und Ban dieDoppelbindung H2O2
OH-
OH Polyalkohole
HO
H2C
CH2
H2C
CH2
H2C
CH2
OH
CH2OH
C OHH
C HHO
C OHH
C OHH
CH2OH
H2C OH
C OHH
H2C OH
H2C OH
H2C OH
EthylenglykolSdp. 197°C
GlyercinSdp. 290°C
1,6-HexandiolSchmp. 42°C, Sdp. 250°C
D-SorbitSchmp. 97°C
Diole wurden schon besprochen Reaktionen: KMnO4 oder OsO4 und Epoxidierung/Hydrolyse
138
b) Durch nukleophile Substitution SN-Reaktion bereits ausführlich besprochen. Wichtig vor allem zur Umwandlung von Alkylhalogeniden Besonders wichtig zur Herstellung von Alkoholen SN1-Typ
ClNaOH
(überCarbenium-
ionen)
OH
SN2-Typ geht nur gut bei primären Halogenverbindungen, aber OH- schlecht
I
NaOH
OH+
O+
besserNaOAc
OO NaOH
VerseifungOH
Reaktionen der Alkohole a) Acidität/Basizität Analog zum Wasser sind Alkohole sowohl schwache Säuren als auch Basen
R OH
HR OH + H pKs = -8
R OH
R O + H pKs = 17-19
139
praktisch:
OH
NaH
-H2 O Na
Na-1/2 H2
b) Oxidation (Brennbarkeit, z.B. Flambieren) Wichtigstes Ox-Mittel: Chromsäure
Cr2O7
gelb
+ 6 e + 14 H 2 Cr3+ + 7 H2O
grün
2
Wichtiger Unterschied: - Primäre R-OH, Aldehyd, Carbonsäure Versuche
OH 1/3 Cr2O72- O
-I +IH+
1/3 Cr2O72-
H+
O
+III OH
Acet-aldehyd
Essig-säure
Früher Polizei Alkohol-Teströhrchen (Kieselgel, Chromsäure) - Sek. R-OH, Keton
OH 1/3 Cr2O72- O
H+
1/3 Cr2O72-
+HAceton2-Propanon
140
- Tert. R-OH: keine Reaktion OH 1/3 Cr2O7
2-
+H c) Katalytische Dehydrierung Technisch wichtig: Cu-Kontakt
O - H2
Cu200-300°C
O - H2
Cu200-300°C
O
H
- H2
Cu200-300°C
O - H2
Cu200-300°C
H
H
O
Formaldehyd
H
H
H
O
O
Acetaldehyd
Aceton
H
d) Reaktionen mit Mineralsäuren Allgemein Reaktionsmodus einer Veresterung: - Halogenwasserstoff: Aktivierung des Alkohol Bruttoreaktion:
R OH + H-X R X + H2O
141
Formal eine Veresterung: Alkohol + Säure → Ester + Wasser Mechanismus SN1 oder SN2, je nach Alkohol. CH3OH/R-CH2OH: SN2 (HF) < HCl < HBr < HI
OH + H-I
I + H2O
RO
R
H
HI
R
guteAustrittsgruppe
R3C-OH: SN1
OH + H-Cl
+ H2O
OH
HCl
guteAustrittsgruppe
OH
HClCl
HCl + + H2O
Aktivierung der Säure
R OH HO S
O
O
OH+ RO S
O
O
OH- H2O
RO S
O
O
OH- H2O
Mono-alkyl-sulfat
Di-alkyl-sulfat
142
Mechanismus:
R OH
HO S
O
O
OH2 RO S
O
O
OH- H2O
O S
O
O
OHH
H HSO4
- H2SO4
Nukleophile Substitution am Schwefel Wichtige Verb.: Dimethylsulfat, ein Alkylierungsmittel
O S
O
O
O
Nu
Vorsicht! Giftig und krebserregend, Aufnahme durch die Haut möglich
Analoge Reaktionen mit: HNO3 HNO2 H3PO4 Aktive Spezies: NO2
+ NO+ Nitronium-Ion Nitrosyl-Ion
R OHHNO3
H2SO4
R ON O
O
NaNO2
H+R O
NO
H3PO4
H+R O
POH (R)O
OH (R)
Alkylnitrat
Alkylnitrit
Mono-, Di-oder Trialkyl-phosphat
Teilstruktur der Nukleinsäuren
143
Besonders bekannt:
H2C O
HC O
H2C
NO2
NO2
O NO2
H2C OH
HC OH
H2C OH
HNO3H2SO4
10-20°C
Glycerin "Nitroglycerin"Glycerintrinitrat
R NO2
R ONO2 Eigenschaften: Erweiterung Blutgefäße (Angina pectoris)
Zerfall von Nitroglycerin
H2C O
HC O
H2C
NO2
NO2
O NO2
-1377 kJ3 CO25/2 H2O1/4 O23/2 N2
"Nitroglycerin" explosiv auf Schlag und Erhitzen "Nitroglycerin" im Gemisch mit Kieselgur (Diatomeen-Erde)
ergibt Dynamit Reaktion mit Thionylchlorid
OHR
SOCl2O
R
S ClO
ClR- HCl
+ SO2
Sehr saubere Reaktion
144
Wichtige Alkohole a) Methanol CH3OH, Sdp. 65 °C, Lösungsmittel, Gift: dosis letalis 6-8 g, bei geringerer Dosis Erblinden
möglich Industrielle Herstellung - historisch ("Holzgeist"):
1 m3 Holz gibt bei Erhitzen unter Luftabschluss etwa 12 l Methanol - heute
CO + 2 H2ZnO/Cr2O3
300-400 °C200-200 bar
OH
b) Ethanol C2H5OH, Sdp. 78.3 °C, Vergällung mit Petrolether oder Pyridin Azeotrop C2H5OH/H2O = 96 : 4, Sdp. 78.2 °C Industr. Herstellung - biotechnologisch ("Weingeist"):
C6H12O6
Glucose
Enzyme
Wasser
OH2 + 2 CO2
145
Alkoholgehalt verschiedener Getränke
Vollbier 3 - 4 Vol % Starkbier ~ 5 Vol % Apfelwein 5 - 6 Vol % Traubenwein 8 - 13 Vol % Dessertwein 16 - 20 Vol % Liköre 20 - 40 Vol % Branntwein 32 - 55 Vol %
- aus Erdöl:
H2O
H3PO4300°C
OH
wasserfrei Entwässerung
OH
H2O
Benzol
bei 65 °C
ternäres AzeotropGemisch aller drei Komponenten
zurück bleibtEtOH / Benzol
bei 68 °C
binäres AzeotropGemisch EtOH / Benzol
zurück bleibtreinesEtOHSdp. 78.5 °C
146
c)Glycol HO-CH2CH2-OH Sdp. 198 °C
0.5 O2
Ag250°C
O H2O
H+
HO
OH d) Glycerin
OH
OH
OH
Sdp. 290 °C (Zers.) zu Acrolein Industrielle Herstellung - spezielle Gärungsprozesse - Verseifung von Fetten später - aus Erdöl:
OH
OH
OH
Cl2
500 °C Cl
Cl-OH
Cl
ClHO
Cl
OHCl
Chemo-konvergent
O
Cl
NaOH
147
Phenole Übersicht
OH
OH
OH
OH OH
OHOH
OH
OH
OH OH
OH
OH
OH
HO OH
OHOH
Phenol
Brenzkatechin Resorcin Hydrochinon
Pyrogallol Phloroglucin Hydroxyhydrochinon
1-Naphthol 2-Naphthol
148
Azidität organischer Verbindungen
HA = H + A pKS = −log K[ HA ]
[ H ][ A ]KS =
Org08-01.CW3 H3O+ -2
H3CCOOH 5 Ph-NH3
+ 4.6 H2S 7
OH
10
NH4+ 9.2
HOOH 11.6 C2H5SH 11 H3CNH3+ 10.6 O2NCH3 11
(EtOOC)2C
H2 13
H2O 15.7 H3COH 16
CH2
16
H3CH2COH 17 (H3C)2HCOH 18 (H3C)3COH 19
H3CCOCH3 20 HC�CH 25 N�CCH3 31 NH3 33 H2C=CH2 44 CH4 50
Zahlenwerte nach T.H. Lowry, K.S. Richardson, Mechanism and Theory in Organic Chemistry, 2. Aufl.
149
Eigenschaften Im allgemeinen kristallin aufgrund der Planarität und H-Brücken Azidität sehr hoch im Vergleich zu Wasser und Alkoholen H2O pKs 16 MeOH pKs 17 PhOH pKs 10 Herstellung Folie - Extraktion von Steinkohlenteer - Dow-Prozess:
Cl
NaOH 15%ig
375 °C
OH
(über Arin)
- Alkalischmelze mit Sulfonsäuren:
SO3H
NaOH
300 °C
OH
150
- Hock-Verfahren Cumol
Beispiel für eine elektrophile aromatische Alkylierung:Cumol
++ [H+]
+H
+
H
H+
- [H+]
Cumol
Cumol-hydroperoxid
SR +
H
Start:
SR-H +
CumylradikalKette:
+ O=O
O-OKohlenstoff -Radikal sauerstoffzentriertes Radikal
O-O H
+
O-OH
+
Abbruch: Rekombination der Radikale,insbesondere die Dimerisierung des Cumylradikals
151
Mechanismus der Umwandlung des Hydroperoxids später
Cumol(leicht aus Benzen und
Propen herstellbar)
O2
StartradikaleSR
Cumolhydroperoxid
OOHH
H+
OH
+O
Phenol(ein wichtiges
Reagenz)
Aceton(wichtiges Reagenzund Lösungsmittel)
Reaktionen
- leicht elektrophil angreifbar und oxidierbar - Phenolat reaktiver als Phenol
a) Elektrophile Substitution Bromierung:
NaHSO3/ H
OH OH OH
O
Br
Br
Br
OH
Br
Br
Br
BrBr
Br2
H2O
Br2 Br2
Br2
Br2
CCl4
Br Br
152
Nitrierung:
OH
20 % HNO3
RT
OH
NO2
OH
NO2
15 % 35 %H2SO4
100 oC
(20 oC mono!)
OH
SO3H
SO3H
konz. HNO3
OH
NO2
NO2
O2NPikrinsäurepKs = 1 !gelb !
Reversibilität derSulfonierung !
Carboxylierung/Kolbe-Synthese
O Na
+ C
O
O
150 °COH
CO2 Na K2CO3
240 °C
Natriumsalicylat
OH
CO2 K b) Oxidation zu Chinonen
- 2 e-
OH
OH
O
O
+ 2 e-+ 2 H+