Aufbau definierter Polymerarchitekturen durch Radikalische...
Transcript of Aufbau definierter Polymerarchitekturen durch Radikalische...

Aufbau definierter Polymerarchitekturen
durch
Radikalische Polymerisation unter Atomtransfer
(ATRP)
Vom Fachbereich Chemie
der Technischen Universität Darmstadt
zur Erlangung des akademischen Grades eines
Doktor-Ingenieurs (Dr.-Ing.)
genehmigte
DISSERTATION
vorgelegt von
Dipl.-Ing. Gabriele Wittmann
aus Heidelberg
Berichterstatter: Prof. Dr. Dr. h.c. D. Braun
Mitberichterstatter: Prof. Dr. M. Rehahn
Tag der Einreichung: 05.05.2003
Tag der mündlichen Prüfung: 23.06.2003
Darmstadt 2003
D 17

Ich bedanke mich bei allen, die mit ihrer Unterstützung zum Gelingen dieser Arbeit beigetra-
gen haben:
Herrn Prof. Dr. Dr. h.c. D. Braun danke ich für die freundliche Betreuung dieser Arbeit und
für sein Vertrauen, mir auch den Freiraum für eigene Ideen zu lassen.
Herrn Prof. Dr. M. Rehahn danke ich für die Möglichkeit, dass ich einen Teil meiner Arbeit
an der Carnegie-Mellon University in Pittsburgh, Pennsylvania, USA durchgeführen konnte.
Herrn Prof. Dr. Kris Matyjaszewski danke ich für die freundliche Aufnahme für mehrere Mo-
nate in seinem Arbeitskreis an der Carnegie-Mellon University in Pittsburgh, Pennsylvania,
USA und für die vielen hilfreichen Diskussionen über die kontrollierte radikalische Polymeri-
sation. Den Mitgliedern seines Arbeitskreises, im besonderen Herrn Dr. Tomislav Pintauer,
Herrn Nicolay Tsarevsky und Frau Dr. Jian Qiu, danke ich für wertvolle Anregungen und
Diskussionen und die stete Hilfsbereitschaft während meines Aufenthaltes in Pittsburgh.
Bei Herrn Dr. habil. G. P. Hellmann bedanke ich mich für die stete Diskussionsbereitschaft.
Herrn Ingo Almeroth danke ich für seine tatkräftige Unterstützung bei der Durchführung vie-
ler Experimente am Institut für Makromolekulare Chemie sowie Herrn Thorsten Schwalm für
die Synthesen, die er während seines Vertiefungspraktikums durchgeführt hat.
Herrn Dr. Wolfgang Radke, Herrn Dipl.-Chem. Johannes Gerber, Frau Dr. Anja Siewing,
Herrn Dr. Kibret Mequanint, Herrn Dipl.-Ing. Carsten Rode, Herrn Dipl.-Chem. Christian
Kloninger und Herrn Christoph Brinkmann danke ich für die Durchführung und Unterstüt-
zung bei der Durchführung der chromatographischen Methoden.
Den jetzigen und ehemaligen Mitgliedern des Arbeitskreises für ihre stete Hilfsbereitschaft
und das angenehme und kollegiale Arbeitsklima während der gesamten Doktorarbeit.

Meinen Eltern danke ich dafür, dass sie mir meine Ausbildung ermöglichten und mich jeder-
zeit unterstützt und gefördert haben; Jan Malluche danke ich für wertvolle fachliche Diskussi-
onen und die liebevolle Unterstützung.
Teile dieser Arbeit sind in folgender Publikation veröffentlicht:
J. Gerber, W. Radke, G. Wittmann, „Simulation of GPC-distribution coefficients of linear and
star-shaped molecules in spherical pores. 2. Comparison of simulation and experiment“ Po-
lymer 44 (2003) 519.
Diese Arbeit wurde am Institut für Makromolekulare Chemie der Technischen Universität
Darmstadt und am Deutschen Kunststoff-Institut unter der Leitung von Prof. Dr. Dr. h.c. D.
Braun in der Zeit von Mai 1998 bis August 2002 durchgeführt.

Für meine Eltern

Inhaltsverzeichnis I
1 EINLEITUNG UND PROBLEMSTELLUNG 1
2 THEORETISCHER TEIL 3
2.1 Die lebende Polymerisation 3
2.2 Die lebende radikalische Polymerisation durch Atomtransfer (ATRP) 6
2.2.1 Mechanismus und Kinetik 6
2.2.2 Katalysatoren 11
2.2.3 Initiatoren 14
2.3 Blockcopolymere 16
2.4 Sternpolymere 17
2.4.1 „Arm-first“-Methode 17
2.4.2 „Core-first“-Methode 18
2.5 Pfropfcopolymere 20
2.5.1 Grafting-Onto-Methode 20
2.5.2 Grafting-From-Methode 21
2.5.3 Grafting-From-Onto-Methode 22
2.5.4 Copolymerisation mit Makromonomeren 23
2.6 Reaktive Extrusion 23
2.7 Phasenverhalten 25
3 ERGEBNISSE 27
3.1 Untersuchungen zur Polymerisation von Methylmethacrylat in Lösung 27
3.1.1 Auswahl des Reaktionssystems 27
3.1.2 Vergleich verschiedener Katalysatorsysteme 33
3.2 Initiatoren 46
3.2.1 Initiatoren mit Azidendgruppe 47
3.2.2 Initiatoren für die Herstellung linearer Polymerer 50
3.2.3 Initiatoren für die Herstellung sternförmiger Polymerer 52
3.3 Lineare Blockcopolymere 68
3.3.1 Herstellung 68
3.3.2 Charakterisierung 70

Inhaltsverzeichnis II
3.4 Sternblockcopolymere 87
3.4.1 Herstellung 87
3.4.2 Charakterisierung 89
3.5 Gradientencopolymere 105
3.5.1 Herstellung 106
3.5.2 Charakterisierung 107
3.6 Pfropfcopolymere 115
3.6.1 Herstellung und Charakterisierung der Pfropfäste 117
3.6.2 Herstellung und Charakterisierung der Rückgratpolymeren 135
3.6.3 Herstellung und Charakterisierung der Pfropfprodukte 139
4 EXPERIMENTELLER TEIL 152
4.1 Meßmethoden 152
4.1.1 Kernresonanzspektroskopie (NMR) 152
4.1.2 FT-IR-Spektroskopie (IR) 152
4.1.3 Mikroanalyse 152
4.1.4 Massenspektrometrie 152
4.1.5 Matrixunterstützte Laser-Desorptions/Ionisations-Flugzeit-Massenspektrometrie
(MALDI-TOF-MS) 153
4.1.6 Dynamic Scanning Calorimetry (DSC) 153
4.1.7 Dünnschicht- und Säulenchromatographie 153
4.1.8 Gaschromatographie (GC) 154
4.1.9 Gelpermeationschromatographie (GPC) 154
4.1.10 GPC mit Lichtstreudetektion 154
4.1.11 GPC-LCCC-Kopplung 154
4.1.12 GPC-FTIR-Kopplung 155
4.2 Chemikalien und Lösungsmittel 155
4.2.1 Lösungsmittel und Reagenzien 155
4.2.2 Monomere 155
4.2.3 Katalysatoren 155
4.3 Synthese der Initiatoren 156
4.3.1 2-Brompropionsäure-2-azidoethylester (AEBP) und 2-Brom-2-
methylpropionsäure-2-azidoethylester (AEBiB) 156

Inhaltsverzeichnis III
4.3.2 4-Azidobenzylbromid (ABB) 158
4.3.3 Bis(2-brom-2-methylpropanoyloxy)ethan (EGBiB) 159
4.3.4 1,1,1-Tris(4-(2-brom-2-methylpropanoyloxy)phenyl)ethan (TBiBPE) 159
4.3.5 Tetrakis(2-brom-2-methylpropanoyloxy)-2,2-dimethylpropan (PTBiB) 160
4.3.6 Tetrakis(2,2-bis((2-brom-2-methylpropanoyloxy)methyl)propanoyloxy)2,2-
dimethylpropan (8PBiB) 161
4.4 Synthese der Polymeren 162
4.5 Pfropfreaktionen 163
4.5.1 Pfropfung im Differential-Raster-Kalorimeter 163
4.5.2 Pfropfung im Mikroextruder 163
5 ZUSAMMENFASSUNG 164
6 LITERATUR 170

Abkürzungsverzeichnis i
TEMPO 2,2,6,6-Tetramethyl-piperidin-1-oxyl
RAFT Reversible Addition Fragmentation Chain Transfer Process
NMP Nitroxide Mediated Polymerization
DT Degenerative Transfer
ATRP Atom Transfer Radical Polymerization
PDI Polydispersitätsindex
DP Polymerisationsgrad (degree of polymerisation)
RX Initiator, Alkylhalogenid
PX Polymeres mit Halogenidendgruppe, „schlafende Spezies“
D Deaktivator
TMEDA N,N,N’,N’-Tetramethylethylendiamin
PMDETA N,N,N’,N’’,N’’-Pentamethyldiethylentriamin
HMTETA N,N,N’,N’’,N’’’,N’’’-Hexamethyltriethylentetramin
bpy 2,2’-Bypyridin
dNbpy 4,4’-Di-(5-nonyl)-2,2’-bipyridin
BPMOA N,N-Bis(2-pyridylmethyl)octylamin
phen 1,10-Phenanthrolin
dmdp-phen Dimethyl-diphenyl-o-phenanthrolin
MeOPh-phen 2,9-bis(4-methoxyphenyl)-o-phenanthrolin
Poly-phen Poly(2,9-o-phenanthrolin-alt-(2’,5’-dihexyl)-4,4’’-terphenylen)
BiBME α-Bromisobuttersäuremethylester
MBP 2-Brompropionsäuremethylester
PEB 1-Phenylethylbromid
AEBiB 2-Brom-2-methylpropionsäure-2-azidoethylester
AEBP 2-Brompropionsäure-2-azidoethylester
ABB 4-Azidobenzylbromid
AIBN Azobisisobutyronitril
BPO Dibenzoylperoxid

Abkürzungsverzeichnis ii
S Styrol
MMA Methylmethacrylat
ALMA Allylmethacrylat
n-BuLi n-Butyllithium
TEA Triethylamin
DMSO Dimethylsulfoxid
DMF N,N-Dimethylformamid
ESI Elektronenspray-Ionisation
MALDI Matrixunterstützte Laser-Desorption/Ionisation

1 Einleitung und Problemstellung 1
1 Einleitung und Problemstellung
Seit Beginn des 20. Jahrhunderts haben die Entwicklung und der Einsatz synthetischer
polymerer Werkstoffe mit ihren vielfältigen Eigenschaften zu einer wertvollen Ergänzung
herkömmlicher Materialien wie Metall, Holz, Glas, Keramik, Wolle und Baumwolle ge-
führt. Dieses Spektrum reicht von guter Verarbeitbarkeit, hoher mechanischer Belastbar-
keit über optische Durchlässigkeit, anisotropes optisches, elektrisches und mechanisches
Verhalten bis hin zu elektrischer Leitfähigkeit und Biokompatibilität. Die Kenntnisse über
Struktur-Eigenschafts-Beziehungen und adäquate Polymerisationsverfahren, die eine Kon-
trolle der Zusammensetzung und der molekularen Architektur eines Polymeren gewährleis-
ten, sind dabei von entscheidender Bedeutung. Die Herstellung neuartiger polymerer
Werkstoffe, die ihren Vorgängern in Eigenschaften, Anwendbarkeit und Funktionalität
überlegen sind, erfordert die Entwicklung selektiver Polymerisationsverfahren, die den
Aufbau wohldefinierter Strukturen ermöglichen.
In den letzten Jahren wurden neuartige Produkte mit kontrollierter Struktur durch Polyme-
risationsverfahren auf Basis von Metallocenkatalysatoren zugänglich, die die etablierten
ionischen Verfahren zum Aufbau definierter molekularer Strukturen ergänzen. Ein neueres
Verfahren zur Herstellung wohldefinierter Polymerer ist die „lebende“ oder kontrollierte
radikalische Polymerisation. Die radikalische Polymerisation ist die bedeutendste Methode
für die großtechnische Produktion von Polymeren, weil sich mit ihr in einem breiten Tem-
peraturspektrum verschiedenartig funktionalisierte Monomere homo- und copolymerisie-
ren lassen. Dabei sind nur vergleichsweise geringe Anforderungen an die Reinheit der Mo-
nomeren und Lösungsmittel zu stellen. Die radikalische Polymerisation kann in vielen Me-
dien ausgeführt werden, z.B. in Masse, Lösung, wässriger Suspension, Emulsion und Dis-
persion. Sie ist jedoch im Vergleich zu den „lebenden“ Polymerisationsverfahren wie der
anionischen, kationischen und metallocenkatalysierten Polymerisation nicht geeignet, um
Polymere mit wohldefinierten Zusammensetzungen, Architekturen und Funktionalitäten
kontrolliert zu synthetisieren, hauptsächlich weil die Terminierung zwischen den wachsen-
den Radikalketten unvermeidbar ist. Allerdings können mit den in den letzten Jahren ent-
wickelten Methoden zur lebenden kontrollierten radikalischen Polymerisation die irrever-
sible Kettenübertragung und der Kettenabbruch stark zurückgedrängt werden. Eine dieser
Methoden ist die radikalische Polymerisation durch Atomtransfer (ATRP), bei der freie
Radikale (aktive Spezies) aus ihren halogenierten Verbindungen (deaktivierte Spezies)
durch einen Redoxprozess mit Hilfe von Metallkomplexen erzeugt werden. Mit ihr lassen

1 Einleitung und Problemstellung 2
sich wie bei allen lebenden Polymerisationsmethoden die Konstitution, die Molekularge-
wichtsverteilung, die Art und Zahl der Endgruppen und bei der Synthese von Blockcopo-
lymeren die Zahl der Blöcke, die Blocklängen und die Blocklängenverteilungen einstellen.
Blockcopolymere besitzen aufgrund ihrer selbstorganisierenden und oberflächenaktiven
Eigenschaften vielfältige Anwendungsmöglichkeiten. Neben der Schlagzähmodifizierung
und der Kompatibilisierung von Mischungen unverträglicher Polymerer ist dabei der pha-
senvermittelnde Charakter von Blockcopolymeren von großer Bedeutung. Auch Gradien-
tencopolymere, die sich aus zwei Monomeren so aufbauen, dass der Anteil eines jeden
Monomeren innerhalb der Polymerkette in eine Richtung stetig ansteigt, wirken als Pha-
senvermittler für Blends nicht mischbarer Polymerer. Sterncopolymere und Pfropfcopoly-
mere eignen sich sowohl zur Kompatibilisierung von Polymermischungen als auch als Ad-
ditive zur Viskositätsverbesserung von Ölen, wenn die Kettensegmente unterschiedliche
Löslichkeit besitzen.
Die vorliegende Arbeit befasst sich mit der Untersuchung der ATRP von Methylmethacry-
lat (MMA) zum industriell wichtigen Thermoplasten Polymethylmethacrylat (PMMA) mit
unterschiedlichen Liganden von Kupferkomplexen und in verschiedenen Medien. Auf die-
ser Basis sollte ein geeignetes System zur Herstellung von Blockcopolymeren aus MMA
und Styrol gefunden werden, um damit neben linearen auch sternförmige Blockcopolyme-
ren herzustellen. Des Weiteren sollten Gradientencopolymere aus MMA und Styrol
synthetisiert werden, die wie die Blockcopolymeren als Verträglichkeitsvermittler für
Blends aus den nicht mischbaren Homopolymeren PMMA und Polystyrol eingesetzt
werden können. Eine weitere Aufgabe bestand darin, zu prüfen, ob sich durch ATRP von
MMA bzw. Styrol hergestelltes PMMA und Polystyrol, welche an den Endgruppen
modifiziert wurden, zu Pfropfreaktionen eignen. Dazu wurden Doppelbindungen
enthaltende Polymere mit den durch ATRP hergestellten PMMA- und Polystyrol-
Seitenästen in der Schmelze zur Reaktion gebracht.

2 Theoretischer Teil 3
2 Theoretischer Teil
2.1 Die lebende Polymerisation
Der Begriff der „living polymerization“ wurde 1956 von Szwarc bei der anionischen Po-
lymerisation von Styrol in aprotischen Lösungsmitteln eingeführt[1,2]. Danach sind „leben-
de“ Polymerisationen definiert als Kettenreaktionen, die zu wohl definierten Polymeren
führen, ohne dass irreversible Übertragungs- oder Abbruchreaktionen auftreten. Nach der
vollständigen Umsetzung des Monomeren zu Makromolekülen mit definierter Molmasse
liegen die Kettenenden weiterhin aktiv vor. Somit ist durch gezielten Zusatz von Abbruch-
reagenzien die Funktionalisierung von Homopolymeren[3] oder durch sequentielle Zugabe
von Monomeren die Herstellung von Blockcopolymeren[4] möglich. Wenn a) die Initiie-
rungsgeschwindigkeit größer oder gleich der Wachstumsgeschwindigkeit ist, b) die Zahl
der aktiven Kettenenden während der Polymerisation konstant bleibt, also das Ketten-
wachstum über eine einzige Spezies erfolgt oder ein sehr schneller Wechsel zwischen ver-
schiedenen Spezies stattfindet und c) die Kinetik des Kettenwachstums erster Ordnung
bezüglich der Konzentration des Monomeren und der aktiven Spezies ist (Gl. 2.1), gilt
]P][M[k]I][M[kdt/]M[dR ppp•==−= Gl. 2.1
Rp Polymerisationsgeschwindigkeit
kp Geschwindigkeitskonstante
[P•] Konzentration der lebenden Kettenenden
[M] Monomerkonzentration
[I] Initiatorkonzentration
Daraus resultiert im Idealfall eine Poissonverteilung für die Molmassenverteilung. Der
Polydispersitätindex PDI (Gl. 2.2) strebt dann mit zunehmender Molmasse gegen 1[2]:
nn
w
PMMPDI 11+== Gl. 2.2
PDI Polydispersitätsindex
Mw Gewichtsmittel der Molmasse
Mn Zahlenmittel der Molmasse
Pn Zahlenmittel des Polymerisationsgrades

2 Theoretischer Teil 4
Der zahlenmittlere Polymerisationsgrad (Pn) berechnet sich aus dem Verhältnis der Kon-
zentrationen des bei der Polymerisation verbrauchten Monomeren und des eingesetzten
Initiators (Gl. 2.3):
0
0
0 ]I[]M[]M[
]I[]M[
MMP t
M
Pn
−===
∆ Gl. 2.3
MP / MM Molmasse des Polymeren / Monomeren
Neben der erwähnten anionischen Polymerisation wurden in den letzten Jahren weitere
Polymerisationstypen untersucht, die dem Konzept der „lebenden“ Polymerisation entspre-
chen. Anfang der achtziger Jahre beschrieben Sawamoto und Kennedy[5,6] die „lebende“
kationische Polymerisation. Ferner sind „lebende“ Ziegler/Natta-, Ringöffnungs- und Me-
tathese-Polymerisationen benannt[7].
Ein sehr großes Interesse gilt in neuester Zeit der „lebenden“ kontrollierten radikalischen
Polymerisation, die im Vergleich zu den vorher genannten Polymerisationsmethoden weit-
aus weniger empfindlich gegenüber Verunreinigungen und Luftsauerstoff ist und für spe-
zielle Anforderungen in der Industrie schon angewendet wird[8-12]. Das Prinzip der „leben-
den“ kontrollierten radikalischen Polymerisation beruht darauf, dass ein dynamisches
Gleichgewicht zwischen einer relativ kleinen Anzahl an wachsenden freien Radikalen und
einer großen Anzahl an deaktivierten „schlafenden“ Spezies erzeugt wird[13]. Damit kön-
nen die irreversible Kettenübertragung und der Kettenabbruch zwar nicht vollständig ver-
hindert, aber stark zurückgedrängt werden. Es wurden mehrere Methoden entwickelt, bei
denen die notwendige Verringerung der Konzentration an freien Radikalen auf sehr unter-
schiedliche Weise erreicht wird; alle beinhalten Aktivierungs-, Deaktivierungs-, Wachs-
tums- und Abbruchreaktionen. Letztere sind jedoch unter diesen Bedingungen so weit un-
terdrückt, dass die radikalische Polymerisation in dieser Hinsicht nahezu der lebenden ani-
onischen entspricht.
Bei der Nitroxide Mediated Polymerization (NMP) wird die Polymerisation durch klassi-
sche Radikalstarter (BPO, AIBN etc.) initiiert und in einer Vorgleichgewichtsphase Mo-
nomeres addiert und so die aktive Spezies gebildet. Stabile Radikale auf Basis von linearen
oder cyclischen Nitroxiden wie z.B. 2,2,6,6-Tetramethylpiperidin-1-oxyl (TEMPO) reagie-
ren dann reversibel mit den C-zentrierten Radikalen unter Bildung von Alkoxyaminen.
Diese unterliegen bei Temperaturen über 100°C einer reversiblen Spaltung der C-ON-
Bindung unter Rückbildung des stabilen Nitroxidradikals und des C-Radikals, woran wie-

2 Theoretischer Teil 5
der Monomeres addiert werden kann. Das Gleichgewicht liegt hierbei weit auf der Seite
der deaktivierten Spezies, des Alkoxyamins (Schema 2.1).
NOP NOPnPn +.ka
kd
+ Mkp
.>100°C
Schema 2.1. Aktivierungs-Deaktivierungs-Gleichgewicht der „Nitroxide Mediated
Polymerization“ (NMP) mit 2,2,6,6-Tetramethylpiperidin-1-oxyl (TEMPO)
als stabilem Radikal.
Im Fall des Reversible Addition Fragmentation Chain Transfer Process (RAFT) werden
Dithioester zum Erzeugen der deaktivierten Spezies eingesetzt. Als Initiatoren dienen ge-
ringe Mengen konventioneller Initiatoren, die zu Radikalen zerfallen und Monomeres ad-
dieren können. Mit substituierten Dithioestern reagiert die aktive Spezies im Sinne einer
„radikalischen Umesterung“ zur deaktivierten Spezies (Schema 2.2).
S S
z
S S
z
S S
z
Pn +.
+ Mkp
Pm PmPmPn Pn
+ .
+ Mkp
.
Schema 2.2. Gleichgewicht zwischen aktiver und deaktivierter Spezies im RAFT-Prozess.
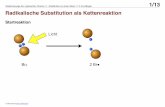
Bei der Atom Transfer Radical Polymerization (ATRP) werden die freien Radikale (aktive
Spezies), die mit Alkylhalogeniden (deaktivierte Spezies) im Gleichgewicht stehen, durch
einen Redoxprozess erzeugt. Diese Methode wird ausführlich im folgenden Abschnitt vor-
gestellt.

2 Theoretischer Teil 6
2.2 Die lebende radikalische Polymerisation durch Atomtransfer
(ATRP)
Die lebende radikalische Polymerisation durch Atomtransfer (ATRP) basiert auf der in der
organischen Chemie bekannten übergangsmetallkatalysierten Atom Transfer Radical Addi-
tion (ATRA) [14] und wurde 1995 von Matyjaszewski erstmals beschrieben.[15] Seitdem ist
dieser Ansatz zur „lebenden“ radikalischen Polymerisation Gegenstand intensiver Untersu-
chungen und wird unter anderem von Sawamoto et al. [16] (Metall (Mt) = Ru, Fe), Percec et
al.[17] (Mt = Cu, RX = Arylsulfonylhalogenid) und insbesondere von Matyjaszewski et al.
(Mt = Cu, Fe) bearbeitet.
2.2.1 Mechanismus und Kinetik
Der Mechanismus der kupferkatalysierten ATRP ist in Schema 2.3 dargestellt.
Schema 2.3. Mechanismus der kupferkatalysierten ATRP mit Initiierung, Kettenwachs-
tum und Kettenabbruch.

2 Theoretischer Teil 7
In einem vorgelagerten Gleichgewicht werden die Radikale (aktive Spezies) durch einen
reversiblen Redoxprozess aus einem Alkylhalogenid (R-X) generiert. Die Abspaltung des
Halogenatoms X der deaktivierten Spezies R-X wird durch einen Kupfer(I)komplex (CIX)
katalysiert, der dabei selbst zum Kupfer(II)komplex (X-CuIIX) oxidiert wird. Im Initiie-
rungsschritt lagert das Radikal ein Monomeres an und reagiert dann wieder mit dem oxi-
dierten Kupfer(II)komplex (X-CuIIX) zur deaktivierten Spezies (RM-X) und zum Kup-
fer(I)komplex (CuIX). Das Kettenwachstum erfolgt durch Anlagern von Monomerem an
die aktive Spezies (Pn•), die dann wieder reversibel durch Übertragung des Halogens vom
Kupfer(II)komplex (X-CuIIX) zur deaktivierten Form (Pn-X) oxidiert wird. Kettenabbruch
kann wie bei der konventionellen radikalischen Polymerisation durch Kombination oder
Disproportionierung zweier Radikale hervorgerufen werden.
Die Übertragung des Elektrons im Redoxprozess erfolgt hauptsächlich konzertiert („inner-
sphere electron transfer“, ISET). Allerdings können auch Nebenreaktionen durch „outer-
sphere electron transfer“, OSET, auftreten[18,19], die ionische Zwischenstufen beinhalten
(Schema 2.4).
Schema 2.4. Mögliche OSET-Mechanismen bei der ATRP.
Fall A stellt einen zweistufigen Mechanismus dar, in dem als Zwischenstufe ein Radikal-
anion gebildet wird. Dies kann vor allem bei Initiatoren mit hoher Elektonenaffinität (z. B.
CCl4) stattfinden und führt daher zu Nebenreaktionen und somit zu geringerer Initiatoreffi-
zienz. Im Fall B werden die Radikale zum Carbanion reduziert, im Fall C zum Carbokation
oxidiert. Z.B. ist p-Methoxystyrol nicht durch ATRP mit dem System Cu(I)/(dNbpy)2 po-
lymerisierbar[20]; das p-Methoxystryrylradikal wird vielmehr zum Kation oxidiert, was zu
Eliminierungsreaktionen führt.
Ob die Halogenübertragung reversibel durch ISET stattfindet oder Nebenreaktionen durch
OSET auftreten, hängt zum einen von den Redoxeigenschaften des Übergangsmetallkom-

2 Theoretischer Teil 8
plexes ab, zum anderen von denen des Initiators und der makromolekularen Halogenver-
bindung.
Obwohl der Nachweis freier Radikale mit Hilfe der ESR in ATRP-Systemen wegen des
vorhandenen Übergangsmetalls oft schwierig ist, konnte bewiesen werden, dass die ATRP
nach einem radikalischen Mechanismus abläuft[21]:
Die Verwendung von konventionellen radikalischen Initiatoren wie AIBN und BPO in
Verbindung mit Deaktivatoren (X-CuII) führt zu wohldefinierten Produkten („reverse
ATRP“)[15,22].
•
•
•
Die Chemoselektivität[23] und die Reaktivität der aktiven Zentren entspricht der der
konventionellen radikalischen Polymerisation[24,25].
Wie bei der konventionellen radikalischen Polymerisation können Regio- und Stereo-
selektivität nicht beobachtet werden. Alle Polymere haben reguläre Kopf-Schwanz-
Verknüpfungen[11,26], die Taktizitäten entsprechen ebenfalls der der konventionellen
radikalischen Polymerisation[15,27].
Der Initiator wird in einem frühen Stadium der Reaktion vollständig verbraucht, so dass
alle Ketten bei sehr niedrigem Monomerumsatz gestartet werden. Die Konzentration der
aktiven Spezies (freie Radikale) wird jedoch im Vergleich zur Gesamtkonzentration der
Ketten durch das dynamische Gleichgewicht zwischen schlafenden (Pn-X) und aktiven
Polymerketten (Pn•) sehr klein gehalten. Somit unterliegt nur ein geringer Prozentsatz der
Ketten einer irreversiblen Radikal-Radikal-Terminierung, die die Funktionalität der Ketten
aufhebt. Dieser Anteil an Terminierung verhindert jedoch durch den im gleichen Maß ent-
stehenden Deaktivator (X-CuIIX), dass im weiteren Verlauf der Polymerisation Deaktivie-
rung abläuft („persistent radical effect“, PRE)[28] (Schema 2.5).
Pn-X + CuIX Pn X-CuIIX+.ka
kd
+ M
kp
Pn+m +Pn= Pm
H
2kt
/
Schema 2.5. Kupferkatalysierte ATRP mit „persistent radical effect“ (PRE).

2 Theoretischer Teil 9
Das Geschwindigkeitsgesetz der ATRP kann wie folgt (Gl. 2.4) beschrieben werden:
X]Cu-[X kX][Cu k [I][M] k R II
d
Ia
0pp = Gl. 2.4
ka Aktivierungskonstante
kd Deaktivierungskonstante
Aus der konstanten Konzentration an aktiver Spezies während der Polymerisation und der
Kinetik erster Ordnung bezüglich des Monomeren ergibt sich ein linearer Zusammenhang
des Umsatzes mit der Zeit bei semilogarithmischer Auftragung (Abb. 2.1).
Abb. 2.1. Schematische Darstellung der Abhängigkeit des Umsatzes von der Zeit bei
linearer und halblogarithmischer Auftragung bei der lebenden Polymerisa-
tion.
Da jedoch ständig Abbruchreaktionen auftreten, die Cu(II)-Konzentration also zunimmt,
sind Abweichungen vom idealen linearen Verlauf möglich. Für den idealen Fall der ketten-
längen-unabhängigen Terminierung wird durch den „persistent radical effect“ (PRE) eine
lineare Abhängigkeit des Umsatzes von der Zeit mit dem Exponenten 2/3 bestimmt[29].
Aus Gl. 2.4 ist ersichtlich, dass die Polymerisationsgeschwindigkeit erster Ordnung bezüg-
lich der Konzentration des Monomeren, aber auch bezüglich der des Initiators und der des
Cu(I)-Komplexes ist[17,30-32]. Die Reaktionsordnung des Deaktivators zu bestimmen, ist
aufgrund der spontanen Bildung von Cu(II) (PRE) komplizierter[29]. Ist die Anfangskon-
zentration an Cu(II) nicht groß genug, um eine schnelle Deaktivierung zu ermöglichen, tritt
Kupplung von niedermolekularen Radikalen auf, was ein Ansteigen der Konzentration an
Cu(II) verursacht[28,33]. Mit jeder Terminierungsreaktion werden irreversibel zwei Äquiva-

2 Theoretischer Teil 10
lente Cu(II) erzeugt, bis die Konzentration an Cu(II) hoch genug und die Radikalkonzent-
ration klein genug ist, damit eine lebende kontrollierte Polymerisation ablaufen kann. Etwa
5% aller wachsenden Polymerketten werden im ersten Stadium terminiert. Durch Zugabe
von ca. 10% Deaktivator zu Beginn der Polymerisation kann der Anteil an anfänglicher
Terminierung aber minimiert werden[17,34].
Wenn kein Kettenabbruch stattfindet, ist der Polydispersitätsindex (PDI) bei der ATRP
abhängig von der Konzentration des Initiators (R-X), des Deaktivators (X-CuIIX), von der
Wachstumsgeschwindigkeits- (kp) und der Deaktivierungskonstante (kd) und vom Umsatz
des Monomeren (p)[35] (Gl. 2.5):
[ ] [ ]( )[ ]
−
−
−−−+== 121 0
pXCuXkkXRXR
MMPDI II
d
pt
n
w Gl. 2.5
Katalysatoren, die wachsende Polymerketten schneller deaktivieren können, bewirken eine
Verringerung der Polydispersität (kleinerer Quotient [ ] [ ]( )
[ ]XCuXkkXRXR
IId
pt
−−−− 0 ). Auch höhe-
re Konzentrationen an Deaktivator (Zugabe von kleinen Mengen vor der Polymerisation)
führen zu kleineren Polydispersitäten, allerdings mit geringerer Wachstumsgeschwindig-
keit[30]. Durch Zugabe von metallischem Kupfer (Cu0) wird die Wachstumsgeschwindig-
keit erhöht, da Cu(II) in Verbindung mit Cu0 zu Cu(I) reduziert wird[36]. Ist die
Wachstumsgeschwindigkeit hoch oder sind die Ketten noch relativ kurz (größerer Betrag
für [R-X]0), ist die Uneinheitlichkeit noch relativ groß. Mit fortschreitender Polymerisation
(höherer Umsatz des Monomeren) werden die Ketten aufgrund der ständig stattfindenden
Austauschreaktionen einheitlicher, die Polydispersität sinkt. Auch die Labilität der Metall-
Halogen-Bindung im Deaktivator, die durch Übergangsmetall, Gegenion und Ligand be-
einflusst wird, ist für die Geschwindigkeitskonstante der Deaktivierung in erheblichem
Maße verantwortlich.
Ein wichtiger Aspekt, der die Kontrolle der Polymerisation und somit die Polydispersität
bestimmt, ist die Löslichkeit des Katalysators im System. Bei schlechter Löslichkeit des
Salzes (des Komplexes) wird auch die Untersuchung der Kinetik bezüglich Cu(II) erheb-
lich erschwert. Durch Verwenden von Liganden, die mit langen Alkylketten substituiert
sind, werden diese löslich gemacht. In Systemen mit homogenen Katalysatoren ist die
Konzentration an Deaktivator in der Lösung höher als in heterogenen Systemen, und Ter-
minierungsreaktionen werden daher weitgehend zurückgedrängt. Somit ergeben sich für

2 Theoretischer Teil 11
die Polymeren engere Verteilungen[37]. Verwendet man Katalysatoren, die auf Trägermate-
rialien wie Kieselgel oder vernetztem Polystyrol aufgebracht sind, um sie wieder besser
aus dem System entfernen zu können, erhält man Polymere mit Polydispersitäten über
1,5[38].
Bei lebenden Polymerisationen kann das Molekulargewicht über das Verhältnis von ver-
brauchtem Monomeren zu eingesetztem Initiator [I]0 bestimmt werden: Pn = ∆[M]/[I]0. Die
Polydispersität Mw/Mn liegt dabei zwischen 1,0 und 1,5. Bis zu einem Molekulargewicht
von ca. 150 000 können eng verteilte Polymere relativ leicht synthetisiert werden. Strebt
man höhere Molekulargewichte an, wird der Anteil an Nebenreaktionen und Terminierung
größer. Die Kontrolle wird durch Wechselwirkung der Cu(II)-Spezies mit den wachsenden
Radikalketten und den makromolekularen Alkylverbindungen beeinträchtigt.
Bei geeigneter Wahl des Katalysators (Übergangsmetallsalz und Ligand), des Initiators
und der Polymerisationsbedingungen steigen die Molekulargewichte - wie für lebende Pro-
zesse typisch - linear mit dem Umsatz an, und die Molekulargewichtsverteilung ist ähnlich
eng. Dies ermöglicht, ein breites Spektrum an Monomeren radikalisch zu polymerisieren
und Polymere mit definierten Strukturen, Zusammensetzungen und Endfunktionalitäten zu
erhalten.
2.2.2 Katalysatoren
Kupferkatalysatoren sind in ihrer aktivierenden Wirkung bei der ATRP anderen Systemen
in aller Regel überlegen, da sie für viele Monomere wie Styrole, (Meth)acrylate und Ac-
rylnitril angewandt werden können [39-41] und unempfindlich gegenüber funktionellen
Gruppen wie Hydroxy- und Aminogruppen und gegenüber Medien wie Wasser, Methanol
und Acetonitril sind[30]. Üblicherweise werden Kupferchlorid oder Kupferbromid in Ver-
bindung mit Liganden zur ATRP eingesetzt. Die Aufgabe des Liganden in der ATRP ist,
das Kupfersalz in organischen Medien zu lösen und das Redoxpotential des Kupfers in
Bezug auf Reaktivität und auf den dynamischen Halogenaustausch zu regulieren[42,43] Wei-
tere Ansprüche an die Liganden und das Metallsalz (Katalysator) sind:
•
•
•
Schnelle und quantitative Initiation zu ermöglichen
Das Gleichgewicht zwischen aktiver und deaktivierter Spezies auf die Seite der deakti-
vierten zu verschieben
Schnelle Deaktivierung der freien Radikale durch Halogenübertragung und gleichzeitig
relativ schnelle Aktivierung der deaktivierten Polymerkette zu ermöglichen

2 Theoretischer Teil 12
Keine Nebenreaktionen wie β-H-Abstraktion oder Oxidations/Reduktions-Mechanis-
mus der Radikale hervorzurufen.
•
Elektronische und sterische Effekte spielen für die Aktivität und Effizienz der Katalysato-
ren eine wichtige Rolle[44]. Mehrzähnige Stickstoffliganden eignen sich gut für die kontrol-
lierte Polymerisation mit Kupfer[44]. So können Phenanthroline[45-47], Pyridine[42], Pyridi-
nimine[48] und aliphatische Amine[44,49-51] für die kupferkatalysierte ATRP eingesetzt wer-
den. In Abb. 2.2 sind einige Stickstoffliganden aufgeführt, die bei der kupferkatalysierten
ATRP verwendet werden können.
Abb. 2.2. Beispiele für Stickstoffliganden für die Kupfer-katalysierte ATRP.

2 Theoretischer Teil 13
Kupfer(I) bevorzugt tetraedrische oder quadratisch-planare Anordnungen, welche durch
kationische Komplexe mit vierzähnigen Liganden oder mit zwei Äquivalenten an zweizäh-
nigen Liganden hervorgerufen wird. Mit dreizähnigen Liganden und einem Halogenidli-
ganden werden neutrale Komplexe gebildet. Kupfer(II) liefert mit einem vierzähnigen oder
mit zwei zweizähnigen Liganden in Verbindung mit einem Halogenidliganden kationische,
trigonal-bipyramidale Komplexe. Mit dreizähnigen Liganden und zwei Halogenidliganden
entstehen neutrale, quadratisch-pyramidale Komplexe mit verlängerter Cu-X-Bindung in
apicaler Position (Abb. 2.3).
Abb. 2.3. Aktive Komplexe für die kupferkatalysierte ATRP.
Aliphatische Amine sind reaktiver als Pyridine, diese wiederum sind reaktiver als Imine.
Verbrückte und cyclische Liganden sind reaktiver als die entsprechenden linearen. Die
ATRP mit Kupfer, das komplexiert mit Phosphinliganden ist, führt wegen ungünstiger
elektronischer Effekte und Bindungsenergien zu schlecht definierten Polymeren mit relativ
breiter Molekulargewichtsverteilung[52].
UV-vis Untersuchungen der Cu(I)- und Cu(II)-Verbindungen des Systems aus CuBr und
2,2’-Bipyridyn (bpy) und ESR-Messungen der Cu(II)-Spezies ergaben, dass die Struktur
der aktiven Spezies bei der Lösungspolymerisation komplex ist[53] und stark von der Pola-
rität des Lösungsmittels abhängt[54-57] (Schema 2.6).

2 Theoretischer Teil 14
CuN
N
N
NCuX2 Cu
N
N
N
NX
+ +NN2
A B
X = Cl oder Br
NN = dNbpy
2
Schema 2.6. Katalysatorstrukturen des Systems CuX/dNbpy in Abhängigkeit von der
Polarität des Mediums.
Durch Isolieren der Komplexe aus verschieden polaren Lösungsmitteln konnten die Struk-
turen A und B mit der „extended X-ray absorption fine structure” (EXAFS) [58-
61]identifiziert werden. Das Gleichgewicht zwischen A und B hängt stark von der Polarität
des Lösungsmittels und dessen Fähigkeit, Wasserstoffbrückenbindungen zu bilden, ab. In
polaren protischen Lösungsmitteln wird B bevorzugt, in weniger polaren Lösungsmitteln,
welche das X--Anion nicht über H-Brücken stabilisieren können, dominiert Struktur A[62].
Durch Verwenden von Kupfersalzen, die mit zwei Äquivalenten 2,2’-Bipyridin komple-
xiert sind[15,27] können Polymere mit Molekulargewichten von 100 000 und einer Poly-
dispersität von 1,2 bis 1,5 erhalten werden. Durch ATRP mit in Position 4 und 4’ durch
Alkylreste substituierten Bipyridinen können Polymere mit noch engerer Verteilung ge-
wonnen werden. Die Molekulargewichte steigen linear mit dem Umsatz und entsprechen
dem theoretisch berechneten Wert.
2.2.3 Initiatoren
Die Aufgabe des Initiators bei der ATRP besteht darin, in einem vorgelagerten Gleichge-
wicht Radikale (aktive Spezies) durch einen reversiblen Redoxprozess zu generieren. Die
Geschwindigkeit dieses Prozesses ist ein entscheidender Faktor. Die Initiierung muss
schnell und quantitativ erfolgen. Bei Initiatoren, die eine ähnliche chemische Struktur be-
sitzen wie die makromolekularen deaktivierten Spezies, entspricht die Konstante der Initi-
ierung (ki) ungefähr der Wachstumskonstante (kp). Solche Initiatoren eignen sich gut für
die ATRP des entsprechenden Monomeren.

2 Theoretischer Teil 15
Die Kohlenstoff-Halogen-Bindung muss homolytisch gespalten werden. Die Bindungs-
stärke der C-X-Bindung korreliert gut mit der Geschwindigkeit der homolytischen Spal-
tung der Bindung. Daher kann man die Initiatoren nach der Bindungsstärke der C-X-
Bindung ordnen: R-Cl > R-Br > R-I. Alkylbromide übertragen das Halogen schneller als
Chloride. Alkyliodide sind für die ATRP jedoch weniger gut geeignet, da hierbei die Bin-
dungsspaltung auch heterolytisch erfolgen kann. Außerdem können sich Metalliodid-
Komplexe bilden. Auch Pseudohalogenide wie Thiocyanate sind nicht gut geeignet. Sie
initiieren sehr langsam[29,63].
Solange funktionelle Gruppen am Initiator inert sind in Bezug auf Katalysator und Alkyl-
verbindung und ki größer oder ungefähr gleich kp ist, können leicht funktionelle Gruppen
in die Polymeren eingebaut werden (Abb. 2.4).
Abb. 2.4. Initiatoren für die ATRP.
Die Initiatoren (f-R-X) können aufgrund ihrer funktionellen Gruppen (f) am Rest (R) nach
ihrer Aktivität eingeteilt werden: NC-R-X > R’OC-R-X > R’OOC-R-X > Ph-R-X >
Cl-R-X > Me-R-X. Sulfonylchloride bewirken schnelle Initiation. Tertiäre sind reaktiver
als sekundäre Alkylverbindungen, die wiederum aktiver sind als primäre.
Je nach Wahl des Katalysators (Redoxpotential) muss auch der Initiator auf das System
abgestimmt werden, damit die Initiierung schnell und quantitativ erfolgt. Die Molekular-
gewichte der durch ATRP hergestellten Polymeren entsprechen dann den theoretisch be-
rechneten mit enger Verteilung.

2 Theoretischer Teil 16
2.3 Blockcopolymere
Blockcopolymere sind Makromoleküle, die aus mindestens zwei Blöcken kovalent mitein-
ander verbundener Homopolymerer aufgebaut sind. Durch diese Verknüpfung können
Blockcopolymere im Vergleich zu den sie bildenden Homopolymeren ein völlig neues
Eigenschaftsprofil erhalten. Je nach Molekülarchitektur werden u.a. lineare (Zwei-, Drei-
und Multiblockcopolymere; siehe Abschnitt 2.1.2.1), verzweigte (Stern-[64] und Pfropfco-
polymere[65-68], cyclische[69-73], hantelförmige[74] und Leiterblockcopolymere[75]) unter-
schieden. Eine Vielzahl weiterer Strukturvariationen ist beschrieben[75]. Für das gezielte
Einstellen von Eigenschaften durch definierte Synthesemöglichkeiten hat sich der Begriff
des „macromolecular engineering“ durchgesetzt[76,77]. Als mögliche Eigenschaftskombi-
nationen ergeben sich hart-weich[78], hart-zäh[79] oder hydrophil-hydrophob[80,81]. Durch die
große Vielfalt unterschiedlicher Strukturen und Eigenschaften besitzen Blockcopolymere
sehr interessante Eigenschaften und können vielseitig verwendet werden, z.B. als Polymer-
additive wie Schlagzäh-Modifier oder als thermoplastische Elastomere.
In der Literatur sind drei Methoden zum Herstellen von Blockcopolymeren beschrieben:
•
•
•
Nach beendeter Polymerisation des Monomeren A fungiert das entstandene Polymere
als Makroinitiator für die Polymerisation des Monomeren B usw. (Sequentielle Mono-
meraddition)[82-84]. Damit führt der monofunktionelle Polymerisationsstart in zwei Stu-
fen zu AB- Strukturen[85,86], in drei Stufen zu ABA- [84,87] oder ABC-Strukturen[88]. Der
bifunktionelle Polymerisationsstart gestattet die Herstellung von ABA-[78] (zwei Stu-
fen) oder CBABC-Strukturen[89] (drei Stufen).
Die Kondensation oder Kopplung von funktionalisierten Homo- oder Blockcopolyme-
ren durch spezielle Reagenzien unter Bildung von Zwei-, Drei- bis zu Multi- und
Sterncopolymeren[90].
Die Kombination verschiedener Mechanismen („Site transformation“) zur Realisierung
von völlig neuen Blockkombinationen[91,92].
Die klassische Methode zum Herstellen von Blockcopolymeren stellt die anionische Poly-
merisation dar. Diese hat aber den Nachteil, sehr empfindlich gegenüber Verunreinigungen
und auch nur für eine begrenzte Anzahl von Monomeren anwendbar zu sein. In den letzten
Jahren wurden deshalb große Bemühungen auf die Weiterentwicklung der kontrollierten
radikalischen Polymerisation gelegt. Sie bietet ebenfalls die Möglichkeit der Synthese von

2 Theoretischer Teil 17
Blockcopolymeren unterschiedlichster Architekturen, ist aber wesentlich unempfindlicher
gegen Verunreinigungen im Reaktionssystem und kann zahlreiche Vinylmonomere poly-
merisieren. Die Herstellung von Blockcopolymeren durch „lebende“ radikalische Polyme-
risation und im besonderen durch ATRP[84] hat den Vorteil, dass die „lebenden“, z.B. die
halogenterminierten Ketten isoliert und charakterisiert werden können. Auch müssen sie
im Gegensatz zur ionischen Polymerisation nicht sofort weiterverarbeitet werden. Die
durch ATRP erhaltenen Ketten sind somit als Makroinitiatoren für die ATRP von anderen
Monomeren einsetzbar. So werden Blockcopolymere durch diese „sequentielle Monomer-
zugabe“ zugänglich, aber auch durch Kombination unterschiedlicher Polymerisationsver-
fahren, wie freie radikalische[93], anionische[92] und kationische[94]
Polymerisationen mit
„lebender“ radikalischer.
2.4 Sternpolymere
Bei Sternpolymeren handelt es sich um sehr kompakte Moleküle, die im Vergleich zu ihren
linearen Homologen einen höhere Segmentdichte besitzen. Für die Herstellung von Stern-
polymeren werden im Wesentlichen zwei Methoden unterschieden, die „arm-first“-
Methode und die „core-first“-Methode.
2.4.1 „Arm-first“-Methode
Sternpolymere mit definierter Armlänge, aber variabler Armzahl können mit Hilfe der
„arm-first“-Methode sowohl anionisch als auch durch kontrollierte radikalische Polymeri-
sation (ATRP) hergestellt werden. Zuerst wird das Precursor-Polymere, ein lineares Poly-
meres synthetisiert. Anschließend wird eine Divinylverbindung zugegeben, der sog. Ver-
netzer, wodurch das Sternpolymere entsteht: Durch Vernetzung über die Divinylverbin-
dung bildet sich der Kern des Sternpolymeren (Schema 2.7).

2 Theoretischer Teil 18
XX
funktionelle Endgruppefunktionelle Endgruppe
ATRP
R
X + Monomeres
X
R R
+ XX
R R
+ XXX +
1.
2.
Divinylbenzolnetzwerk
XXInitiator mitfunktioneller Gruppe
Schema 2.7. ATRP nach der „Arm-first“-Methode mit 1,4-Divinylbenzol als Vernet-
zungsreagenz.
Im Falle der Polymerisation von Styrol[95,96] wird meistens 1,4-Divinylbenzol als Vernetzer
eingesetzt, bei der Polymerisation von (Meth)acrylaten[97,98] dagegen Ethylenglycoldi-
methacrylat. Die so erhaltenen Sternpolymeren sind uneinheitlich bezüglich ihre Armzahl
und ihrer Kerngröße und besitzen in der Regel keine Endfunktionalität. Werden allerdings
Initiatoren eingesetzt, die neben der initiierenden Funktion auch noch eine weitere funktio-
nelle Gruppen tragen, wie in Schema 2.7 dargestellt, so können auch Sternpolymere mit
jeweils einer funktionellen Gruppe an jedem Arm erhalten werden. Durch stöchiometrische
Umsetzung mit multifunktionellen Elektrophilen wie Chlorsilanen[90,99] anstatt der Umset-
zung mit Divinylbenzol oder Ethylenglycoldimethacrylat bilden sich durch anionische Po-
lymerisation Produkte mit definierter Armzahl.
2.4.2 „Core-first“-Methode
Mit der „Core-first“-Methode kann man Sternpolymere mit definierter Armzahl erhalten,
indem multifunktionelle Initiatoren zur Polymerisation verwendet werden (Schema 2.8).

2 Theoretischer Teil 19
ATRP+ Monomeres
X
X
X
X
X
X
X
X X
X = Halogen
XX
XXX
XX
X X X
XX
XXX
XX
X X X
X
Schema 2.8. ATRP nach der „Core-first“-Methode.
Diese Methode bietet sich für die Synthese von Sternpolymeren an, die an ihren äußeren
Enden funktionalisiert werden sollen, um die weitere Anlagerung von Monomeren oder
eine Reaktion an den Endgruppen zu ermöglichen.
Bei der Umsetzung von 1,4-Divinylbenzol mit einem monofunktionellen Initiator durch
anionische Polymerisation werden lösliche Mikrogele mit einer Vielzahl anionischer Start-
zentren gebildet. Damit entstehen Sternpolymere mit vielen hundert Armen, die aber eine
starke Uneinheitlichkeit in der Armzahl und der Kerngröße aufweisen, allerdings an den
äußeren Enden funktionalisiert werden können[103]. Die für die Herstellung von
Sternpolymeren mit der anionischen Polymerisation benötigten multifunktionellen
Initiatoren sind nur schwer zugänglich, da sie zur Aggregation neigen und schlecht löslich
sind. Bei kontrollierten radikalischen Polymerisationen, im Besonderen bei der ATRP können
dagegen leicht zugängliche mehrfunktionelle Initiatoren verwendet werden. So konnte He-
xakis(brommethyl)benzol erfolgreich als Initiatior für die ATRP von Styrol zu einem 6-
Arm-Stern eingesetzt werden[100]. Mit Cyclotetrasiloxanen und Cyclotriphosphazenen wer-
den 4- und 6-Arm-Sterne hergestellt[101]. Auch modifizierte Calixarene[102] eignen sich zum
Herstellen von mehrarmigen Sternen aus Styrol und (Meth)acrylaten.

2 Theoretischer Teil 20
2.5 Pfropfcopolymere
Zur Herstellung von Pfropfcopolymeren sind in der Literatur mehrere Synthesewege be-
schrieben, die sich durch den Pfropfmechanismus unterscheiden[104]. Am häufigsten wer-
den die Prinzipien des Grafting-Onto (Abschnitt 2.5.1) und des Grafting-From (Abschnitt
2.5.2) genannt. Eine dritte und neue Möglichkeit[105] wird als Grafting-From-Onto be-
zeichnet (Abschnitt 2.5.3). Des Weiteren können Pfropfcopolymere durch Copolymerisati-
on von Monomeren mit Makromonomeren hergestellt werden. Bei letzteren handelt es sich
um Polymere mit polymerisierbaren Endgruppen[106,107].
2.5.1 Grafting-Onto-Methode
Bei der Grafting-Onto-Methode liegen zu Reaktionsbeginn zwei Polymere vor: Das späte-
re Rückgratpolymere P(A), welches seitenständige funktionelle Gruppen an der Kette be-
sitzt, und das Seitenkettenpolymere P(B) mit den am Kettenende befindlichen reaktiven
Endgruppen. Schema 2.9 zeigt den Grafting-Onto-Prozess.
Grenzfläche
P(A)P(B)
P(A-g-B)
Funktionelle Gruppe des Rückgratpolymeren P(A)
Reaktive Endgruppe von P(B)
Grenzfläche
P(A)P(B)
P(A-g-B)
Funktionelle Gruppe des Rückgratpolymeren P(A)
Reaktive Endgruppe von P(B)
Funktionelle Gruppe des Rückgratpolymeren P(A)
Reaktive Endgruppe von P(B)
Schema 2.9. Pfropfung nach der Grafting-Onto-Methode.
Die funktionellen Gruppen des Polymeren P(A) reagieren mit den Endgruppen des Poly-
meren P(B) zum gewünschten Pfropfcopolymeren P(A-g-B). Wenn die Reaktion bis zur
Vollständigkeit fortschreitet und ein Überschuss an P(B) vermieden wird, kann im Prinzip

2 Theoretischer Teil 21
reines Pfropfcopolymeres P(A-g-B) entstehen. Dazu muss das Polymere P(B) monofunkti-
onell bezüglich seiner reaktiven Endgruppe sein. Ein bifunktioneller Anteil führt zur Ver-
netzung und damit zum Verlust der thermoplastischen Verarbeitbarkeit. Die Verteilung der
funktionellen Gruppen auf dem Rückgratpolymeren P(A) muss möglichst gleichmäßig
sein. Der Grafting-Onto-Prozess kann in Lösung oder in der Schmelze durchgeführt wer-
den. Schmelzereaktionen von Polymeren lassen sich besonders gut durch reaktive Extrusi-
on durchführen[108,109]. Allerdings erhält man bei der Schmelzeverarbeitung aus folgenden
Gründen selten ein reines Pfropfprodukt: Zum einen sind beide Komponenten fast immer
schon bei Reaktionsbeginn entmischt (Abschnitt 2.6). Deshalb ist bei Schmelzereaktionen
eine andere Kinetik zu erwarten als bei homogenen Reaktionen in Lösung. Die Kopplung
der Komponenten ist nur an den Phasengrenzflächen möglich. Oft ist die Diffusion der
Polymeren an die Grenzfläche geschwindigkeitsbestimmend.
Im Rahmen dieser Arbeit wurden Pfropfcopolymere aus Doppelbindungen enthaltenden
thermoplastischen und elastomeren Rückgratpolymeren P(A) (Abschnitt 3.6.2) und azid-
terminiertem Polystyrol bzw. Polymethylmethacrylat P(B) (Abschnitt 3.6.1) hergestellt.
Auf die erhaltenen Pfropfcopolymeren nach dem Grafting-Onto-Prozess wird ausführlich
in Abschnitt 3.6.3 eingegangen.
2.5.2 Grafting-From-Methode
Bei der Grafting-From-Methode geht die Pfropfreaktion von einer Lösung des Rückgrat-
polymeren P(A) im Monomeren des zu bildenden Pfropfastpolymeren P(B) aus. Am
Rückgratpolymeren werden im Falle von radikalischer Seitenkettenpolymerisation durch
Angriff von Initiatoren Radikale erzeugt, mit denen die Polymerisation gestartet wird. Die
Seitenkettenpolymerisation kann aber auch kontrolliert radikalisch, kationisch oder anio-
nisch durchgeführt werden. Dies gelingt durch Einbau von Monomeren mit reaktiven
Gruppen (z.B. Säurechloride, Borane, Alkylhalogenide) in die Polymerrückgratkette, von
denen die Seitenkettenpolymerisation dann gestartet werden kann (Schema 2.10).

2 Theoretischer Teil 22
P(A)
B
P(A-g-B)
+
B
+P(A)
+
P(B)P(A)
B
P(A-g-B)
+
B
+P(A)
+
P(B)
RR
Schema 2.10. Radikalische Pfropfung nach der Grafting-From-Methode.
Ein industriell angewandtes Beispiel für den mit Initiatoren gestarteten radikalischen Graf-
ting-From-Prozess ist die Polymerisation von Styrol in einer Lösung von Polybutadien in
Styrol, die zum schlagzähen Polystyrol (HIPS-Prozess)[110] führt. Zu Beginn der Reaktion
ist das System meistens homogen, während der Reaktion tritt jedoch Phasenseparation ein,
die im Falle des HIPS auch gewünscht ist. Ein Nachteil ist der nicht zu vermeidende Anteil
an Homopolymerem P(B), der durch Angriff des Initiators auf das Monomere B während
der radikalischen Polymerisation entsteht. Bei den lebenden Polymerisationsmethoden
wird dagegen kein zusätzliches Homopolymeres gebildet, und das Molekulargewicht der
Seitenkette kann einfach eingestellt werden.
2.5.3 Grafting-From-Onto-Methode
Aus der Kombination der beiden in den vorangegangenen Abschnitten beschriebenen
Möglichkeiten (Grafting-From und Grafting-Onto) ergibt sich die Grafting-From-Onto-
Methode[105]. Dieser Mechanismus ist nur möglich, wenn das Monomere durch eine
Stufenreaktion, z.B. durch Polykondensation, polymerisiert und das spätere Polymer-
rückgrat zur Kondensation befähigte Gruppen enthält. Zur Pfropfreaktion wird das
Rückgratpolymere in Monomerem gelöst. Dieses kann dann entweder von vornherein an
der Rückgratkette polykondensieren (Grafting-From) oder zunächst mit weiteren
Monomermolekülen zu freien Ketten polykondensieren. Diese Homopolymeren können
sich dann aber als Pfropfäste an die Rückgratkette anschließen (Grafting-Onto). So liegt
bei dieser Pfropfmethode im Zwischenstadium ungepfropftes Monomeres neben pfropf-
fähigem Homopolymerem und Pfropfprodukt vor. Dessen Seitenketten können durch
Anlagerung von Monomerem dann noch weiter wachsen.

2 Theoretischer Teil 23
2.5.4 Copolymerisation mit Makromonomeren
Um Pfropfprodukte aus Makromonomeren zu erhalten, müssen diese in einem ersten Reak-
tionsschritt synthetisiert werden. Sie besitzen meistens am Kettenende eine polymerisierba-
re Gruppe (z.B. Doppelbindung, Epoxid) und können entweder mit anderen Monomeren
oder auch alleine mit sich selbst reagieren[111]. Die Umsetzung eines Makromonomeren mit
seinem niedermolekularen Monomeren führt zur Klasse der Kammpolymeren[112]. Bei der
Polymerisation mit nicht identischen Monomeren erhält man Pfropfcopolymere. Die Länge
der Seitenkette wird durch das Molekulargewicht der Makromonomeren bestimmt, der
Abstand der Seitenketten im Pfropfcopolymeren durch das Monomerverhältnis von
Makromonomerem zu niedermolekularem Monomeren und durch die Copolymerisati-
onsparameter.
2.6 Reaktive Extrusion
Aufgrund der stark steigenden Anforderungen an das Eigenschaftsprofil von Kunststoffen
ist das Interesse am kontinuierlichen Herstellen und Modifizieren von Polymeren sehr
groß. Mit preiswerten Synthese- und Verarbeitungsverfahren kann man Kunststoffformstü-
cke herstellen, deren Eigenschaftsprofil sich wegen der chemischen und physikalischen
Vielfalt der Polymeren den verschiedensten Erfordernissen anpassen lässt. Dieser Trend
zur Optimierung des Preis-Leistungs-Verhältnisses hat Polymerkombinationen in den Vor-
dergrund gerückt. Aus verfügbaren und bewährten Kunststoffen können, gegebenenfalls
nach Modifizierung, durch Blenden oder Copolymerisation mit geringem Entwicklungs-
aufwand viele neue Werkstoffe gestaltet werden. Die Extrusion stellt eine technisch ge-
nutzte Möglichkeit dar, Polymere zu schmelzen und zu mischen (Polymerblends), um an-
schließend über andere geeignete industrielle Verfahren gewünschte Formkörper zu erhal-
ten. Bei der reaktiven Extrusion (REX) werden chemische Prozesse wie Polymersynthese
und Modifizierung der Kunststoffe durch chemische Umsetzungen mit Extrusionsprozes-
sen gekoppelt. Durch die Integration mehrerer Verfahrensschritte zu einem Prozess und die
damit verbundene Energieeinsparung und durch die hohe Prozessflexibilität sowie die
Möglichkeit, keine oder nur geringe Mengen an Lösemittel zu verwenden, ist das Interesse
an der Entwicklung der reaktiven Extrusion in den letzten 15 Jahren zunehmend gestiegen.
Mehrere chemische Reaktionen sind bekannt, die an Polymeren während ihrer Verarbei-

2 Theoretischer Teil 24
tung durch reaktive Extrusion durchgeführt werden können und die auch industriell ange-
wendet werden:
So lassen sich Polyurethane durch Addition von Polyesterdiolen mit Polyisocyanaten im
Extruder herstellen. Auch die Bildung von Polykondensaten wie Polyestern (Polyethylen-
terephthalat (PET) und Polybutylenterephthalat (PBT)) und Polyamiden (PA 66) während
der Extrusion wird industriell durchgeführt.
Weitere bekannte Verfahren sind Pfropfreaktionen mit funktionalisierten Polymeren, Ver-
netzungsreaktionen (Vulkanisation von Elastomeren) und radikalische Copolymerisatio-
nen.
In der Schmelze verlaufen chemische Reaktionen aufgrund der hohen Viskosität anders als
in Lösung. Die Umsetzung kann durch Unmischbarkeit der miteinander reagierenden
Komponenten und durch die erhöhte Konzentration komplizierter werden. Daher ist bei der
reaktiven Extrusion ein sehr intensives Mischen unabdingbar, um bei nicht-mischbaren
Komponenten und heterogenen Phasen einen optimalen Kontakt der reaktiven Zentren zu
erreichen. Dazu werden Doppelschneckenextruder den Einschneckenextrudern vorgezo-
gen.
Für die Pfropfversuche durch reaktive Verarbeitung wurde ein Mikroextruder der Firma
DSM verwendet, der in Abb. 2.5 dargestellt ist. Es handelt sich um einen corotatorischen
Doppelschneckenextruder mit konischen Schnecken von 15 cm Länge. Im Unterschied zu
praxisüblichen Doppelschneckenextrudern ist der Mischraum im Mikroextruder immer
vollständig gefüllt. Das Füllvolumen beträgt maximal 5 cm3, wobei die Schmelzemischung
über einen Stempel unter Druck in die Einzugszone der Schnecken gegeben werden kann.
Die Verweilzeit im Mikroextruder ist frei wählbar, da die Schmelze über den Bypass im
Kreis geführt wird. Zur Probenentnahme und bei Mischzeitende bzw. Reaktionsende kann
ein Ventil geöffnet werden, worauf die Schmelze als Strang ausfließt.

2 Theoretischer Teil 25
Bypass
Ventil
Befüllung
Auslaß
Antrieb
N2 -Spülung
Bypass
Ventil
Befüllung
Auslaß
Antrieb
N2 -Spülung
Abb. 2.5. Mikroextruder der Firma DSM;
links: Photo mit geöffneter Kammer, rechts: Schema.
2.7 Phasenverhalten
Für die vollständige Mischbarkeit von unterschiedlichen Polymeren in Polymerblends und
Block- bzw. Pfropfcopolymeren muss die Freie Mischungsenergie ∆Gm negative Werte
annehmen. Für die Freie Mischungsenergie gilt nach Gl. 2.6,
mmm ST∆H∆G ∆−= Gl. 2.6
in der ∆Hm die Mischungsenthalpie und ∆Sm die Mischungsentropie sind. Phasensepara-
tion tritt dann auf, wenn ∆Gm positiv ist und somit ∆Hm > T ∆Sm gilt. Der meist positive
Beitrag der Mischungsenthalpie müsste für den Fall der Mischbarkeit der Komponenten
durch den Entropieterm überkompensiert werden. Die Mischungsentropie nimmt allerdings
aufgrund der hohen Molmasse von Polymeren nur geringe positive Werte an, die sich mit
steigender Molmasse dem Wert Null nähern. Weil T ∆Sm den positiven Betrag der Mi-
schungsenthalpie daher selten überkompensieren kann, kommt es bei den meisten Poly-
mersystemen zur Entmischung, da positive Werte für ∆Gm resultieren[113].
Phasenseparation in Blockcopolymeren sollte nach Gl. 2.6 dann auftreten, wenn die chemi-
sche Natur der Blöcke unterschiedlich ist, die Blöcke hohe Molmassen aufweisen und/oder

2 Theoretischer Teil 26
die Temperatur niedrig ist. Für den Fall niedriger Molmassen und/oder partieller Verträg-
lichkeit von Blöcken wird das Auftreten einer Mischphase beobachtet. Mikrophasensepara-
tion in Blockcopolymeren tritt dann auf, wenn das Produkt des Polymerisationsgrades N
(N = Na + Nb) und des Flory-Huggins-Wechselwirkungsparameters χAB einen kritischen
Wert überschreitet[114]:
510 > ) .( cΝχ
Ist das Produkt χN viel größer als der kritische Wert, kommt es zu einer fast vollständigen
Entmischung („strong segregation limit“; SSL) unter Bildung scharfer Grenzflächen. In der
Nähe des kritischen Wertes wird das Konzentrationsprofil durch eine Sinuskurve beschrie-
ben („weak segregation limit“; WSL), so dass eine verbreiterte Grenzschicht zwischen den
Phasen resultiert.
In Abb. 2.6 ist der Verlauf der Konzentrationsprofile für SSL und WSL dargestellt.
Abb. 2.6. Konzentrationsprofile im „strong seggregation limit“ (SSL) und „weak seg-
regation limit“ (WSL) an der Grenzschicht zweier Phasen; ΦA = Volumen-
anteil Komponente A.

3 Ergebnisse 27
3 Ergebnisse
Ziel des ersten Teils der Arbeit war die Herstellung von Blockcopolymeren aus Methyl-
methacrylat und Styrol durch radikalische Polymerisation mittels Atomtransfer. Die Syn-
these von solchen Blockcopolymeren war unter ATRP-Bedingungen zu Beginn der Arbeit
noch nicht erforscht. Zur Herstellung von Blockcopolymeren ist es notwendig, in einem
ersten Schritt Polymere mit enger Molmassenverteilung und hohem Anteil an Endgruppen
zu synthetisieren, die dann im zweiten Schritt als Makroinitiatoren für die Polymerisation
des zweiten Monomeren eingesetzt werden können. Um zu Polymeren mit enger Molmas-
senverteilung und hohem Endgruppengehalt zu gelangen, müssen Initiator, Übergangsme-
tallkomplex, Halogenid, Lösungsmittel und Temperatur genau aufeinander abgestimmt
werden. Solche Systeme, die bei der Polymerisation von Styrol zu hohem Endgruppenge-
halt führen, waren schon ausführlich beschrieben, dagegen war die ATRP von Methyl-
methacrylat noch wenig untersucht. Deshalb wurde MMA in verschiedenen Lösungsmit-
teln und mit verschiedenen Katalysatorsystemen polymerisiert. Mit Hilfe der gewonnenen
Erkenntnisse wurde eine Methode ausgewählt, die wohldefinierte Produkte liefert und
dann für die Herstellung zu Blockcopolymeren aus MMA und Styrol eingesetzt werden
konnte.
3.1 Untersuchungen zur Polymerisation von Methylmethacrylat in Lö-
sung
Zur Untersuchung der ATRP von MMA wurde dieses in verschiedenen Lösungsmitteln
und mit verschiedenen Katalysatorsystemen polymerisiert. Die semilogarithmische Auftra-
gung des Umsatzes gegen die Zeit ergibt für kontrollierte Polymerisationen einen linearen
Zusammenhang, da die Konzentration an aktiver Spezies konstant bleibt und Produkte mit
hohem Endgruppengehalt entstehen. Somit kann die Kinetik für die Beurteilung des Sys-
tems herangezogen werden.
3.1.1 Auswahl des Reaktionssystems
Zur Untersuchung des Einflusses des Lösungsmittels und dessen Konzentration auf die
Kontrolle der ATRP von Methylmethacrylat wurde ein für andere Monomere übliches Ka-
talysatorsystem, Kupfer(I)-bromid und N,N,N´,N´-Tetramethylethylendiamin (TMEDA)

3 Ergebnisse 28
als Ligand, eingesetzt. MMA wurde dann mit α-Bromisobuttersäuremethylester (BiBME)
als Initiator bei 90°C in verschiedenen herkömmlichen Lösungsmitteln (50 Gew.-proz.)
wie Diphenylether, Anisol, Toluol, Ethylacetat, Methylisobutyrat und Acetonitril, und bei
unterschiedlichen Lösungsmittelkonzentrationen polymerisiert. Das eingesetzte molare
Verhältnis Monomeres / Initiator / Kupfer(I)-bromid / Ligand betrug 500/1/1/2. Der Um-
satz von MMA wurde in regelmäßigen Zeitabständen gaschromatographisch bestimmt und
semilogarithmisch gegen die Zeit aufgetragen. Aus den Zeit-Umsatz-Kurven sollte sich bei
konstanter Konzentration an wachsenden Radikalen ein linearer Zusammenhang ergeben.
Dann verhält sich die Polymerisation erster Ordnung bezüglich des MMA und liefert defi-
nierte Polymere mit hohem Gehalt an Endgruppen und enger Molmassenverteilung. In
Abb. 3.1 sind die Zeit-Umsatz-Kurven der Polymerisation von MMA mit α-Bromiso-
buttersäuremethylester (BiBME) als Initiator und Kupfer(I)-bromid und N,N,N´,N´-Tetra-
methylethylendiamin (TMEDA) als Katalysator in 50-proz. Anisol-, Ethylacetat- und To-
luollösung bei 90°C mit dem molaren Verhältnis MMA / Initiator / Kupfer(I)-bromid /
TMEDA von 500/1/1/2 aufgetragen. Die MMA-Umsätze steigen in allen drei Lösungsmit-
teln linear mit der Zeit an, so dass sich eine Kinetik erster Ordnung bezüglich der MMA-
Konzentration ergibt, d.h. die Konzentration an wachsenden Radikalen bleibt weitgehend
konstant. Aus den Steigungen der Geraden wurden die scheinbaren Geschwindigkeitskon-
stanten zu 8,33.10-5 s-1 für die Polymerisation in Toluol, 10,03.10-5 s-1 für die in Ethylacetat
und 10,43.10-5 s-1 für die in Anisol berechnet.

3 Ergebnisse 29
0 200 400 600
0
1
2
3
4kEthylacetat=10,03x10-5s-1
kToluol=8,33x10-5s-1
Anisol Ethylacetat Toluol
ln([M
] 0/[M
] t)
Zeit t (min)
kAnisol=10,43x10-5s-1
Abb. 3.1. Semilogarithmische Auftragung des Umsatzes gegen die Zeit bei der ATRP
von MMA in verschiedenen Lösungsmitteln; T = 90°C, 50-proz. Lösungen,
(molares Verhältnis: MMA / BiBME / CuBr / TMEDA = 500 / 1 / 1 / 2).
Des Weiteren wurden die Molekulargewichte in verschiedenen Polymerisationsstadien
bestimmt, um sie mit den aus dem Verhältnis der Konzentrationen des bei der Polymerisa-
tion verbrauchten Monomeren und des eingesetzten Initiators berechneten Molekularge-
wichten vergleichen zu können. Zum Bestimmen der Molekulargewichte und Molekular-
gewichtsverteilungen wurde die Gelpermeationschromatographie (GPC) herangezogen.
Bei diesem chromatographischen Verfahren ist die für die Trennung maßgebliche Größe
das hydrodynamische Volumen des gelösten Polymerknäuels. Für chemisch homogene
Homopolymere korreliert das hydrodynamische Volumen sehr gut mit dem Molekularge-
wicht, so dass dessen exakte Bestimmung möglich ist. Als Detektor wurde ein Differential-
Refraktometer verwendet, das die Differenz des Brechungsindexes zwischen der mobilen
Phase und der eluierten Probe misst. Bei kontrollierten lebenden Polymerisationen berech-
net sich das Molekulargewicht der Polymeren zu[13]:
Mt
P M]I[
]M[]M[M0
0 −= Gl. 3.1
MP / MM Molmasse des Polymeren / Monomeren
[M]0 / [M]t Konzentration des Monomeren zum Zeitpunkt t=0 und t
[I]0 Konzentration des eingesetzten Initiators

3 Ergebnisse 30
Wenn keine Nebenreaktionen wie Abbruch und Kettenübertragung stattfinden, entsprechen
die erhaltenen Molekulargewichte den berechneten. Aus den Auftragungen des Umsatzes
gegen die Molekulargewichte der ATRP von MMA in Anisol, Ethylacetat und Toluol
(Abb. 3.2) ist ersichtlich, dass die Molekulargewichte in diesen drei Medien etwa den aus
dem Monomer/Initiator-Verhältnis berechneten Werten entsprechen. Die Initiation erfolgte
also vollständig, d.h. der eingesetzte Initiator wurde komplett verbraucht, und Nebenreak-
tionen wie Kettenübertragung oder Wasserstoffabstraktion vom Lösungsmittel finden nicht
statt.
0 20 40 60 80 10
10000
20000
30000
40000
50000
00
Mn,theoret. Mn Anisol Mn Ethylacetat Mn Toluol
Mn [
g/m
ol]
Umsatz [%]
Abb. 3.2. Abhängigkeit des Molekulargewichtes Mn vom Umsatz bei der ATRP von
MMA bei 90°C in 50-proz. Anisol-, Ethylacetat- und Toluollösung;
molares Verhältnis: MMA / BiBME / CuBr / TMEDA = 500 / 1 / 1 / 2.
Um den Einfluss der Konzentration des Monomeren auf den kontrollierten Verlauf der
Polymerisation zu ermitteln, wurde MMA bei 90°C mit CuBr/TMEDA als Katalysator und
BiBME als Initiator in Masse und in 50, 33 und 10 gew.-proz. Lösungen von Ethylacetat
polymerisiert. In Abb. 3.3 sind die Zeit-Umsatz-Kurven für die ATRP von MMA in Ethyl-
acetat mit unterschiedlichen Konzentrationen vorgestellt. Für alle Systeme ergibt sich ein
linearer Zusammenhang des logarithmisch aufgetragenen Umsatzes gegen die Zeit. Somit
verlaufen die Polymerisationen nach erster Ordnung bezüglich des Monomeren.

3 Ergebnisse 31
0 200 400 600 800 1000 1200
0
1
2
3
4 Masse 50 gew-% 33 gew-% 10 gew-%
ln([M
] 0/[M
] t)
Zeit t (min)
Abb. 3.3. Semilogarithmische Auftragung des Umsatzes gegen die Zeit bei der ATRP
von MMA bei unterschiedlichen Konzentration in Ethylacetat; T = 90°C,
(molares Verhältnis: MMA / BiBME / CuBr / TMEDA = 500 / 1 / 1 / 2).
In Abb. 3.4 sind die scheinbaren Geschwindigkeitskonstanten für die ATRP von MMA in
Ethylacetat bei 90°C als Funktion der Anfangskonzentrationen an MMA aufgetragen. Für
die Polymerisation in Masse beträgt die scheinbare Geschwindigkeitskonstante 3.10-3 s-1,
für die in 50-proz. Lösung 10.10-5 s-1, für die in 33-proz. Lösung 4,7.10-5 s-1 und für die in
10-proz. Lösung 1.10-5 s-1. Somit ergibt sich ein linearer Zusammenhang zwischen semilo-
garithmisch aufgetragener scheinbarer Geschwindigkeitskonstante und Anfangskonzentra-
tion an Monomerem. Die Geschwindigkeit der ATRP von MMA steigt daher exponentiell
mit zunehmender Konzentration an MMA im Polymerisationssystem.

3 Ergebnisse 32
0 20 40 60 80 1
-12
-11
-10
-9
-8
-7
-6
-5
00
ln(k
app)
Gew-% MMA
Abb. 3.4. Scheinbare Geschwindigkeitskonstanten für die ATRP von MMA in Ethyl-
acetat bei 90°C als Funktion der Anfangskonzentration von MMA;
(molares Verhältnis: MMA / BiBME / CuBr / TMEDA = 500 / 1 / 1 / 2).
Die Molekulargewichte der Polymeren, die durch ATRP in 10, 33 und 50 gew.-proz. Lö-
sung hergestellt wurden, entsprechen den theoretisch berechneten Werten. Auch die Poly-
dispersitäten der Polymeren sind mit 1,3 bis 1,4 relativ gering und lassen auf einen kontrol-
lierten Prozess schließen. Allerdings sind die Molekulargewichte des PMMA, das durch
Massepolymerisation von MMA erhalten wurde, höher als es dem eingestellten Mono-
mer/Initiator-Verhältnis entspricht, und die Polydispersität ist mit 1,6 relativ breit. Dies
lässt darauf schließen, dass bei der hohen Polymerisationsgeschwindigkeit der Kupfer-
TMEDA-Komplex nicht mehr in der Lage ist, die wachsenden Ketten schnell genug zu
deaktivieren, wodurch eine hohe Konzentration an aktiven Radikalen entsteht. Diese gehen
dann analog zur konventionellen radikalischen Polymerisation in beträchtlichem Umfang
Nebenreaktionen wie Kettenabbruch und -übertragung ein. Daraus resultiert eine breitere
Verteilung der Molekulargewichte. Die Polymerisation von MMA in Masse durch ATRP
mit dem Aktivator-Komplex aus aliphatischen Aminen und Kupfer(I)-bromid ist zur kon-
trollierten Herstellung von wohl definierten Polymeren demnach nicht geeignet. Durch
Zusatz von Lösungsmittel kann die Reaktionsgeschwindigkeit allerdings so erniedrigt wer-
den, dass das Gleichgewicht der Redoxreaktion zwischen deaktivierter Spezies und freien
Radikalen auf der Seite der deaktivierten Polymerketten liegt. Dadurch verringert sich die
Anzahl der freien Polymerradikale, was wiederum zu weniger Nebenreaktionen führt. So
können aliphatische Amine als Liganden in Kombination mit Kupfer(I)-bromid unter Zu-

3 Ergebnisse 33
gabe von Lösungsmittel für die ATRP von MMA zum Herstellen von wohldefinierten Po-
lymeren eingesetzt werden. Aus den vorher genannten Untersuchungen mit verschiedenen
Lösungsmitteln geht zudem hervor, dass sowohl Anisol als auch Toluol und Ethylacetat für
die ATRP von MMA geeignet ist.
3.1.2 Vergleich verschiedener Katalysatorsysteme
Bei der ATRP werden die Katalysatoren üblicherweise in situ durch Reaktion der Ligan-
den mit den Kupfersalzen in Gegenwart von Monomeren und gegebenenfalls Lösungsmit-
teln hergestellt. Die Kupfer(I)-Verbindungen werden vor Zugabe zum Reaktionsgemisch
gereinigt, da sie unbekannte Mengen an Kupfer(II)-Verunreinigungen enthalten, die das
Redoxgleichgewicht beeinflussen. Ziel dieses Teils der Arbeit war es herauszufinden, ob
auch vorkomplexierte Kupferkatalysatoren für die ATRP geeignet sind und in wieweit sich
die Kontrolle der ATRP durch deren Einsatz von den in situ hergestellten Katalysatoren
unterscheidet. Drei unterschiedliche Liganden, N,N,N´,N´-Tetramethylethylendiamin
(TMEDA), 4,4’-Di-(5-nonyl)-2,2’-bipyridin (dNbpy) und N,N-Bis(2-pyridylmethyl)octyl-
amin (BPMOA) wurden mit Kupfer(I)-bromid in Toluol zu den entsprechenden Komple-
xen (CuL2Br) umgesetzt und diese als Katalysatoren für die ATRP von MMA in 50-proz.
Toluollösung bei 90°C eingesetzt. Zum Vergleich wurde MMA unter den gleichen Bedin-
gungen mit den im gleichen stöchiometrischen Verhältnis in situ eingesetzten Liganden
und Kupfer(I)-bromid polymerisiert. Die Kinetiken der ATRP von MMA mit den unter-
schiedlich hergestellten Katalysatorsystemen aus TMEDA, dNbpy und BPMOA als Ligan-
den sind in Abb. 3.5 dargestellt. Die semilogarithmischen Auftragungen des Umsatzes ge-
gen die Zeit verlaufen bei allen Polymerisationen linear und weisen auf einen kontrollier-
ten Prozess hin.

3 Ergebnisse 34
0 100 200 300 400 500 600
0
1
2
3
4
N N
TMEDA
NNNC8H17
BPMOA
CuBr / BPMOA = 1/2 Cu(BPMOA)2Br
CuBr / TMEDA = 1/2 Cu(TMEDA)2Br
CuBr / dNbpy = 1/2 Cu(dNbpy)2Br
ln([M
] 0/[M
] t)
Zeit t (min)
N N
dNbpy
Abb. 3.5. Semilogarithmische Auftragung des Umsatzes gegen die Zeit bei der ATRP
von MMA mit vorkomplexierten Katalysatoren und mit in situ hergestellten
Katalysatoren bei T = 90°C und 50 Gew.-% Toluol,
(molares Verhältnis: MMA / BiBME / CuBr / Ligand = 500 / 1 / 1 / 2).
Die Reaktionsgeschwindigkeiten der ATRP mit vorkomplexierten Katalysatoren sind un-
wesentlich geringer als die mit in situ im Polymerisationsgemisch entstandenen Katalysa-
toren. In Tab. 3.1 sind die scheinbaren Geschwindigkeitskonstanten aufgeführt. Sie liegen
zwischen 8.10-5 s-1 und 12.10-5 s-1.
Tab. 3.1. Vergleich der scheinbaren Reaktionsgeschwindigkeitskonstanten (kapp) der
ATRP mit in situ hergestellten und vorkomplexierten Katalysatoren bei
90°C.
Komplex kapp (s-1)
in situ generiert 1,19.10-4 Cu(dNbpy)2Br
vorkomplexiert 1,07.10-4
in situ generiert 9,82.10-5 Cu(BPMOA)2Br
vorkomplexiert 8,85.10-5
in situ generiert 8,25.10-5 Cu(TMEDA)2Br
vorkomplexiert 8,01.10-5

3 Ergebnisse 35
Mit dNbpy und BPMOA als Liganden werden höhere Polymerisationsgeschwindigkeiten
erreicht als mit TMEDA, da die Methylgruppen am Stickstoff des TMEDA im entspre-
chenden Kupfer(I)-Komplex die Anlagerung von weiterem Halogen unter Bildung des
Kupfer(II)-Komplexes und freiem Radikal aus sterischen Gründen erschweren. Beide aus
der Polymerisation mit in situ generiertem und vorkomplexiertem Katalysator entstande-
nen Produkte besitzen die den aus dem Monomer/Initiator-Verhältnis berechneten Moleku-
largewichte und haben enge Molekulargewichtsverteilungen von 1,1-1,4. Damit kann für
die ATRP sowohl der Katalysator aus den Einzelkomponenten in situ verwendet werden
als auch der schon vorher hergestellte Komplex. Dies entspricht den Erwartungen. Bei der
ATRP mit in situ generierten Komplexen werden die Komponenten zum Monomeren und
Lösungsmittel gegeben, und unter Rühren entsteht in ca. 10 min der Komplex. Danach
wird der Initiator zugegeben und die Polymerisation gestartet. Bei der Verwendung des
vorkomplexierten Katalysators ist der Komplexierungsprozess vorgelagert, so dass die
Zugabe des Initiators zu Beginn erfolgen kann. Aufgrund dieser Befunde wurden im weite-
ren Verlauf dieser Arbeit für die ATRP die Katalysatoren als Einzelkomponenten einge-
setzt, um sich den vorgelagerten Komplexierungsschritt zu ersparen. Ausnahme war der
von Julia Kubasch[115] am Institut für Makromolekulare Chemie synthetisierte Phenanthro-
lin-Komplex Bis[2,9-bis(4-methoxyphenyl)-1,10-phenanthrolin]-Kupfer(I)-Hexafluoro-
phosphat (Cu(MeOPhphen)2PF6).
Die Polydispersitäten der Polymethylmethacrylate, die unter Aktivierung mit Cu(I)-
TMEDA-Komplexen erhalten wurden, betragen etwa 1,4, die mit dNbpy und BPMOA
liegen bei 1,1 bzw. 1,2. Somit werden bei der ATRP von MMA mit dNbpy und BPMOA
als Liganden Nebenreaktionen wie Kettenabbruch durch Wasserstoffabstraktion und Ket-
tenübertragung stärker zurückgedrängt als mit TMEDA als Ligand. Dies ist auf die Lös-
lichkeit der Kupfer(II)-Komplexe zurückzuführen. Cu(dNbpy)2Br2 und Cu(BPMOA)2Br2
sind im Gegensatz zu Cu(TMEDA)2Br2 während der ATRP vollständig im System gelöst.
Die Kupfer(II)-Komplexe sind für das Maß der Deaktivierung verantwortlich. Sie ver-
schieben das Redoxgleichgewicht auf die Seite der deaktivierten Spezies und verhindern
dadurch einen Überschuss an freien Radikalen. Sobald die Konzentration an aktiven freien
Radikalen zu groß wird, neigen diese in erhöhtem Maße zu Nebenreaktionen und somit zu
einer breiteren Verteilung der Molekulargewichte. Im Fall der ATRP mit TMEDA fällt ein
Teil des Cu(TMEDA)2Br2-Komplexes aus, da er schlechter im System löslich ist als der
Cu(TMEDA)2Br-Komplex. Das Redoxgleichgewicht liegt dann nicht mehr vollständig auf
Seiten der deaktivierten Spezies. Es entsteht eine höhere Konzentration an aktiven Radika-

3 Ergebnisse 36
len, die zu Nebenreaktionen neigen. Daraus resultiert eine etwas breitere Molekularge-
wichtsverteilung der Polymeren. Für die ATRP von MMA sind also dNbpy und BPMOA
als Liganden besser geeignet als TMEDA, da sie bei höheren Polymerisationsgeschwin-
digkeiten zu Polymethacrylaten mit engerer Molekulargewichtsverteilung führen.
Die Liganden dNbpy und BPMOA sind keine käuflichen, sondern aufwendig synthetisierte
Produkte. Für technische Anwendung sind kostengünstige Produkte wünschenswert.
TMEDA ist ein im Handel zugänglicher Ligand, dessen Anwendung, wie aus den voran-
gegangenen Untersuchungen hervorgeht, allerdings nicht zu so sehr definierten Produkten
führt, wie sie mit dNbpy und BPMODA erhalten werden können. Deshalb wurden im wei-
teren Verlauf der Arbeit unterschiedliche käufliche aliphatische Amine, Bipyridine und
Phenanthroline mit substituierten Liganden für die ATRP von MMA eingesetzt und im
Hinblick auf einen kontrollierten Polymerisationsprozess untersucht und miteinander ver-
glichen. Dies waren die aliphatischen Amine N,N,N’,N’-Tetramethylethylendiamin
(TMEDA), N,N,N’,N’’,N’’-Pentamethyldiethylentriamin (PMDETA) und
N,N,N’,N’’,N’’’,N’’’Hexamethyltriethylentetramin (HMTETA), die Bipyridine 2,2’-
Bipyridin (bpy) und das alkylierte 4,4’-Di-(5-nonyl)-2,2’-bipyridin (dNbpy) sowie das aus
zwei Pyridinen und einem aliphatischen Amin kombinierte N,N-Bis(2-pyridylmethyl)-
octylamin (BPMOA) und die Phenanthroline 1,10-Phenanthrolin (phen), die substituierten
Phenanthroline 2,9-Dimethyl-4,7-diphenyl-1,10-phenanthrolin (dmdp-phen) und 2,9-Bis(4-
methoxyphenyl)1,10-phenanthrolin (MeOPh-phen) und Poly(2,9-o-phenanthrolin-alt-
(2’,5’-dihexyl)-4,4’’-p-terphenylen) (poly-phen), deren Formeln in Abb. 3.6 zusammenge-
stellt sind. Die ATRP von MMA wurde mit diesen Liganden in Kombination mit Kup-
fer(I)-bromid bei 90°C in Toluol und in Ethylacetat bei einem Monomer/Initiator-
Molverhältnis von 300/1 durchgeführt.

3 Ergebnisse 37
NNNC8H17
N N
N N
N N
NN
NN
NN
O O
N N N N N N N
NN NN
NN
C6H13C6H13 C6H13 C6H13
n
C6H13 C6H13
BPMOA
TMEDA
dNbpy
bpy
phen
dmdp-phenMeOPh-phen
poly-phenn=10-15
PMDETA HMTETA
Abb. 3.6. Strukturformeln der verwendeten Liganden für die ATRP von MMA.
In Abb. 3.7 sind die semilogarithmisch aufgetragenen Zeit-Umsatz-Diagramme der ATRP
von MMA in Ethylacetat als Lösungsmittel unter Verwendung der Kupfer(I)-Komplexe
mit den Liganden TMEDA, PMDETA und HMTETA vergleichend aufgetragen. Für die
ATRP von MMA mit dem zweizähnigen aliphatischen Stickstoffliganden TMEDA und
dem vierzähnigen aliphatischen Stickstoffliganden HMTETA ergibt sich ein linearer Zu-
sammenhang. Die Konzentration an wachsenden aktiven Radikalen bleibt somit während
der Polymerisation unter Verwendung dieser beiden Liganden konstant. Dagegen steigt die

3 Ergebnisse 38
Konzentration der aktiven Spezies im Verlauf der ATRP mit PMDETA beträchtlich an,
was sich in einer Abweichung vom linearen Verlauf der Zeit-Umsatz-Kurve zu erkennen
gibt. Die Polymerisationsgeschwindigkeit sinkt hier mit zunehmendem Umsatz.
0 100 200 300 400 500
0
1
2
N N N N
N N N
TMEDA PMDETA HMTETA
ln([M
] 0/[M
] t)
Zeit t (min)
N N
Abb. 3.7. Semilogarithmische Auftragung des Umsatzes von MMA gegen die Zeit bei
der ATRP in Ethylacetat bei 90°C unter Verwendung der Liganden TMEDA,
PMDETA und HMTETA; molares Verhältnis: MMA / BiBME / CuBr / Li-
gand = 300 / 1 / 1 / 1 (TMEDA:2).
Betrachtet man die Löslichkeit der Kupfer(I)- und Kupfer(II)-Komplexe der drei Liganden
während des gesamten Polymerisationsprozesses, so stellt man fest, dass die Kupfer(I)-
Komplexe der drei Liganden sehr gut löslich sind. Der Kupfer(II)-Komplexe mit
HMTETA als Ligand ist ebenfalls sehr gut löslich; das System ist während der Polymerisa-
tion vollständig homogen. Bei der ATRP von TMEDA beginnt nach etwa einer halben
Stunde nach und nach etwas [CuII(TMEDA)2Br]Br dunkelgrün auszufallen. Bei der ATRP
mit PMDETA schlägt sich schon nach wenigen Minuten sehr viel CuII(PMDETA)Br2 dun-
kelgrün am Kolbenrand nieder, so dass der Prozess während des gesamten Verlaufs hete-
rogen ist. Bei der Polymerisation mit TMEDA als Ligand führt dies dazu, dass das Re-
doxgleichgewicht nicht mehr vollständig auf der Seite der deaktivierten Spezies liegt, son-
dern eine etwas zu hohe Konzentration an aktiven Radikalen vorhanden ist, die Nebenreak-
tionen eingehen, woraus eine etwas breitere Molekulargewichtsverteilung von ca. 1,4 folgt.

3 Ergebnisse 39
Das Molekulargewicht (Mn) ist mit 25.900 g/mol etwas höher als das aus dem Mono-
mer/Initiator-Verhältnis berechnete (Mn,th) von 25.530 g/mol bei einem Umsatz (p) an
MMA von 85%.
Bei der Polymerisation mit PMDETA verschiebt sich das Aktivierungs-Deakti-
vierungsgleichgewicht sehr stark auf die Seite der aktiven Radikale, da der Deaktivator
CuII(PMDETA)Br2 ausfällt und so kaum noch wirksam ist. Durch die relativ hohe Kon-
zentration an aktiven Radikalen findet dann auch eine beträchtliche Anzahl an Terminie-
rungsreaktionen statt. Die Molekulargewichte der Produkte aus der Polymerisation mit
PMDETA als Ligand liegen somit etwas über dem theoretischen Wert.
Bei der ATRP von MMA mit HMTETA ist der Aktivierungs-Deaktivierungsprozess sehr
gut wirksam. Dies äußert sich in einer engen Molekulargewichtsverteilung der Polymeren
(1,18), die zudem genau die aus verbrauchtem MMA und Initiator berechneten Molekular-
gewichte besitzen.
In Tab. 3.2 sind die durch ATRP von MMA mit TMEDA, PMDETA und HMTETA als
Liganden erhaltenen Molekulargewichte und die aus dem Verhältnis von verbrauchtem
MMA und der Anfangskonzentration an Initiator berechneten Molekulargewichte sowie
die Molekulargewichtsverteilungen aufgelistet.
Tab. 3.2. Molekulargewichte und Molekulargewichtsverteilung des durch ATRP von
MMA unter Verwendung von Kupfer(I)-Komplexen mit den Liganden
TMEDA, PMDETA und HMTETA in 50-proz. Ethylacetatlösung bei 90°C
erhaltenen PMMA, molares Verhältnis: MMA / BiBME / CuBr / Ligand =
300 / 1 / 1 / 1( TMEDA:2).
Ligand Zeit t
[min]
Umsatz p
[%]
Mn [g/mol] Mn,th [g/mol] PDI
TMEDA 300 85 25.900 25.530 1,41
PMDETA 450 78 25.100 23.400 1,33
HMTETA 420 75 22.600 22.530 1,18

3 Ergebnisse 40
Bei der ATRP von MMA mit Kupfer(I)-bromid und bpy als Ligand bei 90°C ist das Sys-
tem von Beginn an heterogen, da der sich bildende Cu(II)- Komplex schlechter löslich ist
als der Cu(I)-Komplex. Daher verschiebt sich das Aktivierungs-Deaktivierungsgleich-
gewicht am Anfang der Polymerisation etwas mehr auf die Seite des Deaktivators
[Cu(bpy)2Br]Br und der freien radikalischen Polymerketten. Dies hat zur Folge, dass ver-
mehrt Terminierungsreaktionen stattfinden und somit die Molekulargewichtsverteilung der
Polymeren mit 1,32 breiter wird. Allerdings verläuft die Polymerisation nach einer Kinetik
erster Ordnung bezüglich MMA (Abb. 3.8). Der Umsatz steigt bei semilogarithmischer
Auftragung linear mit der Zeit an. Die Molekulargewichte der so erhaltenen Polymeren
liegen etwas über den aus den Umsätzen der Monomeren und der Konzentration des Initia-
tors errechneten Werten. Aus diesen Erkenntnissen lässt sich schließen, dass das Aktivie-
rungs-Deaktivierungsgleichgewicht nach anfänglicher Verschiebung in Richtung des
Deaktivators und der freien Radikale dennoch wirksam ist. Offenbar ist der Deaktivator
[Cu(bpy)2Br]Br im System löslich, so dass der lösliche Anteil zur Deaktivierung der freien
Radikale zur Verfügung steht und so zu einer Kontrolle des Polymerisationsprozesses bei-
trägt.
0 100 200 300
0
1
2
N N
NNNC8H17
dNbpy bpy BPMOA
ln([M
] 0/[M
] t)
Zeit t (min)
N N
Abb. 3.8. Semilogarithmische Auftragung des Umsatzes von MMA gegen die Zeit bei
der ATRP in Ethylacetat bei 90°C unter Verwendung der Liganden bpy,
dNbpy und BPMOA; (molares Verhältnis: MMA / BiBME / CuBr / Ligand =
300 / 1 / 1 / 2(BPMOA:1)).

3 Ergebnisse 41
Wird dNbpy oder BPMOA als Ligand für die ATRP von MMA verwendet, so verläuft die
Polymerisation ebenfalls nach einer Kinetik erster Ordnung (Abb. 3.8) und führt zu wohl-
definierten Molekulargewichten, die linear mit dem Umsatz steigen und den theoretischen
Werten entsprechen. Auch die Polydispersität der ATRP mit dem Liganden dNbpy und
BPMOA ist sehr niedrig (<1,2). Die Molekulargewichte und Molekulargewichtsverteilun-
gen bei der ATRP von MMA unter Verwendung der Kupferkomplexe mit den Liganden
bpy, dNbpy und BPMOA sind in Tab. 3.3 aufgeführt. Mit dNbpy und BPMOA bilden sich
lösliche Cu(I)- und Cu(II)-Komplexe; die Systeme sind rotbraun bzw. orange gefärbt und
während der gesamten Reaktionszeit homogen. Dadurch ist das Aktivierungs-
Deaktivierungsgleichgewicht voll wirksam. Da es auf Seiten der deaktivierten Spezies
liegt, sind Terminierungsreaktionen weitgehend zurückgedrängt. Deshalb sind Kupfer-
komplexe mit Bipyridinen als Liganden aufgrund ihres Redoxgleichgewichtes sehr gut für
die ATRP von MMA geeignet, besonders wenn der Cu(II)-Komplex durch Alkylsubsti-
tuenten am Liganden in Lösung gehalten werden kann.
Tab. 3.3. Molekulargewichte und Molekulargewichtsverteilungen des durch ATRP
von MMA unter Verwendung von Kupfer(I)-Komplexen mit den Liganden
bpy, dNbpy und BPMOA in 50-proz. Ethylacetatlösung bei 90°C erhaltenen
PMMA, molares Verhältnis: MMA / BiBME / CuBr / Ligand = 300 / 1 / 1 /
2( BPMOA:1).
Ligand Zeit t
[min]
Umsatz p
[%]
Mn [g/mol] Mn,th [g/mol] PDI
bpy 270 88 26.800 26.430 1,32
dNbpy 250 88 26.500 26.430 1,12
BPMOA 300 89 26.800 26.730 1,16
Des Weiteren wurden Phenanthrolinliganden in Verbindung mit Kupfer(I)-bromid für die
ATRP von MMA eingesetzt: unsubstituiertes 1,10-Phenanthrolin (phen), 2,9-Dimethyl-
4,7-diphenyl-1,10-phenanthrolin (dmdp-phen), 2,9-Bis(4-methoxyphenyl)-o-phenanthrolin
(MeOPh-phen) und Poly(2,9-o-phenanthrolin-alt-(2’,5’-dihexyl)-4,4’’-terphenylen) (poly-
phen). 1,10-Phenanthrolin bildet mit Kupfer(I)-bromid im Polymerisationssystem einen

3 Ergebnisse 42
löslichen rotbraunen Komplex. Kurz nach Beginn der Polymerisation fällt allerdings ein
Teil des gebildeten Cu(II)-Komplexes aus. Im System mit dmdp-phen als Ligand bewirken
die Phenyl- und Methylgruppen eine höhere Löslichkeit des sich bildenden Cu(II)-
Komplexes, so dass dieser besser, aber dennoch nicht vollständig löslich ist. Dadurch ist
der Prozess mit dmdp-phen als Ligand zu Beginn homogen, wird dann aber mit
fortschreitender Polymerisationszeit heterogen. In Abb. 3.9 ist der Umsatz bei der ATRP
von MMA mit Kupfer(I)-Komplexen mit den verwendeten Phenanthrolinliganden gegen
die Zeit semilogarithmisch aufgetragen. Mit phen und dmdp-phen als Liganden ergeben
sich Polymerisationskinetiken erster Ordnung bezüglich des Monomeren. Im
semilogarithmischen Zeit-Umsatz-Diagramm steigt der Umsatz linear mit der Zeit.
0 250 500 750 1000 1250 1500 1750 2000
0
1
2
NN NN
NN
C6H13C6H13 C6H13 C6H13
n
C6H13 C6H13
n=15
NN
NN
O O
phen dmdp-phen MeOPh-phen poly-phen, n=15
ln([M
] 0/[M
] t)
Zeit t (min)
NN
Abb. 3.9. Semilogarithmische Auftragung des Umsatzes gegen die Zeit bei der ATRP
von MMA in Toluol bei 90°C unter Verwendung von unterschiedlich substi-
tuierten Phenanthrolin-Liganden; (molares Verhältnis: MMA / BiBME /
CuBr / Ligand = 300 / 1 / 1 / 2).
Aus der Linearität im Zeit-Umsatz-Diagramm der Systeme mit phen und dmdp-phen als
Liganden ergibt sich, dass die Konzentration an wachsenden aktiven Polymerketten wäh-
rend der ATRP nahezu konstant bleibt. Da die Polymerisationslösungen aber heterogen
sind, die Cu(II)-Komplexe also teilweise ausfallen und nicht mehr zur Deaktivierung der
Radikale zur Verfügung stehen, verschiebt sich das Gleichgewicht mehr in Richtung der

3 Ergebnisse 43
aktiven Spezies. Dadurch ist die Konzentration an freien Radikalen relativ hoch, was zu
Terminierungsreaktionen führt. Die Molekulargewichte sind dementsprechend höher als
die theoretisch aus den Umsätzen und Initiatorkonzentrationen berechneten Werte und die
Polydispersitäten mit ca. 1,4 relativ breit. In Tab. 3.4 sind die Molekulargewichte und –
verteilungen der ATRP von MMA unter Verwendung der Phenanthrolinliganden aufge-
führt.
Tab. 3.4. Molekulargewichte und Polydispersitäten bei der ATRP von MMA in Toluol
(50 Gew.-%) bei 90°C unter Verwendung der Liganden phen, dmdp-phen,
MeOPh-phen und poly-phen,
(molares Verhältnis: MMA / BiBME / CuBr / Ligand = 300 / 1 / 1 / 2).
Ligand Zeit t
[min]
Umsatz p
[%]
Mn [g/mol] Mn,th [g/mol] PDI
phen 250 82 27.500 24.630 1,42
dmdp-phen 270 75 24.400 22.530 1,39
MeOPh-phen 390 50 21.300 15.020 1,74
poly-phen 1860 11 65.800 3.300 2,33
Nach dem Start der ATRP mit MeOPh-phen als Ligand wird die gelbbraune Lösung des
Cu(I)-Komplexes in MMA und Toluol heterogen; der sich durch die Initiierung bildende
Cu(II)-Komplex fällt aus. Im semilogarithmischen Zeit-Umsatz-Diagramm wird eine ex-
treme Abweichung von der Linearität erhalten. Der ausgefallene Cu(II)-Komplex muss
ständig nachgebildet werden, so dass sich das Gleichgewicht vollständig auf die Seite der
aktiven Spezies und des Deaktivators [Cu(MeOPh-phen)2Br]Br verschiebt. Dieser wird
unwirksam, da er unlöslich ist und daher die freien Radikale nicht mehr deaktivieren kann.
Somit ähnelt dieser Verlauf der Polymerisation der konventionellen radikalischen Polyme-
risation, wobei sich mit fortschreitender Zeit die Polymerisationsgeschwindigkeit verrin-
gert. Auch die Molekulargewichte und -verteilungen des so erhaltenen PMMA gleichen
den bei der konventionellen radikalischen Polymerisation hergestellten Polymeren. Die
Molekulargewichte liegen weit über den berechneten Werten, und die Verteilung ist sehr
breit (1,74). Somit eignet sich MeOPh-phen nicht als Ligand in Verbindung mit Kupfer(I)-
bromid zur ATRP von MMA. Ebenso wenig ist poly-phen als Ligand zur kontrollierten
Polymerisation von MMA brauchbar. Wie aus Abb. 3.9 ersichtlich ist, ist die Polymerisati-

3 Ergebnisse 44
onsgeschwindigkeit sehr gering. Die entstandenen Polymeren besitzen schon bei geringen
Umsätzen sehr hohe Molekulargewichte mit breiter Verteilung (Tab. 3.4). Zwar ist die
Löslichkeit des Liganden in diesem Fall durch die Alkylsubstituenten am Terphenylen
gewährleistet, vermutlich ist aber die starre Verknüpfung über p-Terphenylene in ortho-
Position zum Stickstoff zu unflexibel, um eine tetraedrische bzw. bipyramidale Anordnung
zur Aktivierung und Deaktivierung der Polymerketten zu gewährleisten.
Aus diesen Experimenten ergibt sich, dass unsubstituierte oder in para-Position zum Stick-
stoff substituierte Phenanthroline als Liganden für die ATRP eingesetzt werden können.
Allerdings besitzen die erhaltenen Polymeren etwas höhere Molekulargewichte als die aus
dem verbrauchten Monomeren und der Konzentration des Initiators berechneten Werte.
In Tab. 3.5 sind die Geschwindigkeitskonstanten der ATRP von MMA mit Kupfer(I)-
Komplexen, deren Liganden aliphatische Amine, Bipyridine, Phenanthroline und BPMOA
sind, aufgeführt. Die Polymerisationen wurden in Toluol bzw. Ethylacetat bei 90°C und
einem molaren Monomer/Initiator-Verhältnis von 300/1 durchgeführt. Die Geschwindig-
keitskonstanten nehmen in folgender Reihe ab:
dNbpy > bpy > BPMOA > phen > TMEDA >dmdp-phen > (PMDETA ≅ MeOPh-phen) ≅
HMTETA >> poly-phen
Tab. 3.5. Scheinbare Reaktionsgeschwindigkeitskonstanten der ATRP von MMA mit
Phenanthrolinen, Bipyridinen und aliphatischen Aminen als Liganden der
aktivierenden Kupfer(I)-Komplexe in Toluol (T) bzw. Ethylacetat (E) bei ei-
nem molaren Monomer/Initiator-Verhältnis von 300/1 bei 90°C.
Ligand kapp (s-1)
TMEDA (E) 1,03.10-4
HMTETA (E) 5,48.10-5
bpy (E) 1,27.10-4
dNbpy (E) 1,38.10-4
BPMOA (E) 1,21.10-4
phen (T) 1,13.10-4
dmdp-phen (T) 8,07.10-5
poly-phen (T) 6,85.10-7

3 Ergebnisse 45
Die Polymerisationen mit HMTETA, dNbpy und BPMOA als Liganden der Kupfer(I)-
Komplexe verlaufen bis zu hohen Umsätzen homogen. Die ATRP folgt in diesen Fällen
einer Kinetik erster Ordnung, so dass die Konzentration an aktiven Radikalen konstant
bleibt. Da diese durch die Lage der Redoxgleichgewichte gering gehalten wird, kommt es
auch kaum zu Terminierungsreaktionen. Dies führt dazu, dass der Gehalt an Endgruppen
(Halogen) der Produkte (d.h., deaktivierten Spezies) sehr hoch ist und die erhaltenen Po-
lymeren sehr enge Molekulargewichtsverteilungen besitzen; die Molekulargewichte kön-
nen über das Monomer/Initiator-Verhältnis und den Umsatz an MMA genau vorherbe-
stimmt werden. Die Polymerisationsgeschwindigkeiten sind ausreichend hoch, so dass in
akzeptabler Zeit wohldefinierte Produkte erhalten werden. Daher wurden im weiteren Ver-
lauf der Arbeit für die ATRP von MMA Kupferkomplexe mit HMTETA, dNbpy und
BPMOA als Liganden zur Herstellung der Makroinitiatoren für die Synthese von Blockco-
polymeren aus MMA und Styrol verwendet.

3 Ergebnisse 46
3.2 Initiatoren
Die Aufgabe der Initiatoren bei der ATRP besteht darin, in einem vorgelagerten Gleichge-
wicht Radikale (aktive Spezies) durch einen reversiblen Redoxprozess zu generieren. Die
Initiierungseffizienz der verwendeten Initiatoren und die Geschwindigkeit dieses Prozesses
ist von entscheidender Bedeutung für die erfolgreiche Durchführung der ATRP. Die Initi-
ierung muss schnell und quantitativ erfolgen. Geeignete Initiatoren müssen daher eine
Startgeschwindigkeit gewährleisten, die größer oder gleich der Wachstumsgeschwindigkeit
bereits entstandener Ketten ist. Außerdem sollten sie eine geringe Neigung zu Nebenreak-
tionen besitzen[116]. Verbindungen, die den mit Styrol und MMA gebildeten deaktivierten
Ketten strukturell ähnlich sind, wie 1-Phenylethylbromid (PEB) 1, 2-Brompropionsäure-
methylester (MBP) 2 und α-Bromisobuttersäuremethylester (MBiB) 3 eignen sich sehr gut
als Initiatoren für die ATRP der jeweiligen Monomeren und sind käuflich (Abb. 3.10). Sie
wurden für die Herstellung von einfachen linearen Homopolymeren wie PMMA und Po-
lystyrol und von linearen Block- und Gradientencopolymeren aus MMA und Styrol einge-
setzt.
Br
O
O
BrR
1 R=H (2), CH3 (3)
Abb. 3.10. Initiatoren für die ATRP von MMA bzw. Styrol.
Zum Herstellen von sternförmigen Blockcopolymeren aus MMA und Styrol wurden mehr-
funktionelle Initiatoren synthetisiert (Abschnitt 3.2.3).
Außerdem wurden im Rahmen der vorliegenden Arbeit ein- und beidseitig Azid-
terminierte Polymere hergestellt. Für die Synthese von einseitig Azid-terminierten Polyme-
ren wurden einerseits die oben genannten käuflichen Initiatoren eingesetzt. Anschließend
wurden die bei der ATRP als deaktivierte Spezies enthaltenden halogenierten Endgruppen
der Polymeren durch Azidreste substituiert. Andererseits wurden Initiatoren synthetisiert,
die schon Azidgruppen enthalten (Abschnitt 3.6.1). Damit konnte für einseitig Azid-
terminierte Polymere die anschließende Substitution am Kettenende durch Azid umgangen

3 Ergebnisse 47
werden. Für beidseitig Azid-terminierte Polymere wurde im Anschluß an die ATRP mit
Azid-haltigen Initiatoren die Halogenendgruppe in die Azidgruppe überführt.
3.2.1 Initiatoren mit Azidendgruppe
Zur Herstellung von 2-Brompropionsäure-2-azidoethylester (AEBP) 8 und 2-Brom-2-
methylpropionsäure-2-azidoethylester (AEBiB) 9 wurde im ersten Schritt 2-Chlorethanol 4
in verdünnter Natronlauge bei 70°C mit Natriumazid zu 2-Azidoethanol 5 umgesetzt
(Schema 3.1).
OHN3
OHCl
+NaN3
-NaCl
4 5
Schema 3.1. Synthese von 2-Azidoethanol.
Anschließend wurde 2-Brompropionsäurebromid 6 mit 2-Azidoethanol 5 unter Eiskühlung
in Dichlormethan und Triethylamin als Säurefänger zum 2-Brompropionsäure-2-
azidoethylester (AEBP) 8 verestert. In analoger Weise verläuft die Veresterung von 2-
Brom-2-methylpropionsäurebromid 7 zu 2-Brom-2-methylpropionsäure-2-azidoethylester
(AEBiB) 9 (Schema 3.2). Die Initiatoren wurden säulenchromatographisch und destillativ
gereinigt.
OHN3
Br
O
BrR
ON3
O
BrR
+Et3N
5 R=H (6), CH3 (7) R=H (8), CH3 (9)
Schema 3.2. Veresterung von 2-Brompropionsäurebromid 6 und 2-Brom-2-methyl-
propionsäurebromid 7 zu den Initiatoren mit Azidgruppe 8 (AEBP) und
9 (AEBiB).
In Abb. 3.11 sind die 1H-NMR-Spektren von AEBP 8 und AEBiB 9 dargestellt. Die Me-
thylprotonen (1) im AEBiB erscheinen als Singulett bei 1,96 ppm, die im AEPB als
Dublett bei 1,78 ppm, da sie mit dem Methinproton (4) bei 4,36 ppm koppeln.

3 Ergebnisse 48
5,0 4,5 4,0 3,5 3,0 2,5 2,0 1,5 1,0
OBrN3
O
12
3
4
ON3
O
Br1
2
3
ppm
4
3
3 2
2
1
1
Abb. 3.11. 1H-NMR-Spektren von 2-Brompropionsäure-2-azidoethylester 8 und
2-Brom-2-methylpropionsäure-2-azidoethylester 9 in CDCl3 bei Raumtem-
peratur.
Die Synthese des 4-Azidobenzylbromids (ABB) 12 mit arylischer Azidgruppe gelingt in
zwei Schritten: Dazu wird p-Toluidin 10 zunächst diazotiert und dann mit Natriumazid in
4-Azidotoluol 11 überführt. Im zweiten Schritt wird die Methylgruppe mit N-
Bromsuccinimid (NBS) in Tetrachlorkohlenstoff zum Initiator 4-Azidobenzylbromid 12
bromiert (Schema 3.3).
NH2 N3 N3
Br1. NaNO2/ H+
2. NaN3 NBS
CCl4
10 11 12
Schema 3.3. Synthese von 4-Azidobenzylbromid (ABB) 12.
In Abb. 3.12 ist das 1H-NMR-Spektrum von 4-Azidobenzylbromid 12 dargestellt. Die Me-
thylenprotonen (1) werden bei 4,48 ppm als Singulett, die Arylprotonen (2, 2’ und 3, 3’)
bei 6,99 und 7,38 ppm als Dubletts detektiert.

3 Ergebnisse 49
7,5 7,0 6,5 6,0 5,5 5,0 4,5 4,0
N3
Br1
2
3
2'
3'
CDCl3
3,3' 2,2'
1
ppm
Abb. 3.12. 1H-NMR-Spektrum von 4-Azidobenzylbromid 12 in CDCl3 bei Raumtempe-
ratur.
Alle drei Initiatoren 2-Brompropionsäure-2-azidoethylester 8, 2-Brom-2-methylpropion-
säure-2-azidoethylester 9 und 4-Azidobenzylbromid 12 zeigen eine scharfe Absorptions-
bande der Azidgruppe im Infrarotspektrum (Abb. 3.13). Dies kann als weiterer Konstituti-
onsbeweis für die Verbindungen angesehen werden.
4000 3500 3000 2500 2000 1500 1000
Wellenzahl [cm -1 ]
ON3
O
Br
N3Br
2100 cm-1
4000 3500 3000 2500 2000 1500 1000
Wellenzahl [cm -1 ]
ON3
O
Br
N3Br
4000 3500 3000 2500 2000 1500 1000
Wellenzahl [cm -1 ]Wellenzahl [cm -1 ]
ON3
O
Br
N3Br
2100 cm-12100 cm-1
N N N+ -
N N N+ -
N N N+ -
Abb. 3.13. FT-IR-Spektrum (KBr) der Initiatoren AEBiB 9 und ABB 12 mit scharfer
Absorptionsbande bei 2100 cm-1.
Damit liegen alle für die nachfolgenden ATRP-Experimente benötigten Initiatoren zur
Herstellung von Polymeren mit Azidendgruppe vor.

3 Ergebnisse 50
3.2.2 Initiatoren für die Herstellung linearer Polymerer
Zum Herstellen linearer Polymerer durch ATRP können sowohl monofunktionelle als auch
bifunktionelle Initiatoren verwendet werden. Mit monofunktionellen Initiatoren wird das
Kettenwachstum in eine Richtung gestartet, mit bifunktionellen wachsen die Polymerket-
ten in beide Richtungen vom Initiator weg. Die Synthese von AB-Blockcopolymeren und
von Gradientencopolymeren wurde mit α-Bromisobuttersäuremethylester (MBiB) 3 als
monofunktionellem Initiator durchgeführt (Abb. 3.10). Für die Herstellung von ABA-
Blockcopolymeren mit PMMA-Innenblock wurde anstatt der Polymerisation durch se-
quentielle Addition der Monomeren A, B und A in drei Stufen ein bifunktioneller Initiator
3 synthetisiert, mit dem es gelingt, die Polymerisation mit nur einem Monomerwechsel
durchführen (Schema 3.4).
R-X monofunktioneller Initiator
MonomereBX-R-X bifunktioneller Initiator
R-X R X1. 2. B
R X3.
R XB B
X-R-X1. B
X R X2.
X R XB B
Sequentielle Monomeraddition mit monofunktionellem Initiator
Sequentielle Monomeraddition mit bifunktionellem Initiator
R-X monofunktioneller Initiator
MonomereBBX-R-X bifunktioneller Initiator
R-X R X1. 2. B
R X3.
R XB B
R-X R X1. 2. B
R X3.
R XB B
X-R-X1. B
X R X2.
X R XB B
X-R-X1. B
X R X2.
X R XB B
Sequentielle Monomeraddition mit monofunktionellem Initiator
Sequentielle Monomeraddition mit bifunktionellem Initiator
A,
A A
A A A A
A
A A
A,A,
A A
A A A A
A A
A A A A
A
A A
A
A A
Schema 3.4. Herstellung von ABA-Blockcopolymeren mit monofunktionellem bzw.
bifunktionellem Initiator.
Der bifunktionelle Initiator Bis(2-brom-2-methylpropanoyloxy)ethan (EGBiB) 15 wurde
durch Verestern von 2-Brom-2-methylpropionsäure 14 mit Ethylenglycol 13 erhalten, wel-
ches gleichzeitig als Lösungsmittel diente (Schema 3.5).

3 Ergebnisse 51
OHOH
OH
BrO
BrO
BrO
OO+ 2
-H2O
13 14 15
Schema 3.5. Synthese von Bis(2-brom-2-methylpropanoyloxy)ethan (EGBiB) 15.
Die Reaktion wurde mit einem sauren Ionenaustauscher katalysiert und am Wasserab-
scheider durchgeführt. EGBiB 15 wurde nach Destillation unter vermindertem Druck
durch anschließende Kristallisation isoliert.
Im 300 MHz 1H-NMR-Spektrum von 15 (Abb. 3.14) sind zwei Singuletts zu erkennen. Die
Absorption der Methylenprotonen tritt bei 4,42 ppm auf, die der Methylprotonen des Iso-
butyrats bei 1,92 ppm. Die Spektren weisen darüber hinaus das korrekte Intensitätsverhält-
nis von 3:1 auf. Damit ist die Konstitution von 15 nachgewiesen.
4,5 4,0 3,5 3,0 2,5 2,0 1,5
BrO
BrO
OO
1
2
2 1
ppm
Abb. 3.14. 1H-NMR-Spektrum von EGBiB 15 in CDCl3 bei Raumtemperatur.

3 Ergebnisse 52
3.2.3 Initiatoren für die Herstellung sternförmiger Polymerer
Sternförmige Polymere mit definierter Armzahl können durch ATRP mit entsprechend
multivalenten Initiatoren erhalten werden. Die Zahl der Arme der Sternpolymeren ist durch
die Anzahl der initiierungsfähigen Gruppen des Initiators gegeben.
Für die Herstellung von dreiarmigen Polymer-Sternen wird ein trifunktioneller Initiator
benötigt. Die Wahl fiel auf 1,1,1-Tris(4-(2-brom-2-methylpropanoyloxy)phenyl)ethan
(TBiBPE) 17. Dieses konnte durch Umsetzen von 1,1,1-Tris(4-hydroxyphenyl)ethan 16
mit drei Äquivalenten. 2-Brom-2-methylpropionsäurebromid 7 bei 0°C mit Triethylamin
als Säurefänger und anschließende Kristallisation in ca. 70-proz. Ausbeute erhalten wer-
den.
OHOH
OH
Br
BrO
BrO
Br
O
Br
OOO
O
+ 3
NEt3
16 7
17
Schema 3.6. Synthese von 1,1,1-Tris(4-(2-brom-2-methylpropanoyloxy)phenyl)ethan
(TBiBPE) 17.

3 Ergebnisse 53
Im 1H-NMR-Spektrum von TBiBPE 17 (Abb. 3.15) sind die Methylprotonen des Bromi-
sobuttersäurerestes als Singulett bei 2,00 ppm und die der zentralen Methylgruppe eben-
falls als Singulett bei 2,11 ppm erkennbar. Die aromatischen Protonen werden bei 6,95 und
7,05 ppm jeweils als Dublett mit ausgeprägtem Dacheffekt detektiert.
7,5 7,0 6,5 2,5 2,0 1,5
CDCl34,4'
2
BrO
Br
O
Br
OOO
O
1
23
3'
4
4'
3,3'1
ppm
Abb. 3.15. 1H-NMR-Spektrum des trifunktionellen Initiators TBiBPE 17 in CDCl3 bei
Raumtemperatur.
Im ESI-MS-Spektrum (Abb. 3.16) werden die Molekülionen mit Natrium und Kalium als
Gegenionen bei einer mittleren Molmasse von 776 und 792 m/z registriert. Dies entspricht
exakt der erwarteten Molmasse von TBiBPE 17 von 753 g/mol. Das Aufspaltungsmuster
(b) entspricht dem berechneten Muster (b) der Isotopenverteilung von drei Bromatomen.

3 Ergebnisse 54
750 752 754 756 758 7600
20
40
60
80
100
1
2
3
4
5
6
7
8
910 11
Intens
ität
m/z
a)
b)
750 752 754 756 758 7600
20
40
60
80
100
1
2
3
4
5
6
7
8
910 11
Intens
ität
m/z
a)
b)
Abb. 3.16. ESI-MS-Spektrum von TBiBPE 17, a) berechnetes Isotopenmuster, b) Mole-
külionenpeaks mit Natrium bzw. Kalium als Gegenionen.
Die Herstellung des tetrafunktionellen Initiators Tetrakis(2-brom-2-methylpropanoyloxy)-
2,2-dimethylpropan (PTBiB) 19 gelingt in gleicher Weise durch Veresterung von Pentae-
rythrit 18 mit vier Äquivalenten 2-Brom-2-methylpropionsäurebromid 7 bei 0°C unter
Stickstoffatmosphäre. Die Synthese ist in Schema 3.7, das 1H-NMR-Spektrum in Abb.
3.17 dargestellt.

3 Ergebnisse 55
Br
OBrOH
OHOH
OH
O
OBr
O
OBr
O
OBr
O
OBr
+ 4
NEt3
18 7
19
Schema 3.7. Veresterung von Pentaerythrit 18 mit vier Äquivalenten 2-Brom-2-methyl-
propionsäurebromid 7 zu Tetrakis(2-brom-2-methylpropanoyloxy)-2,2-di-
methylpropan (PTBiB) 19.
Das Integralverhältnis der Signale der Methylprotonen bei 1,88 ppm und der Methylenpro-
tonen bei 4,27 ppm beträgt 3 zu 1 entsprechend dem zu erwartendem der Protonen im Mo-
lekül. Weitere Absorptionen sind nicht detektierbar. Somit wurden alle vier Positionen
vollständig verestert.

3 Ergebnisse 56
4,5 4,0 3,5 3,0 2,5 2,0 1,5
O
OBr
O
OBr
O
OBr
O
OBr
1
2
2
1
ppm
Abb. 3.17. 1H-NMR-Spektrum des tetrafunktionellen Initiators PTBiB 19 in CDCl3 bei
Raumtemperatur.
Aus dem ESI-MS-Spektrum des tetrafunktionellen Initiators 19 (Abb. 3.18) geht die Mol-
masse mit 732 m/z hervor. Es treten zwei Molekülionenpeaks mit Natrium oder Kalium als
Gegenionen bei einer Molmasse von 755 (732 + Na) und 771 (732 + K) m/z auf (b). Die
gemessene Molmasse und das Brom-Isotopenmuster stimmen mit dem berechneten Wert
(a) überein.
728 730 732 734 736 738 740
0
20
40
60
80
100
1
2
3
4
5
6
7
8
9
10
11 12 13
Intensi
tät
m/z
a) b)
728 730 732 734 736 738 740
0
20
40
60
80
100
1
2
3
4
5
6
7
8
9
10
11 12 13
Intensi
tät
m/z
a) b)
Abb. 3.18. ESI-MS-Spektrum von PTBiB 19, a) berechnetes Isotopenmuster, b) Mole-
külionenpeaks mit Natrium bzw. Kalium als Gegenionen.

3 Ergebnisse 57
Die Schmelzpunkte von TBiBPE 17 und von PTBiB 19 wurden mit der Differential-
Raster-Kalorimetrie (DSC) ermittelt. Der erste (---) und der zweite Heizgang (____) der
Messung mit einer Heizrate von 20 K/min sind in Abb. 3.19 dargestellt.
100 150 200 250 300-2
0
2
4
6
138°C
TBiBPE 17, 1. Heizen TBiBPE 17, 2. Heizen PTBiB 19, 1. Heizen PTBiB 19, 2. Heizen
Wär
mef
luss
[W/g
]
Temperatur [°C]
128°C137°C
Heizrate 20°C/min
268°C
253°C 266°C
Abb. 3.19. DSC-Kurven (1. und 2. Heizzyklus, Heizrate 20 K/min) des tri- (rot) und
tetrafunktionellen (blau) Initiators (TBiBPE 17 und PTBiB 19) mit Schmelz-
peaks.
Im ersten Heizzyklus beider Inititiatoren ist jeweils 9 bzw. 13 K unterhalb des Schmelz-
punktes ein weiterer Übergang erster Ordnung vorgelagert. Dies könnte auf eine andere
Morphologie zurückzuführen sein, die sich durch Kristallisation aus Lösung gebildet hat.
Im zweiten Heizzyklus ist diese Umwandlung nicht mehr vorhanden. TBiBPE 17 schmilzt
dann bei 268°C und PTBiB 19 bei 138°C.
Um einen Initiator für die ATRP von MMA und Styrol zum Herstellen von sechsarmigen
Sternblockcopolymeren zu erhalten, wurde versucht, die Synthese von TBiBPE 17 und
PTBiB 19 auf das achiralen Hexahydroxycyclohexan myo-Inosit 20 zu übertragen (Schema
3.8). Allerdings konnte dabei Hexakis(2-brom-2-methylpropanoyloxy)-cyclohexan (IT-
BiB) 21 nicht isoliert werden. Es wurde eine zähe braune Masse erhalten, die weder durch
Umkristallisieren noch durch Säulenchromatographie gereinigt werden konnte.

3 Ergebnisse 58
O
BrBr
O
Br
O
O
Br
O
OBrO O
Br
O
O
BrO
O Br
O
OHOH
OH
OH
OH
OH
+ 6
20 7
21
Schema 3.8. Syntheseschema zur Herstellung von Hexakis(2-brom-2-methylpropan-
oyloxy)-cyclohexan (ITBiB) 21.
Möglicherweise misslang der Versuch zum Herstellen von ITBiB 21, weil sich die Brom-
isobuttersäurereste am Cyclohexanring aufgrund der hohen Raumbeanspruchung derart
sterisch behindern, dass die Anlagerung von sechs Bromisobuttersäureresten unmöglich
wird. Deshalb wurde auf die Synthese eines Dentriten zurückgegriffen, bei dem die Bromi-
sobuttersäurereste in größerem Abstand voneinander entfernt liegen. Dazu wurde in einem
ersten Schritt eine Vorstufe, die 2,2-Bis((2-brom-2-methylpropanoyloxy)methyl)-
propionsäure (BMPA) 23 mit der Funktionalität AB2 (eine Säurefunktion, zwei Hydro-
xygruppen) durch Verestern der beiden Hydroxygruppen der 2,2-Bis(hydroxymethyl)-
propionsäure 22 mit 2-Brom-2-methylpropionsäurebromid 7 hergestellt (Schema 3.9).

3 Ergebnisse 59
Br
BrOO
OH
OH
OH
O
O
Br
O O
Br
O
OH2+
NEt3
22 7
23
Schema 3.9. Herstellung des AB2-Precursors 2,2-Bis((2-brom-2-methylpropanoyloxy)
methyl)propionsäure (BMPA) 23.
Schema 3.10 zeigt die Umsetzung des AB2-Precursors 23 mit Pentaerythrit 18 zu Tetrakis-
(2,2-bis((2-brom-2-methylpropanoyloxy)methyl)propanoyloxy)2,2-dimethylpropan
(8PBiB) 24. Die Wasserabspaltung wird durch Dicyclohexylcarbodiimid (DCC) bei Raum-
temperatur aktiviert.
OH
OHOH
OHO
O
Br
O O
Br
O
OH
O
OBr
OO
BrO
O
OO
Br
OO
Br
O
O
OO
Br
O O
Br
O
OBr
OO
Br
O
O
O
O
+ 4
DCC
24
18 23
Schema 3.10. Oktafunktioneller Initiator 24 aus Pentaerythrit 18 und AB2-Precursor 23.

3 Ergebnisse 60
In Abb. 3.20 ist das 1H-NMR-Spektrum von 2,2-Bis((2-brom-2-methylpropanoyloxy)-
methyl)propionsäure (BMPA) 23 und in Abb. 3.21 das Spektrum des oktafunktionellen
Initiators Tetrakis(2,2-bis((2-brom-2-methylpropanoyloxy)methyl)propanoyloxy)2,2-dime-
thylpropan (8PBiB) 24 dargestellt. Das Proton H4 der Säuregruppe des BMPA erscheint
als breites Signal bei 9,26 ppm, die Methylprotonen H1 und H2 bei 1,31 und 1,85 ppm.
Die beiden Methylenprotonen H3 und H3’ treten jeweils als Dublett bei 4,34 und 4,28 ppm
auf und koppeln mit einer Konstante von 11 Hz.
5,0 4,5 4,0 3,5 3,0 2,5 2,0 1,5 1,0
4,40 4,38 4,36 4,34 4,32 4,30 4,28 4,26 4,24 4,22 4,20
O
O
Br
O O
Br
O
OH1
2
3,4 3'
3,3
2
1
ppm
Abb. 3.20. 1H-NMR-Spektrum (500MHz) des Precursors AB2 (BMPA) 2 in CDCl3 bei
Raumtemperatur.
Im Spektrum des oktafunktionellen Initiators 24 (Abb. 3.21) tritt zusätzlich das Signal der
Methylenprotonen H4 des Pentaerythrits 18 als Singulett bei 4,19 ppm auf. Das Säurepro-
ton bei 9,25 ppm ist dagegen nicht mehr zu erkennen.

3 Ergebnisse 61
5,0 4,5 4,0 3,5 3,0 2,5 2,0 1,5 1,0
O
O
O
OBr
OO
Br
O
O
O 1
2
43, 3'
4,50 4,45 4,40 4,35 4,30 4,25 4,20 4,15 4,10
Cyclohexyl-(DCC)
Aceton
3, (AB2)
3 (AB2)
3 4
3,
2
1
ppm
Abb. 3.21. 1H-NMR-Spektrum (500MHz) des Initiators Tetrakis(2,2-bis((2-brom-2-
methylpropanoyloxy)methyl)propanoyloxy)2,2-dimethylpropan (8PBiB) 24
in CDCl3 bei Raumtemperatur.
Neben geringen Mengen an Aceton, welches zum selektivem Herauslösen des Precursors
23 verwendet wurde, und Resten an DCC sind zusätzlich zu den Dubletts der Methylenpro-
tonen H3 und H3’ bei 4,36 und 4,25 ppm Dubletts bei 4,45 und 4,25 ppm erkennbar. Das
Signal bei 4,25 erscheint somit als doppeltes Dublett. Da auch die Singuletts der Methyl-
protonen H2 und H1 bei 1,85 und 1,29 ppm leichte Schultern besitzen, deutet dies auf ei-
nen verbliebenen Rest der Vorstufe 2,2-Bis((2-brom-2-methylpropanoyloxy)methyl)-
propionsäure (BMPA) 23 hin. Allerdings sind die Dubletts der Methylenprotonen der un-
bekannten Substanz im Vergleich zu denen des BMPA 23 zu tieferem Feld verschoben.
Möglicherweise handelt es sich um ein verestertes Derivat, da auch das Säureproton ver-
schwunden ist.
Dies kann zusätzlich durch ESI-MS bestätigt werden. Das Spektrum von BMPA 23 zeigt
den Molekülpeak im Negativmodus bei 431 m/z, was exakt der Molmasse von 432 g/mol
entspricht. Das Aufspaltungsmuster (b) zeigt die Isotopenverteilung (a) von zwei
Bromatomen (Abb. 3.22).

3 Ergebnisse 62
430 432 434 436 438
0
20
40
60
80
100
1
2
3
4
5
6
7 8 9
Intensi
tät
m/z
a) b)
430 432 434 436 438
0
20
40
60
80
100
1
2
3
4
5
6
7 8 9
Intensi
tät
m/z
a) b)
Abb. 3.22. ESI-MS-Spektrum von 2,2-Bis((2-brom-2-methylpropanoyloxy)methyl)pro-
pionsäure (BMPA) 23, a) berechnetes Isotopenmuster, b) Molekülionenpeak
im Negativmodus.
Im ESI-MS-Spektrum von Tetrakis(2,2-bis((2-brom-2-methylpropanoyloxy)methyl)pro-
panoyloxy)2,2-dimethylpropan 24 werden zusätzlich zu dem Molekülpeak bei 1835 m/z
(d) weitere Ionen detektiert, die ein Masse-zu-Ladungsverhältnis von 123 (a) und 209 (b)
besitzen. Diese Peaks sind auf die Verunreinigungen von 4-Dimethylaminopyridin und
Dicyclohexylcarbodiimid, die als Katalysatoren bei der Reaktion eingesetzt wurden, zu-
rückzuführen. Weiterhin tritt ein Nebenprodukt bei 473 m/z (c) auf. Die auf den Molekül-
peak mit Natrium als Gegenion zurückzuführende Masse von 473 m/z entspricht dem aus
BMPA 22 entstandenen Methylester.

3 Ergebnisse 63
a)
b)
c)
d)d)
a)
b)
c)
d)d)
Abb. 3.23. ESI-MS-Spektrum von Tetrakis(2,2-bis((2-brom-2-methylpropanoyloxy)-
methyl)propanoyloxy)2,2-dimethylpropan 24 mit Molekülpeaks von a)
4-Dimethylaminopyridin, b) Dicyclohexylcarbodiimid, c) Nebenprodukt und
d) dem Aufspaltungsmuster des Hauptproduktes.
Allerdings konnte das BMPA-Derivat nicht durch Säulenchromatographie aus dem gelben,
viskosen Produkt 24 entfernt werden. Somit musste der octafunktionelle Initiator 24 mit
etwa 15 % Verunreinigung für die ATRP von MMA und Styrol eingesetzt werden.
Um Sternpolymere mit noch größerer Armanzahl als acht herzustellen, wurde im Rahmen
der Arbeit ein Initiator synthetisiert, dessen Kern keine niedermolekulare Verbindung,
sondern ein polymeres Grundgerüst auf Basis von Hydroxyethylmethacrylat darstellt.
Hierzu wurde zuerst Hydroxyethylmethacrylat (HEMA) 26 mit 2-Brom-2-methylpropion-
säure-2-hydroxyethylester (HEBiB) 25 als Initiator bei Raumtemperatur in 50-proz. Me-
thanol-Lösung und CuCl/bpy als Katalysator zum Oligomeren OHEMA 27 polymerisiert
(Schema 3.11). Durch das Monomer/Initiator-Verhältnis von 20/1 und den Umsatz von
etwa 97% resultiert ein mittlerer Polymerisationsgrad von fast 20 und somit eine Funktio-
nalität von 21 Hydroxy- und einer Halogenidgruppe pro Kette.

3 Ergebnisse 64
OHO
O
BrO
O
OH
OHO
OBr/Cl
O O
OH
n + n
MeOHRT
25
26 27
ATRP
Schema 3.11. ATRP von Hydroxyethylmethacrylat (HEMA) 26 mit 2-Brom-2-methylprop-
ionsäure-2-hydroxyethylester (HEBiB) 25 bei Raumtemperatur in 50-proz.
Methanol-Lösung (molares Verhältnis: HEMA / HEBiB / CuCl / bpy = 20 /
1 / 1 / 2).
Die semilogarithmische Auftragung des Umsatzes von HEMA gegen die Zeit ist in Abb.
3.24 dargestellt. Die Linearität der Kurve weist auf eine Polymerisation erster Ordnung
bezüglich des Monomeren HEMA hin und besitzt unter den gegebenen Bedingungen eine
scheinbare Geschwindigkeitskonstante von k = 7,58.10-4s-1. Die Molekulargewichte wur-
den nicht verfolgt, da PHEMA nicht in THF löslich ist, welches für GPC-Standard-
messungen als Eluent verwendet wurde.
0 20 40 60 80 1000
1
2
3
4
k=7,58x10-4 s-1
ln([M
] 0/[M
] t)
Zeit [min]
Abb. 3.24. Semilogarithmische Auftragung der ATRP von HEMA bei Raumtemperatur
in 50-proz. Methanollösung (molares Verhältnis: HEMA / HEBiB / CuCl /
bpy = 20 / 1 / 1 / 2).

3 Ergebnisse 65
Aus den so erhaltenen Oligomeren 27 wurde durch Verestern mit 21 Äquivalenten
2-Brom-2-methylpropionsäurebromid 7 bei 0°C unter Stickstoffatmosphäre Oligo((2-
brom-2-methylpropionyloxy)-2-ethylmethacrylat) (OBEMA) 28 erhalten (Schema 3.12).
OHO
OBr
O O
OH
n
Br
BrO
OO
OBr/Cl
O O
O
n
O
Br
O
Br
+ n+1
NEt3
27 7
28
Schema 3.12. Veresterung der Hydroxygruppen des OHEMA 27 mit 2-Brom-2-methyl-
propionsäurebromid 7 zum Oligo((2-brom-2-methylpropionyloxy)-2-ethyl-
methacrylat) (OBEMA) 28.
Im 1H-NMR-Spektrum des OBEMA 28 (Abb. 3.26) sind die Protonen der OH-Gruppen
des OHEMA 27 bei 4,84 ppm (Abb. 3.25) verschwunden. Die Methylenprotonen in Nach-
barschaft zu den OH-Gruppen erfahren durch das Verestern einen Tieffeldshift von 3,59 zu
4,37 ppm. Zusätzlich erscheinen die Methylprotonen des Isobutyrats als breites Singulett
bei 1,97 ppm.

3 Ergebnisse 66
5,5 5,0 4,5 4,0 3,5 3,0 2,5 2,0 1,5 1,0 0,5
Br
OO
OH
O
OH
O
n
12
34
5
DMSOH2O
ppm
4
25
31
Abb. 3.25. 1H-NMR-Spektrum von OHEMA 27 in d6-DMSO bei Raumtemperatur.
5,5 5,0 4,5 4,0 3,5 3,0 2,5 2,0 1,5 1,0 0,5
Br
OO
Br
OO
O
OO
n
Br
O
12
3
45
ppm
42
5
3
1
Abb. 3.26. 1H-NMR-Spektrum von Oligo((2-brom-2-methylpropionyloxy)-2-ethylmeth-
acrylat) (OBEMA) 28 in CDCl3 bei Raumtemperatur.

3 Ergebnisse 67
In der DSC (Abb. 3.27) ist die Glasübergangstemperatur von OBEMA 28 bei einer Heizra-
te von 20 K/min bei 46°C zu erkennen. Der Schmelzpunkt liegt bei 284°C.
0 100 200 300-0,75
-0,50
-0,25
0,00
0,25
284°C
46°C
Wär
mef
luss
[W/g
]
Temperatur [°C]
Abb. 3.27. DSC-Kurve des zweiten Heizzyklus bei einer Heizrate von 20 K/min von
Oligo((2-brom-2-methylprop-ionyloxy)-2-ethylmethacrylat) (OBEMA) 28.
Das Molekulargewicht von OBEMA 28 kann durch Gelpermeationschromatographie
(GPC) abgeschätzt werden. Da keine linearen niedermolekularen Poly((2-brom-2-methyl-
propionyloxy)-2-ethylmethacrylat)-Standards zur Verfügung standen, wurde mit Polysty-
rolstandards kalibriert. Mit PS-Eichung liegt das Molekulargewicht bei 7250g/mol. Das
aus Umsatz und Monomer/Initiator-Verhältnis berechnete Molekulargewicht beträgt dage-
gen 5940 g/mol. Mit 279 g/mol pro Monomereinheit ergibt sich ein Polymerisationsgrad
von 21. Da jede Wiederholungseinheit eine initiierungsfähige Bromidendgruppe trägt und
das durch ATRP entstandene Polymere als Endgruppe ebenfalls Brom besitzt, resultieren
daraus 22 zur Initiation fähige Gruppen. Massenspektrometrisch ist OBEMA 28 weder
durch MALDI-MS noch durch ESI charakterisierbar, da es sich unter den üblichen Bedin-
gungen nicht ionisieren lässt.
In Abschnitt 3.4 ist die ATRP mit OBEMA 28 als Initiator für die Herstellung von multi-
funktionellen Sternblockcopolymeren beschrieben.

3 Ergebnisse 68
3.3 Lineare Blockcopolymere
Blockcopolymere weisen im Vergleich zu den sie bildenden Homopolymeren ein völlig
anderes Eigenschaftsprofil auf. Durch die große Vielfalt unterschiedlicher Strukturen kön-
nen Blockcopolymere für zahlreiche Zwecke verwendet werden, z.B. als Polymeradditive
wie Schlagzäh-Modifier oder als thermoplastische Elastomere. Allerdings war es bisher
nur möglich, mit der ionischen, vorwiegend mit der anionischen, Polymerisation Blockco-
polymere herzustellen. Die ionische Polymerisation hat aber den Nachteil, sehr empfind-
lich gegenüber Verunreinigungen und auch nur für eine begrenzte Anzahl von Monomeren
anwendbar zu sein. Deshalb fand in den letzten Jahren die Weiterentwicklung der kontrol-
lierten radikalischen Polymerisation großes Interesse. Auch sie bietet die Möglichkeit der
Synthese von Blockcopolymeren, ist aber wesentlich unempfindlicher gegenüber Verun-
reinigungen. Die kontrollierte radikalische Polymerisation, im besonderen die ATRP[84],
hat den Vorteil, dass die „lebenden“, d.h. die halogenterminierten Ketten isoliert und cha-
rakterisiert werden können. Die durch ATRP erhaltenen Polymeren sind somit als Makro-
initiatoren für die ATRP von weiteren Monomeren einsetzbar. Damit werden Blockcopo-
lymere durch diese „sequentielle Monomerzugabe“ zugänglich.
In der vorliegenden Arbeit sollten lineare und sternförmige Blockcopolymere aus MMA
und Styrol hergestellt werden. Lineare AB-Blockcopolymere wurden durch ATRP mit den
in Abschnitt 3.2.1 beschriebenen monofunktionellen Inititiatoren erhalten. Zur Synthese
von ABA-Blockcopolymeren mit PMMA-Innenblock wurde der in Abschnitt 3.2.2
beschriebene bifunktionelle Initiator verwendet. Die Sternblockcopolymeren aus MMA
und Styrol wurden mit den multifunktionellen Initiatoren aus Abschnitt 3.2.3 hergestellt.
3.3.1 Herstellung
Zur Herstellung linearer Blockcopolymerer durch ATRP wurden sowohl monofunktionelle
als auch bifunktionelle Initiatoren verwendet. Mit monofunktionellen Initiatoren wird das
Kettenwachstum in eine Richtung gestartet, mit bifunktionellen wachsen die Polymerket-
ten in beide Richtungen vom Initiator weg. Die Synthese von AB-Blockcopolymeren wur-
de mit den Initiatoren α-Bromisobuttersäuremethylester (MBiB) 3, 2-Brompropionsäure-2-
azidoethylester (AEBP) 8 bzw. 2-Brom-2-methylpropionsäure-2-azidoethylester (AEBiB)
9 als monofunktionellen Initiatoren durchgeführt. Für die Herstellung von ABA-Blockco-
polymeren mit PMMA-Innenblock wurde anstatt der Polymerisation durch sequentielle

3 Ergebnisse 69
Addition von Monomeren A, B und A in drei Stufen der bifunktionelle Initiator (2-Brom-
2-methylpropanoyloxy)ethan (EGBiB) 15 eingesetzt, mit dem es gelingt, die Polymerisati-
on mit nur einem Monomerwechsel durchführen.
Zuerst wurde MMA durch ATRP polymerisiert. Dazu wurden die in Abschnitt 3.1.2 aus-
führlich diskutierten Liganden N,N,N’,N’’,N’’’,N’’’-Hexamethyltriethylentetramin
(HMTETA) bzw. 4,4’-Di-(5-nonyl)-2,2’-bipyridin (dNbpy) in Verbindung mit Kupfer(I)-
chlorid als Katalysatoren eingesetzt. Die Polymerisationen mit MMA wurden in Lösung
durchgeführt. Bei Verwendung von dNbpy als Ligand wurde Anisol eingesetzt. Mit dem
Liganden HMTETA erfolgte die Polymerisation in Ethylacetat bei 60°C. Die Polymerisa-
tion wurde bis zu einem maximalen MMA-Umsatz von 90% durchgeführt, um Abbruchre-
aktionen, die bei sehr hohen Umsätzen einen größeren Anteil an der Gesamtreaktion errei-
chen, gering zu halten. Die nach beendeter Polymerisation isolierten Homopolymeren
wurden dann als Makroinitiatoren für die ATRP von Styrol mit Kupfer(I)-bromid in
Verbindung mit dNbpy bzw. N,N,N’,N’’,N’’-Pentamethyldiethylentriamin (PMDETA) als
Liganden eingesetzt. Diese Polymerisationen wurden bei 100°C bis zu Umsätzen zwischen
50 und 90% durchgeführt. Um den PMMA-Makroinitiator vollständig zu lösen, wurde in
50-proz. Toluollösung polymerisiert. In Schema 3.13 ist der sequentielle Ablauf der ATRP
von MMA mit anschließender Zugabe von Styrol dargestellt. In einem Fall wurde zuerst
Styrol polymerisiert und anschließend mit dem Polystyrol-Makroinitiator die ATRP von
MMA gestartet (A-PS-b-PMMA).
R-X R X+ S
SR XR-X R X+ S
SR X
MMAMMA
MMAMMA
MMA MMAMMA MMA
MMA
Schema 3.13. Synthese der AB-Blockcopolymeren aus MMA und Styrol.
Zur Herstellung des ABA-Blockcopolymeren mit PMMA-Innenblock wurde zuerst MMA
mit EGBiB 15 als Initiator und Kupfer(I)-chlorid in Verbindung mit HMTETA als Kataly-
sator zum bifunktionellen Makroinitiator bei 60°C in 50-proz. Anisollösung polymerisiert.
Nach dem Isolieren des Makroinitiators wurde die ATRP von Styrol bei 100°C in 50-proz.
Toluollösung mit Kupfer(I)-bromid und PMDETA als Liganden gestartet (Schema 3.14).
X-R-X X R X X R XS
+S
S
Schema 3.14. Synthese des ABA-Blockcopolymeren mit PMMA-Innenblock.

3 Ergebnisse 70
Wie die Blockcopolymeren wurden auch die Makroinitiatoren vor ihrem weiteren Einsatz
in THF über neutrales Aluminiumoxid filtriert, um den Katalysator zu entfernen. An-
schließend wurden sie in Methanol ausgefällt, abgesaugt und bei 40°C im Vakuum ge-
trocknet. In Tab. 3.6 sind die hergestellten Makroinitiatoren mit den bei der ATRP ver-
wendeten Initiatoren, Katalysatoren, Lösungsmitteln und den dazugehörigen Polymerisati-
onstemperaturen aufgelistet.
Tab. 3.6. Eingesetzte Initiatoren und Liganden sowie Temperaturen und Lösungsmit-
tel für die Herstellung der Makroinitiatoren mit ATRP.
Makro-
initiatoren
Monomer Initiator Ligand Lösungsmittel Temper atur
(°C)
A-PS Styrol AEBP 8 PMDETA Toluol 100
A-PMMA MMA AEBiB 9 dNbpy Anisol 90
PMMA (b1) MMA MBiB 3 dNbpy Anisol 90
PMMA (b2) MMA MBiB 3 HMTETA Ethylacetat 60
PMMA (t) MMA MBiB 3 dNbpy Anisol 90
PMMA (aba) MMA EGBiB 15 HMTETA Ethylacetat 60
3.3.2 Charakterisierung
Die Monomer-Umsätze bei der ATRP wurden gaschromatographisch ermittelt. In Abb.
3.28 sind die Zeit-Umsatz-Kurven der Polymerisation zu den Makroinitiatoren dargestellt.
Sie verlaufen linear und erster Ordnung bezüglich der Monomeren.

3 Ergebnisse 71
0 200 400 600 800 1000 1200 1400 1600
0,0
0,8
1,6
2,4
k=2,29 10-4 APS (CuBr/PMDETA=1/1) aba (CuCl/HMTETA=1/1) APMMA (CuCl/dNbpy=1/2) b2 (CuCl/HMTETA=1/1) b1 (CuCl/dNbpy=1/2) t (CuCl/dNbpy=1/2)
k=1,31 10-4
k=1,96 10-4
k=1,87 10-5
k=7,09 10-5ln
([M] 0/[
M] t)
Zeit t (min)
k=5,48 10-5
Abb. 3.28. Zeit-Umsatz-Kurven der Herstellung der Makroinitiatoren APS, APMMA,
b1, b2, t und des bifunktionellen Makroinitiators aba mit ATRP.
Zur Bestimmung der Molekulargewichte und Molekulargewichtsverteilungen wurde die
Gelpermeationschromatographie (GPC) herangezogen. In Abb. 3.29 sind exemplarisch die
GPC-Kurven während der Polymerisation von MMA mit einem molaren Initia-
tor/Monomer-Verhältnis von 1/50 des Ansatzes b2 dargestellt. Das zahlenmittlere Moleku-
largewicht der PMMA-Makroinitiatoren b2 von 2400 g/mol bei 50% Umsatz steigt linear
mit dem Umsatz an MMA bis zum Endmolekulargewicht des PMMA-Makroinitiators von
4200 g/mol bei 85% Umsatz an MMA. Die Kurven sind monomodal. Der Verlauf ent-
spricht dem bei lebenden Polymerisationen üblichen linearen Anstieg des Molekularge-
wichtes der Polymeren mit dem Umsatz.

3 Ergebnisse 72
103 104
50 % 62 % 75 % 85 %
Molekulargewicht [g/mol]
Abb. 3.29. GPC-Kurven der unterschiedlichen Stadien der Polymerisation von MMA
(b2) bei 50%, 62%, 75% und 85% Umsatz.
Auch die Molekulargewichte der Makroinitiatoren A-PS, A-PMMA, b1, t und aba steigen
linear mit dem Umsatz an (Abb. 3.30).
0 30 60 9
0
5000
10000
15000
20000
25000
30000
0
B1 (CuCl/dNbpy=1/2) B2 (CuCl/HMTETA=1/1) T (CuCl/dNbpy=1/2) APMMA (CuCl/dNbpy=1/2) ABA (CuCl/HMTETA=1/1) APS (CuBr/PMDETA=1/1)
Mol
ekul
arge
wic
ht M
n [g/
mol
]
Umsatz [%]
Abb. 3.30. Umsatz-Molekulargewichts-Kurven bei der Herstellung der Makroinitiato-
ren APS, APMMA, b1, b2, t und des bifunktionellen Makroinitiators aba
mittels ATRP.

3 Ergebnisse 73
In Tab. 3.7 sind die Umsätze, Molekulargewichte und Molekulargewichtsverteilungen der
Makroinitiatoren A-PS, A-PMMA, b1, b2, t und aba aufgeführt. Die zahlenmittleren Mo-
lekulargewichte Mn liegen zwischen 4200 und 29500 g/mol und sind mit 1,15 bis 1,20 eng
verteilt. Sie korrelieren gut mit den aus dem jeweiligen Initiator/Monomer-Verhältnis
([M]0/[I]0) berechneten Molekulargewichten Mn,th.
Tab. 3.7. Polymerisationszeit, Umsatz (MMA) und Molekulargewichte und
-verteilungen der hergestellten Makroinitiatoren.
Polymeres t (min) p (%) [M]0/[I]0 Mn,PMMAa)
(g/mol)
Mn,th,PMMA
(g/mol) PDI
A-PS 170 91b) 50 5000c) 4730d) 1,20
A-PMMA 240 85 100 8700 8510 1,18
PMMA (b1) 510 89 100 8800 8910 1,15
PMMA (b2) 360 85 50 4200 4255 1,18
PMMA (t) 1500 80e) 350 29500 28040 1,19
PMMA (aba) 140 82 200 16630 16420 1,16 a) PMMA-Eichung b) Umsatz von Styrol c) Polystyrol-Eichung d) Mn,th,PS e) Nach Polymerisation mit Styrol beträgt der Umsatz von MMA 99%
Die isolierten und von Kupfersalz und Ligand gereinigten Makroinitiatoren wurden dann
zur ATRP von Styrol als Starter zur Herstellung der Blockcopolymeren eingesetzt. Dazu
wurden die Makroinitiatoren in Toluol gelöst und dann zur Polymerisationslösung gege-
ben. Für die ATRP von Styrol wurde Kupfer(I)-bromid in Verbindung mit N,N,N’,N’’,N’’-
Pentamethyldiethylentriamin (PMDETA) als Ligand eingesetzt. Zur Herstellung des
Blockcopolymeren A-PS-b-PMMA aus dem Polystyrol-Makroinitiator A-PS wurde dieser
in Anisol gelöst und zur Polymerisationslösung aus MMA, Kupfer(I)-chlorid und dNbpy
gegeben. In Tab. 3.8 sind die zur ATRP des zweiten Monomeren verwendeten Initiatoren,
Katalysatoren und Lösungsmittel mit den dazugehörigen Polymerisationstemperaturen zur
Herstellung der Blockcopolymeren aufgelistet.

3 Ergebnisse 74
Tab. 3.8. Eingesetzte Initiatoren, Katalysatoren, Lösungsmittel und Polymerisations-
temperaturen zur Herstellung der Blockcopolymeren.
Blockcopolymere Monomeres Makro-
initiator
Ligand Lösungs-
mittel
Tempe-
ratur (°C)
A-PS-b-PMMA MMA A-PS dNbpy Anisol 90
A-PMMA-b-PS Styrol A-PMMA PMDETA Toluol 100
PMMA-b-PS (B1) Styrol PMMA (b1) PMDETA Toluol 100
PMMA-b-PS (B2) Styrol PMMA (b2) PMDETA Toluol 100
PMMA-b-PS (T) Styrol PMMA (t) PMDETA Toluol 100
PS-b-PMMA-b-PS
(ABA)
Styrol PMMA (aba) PMDETA Toluol 100
Auch die Umsätze der ATRP von Styrol mit den Makroinitiatoren zu den Blockcopolyme-
ren wurden gaschromatographisch verfolgt. In Tab. 3.9 sind die Umsätze der Polymerisati-
on von Styrol zu den Blockcopolymeren, die eingesetzten Monomer/Initiator-Verhältnisse
und die daraus berechneten Molekulargewichte für den Polystyrolblock aufgeführt. Im
Blockcopolymeren A-PS-b-PMMA entspricht der Umsatz p dem von MMA.
Tab. 3.9. Umsatz von Styrol, Monomer/Initiator-Verhältnisse und daraus berechnete
Molekulargewichte des Polystyrolblocks der Blockcopolymerisation.
Polymeres t (min) p (%) [M]0/[I]0 Mn,th,PS
(g/mol) A-PS-b-PMMA 120 41a) 50 2050b)
A-PMMA-b-PS 240 92 300 28700
PMMA-b-PS (B1) 190 55 200 11400
PMMA-b-PS (B2) 1200 98 100 10900
PMMA-b-PS (T) 1400 96 350 29950
PS-b-PMMA-b-PS (ABA) 1040 76 100 7900 a) Umsatz von MMA
b) Mn,th,PMMA

3 Ergebnisse 75
Die Molekulargewichte der mit der ATRP erhaltenen Blockcopolymeren wurden mit der
GPC anhand der PMMA-Eichung abgeschätzt. In Abb. 3.31 sind die GPC-Kurven des
Makroinitiators A-PMMA und des daraus hergestellten Blockcopolymeren A-PMMA-b-
PS dargestellt. Die GPC-Kurve des Blockcopolymeren ist zu höheren Molekulargewichten
verschoben. Beide Kurven sind symmetrisch und monomodal. Es bleibt kein Anteil des
Makroinitiators bei 8700 g/mol zurück. Die Polydispersität des Blockcopolymeren ist mit
1,18 etwa so groß wie die des Makroinitiators mit 1,17. Daraus lässt sich schließen, dass
alle Ketten des Makroinitiators gestartet haben und gleichmäßig gewachsen sind. Auch die
GPC-Kurven der Blockcopolymeren PMMA-b-PS B1, B2, T und ABA sind monomodal,
eng verteilt und im Vergleich zu den Makroinitiatoren zu höheren Molekulargewichten
verschoben. Dies entspricht den Erwartungen der kontrollierten Polymerisation.
103 104 105
A-PMMA A-PMMA-b-PS
MolekulargewichtMolekulargewicht [g/mol]
Abb. 3.31. GPC-Kurven des Makroinitiators A-PMMA und des daraus hergestellten
Blockcopolymeren A-PMMA-b-PS.
Dagegen ist bei der ATRP von MMA ein beträchtlicher Anteil an Polystyrol aus dem Mak-
roinitiator im Blockcopolymeren enthalten. Dies ist im GPC-Chromatogramm des Block-
copolymeren A-PS-b-PMMA (Abb. 3.32) ersichtlich. Die Kurve ist bimodal und besitzt
Maxima bei 4000 g/mol, was dem Molekulargewicht des Restgehaltes an Makroinitiator
A-PS entspricht, der keine Ketten initiiert hat. Das Molekulargewicht von 20000 g/mol
entspricht dem Blockcopolymeren, welches durch einen geringen Teil des Makroinitiators
A-PS initiiert wurde. Durch die unvollständige Initiation von MMA mit dem PS-

3 Ergebnisse 76
Makroinitiator und durch Abbruchreaktionen kann ein Teil der Polystyrolketten nicht mehr
weiter wachsen und bleibt daher als zweite Komponente enthalten.
10 3 10 4 10 5
MolekulargewichtMolekulargewicht [g/mol]
Abb. 3.32. GPC-Chromatogramm des Blockcopolymeren A-PS-b-PMMA.
Blockcopolymere mit enger monomodaler Verteilung und hoher Blockausbeute können
somit nur durch ATRP von zunächst MMA und anschließend Styrol hergestellt werden
und nicht umgekehrt. Die Geschwindigkeit der homolytischen Spaltung der Kohlenstoff-
Brom-Bindung am Kettenende der deaktivierten Polystyrol-Makroinitiatoren ist offensicht-
lich geringer als die Wachstumsgeschwindigkeit der Polymerisation von MMA. Daher ist
auch die Initiationsgeschwindigkeit im Vergleich zur Wachstumsgeschwindigkeit geringer,
so dass ein Rest an Makroinitiator in der Polymerisationslösung zurückbleibt.
Aus den bei der ATRP verbrauchten Monomeren und den eingesetzten Monomer/Initiator-
Verhältnissen können die theoretisch bei kontrollierten Polymerisationen resultierenden
Molekulargewichte berechnet werden. Die mit der GPC gemessenen Molekulargewichte
der Blockcopolymeren (Mn,Block) wurden daher mit den theoretischen Molekulargewichten
des jeweiligen Blockcopolymeren (Mn,th,Block) verglichen (Tab. 3.10). Diese wurden durch
einfache Addition der berechneten Molekulargewichte des PMMA-Blocks (Mn,th,PMMA) der
Makroinitiatoren (Tab. 3.7) mit den berechneten Molekulargewichte des PS-Blocks
(Mn,th,PS) ermittelt.

3 Ergebnisse 77
Tab. 3.10. Aus verbrauchtem Monomeren und der Konzentration des Initiators be-
rechnete Werte für die Molekulargewichte der Teilblöcke PMMA
(Mn,th,PMMA) und PS (Mn,th,PS) sowie der Blockcopolymeren (Mn,th,Block) und
durch GPC-Messungen anhand der PMMA-Eichung abgeschätzte Gesamt-
molekulargewichte der Blockcopolymeren (Mn,Block).
Polymeres Mn,th,PMMA
(g/mol)
Mn,th,PS
(g/mol) Mn,th,Block
(g/mol) Mn,Block
(g/mol)
A-PS-b-PMMA 4730a) 2050b) 6780 8200
A-PMMA-b-PS 8510 28700 37200 40400
PMMA-b-PS (B1) 8910 11440 20350 22000
PMMA-b-PS (B2) 4255 10190 14450 19400
PMMA-b-PS (T) 28040c) 29950 54950d) 73800
PS-b-PMMA-b-PS (ABA) 16420 7900 24320 30400 a) Mn,th,PS b) Mn,th,PMMA c) Nach Polymerisationsende mit Styrol beträgt das berechnete Molekulargewicht von PMMA
34690 g/mol d) Mit 99% Umsatz von MMA ist Mn,th,block=66400 g/mol
Die Werte der Gesamtmolekulargewichte der Blockcopolymeren aus den GPC-Messungen
mit PMMA-Eichung (Mn,Block) sind etwas höher als die aus den Umsätzen von MMA und
Styrol berechneten Gesamtmolekulargewichte (Mn,th,Block). Weil die Blockcopolymeren
chemisch heterogen sind und eine Verteilung der Kettenlängen der einzelnen Homopoly-
merblöcke besitzen, wird die chemische Bruttozusammensetzung des Copolymeren unein-
heitlich, wodurch die Molekulargewichte mit der GPC mit PMMA-Eichung nicht mehr
exakt bestimmt werden können und überschätzt werden.
Im PMMA-b-PS (T) erscheint der berechnete Wert für das zahlenmittlere Molekularge-
wicht des Blockcopolymeren allerdings um etwa 19000 g/mol zu niedrig. Um dies zu ver-
stehen, muss berücksichtigt werden, dass dieses Blockcopolymere durch sequentielle Ad-
dition von MMA und anschließend von Styrol ohne Isolierungsschritt hergestellt wurde.
Styrol wurde zum Polymerisationsgemisch gegeben, als dieses noch einen Restgehalt von
20% der eingesetzten MMA-Konzentration enthielt. Da der verbleibende Rest an MMA im
Polymerisationsgemisch mit ins Blockcopolymere eingebaut wurde, entspricht der Ge-
samtumsatz an MMA nicht 80% (entsprechend dem Makroinitiator t (Tab. 3.7)), sondern
99%. Daraus resultiert ein theoretisches Molekulargewicht des Blockcopolymeren
(Mn,th,Block) von 66400 g/mol, welches etwas besser mit dem aus der GPC ermittelten Wert

3 Ergebnisse 78
des zahlenmittleren Molekulargewichtes des Blockcopolymeren (Mn,Block) von
73800°g/mol übereinstimmt.
Um die theoretisch bestimmten Blockcopolymerzusammensetzung zu verifizieren, wurde
aus den 1H-NMR-Spektren der Blockcopolymeren die Massenanteile an MMA bzw. Styrol
bestimmt. Dazu wurden die Intensitäten der Signale der Methoxyprotonen bei 3,6 ppm mit
denen der Phenylprotonen bei 7,3-6,2 ppm verglichen.
Für den Massenanteil an MMA ergibt sich dann
53
3264763
63
,,PS
,PMMA
,PMMA
II
I
MMA −
+=Φ mit 1=+ StyrolMMA ΦΦ
der Massenanteil für Styrol. Daraus und aus der Molmasse des PMMA-Makroinitiators
wird das Molekulargewicht des Polystyrolblocks erhalten:
PMMA,nMMA
StyrolPS,n MM ⋅=
ΦΦ
, : Molmasse des PMMA-Blocks bzw. PS-Blocks PMMA,nM PS,nM
MMAΦ , StyrolΦ : Massenanteil an MMA bzw. Styrol im Polymeren
: Intensitäten der Methoxyprotonen (3,6 ppm) 63,PMMAI
: Intensitäten der Phenylprotonen (7,3 bis 6,2 ppm) 2637 ,,PSI −
In Abb. 3.33 ist das 1H-NMR-Spektrum des Blockcopolymeren A-PMMA-b-PS mit den
integrierten Bereichen der Phenylprotonen von Styrol und der Methoxyprotonen von
MMA dargestellt.
0.00.00.50.51.01.01.51.52.02.02.52.53.03.03.53.54.04.04.54.55.05.05.55.56.06.06.56.57.07.07.57.5
30.0
160.0
Abb. 3.33. 1H-NMR-Spektrum des Blockcopolymeren A-PMMA-b-PS in CDCl3 bei
Raumtemperatur.

3 Ergebnisse 79
In Tab. 3.11 sind die aus den Spektren erhaltenen Massenanteile von MMA (ΦMMA) und
Styrol (ΦStyrol) und die sich daraus ergebenden Molekulargewichte des Polystyrolblocks
(Mn,PS,ber.) den aus den Umsätzen berechneten Molekulargewichten des Polystyrolblocks
(Mn,th,PS) und denen des Makroinitiators (GPC, Mn,PMMA) gegenübergestellt. Aus den Daten
erkennt man, dass es sich im Falle der Blockcopolymeren PMMA-b-PS (B1) und PMMA-
b-PS (T) um nahezu identische Blockanteile, also um symmetrische Blöcke handelt. Die
Blockcopolymeren A-PS-b-PMMA, A-PMMA-b-PS und PMMA-b-PS (B2) sind hingegen
unsymmetrisch. A-PS-b-PMMA besitzt einen höheren MMA-Anteil, A-PMMA-b-PS und
PMMA-b-PS (B2) einen höheren Styrolanteil. Im ABA-Blockcopolymeren mit PMMA-
Innenblock sind die Einzelblöcke im Verhältnis S-MMA-S von etwa 1:2:1 enthalten.
Tab. 3.11. Massenanteile von MMA und Styrol, Molekulargewichte der Makroinitiato-
ren (Mn,PMMA) und aus NMR-Daten berechnete Molekulargewichte (Mn,PS,ber)
bzw. aus den Umsätzen ermittelte Werte (Mn,th,PS) des Polystyrolblocks.
Polymeres ΦMMA ΦStyrol Mn,PMMA
(g/mol) Mn,PS,ber
(g/mol)
Mn,th,PS
(g/mol) A-PS-b-PMMA 0,62 0,38 5000a) 3060b) 2050c)
A-PMMA-b-PS 0,24 0,76 8700 27550 28700
PMMA-b-PS (B1) 0,43 0,57 8800 11670 11440
PMMA-b-PS (B2) 0,34 0,66 4200 8150 10190
PMMA-b-PS (T) 0,53 0,47 29500 26160 29950
PS-b-PMMA-b-PS (ABA) 0,66 0,34 16630 8550 7900 a) Mn,PS b) Mn,PMMA,ber c) Mn,th,PMMA
Weiterhin ist aus den Daten ersichtlich, dass die aus den Massenanteilen und den Moleku-
largewichten der Blockcopolymeren der GPC-Messung berechneten Molekulargewichte
des Polystyrolanteils (Mn,PS,ber) gut mit den aus dem verbrauchtem Styrol und dem Mono-
mer/Initiator-Verhältnis der ATRP des zweiten Monomeren der Blockcopolymeren
(Mn,th,PS) übereinstimmen. Die Molekulargewichte von Homo- und Blockcopolymeren
können also wie für lebende Polymerisationen typisch über das Monomer/Initiator-
Verhältnis zu Beginn der ATRP eingestellt werden.

3 Ergebnisse 80
Werden die aus den Umsätzen der Monomeren berechneten Molekulargewichte der Block-
copolymeren (Mn,th,Block) mit den Molekulargewichten (Mn,ber,Block) aus denen des Makro-
initiators und den aus den NMR-Spektren ermittelten Massenanteilen des Polystyrolblocks
und den aus der GPC mit PMMA-Eichung bestimmten Molekulargewichten der Blockco-
polymeren (Mn,Block) verglichen, dann findet man einen gute Übereinstimmung der Daten.
In Tab. 3.12 sind die erwähnten Werte aufgelistet.
Tab. 3.12. Aus den Umsätzen der Monomeren berechnete Molekulargewichte
(Mn,th,Block), aus den NMR-Spektren und den Molekulargewichten des Ma-
kroinitiators ermittelte Molekulargewichte (Mn,ber,Block) und aus der GPC mit
PMMA-Eichung bestimmte Molekulargewichte der Blockcopolymeren
(Mn,Block).
Polymeres Mn,th,Block
(g/mol)
(Umsatz)
Mn,ber,Block
(g/mol)
(Makroinitiator/
NMR)
Mn,Block
(g/mol)
(GPC)
A-PS-b-PMMA 6780 8060 8200
A-PMMA-b-PS 37200 36250 40400
PMMA-b-PS (B1) 20350 20470 22000
PMMA-b-PS (B2) 14450 12350 19400
PMMA-b-PS (T) 66400*) 55660 73800
PS-b-PMMA-b-PS (ABA) 24320 25180 30400 *) Bei 99% MMA-Umsatz
Die Werte der GPC-Messung (Mn,Block) zeigen allerdings eine geringfügig höhere Masse.
Beim Blockcopolymeren (T) wird die Molmasse hingegen aufgrund der PMMA-Eichung
und der beträchtlich größeren Blocklänge als bei den anderen Copolymeren um einen hö-
heren Betrag (7400 g/mol) überschätzt. Da hier die Blöcke wesentlich länger sind als die
der anderen Blockcopolymeren wird auch der Fehler, der durch die Messung der Polysty-
rolanteile mit PMMA-Standards entsteht, größer, weil bei der GPC die Makromoleküle
nach ihrem hydrodynamischen Volumen getrennt werden. Dieses ist u.a. eine Funktion der
Kettenlänge, der chemischen Zusammensetzung und der Konformation des Makromole-
küls. Bei linearen Blockcopolymeren besteht kein eindeutiger Zusammenhang zwischen
dem hydrodynamischen Volumen und der Kettenlänge. So können die Retentionsvolumina

3 Ergebnisse 81
von Blockcopolymeren nicht direkt mit Standards von Homopolymeren verglichen wer-
den.
Mit der Chromatographie am kritischen Punkt der Adsorption (LC-CC) können Blockco-
polymere aber selektiv nach den Blocklängen der Homopolymerblöcke getrennt werden.
Wird die LC-CC mit der GPC gekoppelt (2-dimensionale Chromatographie (2D)), ist daher
eine Trennung des Blockcopolymeren in den Koordinaten chemische Heterogenität und
Molmasse möglich. Deshalb wurden die Blockcopolymeren am kritischen Punkt der Ad-
sorption für PMMA untersucht. Die Trennung erfolgte nach der Kettenlänge der PS-
Blöcke. Abb. 3.34 zeigt den Konturplot der zweidimensionalen Trennung des Blockcopo-
lymeren A-PMMA-b-PS. Die erste Dimension (Ordinate) entspricht der LC-CC am kriti-
schen Punkt der Adsorption von PMMA. Hier ist das Retentionsvolumen Ve für die Block-
länge des PS-Blocks aufgetragen. Die zweite Dimension (Abszisse) entspricht der GPC
und enthält die Molmasseninformation des gesamten Blockcopolymeren. Da nur ein Eluti-
onsfleck im Konturplot vorhanden ist, handelt es sich um nur eine Komponente, d.h., es ist
kein homopolymeres PMMA (Makroinitiator) vorhanden. Die leicht negative Neigung des
Elutionsbereichs resultiert aus der Verteilung der PS-Blocklängen in Kombination mit der
Verteilung der Gesamtkettenlänge des Blockcopolymeren. Blockcopolymere, die kürzere
PS-Blöcke besitzen, werden in der ersten Dimension später eluiert als solche mit längeren
Blöcken. Gleichzeitig besitzen die entsprechenden Blockcopolymermoleküle insgesamt
eine geringere Molmasse und sind daher gegenüber den Blockcopolymeren mit längeren
PS-Blöcken auf der Abszisse nach links verschoben.

3 Ergebnisse 82
Molmassenverteilungdes PS-Blocks
Molmassenverteilungdes Blockcopolymeren
Trennung nachMolmassenverteilungdes PS-Blocks
Ve [ml]
M [g/mol]
Molmassenverteilungdes PS-Blocks
Molmassenverteilungdes Blockcopolymeren
Trennung nachMolmassenverteilungdes PS-Blocks
Molmassenverteilungdes PS-Blocks
Molmassenverteilungdes Blockcopolymeren
Trennung nachMolmassenverteilungdes PS-Blocks
Ve [ml]
M [g/mol]
Abb. 3.34. Konturplot der 2D-Trennung von A-PMMA-b-PS. Die erste Dimension ent-
spricht der LC-CC am kritischen Punkt der Adsorption von PMMA, die
zweite Dimension entspricht der GPC.
Bei unvollständigem Start mit dem PMMA-Makroinitiator wäre ein Restgehalt an PMMA-
Homopolymeren im Blockcopolymeren vorhanden. Dieses müßte an dessen kritischem
Punkt der Adsorption im Elutionsbereich bei 3,00 ml als zweiter Fleck unabhängig von
dessen Molmasse auftreten. Das ist weder bei dem Blockcopolymeren A-PMMA-b-PS
noch bei den Blockcopolymeren PMMA-b-PS (B1), PMMA-b-PS (B2) und PMMA-b-PS
(T) und dem ABA-Blockcopolymeren der Fall (Abb. 3.35). Das bedeutet, dass bei allen
Ansätzen die PMMA-Makroinitiatoren bei der ATRP von Styrol vollständig verbraucht
wurden und somit kein Homopolymeres PMMA sondern nur Blockcopolymeres entsteht.
Die Initiierungsgeschwindigkeit der deaktivierten PMMA ist demnach höher als die
Wachstumsgeschwindigkeit der Styrolsequenzen der aktiven Blockcopolymerketten. Dies
entspricht auch den Anforderungen an die Synthese von Blockcopolymeren, wie sie von
lebenden Polymerisationen erfüllt werden.

3 Ergebnisse 83
TVe [ml]
M [g/mol]
ABA
Ve [ml]
M [g/mol]
B1
Ve [ml]
M [g/mol]
B2
Ve [ml]
M [g/mol]
TVe [ml]
M [g/mol]
TVe [ml]
M [g/mol]
ABA
Ve [ml]
M [g/mol]
ABA
Ve [ml]
M [g/mol]
B1
Ve [ml]
M [g/mol]
B1
Ve [ml]
M [g/mol]
B2
Ve [ml]
M [g/mol]
B2
Ve [ml]
M [g/mol]
Abb. 3.35. 2D-Chromatogramme der Blockcopolymeren PMMA-b-PS B1, B2, T und
PS-b-PMMA-PS (ABA). Die erste Dimension entspricht der LC-CC am kri-
tischen Punkt der Adsorption von PMMA, die zweite Dimension entspricht
der GPC.
Die aus der 2D-Chromatographie erhaltenen Gesamtmolekulargewichte (Mn,Block,2D) der
Blockcopolymeren A-PMMA-b-PS, PMMA-b-PS (B1), PMMA-b-PS (B2), PMMA-b-PS
(T) und PS-b-PMMA-b-PS (ABA) sind in Tab. 3.13 den aus den Umsätzen der Monomeren
berechneten Molekulargewichten (Mn,th,Block), den aus dem Molekulargewicht des PMMA-
Makroinitiators und aus dem NMR-Spektrum des Blockcopolymeren ermittelten Moleku-
largewichten (Mn,ber,Block) und den aus der GPC-Messung mit PMMA-Eichung erhaltenen
Werten (Mn,Block) gegenübergestellt.

3 Ergebnisse 84
Tab. 3.13. Ermittelte Molekulargewichte der Blockcopolymeren aus den Umsätzen der
Monomeren (Mn,th,Block), aus den NMR-Spektren und den Molekulargewich-
ten des Makroinitiators (Mn,ber,Block), durch GPC mit PMMA-Eichung
(Mn,Block) und aus der 2D-Chromatographie (Mn,Block,2D).
Polymeres Mn,th,Block
(g/mol)
(Umsatz)
Mn,ber,Block
(g/mol)
(Makroinitiator/
NMR)
Mn,Block
(g/mol)
(GPC)
Mn,Block,2D
(g/mol)
(2D)
A-PMMA-b-PS 37200 36250 40400 37400
PMMA-b-PS (B1) 20350 20470 22000 20600
PMMA-b-PS (B2) 14450 12350 19400 16400
PMMA-b-PS (T) 66400*) 55660 73800 68150
PS-b-PMMA-b-PS (ABA) 24320 25180 30400 26100 *) Bei 99% MMA-Umsatz
Die zuvor berechneten Molekulargewichte der Blockcopolymeren (Mn,th,Block und
Mn,ber,Block) stimmen deutlich besser mit den aus der 2D-Chromatographie ermittelten Ge-
samtmolekulargewichten der Blockcopolymeren (Mn,Block,2D) überein als mit den
Gesamtmolekulargewichten der GPC-Messung (Mn,Block), die mit PMMA-Standards
durchgeführt wurde, denn bei der Abschätzung der Molekulargewichte der chemisch
heterogenen Blockcopolymeren entsteht ein Fehler von 10 bis 15%.
Um das exakte Molekulargewicht der Blockcopolymeren und das der Teilblöcke zu erhal-
ten, muss die Trennung der Blockcopolymeren in den Koordinaten chemische Heterogeni-
tät und Molmasse durch Kopplung der LC-CC mit der GPC erfolgen. Eine gute Annähe-
rung der Molekulargewichte der Blockcopolymeren aus MMA und Styrol an die tatsächli-
chen Molekulargewichte kann über die berechneten Molekulargewichte erhalten werden,
die aus den Umsätzen der Monomeren und des eingesetzten Monomer/Initiator-
Verhältnisses resultieren. Eine Voraussetzung dafür ist, dass zuerst ein PMMA-
Makroinitiator mit hohem initiierungsfähigem Endgruppenanteil synthetisiert wird, der
dann im zweiten Schritt die ATRP von Styrol initiiert. Mit N,N,N’,N’’,N’’’,N’’’-
Hexamethyltriethylentetramin (HMTETA) bzw. 4,4’-Di-(5-nonyl)-2,2’-bipyridin (dNbpy)
in Verbindung mit Kupfer(I)-chlorid als Katalysator konnte dies bei der ATRP von MMA
in 50-proz. Lösung erreicht werden. So lassen sich lineare Blockcopolymere aus MMA
und Styrol über ATRP mit sehr enger Molekulargewichtsverteilung (<1,2) durch sequen-

3 Ergebnisse 85
tielle Monomeraddition erhalten, deren Molekulargewichte anhand des Monomer/Initiator-
Verhältnisses und des Umsatzes sehr gut einstellbar sind.
Polymere besitzen charakteristische Glasübergangstemperaturen, die vor allem von der
chemischen Zusammensetzung und der Struktur der Ketten abhängen. Bei statistischen
Copolymeren liegen die Glastemperaturen zwischen denen der aus den jeweiligen
Monomeren gebildeten Homopolymeren. Bei Mischungen von zwei Homopolymeren
(Blends) existieren die den Homopolymeren entsprechende Glastemperaturen
nebeneinander. Phasenseparierte Blockcopolymere verhalten sich in Bezug auf die
Glasübergangstemperatur wie Blends. Daher sollte in den hergestellten Blockcopolymeren
aus MMA und Styrol sowohl die Glastemperatur von PMMA als auch die von Polystyrol
rkennbar sein. e
Die Blockcopolymeren wurden mit Hilfe der DSC auf ihre Glastemperatur untersucht. Da-
bei wird in Abhängigkeit von der Temperatur der Wärmefluss der Probe gemessen. Die
Glasübergangstemperatur äußert sich dann in einer Stufe im DSC-Diagramm, weil beim
Glasübergang die spezifische Wärme zunimmt. Die Polymeren wurden zweimal von
Raumtemperatur auf 250°C mit einer Heizrate von 10 K/min erhitzt und dann mit flüssi-
gem Stickstoff abgekühlt. Weil bei der ersten Messung (erster Heizgang) die Glasstufe von
einem endothermer Relaxationspeak überlagert ist, der nach Lagerung der Polymeren un-
terhalb der Glastemperatur auftritt, wurde immer der zweite Heizgang zum Bestimmen der
Glastemperatur herangezogen. Im zweiten Heizgang der DSC-Messung des Blockcopoly-
meren A-PMMA-b-PS (Abb. 3.36) sind zwei Glasstufen erkennbar.
80 100 120 140 160
-0,56
-0,55
-0,54
-0,53
-0,52
-0,51
-0,50
x
x96°C
116°C
Wär
mef
luss
[W/g
]
Temperatur [°C]
Abb. 3.36. DSC-Diagramm mit den Glasstufen des Blockcopolymeren A-PMMA-b-PS.

3 Ergebnisse 86
Je nach Kettenlänge und Heizrate liegen die Glasübergangstemperaturen von Polystyrol
bei ca. 100°C und die von PMMA bei etwa 120°C. Die Glastemperatur des Blockcopoly-
meren A-PMMA-b-PS von 96°C kann somit dem Polystyrolblock und die bei 116°C dem
PMMA-Block zugeordnet werden. Die Glastemperaturen der mit der ATRP hergestellten
Blockcopolymeren aus MMA und Styrol sind in Tab. 3.14 aufgelistet; Tg,1 entspricht der
ersten und Tg,2 der zweiten Glasübergangstemperatur der Blockcopolymeren. Tg,1 liegt bei
den hergestellten Blockcopolymeren zwischen 83 und 106°C und kann den Polystyrolblö-
cken zugeordnet werden, Tg,2 liegt zwischen 112 und126°C und entspricht den Glastempe-
raturen der PMMA-Blöcke.
Tab. 3.14. Glastemperaturen der durch ATRP hergestellten Blockcopolymeren aus
MMA und Styrol.
Polymeres Tg,1[°C] Tg,2[°C]
A-PS-b-PMMA 87 112
A-PMMA-b-PS 96 116
PMMA-b-PS (B1) 95 126
PMMA-b-PS (B2) 96 118
PMMA-b-PS (T) 106 125
PS-b-PMMA-b-PS (ABA) 83 114
Die Tatsache, dass in den Blockcopolymeren zwei Glasübergangstemperaturen nachgewie-
sen werden konnten und diese in den für homopolymeres Polystyrol und PMMA üblichen
Bereichen liegen, weist auf separierte Polystyrol- und PMMA-Segmente in den durch
ATRP hergestellten Blockcopolymeren hin. Das Ziel, wohldefinierte lineare AB- und
ABA-Blockcopolymeren aus MMA und Styrol durch ATRP herzustellen, konnte somit
erreicht werden.

3 Ergebnisse 87
3.4 Sternblockcopolymere
Viele der heute technisch eingesetzten Kunststoffe bestehen nicht aus linearen Polymerket-
ten sondern besitzen Verzweigungen, z.B. durch Kettenübertragung. Polymere mit gezielt
eingestellten Verzweigungen sind z.B. Dendrimere, Stern- und Pfropfcopolymere. Die
Verzweigungen haben einen erheblichen Einfluss auf die Kristallisationsfähigkeit, die
Dichte und das Fließverhalten von Polymeren. Sternpolymere werden z.B. als Additive zur
Viskositätsverbesserung in Motorölen eingesetzt. Gelingt die Synthese von Sternblockco-
polymeren, so können die durch Verzweigungen erzielten Eigenschaften mit denen der
Blockcopolymeren kombiniert und noch gezielter auf das Anwendungsgebiet abgestimmt
werden.
In der vorliegenden Arbeit wurden Sternblockcopolymere aus MMA und Styrol durch
ATRP hergestellt. Zur Synthese wurden die in Abschnitt 3.2.3 beschriebenen mehrarmigen
Initiatoren eingesetzt.
3.4.1 Herstellung
Mit den in Abschnitt 3.2.3 beschriebenen mehrfunktionellen Initiatoren wird das Ketten-
wachstum bei der ATRP in mehrere Richtungen vom Initiator weg gestartet. Die Synthese
der dreiarmigen Blockcopolymeren wurde mit dem trifunktionellen Initiator 1,1,1-Tris(4-
(2-brom-2-methylpropanoyloxy)phenyl)ethan (TBiBPE) 17 durchgeführt. Für die Herstel-
lung von vierarmigen Blockcopolymeren wurde der tetrafunktionelle Initiator Tetrakis(2-
brom-2-methylpropanoyloxy)-2,2-dimethylpropan (PTBiB) 19 eingesetzt. Mit Tetrakis-
(2,2-bis((2-brom-2-methylpropanoyloxy)methyl)propanoyloxy)2,2-dimethylpropan
(8PBiB) 24 wurde die ATRP von MMA und anschließend von Styrol als zweitem Mono-
meren zum achtarmigen Sternblockcopolymeren gestartet. Mit Oligo((2-brom-2-methyl-
propionyloxy)-2-ethylmethacrylat) (OBEMA) 28 wurden Sternblockcopolymere herge-
stellt, die etwa 22 Arme enthalten. In allen erwähnten Fällen wurde zuerst MMA durch
ATRP in Ethylacetat-Lösung bei 60°C polymerisiert. Dazu wurde der Ligand
N,N,N’,N’’,N’’’,N’’’-Hexamethyltriethylentetramin (HMTETA) in Verbindung mit Kup-
fer(I)-chlorid als Katalysator eingesetzt. Die Polymerisation wurde bis zu einem maxima-
len MMA-Umsatz von 90% durchgeführt, um Abbruchreaktionen, die bei sehr hohen Um-
sätzen einen größeren Anteil an der Reaktion ausmachen, gering zu halten. Die nach der
Polymerisation isolierten Homopolymeren wurden dann als Makroinitiatoren für die ATRP
von Styrol mit Kupfer(I)-bromid in Verbindung mit N,N,N’,N’’,N’’-Penta-
methyldiethylentriamin (PMDETA) als Ligand eingesetzt. Die Polymerisation wurde bei

3 Ergebnisse 88
100°C bis zu Umsätzen zwischen 70 und 95% durchgeführt. Um den PMMA-
Makroinitiator vollständig zu lösen, wurde in 50-proz. Toluollösung polymerisiert. In
Schema 3.15 ist der sequentielle Ablauf der ATRP von MMA mit anschließender Zugabe
von Styrol zum vierarmigen Sternblockcopolymeren schematisch dargestellt.
X
X
X-R-X
X
X
X R X
X
X
X R X X R XS
+S
S
X
X
MMA
MMA MMA
Schema 3.15. Synthese der vierarmigen Sternblockcopolymeren aus MMA und Styrol.
Alle Polymere wurden in THF-Lösung über neutrales Aluminiumoxid filtriert, um den
Katalysator zu entfernen. Anschließend wurden sie in Methanol ausgefällt, abgesaugt und
bei 40°C im Vakuum getrocknet. In Tab. 3.15 sind die hergestellten mehrfunktionellen
Initiatoren für die ATRP von MMA in Ethylacetat bei 60°C mit HMTETA als Ligand zu
den mehrfunktionellen Makroinitiatoren, in Tab. 3.16 die zur ATRP des zweiten Monome-
ren (Styrol) in Toluol bei 100°C mit PMDETA als Ligand verwendeten Makroinitiatoren
zur Herstellung der Sternblockcopolymeren aufgelistet.
Tab. 3.15. Eingesetzte Initiatoren für die ATRP von MMA in Ethylacetat bei 60°C mit
HMTETA als Ligand zu den mehrfunktionellen Makroinitiatoren.
Initiatoren Makroinitiatoren
TBiBPE 17 3PMMA
PTBiB 19 4PMMA
8PBiB 24 8PMMA
OBEMA 28 22PMMA

3 Ergebnisse 89
Tab. 3.16. Eingesetzte Makroinitiatoren für die ATRP von Styrol in Toluol bei 100°C
mit PMDETA als Ligand zur Herstellung der Sternblockcopolymeren.
Makroinitiatoren Blockcopolymere
3PMMA 3PMMA-b-PS
4PMMA 4PMMA-b-PS
8PMMA 8PMMA-b-PS
22PMMA 22PMMA-b-PS
3.4.2 Charakterisierung
Die Molekulargewichte und die Molekulargewichtsverteilungen der Sternblockcopolyme-
ren wurden durch GPC mit THF als Eluent und linearen PMMA-Eichstandards bestimmt.
In Abb. 3.37 sind die GPC-Kurven während der Polymerisation von MMA bei 60°C in
Ethylacetat mit dem tetrafunktionellen Initiator PTBiB 19 bei 24%, 51%,58% und 78%
Umsatz dargestellt. Die Kurven sind monomodal, und die Molekulargewichte sind relativ
eng verteilt (< 1,4).
16 17 18 19 20 21 22 23 24 25
24% 51% 58% 78%
Elutionsvolumen [ml]
Abb. 3.37. GPC-Kurven der Polymerisation von MMA mit PTBiB 19 als Initiator.

3 Ergebnisse 90
Die mit dem trifunktionellen Initiator TBiBPE 17 und die mit dem 22armigem OBEMA 28
initiierten Polymerisationen von MMA verlaufen beide kontrolliert. Die Molekulargewich-
te wachsen linear mit dem Umsatz, und die Verteilungen sind eng.
Die GPC-Kurve des octafunktionellen Makroinitiators 8PMMA zeigt einen zweiten Peak
bei höherem Elutionsvolumen und eine leichte Schulter im hochmolekularen Bereich
(Abb. 3.39). Wie in Abschnitt 3.2.3 beschrieben, konnte das Nebenprodukt bei der Herstel-
lung des octafunktionellen Initiators Tetrakis(2,2-bis((2-brom-2-methylpropanoyloxy)-
methyl)propanoyloxy)2,2-dimethylpropan (8PBiB) 24 nicht entfernt werden. Deshalb
wurde dieser mit etwa 15% Verunreinigung des Derivates des Precursors 2,2-Bis((2-brom-
2-methylpropanoyloxy)methyl)propionsäure (BMPA 22) zur ATRP von MMA zum octa-
funktionellen Makroinitiator 8PMMA eingesetzt. Somit kann der zweite Peak mit höherem
Elutionsvolumen bei der GPC-Messung dem Polymeren zugeschrieben werden, das durch
Start von MMA mit dem im octafunktionellen Initiator enthaltenen Nebenprodukt entstan-
den ist. Das Derivat des BMPA 22 enthält der Charakterisierung aus Abschnitt 3.2.3 nach
zwei zur Initiation fähige Bromidgruppen. Setzt man ähnliche Initiationsgeschwindigkeiten
des BMPA-Derivates und des octafunktionellen Initiators 8PBiB 24 und somit auch ähnli-
che Polymerisationsgeschwindigkeiten der wachsenden Polymeren voraus, so sollte das
Molekulargewicht des Peaks bei hohem Elutionsvolumen etwa 25% des Molekularge-
wichts des Peaks bei niedrigem Elutionsvolumen betragen. Das anhand der GPC-Messung
mit linearen PMMA-Eichstandards ermittelte Molekulargewicht des Makroinitiators
8PMMA beträgt im Maximum der niedermolekularen Kurve 18000 g/mol, was etwa der
Hälfte des Molekulargewichts des im Hauptpeak liegenden Maximums entspricht. Somit
ergibt sich eine beträchtliche Abweichung der durch GPC-Messungen mit linearen
PMMA-Eichstandards ermittelten Werte von den aus den aus dem Initiator/Monomer-
Verhältnis ([M]0/[I]0) berechneten Molekulargewichten (Mn,th,PMMA, Tab. 3.17). Die kleine
Schulter im hochmolekularen Bereich des Elugramms des 8PMMA könnte auf Kopplung
zweier aktiven Radikale zurückzuführen sein. Dadurch entstehen Polymere mit hantelför-
miger Architektur, die etwa dem doppelten Molekulargewicht des eigentlichen Sternpoly-
meren entsprechen.
In Tab. 3.17 sind die Umsätze, die mit der GPC anhand linearer PMMA-Eichstandards
ermittelten Molekulargewichte und die Molekulargewichtsverteilungen der mit ATRP von
MMA mit mehrfunktionellen Initiatoren entstandenen Makroinitiatoren 3PMMA,
4PMMA, 8PMMA und 22PMMA aufgeführt. Die Molekulargewichte (Mn,PMMA) liegen
zwischen 24200 und 89200 g/mol und besitzen geringe Polydispersitäten (PDI < 1,4). Al-

3 Ergebnisse 91
lerdings stimmen sie nicht mit den aus Initiator/Monomer-Verhältnis ([M]0/[I]0) berechne-
ten Molekulargewichten (Mn,th,PMMA) überein. Der berechnete Wert des Molekulargewichts
von 3PMMA ist um 17% höher als der mit der GPC anhand linearer PMMA-Eichstandards
ermittelte; bei 4PMMA beträgt die Abweichung 18%, bei 8PMMA 56% und bei 22PMMA
sogar 136%. Die Differenzen der ermittelten und der berechneten Molekulargewichte wer-
den demnach umso größer, je mehr Arme die Sterne besitzen. Darauf wird später bei der
Charakterisierung der Sternblockcopolymeren näher eingegangen.
Tab. 3.17. MMA-Umsatz, eingesetzte Monomer/Initiator-Verhältnisse, theoretische und
mit der GPC gegen lineare PMMA-Eichstandards ermittelte Molekularge-
wichte (Mn,th,PMMA) der unter Verwendung von mehrfunktionellen Initiatoren
hergestellten PMMA-Sterne.
Polymeres t (min) p (%) [M]0/[I]0 Mn,PMMA
(g/mol)
Mn,th,PMMA
(g/mol) PDI
3PMMA 510 83 400 28400 33240 1,24
4PMMA 420 78 600 39800 46860 1,38
8PMMA 1230 47 800 24200 37650 1,69
22PMMA 1380 84 2500 89200 210250 1,42
Um Sternblockcopolymere aus MMA und Styrol herzustellen, wurden die in Tab. 3.17
aufgeführten sternförmigen PMMA-Makroinitiatoren für die ATRP von Styrol eingesetzt.
Dazu wurden die Makroinitiatoren in Toluol gelöst und anschließend der Katalysator und
Styrol zugegeben. So dauerte die Polymerisation von Styrol in Lösung zwischen 30 und 53
Stunden, um einen angestrebten Umsatz von 70 bis 95% zu erreichen. In Abb. 3.38 sind
die Elugramme der GPC-Messung der Sternblockcopolymeren 4PMMA-b-PS aus der
ATRP von Styrol mit 4PMMA als Makroinitiator bei 0%, 28% und 68% Umsatz zu sehen.
Man kann leicht erkennen, dass sich bei höheren Umsätzen eine Schulter bei höheren Mo-
lekulargewichten bildet. Bei 28% ist diese nur leicht, bei 68% Umsatz schließlich stark
ausgeprägt. Das gleiche Bild ergibt sich für die ATRP von Styrol zu 3PMMA-b-PS und
22PMMA-b-PS.

3 Ergebnisse 92
15 16 17 18 19 20 21 22
4PMMA 4PMMA-b-PS 28% 4PMMA-b-PS 68%
Elutionsvolumen [ml]
Abb. 3.38. GPC-Elugramme der Sternblockcopolymeren 4PMMA-b-PS bei der ATRP
von Styrol mit dem Makroinitiator 4PMMA bei 0%, 28% und 68% Umsatz.
Die Elugramme der GPC-Messung der Polymeren der ATRP von Styrol mit 8PMMA als
Makroinitiator zum achtarmigen Sternblockcopolymeren 8PMMA-b-PS sind sowohl bei
0% als auch bei 94% Umsatz bimodal (Abb. 3.39).
14 16 18 20 22
8PMMA 8PMMA-b-PS
Elutionsvolumen [ml]
Abb. 3.39. GPC-Elugramm des Makroinitiators 8PMMA und des damit durch ATRP
von Styrol synthetisierten Sternblockcopolymeren 8PMMA-b-PS bei 94%
Umsatz.

3 Ergebnisse 93
Wie zuvor erwähnt, kann der Peak im niedereren Molekulargewichtsbereich, d.h. bei höhe-
ren Elutionsvolumina, Polymeren zugeordnet werden, die durch Start mit der im achtarmi-
gen Initiator enthaltenen Verunreinigung mit zwei zur Initiation befähigten Bromidgruppen
entstanden sind. Im Elugramm des Makroinitiators 8PMMA überschneiden sich die beiden
Verteilungs-Kurven noch, während sie nach der Polymerisation von Styrol im Blockcopo-
lymeren 8PMMA-b-PS dann nahezu basislinien-getrennt voneinander vorliegen. Somit
wachsen sowohl die Ketten des niedermolekularen als auch die des höhermolekularen An-
teils des Makroinitiators.
Aus dem Umsatz der ATRP von Styrol mit den sternförmigen Makroinitiatoren zu den
Sternblockcopolymeren und den Monomer/Initiator-Verhältnissen kann das sich daraus
ergebende Molekulargewicht des Polystyrolblocks (Mn,th,PS) berechnet und das Molekular-
gewicht der Sternblockcopolymeren (Mn,th,Block) mit den berechneten Molekulargewichten
der Makroinitiatoren (Mn,th,PMMA) durch einfache Addition abgeschätzt werden (Tab. 3.18).
Bei lebenden Polymerisationen entspricht das durch das Monomer/Initiator-Verhältnis ein-
gestellte Molekulargewicht etwa dem tatsächlichen Molekulargewicht des Polymeren.
Tab. 3.18. Umsatz, Monomer/Initiator-Verhältnis und daraus berechnete Molekular-
gewichte des Styrolanteils (Mn,th,PS) und der Sternblockcopolymeren
(Mn,th,Block) bei der ATRP von Styrol mit den Makroinitiatoren 3PMMA,
4PMMA, 8PMMA und 22PMMA.
Polymeres t (min) p (%) [M]0/[I]0 Mn,th,PS
(g/mol) Mn,th,Block
(g/mol) 3PMMA-b-PS 1850 92 400 38270 71510
4PMMA-b-PS 1500 68 600 42430 89290
8PMMA-b-PS 2450 94 1000 97760 135410
22PMMA-b-PS 3180 71 2500 184600 394850
Wie in Abschnitt 3.3.2 beschrieben, können aus den 1H-NMR-Spektren der hergestellten
Sternblockcopolymeren aus den Integralen der Signale der Methoxyprotonen bei 3,6 ppm
und denen der Phenylprotonen bei 7,3-6,2 ppm die Massenanteile an MMA und Styrol in
den Sternblockcopolymeren bestimmt werden. Aus den mit der GPC anhand von linearen
PMMA-Eichstandards gemessenen Molekulargewichten der Makroinitiatoren (Mn,PMMA)
und den aus der 1H-NMR-Spektroskopie bestimmten Massenanteilen wurde ferner das

3 Ergebnisse 94
Molekulargewicht des Styrolblockanteils der Sternblockcopolymeren (Mn,PS,ber) bestimmt.
Mit den Molekulargewichten der Makroinitiatoren ergibt sich dann das Molekulargewicht
der Sternblockcopolymeren (Mn,Block,ber), das ebenfalls in Tab. 3.19 aufgelistet ist. Die aus
Umsatz und Monomer/Initiator-Verhältnis berechneten Molekulargewichte des Sty-
rolblocks (Mn,th,PS) (Tab. 3.18) sind im 3PMMA-b-PS um 24%, im 4PMMA-b-PS um 20%,
im 8PMMA-b-PS um 57% und im 4PMMA-b-PS schließlich sogar um 129% höher als die
Molekulargewichte (Mn,PS,ber), die aus den Massenanteilen und der durch GPC mittels line-
arer Standards ermittelten Molmasse der Makroinitiatoren berechnet wurden.
Tab. 3.19. Molekulargewichte der Sternblockcopolymeren (Mn,Block,ber) und des darin
enthaltenen Molekulargewichtes des Styrolblockanteils (Mn,PS,ber), berechnet
aus den aus der 1H-NMR-Spektroskopie ermittelten Massenanteilen an
MMA und Styrol und aus den durch GPC gemessenen Molekulargewichten
der Makroinitiatoren (Mn,PMMA).
Polymeres ΦMMA ΦStyrol Mn,PMMA
(g/mol) Mn,PS,ber
(g/mol)
Mn,Block,ber
(g/mol)
(NMR)
3PMMA-b-PS 0,48 0,52 28400 30770 59170
4PMMA-b-PS 0,53 0,47 39800 35290 75090
8PMMA-b-PS 0,28 0,72 24200 62230 86430
22PMMA-b-PS 0,52 0,47 89200 80620 169820
Die gemessenen und berechneten Molekulargewichte der Sternblockcopolymeren sind in
Tab. 3.20 nebeneinander aufgelistet. Man erkennt, dass die anhand von GPC-Messungen
mit linearen PMMA-Standards ermittelten Molekulargewichte der Sternblockcopolymeren
geringer sind als die aus den Umsätzen der Monomeren und den eingesetzten Mono-
mer/Initiator-Verhältnissen berechneten Werten.

3 Ergebnisse 95
Tab. 3.20. Molekulargewichte der Sternblockcopolymeren, berechnet aus Umsatz und
Monomer/Initiator-Verhältnis (Mn,th,Block), aus 1H-NMR-Spektroskopie
(Mn,Block,ber) und ermittelt durch GPC-Messung mit PMMA-Eichung
(Mn,Block).
Polymeres Mn,th,Block
(g/mol)
(Umsatz)
Mn,Block,ber
(g/mol)
(NMR)
Mn,Block
(g/mol)
(GPC)
3PMMA-b-PS 71510 59170 65200
4PMMA-b-PS 89290 75090 68900
8PMMA-b-PS 135410 86430 86600
22PMMA-b-PS 394850 169820 137400
Bei der Charakterisierung linearer Blockcopolymerer aus MMA und Styrol wurden deren
Molekulargewichte anhand der GPC-Messung mit linearen PMMA-Eichstandards über-
schätzt. Warum bei Sternblockcopolymeren die GPC-Messung mit PMMA-Standards zu
einer Unterschätzung des Molekulargewichts führt, kann darauf zurückzuführen sein, dass
das hydrodynamische Volumen, nach welchem die Trennung in der GPC erfolgt, nicht nur
von der Kettenlänge und der chemischen Zusammensetzung abhängt, sondern auch von der
Konformation der Makromoleküle. Daher können bei GPC-Messungen von Sternpolyme-
ren die Retentionsvolumina nicht mehr direkt mit linearen Polymerstandards verglichen
werden. Demnach wurden die Sternblockcopolymeren 3PMMA-b-PS und 4PMMA-b-PS
wegen ihrer chemischen Heterogenität wie die linearen Blockcopolymeren mit der 2D-
Chromatograpie untersucht. In Abb. 3.40 ist der Konturplot der 2D-Trennung des
Sternblockcopolymeren 4PMMA-b-PS zu sehen. In der ersten Dimension werden die Po-
lymeren durch Chromatographie am kritischen Punkt der Adsorption von PMMA (LC-CC)
nach der Molmasse des Polystyrolblocks getrennt. Die zweite Dimension entspricht der
GPC. Im Konturplot erkennt man neben dem Elutionsbereich 1 einen zweiten, weniger
intensiven Bereich 2. Peak 2 entspricht ungefähr der doppelten Molmasse des ersten Peaks.
Im 4PMMA-b-PS ist die Masse des zweiten Elutionsbereichs 2,4-mal so hoch. Peak 2 im
Konturplot entspricht dem Schulterbereich des Elugramms aus der GPC. Die Polymeren in
diesem Bereich können durch Kupplungsreaktion während der Endphase der Polymerisati-
on des Styrols bei hohen Umsätzen entstanden zu sein. Da im Bereich des kritischen Punk-
tes von PMMA (erste Dimension, 3,00 ml) kein Polymeres zu erkennen ist, enthalten die
Blockcopolymeren kein Homopolymethylmethacrylat. Somit starten alle zur Initiation fä-

3 Ergebnisse 96
higen Gruppen die Polymerisation von Styrol. Auch im Konturplot des 3PMMA-b-PS ist
kein PMMA-Makroinitiator zu erkennen.
Molmassenverteilungdes PS-Blocks
Molmassenverteilungdes Sternblockcopolymeren
Trennung nachMolmassenverteilungdes PS-Blocks
1
2
Ve [ml]
M [g/mol]
Abb. 3.40. Konturplot der 2D-Trennung des Sternblockcopolymeren 4PMMA-b-PS.
Erste Dimension: LC-CC am kritischen Punkt der Adsorption von PMMA,
zweite Dimension: GPC.
Damit lassen sich auch Sternblockcopolymere wie lineare Blockcopolymere aus MMA und
Styrol mit ATRP durch sequentielle Monomeraddition ohne Bildung von Homopolymerem
herstellen. Vergleicht man die aus der 2D-Chromatographie erhaltenen Molekulargewichte
(Mn,Block,2D) mit den aus der einfachen GPC-Messung erhaltenen Molekulargewichten der
Sternblockcopolymeren (Mn,Block) und den aus den Umsätzen berechneten Molekularge-
wichten (Mn,th,Block), so stellt man fest, dass die Molekulargewichte der GPC- und der 2D-
Messung etwa übereinstimmen (Tab. 3.21). Allerdings sind sie immer kleiner als die aus
den Umsätzen berechneten Werte (Mn,th,Block).

3 Ergebnisse 97
Tab. 3.21. Vergleich der durch GPC-Messungen (Mn,Block) und 2D-Messungen
(Mn,Block,2D) ermittelten Molekulargewichte der Sternblockcopolymeren mit
den aus den Umsätzen und Monomer/Initiator-Verhältnissen berechneten
Molekulargewichten der Sternblockcopolymeren (Mn,th,Block).
Polymeres Mn,th,Block
(g/mol)
(Umsatz)
Mn,Block
(g/mol)
(GPC)
Mn,Block,2D*)
(g/mol)
(2D)
3PMMA-b-PS 71510 65200 59730
1: 39400, 2: 80800
4PMMA-b-PS 89290 68900 71880
1: 64000, 2: 151700
8PMMA-b-PS 135410 86600 -
22PMMA-b-PS 394850 137400 - *) 1 und 2: Peakmaxima in Abb. 3.40
Da bei beiden verwendeten chromatographischen Trennverfahren (GPC und 2D-Chroma-
tographie) die Eichung anhand linearer Standards durchgeführt wird, kann es zu Abwei-
chungen der ermittelten Molekulargewichte der Sternblockcopolymeren kommen, denn die
für die Trennung maßgebliche Größe ist das hydrodynamische Volumen des gelösten Po-
lymerknäuels. Da verzweigte Polymere eine dichtere Struktur (Abb. 3.41) und demnach
bei gleichem realen Molekulargewicht ein geringes hydrodynamisches Volumen besitzen
als ihre linearen Homologen, werden sie bei der GPC bei größerem Volumen eluiert als
lineare Polymere mit gleichem Molekulargewicht.
Vh,linear > Vh,stern
Mlinear = Mstern
Abb. 3.41. Poren der stationären Phase mit linearem und sternförmigem Polymeren
gleicher Molmasse, aber verschiedenen hydrodynamischen Volumens.

3 Ergebnisse 98
Die Molmassen sternförmiger Polymerer werden daher bei der mit linearen Standardpoly-
meren geeichten GPC und 2D-Chromatographie unterschätzt. Zur exakten Molmassen-
bestimmung der Sternblockcopolymeren müssten sternförmige Eichstandards verwendet
werden. Da solche Standards nicht zur Verfügung stehen, müssen zur exakten Bestimmung
der Molmasse molekulargewichtssensitive Methoden wie die Lichtstreuung herangezogen
werden. Deshalb wurden die Molekulargewichte der sternförmigen Makroinitiatoren
3PMMA, 4PMMA, 8PMMA und 22PMMA und der Sternblockcopolymeren 3PMMA-b-
PS und 4PMMA-b-PS durch GPC anhand eines Lichtstreudetektors bestimmt. In Abb. 3.42
ist das Elugramm der GPC-Messung des dreiarmigen Sternblockcopolymeren 3PMMA-b-
PS dargestellt. Die gestrichelte Linie stellt die Brechungsindexdetektion (RI) und die
durchgezogene Linie die der Lichtstreudetektion (LS) dar. Während man im Chroma-
togramm mit RI-Signal nur eine Schulter im höhermolekularen Bereich erkennen kann, ist
im Chromatogramm mit LS-Signal diese so ausgeprägt, dass die Kurve bimodal erscheint.
Die Lichtstreuanalyse liefert ein Molekulargewicht von 61700 g/mol für das Peakmaxi-
mum des RI-Signals. Für das Peakmaximum des Lichtstreusignals wird ein Molekularge-
wicht von 130500 g/mol erhalten.
16 18 20 22 24
LS-signal RI-signal
Ve/ml
Abb. 3.42. RI- (....) und LS-Kurve (-) der GPC des dreiarmigen Sternblockcopolymeren
3PMMA-b-PS.
Somit entspricht die Molmasse des zweiten Signals etwa der doppelten des ersten Signals.
Dies deutet auf eine Kupplungsreaktion hin. Die Kombination zweier wachsender Sternpo-
lymerer über jeweils einem Arm liefert hantelförmige Polymere, wobei die Distanz zwi-

3 Ergebnisse 99
schen den beiden Verzweigungspunkten genau der doppelten Armlänge des Sternpolyme-
ren entspricht. Bei sehr hohen Umsätzen, d.h. nahe dem Ende der Polymerisation, ent-
spricht das Molekulargewicht des hantelförmigen Polymeren genau dem doppelten des
Sternpolymeren.
Der Verlauf der GPC-Messung mit Lichtstreudetektion des vierarmigen Sternblockcopo-
lymeren 4PMMA-b-PS entspricht dem des dreiarmigen. Auch bei dieser Polymerisation
entstanden durch Kupplungsreaktionen hantelförmige Blockcopolymere. Das Molekular-
gewicht des 4PMMA-b-PS beträgt 75800 g/mol, das des Kupplungsproduktes mit
129300 g/mol etwa das Doppelte. Abb. 3.43 zeigt die GPC-Messung mit RI- und LS-
Detektion des achtarmigen Sternblockcopolymeren 8PMMA-b-PS. Hierbei sind drei ver-
schiedene Peakmaxima zu erkennen. Die erhaltenen Molekulargewichte betragen 62300,
205000 und 378000 g/mol.
16 18 20 22 24
Ve/ml
LS-signal
RI-signal
Abb. 3.43. RI- (....) und LS-Kurve (-) der GPC des achtarmigen Sternblockcopolymeren
8PMMA-b-PS.
Das Molekulargewicht des ersten Peaks beträgt etwa ein Viertel des Molekulargewichts
des zweiten, das des dritten etwa das Doppelte des zweiten. Die in Abschnitt 3.2.3 be-
schriebene Synthese des octafunktionellen Initiators beinhaltet die Umsetzung der bifunk-
tionellen Verbindung 2,2-Bis((2-brom-2-methylpropanoyloxy)methyl)propionsäure mit
dem tetrafunktionellen Pentaerythrit. Ein Produkt dieser bifunktionellen Vorstufe konnte
nicht vom octafunktionellen Initiator abgetrennt werden. Daher ist es plausibel, den ersten
Peak (62300 g/mol) einem aus dieser Verunreinigung entstandenen Produkt zuzuschreiben.

3 Ergebnisse 100
Der zweite Peak mit 205000 g/mol entspricht dem Molekulargewicht des achtarmigen
Sternblockcopolymeren. Der dritte Peak mit etwa dem doppelten Molekulargewicht des
zweiten, der in der LS-Kurve zu sehen ist, kann auf eine Hantelstruktur zurückzuführen
sein.
In Tab. 3.22 sind die durch GPC mit PMMA-Eichung und mit LS-Detektion ermittelten
Molekulargewichte der sternförmigen Makroinitiatoren mit den aus den Umsätzen und
Monomer/Initiator-Verhältnissen berechneten Molekulargewichten der sternförmigen Po-
lymethylmethacrylate vergleichend aufgetragen. Eindeutig ist zu erkennen, dass die Mole-
kulargewichte der Sternpolymeren mit der GPC bei Eichung mit linearen PMMA-
Standards deutlich unterschätzt werden. Dagegen entsprechen die Molekulargewichte der
GPC-Messung mit Lichtstreudetektion den aus den Umsätzen und Monomer/Initiator-
Verhältnissen erwarteten Werten relativ gut.
Tab. 3.22. Vergleich der durch GPC mit PMMA-Eichung (Mn,PMMA) und mit LS-
Detektion (Mn,PMMA,LS) ermittelten Molekulargewichte der sternförmigen
PMMA mit den aus den Umsätzen und Monomer/Initiator-Verhältnissen be-
rechneten Molekulargewichten der sternförmigen PMMA (Mn,th,PMMA).
Polymeres [M]0/[I]0 Mn,th,PMMA
(g/mol) Mn,PMMA
(g/mol)
(GPC)
Mn,PMMA,LS
(g/mol)
(LS)
3PMMA 400 33240 28400 32600 (1,25)
4PMMA 600 46860 39800 44800 (1,42)
8PMMA 800 37650 24200 36090 (1,67)
22PMMA 2500 210250 89200 242000 (1,36)
In Tab. 3.23 sind die Molekulargewichte der Sternblockcopolymeren der GPC-Messungen
mit linearen PMMA-Eichstandards, der 2D-Messungen und der GPC-Messungen mit
Lichtstreudetektion den aus den Umsätzen und Monomer/Initiator-Verhältnissen berechne-
ten Molekulargewichten gegenübergestellt. Auch bei den Sternblockcopolymeren ent-
spricht das durch Lichtstreuung bestimmte Molekulargewicht relativ gut dem aus Umsatz
und Monomer/Initiator-Verhältnis erwarteten. Bei den Messungen mit linearen Eichstan-
dards wird das Molekulargewicht dagegen weit unterschätzt.

3 Ergebnisse 101
Tab. 3.23. Vergleich der durch GPC-Messungen mit PMMA-Eichung (Mn,Block), 2D-
Messungen (Mn,Block,2D) und GPC-Messungen mit LS-Detektion ermittelten
Molekulargewichte (Mn,Block,LS) mit den aus den Umsätzen und Mono-
mer/Initiator-Verhältnissen berechneten Molekulargewichten der Stern-
blockcopolymeren (Mn,th,Block).
Polymeres Mn,th,Block
(g/mol)
(Umsatz)
Mn,Block
(g/mol)
(GPC)
Mn,Block,2D1)
(g/mol)
(2D)
Mn,Block,LS2)
(g/mol)
(LS)
3PMMA-b-PS 71510 65200 59730
1: 39400, 2: 80800
74470 (PDI=1,42)
1: 61700, 2: 130500
4PMMA-b-PS 89290 68900 71880
1: 64000, 2: 151700
87400 (PDI=1,62)
1: 75800, 2: 129300
8PMMA-b-PS 135410 86600 - 132500 (PDI=1,73)
1: 62300, 2: 205000,
3: 378000
22PMMA-b-PS 394850 137400 - 397000 (PDI=1,46) 1) 1 und 2: Peakmaxima in Abb. 3.40 2) 1, 2 und 3: Peakmaxima in Abb. 3.42 bzw. Abb. 3.43
Eine Möglichkeit, die Molekulargewichte von Sternpolymeren mit GPC-Messungen an-
hand linearer Polymerstandards gut abschätzen zu können, wurde von Radke et al. [117,118]
beschrieben. Durch Simulation und deren Bestätigung durch experimentelle Befunde konn-
te gezeigt werden, dass die scheinbaren Molekulargewichte der Sternpolymeren Mapp aus
einer Eichung mit linearen Standards über einen konstanten Faktor γ mit den realen Mole-
kulargewichten der Sterne Mreal über Mreal = γ Mapp in Zusammenhang stehen. Der Faktor γ
ist lediglich von der Armzahl der Sternpolymeren abhängig (Abb. 3.44). Der Faktor γ wird
umso größer, je höher die Anzahl der Arme in den Sternpolymeren ist. Damit wird auch
die Abweichung der durch GPC-Messung mit linearen Eichstandards ermittelten Moleku-
largewichte von den realen Molekulargewichten der Sternpolymeren mit zunehmender
Armzahl größer.

3 Ergebnisse 102
5 10 15 2
1
2
3
0
γ sim
number of arms (f)
Abb. 3.44. Durch Simulation ermittelte Abhängigkeit des Faktors γ von der Armzahl
der Sternpolymeren.
In Tab. 3.24 sind die von Radke durch Simulation ermittelten Faktoren γsim der Armzahl
der Sternpolymeren den experimentell ermittelten Faktoren γexp gegenübergestellt.
Tab. 3.24. Berechnete Werte der Faktoren γexp aus den durch GPC-Messungen mit
linearen Eichstandards (Mn,Block) und durch Lichtstreudetektion ermittelten
Molekulargewichten (Mn,Block,LS) im Vergleich zu den aus der Simulation er-
haltenen Faktoren γsim der Sternpolymeren.
Polymeres Mn,Block
(g/mol)
(GPC)
Mn,Block,LS
(g/mol)
(LS)
γexp
(Mn,Block,LS /
Mn,Block)
γsim
3PMMA-b-PS 65200 74470 1,14 1,09
4PMMA-b-PS 68900 87400 1,26 1,20
8PMMA-b-PS 86600 132500 1,53 1,64
22PMMA-b-PS 137400 397000 2,88 2,79
Die aus GPC-Messungen unter Verwendung linearer Eichstandards und mit Lichtstreude-
tektion ermittelten Faktoren γexp der entsprechenden Sternblockcopolymeren stimmen sehr
gut mit den simulierten Faktoren γsim überein. Damit ist es möglich, bei Kenntnis der An-
zahl der Arme in den Sternpolymeren die Molekulargewichte auf einfache Weise zu

3 Ergebnisse 103
bestimmen. Durch Multiplikation des aus der GPC-Messung mit linearen Eichstandards
ermittelten Molekulargewichtes mit dem Faktor der jeweiligen Armzahl des Sternes kann
in sehr guter Näherung das reale Molekulargewicht des Sternpolymeren ermittelt werden.
Des Weiteren bestätigt die gute Übereinstimmung der berechneten und der experimentell
bestimmten Faktoren γ die Anzahl der Arme in den Sternpolymeren. Danach lassen sich
durch ATRP sternförmige Polymere mit definierter Armzahl aus den dafür eingesetzten
Initiatoren herstellen. Alle funktionellen Gruppen des Initiators starten das Wachstum der
Ketten. Darüber hinaus entspricht das reale Molekulargewicht der erhaltenen Polymeren
dem aus Umsatz der Monomeren und eingesetztem Monomer/Initiator-Verhältnis ange-
strebten Molekulargewicht. Allerdings kann es zur Kopplungen zweier aktiver Radikale
kommen, wenn man bis zu hohen Umsätzen (über 70%) polymerisiert. Um reine Sternpo-
lymere zu erhalten, sollte deshalb die ATRP mit mehrfunktionellen Initiatoren nur bis zu
maximal 70% Umsatz durchgeführt werden.
Wie bei linearen Blockcopolymeren sollten auch bei den Sternblockcopolymeren aus
MMA und Styrol sowohl die Glastemperatur von PMMA als auch die von Polystyrol er-
kennbar sein. Daher wurden die Sternblockcopolymeren mit Hilfe der DSC auf ihre Glas-
temperatur untersucht. Die Polymeren wurden zweimal von Raumtemperatur auf 250°C
mit einer Heizrate von 10 K/min erhitzt und dann sofort mit flüssigem Stickstoff abge-
kühlt. Weil bei der ersten Messung (erster Heizgang) die Glasstufe von einem endothermer
Relaxationspeak überlagert ist, der nach Lagerung der Polymeren unterhalb der Glastem-
peratur auftritt, wurde immer der zweite Heizgang zum Bestimmen der Glastemperatur
herangezogen. Es wurden stets zwei Glasstufen registriert. Je nach Kettenlänge und Heiz-
rate liegen die Glasübergangstemperaturen von Polystyrol bei ca. 100°C und die von
PMMA bei etwa 120°C. Die Glastemperatur des Sternblockcopolymeren 3PMMA-b-PS
bei 97°C kann somit dem Polystyrolblock und die bei 124°C dem PMMA-Block zugeord-
net werden. Die Glastemperaturen der mit der ATRP hergestellten Sternblockcopolymeren
aus MMA und Styrol sind in Tab. 3.25 aufgelistet; Tg,1 entspricht der ersten und Tg,2 der
zweiten Glasübergangstemperatur der Sternblockcopolymeren. Tg,1 liegt bei den hergestell-
ten Sternblockcopolymeren zwischen 93 und 97°C und kann den Polystyrolblöcken zuge-
ordnet werden, Tg,2 liegt zwischen 109 und 124°C, was den Glastemperaturen der PMMA-
Blöcke entspricht.

3 Ergebnisse 104
Tab. 3.25. Glastemperaturen der mit ATRP hergestellten Sternblockcopolymeren aus
MMA und Styrol.
Polymeres Tg,1[°C] Tg,2[°C]
3PMMA-b-PS 97 124
4PMMA-b-PS 96 118
8PMMA-b-PS 95 109
22PMMA-b-PS 93 112
Die Tatsache, dass in den Sternblockcopolymeren zwei Glasübergangstemperaturen nach-
gewiesen werden konnten und diese in den für homopolymeres Polystyrol und PMMA
erwarteten Bereichen liegen, weist auf separierte Polystyrol- und PMMA-Segmente in den
hergestellten Sternblockcopolymeren hin.
Damit konnten Sternblockcopolymere aus MMA und Styrol durch ATRP mit mehrfunkti-
onellen Initiatoren hergestellt werden. Die Anzahl der Arme entspricht den zur Initiation
fähigen funktionellen Gruppen in den verwendeten Initiatoren. Mit den eingesetzten Mo-
nomer/Initiator-Verhältnissen lassen sich die Molmassen und die Zusammensetzungen der
Sternblockcopolymeren gezielt einstellen.

3 Ergebnisse 105
3.5 Gradientencopolymere
Blockcopolymere bestehen aus Sequenzen von Homopolymeren. Zwischen den Sequenzen
existiert ein scharfer Übergang vom Monomerbaustein A zum Monomerbaustein B. Bei
Taperedcopolymeren dagegen ist der Übergang vom Monomeren A zum Monomeren B
weniger scharf. Im Übergangsbereich zwischen den Blöcken existiert eine statistische Ver-
teilung der Monomeren A und B. Bei Gradientencopolymeren sind die beiden Blocklängen
aus den Monomeren A und B an den Kettenenden in der Regel wesentlich kürzer als der
Bereich des fließenden Übergangs vom Monomeren A zum Monomeren B (Abb. 3.45).
A
A A / B
A / B
Gradientencopolymeres
Taperedcopolymeres
Blockcopolymeres
A
B
B B
Abb. 3.45. Vergleich der Struktur von Gradienten-, Tapered- und Blockcopolymeren.
Neben Blockcopolymeren können auch statistische, Tapered- und Gradientencopolymere
als Verträglichkeitsvermittler für Blends verwendet werden. Beim fließenden Übergang
vom Monomeren A nach B, wie dies bei Gradientencopolymeren gegeben ist, sollten diese
sich in die Grenzfläche zwischen den Polymeren P(A) und P(B) einlagern können. Sie fin-
den weiterhin Anwendung in Klebstoffen oder als Dispersionen. Die Einsatzgebiete sind
von den makroskopischen Eigenschaften der Polymeren wie Glastemperatur, Modul und
Phasenverhalten und damit von der Molekülarchitektur abhängig. Für Blends aus den Ho-
mopolymeren PMMA und Polystyrol sollten sich daher auch Gradientencopolymere eig-
nen, die aus MMA und Styrol aufgebaut sind. In dieser Arbeit wurde untersucht, ob sich
diese durch ATRP von MMA und Styrol mit gezielter Zusammensetzungsverteilung her-
stellen lassen. Die Zusammensetzung der Kette wurde durch Variation der Monomerzu-
sammensetzung und -zugabe eingestellt.

3 Ergebnisse 106
3.5.1 Herstellung
Aufgrund der bei der ATRP viel höheren Reaktivität des MMA im Vergleich zu Styrol,
wodurch MMA schneller als Styrol polymerisiert werden kann, würden bei gleichzeitiger
Zugabe beider Monomerer zu Beginn der ATRP Polymere entstehen, die hauptsächlich
MMA enthalten, jedoch kaum Segmente mit mehreren aufeinander folgenden Styroleinhei-
ten. Deshalb wurde zur Herstellung der Gradientencopolymeren aus MMA und Styrol in
einem erstem Schritt Styrol im Fall von Versuch R1 und G1 eine halbe Stunde, im Fall von
Versuch R2 und G2 eine Stunde vorpolymerisiert. Dann wurde dem Polymerisationsge-
misch MMA in einem Zeitraum von einer Stunde (R1 und G1) bzw. zwei Stunden (R2 und
G2) zudosiert, welches sich so nach und nach neben Styrol in die wachsende Polymerkette
einbauen sollte. Aufgrund der stetig abnehmenden Konzentration an Styrol sollte sich
schließlich fast ausschließlich MMA am Ende der Polymerkette anlagern (Schema 3.16).
S S+
PS PS S-t-MMA PS S-t-MMA
MMA
PMMA
Schema 3.16. Synthese von Gradientencopolymeren aus MMA und Styrol.
PS: Polystyrolblock; PMMA: Polymethylmethacrylatblock; S-t-MMA:
Bereich des fließenden Übergangs von Styrol nach MMA.
Die Polymerisationen wurden mit dem für Styrol und für MMA günstigen Katalysatorsys-
tem aus Kupfer(I)-bromid in Verbindung mit den Liganden 2,2’-Bypyridin (bpy) bzw.
4,4’-Di-(5-nonyl)-2,2’-bipyridin (dNbpy) bei 100°C bis zu etwa 80% Styrol-Umsatz inner-
halb einer Gesamtreaktionsdauer von 3 Stunden (R1 und G2) bzw. 5 Stunden (R2 und G2)
durchgeführt. Das eingesetzte Verhältnis von Styrol zu MMA betrug in allen Fällen 1/1.
Die für die ATRP von MMA notwendige Verdünnung des Systems und somit die Vermin-
derung der Reaktivität von MMA wurde durch den Anteil an Monomerem Styrol im Po-
lymerisationsgemisch erzielt. Auf diese Weise wurden die Gradientencopolymeren R1, R2,
G1 und G2 hergestellt. Die Herstellung des Copolymeren T wurde schon bei den linearen
Blockcopolymeren (Abschnitt 3.3) beschrieben. Dafür wurde zuerst MMA zum Makroini-
tiator durch ATRP polymerisiert und nach 80% MMA-Umsatz Styrol zugegeben, um den
zweiten Block zu bilden. Dabei entsteht durch Polymerisation des im Gemisch enthaltenen
Restes an MMA ein kurzer fließender Übergang, bis alles MMA verbraucht ist und nur
noch Styrol zum zweiten Block polymerisiert wird (Taperedblockcopolymeres).

3 Ergebnisse 107
3.5.2 Charakterisierung
Die Molekulargewichte der Polymeren wurden mit der GPC bestimmt. Aus der GPC der
Polymerproben, die vor Zudosieren des MMA untersucht wurden, konnte das Molekular-
gewicht des reinen Polystyrolblocks, der zu Beginn der Polymerisation gebildet wird, er-
mittelt werden. Die Bestimmung des Molekulargewichts des reinen PMMA-Blocks ist
allerdings komplizierter, da dieser nicht wie der „Polystyrolmakroinitiator“ vor dem Zudo-
sieren des MMA zur Verfügung steht, sondern nur das Gesamtmolekulargewicht des Gra-
dientencopolymeren bestimmt werden kann. Daher wurde zur Molekulargewichts-
abschätzung der Blockanteile die 1H-NMR-Spektroskopie herangezogen. In Abb. 3.46 ist
das 1H-NMR-Spektrum eines Blockcopolymeren und das eines Gradientencopolymeren
dargestellt.
0.00.00.50.51.01.01.51.52.02.02.52.53.03.03.53.54.04.04.54.55.05.05.55.56.06.06.56.57.07.07.57.5
Styrol Styrol / MMA
Gradientencopolymeres
Blockcopolymeres
Styrol
MMA
MMA
PMMA-Block
Abb. 3.46. 1H-NMR-Spektrum eines Blockcopolymeren und eines Gradientencopoly-
meren aus MMA und Styrol in CDCl3 bei Raumtemperatur.
Man erkennt, dass das scharfe Signal bei 3,6 ppm im Spektrum des Blockcopolymeren, das
von den Methoxyprotonen der MMA-Bausteine stammt, im Gradientencopolymeren we-
sentlich verbreitert ist und mehrere Maxima besitzt. Der Bereich des Signals der Metho-

3 Ergebnisse 108
xyprotonen erstreckt sich von 3,7 bis 2,1 ppm. Dies kommt durch die unterschiedliche
Nachbarschaft der Methoxyprotonen zustande, da sie von Aromatenprotonen des Styrol-
restes aber auch von Methoxyprotonen des MMA-Bausteins umgeben sein können. Außer-
dem haben nicht nur die Protonen in direkter Nachbarschaft über Dipol-Dipol-
Wechselwirkung einen Einfluss auf die chemische Verschiebung der Methoxyprotonen,
sondern auch die Protonen der nächsten Monomereinheiten. Aerdts et al.[119] gelang eine
Unterscheidung und Zuordnung von Methoxyprotonen im Bereich von 3,7 bis 2,1 ppm mit
beiden direkten Nachbarn (MMA-zentrierte Triaden) und mit den darauf folgenden Nach-
barn (MMA-zentrierte Pentaden). Die Methoxyprotonen, die von vier MMA-Resten um-
geben sind (MMMMM-Pentade) treten bei einer chemischen Verschiebung von 3,7 bis
3,4 ppm auf. Unter der Annahme, dass der Peak der Methoxyprotonen der MMM-Triaden
bzw. MMMMM-Pentaden bei 3,7 bis 3,4 ppm nur dem PMMA-Block, der am Ende der
Polymerisation entsteht, zuzuordnen ist, kann das Molekulargewicht des PMMA-Blocks
abgeschätzt werden:
53
326471273
1273
,,PS
,,PMMA
,,PMMA
II
I
ges,nMMAges,nPMMA,n MMM −−
−
+⋅=⋅= Φ
: Molekulargewicht des PMMA-Blocks PMMA,nM
ges,nM : Molekulargewicht des Blockcopolymeren
MMAΦ : Massenanteil an MMA im Polymeren
: Intensität der Absorption der Methoxyprotonen im 1273 ,,PMMAI − 1H-NMR-
Spektrum bei d=3,7-2,1 ppm
: Intensität der Absorption der Phenylprotonen im 2647 ,,PSI − 1H-NMR-
Spektrum bei d=7,4-6,2 ppm
Um den Massenanteil an MMA bzw. Styrol im Gradientencopolymeren zu ermitteln, wur-
den aus den 1H-NMR-Spektren die Intensitäten der Signale der Methoxyprotonen bei 3,7
bis 2,1 ppm mit denen der Phenylprotonen bei 7,4 bis 6,2 ppm verglichen. In Tab. 3.26
sind die Molekulargewichte der Gradientencopolymeren R1, R2, G1, G2 und T, der Mas-
senanteil an MMA in den Polymeren, die mit der GPC ermittelten Molekulargewichte der
PS-Blöcke und die aus den 1H-NMR-Spektren abgeschätzten Molekulargewichte der

3 Ergebnisse 109
PMMA-Endblöcke aufgeführt. Es ist ersichtlich, dass die Massenanteile der PS-Blöcke
und der PMMA-Endblöcke der erhaltenen Polymeren etwa gleich groß sind und etwa 15-
20% des Gesamtmolekulargewichts betragen, so dass der Anteil der Molmasse des Über-
gangsbereichs von Styrol zu MMA bei etwa 60-70% liegt.
Tab. 3.26. Molekulargewichte (Mn,exp) und –verteilungen der Gradientencopolymeren,
Massenanteil an MMA im Polymeren und mit der GPC ermittelte Moleku-
largewichte des PS- (Mn,S) und daraus berechnete Molekulargewichte der
PMMA-Blöcke (Mn,MMA,ber).
Polymeres Mn,exp
[g/mol]
PDI ΦMMA Mn,S
[g/mol]
Mn,MMA,ber
[g/mol]
R1 8500 1,31 0,40 1020 1090
R2 5300 1,42 0,42 900 730
G1 4200 1,28 0,48 430 650
G2 7800 1,25 0,45 1900 1160
Ta) 33000 1,21 0,56 <22300b) 10700c)
a) Synthese: 1. MMA bis 80% Umsatz polymerisiert, 2. ohne Isolierungsschritt Styrol polymerisiert. b) Nicht exakt bestimmbar, Mn,S < Mn,exp - Mn,MMA,ber c) Berechneter Wert entspricht GPC-Messung vor Zugabe von Styrol
Versucht man den Bereich des fließenden Übergangs zwischen reinen aufeinander folgen-
den Styroleinheiten und reinen aufeinander folgenden MMA-Einheiten in den Gradienten-
copolymeren aufzuklären, so müssen neben den MMM-Triaden bzw. MMMMM-
Pentaden, deren Signale wie im Blockcopolymeren bei 3,6 ppm erscheinen, auch die sty-
rolhaltigen Triaden und Pentaden in Betracht gezogen werden. Die SMMMM-Pentaden
und die SMMMS-Pentaden sind durch den abschirmenden Effekt des aromatischen Rings
im Styrol im Vergleich zur MMM-Triade leicht hochfeld-verschoben und absorbieren im
Bereich von 3,6 bis 3,4 ppm. MMS-Triaden werden zwischen 3,4 und 2,78 ppm detektiert,
wobei wiederum zwischen SSMMM- und SSMMS-Pentaden bei 3,4 bis 3,0 ppm und
MSMMM- und MSMMS-Pentaden bei 3,0 bis 2,78 ppm unterschieden werden kann.
Schließlich sind SMS-Triaden im Bereich von 2,78 bis 2,1 ppm zu finden. In Abb. 3.47 ist
der Bereich der Methoxyprotonen der Gradientencopolymeren G1, G2 und T und des
Blockcopolymeren A-PMMA-b-PS dargestellt; in Tab. 3.27 sind die Massenanteile der
entsprechenden MMA-zentrierten Pentaden und Triaden am Gesamtgehalt an MMA im
Polymeren aufgelistet.

3 Ergebnisse 110
MMM MMS SMSTriaden
PentadenMMMMMMMMMSSMMMS
SSMMMSSMMS
MSMMMMSMMS
Block
T
G 1
2.202.402.602.803.003.203.403.60
Block
T
G 1
2.202.402.602.803.003.203.403.60 2.202.402.602.803.003.203.403.60
G 2G 2
Abb. 3.47. Überlagerte 1H-NMR-Spektren im Bereich der Methoxyprotonen der Gra-
dientencopolymeren G1, G2 und T und des Blockcopolymeren A-PMMA-b-
PS in CDCl3 bei Raumtemperatur.
Tab. 3.27. Massenanteile der unterschiedlichen MMA-zentrierten Pentaden und der
SMS-Triade in den Gradientenpolymeren.
Polymeres ΦMMA Φ
MMMMM
MMMMS
SMMMS
Φ
SSMMM
SSMMS
Φ
MSMMM
MSMMS
Φ
SMS
R1 0,40 0,318 0,131 0,280 0,271
R2 0,42 0,326 0,145 0,288 0,241
G1 0,48 0,323 0,152 0,281 0,246
G2 0,45 0,331 0,132 0,277 0,260
T 0,56 0,580 0,109 0,094 0,217
Aus den Massenanteilen der MMA-zentrierten Pentaden und Triaden der Gradientencopo-
lymeren ist ersichtlich, dass diese jeweils etwa gleich bleiben, unabhängig davon, in wel-
chem Zeitraum Styrol vorpolymerisiert bzw. MMA zudosiert wurde. Eine Ausnahme stellt
das Copolymere T dar, das allerdings über den oben beschriebenen und von R1, R2, G1

3 Ergebnisse 111
und G2 abweichenden Syntheseweg hergestellt wurde. Der Anteil der MMA-reichen Pen-
taden im Bereich von 3,7 bis 3,4 ppm ist in diesem Polymeren sehr hoch (0,58), weil es nur
einen sehr kurzen Übergangsbereich zwischen den beiden Homopolymerblöcken besitzt.
Der Anteil der MMMMM-, MMMMS- und SMMMS-Pentaden liegt bei den Gradienten-
copolymeren R1, R2, G1 und G2 bei etwa 0,3, der Anteil der SSMMM- und der SSMMS-
Pentaden bei ca. 0,14, der der MSMMM- und MSMMS-Pentaden bei 0,28 und der Anteil
der SMS-Triaden bei etwa 0,25.
Eine Zuordnung der Sequenzen gelingt im Bereich von 3,5 bis 2,5 ppm auch mit der 2D-
NOESY NMR-Spektroskopie. Mit Hilfe der NOESY NMR-Spektroskopie können Wech-
selwirkungen benachbarter Styrol und MMA-Einheiten aufgedeckt werden. Im 2D Spekt-
rum erscheint entlang der ersten und der zweiten Dimension und entlang der Diagonalen
das eindimensionale Spektrum der Polymeren. Protonen, die miteinander in Wechselwir-
kung treten, erscheinen in einem Kreuzpeak. Für die Methoxyprotonen im Bereich von 3,5
bis 2,5 ppm ergeben sich drei verschiedene Kreuzpeaks unterschiedlicher chemischer Ver-
schiebungen, die durch die Phenylringe in nächster Umgebung ausgelöst werden. In Abb.
3.48 ist beispielhaft das 2D-NOESY NMR-Spektrum des Gradientencopolymeren G2
dargestellt.
Abb. 3.48. 2D-NOESY NMR-Spektrum des Gradientencopolymeren 2 in CDCl3 bei
Raumtemperatur.

3 Ergebnisse 112
Der Ausschnitt im Bereich von 3,5 bis 2,0 ppm ist in Abb. 3.49 für G1, G2, T und das
Blockcopolymere A-PMMA-b-PS vergrößert abgebildet. Kreuzpeak 1 kann den Pentaden
SSMMS, Peak 2 SSMMM und Kreuzpeak 3 MSMMM und MSMMS zugeordnet werden.
Im Vergleich zu G1 und G2 sind diese im Copolymeren T nur schwach zu erkennen, da sie
gegenüber der MMMMM-Pentade aufgrund des kurzen fließenden Übergangs in der Po-
lymerkette weniger Massenanteile besitzen. Im Blockcopolymeren, welches einen scharfen
Übergang der MMA-Sequenzen in die Styrol-Sequenzen besitzt, sind sie wie zu erwarten
überhaupt nicht vorhanden.
3.5 3.0 2.5 2.0ppm
6.5
7.0
7.5
ppm
3.5 3.0 2.5 2.0ppm
6.5
7.0
7.5
ppm
3.5 3.0 2.5 2.0ppm
7.0
ppm
3.0 2.5 2.0 1.5ppm
6.5
7.0
7.5
pp
m
G 1 G 2
T Block
12 3
12 3
1 2 3
3.5 3.0 2.5 2.0ppm
6.5
7.0
7.5
ppm
3.5 3.0 2.5 2.0ppm
6.5
7.0
7.5
ppm
3.5 3.0 2.5 2.0ppm
7.0
ppm
3.0 2.5 2.0 1.5ppm
6.5
7.0
7.5
pp
m
G 1 G 2
T Block
12 3
12 3
1 2 3
Abb. 3.49. Ausschnitt aus den 500 MHz 2D-NOESY NMR-Spektren im Bereich von 3,5
bis 2,0 ppm der Gradientencopolymeren G1 und G2, dem Copolymeren T
und des Blockcopolymeren A-PMMMA-b-PS in CDCl3 bei Raumtemperatur,
Peak: 1 = SSMMS, 2 = SSMMM, 3 = MSMMM, MSMMS.

3 Ergebnisse 113
Die thermischen Eigenschaften von Polymeren hängen von der chemischen Zusammenset-
zung und der Struktur der Ketten ab. Charakteristisch ist die Glasübergangstemperatur.
Phasenseparierte Blockcopolymere verhalten sich in Bezug auf die Glasübergangstempera-
tur wie Mischungen zweier Homopolymerer (Blends). Bei ihnen existieren die den Homo-
polymeren entsprechende Glastemperaturen nebeneinander. Statistische Copolymeren und
Gradientencopolymeren besitzen dagegen Glastemperaturen, die zwischen denen der aus
diesen Monomeren gebildeten Homopolymeren liegen. So sollte in den Gradientencopo-
lymeren aus MMA und Styrol eine Glastemperatur existieren, die zwischen der von reinem
PMMA (120°C) und der von Polystyrol (100°C) liegt. Daher wurden die Gradientencopo-
lymeren mit Hilfe der DSC auf ihre Glastemperatur untersucht. Die Glasübergangstempe-
ratur äußert sich in einer Stufe im DSC-Diagramm, weil beim Glasübergang die spezifi-
sche Wärme des Polymeren zunimmt. Die Polymeren wurden zweimal von Raumtempera-
tur auf 250°C mit einer Heizrate von 10 K/min erhitzt und mit flüssigem Stickstoff abge-
kühlt. Weil bei der ersten Messung (erster Heizgang) die Glasstufe von einem endothermer
Relaxationspeak überlagert ist, der nach Lagerung der Polymeren unterhalb der Glastem-
peratur auftritt, wurde die Glasstufe, die im zweiten Heizgang der DSC-Messung auftritt,
zur Charakterisierung der Gradientencopolymeren herangezogen (Abb. 3.50).
50 100 150 200
-0,40
-0,35
-0,30
-0,25
Wär
mef
luss
[W/g
]
Temperatur [°C]
Tg=113°Cx
Abb. 3.50. Zweiter Heizgang (HR=1 K/min) der DSC-Messung des Gradientencopoly-
meren G2 mit der Glasstufe bei 113°C.
Die Glastemperaturen der mit der ATRP hergestellten Gradientencopolymeren R1, R2, G1,
G2 und T aus MMA und Styrol sind in Tab. 3.28 aufgelistet.

3 Ergebnisse 114
Tab. 3.28. Glastemperaturen der Gradientencopolymeren R1, R2, G1, G2 und T,
gemessen bei einer Heizrate von 10 K/min.
Polymeres Tg,1[°C] Tg,2[°C]
R1 113 -
R2 110 -
G1 115 -
G2 113 -
T 106 125
Bei den Copolymeren R1, R2, G1 und G2 ist den Erwartungen gemäß nur ein Glasüber-
gang zu beobachten, der zwischen 110 und 115°C liegt. Die Mischglasstufe liegt demnach
genau zwischen der der Homopolymeren PMMA und Polystyrol. In diesen Polymeren ü-
berwiegt der Anteil des Gradienten gegenüber den Endblöcken. Im Copolymeren T sind
dagegen zwei Glasstufen zu erkennen. Die Glastemperatur bei 106°C entspricht dem Po-
lystyrol-Block, die bei 125°C dem PMMA-Block. Der Gradient zwischen den beiden Blö-
cken aus MMA und Styrol ist hier so kurz, dass keine Mischglasstufe zu erkennen ist.

3 Ergebnisse 115
3.6 Pfropfcopolymere
Wie Blockcopolymere und Gradientencopolymere finden auch Pfropfcopolymere breite
Anwendung zum Kompatibilisieren und Schlagzähmodifizieren von Blends aus nicht
mischbaren Homopolymeren. Des Weiteren können sie als Additive zur Viskositätsverbes-
serung in Motorölen verwenden werden. Als thermoplastische Elastomere werden sie oft-
mals auch in reiner Form eingesetzt. Sie sind preiswert und in großer Vielfalt herstell-
bar[120]. Aus verfügbaren und bewährten Kunststoffen können durch Pfropfen, gegebenen-
falls nach Modifizierung, viele neue Werkstoffe gestaltet werden. Eine Möglichkeit zum
Herstellen solcher Pfropfcopolymerer stellt die reaktive Extrusion (REX) dar. Mit ihr kön-
nen chemische Reaktionen wie Modifizierung von Kunststoffen aus funktionalisierten Po-
lymeren mit Schmelzprozessen gekoppelt werden.
In der vorliegenden Arbeit sollte geprüft werden, ob sich durch ATRP von MMA bzw.
Styrol hergestelltes PMMA und Polystyrol, welches anschließend an den Endgruppen mo-
difiziert wurde, für Pfropfreaktionen in der Schmelze eignet. Für die Pfropfung wurde das
in Schema 3.17 gezeigte Vorgehen gewählt.
Grenzfläche
Polymer-rückgrat
Pfropfast
Pfropfcopolymeres
∆
N
NNN+ -
Schema 3.17. Schema der Pfropfreaktion von azidterminierten Pfropfästen mit Doppel-
bindungen enthaltenden Polymeren.
Dazu wurden Doppelbindungen enthaltende Polymere mit den hergestellten und an den
Endgruppen modifizierten PMMA- und Polystyrol-Seitenästen in der Schmelze nach dem

3 Ergebnisse 116
Grafting-onto-Prozess (Abschnitt 2.5.1) zur Reaktion gebracht. Die Halogenidendgruppen
der Seitenäste wurden zuvor durch Azidgruppen substituiert.
Grundlage dieses Vorgehens ist das von niedermolekularen Azidverbindungen bekannte
Verhalten gegenüber ungesättigten Verbindungen. Das Azid zerfällt bei thermischer Ein-
wirkung oder mit Licht durch Abspaltung von molekularem Stickstoff zum Nitren, welches
aufgrund des Elektronenmangels äußerst reaktionsfähig ist. Je nach vorhandenem Reakti-
onspartner lassen sich Azoverbindungen, Amine und mit ungesättigten Verbindungen Azi-
ridine herstellen (Schema 3.18).
Reaktionsmöglichkeiten des Nitrens
Thermisch oder photochemisch induzierter Zerfall des Azids
R Rhν
∆ oder+
Azid Nitren Stickstoff
Azoverbindung
Amin Stickstoffradikal
Aziridin
R
R
H C
R´
R´´´R´´
RRC
R´
R´´´R´´R
H
R´
R´´´R´´R
H
R
+ + +
+
N N N N+-
.. N2
N
N
NNN CN
N
.
..
. .
.
Schema 3.18. Thermisch oder photochemisch induzierter Zerfall des Azids zum Nitren und
dessen Reaktionen.
Zu prüfen war, ob sich die Reaktion mit Olefinen auch auf Polymere übertragen lässt. Für
die polymeranaloge Umsetzung von azidterminierten Polymeren mit Doppelbindungen von
Rückgratpolymeren sind folgende Rahmenbedingungen zu beachten:
Zum Herstellen von Pfropfcopolymeren ist eine hohe Pfropfausbeute erforderlich, da mög-
lichst reines Pfropfcopolymeres als Endprodukt erhalten werden soll. Dies bedeutet, dass
kein homopolymeres azidterminiertes Seitenastpolymeres und kein ungepfropftes Rück-
gratpolymeres im Endprodukt verbleiben dürfen und alle Azidgruppen mit vorhandenen
Doppelbindungen über Aziridingruppen verknüpft sein müssen. Ein Überschuss an Nitren
führt zur Bildung von Azoverbindungen durch Kupplung zweier Nitrene. Daher darf die

3 Ergebnisse 117
Konzentration an Nitren nur so groß sein, dass diese Nebenreaktion weitgehend
ausgeschlossen werden kann. Zum einen muss daher gewährleistet sein, dass die zur
Reaktion eingesetzten Polymeren, Seitenast- und Rückgratpolymeres, optimal durchmischt
werden. Bei chemisch ähnlichen Polymeren ist dies einfach realisierbar. Durch Lösen in
geeigneten Lösungsmitteln und anschließendes Fällen bzw. Abdampfen des
Lösungsmittels können gut gemischte Edukte erhalten werden. Bei chemisch heterogenen
Polymeren führt das Abdampfen des Lösungsmittels wieder zur Entmischung. Auch in der
Schmelze tritt bei chemisch heterogenen Polymeren Phasenseparation auf, so dass die
Reaktion der beiden Polymeren nur an der Phasengrenzfläche stattfinden kann. Daher ist
ein intensives Mischen unabdingbar, um zwischen den Phasen der azidterminierten Seiten-
kettenpolymeren und den Rückgratpolymeren einen optimalen Kontakt der reaktiven Zent-
ren zu erreichen. Im Doppelschneckenextruder kann dies gewährleistet werden. Des
Weiteren hat die Reaktionstemperatur beim thermischen Zerfall des Azids zum Nitren
einen Einfluss auf die Konzentration des entstehenden Nitrens. Deshalb muss die
polymeranaloge Umsetzung bei Temperaturen durchgeführt werden, bei denen die
Konzentration des Nitrens so gering ist, dass Nebenreaktionen wie die Azokupplung
zurückgedrängt werden können. Für die Pfropfversuche wurden durch ATRP von MMA und Styrol Polymethylmethacryla-
te und Polystyrole hergestellt werden. Durch Substitution des Halogens am Kettenende der
Polymeren durch Azid wurden daraus azidterminierte Thermoplaste erhalten, die als Seite-
näste eingesetzt werden können. Daneben wurden aus MMA und Styrol durch ATRP mit
Hilfe der in Abschnitt 3.2.1 beschriebenen Azidgruppen tragenden Initiatoren PMMA und
Polystyrol synthetisiert, die sich direkt für die Pfropfreaktion einsetzen lassen. Um die
Pfropfung zu vereinfachen und eine Entmischung der Polymeren zu vermeiden, wurde für
die Pfropfreaktion mit Polymethylmethacrylat-Seitenketten dem PMMA chemisch ähnli-
che Copolymere aus MMA und Allylmethacrylat synthetisiert (Abschnitt 3.6.2). Dadurch
sollten sich durch Lösen der Polymeren und anschließendes Abdampfen des Lösungsmit-
tels homogene Mischungen herstellen lassen, die thermisch zur Reaktion gebracht werden
können. Als weiteres Rückgratpolymeres wurde für die Pfropfreaktionen im Extruder das
Terpolymere EPDM verwendet.
3.6.1 Herstellung und Charakterisierung der Pfropfäste
Für die Herstellung der Polymethylmethacrylate wurde MMA durch ATRP in 50-proz.
Anisollösung bei 90°C polymerisiert. Dazu wurde der Ligand N,N-Bis(2-pyridylmethyl)-
octylamin (BPMOA) in Verbindung mit Kupfer(I)-chlorid als Katalysator eingesetzt. Als

3 Ergebnisse 118
Initiator wurde α-Bromisobuttersäuremethylester (BiBME) verwendet. Die so hergestell-
ten Polymethylmethacrylate besitzen aus verbrauchtem MMA und Initiator berechnete
Molekulargewichte und enge Molekulargewichtsverteilungen.
Styrol wurde durch ATRP bei 100°C in Masse polymerisiert. 1-Phenylethylbromid (PEB)
wurde als Initiator, BPMOA bzw. N,N,N’,N’’,N’’-Pentamethyldiethylentriamin
(PMDETA) in Verbindung mit Kupfer(I)-bromid als Katalysator eingesetzt. Auch die dar-
aus resultierenden Polystyrole besitzen die aus Styrol-Umsatz und eingesetzten Sty-
rol/PEB-Verhältnissen berechneten Molekulargewichte.
Die Halogenidendgruppen der so hergestellten Polymethylmethacrylate und Polystyrole
wurden anschließend in DMF als Lösungsmittel mit Natriumazid substituiert[121] (Schema
3.19). In Tab. 3.29 sind die durch ATRP hergestellten Polymeren mit den verwendeten
Initiatoren und Katalysatoren und die Molekulargewichte der Polymeren aufgelistet.
R X
O OMe
RX
n
RN3n
RX
O
n
OMe
R
O
n
OMe
N3
+ATRP NaN3
DMF
Schema 3.19. Synthese von azidterminiertem Polystyrol und PMMA durch ATRP von Sty-
rol bzw. MMA mit anschließender Substitution der Halogenidendgruppen
(X) durch Natriumazid.
Tab. 3.29. Polystyrole und Polymethylmethacrylate, die durch ATRP von Styrol bzw.
MMA hergestellt wurden, und deren Molekulargewichte sowie die verwen-
deten Initiatoren und Katalysatoren aus Kupfersalz und Ligand.
Polymeres Initiator Cu-Salz Ligand Mn (g/mol)
PS1A PEB CuBr BPMOA 2650
PS2A PEB CuBr PMDETA 4900
PMMA1-A BiBME CuCl BPMOA 12000
PMMA2-A BiBME CuCl BPMOA 3200

3 Ergebnisse 119
Um möglichst reine Pfropfcopolymere als Endprodukte zu erhalten, ist eine hohe Pfropf-
ausbeute erforderlich, damit kein homopolymeres Seitenastpolymeres und kein unge-
pfropftes Rückgratpolymeres im Produkt verbleibt. Dazu müssen die Halogenidendgrup-
pen der Seitenastpolymeren quantitativ in Azidgruppen überführt werden. Bei Polymeren
ist eine quantitative Endgruppenbestimmung wegen der geringen Konzentration der End-
gruppen schwierig. Zudem werden, um die Polymeren vollständig für die Reaktion in Lö-
sung zu bringen, höhere Lösungsmittelkonzentrationen benötigt als bei niedermolekularen
Verbindungen. Durch die hohe Verdünnung wird aber die Reaktionsgeschwindigkeit her-
abgesetzt. Daher können sich für die Substitution an Endgruppen in Polymeren sehr lange
Reaktionszeiten ergeben.
Zum Bestimmen der Reaktionszeit für die Substitution von Bromid bzw. Chlorid durch
Azid im Polymeren wurden zunächst Modellreaktionen mit niedermolekularen Verbindun-
gen herangezogen[122] (Tab. 3.30) herangezogen. Dazu wurden niedermolekulare Modelle,
die strukturell der Endgruppe des Polymeren entsprechen, mit Natriumazid in DMF bei
Raumtemperatur zur Reaktion gebracht; der Umsatz wurde gaschromatographisch verfolgt.
Aus den Zeit-Umsatz-Kurven wurden dann die Reaktionsgeschwindigkeitskonstanten be-
stimmt. Im Falle des bromterminierten Polystyrols diente als strukturähnliche Verbindung
1-Phenylethylbromid, im Falle des chlorterminierten Polystyrols 1-Phenylethylchlorid.
Zum Abschätzen der Geschwindigkeitskontanten der Substitution von Chlorid durch Azid
in Polymethylmethacrylat wurde die Reaktionsgeschwindigkeitskonstante der Substitution
der Modellverbindung 2-Chlorisobuttersäureethylester herangezogen.
Tab. 3.30. Reaktionsgeschwindigkeitskonstanten k der Substitution der Haloge-
nidgruppen der Modellverbindungen durch Azid bei einer Konzentration
von 1M (DMF) und 1,1 Äquivalenten Natriumazid bei 25°C.
Modellverbindung R-X k (M-1s -1)
1-Phenylethylbromid (1-PEB) 6,75.10-3
1-Phenylethylchlorid (1-PEC) 6,7.10-5
2-Chlorisobuttersäureethylester (ECiB) 7,2.10-6
Unter der Annahme, dass die Geschwindigkeitskonstante der Substitutionsreaktion am
Kettenende der Polymeren etwa der der niedermolekularen Modelverbindung entspricht,
für die das Geschwindigkeitsgesetz zweiter Ordnung gilt, kann die Halbwertszeit

3 Ergebnisse 120
]RX[)T(k)T(/ ⋅
=1
21τ für die Substitutionsreaktion im Polymeren berechnet werden.
Weil die Substitutionsreaktion der Polymeren bei viel geringeren Konzentrationen ablau-
fen muss, um die Polymeren im Reaktionsmedium zu lösen, verringert sich die
Reaktionsgeschwindigkeit erheblich. Unter der Annahme, dass sich bei den meisten
Reaktionen die Geschwindigkeit etwa verdoppelt, wenn die Temperatur um 10°C erhöht
wird, und dass sie auch linear mit Erhöhen der Konzentration an Natriumazid steigt,
wurden die Konzentrationen an Natriumazid und die Reaktionstemperaturen so gewählt,
dass sich für die jeweiligen Substitutionen akzeptable Halbwertszeiten ergeben. In Tab.
3.31 sind die so berechneten Ansätze der Substitutionsreaktion der Polymerendgruppen mit
Natriumazid und die entsprechenden Halbwertszeiten aufgeführt.
Tab. 3.31. Ansätze für die Substitutionsreaktionen an Polymeren, eingesetzte Natrium-
azid-Konzentrationen und berechnete Halbwertszeit bei 25 bzw. 55°C.
Polymeres
(Mn [g/mol])
Modell-
verbindung
k (M-1s -1) [Polymer-X] [NaN3] τ1/2 (25°C)
PS1A (2650) 1-PEB 6,75.10-3 2,5 mM 20 x 2,5 mM 49,4 min
PS2A (4900) 1-PEB 6,75.10-3 2,5 mM 20 x 2,5 mM 49,4 min
APS1A (5000) 1-PEB 6,75.10-3 5 mM 20 x 5 mM 24,7 min
APMMA-b-PSA
(37000)
1-PEC 6,7.10-5 5mM 20 x 5 mM 4,15 h
PMMA1-A (12000) ECiB 7,2.10-6 2,5mM 300 x 2,5 mM 6,4 h
(55°C)
PMMA2-A (3200) ECiB 7,2.10-6 5mM 300 x 5 mM 3,2 h
(55°C)
Die Substitution der Halogenid- durch Azidendgruppen sollte danach beim Polystyrol mit
einem Überschuss von 20 Äquivalenten Natriumazid zur Endgruppe bei Raumtemperatur
innerhalb von 24 h quantitativ erfolgen. Bromidendgruppen sollten etwa viermal so schnell
substituiert werden können wie Chloridendgruppen. Für die Substitution der Chloridend-
gruppen der Polymethylmethacrylate sind 300 Äquivalente an Natriumazid notwendig, um
sie bei 55°C innerhalb 24 h vollständig substituieren zu können. Alle Polymeren wurden
entsprechend den Konzentrationen in Tab. 3.31 in DMF gelöst und mit 20 bzw. 300 Äqui-

3 Ergebnisse 121
valenten Natriumazid versetzt. Bei Raumtemperatur bzw. 55°C wurden sie 24 h unter Rüh-
ren zur Reaktion gebracht. Nach dem Ausfällen in einem Überschuss an Methanol, Isolie-
ren und Trocknen wurden die azidterminierten Polymeren auf ihren Azidgehalt mit der
Infrarotspektroskopie untersucht. Azide zeigen im Infrarotspektrum eine signifikante
scharfe Bande im Absorptionsbereich der kumulierten Doppelbindungen des Azids bei
2170 – 2100 cm-1 (Abb. 3.51).
3500 3000 2500 2000 1500 1000 500
2100 cm-1
Polystyrol PS1A, Mn=2650, Mw/Mn=1.13
Wellenzahl [cm-1]
N N N+ -
Abb. 3.51. Infrarotspektrum des Polystyrol-Films PS1A mit scharfer Absorptionsbande
der Azidendgruppe bei 2100 cm-1.
Um die Konzentration an Azid im Polymeren zu bestimmen und somit die Vollständigkeit
der Substitution der erhaltenen Produkte prüfen zu können, wurden Eichkurven erstellt.
Dazu wurden Lösungen unterschiedlicher Konzentrationen an Polystyrol PS1 bzw.
PMMA1 bekannten Molekulargewichts mit der Modellverbindung 1-Phenylethylazid in
THF hergestellt und bei jeder Konzentration IR-Spektren aufgenommen. Nach dem Lam-
bert-Beer-Gesetz kann aus dem Verhältnis der Differenz der Höhe der Basislinie und der
Höhe der Absorptionsbande I0 / I die Extinktion der Azidbande mit E = log(I0 / I) berech-
net werden. Die Extinktion wird gegen die Konzentration von Azid in der jeweiligen Lö-
sung aufgetragen. Daraus ergibt sich die Eichkurve für die Extinktion der Azidbande in
Abhängigkeit von der Konzentration. In Abb. 3.52 ist exemplarisch die Eichkurve für Po-
lystyrol aufgetragen.

3 Ergebnisse 122
Um die Konzentration an Azid in einer azidterminierten Polystyrolprobe zu bestimmen,
wird das Verhältnis I0 / I der Azidbande des Infrarotspektrums und daraus die Extinktion E
ermittelt. Aus der Eichkurve kann dann die Konzentration an Azid im Polymeren abgele-
sen und mit dem theoretischen Wert bei vollständiger Substitution des Halogenids durch
Azid, der sich aus dem Massenanteil an Azid und dem Molekulargewicht des entsprechen-
den Polymeren ergibt, verglichen werden.
0,00 0,02 0,04 0,06 0,08 0,100,0
0,1
0,2
0,3
0,4E
Konzentration N3- [mol]
Abb. 3.52. Eichkurve zum Bestimmen der Azidkonzentration in Polystyrol.
Bis auf das Blockcopolymere APMMA-b-PSA, welches ein Molekulargewicht von 37000
g/mol besitzt, konnten alle in Tab. 3.31 aufgeführten azidterminierten Polymeren mit Hilfe
der quantitativen Infrarotmethode charakterisiert werden. Im Spektrum von APMMA-b-
PSA war die Azidbande nur sehr schwach zu erkennen. Die Ursache könnte in der zur
Molmasse der Azidgruppe vergleichsweise hohen Molmasse des Blockcopolymeren lie-
gen. Daher war eine Quantifizierung des Azidgehalts in diesem Blockcopolymeren nicht
möglich. Die Polymeren PS1A, PS2A, APS1, PMMA1-A und PMMA2-A konnten dage-
gen gut charakterisiert werden. Aus der Infrarotanalyse ergab sich, dass in allen Fällen die
Substitution des Halogenids zum Azid quantitativ erfolgte. Die erhaltenen azidfunktionali-
sierten Polymeren wurden dann für die Pfropfung als reaktive Seitenäste eingesetzt. Aller-
dings ist die IR-Methode nur für kleine Konzentrationen gültig, da als Störfaktoren Refle-
xion und Streuungen des eingestrahlten Lichtes auftreten können.
Um die Herstellung von azidterminierten Polymeren zu vereinfachen und die an die ATRP
anschließende aufwendige Substitution der Halogenidendgruppen vermeiden zu können,

3 Ergebnisse 123
wurde die ATRP von Styrol und MMA auch mit den in Abschnitt 3.2.1 beschriebenen a-
zidfunktionalisierten Initiatoren 2-Brompropionsäure-2-azidoethylester (AEBP) bzw. 2-
Brom-2-methylpropionsäure-2-azidoethylester (AEBiB) durchgeführt. Dadurch sollten in
einem Syntheseschritt Polymere mit Azidendgruppe herstellbar sein (Schema 3.20). Mit 4-
Azidobenzylbromid (ABB) als Initiator können Polystyrole mit aromatischer Azidfunktion
erhalten werden.
ON3
O
Br
O OMe
Brn
ON3
O
Br
O
n
OMe
ON3
OABiB
+ATRP
Schema 3.20. Herstellung von Polystyrol bzw. PMMA mit primärer aliphatischer Azid-
funktion am Kettenende.
Die ATRP von Styrol mit AEBP bzw. ABB als Initiator wurde bei 100°C in Masse durch-
geführt. Als Katalysator wurde N,N,N’,N’’,N’’-Pentamethyldiethylentriamin (PMDETA)
bzw. N,N-Bis(2-pyridylmethyl)octylamin (BPMOA) in Verbindung mit Kupfer(I)-bromid
verwendet. Die ATRP von MMA wurde durch AEBiB initiiert. Als Katalysator wurde
Kupfer(I)-chlorid in Verbindung mit den Liganden 4,4’-Di-(5-nonyl)-2,2’-bipyridin
(dNbpy) bei 90°C in 50-proz. Anisollösung bzw. N,N,N’,N’’,N’’’,N’’’-Hexamethyltri-
ethylentetramin (HMTETA) bei 60°C in 50-proz. Ethylacetatlösung eingesetzt. Die Poly-
merisationen mit azidfunktionalisierten Initiatoren verlaufen kontrolliert und führen zu
Polymeren mit enger Molekulargewichtsverteilung und definierten Endgruppen. In Abb.
3.53 ist die Zeit-Umsatz-Kurve der ATRP von MMA mit AEBiB in Ethylacetat bei 60°C
zum Polymethylmethacrylat APMMA1a dargestellt. Die erhaltenen Molekulargewichte der
Polymeren entsprechen den aus dem Monomer/Initiator-Verhältnis berechneten Werten,
und die Polydispersität der Polymeren beträgt 1,2.

3 Ergebnisse 124
0 1 2 3 4 5 6 70,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
1,8
2,0 APMMA1a
ln([M
] 0/[M] t)
Zeit t (h)
Abb. 3.53. Semilogarithmische Auftragung des Umsatze beis der Polymerisation von
MMA mit AEBiB als Initiator und [Cu(HMTETA)2]Cl als Katalysator bei
60°C in 50-proz. Ethylacetatlösung,
(MMA / AEBiB / CuCl / HMTETA = 70 / 1 / 0,5 / 0,5).

3 Ergebnisse 125
In Tab. 3.32 sind die mit den verwendeten Initiatoren und Katalysatoren hergestellten Po-
lymeren und die Molekulargewichte der Polymeren mit Azidendgruppe aufgeführt.
Tab. 3.32. Durch ATRP von Styrol bzw. MMA hergestellte Polymere mit Azidendgrup-
pen, verwendete Initiatoren, Kupfersalze und Liganden und Molekularge-
wichte der Polymeren.
Polymeres Initiator Cu-Salz Ligand Mn (g/mol)
APS1 AEBP CuBr PMDETA 5000
APS1A AEBP CuBr PMDETA 5000
APS2 AEBP CuBr BPMOA 1900
APS3 AEBP CuBr PMDETA 12000
APS4 AEBP CuBr PMDETA 1990
APS5 AEBP CuBr PMDETA 5000
ABPS1 ABB CuBr PMDETA 10000
ABPS2 ABB CuBr dNbpy 2600
APMMA1a AEBiB CuCl HMTETA 6900
APMMA1b AEBiB CuCl dNbpy 8400
APMMA2 AEBiB CuCl dNbpy 5200
APMMA3 AEBiB CuCl dNbpy 10000
APMMA5 AEBiB CuCl HMTETA 5000
APMMA-b-PSA AEBiB CuCl/CuBr dNbpy/
PMDETA
37000
Die erhaltenen Polymeren wurden mit Hilfe der Infrarotspektroskopie charakterisiert. Alle
Spektren zeigen wie zu erwarten die signifikante scharfe Bande der kumulierten Doppel-
bindungen des Azids bei 2170 – 2100 cm-1. Da eine quantitative Bestimmung der Azi-
dendgruppen im Polymeren mit Hilfe der Infrarotmethode sehr schwierig ist (s.o.), wurden
die Polymeren mit der Matrix-unterstützten Laser-Desorptions/Ionisations-Flugzeit-
Massenspektrometrie (MALDI-TOF-MS) untersucht, wobei überwiegend intakte Molekü-
lionen erhalten werden. Mit einer Detektion, die eine Messgenauigkeit von ±1 Da erlaubt,
sollte somit eine präzise Endgruppenanalyse und eine Unterscheidung von Polymermole-
külen mit und ohne Azidgruppe möglich sein. In Abb. 3.54 ist das MALDI-TOF-MS-

3 Ergebnisse 126
Spektrum des azidfunktionalisierten Polystyrols ABPS2 dargestellt. Man erkennt zwei ho-
mologe Reihen mit unterschiedlichen Endgruppen. Der Massenabstand der korrespondie-
renden Peaks beider Reihen beträgt 104 g/mol (Molekulargewicht von Styrol). Die homo-
loge Reihe mit höherer Intensität entspricht den Polystyrolen mit Azidendgruppen. Die
homologe Reihe mit niedriger Intensität ist um 28 Da zu kleineren Molekulargewichten
verschoben. Diese Differenz entspricht exakt dem Molekulargewicht von molekularem
Stickstoff. Das deutet darauf hin, dass durch die Laseranregung bei einem Teil der A-
zidgruppen der Zerfall zu Nitrenen unter Verlust von molekularem Stickstoff induziert
wurde. Allerdings treten keine weiteren homologen Reihen auf, die Polymeren zuzuordnen
wären, die keine Azidgruppe tragen. Daraus kann geschlossen werden, dass alle durch
ATRP mit azidfunktionalisierten Initiatoren hergestellten Polymeren eine Azidendgruppe
tragen.
104 Da
28 Da
104 Da
28 Da
Abb. 3.54. MALDI-MS-Spektrum des azidfunktionalisierten Polystyrols ABPS2.
Somit ist die erste Voraussetzung für die Pfropfreaktion erfüllt. Jedes potentielle Seite-
nastpolymeresenthält eine reaktionsfähige Endgruppe, die zur Pfropfung an die Rückgrat-
polymeren fähig ist.
Um die Temperatur zu bestimmen, bei der die Azidendgruppen durch Abgabe von moleku-
larem Stickstoff zu Nitrenen reagieren, wurden die azidterminierten Polymeren mit Hilfe

3 Ergebnisse 127
der Differential-Raster-Kalorimetrie (DSC) untersucht. Damit können nicht nur die Glas-
übergangstemperaturen und Schmelzpunkte bestimmt werden, sondern auch Temperatu-
ren, bei denen eine Reaktion einsetzt oder Zersetzung auftritt. Die Reaktionspeaks liefern
Aussagen über die Arrhenius-Daten, woraus die Halbwertszeit der Reaktion bei bestimm-
ten Temperaturen ermittelt werden kann. Die Temperatur und Halbwertszeit der Dissozia-
tion von Azid zu Nitren am Kettenende der Polystyrole und Polymethylmethacrylate sollte
im Bereich der üblichen Verarbeitungstemperaturen und –zeiten des Extruders liegen. Die
Verarbeitungstemperatur im Extruder dürfen 260°C nicht überschreiten, um den thermi-
schen Abbau von Polystyrol bzw. Polymethylmethacrylat und die Vernetzung des elasto-
meren Pfropfrückgrates (EPDM) zu vermeiden. Allerdings muss eine gute Durchmischung
der Polymeren erreicht werden; die dafür erforderliche Verarbeitungstemperatur liegt für
Polystyrol und PMMA bei etwa 160°C [108]. Neben der Temperatur spielt auch die Reakti-
onszeit im Extruder eine große Rolle. Je größer die Verweilzeit im Extruder ist, umso hö-
her wird der Anteil an Abbau und Vernetzung. Damit Nebenreaktionen der Nitrene wie
Kupplung zur Azoverbindung zurückgedrängt werden, muss ferner die Konzentration an
Nitren im Extruder möglichst niedrig, aber bei guter Durchmischung gewährleistet sein.
Daher sollten die Polymeren bis maximal 260°C für eine Dauer von 15 min im Extruder
gemischt und zur Reaktion gebracht werden.
In Abb. 3.55 sind die Heizkurven der DSC-Messung für Polystyrol PS1A des ersten und
zweiten Heizzyklus dargestellt. Im ersten Heizgang findet man die Glasstufe bei Tg = 86°C
und einen breiten exothermen Peak bei Tazid = 195-265°C. Im zweiten Heizgang ist die
Glastemperatur bei Tg = 92°C zu erkennen. Der exotherme Peak oberhalb 190°C tritt nicht
mehr auf. Die Messkurve verläuft im Bereich von 195 bis 265°C flach. Die Azidendgruppe
muss demnach beim ersten Heizen vollständig zum Nitren reagiert haben.

3 Ergebnisse 128
0 50 100 150 200 250 300
exo
HR = 10°C/min
1. Heizgang 2. Heizgang
Wär
mef
luß
[W/g
]
Temperatur [°C]
Abb. 3.55. DSC-Messung von Polystyrol PS1A mit Azidendgruppe;
1. und 2. Heizgang (Heizrate HR=10°C/min).
Unter der Annahme, dass die Dissoziation des Azids zu Nitren und Stickstoff einem Ge-
schwindigkeitsgesetz erster Ordnung gehorcht, lässt sich mit der Konzentration der Azid-
gruppe zum Zeitpunkt t [Azid]t und der Konzentration der Azidgruppe zu Beginn der Re-
aktion [Azid] das Geschwindigkeitsgesetz der Reaktion wie folgt formulieren (Gl. 3.2):
ktt e]Azid[]Azid[ −⋅= Gl. 3.2
Setzt man weiterhin voraus, dass der exotherme Peak des ersten Heizgangs der DSC-
Messung (Abb. 3.56) nur auf die Dissoziation der Azidendgruppe zum Nitren zurückzu-
führen ist und d[Azid]t/dT bei jeder Temperatur des Reaktionspeaks proportional zur
Wärmekapazität cp(T) ist[123], liefert die erste Ableitung (Gl. 3.3) von Gl. 3.2 und Auflösen
nach k(T) zu Gl. 3.4:

3 Ergebnisse 129
190 200 210 220 230 240 250 260 270
0,00
0,05
0,10
0,15
0,20
0,25
exo 1. Heizgang, HR = 10°C/min
Wär
mef
luß
[W/g
]
Temperatur [°C]
∫ ⋅2T
Tp dTc
HR)T(cW p
.⋅=
∫ ⋅265
220
T
Tp dT)T(c
HR = 10 K/min
Abb. 3.56. Exothermer Reaktionspeak des ersten Heizgangs der DSC-Messung von
Polystyrol PS1A mit Darstellung zur Berechnung von cp(220°C) und
. ∫°
°
⋅C
C
T
Tp dT)T(c
265
220
dT]Azid[dHR]Azid)[T(k)t](Azid[d t ⋅=−= Gl. 3.3
∫ ⋅
⋅−=
maxT
Tp
p
dT)T(c
)T(cHR)T(k mit
HRW(
.
p =)Tc Gl. 3.4
k(T) Geschwindigkeitskonstante bei Temperatur T
HR Heizrate
cp(T) Wärmekapazität .
W Wärmefluss
Für jede Temperatur T ergibt sich aus dem zugehörigen Ordinatenabschnitt (Wärmefluss
) die Wärmekapazität cHR)T(cW p
.⋅= p und aus der Fläche unter der Kurve
(Abb. 3.56). Unter der Vorrausetzung, dass die Reaktiongeschwindigkeitskonstante des
∫ ⋅maxT
Tp dT)T(c

3 Ergebnisse 130
Zerfalls von Azid zu Nitren und molekularem Stickstoff eine Temperaturabhängigkeit nach
Arrhenius (Gl. 3.5) hat, werden aus den aus Gl. 3.4 berechneten Werten für k(T) durch
Auftragen von ln k(T) gegen 1/T aus der logarithmischen Form der Arrhenius-Gleichung
(Gl. 3.6) die Steigung der Geraden (Aktivierungsenergie Ea) und der Ordinatenabschnitt
(präexponentieller Faktor A) der Reaktion erhalten.
RT/EaAek −= Gl. 3.5
RT/EAlnkln a−= Gl. 3.6
In Abb. 3.57 ist beispielhaft das Arrhenius-Diagramm und die ermittelte Aktivierungsener-
gie für die Dissoziationsreaktion der Azidendgruppe im Polystyrol PS1A aufgetragen.
1,85x10-3 1,90x10-3 1,95x10-3 2,00x10-3 2,05x10-3 2,10x10-3 2,15x10-3
-8
-7
-6
-5
-4
-3
-2
A = 6,5*1013
Ea = 153,8 kJ/(mol*s)
ln k
1/T [1/K]
y = -18499x + 31,8
Abb. 3.57. Arrhenius-Diagramm von ln k(T) gegen 1/T für die Dissoziation der Azid-
endgruppe von Polystyrol PS1A.
Die Glastemperaturen Tg, der Temperaturbereich der Dissoziation von Azid zu Nitren TAzid
und die berechneten Arrhenius-Daten von allen azidterminierten Polymeren sind wie die
Aktivierungsenergie Ea und der präexponentielle Faktor A in Tab. 3.33 aufgeführt.

3 Ergebnisse 131
Tab. 3.33. Arrhenius-Daten und Glastemperaturen für die azidfunktionalisierten Initia-
toren und Polymeren.
Polymeres/Initiator
Mn
(g/mol)
Tg (°C) TAzid (°C) Ea
(kJ mol-1 s-1)
A
(s-1)
AEBP 222 124 (Tb) 190-250 205,7 3,8.1019
AEBiB 236 192 (Tb) 180-210 225,3 2,3.1021
ABB 212 149 (Tb) 160-205 267,3 4,6.1025
PS1A 2650 92 195-265 153,8 6,5.1013
PS2A 4900 87 190-250 167,5 1,4.1015
APS1 5000 94 180-225 207,8 1,4.1020
APS1A 5000 96 185-240 192,9 1,7.1018
APS2 1900 84 190-245 198,5 4,2.1019
APS3 12000 100 200-250 195,3 9,1.1018
APS4 1990 89 185-245 192,6 5,4.1018
APS5 5000 98 190-250 196,3 1,9.1019
ABPS1 10000 99 175-230 221,8 7,2.1021
ABPS2 2000 87 170-220 235,4 1,5.1023
PMMA1-A 12000 112 200-250 197,2 6,8.1019
PMMA2-A 3200 100 180-240 187,7 4,9.1018
APMMA1a 6900 105 175-250 161,2 2,3.1015
APMMA1b 8400 108 180-250 159,9 2,7.1015
APMMA2 5200 103 175-230 160,6 1,9.1015
APMMA3 10000 110 190-240 158,8 3,1.1015
APMMA5 5000 108 185-245 170,5 2,2.1016
APMMA-b-PSA 37000 115/94 nicht regist-
rierbar
- -
Die Glastemperaturen der azidterminierten Polystyrole liegen wie die der homopolymeren
Polystyrole bei 84 bis 100°C, die der Polymethylmethacrylate bei 100 bis 112°C. Die
Peaks des Azidzerfalls erstrecken sich über einen Temperaturbereich von 45 bis zu 70 K
und liegen zwischen 170 und 265°C. Beim Initiator AEBiB überschneidet sich der Siede-
punkt bei 192°C mit dem Azidzerfall bei 180 bis 210°C. Bei den Initiatoren AEBP und

3 Ergebnisse 132
ABB liegen die Siedepunkte (124 bzw. 149°C) etwas unterhalb der Azid-Reaktionspeaks
(190 bis 250°C und 160 bis 205°C). Die Aktivierungsenergien der Reaktion der Initiatoren
sind mit 206 bis 267 kJ/mol s etwas größer als die der Polymeren mit 154 bis 222 kJ/mol s.
Dabei liegt die Aktivierungsenergie der Polystyrole um 20 bis 30 kJ/mol s höher als die der
Polymethylmethacrylate. Die Länge der Polymerketten scheint keinen Einfluss auf die
Aktivierungsenergie und auf die Lage des Temperaturbereichs zu haben. Dagegen existiert
aber ein Substituenteneffekt am Kettenende. Die Aktivierungsenergie der durch Substituti-
on des Halogenids durch Azid am Kettenende synthetisierten Polystyrole PS-A ist etwa 20
bis 30 kJ/mol s kleiner als die von durch ATRP mit Azidinitiator hergestelltem A-PS. Die
Estergruppe in Nachbarschaft zur Azidgruppe vermindert die Elektronendichte am Azid
stärker als die Phenylgruppe im PS-A (Abb. 3.58). Im A-BPS befindet sich die Azidgruppe
direkt am aromatischen Ring, der die Elektronendichte am Stickstoff so stark vermindert,
so dass die Aktivierungsenergie zusätzlich um etwa 25 kJ/mol s im Vergleich zu A-PS
erhöht wird. Dagegen wird im PMMA-A die Abspaltung von molekularem Stickstoff vom
tertiären Kohlenstoff mit Estergruppe im Vergleich zur Abspaltung vom primären Kohlen-
stoff im A-PMMA erschwert, was eine Erhöhung der Aktivierungsenergie um etwa 30 bis
40 kJ/mol s verursacht.
R n
R
O
n
OMe
Xn
O
O
X
O
n
OMe
O
O
Xn
MMA
PS-
PMMA-
B-PS
Ea
N3
N3
N3
N3
N3-PS
-P
A
A
A
A
A-BPSA
Abb. 3.58. Strukturen der unterschiedlich azidterminierten Polymeren.
Somit nimmt die Aktivierungsenergie der Dissoziationsreaktion der Azidendgruppe der
Polystyrole mit aromatischer Azidendgruppe (A-BPS) über die mit primärer aliphatischer

3 Ergebnisse 133
Azidendgruppe (A-PS) bis hin zu den Polystyrolen mit sekundärer Azidendgruppe (PS-A)
ab. Die Aktivierungsenergie der Dissoziation der Azidendgruppe der Polymethylmethacry-
late mit aliphatischer primärer Azidgruppe (A-PMMA) ist geringer als die für PMMA mit
tertiärer Azidendgruppe (PMMA-A).
Um die Reaktionszeiten für die Pfropfung der azidterminierten Polymeren an Doppelbin-
dungen enthaltenden Rückgratpolymeren abschätzen zu können, wurden aus den Arrheni-
us-Daten die Halbwertszeiten berechnet. Die Halbwertszeit τ1/2 (T) ergibt sich aus den je-
weiligen Werten von k(T) durch Gl. 3.7:
)T(k/ln)T(/ 221 =τ Gl. 3.7
Um eine gute Durchmischung der Polymeren zu gewährleisten, muss die Verarbeitungs-
temperatur bei ca.160°C liegen[108]. Damit gleichzeitig möglichst wenig Abbau der Poly-
meren stattfindet und möglichst wenige Nebenreaktionen der Nitrene auftreten, sollte die
Konzentration der Nitrene im Gemisch nicht zu hoch sein und die Reaktionstemperatur
220°C nicht überschreiten. Daher wurden die Halbwertszeiten τ1/2 für 160°C und 200°C
berechnet. Sie sind in Tab. 3.34 mit den entsprechenden Werten für k(T) aufgelistet.

3 Ergebnisse 134
Tab. 3.34. Halbwertszeiten des Zerfalls der Azidgruppen der Initiatoren und Polyme-
ren bei 160 und 200°C.
Polymeres/
Initiator
k (160°C)
[s-1]
τ1/2 (160°C)
[min]
k (200°C)
[s-1]
τ1/2 (200°C)
[min] AEBP 2,16.10-05 535,41 7,42.10-04 15,54
AEBiB 1,55.10-06 7414,42 3,08.10-04 37,43
ABB 2,67.10-07 43039,32 1,42.10-04 81,06
PS1A 1,84.10-05 626,10 6,81.10-04 16,93
PS2A 8,83.10-06 1304,74 4,51.10-04 25,58
APS1 1,22.10-05 944,79 1,60.10-03 7,19
APS1A 9,28.10-06 1242,26 8,59.10-04 13,42
APS2 4,84.10-05 238,08 5,11.10-03 2,25
APS3 2,55.10-05 451,89 2,50.10-03 4,61
APS4 3,20.10-05 359,82 2,94.10-03 3,91
APS5 4,03.10-05 285,70 4,04.10-03 2,85
ABPS1 1,29.10-05 896,20 2,35.10-03 4,91
ABPS2 6,15.10-06 1877,94 1,52.10-03 7,48
PMMA1-A 1,12.10-04 102,49 1,15.10-02 1,00
PMMA2-A 1,13.10-04 101,72 9,29.10-03 1,24
APMMA1a 8,35.10-05 138,10 3,67.10-03 3,14
APMMA1b 1,41.10-04 82,00 6,00.10-03 1,92
APMMA2 8,15.10-05 141,52 3,53.10-03 3,26
APMMA3 2,19.10-04 52,62 9,11.10-03 1,27
APMMA5 6,03.10-05 190,99 3,30.10-03 3,49
APMMA-b-PSA -- -- -- --
Die Halbwertszeiten des Zerfalls der Azidendgruppen der Polymeren liegen bei 200°C im
Bereich von 1 bis 8 Minuten. Bei den Initiatoren und bei den Polystyrolen PS1A, PS2A
und APS1A ist die Halbwertszeit dagegen etwas länger. Bei 160°C liegt die Halbwertszeit
der Azidreaktion der Polymeren noch im Bereich von Stunden. Um Nebenreaktionen
schon zu Beginn der Pfropfung und vor dem vollständigen Durchmischen des Pfropfastes
mit dem Rückgratpolymeren zu vermeiden, muss die Pfropfreaktion also im Bereich von

3 Ergebnisse 135
160 bis 200°C durchgeführt werden. Bei 160°C ist der Nitrengehalt im Reaktionsgemisch
dann noch relativ niedrig. Nach vollständigem Durchmischen der Thermoplaste mit Azid-
endgruppe und der Rückgratpolymeren kann dann die Temperatur kontinuierlich erhöht
werden, um bei 200°C dann innerhalb weniger Minuten durch Zerfall der Azidendgruppen
eine Pfropfung zu erreichen.
3.6.2 Herstellung und Charakterisierung der Rückgratpolymeren
Die im vorherigen Abschnitt beschriebenen azidterminierten Polystyrole und Polymethyl-
methacrylate wurden als Seitenastpolymere für die Pfropfung von Doppelbindungen ent-
haltenden Rückgratpolymeren eingesetzt. Um die Pfropfreaktion zu vereinfachen und das
Entmischen der Polymeren zu vermeiden, wurden für die Pfropfung mit Polymethyl-
methacrylat-Seitenketten dem PMMA chemisch ähnliche Copolymere aus MMA und Al-
lylmethacrylat synthetisiert. Dadurch sollten sich beim Lösen der Polymeren und anschlie-
ßendem Abdampfen des Lösungsmittels homogene Mischungen herstellen lassen, die
thermisch induziert zur Reaktion gebracht werden können.
Zum Herstellen der Copolymeren aus MMA und Allylmethacrylat (ALMA) wurden die
beiden Monomeren in einem ein festgelegten Verhältnis durch ATRP in 50-proz. Ethylace-
tatlösung bei 60°C polymerisiert. Dazu wurde der Ligand N,N,N’,N’’,N’’’,N’’’-Hexa-
methyltriethylentetramin (HMTETA) in Verbindung mit Kupfer(I)-chlorid als Katalysator
eingesetzt. Als Initiator wurde α-Bromisobuttersäuremethylester (BiBME) verwendet. In
Abb. 3.59 sind die Zeit-Umsatz-Kurven für Oligo(methylmethacrylat-co-allylmethacrylat)
semilogarithmisch aufgetragen. Die Polymerisation verläuft jeweils erster Ordnung bezüg-
lich des Monomeren, die Molekulargewichte entsprechen den aus verbrauchtem MMA und
ALMA und eingesetztem Initiator berechneten Werten, die Molekulargewichtsverteilungen
sind mit 1,15-1,19 relativ eng (Abb. 3.60).

3 Ergebnisse 136
0 50 100 150 200 250 3000
20
40
60
80
1,0
1,5
2,0
2,5
3,0
3,5
4,0Copolymerisation von MMA mit ALMA Umsatz von ALMA
Um
satz
[%]
Zeit [min]
ln([M
] 0/[M
])
0 50 100 150 200 250 3000
20
40
60
80
1,0
1,5
2,0
2,5
3,0
3,5
4,0
Um
satz
Zeit [min]
Copolymerisation von MMA mit ALMA Umsatz von MMA
ln([M
] 0/[M])
Abb. 3.59. Zeit-Umsatz-Kurven der Copolymerisation von MMA mit ALMA in 50-proz.
Ethylacetatlösung bei 60°C durch ATRP,
(Molverhältnis: MMA / ALMA / CuCl / HMTETA / MBiB = 10 / 5 / 0,2
/ 0,2 / 1).
0 20 40 60 800
250
500
750
1000
1250
1500
1,0
1,2
1,4
1,6
1,8
2,0
Mn
Umsatz (MMA)
PDI
Abb. 3.60. Abhängigkeit des Molekulargewichts (Mn) (blau) und der Polydispersität
(rot) vom MMA-Umsatz bei der Copolymerisation von MMA mit ALMA im
Molverhältnis 2:1.
Bei beiden Monomeren wurden jeweils zu etwa 70% der ursprünglich eingesetzten
Konzentration ins Polymere eingebaut. Aus den eingesetzten Monomer/Initiator-
Verhältnissen und dem Umsatz wurde die Zahl der MMA- und ALMA-Einheiten pro Kette
abgeschätzt. Danach enthält jede Polymerkette ca. 3,5 ALMA- und 7 MMA-Einheiten. Mit
der 1H-NMR-Spektroskopie konnte durch Vergleich der Integrale der Methoxyprotonen

3 Ergebnisse 137
NMR-Spektroskopie konnte durch Vergleich der Integrale der Methoxyprotonen des
MMA und des Initiators MBiB mit den Allyloxyprotonen des ALMA dieses Verhältnis der
Monomereinheiten bestätigt werden (Abb. 3.61). Eine Polymerkette enthält somit statis-
tisch eine Initiator- (MBiB), 3,6 Allylmethacrylat- und 7,4 Methylmethacrylateinheiten. In
Tab. 3.35 sind die berechneten und die durch GC- bzw. GPC-Messungen sowie NMR-
Spektroskopie erhaltenen Daten der Copolymeranalyse aufgeführt. Im Copolymeren
P(MMA-co-ALMA) ist die Konzentration an allylischen Protonen zu gering, um NMR-
spektroskopisch erfasst zu werden, da die Polymerkette statistisch nur 1,4 Allylmetha-
crylat- auf 284,8 Methylmethacrylateinheiten enthält. Im Oligomeren O(MMA-co-ALMA)
beträgt das mit der GC und der GPC ermittelte Molverhältnis zwischen ALMA und MMA
dagegen 3,5 zu 7,1, was durch die NMR-Analyse mit 3,6 zu 7,4 bestätigt wird.
333.53.54.04.04.54.55.05.05.55.56.06.0
1
23
4
5
*n
m
OOOOO O
1 3 5
4
2
333.53.54.04.04.54.55.05.05.55.56.06.0
1
23
4
5
*n
m
OOOOO O
1 3 5
4
2
6.1 6.0
3.0
21.2
6.1 6.0
3.0
21.2
Abb. 3.61. 300MHz 1H-NMR-Spektrum des Methoxy- und Allyloxy-Bereichs von Oli-
go(methylmethacrylat-co-allylmethacrylat) in CDCl3 bei Raumtemperatur.

3 Ergebnisse 138
Tab. 3.35. Analyse der Copolymerzusammensetzung von P(MMA-co-ALMA) und
O(MMA-co-ALMA).
Umsatz [%]
(GC)
Aus Umsatz berech-
neter Molenbruch
Aus NMR berech-
neter Molenbruch
Polymeres Molekular-
gewicht Mn
(GPC) MMA ALMA MMA ALMA MMA ALMA
P(MMA-
co-ALMA)
29.000 71,2 70,1 284,8 1,4 - -
O(MMA-
co-ALMA)
1.200 70,7 69,6 7,1 3,5 7,4 3,6
Dem Angriff der Azidgruppen der Pfropfäste auf die Rückgratpolymeren stehen also im
Falle des O(MMA-co-ALMA) 3,5 und im P(MMA-co-ALMA) 1,4 Doppelbindungen pro
Kette zur Verfügung. Da das Molekulargewicht von P(MMA-co-ALMA) 25-mal höher als
das von O(MMA-co-ALMA) und somit der Anteil an MMA größer ist, enthält jede Kette
im P(MMA-co-ALMA) 0,5 mol-% Monomereinheiten mit Doppelbindungen, während im
O(MMA-co-ALMA) jede Kette 30 mol-% Einheiten mit Doppelbindungen besitzt. Auf-
grund der geringen Konzentration an Doppelbindungen ist zu erwarten, dass bei der Pfrop-
fung auf P(MMA-co-ALMA) einige Ketten ungepfropft bleiben können. Im Rückgratpo-
lymeren O(MMA-co-ALMA) ist der Anteil dagegen hoch genug, um statistisch zumindest
eine Doppelbindung pfropfen zu können, wenn die Ausgangsmischung einen genügend
hohen Anteil an funktionalisierten Pfropfästen enthält. Trotzdem wurden beide Copolyme-
risate für die Pfropfung eingesetzt. Des Weiteren wurden für die Herstellung der Pfropf-
produkte das kommerziell erhältliche Tercopolymere EPDM (Keltan 7441A, DSM) mit
freien seitenständigen Doppelbindungen verwendet. Die Struktur des Polymeren ist in
Abb. 3.62 gezeigt, das Molekulargewicht und der Anteil der Monomerbausteine mit Dop-
pelbindungen im Polymeren sind in Tab. 3.36 aufgelistet.

3 Ergebnisse 139
k l m
Ethylen-Propylen-5-Ethyliden-2-norbornen-terpolymeres (EPDM)
Abb. 3.62. Struktur des für die Pfropfreaktion eingesetzten, kommerziell erhältlichen
Polymeren EPDM (Keltan 7441A, DSM).
Tab. 3.36. Für die Pfropfreaktion eingesetzte Rückgratpolymere, deren Molekularge-
wichte und Anteil der Monomereinheiten, die Doppelbindungen enthalten.
Polymeres Molekulargewicht
Mn
(g/mol)
Anteil Monomerbaustei-
ne mit Doppelbindung
(Gew.-%)
Poly(methylmethacrylat-co-
allylmethacrylat)
29.000 0,5
Oligo(methylmethacrylat-co-
allylmethacrylat)
1.200 30
Poly(ethylene-co-propylen-co-5-
methylene-2-norbornen) (EPDM)
130.000 8
3.6.3 Herstellung und Charakterisierung der Pfropfprodukte
Im Anschluss an die in Abschnitt 3.6.1 und 3.6.2 beschriebene Herstellung der Ausgangs-
produkte wurde geprüft, ob sich die azidterminierten Polymeren zu Pfropfreaktionen in
Masse eignen. Für eine hohe Pfropfausbeute müssen alle Azidgruppen mit den vorhande-
nen Doppelbindungen über Aziridingruppen verknüpft sein, damit kein homopolymeres
azidterminiertes Seitenastpolymeres und kein ungepfropftes Rückgratpolymeres im End-
produkt verbleibt. Dazu müssen die zur Reaktion verwendeten Polymeren optimal durch-
mischt werden. Bei chemisch ähnlichen Polymeren kann dies durch Lösen in gemeinsamen

3 Ergebnisse 140
Lösungsmitteln und anschließendes Fällen oder durch Abdampfen des Lösungsmittels er-
reicht werden. Bei chemisch verschiedenen Polymeren führt das Abdampfen des Lö-
sungsmittels dagegen wieder zur Entmischung. Auch im Extruder kann durch ein intensi-
ves Mischen ein ausreichender Kontakt zwischen den reaktiven Phasen hergestellt werden.
Um die Pfropfversuche zu vereinfachen und eine Entmischung der Polymeren zu vermei-
den, wurden zuerst die chemisch ähnlichen azidterminierten PMMA und die Copolymeren
aus MMA und ALMA in Toluol gelöst und nach Abdampfen des Lösungsmittels mit ei-
nem Temperaturprofil der Pfropfreaktion unterzogen. Anschließend wurden dann die azid-
terminierten Polymeren mit dem kommerziell erhältlichen, Doppelbindungen enthaltenden
EPDM-Rückgratpolymeren im Extruder zur Reaktion gebracht.
3.6.3.1 Pfropfung auf MMA-ALMA-Copolymeren
Für die Pfropfreaktion der azidterminierten Polymethylmethacrylat-Seitenketten auf die
Rückgratpolymeren aus MMA und Allylmethacrylat wurden aus diesen zuerst Gemische
hergestellt. Mit Oligo(methylmethacrylat-co-allylmethacrylat) (OALMA) als Rückgrat
betrugen die eingesetzten Molverhältnisse von Doppelbindungen zu aufpfropfbaren Azid-
endgruppen der Seitenkettenpolymeren 3,6 zu 2, mit Poly(methylmethacrylat-co-allyl-
methacrylat) (PALMA) als Rückgrat 1,4 zu 2. Die Gemische wurden in Toluol gelöst, und
anschließend wurde das Lösungsmittel abgedampft. Die so hergestellten homogenen, kla-
ren Polymerfilme wurden dann mit 1 K/min von 160°C auf 240°C erhitzt. Die erhaltenen
Produkte wurden anhand der Gelpermeationschromatographie (GPC) und der 1H-NMR-
Spektroskopie untersucht. In Tab. 3.37 sind die Seitenastpolymeren und die Rückgratpo-
lymeren, deren Gemische thermisch induziert zur Reaktion gebracht wurden, aufgelistet.

3 Ergebnisse 141
Tab. 3.37. Zur Pfropfcopolymerisation eingesetzte Seitenast- und Rückgratpolymere.
Gemisch-Nummer Seitenastpolymeres S
(Mn [g/mol])
Rückgratpolymeres R*)
(Mn [g/mol])
1 PMMA1-A (12000) OALMA (1200)
2 PMMA2-A (3200) PALMA (29000)
3 PMMA2-A (3200) OALMA (1200)
4 APMMA1a (6900) PALMA (29000)
5 APMMA1a (6900) OALMA (1200)
6 APMMA1b (8400) OALMA (1200)
7 APMMA2 (5200) PALMA (29000)
8 APMMA2 (5200) OALMA (1200)
9 APMMA3 (10000) OALMA (1200)
10 APMMA5 (5000) OALMA (1200) *) Poly(methylmethacrylat-co-allylmethacrylat) (PALMA) und
Oligo(methylmethacrylat-co-allylmethacrylat) (OALMA)
In Abb. 3.63 sind die flächennormierten GPC-Elugramme der Gemische von APMMA1a
mit einem Molekulargewicht von 6900 g/mol und von OALMA mit 1200 g/mol vor und
nach der Reaktion dargestellt. Bei einem Elutionsvolumen von 11,5 ml erscheint der Peak
des Standards Toluol. Vor der Reaktion der Polymeren zeigt das Elugramm einen Peak bei
ca. 8,75 ml, der dem azidterminierten Polymethylmethacrylat APMMA1a zuzuordnen ist.
Das Oligo(methylmethacrylat-co-allylmethacrylat) (OALMA) liegt bei 10 ml unter dem
Anstieg des Peaks von APMMA1a. Im Elugramm des Films nach der Reaktion ist dieser
Anstieg verschwunden. Dies deutet darauf hin, dass das OALMA in der ursprünglichen
Form nicht mehr vorhanden ist. Dagegen tritt ein Peak mit einer breiten Molekularge-
wichtsverteilung im Bereich von 5,5 bis 9,5 ml auf. Die Fläche des ursprünglichen
APMMA1a-Peaks ist dagegen ca. 1/3 kleiner als vor der Reaktion. Daraus lässt sich
schließen, dass der Hauptanteil des APMMA1a reagiert hat und mit den während der Re-
aktion entstandenen Nitrenendgruppen auf die im Copolymeren aus MMA und ALMA
enthaltenen Doppelbindungen gepfropft wurde. Auch bei der Pfropfreaktion von
APMMA1b auf OALMA verschwindet der Peak des OALMA bei 9,5 ml und der des
APMMA1b bei 8,25 ml verringert sich zu Gunsten eines breiten Peaks bei 5,5 bis 9 ml

3 Ergebnisse 142
(Abb. 3.64). Entsprechend reagieren auch die Polymergemische 1, 3, 8, 9 und 10 mit dem
oligomeren Pfropfrückgrat OALMA.
4 5 6 7 8 9 10 11 12 1
0,0
0,2
0,4
0,6
0,8
1,0
1,2
3
APMMA1a / oligo(MMA-co-ALMA) = 2:1
Film 5 vor Reaktion Film 5 nach Reaktion
norm
. Are
a
Ve (ml)
Abb. 3.63. GPC-Elugramm vor (blau) und nach (rot) der Reaktion im DSC von Film 5
(s. Tab. 3.37); Heizprogramm: 160°C-240°C, 1 K/min.
5 6 7 8 9 10
0,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
11
APMMA1b / oligo(MMA-co-ALMA) = 2:1
norm
. Are
a
APMMA1b Film 6 vor Reaktion Film 6 nach Reakt
Ve (ml)
ion
Abb. 3.64. GPC-Elugramm vor (blau) und nach (rot) der Reaktion im DSC von Film 6
(s. Tab. 3.37); Heizprogramm: 160°C-240°C, 1 K/min.
Bei den Polymergemischen 2, 4 und 7 mit dem Rückgratpolymeren Poly(methylmeth-
acrylat-co-allylmethacrylat) (PALMA) wurde keine Abnahme der Peakflächen und keine
Verschiebung der Peaks zu höheren Molekulargewichten hin festgestellt. Im PALMA ste-
hen dem Angriff zweier Nitrengruppen der Seitenastpolymeren formal 1,4 Doppelbindun-
gen zur Verfügung, wobei sich diese über die Polymerkette von 386 Monomereinheiten

3 Ergebnisse 143
verteilen. Somit ist die Wahrscheinlichkeit extrem gering, dass eine Nitrengruppe mit einer
Allyldoppelbindung der Rückgratkette reagieren kann. Dagegen stehen in den Gemischen
1, 3, 5, 6, 8, 9 und 10 mit OALMA formal 3,6 Doppelbindungen der Polymerkette aus 11
Monomereinheiten für die Pfropfreaktion zweier Azidgruppen zur Verfügung. Um zu prü-
fen, ob tatsächlich eine Pfropfung zwischen den azidterminierten PMMA-
Seitenastpolymeren und dem Rückgratpolymeren OALMA stattgefunden hat und um die
Ergebnisse aus der GPC-Messung zu bestätigen, wurden die Polymergemische 1, 3, 5, 6, 8,
9 und 10 vor und nach der Reaktion mit der 1H-NMR-Spektroskopie untersucht. Dazu
wurden die Integrale der Signale der Allyl- und Allyloxyprotonen vor und nach der Reak-
tion verglichen. Sie wurden auf die Methoxy-Protonen im Gemisch normiert, da deren Ge-
halt konstant bleibt. In Abb. 3.65 ist der Bereich der Allyl- und Allyloxyprotonen des
Films 5 vor und nach der Pfropfung dargestellt.
4.44.64.85.05.25.45.65.86.0
4.7
9.6 8.6
4.44.64.85.05.25.45.65.86.0
2.4
4.8 4.5 4.44.64.85.05.25.45.65.86.0
4.7
9.6 8.6
4.44.64.85.05.25.45.65.86.0
2.4
4.8 4.5
Abb. 3.65. 1H-NMR-Spektrum der Allyl- und Allyloxyprotonen vor (blau) und nach
(rot) der Pfropfreaktion des Films 5 aus APMMA1a und OALMA mit dem
Verhältnis 2/1 in CDCl3 bei Raumtemperatur.
Der Gehalt an Allyl- und Allyloxyprotonen beträgt nach der Pfropfreaktion etwa die Hälfte
des Anteils vor der Pfropfung. Somit müssen ca. 50% der Allyldoppelbindungen gepfropft
worden sein. Das bedeutet, dass formal 1,8 von 3,6 Allylgruppen pro Rückgratkette vor der
Reaktion mit den Azidendgruppen der Seitenastpolymeren reagiert haben müssen. Damit
konnten 80% der eingesetzten Azidendgruppen des Seitenastpolymeren PMMA1a auf das

3 Ergebnisse 144
Rückgratpolymere OALMA gepfropft werden. Auch in den Polymergemischen 1, 3, 6, 8, 9
und 10 verbleiben nach der Pfropfreaktion nur ca. 50% der Allylgruppen des Rückgratpo-
lymeren OALMA im Polymergemisch, so dass etwa 80% der azidterminierten Polymeren
im Pfropfprodukt enthalten sind. Ca. 20% der azidterminierten Polymeren bleiben unge-
pfropft als Homopolymeres im Polymergemisch zurück. Ob die Seitenäste mit dem Rück-
grat tatsächlich über Aziridine verknüpft sind, konnte nicht geprüft werden, da in den 1H-
NMR-Spektren die Signale der Protonen des Aziridins von den Signalen der Protonen der
Hauptkette des Polymeren überdeckt werden.
Aus den Untersuchungen ergibt sich, dass azidterminierte Polymethylmethacrylate grund-
sätzlich erfolgreich auf Copolymerisate aus MMA und ALMA mit etwa 30 mol-% Anteil
an ALMA über die allylischen Doppelbindungen zwischen 160 und 220°C gepfropft wer-
den können.
3.6.3.2 Pfropfung auf EPDM-Terpolymere
Für die Pfropfung der azidterminierten Polymeren auf die Doppelbindungen des kommer-
ziell erhältlichen EPDM-Terpolymeren wurden Gemische hergestellt, in denen das Ver-
hältnis der Doppelbindungen zu Azidendgruppen 87 zu 5 betrug. Aus diesen Polymerge-
mischen wurden durch Lösen in Toluol und anschließendes Abdampfen des Toluols
Masterbatches hergestellt, so dass eine relativ gute Verteilung der Seitenastpolymeren im
EPDM gewährleistet war. Die Masterbatches, deren Zusammensetzung in Tab. 3.38 aufge-
führt ist, wurden dann im Extruder zur Reaktion gebracht.

3 Ergebnisse 145
Tab. 3.38. Für die Pfropfreaktion eingesetzte Masterbatches.
Masterbatch Seitenastpolymeres S
(Mn [g/mol])
Rückgratpolymeres R*)
(Mn [g/mol])
Verhältnis
DB/Azid
1 APS1 (5000) EPDM (130.000) 87/5
2 APS3 (12000) EPDM (130.000) 87/5
3 APS4 (1990) EPDM (130.000) 87/5
4 APS5 (5000) EPDM (130.000) 87/5
5 APMMA1b (8400) EPDM (130.000) 87/5
6 APMMA2 (5200) EPDM (130.000) 87/5 *) Poly(ethylene-co-propylen-co-5-methylene-2-norbornen) (EPDM)
Nach Abschnitt 3.6.1 liegen die Halbwertszeiten des Zerfalls der Azidendgruppen der Sei-
tenastpolymeren zu den Nitrenen bei 160°C zwischen 1 und 15 Stunden und bei 200°C
zwischen 2 und 7 Minuten. Außerdem wurde dort festgestellt, dass zum Vermeiden von
unerwünschten Nebenreaktionen die Konzentration an entstandenem Nitren möglichst ge-
ring zu halten ist. Um diese Nebenreaktionen schon zu Beginn der Pfropfung und vor der
vollständigen Durchmischung des Pfropfastes mit dem Rückgratpolymeren zu verhindern,
muss die Pfropfreaktion also im Bereich von 160 bis 200°C durchgeführt werden. Bei
160°C ist der Nitrengehalt im Reaktionsgemisch dann noch relativ niedrig. Nach einer
vollständigen Durchmischung von Polymeren mit Azidendgruppe und Rückgratpolymeren
kann die Temperatur kontinuierlich erhöht werden, um bei 200°C dann innerhalb weniger
Minuten durch Zerfall der Azidendgruppen eine Pfropfung auf die Rückgratpolymeren zu
erreichen. Daher wurden die Masterbatches bei 140°C in den Extruder gegeben. Innerhalb
einer Minute wurde die Temperatur auf 160°C erhöht und zwei Minuten gehalten. An-
schließend wurde die Temperatur in Schritten von jeweils einer Minute um 20°C erhöht
und zwei Minuten bei der jeweiligen Temperatur, bei 200°C drei Minuten, gehalten.
Schließlich wurden die Umsetzung bei 220°C beendet, indem das Polymere über das Ven-
til abgelassen wurde. Die Umdrehungszahl der Schmelze betrug konstant 120 min-1. Steigt
die Viskosität des Polymeren während der Pfropfreaktion aufgrund der Erhöhung des Mo-
lekulargewichts, sollte auch ein Druckanstieg im Extruder zu verzeichnen sein. Deshalb
wurde während der Pfropfung der Druck im Extruder kontinuierlich verfolgt. In Abb. 3.66
ist die Druckaufnahme des Mikroextruders während der Pfropfung der Masterbatches 2
und 3 mit den azidfunktionalisierten Polystyrolen APS3 und APS4 und der Masterbatches
5 und 6 mit den Polymethylmethacrylat-Seitenästen APMMA1b und APMMA2 gegen die

3 Ergebnisse 146
Versuchsdauer aufgetragen. Die Druckaufnahme zeigt deutlich, dass während des Mi-
schens bei 140 bis 160°C der Druck besonders bei den Mischungen mit den höhermoleku-
laren Seitenastpolymeren stark fällt. Dies kann darauf zurückgeführt werden, dass die Sei-
tenastpolymeren zu Beginn der Reaktion aufgeschmolzen werden und beim Übergang vom
festen Zustand in die Schmelze der Druckaufwand geringer wird. Im weiteren Verlauf des
Versuchs bis zum Ende der Reaktion sinkt der Druck dann nur noch sehr wenig. Weil die
Temperatur kontinuierlich erhöht wird, sinkt auch die Viskosität der Polymerschmelze und
damit der Druck im Extruder. Auch wenn durch die Pfropfung und damit durch die zu-
nehmende Verzweigung und Erhöhung des Molekulargewichts die Viskosität und der
Druck eigentlich ansteigen sollten, könnte die Temperaturerhöhung diesem Effekt entge-
genwirken.
0 2 4 6 8 10 1250
100
150
200
250
300
350
#2: Azido-PS3 (12.000) #3: Azido-PS4 (1.990) #5: Azido-PMMA1b (8.400) #6: Azido-PMMA2 (5.200)
p Ex [N
]
t [min]
Abb. 3.66. Druckaufnahme pEx des Mikroextruders bei den Pfropfversuchen mit APS3
(# 2), APS4 (# 4), APMMA1b (# 5) und APMMA2 (# 6) auf EPDM.
Zur Charakterisierung der Polymeren nach der Reaktion wurden diese mit Hilfe der GPC
mit FTIR-Detektion untersucht. Mit dieser Methode ist es möglich, an jeder Stelle eines
chromatographischen Laufes ein vollständiges FTIR-Spektrum zu erhalten. Ein Teil des
Eluats wird durch einen Konzentrationsdetektor geleitet, der andere Teil wird durch Ver-
dampfen des Lösungsmittels auf einer rotierenden Germaniumscheibe als Spur niederge-
schlagen. Die mit der Probe beschichtete Scheibe wird nach dem Auftragen in einem

3 Ergebnisse 147
FTIR-Spektrometer gemessen. So kann jeder chromatographischen Fraktion ein FTIR-
Spektrum zugeordnet und daraus die Zusammensetzung ermittelt werden.
Zur chromatographischen Auswertung der erhaltenen Daten wurde die sog. Gram-
Schmidt-Darstellung gewählt. Diese stellt ein Chromatogramm über die Summe der Ein-
zelabsorptionen jedes einzelnen Spektrums des gemessenen chromatographischen Laufes
dar. Zusätzlich kann eine Auswertung der Höhenverhältnisse einzelner Absorptionsbanden
des Chromatogramms erfolgen. Bei den Pfropfversuchen mit PMMA als Seitenastpolyme-
rem kann dazu die Absorptionsbande der Carbonylgruppe bei 1730 cm-1, bei denen mit
Polystyrol die Doppelbande der Gerüstschwingung von monosubstituierten Aromaten bei
700 cm-1 im Vergleich zur Doppelbande der aliphatischen >CH2-Valenzschwingung des
EPDM genutzt werden. In Abb. 3.67 werden sowohl die Gram-Schmidt-Rekonstruktion als
auch der Peakhöhenverlauf des Pfropfversuches 6 mit APMMA1b (8400g/mol) auf EPDM
gezeigt. Der Elutionsverlauf des APMMA1b wird durch die Peakhöhe der Carbonylbande
bei 1727 cm-1 und der des EPDM durch die Peakhöhe der Bande bei 2924 cm-1 wiederge-
geben.
Höhenverhältnis: (1727 cm -1) / (2924 cm -1)
0.000.01
0.02
0.03
0.04
0.05
0.06
0.07
0.08
0.09
0.10
0.11
0.12
0.13
0.14
0.15
0.16
0.17
Inte
nsitä
t
12 14 16 18 20 22 24 Zeit (Minuten)
2
4Höhenverhältnis: (1727 cm -1) / (2924 cm -1)
0.000.01
0.02
0.03
0.04
0.05
0.06
0.07
0.08
0.09
0.10
0.11
0.12
0.13
0.14
0.15
0.16
0.17
Inte
nsitä
t
12 14 16 18 20 22 24 Zeit (Minuten)
2
4Höhenverhältnis: (1727 cm -1) / (2924 cm -1)
0.000.01
0.02
0.03
0.04
0.05
0.06
0.07
0.08
0.09
0.10
0.11
0.12
0.13
0.14
0.15
0.16
0.17
Inte
nsitä
t
12 14 16 18 20 22 24 Zeit (Minuten)
2
4Höhenverhältnis: (1727 cm -1) / (2924 cm -1)
0.000.01
0.02
0.03
0.04
0.05
0.06
0.07
0.08
0.09
0.10
0.11
0.12
0.13
0.14
0.15
0.16
0.17
Inte
nsitä
t
12 14 16 18 20 22 24 Zeit (Minuten)
2
4
Gram-
1
Gram-Schmidt # 6 (APMMA1a / EPDM)
1
Gram-
1
Gram-Schmidt # 6 (APMMA1a / EPDM)
1
3333
Abb. 3.67. Gram-Schmidt-Darstellung und Peakhöhenverlauf der charakteristischen
Absorptionsbanden der Produkte des Pfropfversuchs 6 von APMMA1b auf
EPDM.

3 Ergebnisse 148
Die rote Kurve stellt den Gram-Schmidt-Plot dar. Sie ist bimodal und besitzt Maxima bei
Elutionszeiten von 17 min und 20,5 min. Das EPDM-Terpolymere, welches für die Pfropf-
reaktion als Rückgratpolymeres eingesetzt wurde, wird mit einem Molekulargewicht von
130.000 g/mol zuerst eluiert und kann dem Maximum bei 17 min zugeordnet werden.
APMMA1b, dessen Molekulargewicht 8400 g/mol beträgt, wird nach 20,5 min eluiert. Das
gebildete Pfropfprodukt mit EPDM-Rückgrat und PMMA als Seitenästen sollte etwa im
Bereich des EPDM eluiert werden. Nebenprodukte wie Azoverbindungen, die durch Kupp-
lung zweier Nitrene entstehen können, würden dagegen wegen des wesentlich geringeren
Molekulargewichtes im Bereich von 20 min detektiert. Betrachtet man die IR-Spektren in
diesen Bereichen (1, 2, 3 und 4) des Gram-Schmidt-Plots (Abb. 3.68), so wird deutlich,
dass nur bei Elutionszeiten von 20,5 min (1) und 19 min (2) die Absorption der Carbo-
nylgruppe bei 1730 cm-1 zu erkennen ist. Im Bereich von 13 bis 18 min wird lediglich
EPDM eluiert. Das erwartete Pfropfprodukt im hochmolekularen Elutionsbereich kann also
nicht detektiert werden.
20.546 Min.
80
90
100
%T
19.272 Min.
85
90
95
100
%T
18.157 Min.
60
80
100
%T
16.883 Min.
40
60
80
100
%T
1000 1500 2000 2500 3000 3500 Wellenzahlen (cm-1)
2
4
20.546 Min.
80
90
100
%T
19.272 Min.
85
90
95
100
%T
18.157 Min.
60
80
100
%T
16.883 Min.
40
60
80
100
%T
1000 1500 2000 2500 3000 3500 Wellenzahlen (cm-1)
20.546 Min.
80
90
100
%T
19.272 Min.
85
90
95
100
%T
18.157 Min.
60
80
100
%T
16.883 Min.
40
60
80
100
%T
1000 1500 2000 2500 3000 3500 Wellenzahlen (cm-1)
2
4
11
33
Abb. 3.68. FT-IR-Spektren nach 17, 18, 19 und 20,5 min Elutionszeit von Pfropfver-
such 6 von APMMA1a auf EPDM.
Auch bei der Betrachtung des Peakhöhenverhältnisses der betreffenden Banden (blaue
Kurve, Abb. 3.67) wird deutlich, dass der Peak im Bereich bis 18 min lediglich aus reinem
EPDM besteht. Bis zu 18 min verläuft diese Kurve des Peakhöhenverhältnisses parallel zur

3 Ergebnisse 149
Abszisse. Weiterhin ist eindeutig zu erkennen, dass der Gehalt an Methylmethacrylat von
da an über den Elutionspeak mit einem Maximum bei 20,5 min sprunghaft ansteigt und das
Polymere nur aus PMMA besteht. Eine Pfropfung hat demnach nicht stattgefunden. Das
azidterminierte PMMA1b hat also nur zum Kupplungsprodukt, der Azoverbindung rea-
giert. Diese ist dem Elutionsbereich 2 bei 19 min zuzuordnen.
Die Gram-Schmidt-Rekonstruktion und das Verhältnis der Peakhöhen der Gerüstschwin-
gung des monosubstituierten Aromaten bei 700 cm-1 und der Doppelbande der aliphati-
schen >CH2-Valenzschwingung des EPDM für den Pfropfversuch mit azidterminiertem
Polystyrol APS3 (12000 g/mol) auf EPDM sind in Abb. 3.69 dargestellt. Die Kurve des
Gram-Schmidt-Plots besitzt zwei Elutionsbereiche mit Maxima bei 17 und 20 min. Im
hochmolekularen Bereich wird EPDM-Rückgratpolymeres und im niedermolekularen Be-
reich nach ca. 20 min das Polystyrol APS3 eluiert. Das Pfropfprodukt mit PS-Seitenketten
sollte im hochmolekularen Bereich des EPDM zu detektieren sein.
1
Gram-Schmidt # 2 (APS3 / EPDM)
1
Gram-
1
Gram-Schmidt # 2 (APS3 / EPDM)
1
Gram-
2
Höhenverhältnis: (698 cm -1) / (2922 cm -1)
0.000.02
0.04
0.06
0.08
0.10
0.12
0.14
0.16
0.18
0.20
0.22
0.24
0.26
0.28
Inte
nsitä
t
12 14 16 18 20 22 24 Zeit (Minuten)
2
Höhenverhältnis: (698 cm -1) / (2922 cm -1)
0.000.02
0.04
0.06
0.08
0.10
0.12
0.14
0.16
0.18
0.20
0.22
0.24
0.26
0.28
Inte
nsitä
t
12 14 16 18 20 22 24 Zeit (Minuten)
2
Höhenverhältnis: (698 cm -1) / (2922 cm -1)
0.000.02
0.04
0.06
0.08
0.10
0.12
0.14
0.16
0.18
0.20
0.22
0.24
0.26
0.28
Inte
nsitä
t
12 14 16 18 20 22 24 Zeit (Minuten)
2
Höhenverhältnis: (698 cm -1) / (2922 cm -1)
0.000.02
0.04
0.06
0.08
0.10
0.12
0.14
0.16
0.18
0.20
0.22
0.24
0.26
0.28
Inte
nsitä
t
12 14 16 18 20 22 24 Zeit (Minuten)
3333
Abb. 3.69. Gram-Schmidt-Darstellung und Peakhöhenverlauf der charakteristischen
Absorptionsbanden der Produkte des Pfropfversuchs 2 von APS3 auf
EPDM.
Die IR-Spektren der drei Bereiche des Gram-Schmidt-Plots bei den Elutionszeiten von 17,
18 und 20 min sind in Abb. 3.70 gezeigt. Deutlich ist zu erkennen, dass die signifikanten

3 Ergebnisse 150
Banden des Polystyrols, die Gerüstschwingung des monosubstituierten Aromaten bei
700 cm-1 und die typischen Kombinations- und Oberschwingungen des aromatischen Sys-
tems im Bereich von 1700 - 2000 cm-1, nur im Elutionsbereich 1 und 2 auftreten. Im
hochmolekularen Bereich sind lediglich die >CH2-Valenzschwingung des EPDM
2922 cm-1 zu erkennen.
11
2
20.076 Min.
80
90
100
%T
18.325 Min.
80
90
100
%T
17.051 Min.
60
80
100
%T
1000 1500 2000 2500 3000 3500 Wellenzahlen (cm-1)
2
20.076 Min.
80
90
100
%T
18.325 Min.
80
90
100
%T
17.051 Min.
60
80
100
%T
1000 1500 2000 2500 3000 3500 Wellenzahlen (cm-1)
20.076 Min.
80
90
100
%T
18.325 Min.
80
90
100
%T
17.051 Min.
60
80
100
%T
1000 1500 2000 2500 3000 3500 Wellenzahlen (cm-1)
33
Abb. 3.70. FT-IR-Spektren nach 17, 18 und 20 min Elutionszeit von Pfropfversuch 2
von APS3 auf EPDM.
Auch die Darstellung der Peakhöhenverhältnisse zeigt, dass im hochmolekularen Bereich
das Verhältnis praktisch Null ist. Die Kurve verläuft bis zu 18 min parallel zur Abszisse,
somit ist dort kein Polystyrol sondern lediglich EPDM enthalten. Demnach konnte auch
bei diesem Versuch zur Pfropfung von azidterminiertem Polystyrol auf EPDM-
Terpolymeres kein Pfropfprodukt erhalten werden. Auch mit den Seitenastpolymeren
APS1 (5000), APS4 (1990), APS5 (5000) und APMMA2 (5200) wurden keine andere Er-
gebnisse erzielt. Die Ursache könnte darin liegen, dass die Durchmischung der Rückgrat-
polymeren mit den Seitenastpolymeren im Extruder im Bereich der Reaktionstemperatur
der Azide nicht ausreichend war. Dadurch könnte der Anteil der Phasengrenzfläche zu
gering gewesen sein, so dass die Azidendgruppen eher zu Kupplungsreaktionen neigen als
zur Reaktion mit der Doppelbindung der anderen Phase. Eine weitere Reaktionsmöglich-
keit des azidterminierten Polymeren mit sich selbst wäre die Abstraktion von Wasserstoff,
die zur Aminbildung führt. Auch könnte die Konzentration an verfügbaren Doppelbindun-

3 Ergebnisse 151
gen im EPDM zu gering sein, um erfolgreich gepfropft zu werden. Schließlich könnte die
Allylbindung im EPDM für einen Angriff der Azide bzw. Nitrene sterisch zu abgeschirmt
sein, so dass die Reaktion erschwert wird.
Weitere Möglichkeiten wären Pfropfreaktionen mit Polyisopren oder Polybutadien, in de-
nen der Gehalt an zur Reaktion fähigen Doppelbindungen wesentlich höher ist. Zudem
sind die Doppelbindungen im Polyisopren und Polybutadien leichter zugänglich. Aller-
dings neigen diese Polymeren bei den für diese Pfropfung erforderlichen Reaktionstempe-
raturen in hohem Maße zu Vernetzungen. Allerdings könnten die azidterminierten Polysty-
role ABPS1 und ABPS2 eingesetzt werden, bei denen die Azidgruppe direkt an den aroma-
tischen Ring gebunden ist. Dadurch könnten Nebenreaktionen wie die β-H-Abstraktion
wie in Polymeren, in denen die Azide aliphatisch gebundenen sind, vermieden werden.
Solche Untersuchungen stehen aber noch aus.

4 Experimenteller Teil 152
4 Experimenteller Teil
4.1 Meßmethoden
4.1.1 Kernresonanzspektroskopie (NMR)
Die NMR-spektroskopischen Untersuchungen wurden mit den Spektrometern Avance 500
(500 MHz), WM-300 (300 MHz) und AC-300 (75.5 MHz) der Firma Bruker am Institut
für Organische Chemie der TU Darmstadt durchgeführt. Die chemischen Verschiebungen
sind in ppm (δ-Skala) mit Tetramethylsilan als internem Standard angegeben. Als Lö-
sungsmittel dienten deuteriertes Chloroform und DMSO-d6.
Die Multiplizitäten werden folgendermaßen abgekürzt: s = Singulett, d = Dublett, t =
Triplett, q = Quartett, m = Multiplett, b = verbreitertes Signal.
Die 13C-NMR-Spektren sind 1H-breitbandentkoppelt, zur Signalzuordnung wurden DEPT-
oder 1H/13C-korrelierte Spektren hinzugezogen.
4.1.2 FT-IR-Spektroskopie (IR)
Die Infrarotspektren wurden mit dem FT-IR-Spektrometer 8101 M der Firma Shimadzu
mit der Software Spectacle von LabControl GmbH aufgenommen. Die Angabe der Wel-
lenzahl erfolgt in reziproken Zentimetern (cm-1), Schwingungen werden folgendermaßen
abgekürzt: ν = Valenz-, δ = Deformations-, γ = Deformations- (aus der Ebene), τ = Torsi-
onsschwingung.
4.1.3 Mikroanalyse
Die Elementaranalysen wurden im Mikroanalytischen Labor des Instituts für Organische
Chemie der TU Darmstadt mit einem Perkin-Elmer 240 Elemental Analyzer durchgeführt;
bestimmt wurden die Elemente Kohlenstoff, Wasserstoff und Stickstoff.
Alle Angaben sind Massenprozente; die Molekulargewichte besitzen die Einheit g/mol.
4.1.4 Massenspektrometrie
Die Massenspektren wurden mit den Spektrometern Modell MAT 311 A (Datensystem SS-
100 MS) und MAT 212 der Firma Varian am Institut für Organische Chemie der TU

4 Experimenteller Teil 153
Darmstadt aufgenommen. Die Angaben der Masse/Ladungsverhältnisse (m/z) beziehen
sich auf atomare Masseneinheiten; die Ionisierung erfolgte durch Felddesorption (FD) oder
-ionisation (FI) bzw. Elektronenspray-Ionisation (ESI).
4.1.5 Matrixunterstützte Laser-Desorptions/Ionisations-Flugzeit-Massenspek-
trometrie (MALDI-TOF-MS)
Die MALDI-TOF-Massenspektren wurden mit einem Massenspektrometer Kratos Kom-
pact MALDI 3 der Fa. Shimadzu GmbH (Duisburg) aufgenommen. Dazu wurden die Pro-
ben in Aceton gelöst (c = 2 mg/ml) und mit einer Matrixlösung aus 2,5-Dihydroxybenzoe-
säure (c = 10 mg/ml) im Volumenverhältnis 1:1 gemischt. 0,5 µl dieser Mischung wurden
auf den Probenträger aufgetragen. Nach dem Trocknen wurde der Probenträger mit 100
Pulsen eines bei 337 nm emittierenden Stickstofflasers schrittweise belichtet.
4.1.6 Dynamic Scanning Calorimetry (DSC)
Die Glastemperaturen der Polymeren, die Schmelz- bzw. Siedepunkte der Initiatoren und
die Reaktionstemperaturen der Azide wurden mit einem Differential-Raster-Kalorimeter
(DSC) DuPont 2001 mit dem Messkopf 912 mit einer Heizrate von 10 K/min bzw.
20 K/min bestimmt. Die Auswertung der Messdaten erfolgte mit der General Analysis Uti-
lity Version 4.00 der Firma DuPont Instruments.
4.1.7 Dünnschicht- und Säulenchromatographie
Der Reaktionsverlauf und die Reinheit der Produkte (Initiatoren) wurden dünnschicht-
chromatographisch unter Verwendung von Kieselgel 60 F254-Fertigplatten der Fa. Merck,
Darmstadt bestimmt. Die Substanzflecken wurden durch Bestrahlen mit UV-Licht der
Wellenlänge 254 nm detektiert.
Die säulenchromatographische Reinigungen und Trennungen der Reaktionsprodukte wur-
den mit Kieselgel LiChroprep Si60 (Korngröße 25-40µm) der Fa. Merck, Darmstadt,
durchgeführt.
Zum Entfernen des Kupferkatalysators aus den Polymerlösungen wurde neutrales Alumi-
niumoxid (0,05-0,15mm) der Fa. Fluka verwendet.
Genaue Angaben über die verwendeten Laufmittel sind in den jeweiligen Arbeitsvorschrif-
ten vermerkt.

4 Experimenteller Teil 154
4.1.8 Gaschromatographie (GC)
Zur Umsatzbestimmung wurde der Monomergehalt mit einem Gaschromatographen GC
8160 der Firma Fisons Instruments mit einem Probengeber AS 800 und der Aufnahme-
software Chrom-Card 1.21 ermittelt. Zum Trennen der Substanzen diente eine Kapillarsäu-
le SPBTM-5 (30 m x 0,53 m, 0,5µm Film) der Firma SUPELCO.
4.1.9 Gelpermeationschromatographie (GPC)
Die Gelpermeationschromatographie wurde mit einer Säulenkombination der Fa. Waters
(Ultrastyragel, Porengröße 1x105, 2x104, 2x103 und 1x102 nm) mit THF als Laufmittel
durchgeführt. Als Detektoren dienten ein Differentialrefraktometer R401 und bei 254 nm
ein UV-Detektor der Fa. Waters. Zum Eichen wurden PS- und PMMA-Standards verwen-
det.
4.1.10 GPC mit Lichtstreudetektion
Die GPC-Analyse mit Lichtstreudetektion wurde in THF mit einer Flussrate von 1 ml/min
durchgeführt. Dazu wurde ein Säulensatz aus 3 Säulen (PL-Gel mixed B, mixed C, mixed
D, jeweils 30 x 0,8 cm2) verwendet. Zur Detektion der Probe diente der Lichtstreu-
Detektor DAWN EOS der Fa. Wyatt Technologies (Santa Barbara, USA). Die Datenauf-
nahme und -auswertung erfolgte mit der Software Astra Version 4.73 der Fa. Wyatt Tech-
nologies.
4.1.11 GPC-LCCC-Kopplung
Die Kopplung der Chromatographie am kritischen Punkt der Adsorption mit der Gelper-
peationschromatographie erfolgte über ein Injektionsventil mit zwei Speicherschleifen von
200 µL. Für die Chromatographie am kritischen Punkt der Adsorption wurde dabei eine
Phenomex CN 100 Å Säule eingesetzt. Für die GPC diente eine PSS SDV lin XL Säule.
Als Detektoren wurden ein UV-Detektor der Fa. Waters bei 254 nm und ein Evaporative
Light Scattering Detektor 500 der Fa. Altech verwendet.

4 Experimenteller Teil 155
4.1.12 GPC-FTIR-Kopplung
Für die FTIR-Messungen wurde ein Spektrometer der Firma Nicolet Instrument GmbH,
Typ Protégé 460, eingesetzt. Zum Messen und Auswerten wurde die Software Omnic Ver-
sion 3.1 der gleichen Firma verwendet. Die Auflösung für alle Spektren betrug 4 cm-1 bei
einem Messbereich von 600-4000 cm-1, wofür das Optik-Modul der Firma Lab Connecti-
ons verwendet wurde. Nach vorheriger Aufnahme eines Hintergrundspektrums von einer
mit reinem Lösungsmittel besprühten Position der Scheibe wurden die online-Messungen
bei rotierender Germaniumscheibe ausgeführt. Die Rotationsgeschwindigkeit entsprach
dabei der beim Auftragen verwendeten.
4.2 Chemikalien und Lösungsmittel
4.2.1 Lösungsmittel und Reagenzien
Die für die Reaktionen verwendeten Lösungsmittel und Reagenzien sind kommerziell er-
hältliche Produkte der Firmen Acros, Fluka bzw. Sigma-Aldrich. Sie wurden nach Stan-
dardmethoden gereinigt.
4.2.2 Monomere
Methylmethacrylat und Styrol wurden zum Entstabilisieren mit 0,2 N Natronlauge ausge-
schüttelt, mit entionisiertem Wasser neutral gewaschen, über Calciumchlorid getrocknet
und entgast[124].
4.2.3 Katalysatoren
CuCl und CuBr wurden durch mehrfaches Rühren und Abdekantieren bei Raumtemperatur
mit Eisessig und anschließendes Waschen mit Ethanol gereinigt[125].
Die aliphatischen Amine, Bipyridine und Phenanthroline wurden in handelsüblicher Form
eingesetzt.
N,N-Bis(2-pyridylmethyl)octylamin (BPMOA) wurde am Center for Macromolecular En-
gineering an der Carnegie Mellon University in Pittsburgh, Pennsylvania, USA herge-
stellt[126] und als Ligand für die ATRP von MMA und Styrol zur Verfügung gestellt.

4 Experimenteller Teil 156
Herstellung von 4,4’-Di-(5-nonyl)-2,2’-bipyridin (dNbpy)
Zu 250 ml abs. THF und 48 mL (0,34 mol) Diisopropylamin (über CaH2 getrocknet und
destilliert) werden unter Stickstoffatmosphäre bei –78°C 150 mL n-BuLi (2,5 M in Hexan,
0,375 mol) zugetropft. Die gelbe Suspension wird 2 h bei –78°C gerührt. Danach werden
14,7 g (0,08 mol) des zuvor aus Ethanol umkristallisierten und in 400 mL abs. THF gelös-
tem 4,4’-Dimethyl-2,2’-bipyridin langsam zugegeben und weitere 2 h bei –78°C gerührt.
Zur dunkelbraunen Mischung werden 51,5 mL (0,48 mol) 1-Brombutan gegeben, das Käl-
tebad entfernt und langsam über Nacht auf Raumtemperatur erwärmt. Danach wird die
braune Lösung in 1 L kalte NaCl-Lösung gegossen. Die wässrige Phase wird anschließend
dreimal mit 100 mL Essigsäureethylester extrahiert. Die vereinigten organischen Phasen
werden über MgSO4 getrocknet, und das Lösungsmittel wird abgezogen. Das orangefarbe-
ne viskose Öl wird zur Kristallisation zwei Wochen im Kühlschrank aufbewahrt. Feine
weiße Kristalle werden durch Kristallisation aus Methanol erhalten.
Ausb.: 30 g (94%) (Lit.[127,128]) 1H-NMR (300 MHz, CDCl3), δ in ppm:
8,51 (d, 2H, ArH6), 8,17 (d, 2H, ArH3), 7,15 (dd, 2H, ArH5), 2,52 (m, 2H, C-CH-), 1,57
(m, 8H, CH-CH2-), 1,13 (m, 16H, CH-CH2-CH2-CH3), 0,75 (t, 12H, -CH3) ppm
4.3 Synthese der Initiatoren
4.3.1 2-Brompropionsäure-2-azidoethylester (AEBP) und 2-Brom-2-methyl-
propionsäure-2-azidoethylester (AEBiB)
2-Azidoethanol
In einem 100 mL-Kolben werden 6,7 mL (8,05 g, 100 mmol) 2-Chlorethanol und 25, 6 g
(400 mmol) Natriumazid in 75 mL 1N Natriumhydroxidlösung gelöst und 12 h bei Raum-
temperatur gerührt. Anschließend wird die Lösung auf 50°C erhitzt und weitere 24 h ge-
rührt. Nach Abkühlen auf Raumtemperatur wird die wässrige Lösung mit Na2SO4 gesättigt
und fünfmal mit 50 mL Dichlormethan ausgeschüttelt. Die vereinigten organischen Phasen
werden mit Na2SO4 getrocknet, und das Lösungsmittel wird abgezogen. Die gelbliche
Flüssigkeit wird über eine kurze Aluminiumoxid-Säule chromatographisch gereinigt; dabei
wird eine klare Flüssigkeit erhalten.

4 Experimenteller Teil 157
Ausb.: 8,4 g (96%) 1H-NMR (300 MHz, CDCl3), δ in ppm:
3,78 (t, 2H, C-CH2-O), 3,44 (t, 2H, C-CH2-N), 2,17 (s, 1H, C-OH) ppm
FT-IR (cm-1): 3600-3200 (b) (O-H), 2100 (s) (-N3)
2-Brompropionsäure-2-azidoethylester (AEBP)
In einem 250mL-Kolben werden 2,0 g (23 mmol) 2-Azidoethanol und 2,56 g (25,3 mmol)
TEA in 50 mL Dichlormethan in Stickstoffatmosphäre vorgelegt. Unter Eiskühlung wer-
den dann 5,46 g (25,3 mmol) 2-Brompropionsäurebromid in 50 mL Dichlormethan lang-
sam zugetropft. Die Mischung wird über Nacht bei Raumtemperatur gerührt. Nach fünfma-
ligem Waschen der organischen Phase mit 50 mL Wasser und anschließendem Trocknen
mit MgSO4 wird das Lösungsmittel abgezogen. Die verbleibende gelbbraune Flüssigkeit
wird säulenchromatographisch (Silicgel, (Dichlormethan/Petrolether V:V, 2:1) gereinigt,
wobei eine klare Flüssigkeit erhalten wird.
Ausb.: 3,3 g (65%)
Sdp.: 124°C 1H-NMR (300 MHz, CDCl3), δ in ppm:
4,36 (q, 1H, C(Br)-CH-C), 4,32 (t, 2H, C-CH2-O), 3,50 (t, 2H, C-CH2-N), 1,78 (d, 3H, C-
CH3) ppm
FT-IR (cm-1): 2110 (s) (-N3), 1740 (s) (-COO)
ESI MS: 245 (AEBP + Na+)
2-Brom-2-methylpropionsäure-2-azidoethylester (AEBiB)
In einem 250mL-Kolben werden 8,7 g (100 mmol) 2-Azidoethanol und 11,13 g (110
mmol) TEA in 50 mL Dichlormethan in Stickstoffatmosphäre vorgelegt. Unter Eiskühlung
werden dann 25,3 g (110 mmol) 2-Brom-2-methylpropionsäurebromid in 50 mL Dichlor-
methan langsam zugetropft. Die Mischung wird über Nacht bei Raumtemperatur gerührt.
Nach fünfmaligem Waschen der organischen Phase mit 50 mL Wasser und anschließen-
dem Trocknen mit MgSO4 wird das Lösungsmittel abgezogen. Die verbleibende braune
Flüssigkeit wird destillativ gereinigt, wobei eine klare Flüssigkeit erhalten wird.

4 Experimenteller Teil 158
Ausb.: 20,3 g (86%)
Sdp.: 192°C 1H-NMR (300 MHz, CDCl3), δ in ppm:
4,34 (t, 2H, C-CH2-O), 3,52 (t, 2H, C-CH2-N), 1,96 (s, 6H, C-CH3) ppm
FT-IR (cm-1): 2105 (s) (-N3), 1740 (s) (-COO)
ESI MS: 259 (AEBiB + Na+)
4.3.2 4-Azidobenzylbromid (ABB)
p-Azidotoluol
In einem 500 mL–Kolben werden 10,7 g (100 mmol) p-Toluidin in 200 mL 6N Salzsäure
und 40 mL konz. Schwefelsäure gelöst. Unter kräftigem Rühren und Eiskühlung werden
dann langsam 8,28 g (120 mmol) Natriumnitrit in 20 mL Wasser zugegeben. Nach beende-
ter Diazotierung wird zur Suspension 13,0 g (200 mmol) Natriumazid in 40 mL Wasser
zugetropft und bei 0°C weitere 5 h gerührt. Anschließend wird die Lösung filtriert, der
Rückstand mit kaltem Wasser gewaschen und in Toluol umkristallisiert. Man erhält einen
hellgelben Feststoff.
Ausb.: 12,86 g (97%)
Schmp.: 153°C 1H-NMR (300 MHz, CDCl3), δ in ppm:
7,15 (d, 2H, ArH, JHH = 8,1 Hz), 6,92 (d, 2H, ArH, JHH = 8,5 Hz), 4,48 (s, 2H, C-CH3)
FT-IR (cm-1): 2110 (s) (-N3)
ESI MS: 156 (p-Azidotoluol + Na+)
4-Azidobenzylbromid (ABB)
12,68 g (95,2 mmol) p-Azidotoluol werden zusammen mit 16,75 g (95,2 mmol) N-
Bromsuccinimid in 450 mL Tetrachlorkohlenstoff gelöst und 24h unter Rückfluss erhitzt.
Nach weiteren 24h Rühren bei Raumtemperatur wird der Rückstand abfiltriert und die Lö-
sung eingeengt. Die verbleibende rotbraune Flüssigkeit wird destillativ gereinigt, wobei
eine klare Flüssigkeit erhalten wird.
Ausb.: 14,31 g (71%)

4 Experimenteller Teil 159
Sdp.: 149°C 1H-NMR (300 MHz, CDCl3), δ in ppm:
7,38 (d, 2H, ArH, JHH = 8,8 Hz), 6,99 (d, 2H, ArH, JHH = 8,4 Hz), 4,48 (s, 2H, CH2-Br)
FT-IR (cm-1): 2105 (s) (-N3)
ESI MS: 235 (ABB + Na+)
4.3.3 Bis(2-brom-2-methylpropanoyloxy)ethan (EGBiB)
In einem 100 mL-Kolben werden 8,3 g (135 mmol) Ethylenglycol mit 49,5 g (297 mmol)
2-Brom-2-methylpropionsäure und 4 g Dowex 50WX2-100 Kationenaustauscher versetzt
und am Wasserabscheider unter Rückfluss und vermindertem Druck erhitzt, bis sich kein
Wasser mehr abscheidet. Nach der Reaktion wird das Reaktionsgemisch auf Raumtempe-
ratur abgekühlt und die Mutterlauge zum Entfernen des Ionenaustauschers filtriert. Danach
wird die Lösung mit Diethylether versetzt und dreimal mit einer gesättigten Natriumbicar-
bonat-Lösung ausgeschüttelt. Anschließend wird mit Magnesiumsulfat getrocknet, das
Lösungsmittel abgezogen und die gelbliche Flüssigkeit zur Kristallisation drei Tage im
Kühlschrank aufbewahrt. Nach Rekristallisation aus Diethylether werden weiße Nadeln
erhalten.
Ausb.: 22,3 g (45,9%) (Lit.[129]: 28%)
Schmp.: 50°C 1H-NMR (300 MHz, CDCl3), δ in ppm:
4,42 (s, 4H, C-CH2-O), 1,92 (s, 12H, C(Br)-CH3) ppm
ESI MS: 383 (EGBiB + Na+)
C10H16Br2O4 gef. (ber.), C 33,40% (33,36%), H 4,49% (4,48%)
4.3.4 1,1,1-Tris(4-(2-brom-2-methylpropanoyloxy)phenyl)ethan (TBiBPE)
In einem 500 mL-Dreihalskolben mit Rückflusskühler werden unter Stickstoffatmosphäre
bei 0°C (Eiskühlung) 20 mL (37,2 g, 161,8 mmol) 2-Brom-2-methylpropionylbromid in
200 mL abs. THF vorgelegt. Über einen Tropftrichter werden 14,16 g (46,23 mmol) 1,1,1-
Tris(4-hydroxyphenyl)ethan und 39 mL (28,1 g, 277,4 mmol) Triethylamin in 200 mL
THF innerhalb von 5 h unter Rühren zugetropft. Die Mischung wird über Nacht auf Raum-
temperatur erwärmt. Die Salze werden abfiltriert, und das Lösungsmittel wird am Rotati-

4 Experimenteller Teil 160
onsverdampfer abgezogen. Danach wird der Rückstand in Ethylacetat aufgenommen, mit
5-proz. Natronlauge und dreimal mit Wasser ausgeschüttelt. Die organische Phase wird mit
Magnesiumsulfat getrocknet und das Lösungsmittel anschließend abgezogen. Das hellbei-
ge Produkt wird durch Kristallisation aus einem Gemisch von Ethylacetat/n-Hexan (V:V
1:1) erhalten.
Ausb.: 24,5 g (70,3%) (Lit.[129]: 55%)
Schmp.: 268°C 1H-NMR (300 MHz, CDCl3), δ in ppm:
7,07-6,95 (dd, 12H, ArH), 2,11 (s, 3H, C(Ar)-CH3), 2.00(s, 18H, C(Br)-CH3) ppm
ESI MS: 775 (TBiBPE + Na+)
C32H33Br3O6 gef. (ber.), C 51,09% (51,02%), H 4,42% (4,42%)
4.3.5 Tetrakis(2-brom-2-methylpropanoyloxy)-2,2-dimethylpropan (PTBiB)
In einem 500 mL-Dreihalskolben mit Rückflusskühler werden unter Stickstoffatmosphäre
bei 0°C (Eiskühlung) 3,7 g (27 mmol) Pentaerythrit mit 18,8 mL (13,6 g, 135 mmol) TEA
in 100 mL abs. THF vorgelegt. Über einen Tropftrichter werden 15 mL (27,9 g,
121,4 mmol) 2-Brom-2-methylpropionylbromid in 50 mL THF innerhalb von 5 h unter
Rühren zugetropft. Die Mischung wird über Nacht auf Raumtemperatur erwärmt. Die Sal-
ze werden abfiltriert, die Lösung mit Diethylether versetzt und mit Natriumhydrogencar-
bonat-Lösung gewaschen. Anschließend wird mit Wasser ausgeschüttelt, die organische
Phase mit Magnesiumsulfat getrocknet und das Lösungsmittel abgezogen. Durch Kristalli-
sation aus einem Gemisch von Diethylether / n-Hexan (V:V 5:1) werden farblose Kristalle
erhalten.
Ausb.: 10,3 g (52,6%) (Lit.[129]: 41%)
Schmp.: 138°C 1H-NMR (300 MHz, CDCl3), δ in ppm:
4,24 (s, 8H, C-CH2-O), 1,88 (s, 24H, C(Br)-CH3) ppm
ESI MS: 755 (PTBiB + Na+)
C21H32Br4O8 gef. (ber.), C 34,48% (34,45%), H 4,45% (4,40%)

4 Experimenteller Teil 161
4.3.6 Tetrakis(2,2-bis((2-brom-2-methylpropanoyloxy)methyl)propanoyloxy)-
2,2-dimethylpropan (8PBiB)
2,2-Bis((2-brom-2-methylpropanoyloxy)methyl)propionsäure (BMPA) (Precursor)
Zu einer Lösung aus 9,05 g (67,5 mmol) 2,2-Bis(hydroxymethyl)propionsäure und
23,5 mL (17,05 g, 168,5 mmol) TEA in 150 mL Dichlormethan werden unter Eiskühlung
in Stickstoffatmosphäre 20 mL (37,2 g, 162 mmol) 2-Brom-2-methylpropionylbromid in
50 mL Dichlormethan getropft. Das Gemisch wird 2 h bei 0°C gerührt und über Nacht auf
Raumtemperatur erwärmt. Das Lösungsmittel wird abgezogen, der Rückstand in Diethyl-
ether aufgenommen, und die Salze werden abfiltriert. Anschließend wird mit 2N Salzsäure
ausgeschüttelt und die organische Phase mit Magnesiumsulfat getrocknet. Nach Entfernen
des Lösungsmittels werden durch Kristallisation aus n-Hexan weiße Kristalle erhalten.
Ausb.: 33 g (51%)
Schmp.: 98°C
Sdp.: 291°C 1H-NMR (300 MHz, CDCl3), δ in ppm:
9,26 (b, 1H, -COOH), 4,34 (d, 2H, C-CH2-O, JHH = 11,35 Hz), 4,28 (d, 2H, C-CH2-O,
JHH = 11,03 Hz), 1,85 (s, 12H, C(Br)-CH3), 1,31 (s, 3H, C-CH3) ppm
ESI MS: 455 (BMPA + Na+)
C13H20Br2O6 gef. (ber.), C 36,23% (36,10%), H 4,45% (4,46%)
Tetrakis(2,2-bis((2-brom-2-methylpropanoyloxy)methyl)propanoyloxy)2,2-
dimethylpropan (8PBiB)
In einem 500 mL-Dreihalskolben mit Rückflusskühler werden unter Stickstoffatmosphäre
bei Raumtemperatur 9.5 g (22.0 mmol) 2,2-Bis((2-brom-2-methylpropanoyloxy)me-
thyl)propionsäure (BMPA) und 0.68 g (5.0 mmol) Pentaerythrit in 200 mL Dichlormethan
gelöst. Anschließend werden im Stickstoffgegenstrom 6.2 g (30.0 mmol) Dicyclohexylcar-
bodiimid zugegeben. Nach 2h wird bei 0°C (Eiskühlung) 0.5 g (2.0 mmol) 4-(Dimethyl-
amino)-pyridin zugegeben und die Mischung über Nacht auf Raumtemperatur erwärmt.
Die Salze werden abfiltriert, und das Lösungsmittel wird am Rotationsverdampfer abgezo-
gen. Der Rückstand wird in Ethylacetat aufgenommen und säulenchromatographisch (Sili-
cagel, Ethylacetat / n-Hexan (V:V 1:1)) gereinigt. Nach Entfernen des Lösungsmittels wird

4 Experimenteller Teil 162
ein gelbes zähes viskoses Produkt erhalten. Das nach 2 d Lagern im Eisfach kristallisierte
Nebenprodukt wird selektiv mit Aceton herausgelöst.
Ausb.: 5,3 g (59,5%)
Tg: -13°C Nebenprodukt: Schmp.: 175°C 1H-NMR (300 MHz, CDCl3), δ in ppm:
4,36 (d, 8H, C-CH2-O, JHH = 11,12 Hz), 4,25 (d, 8H, C-CH2-O, JHH = 11,14 Hz), 4,19 (s,
8H, C-CH2-O), 1,85 (s, 48H, C(Br)-CH3), 1,25 (s, 12H, C-CH3) ppm
Nebenprodukt, δ in ppm:
4,45 (d, 2H, C-CH2-O, JHH = 11,35 Hz), 4,25 (d, 2H, C-CH2-O, JHH = 11,40 Hz)
ESI MS: 1835 (8PBiB + Na+)
473 (Nebenprodukt + Na+)
C21H32Br4O8 gef. (ber.), C 34,48% (34,45%), H 4,45% (4,40%)
4.4 Synthese der Polymeren
Allgemeine Arbeitsvorschrift zur ATRP:
In einem Einhalskolben werden Kupfersalz, Ligand, Monomeres und Initiator und evtl.
Lösungsmittel gemischt und mit einem Gummiseptum versehen. Es wird etwa 10-15 min
gerührt, bis alle Komponenten gelöst sind. Anschließend wird das Gemisch durch drei
Einfrier-Auftau-Zyklen entgast, und unter Stickstoff zur Polymerisation in ein auf Reakti-
onstemperatur beheiztes Ölbad überführt. In regelmäßigen Abständen werden dem Ge-
misch mit Hilfe von Spritzen Proben entnommen, mit THF verdünnt und sowohl Umsatz
als auch Molekulargewicht bestimmt. Die Polymerisation wird nach der Zeit t durch ra-
sches Abkühlen auf Raumtemperatur beendet. Das Gemisch wird mit THF versetzt und
solange bei Raumtemperatur an der Luft gerührt, bis der Kupferkatalysator vollständig
oxidiert ist. Der Ansatz wird über eine Aluminiumoxidsäule filtriert, um den Katalysator
zu entfernen. Das Polymere wird dann in Methanol ausgefällt und i. Vak. bei 40°C ge-
trocknet.
Zum Herstellen der Blockcopolymeren wird das betreffende Polymere als Initiator für die
ATRP des zweiten Monomeren eingesetzt und nach der gleichen Vorschrift verfahren.

4 Experimenteller Teil 163
4.5 Pfropfreaktionen
4.5.1 Pfropfung im Differential-Raster-Kalorimeter
Die azidterminierten Polymeren und die Rückgradpolymeren werden zusammen in Toluol
gelöst. Das Lösungsmittel wird dann langsam bei Raumtemperatur abgedampft. Nach voll-
ständiger Trocknung werden 5 – 10 mg der Polymerfilme in Aluminiumpfännchen gege-
ben und im DSC-Gerät mit einer Heizrate von 1 K/min bei 160 bis 220°C zur Reaktion
gebracht. Nach der Reaktion werden die Produkte aus den Pfännchen entnommen und mit
GPC und 1H-NMR untersucht.
4.5.2 Pfropfung im Mikroextruder
Zur Pfropfung im Mikroextruder wird ein Zweischnecken-Mikroextruder der Firma DSM
mit einem Füllvolumen von 5 cm3 (Abschnitt 2.6) verwendet. Zum Herstellen der Master-
batches wird EPDM zusammen mit dem jeweiligen azidterminierten Thermoplasten in
Toluol gelöst und das Lösungsmittel anschließen bei Raumtemperatur langsam abge-
dampft. Nach vollständiger Trocknung werden die so hergestellten Masterbatches in Strei-
fen geschnitten oder zu Strängen gerollt und innerhalb von 30 s in den auf Reaktionstem-
peratur geheizten Mikroextruder gegeben. Danach wird die Drehzahl von 50 min-1 auf 200
min-1 erhöht und die Zeitmessung gestartet. Die Druckaufnahme wird jede Minute regist-
riert. Während der Reaktion wird der Raum oberhalb der Schnecken mit Stickstoff gespült.
Zur Probenentnahme während der Reaktion wird das Ventil kurz aufgedreht und ein Teil
des Pfropfproduktes herausgedrückt. Vor und nach der Probenentnahme und vor und nach
der Temperaturerhöhung wird ebenfalls jeweils die Druckaufnahme beobachtet. Am Ende
der Reaktion wird das Pfropfprodukt als Strang erhalten. Danach wird der Mikroextruder
geöffnet und das restliche Produkt dem Rücklaufkanal entnommen.

5 Zusammenfassung 164
5 Zusammenfassung
Ziel dieser Arbeit war die Herstellung wohldefinierter Polymerarchitekturen durch radika-
lische Polymerisation mittels Atomtransfer (ATRP). Zunächst wurde die ATRP von Me-
thylmethacrylat (MMA) mit Kupferkomplexen mit unterschiedlichen Liganden in ver-
schiedenen Medien untersucht. Aus den Ergebnissen wurde ein geeignetes System zur
Herstellung von Blockcopolymeren aus MMA und Styrol ausgesucht; damit wurden linea-
re, aber auch sternförmige Blockcopolymere sowie Gradientencopolymere aus MMA und
Styrol synthetisiert. Außerdem wurde geprüft, ob sich durch ATRP von MMA bzw. Styrol
hergestelltes PMMA und Polystyrol, welches anschließend an den Endgruppen modifiziert
wurde, für Pfropfreaktionen eignet. Dazu wurden Doppelbindungen enthaltende Polymere
mit den endgruppenfunktionalisierten PMMA- und Polystyrol-Ketten in der Schmelze zur
Reaktion gebracht.
(1) Zum Herstellen von Blockcopolymeren aus MMA und Styrol durch ATRP ist es
notwendig, Polymere mit enger Molmassenverteilung und hohem Gehalt an End-
gruppen zu synthetisieren, die dann als Makroinitiatoren für die Polymerisation eines
zweiten Monomeren eingesetzt wurden können. Systeme, die bei der ATRP von Sty-
rol zu Polymeren mit hohem Endgruppengehalt führen, waren schon ausführlich be-
schrieben, dagegen war die ATRP von Methylmethacrylat noch wenig untersucht.
Deshalb wurde MMA in verschiedenen Lösungsmitteln und mit verschiedenen Kata-
lysatorsystemen, die aus einem Kupferhalogenid und Stickstoffliganden bestehen,
polymerisiert. Aus den Untersuchungen ergab sich, dass die ATRP von MMA so-
wohl in Anisol, Toluol als auch Ethylacetat durchgeführt werden kann. Die Ge-
schwindigkeit der ATRP von MMA steigt exponentiell mit zunehmender Konzentra-
tion an MMA im Polymerisationssystem an. Bei sehr hohen Konzentrationen von
MMA, besonders bei der ATRP von MMA in Masse, ist ein beträchtlicher Anteil an
Nebenreaktionen wie Kettenabruch und –übertragung unvermeidbar, weil die wach-
senden Ketten dann nicht schnell genug durch den Kupfer-Katalysator deaktiviert
werden.
Die Liganden haben einen großen Einfluss auf die Lage des für die Kontrolle der Po-
lymerisation wichtigen Aktivierung- und Deaktivierungsgleichgewichtes, das auf
dem Redoxgleichgewicht zwischen Cu(I)- und Cu(II)-Komplexen beruht. Von den
untersuchten aliphatischen Aminen, Bipyridinen und Phenanthrolinen als Liganden

5 Zusammenfassung 165
eignen sich für die ATRP von MMA N,N,N’,N’’,N’’’,N’’’-Hexamethyltriethylen-
tetramin (HMTETA), 4,4’-Di-(5-nonyl)-2,2’-bipyridin (dNbpy) und N,N-Bis(2-
pyridylmethyl)octylamin (BPMOA) besonders gut, weil die damit hergestellten Sys-
teme bis zu hohen Umsätzen homogen sind. Die Konzentration an aktiven Radikalen
bleibt während der Polymerisation konstant, weil sie durch die Lage des Re-
doxgleichgewichtes niedrig gehalten wird. Die Rückreaktion des Aktivierung- und
Deaktivierungsgleichgewichtes vom Cu(II)- zum Cu(I)-Komplex und damit von der
wachsenden Polymerkette zur deaktivierten Spezies ist schneller als die Hinreaktion
zur aktiven Ketten. Dadurch kommt es kaum zu Abbruchreaktionen. Dies führt dazu,
dass der Gehalt an Endgruppen (Halogen) der deaktivierten Spezies sehr hoch ist und
die erhaltenen Polymeren sehr enge Molekulargewichtsverteilungen und Molekular-
gewichte besitzen, die über das Monomer/Initiator-Verhältnis und den Umsatz an
MMA genau eingestellt werden können. Dabei spielt es keine Rolle, ob der Katalysa-
tor (Komplex) bei der ATRP aus Kupfersalz und Ligand in situ generiert oder vorher
hergestellt und dann zum Polymerisationsgemisch gegeben wird.
(2) Lineare AB- und ABA-Blockcopolymere aus MMA und Styrol mit PMMA-
Innenblock konnten mit Hilfe der ATRP durch sequentielle Monomeraddition erhal-
ten werden. Für die Herstellung der ABA-Blockcopolymeren wurde der bifunktionel-
le Initiator Bis(2-brom-2-methylpropanoyloxy)ethan (EGBiB) synthetisiert, von dem
aus die Ketten in zwei Richtungen wachsen. Zuerst wurde MMA mit den zuvor ge-
nannten Systemen zum PMMA-Makroinitiator mit hohem Endgruppengehalt poly-
merisiert. Dieser PMMA-Makroinitiator wurde dann nach seiner Isolierung im zwei-
ten Schritt zur ATRP von Styrol zu Blockcopolymeren eingesetzt. Die Zusammen-
setzungen und Molekulargewichte der Blockcopolymeren entsprechen den angestreb-
ten Werten, die sich aus den bei der Polymerisation verbrauchten Monomeren und
den eingesetzten Monomer/Initiator-Verhältnissen ergeben. Dies konnte mit Hilfe der
2D-Chromatographie (LC-CC gekoppelt mit GPC) bestätigt werden. Weiterhin konn-
te durch 2D-Chromatographie bewiesen werden, dass die erhaltenen Blockcopolyme-
ren mit enger Molekulargewichtsverteilung keine PMMA-Homopolymere enthalten.
Ein sequentieller Ablauf in umgekehrter Reihenfolge, wobei zuerst Styrol zum Mak-
roinitiator und dann anschließend MMA polymerisiert wird, gelingt nicht, weil die
Initiationsgeschwindigkeit von Polystyrolmakroinitiatoren im Vergleich zur Wachs-

5 Zusammenfassung 166
tumsgeschwindigkeit von MMA bei der ATRP zu gering ist, so dass die Blockcopo-
lymeren einen hohe Anteil an Homopolystyrol enthalten.
(3)
(4)
Drei-, vier-, acht- und 22armige Sternblockcopolymere aus MMA und Styrol konnten
wie die linearen Blockcopolymeren mit definierten Molekulargewichten und enger
Molekulargewichtsverteilung durch ATRP erhalten werden. MMA wurde im ersten
Schritt mit den für die Herstellung der Sterne synthetisierten Initiatoren, dem trifunk-
tionellen 1,1,1-Tris(4-(2-brom-2-methylpropanoyloxy)phenyl)ethan (TBiBPE), dem
tetrafunktionellen Tetrakis(2-brom-2-methylpropanoyloxy)-2,2-dimethylpropan
(PTBiB), dem octafunctionellen Tetrakis(2,2-bis((2-brom-2-methylpropanoyloxy)-
methyl)propanoyloxy)2,2-dimethylpropan (8PBiB) und dem Oligo((2-brom-2-
methylpropionyloxy)-2-ethylmethacrylat) (OBEMA) mit 22 funktionellen Grupppen,
polymerisiert. Die sternförmigen PMMA-Makroinitiatoren wurden dann für die
ATRP von Styrol zu den Sternblockcopolymeren eingesetzt. Anhand der 2D-
Chromatographie konnte bewiesen werden, dass die erhaltenen Sternblockcopolyme-
ren wie die linearen Blockcopolymeren kein PMMA-Homopolymeres enthalten.
Durch GPC mit Lichtstreudetektion konnte bestätigt werden, dass die realen Moleku-
largewichte der Sternblockcopolymeren den bei der ATRP von MMA und Styrol
durch das eingesetzte Monomer/Initiator-Verhältnis und das verbrauchte Monomere
erwarteten Werten entsprechen. Die in den GPC-Elugrammen der Sternblockcopo-
lymeren auftretenden Schultern bei etwa dem doppelten Molekulargewicht des Sterns
konnten als durch Kopplung zweier Sterne entstandene hantelförmige Polymere iden-
tifiziert wurden. Diese treten als Nebenprodukte in konzentrierten Polymerisationslö-
sungen bei Monomer-Umsätzen über 70% auf.
Gradientencopolymere, in denen ein fließender Übergang vom Styrolblock zum
MMA-Block entlang der Ketten vorliegt, konnten ebenfalls mit Hilfe der ATRP her-
gestellt werden. Aufgrund der bei der ATRP viel höheren Reaktivität von MMA im
Vergleich zu Styrol wird MMA schneller als Styrol polymerisiert; dadurch entstehen
bei Zugabe beider Monomerer zu Beginn der ATRP Polymere, die hauptsächlich
MMA enthalten, jedoch kaum Segmente mit mehreren aufeinander folgenden Styro-
leinheiten. Deshalb wurde zum Herstellen von Gradientencopolymeren aus MMA
und Styrol im ersten Schritt Styrol vorpolymerisiert. Dann wurde dem Polymerisati-
onsgemisch MMA zudosiert, welches sich so nach und nach neben Styrol in die Po-

5 Zusammenfassung 167
lymerkette einbauen ließ. Aufgrund der stetig abnehmenden Konzentration an Styrol
wurde schließlich am Ende der Polymerkette ausschließlich MMA angelagert. Auf
diese Weise konnten Gradientencopolymere hergestellt werden, deren kurze Endblö-
cke aus MMA und Styrol etwa gleich lang sind. Der fließende Übergang von Styrol
zu MMA entlang der Polymerkette besteht aus einer Sequenz, die etwa gleiche Mas-
senanteile MMA und Styrol enthält. Die Verteilung der Monomerbausteine konnte
mit Hilfe der 1H-NMR und der 2D NOESY NMR-Spektroskopie bestimmt und der
fließende Übergang entlang den Polymerketten bestätigt werden.
(5) Das von niedermolekularen Aziden bekannte Reaktionsverhalten gegenüber ungesät-
tigten Verbindungen durch thermisch induzierten Zerfall des Azids unter Abspaltung
von molekularem Stickstoff zum Nitren, welches aufgrund des Elektronenmangels
äußerst reaktionsfähig ist und mit ungesättigten Verbindungen reagieren kann, wurde
auf Polymere übertragen und zu Pfropfversuchen eingesetzt. Für die Pfropfung von
PMMA bzw. Polystyrol auf Doppelbindungen enthaltende Rückgratpolymeren wur-
den durch ATRP von MMA und Styrol Polymethylmethacrylate und Polystyrole her-
gestellt. Durch Substitution des Halogens am Kettenende der Polymeren durch Azid
wurden daraus azidterminierte Polymere gewonnen, die als Seitenäste für die Pfropf-
versuche eingesetzt wurden. Außerdem wurden die Initiierung von MMA und Styrol
durch ATRP mit Hilfe der erstmals synthetisierten, Azidgruppen tragenden Initiato-
ren 2-Brompropionsäure-2-azidoethylester (AEBP), 2-Brom-2-methylpropionsäure-
2-azidoethylester (AEBiB) und 4-Azidobenzylbromids (ABB) mit arylischer Azid-
gruppe PMMA und Polystyrol mit definierten Molekulargewichten und enger Vertei-
lung synthetisiert, die am Polymerkettenende pro Polymerkette eine Azidgruppe ent-
halten und so direkt für Pfropfreaktionen einsetzt werden konnten.
Die Halbwertszeiten und Aktivierungsenergien des Zerfalls der Azidgruppen im Po-
lymeren und damit die erforderlichen Reaktionszeiten und –temperaturen für die
Pfropfung der azidterminierten Polymeren auf die Doppelbindungen enthaltenden
Rückgratpolymeren konnten mit Hilfe der bei DSC-Messungen auftretenden Wärme-
tönung über den Arrhenius-Ansatz ermittelt wurden. Der Azidzerfall erstreckt sich
über einen Temperaturbereich von 45 bis zu 70 K und liegt zwischen 170 und 265°C.
Die Halbwertszeiten des Zerfalls der Azidendgruppen der Polymeren liegen bei
200°C im Bereich von 1 bis 8 Minuten. Die Länge der Polymerketten hat keinen Ein-
fluss auf die Aktivierungsenergie und auf den Temperaturbereich des Zerfalls. Dage-

5 Zusammenfassung 168
gen existiert ein Effekt der Substituenten am Kettenende. Die Aktivierungsenergie
der durch Substitution des Halogens durch Azid am Kettenende synthetisierten
Polystyrole PS-A ist etwa 20 bis 30 kJ/mol s kleiner als die des durch ATRP mit
Azidinitiator hergestellten A-PS. Die Estergruppe in Nachbarschaft zur Azidgruppe
im A-PS erniedrigt die Elektronendichte am Azid stärker als die Phenylgruppe im
PS-A. Im A-BPS befindet sich die Azidgruppe direkt am aromatischen Ring, der die
Elektronendichte am Stickstoff so stark erniedrigt, dass die Aktivierungsenergie
zusätzlich um etwa 25 kJ/mol s im Vergleich zu A-PS erhöht wird. Dagegen wird im
PMMA-A die Abspaltung von molekularem Stickstoff vom tertiären Kohlenstoff mit
Estergruppe im Vergleich zur Abspaltung vom primären Kohlenstoff im A-PMMA
erschwert, was eine Erhöhung der Aktivierungsenergie um etwa 30 bis 40 kJ/mol s
verursacht. Somit nimmt die Aktivierungsenergie der Dissoziationsreaktion der Azid-
endgruppe der Polystyrole mit aromatischer Azidendgruppe (A-BPS) über die mit
primärer aliphatischer Azidendgruppe (A-PS) bis hin zu den Polystyrolen mit
sekundärer Azidendgruppe (PS-A) ab. Die Aktivierungsenergie der Dissoziation der
Azidendgruppe der Polymethylmethacrylate ist für PMMA mit aliphatischer primärer
Azidgruppe (A-PMMA) geringer als für PMMA mit tertiärer Azidendgruppe
(PMMA-A).
(6)
(7)
Um die Pfropfreaktion zu vereinfachen und eine Entmischung der Polymeren zu
vermeiden, wurden dem PMMA chemisch ähnliche Copolymere aus MMA und Al-
lylmethacrylat durch ATRP synthetisiert. Von diesen Copolymeren mit ungesättigten
Seitengruppen konnten mit PMMA homogene Mischungen herstellen wurden, die
thermisch bei 160 bis 220°C im DSC mit einer Heizrate von 1 K/min zur Reaktion
gebracht wurden. Anhand der Gelpermeationschromatographie (GPC) und der 1H-
NMR-Spektroskopie konnte bewiesen wurden, dass mit Oligo(methylmethacrylat-co-
allylmethacrylat) (OALMA) als Rückgrat mit etwa 30 mol-% ALMA-Bausteinen bei
Azid/Doppelbindungs-Verhältnissen von 2 zu 3,5 in den Gemischen 80% der Azid-
endgruppen der Seitenastpolymeren auf das Rückgratpolymere OALMA gepfropft
wurden. 20% der azidterminierten Polymeren bleiben ungepfropft als Homopolyme-
res im Polymergemisch zurück.
Als weiteres Rückgratpolymeres wurde für die Pfropfversuche mit den azidterminier-
ten Seitenästen das Terpolymere EPDM verwendet. Weil die Polymeren unmischbar
sind, wurden die Reaktionen im Extruder durchgeführt, der eine ausreichende

5 Zusammenfassung 169
Durchmischung und einen optimalen Kontakt der Phasen gewährleisten sollte. Für
die Pfropfung wurden Polymergemische eingesetzt, bei denen das molare Verhältnis
von Doppelbindungen zu Azidendgruppen 87 zu 5 betrug. Die Gemische wurden als
Masterbatches bei 140°C in den Extruder gegeben und dann bei 160°C bis 220°C in-
nerhalb von 10 min zur Reaktion gebracht. Mit Hilfe der mit der FTIR-Spektroskopie
gekoppelten GPC konnten keine Pfropfprodukte sondern lediglich Kopplungsproduk-
te der azidterminerten Polymeren nachgewiesen werden. Eine Ursache hierfür könnte
darin liegen, dass die Durchmischung der Rückgratpolymeren mit den Seitenastpo-
lymeren im Extruder im Bereich der Zerfallstemperatur der Azide nicht ausreichend
war. Dadurch könnte der Anteil der Phasengrenzflächen zu gering gewesen sein, so
dass die Azidendgruppen eher zu Kupplungsreaktionen neigen als zur Reaktion mit
den Doppelbindungen in der anderen Phase. Ferner ist denkbar, dass die Allylbin-
dung im EPDM für einen Angriff der Azide bzw. Nitrene sterisch zu abgeschirmt
sein kann, so dass die Reaktion erschwert wird.

6 Literatur 170
6 Literatur
[1] M. Szwarc, A. Rembaum, J. Polym. Sci., Part A: Polym. Chem. 22 (1956) 189.
[2] M. Szwarc, M. Levy, L. Milkovich, J. Am. Chem. Soc. 78 (1956) 2656.
[3] B. Keoshkerian, M. K. Georges, D. Boils-Boissiers, Macromolecules 28 (1995)
6381.
[4] M. K. Georges, R. P. N. Veregin, P. M. Kazmaier, G. K. Hamer, Trends Polym.
Sci. 2 (1995) 66.
[5] M. Miyamoto, M. Sawamoto, T. Higashimura, Macromolecules 17 (1984) 265.
[6] K. R. Faust, J. P. Kennedy, Polym. Bull. (Berlin) 15 (1986) 317.
[7] H. G. Elias, Makromoleküle, Vol. 2 (Hüthig & Wepf Verlag, Basel, Heidelberg,
New York, 1992).
[8] D. Greszta, D. Mardare, K. Matjaszewski, Macromolecules 27 (1994) 638.
[9] J. Qiu, K. Matjaszewski, Acta Polym. 48 (1997) 169.
[10] Y. Kotani, M. Kato, M. Kamigaito, M. Sawamoto, Macromolecules 29 (1996)
6979.
[11] T. Nishikawa, T. Ando, M. Kamigaito, M. Sawamoto, Macromolecules 30 (1997)
2244.
[12] N. A. Listigovers, M. K. Georgesm, P. G. Odell, B. Keoshkerian, Macromolecules
29 (1996) 8992.
[13] K. Matyjaszewski, Controlled-living radical polymerization: Progress in ATRP,
NMP and RAFT, Vol. 768 (American Chemical Society, Washington, DC, 2000).
[14] D. P. Curran, Synthesis (1988) 489.
[15] J. S. Wang, K. Matyjaszewski, J. Am. Chem. Soc. 117 (1995) 5614.
[16] M. Kato, M. Kamigaito, M. Sawamoto, T. Higashimura, Macromolecules 28
(1995) 1721.
[17] V. Percec, B. Barboiu, H.-J. Kim, J. Am. Chem. Soc. 120 (1998) 305.
[18] K. Matyjaszewski, Macromol. Symp. 134 (1998) 105.
[19] J. K. Kochi, Organometallic Mechanisms and Catalysis (Academic Press, Inc.,
New York, 1978).
[20] J. Qiu, K. Matyjaszewski, Macromolecules 30 (1997) 5643.
[21] K. Matyjaszewski, Macromolecules 31 (1998) 4710.
[22] J. Xia, K. Matyjaszewski, Macromolecules 32 (1999) 5199.
[23] J. P. A. Heuts, R. Mallesch, T. P. Davis, Macromol. Chem. Phys. 200 (1999) 1380.

6 Literatur 171
[24] D. Greszta, K. Matyjaszewski, Polym. Prep. (Am. Chem. Soc., Polym. Div.) 37(2)
(1996) 569.
[25] D. M. Haddleton, M. C. Crossman, K. H. Hunt, Macromolecules 30 (1997) 3992.
[26] K. Matyjaszewski, V. Coessens, Y. Nakagawa, J. Xia, J. Qiu, S. Gaynor, S. Coca,
C. Jasieczek, Functional Polymers. Modern Synthetic Methods and Novel Struc-
tures Vol. 704 (ed. A. O. Patil, Schulz, D. N., Novak, B. M.) (American Chemical
Society, Washington, DC, 1998).
[27] J.-S. Wang, K. Matyjaszewski, Macromolecules 28 (1995) 7901.
[28] H. J. Fischer, J. Polym. Sci., Part A: Polym. Chem. 37 (1999) 1885.
[29] N. K. Singha, B. Klumperman, Macromol. Rapid Commun. 21 (2000).
[30] K. Matyjaszewski, T. E. Patten, J. Xia, J. Am. Chem. Soc. 119 (1997) 674.
[31] K. Davis, H.-j. Paik, K. Matyjaszewski, Macromolecules 32 (1999) 1767.
[32] J.-L. Wang, T. Grimaud, K. Matyjaszewski, Macromolecules 30 (1997) 6507.
[33] A. Kajiwara, K. Matyjaszewski, M. Kamachi, Macromolecules 31 (1998) 5695.
[34] K. Matyjaszewski, S. Coca, S. G. Gaynor, Y. Nakagawa, S. M. Jo (US 5789487,
1996).
[35] K. Matyjaszewski, Macromol. Symp. 111 (1996) 47.
[36] K. Matyjaszewski, S. Coca, S. G. Gaynor, M. Wei, B. E. Woodworth, Macromole-
cules 30 (1997) 7348.
[37] T. E. Patten, J. Xia, T. Abernathy, K. Matyjaszewski, Science 272 (1996) 866.
[38] G. Kickelbick, H.-j. Paik, K. Matyjaszewski, Macromolecules 32 (1999) 2941.
[39] T. E. Patten, K. Matyjaszewski, Adv. Mater. 10 (1998) 901.
[40] K. Matyjaszewski, Chem. Eur. J. 5 (1999) 3095.
[41] T. E. Patten, K. Matyjaszewski, Acc. Chem. Res. 32 (1999) 895.
[42] G. Kickelbick, K. Matyjaszewski, Macromol. Rapid Commun. 20 (1999) 341.
[43] J. Xia, X. Zhang, K. Matyjaszewski, Transition Metal Catalysis in Macromolecular
Design Vol. 760 (eds. L. S. Boffa & B. M. Novak) (American Chemical Society,
Washington, DC, 2000).
[44] Y. Shen, S. Zhu, F. Zeng, R. Pelton, Macromol. Chem. Phys. 201 (2000) 1169.
[45] M. Destarac, J. M. Bessière, B. Boutevin, Macromol. Rapid Commun. 18 (1997)
967.
[46] G. L. Cheng, C. P. Hu, S. K. Ying, Macromol. Rapid Commun. 20 (1999) 303.
[47] G. L. Wang, C. P. Hu, S. K. Ying, Polymer 40 (1999) 2167.

6 Literatur 172
[48] J. Xia, K. Matyjaszewski, Polym. Prepr. (Am. Chem. Soc., Div. Polym. Chem.)
40(1) (1999) 442.
[49] X. Wan, S. K. Ying, J. Appl. Polym. Sci. 75 (2000) 802.
[50] J. Xia, K. Matyjaszewski, Macromolecules 30 (1997) 7697.
[51] B. Yu, E. J. Ruckenstein, J. Polym. Sci., Part A: Polym. Chem. 37 (1999) 4191.
[52] F. Simal, A. Demonceau, A. F. Noels, Angew. Chem., Int. Ed. Engl. 38 (1999) 538.
[53] J. Qiu, T. Pintauer, S. Gaynor, K. Matyjaszewski, Polym. Prepr. (Am. Chem. Soc.,
Div. Polym. Chem.) 40(1) (1999) 420.
[54] B. J. Hathaway, Comprehensive Inorganic Chemistry (Pergamon, Oxford, 1987).
[55] P. C. Healy, C. Pakawatchai, A. H. White, J. Chem. Soc., Dalton Trans. (1985)
2531.
[56] A. J. Pallenberg, K. S. Koenig, D. M. Barnhart, Inorg. Chem. 34 (1995) 2833.
[57] M. Munakata, S. Kitagawa, A. Asahara, H. Masuda, Bull. Chem. Soc. Jpn. 60
(1987) 1927.
[58] A. T. Levy, M. M. Olmstead, T. E. Patten, Inorg. Chem. 39 (2000) 1628.
[59] G. Kickelbick, U. Reinohl, T. S. Ertel, H. Bertagnolli, K. Matyjaszewski, Polym.
Prep. (Am. Chem. Soc., Polym. Div.) 40(2) (1999) 334.
[60] G. Kickelbick, U. Reinohl, T. S. Ertel, H. Bertagnolli, K. Matyjaszewski, ACS
Symp. Ser. 768 (2000) 211.
[61] G. Kickelbick, U. Reinohl, T. S. Ertel, A. Weber, H. Bertagnolli, K. Maty-
jaszewski, Inorg. Chem. 40 (2001) 6.
[62] T. Pintauer, G. Kickelbick, K. Matyaszewski, Inorg. Chem. 40 (2001) 2818.
[63] K. Davis, J. O'Malley, H.-j. Paik, K. Matyjaszewski, Polym. Prepr. (Am. Chem.
Soc., Div. Polym. Chem.) 38(2) (1997) 687.
[64] D. Rein, P. Rempp, P. Lutz, Makromol. Chem., Macromol. Symp. 67 (1993) 237.
[65] A. D. Jenkins, J. Macromol. Sci., Pure App. Chem. A 31 (1994) 1377.
[66] P. Rempp, D. Decker, J. Polym. Sci., Part C: Polym. Lett. 16 (1968) 4027.
[67] S. S. Sheiko, M. Gerle, K. Fischer, M. Schmidt, M. Möller, Langmuir 13 (1997)
5368.
[68] M. Janata, L. Lochmann, J. Brus, P. Holler, Z. Tuzar, P. Kratochvil, B. Schmitt, W.
Radtke, A. H. E. Müller, Macromolecules 30 (1997) 7370.
[69] D. Geiser, H. Höcker, Macromolecules 13 (1980) 653.
[70] J. Roovers, M. Toporowski, Macromolecules 16 (1983) 843.
[71] G. Hild, H. Kohler, P. Rempp, Eur. Polym. J. 16 (1980) 525.

6 Literatur 173
[72] R. P. Quirk, J. Ma, Polym. Prepr. (Am. Chem. Soc., Div. Polym. Chem.) 29(1)
(1988) 10.
[73] J. Ma, Macromol. Symp. 91 (1995) 41.
[74] U. Bayer, R.Stadler, Macromol. Chem. Phys. 195 (1994) 2709.
[75] O. W. Webster, Macromol. Symp. 98 (1995) 1361.
[76] P. Rempp, E. Franta, J.-E. Herz, Adv. Polym. Sci. 82 (1988) 146.
[77] P. Rempp, P. Lutz, Macromol. Symp. 67 (1993) 1.
[78] J. M. Yu, P. Dubois, R. Jerome, Macromolecules 29 (1996) 7316.
[79] M. Arnold, S. Hofmann, R. Weidisch, G. H. Michler, A. Neubauer, S. Poser, Mac-
romol. Chem. Phys. 199 (1998) 31.
[80] C. D. Deporter, T. E. Long, J. E. McGrath, Polym. Int. 33 (1994) 205.
[81] C. Tsitsilianis, P. Lutz, S. Graff, J. P. Lamps, P.Rempp, Macromolecules 24 (1991)
5897.
[82] C. J. Hawker, Trends Polym. Sci. 4 (1996) 183.
[83] R. T. A. Mayadunne, E. Rizzardo, J. Chiefari, Y. K. Chong, G. Moad, S. H. Thang,
Macromolecules 32 (1999) 6977.
[84] D. A. Shipp, J.-L. Wang, K. Matyjaszewski, Macromolecules 31 (1998) 8005.
[85] W. Liu, Y. Yang, C. Chen, Y. Chen, F. Xi, Macromol. Chem. Phys. 198 (1997)
279.
[86] A. Mühlebach, S. G. Gaynor, K. Matyjaszewski, Macromolecules 31 (1998) 6046.
[87] J.-S. Wang, P. Bayard, R. Jerome, S. K. Varshney, P. Teyssie, Macromolecules 27
(1994) 4890.
[88] C. Auschra, R. Stadler, Polym. Bull. (Berlin) 30 (1993) 257.
[89] J. M. Yu, P. Dubois, R. Jerome, Macromolecules 30 (1997) 6536.
[90] N. Hadjichristidis, L. J. Fetters, Macromolecules 13 (1980) 191.
[91] J. Feldthusen, B. Ivan, A. H. E. Müller, Macromolecules 31 (1998) 578.
[92] P. J. Miller, K. Matyjaszewski, Macromolecules 32 (1999) 8760.
[93] H.-J. Paik, M. Teodorescu, J. Xia, K. Matyjaszewski, Macromolecules 32 (1999)
7023.
[94] A. Kajiwara, K. Matyjaszewski, Macromolecules 31 (1998) 3489.
[95] D. J. Worsfold, J. G. Zilliox, P. Rempp, Canad. J. Chem. 47 (1969) 3379.
[96] J. Xia, X. Zhang, K. Matyjaszewski, Macromolecules 32 (1999) 4482.
[97] M. K. Mishra, S. M. Shirodkar, A. K. Jung (US 5552491, 1996).
[98] X. Zhang, J. Xia, K. Matyjaszewski, Macromolecules 33 (2000) 2340.

6 Literatur 174
[99] J. E. L. Roovers, S. Bywater, Macromolecules 5 (1972) 384.
[100] J.-S. Wang, D. Greszta, K. Matyjaszewski, Polym. Mater. Sci. Eng. 73 (1995) 416.
[101] K. Matyjaszewski, P. J. Miller, E. Fossum, Y. Nakagawa, Appl. Organometal.,
Chem. Eur. J. 12 (1998) 667.
[102] J. Ueda, M. Kamigaito, M. Sawamoto, Macromolecules 31 (1998) 6762.
[103] H. Eschwey, W. Burchard, Polymer 16 (1975) 180.
[104] M. Xanthos, S. S. Dagli, Polym. Eng. Sci. 31 (1991) 929.
[105] O. Schacker, Dissertation, Technische Universität Darmstadt (2001).
[106] P. M. P. Lutz, G. Beinert, P. Rempp, Polym. Bull. (Berlin) 12 (1984) 79.
[107] W. Radke, A. H. E. Müller, Makromol. Chem., Macromol. Symp. 54/55 (1992) 583.
[108] M. Xanthos, Reactive Extrusion: Principles and Practice (Hanser, München, 1996).
[109] A. Grefenstein, Reaktive Extrusion und Aufbereitung: Maschinentechnik und Ver-
fahren (Hanser, München, 1996).
[110] G. E. Molau, J. Polym. Sci., Part A: Polym. Chem. 3 (1965) 1267.
[111] M. Wintermantel, M. Gerle, K. Fischer, M. Schmidt, I. Wataoka, K. Urakawa, Y.
Tsukahara, Macromolecules 29 (1996) 978.
[112] W. Radke, A. H. E. Müller, Makromol. Chem., Macromol. Symp. 54/55 (1992) 583.
[113] D. J. Meier, J. Polym. Sci., Part C: Polym. Lett. 26 (1969) 81.
[114] T. Hogen-Esch, A. Zagala (US 5610248, 1997).
[115] J. Kubasch, Dissertation in Vorbereitung, TU Darmstadt.
[116] K. Matyjaszewski, J.-L. Wang, T. Grimaud, D. A. Shipp, Macromolecules 31
(1998) 1527.
[117] W. Radke, Macromol. Theory Simul. 10 (2001) 668.
[118] J. Gerber, W. Radke, G. Wittmann, Polymer 44 (2003) 519.
[119] A. M. Aerdts, J. W. d. Haan, A. L. German, Macromolecules 24 (1991) 1473.
[120] M. Gehbauer, K. Bühler, Kunststoffe 82 (1992) 21.
[121] V. Coessens, Y. Nakagawa, K. Matyjaszewski, Polym. Bull.(Berlin) 40 (1998) 135.
[122] V. Coessens, K. Matyjaszewski, J. Macromol. Sci., Pure Appl. Chem. A 36 (1999)
667.
[123] D. Braun, K. J. Kuhn, H. Meid, E. H. Hellmann, G. P. Hellmann, J. Polym. Mater.
11 (1994) 197.
[124] D. Braun, H. Cherdron, H. Ritter Praktikum der Makromolekularen Stoffe (Wiley-
VCH, Weinheim, 1999).
[125] R. N. Keller, H. D. Wycoff, Inorg. Synth. 2 (1946) 1.

6 Literatur 175
[126] Z. Tyeklar, R. R. Jacobson, N. Wei, N. N. Murthy, J. Zubieta, K. D. Karlin, J. Am.
Chem. Soc. 115 (1993) 2677.
[127] K. D. Bos, J. G. Kraaijkamp, J. G. Noltes, Synth. Commun. 9 (1979) 497.
[128] F. M. El Torki, R. H. Schmehl, W. F. Reed, J. Chem. Soc., Faraday Trans. 85
(1989) 349.
[129] K. Matyjaszewski, P. J. Miller, J. Pyun, G. Kickelbick, S. Diamanti, Macromole-
cules 32 (1999) 6526.

Eidesstattliche Erklärung
Hiermit erkläre ich an Eides Statt, dass ich meine Dissertation selbständig und nur mit den
angegebenen Hilfsmitteln angefertigt und noch keinen Promotionsversuch unternommen ha-
be.
Darmstadt,

Lebenslauf Name Gabriele Wittmann Anschrift Kasinostraße 14
64293 Darmstadt Geburtsdatum/-ort 02.11.1969 in Heidelberg Familienstand ledig Eltern Edeltraud Wittmann, geb. Braun
Heinz Wittmann
Schulbildung 1975 - 1979 Grundschule, Albert-Schweitzer-Schule in Heidelberg 1979 - 1987 Helmholtz-Gymnasium in Heidelberg 1987 - 1989 Deutsche Evangelische Oberschule in Kairo/Ägypten
Abschluss: Abitur
Studium Oktober 1989 Beginn des Studiums Chemie an der Ruprecht-Karls-Universität
in Heidelberg April 1993 Wechsel des Studienorts an die Technische Universität Darm-
stadt März 1994 Diplom-Vorprüfung April 1997 Diplom-Hauptprüfungen Juli 1997 - März 1998 Diplomarbeit unter der Leitung von Prof. Dr. Dr. h.c. D. Braun
Promotion und Auslandsaufenthalt Mai 1998 – August 2002 Dissertation unter der Leitung von Prof. Dr. Dr. h.c. D. Braun April 2000 – August 2000 Forschungsaufenthalt im Arbeitskreis von Prof. K. Matyjas-
zewski an der Carnegie Mellon University, Pittsburgh, USA
Berufstätigkeit Seit September 2002 Sympatex Technologies GmbH in Wuppertal Darmstadt,