Falk Gastro-Kolleg PankreasFalk Gastro-Kolleg Pankreas Fragebeantwortung unter Falk Gastro-Kolleg 25...
Transcript of Falk Gastro-Kolleg PankreasFalk Gastro-Kolleg Pankreas Fragebeantwortung unter Falk Gastro-Kolleg 25...

Falk Gastro-Kolleg
Pankreas
Fragebeantwortung unter
www.falkfoundation.de
Falk Gastro-Kolleg
25
PankreaskarzinomZusammenfassung
Trotz umfangreicher Forschungsanstrengungen und Verbesserungen der Chemotherapie hat das Pankreaskarzinom immer noch eine schlechte Prognose. Ein entscheidendes Problem stellt nach wie vor die fehlende Möglichkeit einer frühzeitigen Diagnose dar. Nur eine kleine Gruppe von Patienten mit früh diagnostiziertem, lokal begrenztem Tumor hat potenziell Aussicht auf eine Heilung durch eine R0Resektion. Der Nutzen einer adjuvanten Chemotherapie mit Gemcitabin oder 5Fluorouracil (5FU) als Monotherapie über 6 Monate gilt als gesichert. Der Mehrzahl der Erkrankten kann aufgrund der späten Diagnose nur eine palliative Therapie angeboten werden mit dem Ziel, die Lebensqualität zu verbessern und eine Lebensverlängerung von einigen Monaten zu erreichen. Eine Verbesserung der Prognose in der Palliativsituation könnte durch multimodale Therapieansätze und durch komplexere Chemotherapieprotokolle bei entsprechend selektioniertem Patientengut erreicht werden.
Schlüsselwörter
Pankreaskarzinom | Diagnose | Therapie | adjuvante Chemotherapie | palliative Therapie
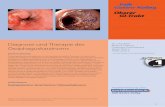
Titelbild: Hepatisch metastasiertes Pankreasschwanzkarzinom.
Dr. J. RingelProf. Dr. J. MayerleProf. Dr. M.M. Lerch*Universitätsmedizin GreifswaldKlinik und Poliklinik für Innere Medizin AFriedrich-Loeffler-Str. a Greifswald
*korrespondierender Autor

26
Pankreaskarzinom
Einführung
Entsprechend der funktionellen Differenzierung des Pankreas unterscheidet man exokrine und endokrine Tumoren. Mit einem Anteil von ca. 85% ist das duktale Adenokarzinom der weitaus häufigste maligne Pankreastumor.Das Adenokarzinom des Pankreas gehört zu den häufigsten Krebstodesursachen in westlichen Ländern und nimmt in der Krebstodesursachenstatistik der USA die fünfte Stelle ein. Die durchschnittliche Inzidenz beträgt zwischen 9 und 12 Neuerkrankte auf 100.000 Einwohner pro Jahr sowohl in Deutschland als auch in anderen westeuropäischen Ländern. Hierbei sind Männer etwas häufiger betroffen als Frauen (Ratio 1,3:1). Autopsiestudien belegen, dass das Pankreaskarzinom darüber hinaus für zusätzliche 25–40% der CUPSyndrome, der Karzinome mit unbekanntem Primärtumor, verantwortlich ist. In Deutschland versterben daran jedes Jahr mehr als 11.000 Menschen. Die Inzidenz des Pankreaskarzinoms nimmt mit dem Lebensalter zu und so ist die Mehrzahl der Betroffenen älter als 60 Jahre. Die Prognose des Pankreaskarzinoms ist mit einer 5JahresÜberlebensrate zwischen 0,4–2% sehr schlecht. Etwa 65% aller Patienten versterben innerhalb der ersten 6 Monate nach Diagnosestellung. Die niedrige Überlebenszeit ist hauptsächlich durch die späte Diagnosestellung, aber auch durch die Tumorbiologie des Pankreaskarzinoms bedingt. Über 80% der Patienten sind zum Zeitpunkt der Diagnose bereits durch Metastasen oder durch Infiltration benachbarter Organe inoperabel. Etwa 70% der Karzinome treten im Kopfbereich des Pankreas und im Processus uncinatus auf. Im Korpusbereich findet sich etwa ein Fünftel der Tumoren. Karzinome im Kaudabereich sind seltener, aber wegen der erst spät einsetzenden Symptome mit einer besonders schlechten Prognose vergesellschaftet.
Risikofaktoren
Mehrere Risikofaktoren gelten als ursächlich beteiligt an der Entstehung des Pankreaskarzinoms. Einerseits sind dies Umweltfaktoren und Lebensgewohnheiten, andererseits Vor und Begleiterkrankungen. Rauchen gilt als der am besten belegte und in Studien reproduzierbare Risikofaktor [1]. Das Risiko steigt proportional zum Nikotinkonsum, wobei von einer durchschnittlichen Verdopplung des Risikos auszugehen ist. Daneben gelten Pestizide und eine fettreiche Ernährung als Risikofaktoren. Wie bei anderen malignen Neoplasien, z. B. dem kolorektalen Karzinom und dem Mammakarzinom, geht eine Adipositas mit einem erhöhten Pankreaskarzinomrisiko einher. Ein BodyMassIndex (BMI) von ≥ 30 kg/m² ist mit einem signifikant erhöhten Pankreaskarzinomrisiko assoziiert. Studien haben nachgewiesen, dass Diabetiker gegenüber NichtDiabetikern ein etwa doppelt so hohes Risiko für ein Pankreasadenokarzinom haben. Eine langjährige chronische Pankreatitis ist ebenfalls mit einem erhöhten Risiko assoziiert [2]. Hier steigert sich das Risiko nach 20 Jahren auf 4%. Entsprechend der Studienlage stellen bestimmte definierte Erbkrankheiten und Tumorsyndrome wahrscheinlich die stärksten Risikofaktoren dar (Tab. 1) [3, 4].
P Wichtige Risikofaktoren sind Rauchen, eine langjährige chronische Pankreatitis, Adipositas und erbliche Tumorsyndrome.
Tab. 1Hereditäre Tumorsyndrome und ihr Pankreaskarzinomrisiko (nach [3, 4])
Syndrom/Erkrankung Pankreaskarzinomrisiko
Hereditäres BrustOvarialkarzinomSyndrom (HBOC) 3–4fach
Hereditäre Pankreatitis 70–100fach
PeutzJeghersSyndrom Über 100fach
Familiäres atypisches multiples Muttermal und Melanom (FAMMM)Syndrom
13–52fach
Familiäres Pankreaskarzinom Etwa 57fach

27
Pathogenese
Die Gründe für das aggressive Wachstum und die frühe Metastasierung des Pankreasadenokarzinoms werden bis heute nur teilweise verstanden. Die derzeitigen Vorstellungen zur Ätiologie/Pathogenese des duktalen Adenokarzinoms basieren auf einem sequenziellen Progressionsmodell, ähnlich der von Vogelstein für das kolorektale Karzinom postulierten AdenomKarzinomSequenz. Über die Zeit akkumulieren Mutationen in Protoonkogenen und Tumorsuppressorgenen, sodass sich aus morphologisch definierten präneoplastischen Veränderungen über das Stadium der Hyper und Dysplasie ein Pankreaskarzinom entwickeln kann. Noch nicht geklärt ist, ob es sich dabei wirklich um eine lineare Sequenz handelt und wie die zeitliche Progression der einzelnen Stadien verläuft. Als Ausgangspunkt für das duktale Adenokarzinom wurden hyperplastischpapilläre Läsionen des Gangepithels identifiziert. Davon ausgehend können pankreatische intraepitheliale Neoplasien (PanINs) der Grade 1–3 unterschieden werden, die durch eine bestimmte Morphologie sowie assoziierte molekulare Veränderungen charakterisiert sind. Es finden sich frühe Veränderungen wie die Überexpression von HER2/neu und späte Ereignisse, z. B. Mutationen im p53Gen oder der Verlust von DPC4/SMAD4. Weitere Alterationen wurden im Bereich von HER2/neu und erbB (erbB2 und B3), p15/INK4b und BRCA2 identifiziert [1, 2, 5]. Verschiedene molekularbiologische Studien zeigen das gehäufte Auftreten von Mutationen des KiRasOnkogens und der Tumorsuppressorgene p21 und p16. Neben den genetischen Veränderungen zeigen Pankreasadenokarzinome eine Deregulation von Wachstumsfaktoren und ihrer Rezeptoren. So konnten aberrante Expressionsmuster von Wachstumsfaktoren wie Transforming Growth Factor α (TGFα), der TGFβFamilie und des Epidermal Growth Factor (EGF) und deren spezifische Rezeptoren sowie ihre Auswirkungen auf das Wachstum und die Metastasierung demonstriert werden. Daneben sind Pankreaskarzinomzellen durch ein erhöhtes proteolytisches Potenzial charakterisiert. Dies scheint ein entscheidender Schritt für die lokale Invasion der Pankreaskarzinomzellen zu sein.
Klinisches Bild
Die klinischen Symptome sind unspezifisch und äußern sich meist in abdominellen (epigastrischen) Schmerzen und/oder Rückenschmerzen, Inappetenz, einem Gewichtsverlust sowie einem Ikterus [5]. In manchen Fällen manifestiert sich im Vorfeld ein Diabetes mellitus. Aufgrund der unspezifischen Symptomatik gestaltet sich die Diagnostik, insbesondere die Differenzialdiagnostik zwischen chronischer Pankreatitis und Pankreaskarzinom, schwierig.
Labordiagnostik/Screening
Ein bevölkerungsweites Screening kommt für das Pankreaskarzinom aufgrund seiner niedrigen Inzidenz und des Fehlens kosteneffektiver, klinisch erprobter Screeningmethoden nicht in Betracht. Auch für die Überwachung von Hochrisikogruppen gibt es bisher keine standardisierten Protokolle.
Bisher erlaubt kein laborchemischer Parameter eine sichere Differenzierung zwischen chronischer Pankreatitis und Pankreaskarzinom. CA 199 ist derzeit der wichtigste klinisch untersuchte serologische Marker [6]. Für den Tumormarker CA 199 werden studienabhängig stark variierende Werte hinsichtlich Spezifität und Sensitivität angegeben. Bei einem Grenzwert von 37 U/ml liegt die Sensitivität im Bereich von 69–93% und die Spezifität im Bereich von 76–99%. Eine Schwierigkeit besteht darin, dass bei Ausbildung eines Ikterus das CA 199 auch unspezifisch erhöht sein kann [6]. Andere Marker wie CA 50, CA 724, CEA und DUPAN2 sind dem CA 199 bislang unterlegen und differenzieren ebenfalls nicht zuverlässig zwischen benignen und malignen Pankreaserkrankungen. Somit können derzeit Serumtumormarker auch nicht routinemäßig zur Diagnostik oder zur Differenzierung des Pankreaskarzinoms empfohlen werden [1].
P Studien geben Hinweise auf ein sequenzielles Progressionsmodell mit verschiedenen Vorstufen – den sogenannten pankreatischen intra-epithelialen Neoplasien (PanINs) – mit verschiedenen genetischen und epigenetischen Veränderungen.
P Die klinische Symptomatik ist unspezifisch mit (Rücken)schmerzen und Gewichtsverlust sowie oftmals zum Diagnosezeitpunkt mit Ausbildung eines Ikterus.
P Es existiert derzeit kein serologischer Tumormarker zur routinemäßigen klinischen Diagnostik.

28
TNM-Klassifikation und Stadieneinteilung
Für das therapeutische Vorgehen beim Pankreaskarzinom sind die TNMKlassifikation und die Stadieneinteilung nach UICC (Union of International Cancer Control) von ausschlaggebender Bedeutung. Dabei muss – wie auch bei anderen malignen Neoplasien – zwischen der klinischen/bildgebenden cTNMKlassifikation und der postoperativen Klassifikation nach pathologischer Untersuchung (pTNM) unterschieden werden. In den Tabellen 2 und 3 sind die entsprechenden Kriterien zusammengefasst. Anhand der TNMKlassifikation kann dann die UICCStadieneinteilung erfolgen (Tab. 3). Im Gegensatz zu anderen Neoplasien spielt das histologische Grading (G1–3) beim Pankreasadenokarzinom hinsichtlich Prognose und Therapie eine untergeordnete Rolle.
Bildgebende Diagnostik
Mittels Bildgebung kann die klinische TNMKlassifikation und somit eine Stadieneinteilung erfolgen. Die einzelnen bildgebenden Verfahren lassen oftmals keine sichere Differenzierung zu. Deshalb ist vielfach die Kombination von verschiedenen Bildgebungsverfahren im klinischen Alltag notwendig.Die Abdomensonografie stellt als einfaches, leicht zugängliches und preiswertes Verfahren die bildgebende Basisuntersuchung dar. Hierbei sind aber die Einschränkungen wie Erfahrung des Untersuchers, Patientenkonstitution und Luftüberlagerung limitierend.
P Von prognostischer und thera-peutischer Bedeutung sind die TNM-Klassifikation und die Stadieneinteilung nach UICC.
Tab. 2TNM-Klassifikation des Pankreaskarzinoms
T – Primärtumor
Tis Carcinoma in situ
T1 Tumor ≤ 2 cm, begrenzt auf das Pankreas
T2 Tumor > 2 cm, begrenzt auf das Pankreas
T3 Tumor überschreitet Pankreas, invadiert aber nicht Truncus coeliacus oder Arteria mesenterica
T4 Tumor überschreitet Pankreas, invadiert aber Truncus coeliacus oder Arteria mesenterica
N – regionäre Lymphknotenmetastasen
N0 keine regionären Lymphknotenmetastasen
N1 regionäre Lymphknotenmetastasen
M – Fernmetastasen
M0 keine Fernmetastasen
M1 Fernmetastasen
Tab. 3UICC-Stadieneinteilung des Pankreaskarzinoms
Stadium TNM
0 T0/Tis/PanIN
I T1 N0 M0; T2 N0 M0
II T1–T3, N0 M0
III T1–T3, N1 M0
IV jedes T, jedes N, M1
P Im Rahmen der Diagnostik müssen oftmals mehrere bildgebende Verfahren kombiniert werden. Die Basis bildet die Multislice-Computertomografie (MSCT). Der endoskopische Ultraschall (EUS) hat eine hohe diagnostische Aussagekraft für die lokale Ausbreitung.

29
Eine hohe lokale Auflösung lässt sich mit dem endoskopischen Ultraschall (EUS) erzielen. Die Sensitivität des EUS beim lokalen Staging von Pankreaskarzinomen liegt für T1Tumoren bei 88%, für T2Tumoren bei 100% und für T3Tumoren bei etwa 93% [7]. Die Anwendung einer kontrastmittelverstärkten Endosonografie kann die Differenzialdiagnose verbessern. Zusätzlich besteht beim Einsatz von linearen Sonden eine Punktionsmöglichkeit. Die MultisliceComputertomografie (MSCT) und die Magnetresonanztomografie (MRT) inklusive MagnetresonanzCholangiopankreatikografie (MRCP) sind sehr sensitive Verfahren zur Diagnostik und zum Staging von Pankreastumoren [7]. Aufgrund der Verfügbarkeit stellt die MSCT ein kostengünstiges Standardverfahren in vielen Zentren dar, da hiermit Pankreastumoren mit einer Sensitivität von etwas über 90% detektiert werden können. Im Gegensatz zur Endo sonografie können mittels CT Fernmetastasen zuverlässig nachgewiesen werden [7]. Dagegen scheint die Sensitivität der MSCT bei T1Tumoren mit 80% etwas geringer als bei der Endosonografie zu sein. MRT und CT sind im TStaging und NStaging etwa gleichwertig. Durch die diffusionsgewichtete Analyse ist die MRT bei der Detektierung sehr kleiner Lebermetastasen der CT überlegen. Derzeit kann noch keine eindeutige Bewertung hinsichtlich der Überlegenheit der einzelnen Verfahren abgegeben werden. Deshalb müssen die Methoden auch ggf. komplementär eingesetzt werden. Ist es nicht möglich, mit den genannten Verfahren eine sichere Diagnose zu stellen, muss ggf. eine explorative Laparoskopie/tomie mit der Möglichkeit eines intraoperativen Ultraschalls (IOUS) und der direkten Gewebeentnahme durchgeführt werden.
Histologische/zytologische Diagnostik
Entsprechend der aktuellen Leitlinie sollte beim Vorliegen eines potenziell resektablen Pankreasprozesses primär operiert und auf eine zytologische/histologische Sicherung verzichtet werden [1]. Eine Ausnahme besteht aber, wenn differenzialdiagnostisch andere Ursachen wie ein Lymphom oder Metastasen anderer Tumoren im Pankreas vorliegen könnten, welche eine andere Therapie erforderlich machen. Zur zytologischen/histologischen Sicherung bietet sich hierbei die endosonografische Feinnadelpunktion an. Im Gegensatz dazu ist bei lokal fortgeschrittenem inoperablem und auch bei metastasiertem Tumorstadium vor Beginn einer Chemotherapie eine histologische/zytologische Sicherung obligat [1], um z. B. das Adenokarzinom von den völlig anders zu behandelnden neuroendokrinen Tumoren des Pankreas zu differenzieren.
Chirurgische Therapie
Die Therapie und die Prognose des Pankreasadenokarzinoms hängten vom Stadium zum Zeitpunkt der Diagnose ab. Da die R0Resektion die einzige potenziell kurative Therapie darstellt, muss zunächst anhand der Bildgebung die lokale Operabilität überprüft werden [1]. Hierbei ist in Abhängigkeit von den örtlichen Möglichkeiten und Expertisen die Kombination von verschiedenen bildgebenden Methoden oft vorteilhaft. Entsprechend der aktuellen Leitlinien gelten Patienten mit Fernmetastasen oder mit einer Infiltration der arteriellen Gefäße als inoperabel [1]. In einzelnen Zentren gibt es dabei insbesondere im Rahmen von Studien abweichende Vorgehensweisen. Die chirurgischen Standardverfahren für operable Pankreaskopfkarzinome sind die partielle Duodenopankreatektomie (klassische KauschWhippleOperation) und die pyloruserhaltende partielle Duodenopankreatektomie (ppWhipple) [8]. Dabei erfolgt eine radikale Tumorentfernung mit einer Lymphknotendissektion peripankreatisch, im Bereich des Ligamentum hepatoduodenale sowie entlang des Truncus coeliacus und der Arteria und Vena mesenterica superior mit dem Ziel einer R0Resektion [8]. Die Mortalität dieser Operationen liegt heute in erfahrenen Zentren unter 5%. Bei Pankreaskorpus und kaudakarzinomen wird eine Pankreaslinksresektion erforderlich. Die Komplikationsrate liegt hier zwischen 15–20% [8, 9]. Eine aktuelle Metaanalyse
P Vor einer palliativen Chemotherapie ist eine histologische/zytologische Sicherung obligat.
P Die chirurgisch-onkologische Resektion ist die einzige potenziell kurative Therapie. Einen wichtigen prognostischen Faktor stellt neben der R0-Resektion der Lymphknotenstatus dar.

30
zeigt, dass perioperative Morbidität und Mortalität signifikant mit der Anzahl der durchgeführten Eingriffe im jeweiligen Zentrum korrelieren [9].Studien haben gezeigt, dass das Ausmaß der Lymphknotenbeteiligung ein wichtiger prognostischer Faktor für das Überleben nach Resektion eines Pankreaskopfkarzinoms ist. So liegt die 5JahresÜberlebensrate bei Lymphknotennegativen Patienten zwischen 25 und 30%, wohingegen diese bei Patienten mit Lymphknotenmetastasen nur 10% beträgt. Insgesamt kommt es aber bei bis zu 90% der Patienten selbst nach R0Resektion zu einem Rezidiv.Heutzutage ist allein das Alter kein Ausschlusskriterium für eine operative Therapie. Im Einzelfall müssen aber Komorbiditäten und natürlich der individuelle Patientenwunsch mit berücksichtigt werden.
Vielfältig diskutiert wird das präoperative Vorgehen bei Ikterus. Liegt zum Diagnosezeitpunkt ein cholestatischer Ikterus vor, sollte entsprechend den Empfehlungen der Leitlinie nur bei Zeichen einer Cholangitis oder einer zeitlichen Verzögerung der Operation eine Galleableitung mittels Stent oder Drainageeinlage erfolgen [1].
Neoadjuvante und adjuvante Chemotherapie
Eine potenzielle Prognoseverbesserung könnte durch eine neoadjuvante Chemotherapie erfolgen. Verschiedene kleinere Studien belegen die Durchführbarkeit und eine Tendenz zu einer verbesserten Überlebenszeit. So konnte bei einer prospektiven PhaseIIStudie unter einer Kombinationschemotherapie mit Gemcitabin und Oxaliplatin bei zuvor nicht resektablem Pankreaskarzinom eine Resektabilität von 39% erzielt werden [10]. Eine retrospektive Studie erbrachte eine verbesserte Überlebensrate bei einer neoadjuvanten Chemotherapie im Vergleich zur adjuvanten Chemotherapie bei resektablen Pankreaskarzinomen [11]. Insgesamt sind aber zur Einschätzung der Rolle einer neoadjuvanten Chemotherapie beim Pankreaskarzinom valide PhaseIIIStudien erforderlich.Im Gegensatz zum neoadjuvanten Ansatz ist die adjuvante Chemotherapie heute ein Standardverfahren. Auf Grundlage der CONKO001Studie hat sich die 6monatige GemcitabinGabe als adjuvante Standardchemotherapie etabliert [12]. In der 2010 veröffentlichten ESPAC3Studie wurde die adjuvante Gabe von 5FU mit der GemcitabinGabe verglichen [13]. Bei ähnlichen Überlebensraten zeigte Gemcitabin ein besseres Nebenwirkungsprofil. Gleichzeitig zeichnete sich ein Trend zu einem verbesserten Überleben bei Patienten mit nodalpositivem Pankreaskarzinom bzw. bei Patienten mit positivem Resektionsrand im GemcitabinArm ab [13].Die Bestrahlung bzw. die kombinierte Radiochemotherapie ist Bestandteil intensiver Forschung. Während in Nordamerika die postoperative kombinierte Radiochemotherapie als Standard gilt, wird die Radiotherapie in Europa aufgrund der Ergebnisse der ESPACStudie sehr kritisch beurteilt.
Palliative Therapie
Beim lokal fortgeschrittenen inoperablen oder metastasierten Pankreaskarzinom steht eine patientenzentrierte und symptomorientierte Behandlung mit optimaler Schmerz und Ernährungstherapie im Mittelpunkt [1]. Nach histologischer bzw. zytologischer Diagnosesicherung und bei entsprechendem körperlichem Allgemeinzustand sollte eine palliative Chemotherapie erfolgen. Diese besteht standardmäßig aus einer GemcitabinMonotherapie (1000 mg/m² i.v., 1x wöchentlich) bis zum Progress des Tumorleidens [1]. Studien haben für diese Therapie eine Lebensverlängerung, eine verbesserte Lebensqualität, einen verringerten Schmerzmittelbedarf und einen geringeren Gewichtsverlust im Vergleich zur „best supportive care“ erbracht. So konnte durch die Behandlung mit Gemcitabin das krankheitsfreie Überleben bei guter Verträglichkeit signifikant verlängert werden.
P Eine adjuvante Chemotherapie mit Gemcitabin über 6 Monate gilt heute als Standard. Neoadjuvante Chemo-therapien sollten nur im Rahmen von Studien durchgeführt werden.
P Neben einer palliativen symptom-orientierten Therapie sollte jedem Patienten mit inoperablem lokal fortgeschrittenem oder metastasiertem Pankreaskarzinom eine Chemotherapie angeboten werden. Bei einem ent-sprechenden Performance-Status kann auch eine intensivierte Chemotherapie erwogen werden.

31
Verschiedene Studien untersuchten unterschiedliche Chemotherapiekombinationen mit Gemcitabin, wobei aber kein signifikanter Vorteil nachgewiesen werden konnte. Die Studie von Moore et al. erbrachte einen Überlebensvorteil für die Kombination von Gemcitabin mit dem Tyrosinkinaseinhibitor Erlotinib (Gemcitabin 1000 mg/m² i.v. Tag 1, 8, 15 und Erlotinib 100 mg p. o. tgl.; Wdh. Tag 29) bei Patienten mit metastasiertem Pankreaskarzinom [14]. Dabei korreliert das Ansprechen eng mit dem Ausbildungsgrad eines Exanthems (Rash) als typische Nebenwirkung. So verlängerte sich die 1JahresÜberlebensrate von 17% bei GemcitabinMonotherapie auf 23% bei der Kombination mit Erlotinib [14]. In der klinischen Praxis hat es sich als praktikabel erwiesen auf eine ErlotinibGabe zu verzichten, wenn nach etwa 6 Wochen kein Exanthem (Rash) aufgetreten ist. Die Therapie muss dann als wirkungslos angesehen werden. Bei diesen Patienten könnte bei gutem PerformanceStatus alternativ eine intensivierte Kombinationschemotherapie nach dem FOLFIRINOXSchema durchgeführt werden. In der kürzlich veröffentlichten Studie von Conroy et al. wurde die intensivierte Kombinationschemotherapie FOLFIRINOX (Oxaliplatin 85 mg/m², Irinotecan 180 mg/m² und Leucovorin 400 mg/m² an Tag 1 eines 2Wochenzyklus, gefolgt von einem 5FUBolus von 400 mg/m² und einer 46stündigen kontinuierlichen 5FUInfusion von 2400 mg/m²) mit der GemcitabinStandardtherapie bei Patienten mit metastasiertem Pankreaskarzinom verglichen [15]. Es zeigte sich ein deutlicher Vorteil hinsichtlich des Gesamtüberlebens von 11,1 Monaten beim FOLFIRINOXSchema im Vergleich zu 6,8 Monaten im GemcitabinArm [15]. Somit steht mit dem FOLFIRINOXSchema trotz einer erhöhten Toxizität (Neutropenierate 46%; 42,5% benötigten GCSF im Vergleich zu 5,3% im GemcitabinArm) eine vertretbare Alternativtherapie bei Patienten mit metastasiertem Pankreaskarzinom in gutem Allgemeinzustand zur Verfügung [15]. Dabei sollte aber beachtet werden, dass die Kombinationstherapie von Gemcitabin mit Erlotinib bei Ansprechen mit einem Rash Grad 2 mit erheblich weniger vital bedrohlichen Nebenwirkungen ein ähnlich langes Überleben (10,5 Monate versus 5,3 Monate ohne Rash) erbracht hat.Mit der CONKO03Studie konnte erstmals gezeigt werden, dass eine Zweitlinien Chemotherapie nach dem OFF (Oxaliplatin plus Folinsäure/Fluorouracil)Schema bei Patienten in gutem Allgemeinzustand zu einem verlängerten Überleben nach Versagen der GemcitabinTherapie führt [16]. Auch diese Option sollte im Einzelfall erwogen werden. Es ist aber anzumerken, dass derzeit nur Gemcitabin und die Kombination von Gemcitabin mit Erlotinib als palliative Chemotherapien zugelassen sind.Oftmals kommt es bei Patienten mit fortgeschrittenem Pankreaskarzinom zur Stenosierung des Gallenwegssystems mit Ausbildung eines Ikterus und konsekutivem Pruritus. Hierbei stellt heutzutage die endoskopische Stentversorgung das Standardverfahren dar. Wenn dies technisch nicht möglich ist, steht die perkutane transhepatische Cholangiodrainage (PTCD) zur Verfügung. Dadurch kann in den meisten Fällen die chirurgische Anlage einer biliodigestiven Anastomose vermieden werden. Ein Teil der Patienten mit fortgeschrittenem Pankreaskarzinom entwickelt eine Obstruktion der gastroduodenalen Passage. Neben der operativ angelegten Gastrojejunostomie stellt die endoskopische Stenteinlage eine gängige palliative Maßnahme dar. Dadurch kann die orale Nahrungsaufnahme in 80–90% der Fälle wieder erreicht werden. Da eine Vielzahl der Patienten eine ausgeprägte Kachexie entwickelt, ist eine dem Stadium der Erkrankung angepasste Ernährungstherapie wichtig. Hierbei ist auch auf die Entwicklung einer exokrinen Pankreasinsuffizienz zu achten und ggf. eine Enzymsubstitution durchzuführen. In Tabelle 4 ist die immer noch bedrückend niedrige Lebenserwartung nach Diagnosestellung in Abhängigkeit von dem jeweils gewählten Therapieverfahren zusammengefasst. Daraus geht hervor, dass auch die chirurgische Tumorentfernung für die meisten Patienten nur ein palliatives Verfahren darstellt und lediglich für einen sehr kleinen Teil der Betroffenen Heilung bedeutet.

32
Zu empfehlende Literatur
1 Adler G, Seufferlein T, Bischoff SC, Brambs HJ, Feuerbach S, Grabenbauer G, Hahn S, Heinemann V, Hohenberger W, Langrehr JM, Lutz MP, Micke O, Neuhaus H, Neuhaus P, Oettle H, Schlag PM, Schmid R, Schmiegel W, Schlottmann K, Werner J, Wiedenmann B, Kopp I. S3Leitlinie „Exokrines Pankreaskarzinom“. Z Gastroenterol 2007; 45: 487–523.
2 Bansal P, Sonnenberg A. Pancreatitis is a risk factor for pancreatic cancer. Gastroenterology 1995; 109: 247–251.
3 Brand RE, Lerch MM, Rubinstein WS, Neoptolemos JP, Whitcomb DC, Hruban RH, Brentnall TA, Lynch HT, Canto MI; Participants of the Fourth International Symposium of Inherited Diseases of the Pancreas. Advances in counselling and surveillance of patients at risk for pancreatic cancer. Gut 2007; 56: 1460–1469.
4 Howes N, Lerch MM, Greenhalf W, Stocken DD, Ellis I, Simon P, Truninger K, Ammann R, Cavallini G, Charnley RM, Uomo G, Delhaye M, Spicak J, Drumm B, Jansen J, Mountford R, Whitcomb DC, Neoptolemos JP; European Registry of Hereditary Pancreatitis and Pancreatic Cancer (EUROPAC). Clinical and genetic characteristics of hereditary pancreatitis in Europe. Clin Gastroenterol Hepatol 2004; 2: 252–261.
5 Holly EA, Chaliha I, Bracci PM, Gautam M. Signs and symptoms of pancreatic cancer: a populationbased casecontrol study in the San Francisco Bay area. Clin Gastroenterol Hepatol 2004; 2: 510–517.
6 Banfi G, Bravi S, Ardemagni A, Zerbi A. CA 19.9, CA 242 and CEA in the diagnosis and followup of pancreatic cancer. Int J Biol Markers 1996; 11: 77–81.
7 Holzapfel K, Fingerle A, Rummeny E. Aktueller Stand der bildgebenden Diagnostik des Pankreaskarzinoms. Onkologe 2010; 16: 568–579.
Tab. 4Ungefähre Lebenserwartung nach der Diagnose eines Pankreaskarzinoms in Abhängigkeit von der angewandten Therapieoption
5JahresGesamtüberleben aller Patienten 0,4%
5JahresGesamtüberleben nach Resektion und adjuvanter Chemotherapie 20%
Medianes Überleben
alle Patienten‚ „best supportive care“
Chemotherapie mit Gemcitabin
Chemotherapie mit Gemcitabin plus Capecitabin
Chemotherapie mit Gemcitabin plus Erlotinib (falls Rash)
Chemotherapie mit FOLFIRINOX
5 Monate
6 Monate
7 Monate
10 Monate
11 Monate
Resektion ohne adjuvante Chemotherapie
Resektion mit adjuvanter Chemotherapie (Gemcitabin oder 5Fluorouracil)
16 Monate
23 Monate
Zusammengefasst nach: Gudjonsson B. Cancer 1987; 60: 2284–2303. Neoptolemos JP, et al. JAMA 2010; 304: 1073–1081. Neoptolemos JP, et al. N Engl J Med 2004; 350: 1200–1210. Burris HA, et al. J Clin Oncol 1997; 15: 2403–2413. Moore MJ, et al. J Clin Oncol 2007; 25: 1960–1966. Cunningham D, et al. J Clin Oncol 2009; 27: 5513–5518. Conroy T, et al. N Engl J Med 2011; 364: 1817–1825.
Literatur

33
8 Diener MK, Fitzmaurice C, Schwarzer G, Seiler CM, Antes G, Knaebel HP, Büchler MW. Pyloruspreserving pancreaticoduodenectomy (pp Whipple) versus pancreaticoduodenectomy (classic Whipple) for surgical treatment of periampullary and pancreatic carcinoma. Cochrane Database Syst Rev 2011; (5): CD006053.
9 Gooiker GA, van Gijn W, Wouters MW, Post PN, van de Velde CJ, Tollenaar RA; Signalling Committee Cancer of the Dutch Cancer Society. Systematic review and metaanalysis of the volumeoutcome relationship in pancreatic surgery. Br J Surg. 2011; 98: 485–494.
10 Sahora K, Kuehrer I, Eisenhut A, Akan B, Koellblinger C, Goetzinger P, Teleky B, Jakesz R, PeckRadosavljevic M, Ba’ssalamah A, Zielinski C, Gnant M. NeoGemOx: Gemcitabine and oxaliplatin as neoadjuvant treatment for locally advanced, nonmetastasized pancreatic cancer. Surgery 2011; 149: 311–320.
11 Artinyan A, Anaya DA, McKenzie S, Ellenhorn JD, Kim J. Neoadjuvant therapy is associated with improved survival in resectable pancreatic adenocarcinoma. Cancer 2011; 117: 2044–2049.
12 Oettle H, Post S, Neuhaus P, Gellert K, Langrehr J, Ridwelski K, Schramm H, Fahlke J, Zuelke C, Burkart C, Gutberlet K, Kettner E, Schmalenberg H, WeigangKoehler K, Bechstein WO, Niedergethmann M, SchmidtWolf I, Roll L, Doerken B, Riess H. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curativeintent resection of pancreatic cancer: a randomized controlled trial. JAMA 2007; 297: 267–277.
13 Neoptolemos JP, Stocken DD, Bassi C, Ghaneh P, Cunningham D, Goldstein D, Padbury R, Moore MJ, Gallinger S, Mariette C, Wente MN, Izbicki JR, Friess H, Lerch MM, Dervenis C, Oláh A, Butturini G, Doi R, Lind PA, Smith D, Valle JW, Palmer DH, Buckels JA, Thompson J, McKay CJ, Rawcliffe CL, Büchler MW; European Study Group for Pancreatic Cancer. Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA 2010; 304: 1073–1081.
14 Moore MJ, Goldstein D, Hamm J, Figer A, Hecht JR, Gallinger S, Au HJ, Murawa P, Walde D, Wolff RA, Campos D, Lim R, Ding K, Clark G, VoskoglouNomikos T, Ptasynski M, Parulekar W; National Cancer Institute of Canada Clinical Trials Group. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007; 25: 1960–1966.
15 Conroy T, Desseigne F, Ychou M, Bouché O, Guimbaud R, Bécouarn Y, Adenis A, Raoul JL, GourgouBourgade S, de la Fouchardière C, Bennouna J, Bachet JB, KhemissaAkouz F, PéréVergé D, Delbaldo C, Assenat E, Chauffert B, Michel P, MontotoGrillot C, Ducreux M; Groupe Tumeurs Digestives of Unicancer; PRODIGE Intergroup. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 2011; 364: 1817–1825.
16 Pelzer U, Schwaner I, Stieler J, Adler M, Seraphin J, Dörken B, Riess H, Oettle H. Best supportive care (BSC) versus oxaliplatin, folinic acid and 5fluorouracil (OFF) plus BSC in patients for secondline advanced pancreatic cancer: a phase IIIstudy from the German CONKOstudy group. Eur J Cancer 2011; 47: 1676–1681.
Literatur

34
Bitte beachten Sie:Bei der Beantwortung der Fragen ist immer nur 1 Antwort möglich.
Die Beantwortung der Fragen und Erlangung des Fortbildungszertifikats ist nur online möglich. Bitte gehen Sie dazu auf unsere Homepage www.falkfoundation.de. Unter dem Menüpunkt Falk GastroKolleg können Sie sich anmelden und die Fragen beantworten. Bitte diesen Fragebogen nicht per Post oder Fax schicken!
Wichtig:Fragebeantwortung unter
www.falkfoundation.de
Falk Gastro-Kolleg
Falk Gastro-Kolleg
Pankreas
Fragen zum Pankreaskarzinom
Frage 1:Welche Aussage ist richtig? Untersuchungen zeigen, dass das Pankreaskarzinom meist
EE im Pankreaskorpus und kaudabereich lokalisiert istEE bei Männern ab dem 40. Lebensjahr auftrittEE Frauen ab dem 5. Lebensjahrzehnt betrifftEE ab dem 6. Lebensjahrzehnt auftritt und etwas häufiger Männer betrifftEE ab dem 7. Lebensjahrzehnt auftritt und etwas häufiger Frauen betrifft
Frage 2:Welche Aussage ist richtig? Als Risikofaktoren für ein Pankreaskarzinom gelten nicht
EE das CriglerNajjarSyndromEE die hereditäre PankreatitisEE das PeutzJeghersSyndromEE ein BodyMassIndex (BMI) > 25 kg/m²EE ein Nikotinabusus
Frage 3:Was trifft für die endosonografische Ultraschalluntersuchung nicht zu?
EE Hat eine hohe lokale AuflösungEE Hilft bei der Unterscheidung zystischer und solider PankreastumorenEE Gibt die Möglichkeit einer FeinnadelpunktionEE Ist die Methode der Wahl zur MetastasendiagnostikEE Kann die Lagebeziehung des Tumors zu benachbarten Gefäßen beurteilen
Frage 4:Welche Aussage ist richtig? Eine histologische/zytologische Sicherung ist obligat
EE vor einer WhippleOperationEE vor einer palliativen ChemotherapieEE vor einer palliativmedizinischen BetreuungEE bei der endosonografischen UntersuchungEE vor einer pyloruserhaltenden partiellen Duodenopankreatektomie
Frage 5:Was ist die einzige potenziell kurative Therapie des Pankreaskarzinoms?
EE Kombinationschemotherapie mit FOLFIRINOXEE Eine onkologische Resektion entsprechend der Lage des PankreastumorsEE Lokalablative VerfahrenEE Kombinierte RadiochemotherapieEE Sequenzielle Radiochemotherapie

35
Falk Gastro-Kolleg
Pankreas
Frage 6:Welche Aussage ist richtig? Postoperativ gehört folgende Maßnahme zum heutigen Therapiestandard:
EE Eine monatliche AbdomensonografieEE Eine chirurgische Vorstellung alle 3 MonateEE Eine adjuvante Chemotherapie mit Gemcitabin über 6 MonateEE Eine adjuvante Chemotherapie mit Gemcitabin und ErlotinibEE Eine monatliche Blutbildbestimmung
Frage 7:Welche adjuvante Chemotherapie stellt derzeit den Standard dar?
EE Eine Chemotherapie mit Gemcitabin bis zur ProgressionEE Eine Chemotherapie mit Gemcitabin über 6 MonateEE Eine Chemotherapie mit Gemcitabin und OxaliplatinEE Eine Chemotherapie nach FOLFIRINOXSchemaEE Gemcitabin kombiniert mit Irinotecan
Frage 8:In der Palliativsituation sind derzeit welche Chemotherapien für das Pankreaskarzinom zugelassen?
EE GemcitabinMonotherapie und Gemcitabin/ErlotinibEE Gemcitabin/IrinotecanEE 5FU/OxaliplatinEE Oxaliplatin/AvastinEE Gemcitabin/5FU
Frage 9:Welche Antwort ist richtig? Das 1JahresÜberleben bei der Kombinationschemotherapie von Gemcitabin und Erlotinib korreliert mit
EE dem Grad der sich entwickelnden NeutropenieEE dem Auftreten von DiarrhöenEE dem Auftreten einer relevanten AnämieEE dem Ausprägungsgrad einer akneähnlichen Hauttoxizität (Rash)EE dem Thrombopeniegrad
Frage 10:Was ist das Mittel der ersten Wahl bei der Therapie von Gallenwegsstenosen?
EE Endoskopische StenteinlageEE Perkutane transhepatische Cholangiodrainage (PTCD)EE Anlage einer biliodigestiven AnastomoseEE Chirurgisches TumordebulkingEE Ursodeoxycholsäuretherapie


![Falk Gastro-Kolleg Darm...Falk Gastro-Kolleg 2/2018 | 3 hinreichend zuverlässig stellen [7 ,11]. Nur bei einem sehr kleinen Teil der Patienten wird im weiteren Verlauf doch noch eine](https://static.fdokument.com/doc/165x107/6081376b307ea03cd37df455/falk-gastro-kolleg-darm-falk-gastro-kolleg-22018-3-hinreichend-zuverlssig.jpg)