Kapitel 1 - Einführung - geochemie.ifg.uni-kiel.de · Nucleotide = heterozyklische Base...
Transcript of Kapitel 1 - Einführung - geochemie.ifg.uni-kiel.de · Nucleotide = heterozyklische Base...
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Textbook: Introduction to GeochemistryEAOG.org
Kapitel 1 - Einführung
Entwicklung der organischen Chemie
Bis zu Beginn des 19. Jahrhunderts erfolgte eine noch aus der Alchemie resultierende Trennung zwischen der Chemie der:
Belebten Materie (Auszüge/Extrakte aus Pflanzen, Naturstoffen) Organische Chemie
Unbelebten Materie (Extrakte/Präparate aus Mineralen, Gestein) Anorganische Chemie
Die künstliche Herstellung von organischen aus anorganischen Verbindungen war unmöglich, die zwei Systeme damit klar und sinnvoll getrennt.
Die Darstellung des Harnstoff aus dem anorganischen Salz Ammoniumcyanat durch Wöhler (1828) war die erste organische Synthese und führte die Anorganik Organik zusammen.
NHOCN 4 O=CNH2
T NH2
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Kapitel 1 - Einführung
Entwicklung der organischen Chemie
Heute versteht man unter organischer Chemie die Chemie der Kohlenstoffverbindungen. Bis dato sind etwa 7 Millionen diverse chemische Einzelverbindungen dargestellt, davon sind über 85 % organische Verbindungen (viele davon in ihrer Wirkung/ihren Eigenschaften unbekannt).
Kohlenstoff besitzt die folgenden speziellen Eigenschaften:
verschiedene Oxidationstufen (+4 bis –4)
verschiedene Aggregatzustände (gas, flüssig, fest, amorph)
die Fähigkeit unbeschränkt stabile C-C-Bindungen einzugehen:
Bildung von beliebig langen Ketten, verzweigte Ketten, Ringe und Kombinationen derselben
die Fähigkeit stabile Bindungen mit vielen verschiedenenHeteroelementen wie H, O, N, S, P, Mg, Ni, Zn, etc. einzugehen(diese sind dann oft auch essentielle Makro-/Mikronutrienten)
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Entwicklung der organischen Geochemie
Die Organische Geochemie geht auf den deutschen Farb/Pigment-Chemiker Alfred Treibs zurück. Dieser stellte 1933-1935 erstmals den Herkunftsbezug (Diagenesepfad) zwischen Geo-Porphyrinen und Bio-Chlorophyllen dar.
Kapitel 1 - Einführung
Aufgabenfelder der organischen Geochemie
Rohstoff-Prospektion: Erdöl Erdgas, Kohle, GashydrateSource Rock-Evaluation, Maturitätsansprache, Öl-Source Rock-Korrelation, Migrationswege, Biodegradation, Reservoirgeochemie
Umweltgeochemie: Evaluation, Forensik, Remediation Detektion persistenter organischer Pollutanten (POP), Ermittlung des Schadstoffpotentials, Verursacheridentifizierung, Diagenese-Metabolitenbewertung, Remediationstechniken und Vermeidungs-/ Reduktionsstrategien, Prognosen, Ausarbeitung & Überwachung von Regulierungsmaßnahmen (Gesetze und Verordnungen)
Rekonstruktion fossiler Environments: OrganofaziesanalysePaleozeanographie, Paleoklimatologie, Milieuanalyse (T, pH, Eh), biotische Steuerungsfaktoren der Hydro-/Atmosphärenentwicklung, Verwitterung, globaler Stoffkreisläufe
Molekulare Evolution: Entstehung & Entwicklung des Lebens Primordiale Enstehung biotischer aus abiotischen Molekülen, Entwicklung von Reaktionen zur Energiegewinnung und zum Transfer genetischer Information, Biosynthesemechanismen
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Kapitel 1 - Einführung
Stellung des Kohlenstoffs im M
NF-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Elementare Zusammensetzung der Erdkruste
Bioelement Kohlenstoff macht nur 0.08 % an Zusammensetzung der Erdkruste aus.
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Elementare Zusammensetzung der Biospäre
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Dennoch basiert der Zellaufbau aller Organismen und die gesamte Biospäre auf dem Bioelement Kohlenstoff.
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
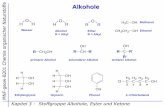
Lignin: quervernetzte Propylphenole (Stützgewebe in Landpflanzen)
Kohlenhydrate: Polyalkohole mit Summenformel (CH2O)n
- Monosacharide – Einfachzucker (Glucose, Fructose, Ribose)
- Disacharide – Zweifachzucker (Saccharose, Lactose, Maltose)
- Polysacharide – polymere Saccharide (Cellulose, Alginan, Chitin)
Fette: Glycerinester mit 2-3 Fettsäuren von je bis 20 C-Atomen
Wachse: Monoester langkettiger n-Fettsäuren (meist C20- C32) mit
mittelkettigen n-Alkoholen (meist C16- C18) – z.T auch mit
Hydroxycarbonsäuren, Sterole, Diole und n-Alkanen
Terpenoide: acyclische Isprenoide, Steroide, Hopanoide, Pigmente, (Photosynthese, Membranen, Hormone, Harze)
Cutin: quervernetzt-polymerisierte (di)Hydroxyfettsäuren (subaerial)
Suberin: quervernetzt-polymerisierte Dicarbonsäuren (rhizosperial)
Proteine: Polypeptide mit >10.000 amu (fibröse Stützgewebe, Enzyme,
Hormone, Antikörper, Energiespeicherung)
Nucleinsäuren: wasserlösliche Biopolymere aus Nucleotiden im Zellkern
Nucleotide = heterozyklische Base (Pyrimidin, Purin) plus ein
Monosaccharid (Ribose, Deoxyribose) plus Phosphorsäure.
Essentielle Stoffgruppen organischer Substanz
Kapitel 1 - Einführung
Die Stellung des Elements Kohlenstoffs imPeriodensystem diktiert die Struktur von Biomolekülen über deren C-Bindungsform
auf der Basis der Valenzelektronen
12C: 6 Protonen, 6 Neutronen, 6 Elektronen
13C: 6 Protonen, 7 Neutronen, 6 Elektronen
Elektronen bewegen sich um den Atomkern in definierten Räumen, um nicht zu kollidieren.
Diese e--Aufenthaltsräume werden als Orbitale bezeichnet und regeln die Bindungzwischen C-Atomem über die Ausbildung gemeinsamer/geteilter Elektronenpaare.
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Kohlenstoffchemie - Bindungsform
s-Orbital, kugelförmig, besetzt mit 2 Elektronen
Drei p-Orbitale, hantelförmig, besetzt mit jeweils nur einem Elektron. Aufnahmekapazität je p-Orbital ist 2 Elektronen.
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Kohlenstoffchemie - Bindungsform
sp3 Hybridisierung, energetisch günstiger - Tetraederkonfiguration
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Kohlenstoffchemie - Bindungsform
sp2 Hybridisierung, planar
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe
Aromatische Kohlenwasserstoffe
Aromatische sp2 Hybridisierung, konjugierte Pi-Bindungen mit delokalisierter Elektronenwolke
Kapitel 1 - Einführung
MN
F-g
eow
-B201 C
hem
ie o
rganis
cher
Natu
rsto
ffe Alkane
Moleküle, die aus C und H bestehen (Kohlenwasserstoffe)
Gesättigte Alkane = Paraffine, wenn acyclisch= CnH2n+2
Alkane besitzen Einfachbindungen (Sigma-Bindungen)
Alkane sind sp3-hybridisiert (Tetraederkonfiguration)
Alkane haben einen Bindungswinkel von 109.5°
Alkane sind kettenförmig, verzweigt oder ringförmig
Alkene
Kohlenwasserstoffe mit Doppelbindung(en)
Ungesättigte Alkane = Olefine, wenn acyclisch= CnH2n
Alkene besitzen Zweifachbindungen (p-Bindungen)
Alkene sind sp2-hybridisiert (planare Konfiguration)
Alkene haben einen Bindungswinkel von 120°
Alkene sind kettenförmig, verzweigt oder ringförmig