30 mMol Boc-L-Phe-OH wurden in 30 ml Methylen- chlorid...
Transcript of 30 mMol Boc-L-Phe-OH wurden in 30 ml Methylen- chlorid...

This work has been digitalized and published in 2013 by Verlag Zeitschrift für Naturforschung in cooperation with the Max Planck Society for the Advancement of Science under a Creative Commons Attribution4.0 International License.
Dieses Werk wurde im Jahr 2013 vom Verlag Zeitschrift für Naturforschungin Zusammenarbeit mit der Max-Planck-Gesellschaft zur Förderung derWissenschaften e.V. digitalisiert und unter folgender Lizenz veröffentlicht:Creative Commons Namensnennung 4.0 Lizenz.
Peptidsynthesen mit symm. Anhydriden, I
F R I E D R I C H W E Y G A N D , P E T E R H U B E R u n d K A R I N W E I S S
Organisch-chemisches Institut der Technisches Hochschule München
( Z . N a t u r f o r s c h g . 22 b , 1 0 8 4 — 1 0 8 5 [1967 ] ; e i n g e g . am 11. A u g u s t 1967)
Die Peptidsynthese mit gemischten Anhydriden von A-Acylaminosäuren1 hat den Nachteil der möglichen „falschen" Aufspaltung bei der Aminolyse. Bei symm. Anhydriden von A-Acylaminosäuren besteht diese Ge-fahr nicht. Lediglich die Tatsache, daß sie bisher nur schwer zugänglich waren, verhinderte den häufigeren Einsatz von symm. Anhydriden bei Peptidsynthesen. Nachdem V I E H E und Mitarbb. 2 gezeigt haben, daß mit Hilfe von Inaminen aus Carbonsäuren leicht Anhydride zugänglich sind und dies auch für A-Acylaminosäuren demonstriert werden konnte 3>4, haben wir ihre Ver-wendbarkeit zu Peptidsynthesen geprüft.
Da Inamine auch mit symm. Anhydriden reagieren 5, A v u r d e n die Bedingungen so gewählt, daß ein Über-schuß an A-Acylaminosäure vorhanden ist. Verwendet man ferner bei der Peptidsynthese einen Überschuß an symm. Anhydrid, so verläuft die Umsetzung mit Amino-säure- oder Peptidestern innerhalb weniger Min. quan-titativ. Bei sterisch gehinderten Aminosäuren kann die Reaktionsdauer länger sein. In jedem Falle kann man sich durch ein Schnell-Dünnschichtchromatogramm und anschließende Ninhydrinreaktion von der Vollständig-keit der Aminolyse überzeugen.
Nach beendeter Aminolyse entfernt man den Über-schuß an symm. Anhydrid durch Umsetzung mit A-(2-Aminoäthyl) -piperazin, dessen Reaktionsprodukt mit dem Anhydrid durch verd. Citronensäure-Lösung aus-waschbar ist. Den Überschuß an A-Acylaminosäure und den bei der Aminolyse des symm. Anhydrids gebilde-ten Teil an TV-Acylaminosäure zieht man mit Natrium-hydrogencarbonat aus. Er wird so zum größten Teil zurückgewonnen. Das bei der Herstellung des symm. Anhydrids mit dem Inamin (Methyläthinyldiäthyl-amin) gebildete Propionsäurediäthylamid ist in Petrol-äther löslich. Als A-Acylschutzgruppe verwenden wir den Boc-Rest, der nach beendeter Peptidsynthese mit Trifluoressigsäure abgespalten wird. Alle 2 — 3 Stdn. ist ein Peptidverknüpfungsschritt durchführbar.
Das Verfahren sei an der schrittweisen Synthese von all-L-Boc-Leu-Ile-Ile-Leu-Val-Pro-Pro-Phe-Phe-OBzl6 er-läutert.
1 Vgl. die zusammenfassende Darstellung: N . F. ALBERTSON, Organic Reactions 12, 157 [1962].
2 H. G . V I E H E , R . F U K S u. M . REINSTEIN, Angew. Chem. 7 6 , 571 [1964].
3 A . S . VAN M O U R I K , E . H A R R Y V A N U. J. F. A R E N S , Ree. trav. chim. Pays-Bas 84, 1344 [1965].
4 F. W E Y G A N D U. U . RAGNARSSON, unveröffentlicht. 5 W . STEGLICH, G . H Ö F L E , W . K Ö N I G U. F. W E Y G A N D , Chem.
Ber., im Druck. Zum Beispiel bildet sich aus Benzoesäure-anhydrid und Methyläthinyldiäthylamin durch Addition und Umlagerung das 3-Phenyl-3-benzoyloxy-methacryl-säure-diäthylamid.
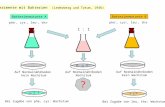
30 mMol Boc-L-Phe-OH wurden in 30 ml Methylen-chlorid durch Zugabe von 14 mMol Methyläthinyl-diäthylamin in 10 ml Methylenchlorid unter Eisküh-lung innerhalb 30 Min. zum symm. Boc-L-Phe-anhydrid umgesetzt. Sodann fügte man 10 mMol HCl-L-Phe-OBzl und 10 mMol A-Äthyl-diisopropylamin in 10 ml Methylenchlorid zu. Nach 5 Min. wurde ein Dünn-schichtchromatogramm (DC Fertigplatten, Kieselgel F254 , Merck, Laufmittel Benzol —Essigester —Eis-essig — Wasser, 1 : 1 : 0,2 : 0,1, vol., obere Phase, oder n-Butanol —Eisessig —Wasser, 4 : 1 : 1 , vol.) mit HC1-L-Phe-OBzl angesetzt. Nach 10 Min. Entwicklungszeit zeigte sich, daß die Aminolyse bereits vollständig war. Der Reaktionslösung fügte man 5 mMol A-(2-Amino-äthyl) -piperazin zum Abfangen des überschüssigen Boc-L-Phe-anhydrids zu und rührte noch 5 Minuten. Nun wurde die Lösung auf zwei Zentrifugengläser verteilt und zunächst mit ges. Natriumhydrogencarbonat-Lösung gewaschen, aus der Boc-L-Phe-OH zurückge-wonnen wurde. Sodann wurde je zweimal mit verd. Citronensäure und Wasser, nochmals mit Natrium-hydrogencarbonat-Lösung und Wasser gewaschen, mit Natriumsulfat getrocknet und eingedampft 7. Anschlie-ßend ließ man 10 Min. bei 20° mit 2 0 - 3 0 ml Tri-fluoressigsäure stehen, dampfte i. Vak. ein und destil-lierte zweimal Toluol und Äther nach. Durch Waschen mit Petroläther entfernte man das aus dem Inamin ge-bildete Propionsäurediäthylamid.
In analoger Weise wurde nun das Peptidester-tri-fluoracetat in denselben Molverhältnissen um eine Boc-L-Aminosäure nach der anderen verlängert, bis die Nonapeptidstufe erreicht war. In den Fällen, in denen die Trifluoracetate der Peptidester nicht kristallisierten, wurden sie in Methylenchlorid gelöst und tropfen-weise mit A-Äthyl-diisopropylamin versetzt, bis die Lö-sung gegen Indikatorpapier nicht mehr sauer reagierte. Bei jedem Syntheseschritt wurde die Ninhydrinreak-tion (Dünnschichtchromatogramme) negativ. Bei ste-risch stark gehinderten Aminosäuren, wie Val und Pro, betrug die Reaktionszeit etwa 1/2 Stunde.
al-L-Boc-Leu-Ile-Ile-Leu-Val-Pro-Pro--Phe-Phe-OBzl: Kristallisation erfolgte beim Verreiben mit Petroläther. Zur Analyse wurde nicht gereinigt. C69H101N9O12 (1248,6)
Ber. C 66,37 H 8,15 N 10,10, Gef. C 65,10 H 8,52 N 10,17.
Die Verbindung zeigte nach der Totalhydrolyse (96 Stdn. mit 6-n. HCl bei 110° unter N2) die korrekte Aminosäurezusammensetzung: Val1)00 : Leu1;98 : Ile2,04 :
6 Zur Konstitutionsaufklärung des aus Leinsamen isolierten all-L-cyclo-Leu-Ile-Ile-Leu-Val-Pro-Pro-Phe-Phe- vgl. A. P R O X U. F. W E Y G A N D , Peptides, Proc. VIIIth Europ. Peptide Symposium, Sept. 1966, Noordwijk, North Holland Publ. Corp., Amsterdam 1967, S. 1 5 8 - 1 7 2 .
7 Beim Verreiben mit Petroläther erfolgte Kristallisation. Ausb. an Boc-L-Phe-L-Phe-OBzl 91%, Schmp. 1 2 0 - 1 2 2 ° , C30H34N2O5 (502,6), Ber. C 71,69, H 6.82, N 5,57; Gef. C 71,83, H 7,07, N 5,65.

Pro2,o4 : Phe2,o2 • Von einer Probe wurden mit HBr/Tri-fluoressigsäure (1 Stde., 20°) die Schutzgruppen abge-spalten, worauf mit methanolischer Salzsäure verestert und mit Trifluoressigsäureanhydrid iV-trifluoracetyliert wurde. Der so erhaltene A-TFA-Nonapeptid-methylester zeigte im Massenspektrum (MS 9) den Molekularpeak bei m/e = 1167.
Spezifische Wirkung von Serum teilhepatekto-mierter Ratten auf Hepatom-Asciteszellen
in vitro
M . V O L M , H . W R B A u n d H . H I N D E R E R
Deutsches Krebsforschungszentrum Heidelberg, Institut für Experimentelle Pathologie
(Direktor: Prof. Dr. Dr. H. W R B A )
( Z . Natur forschg . 22 b , 1085 [ 1 9 6 7 ] ; e i n g e g a n g e n a m 6. M a i 1967 )
Serum teilhepatektomierter Ratten (HS), das 48 Stdn. nach der Operation gewonnen wird, hat in vitro auf den Stoffwechsel verschiedener Tumoren eine depressive WirkungL-2> 6. In vivo wird das Tumorwachstum da-gegen nach Teilhepatektomie nicht beeinflußt oder — vor allem bei Hepatomen — gefördert3> 4. Es findet sich auch in vitro ein .vermehrtes Wachstum des He-patom-Ascites AH-130 unter Zusatz von HS5. Es ergab sich die Frage, ob auch bei Zajdela-Hepatom-Ascites-zellen der Ratte, die bei uns seit Jahren auf Ratten und in vitro gehalten werden, die bei anderen Tumoren in vitro übliche depressive Wirkung des HS auf den Stoffwechsel nachweisbar würde.
Zajdela-Hepatom-Asciteszellen der Ratte zeigen im Gegensatz zum Walker-Ascites-Tumor nach Inkubation im gleichen HS bei 6 durchgeführten Versuchen keinen verwertbaren Unterschied oder allenfalls die Tendenz zur Stimulierung der Atmung. (Material und Metho-den werden an anderer Stelle ausführlich beschrie-1 H . W R B A U . H . R A B E S , Cancer Res. 2 3 , 1 1 1 6 [ 1 9 6 3 ] . 2 H . W R B A , H . R A B E S U . A . G E O R G I I , Naturwissenschaften 5 2 ,
1 6 5 [ 1 9 6 5 ] . 3 K . E . PASCHKIS, A . C A N T A R O W , J . STASNEY, a n d J . H . H O O B S ,
Cancer Res. 1 5 , 5 7 9 [ 1 9 5 5 ] .
Nachweis von 3-Oxi-4.4'-dioxo-/?-carotin in den Grünalgen Chlorococcum wimmeri
und Haematococcus spec. F R A N Z - C H R I S T I A N C Z Y G A N u n d E R I C H K E S S L E R
Botanisches Institut der Universität, Erlangen ( Z . Natur forschg . 22 b , 1 0 8 5 — 1 0 8 6 [ 1 9 6 7 ] ; e i n g e g a n g e n am 24 . Jun i 1967)
Ketocarotinoide sind aus verschiedenen Grünalgen (Chlorococcales, Volvocales, Siphonales) bei Stickstoff-
1 G . DERSCH, Flora [Jena] 1 4 9 , 5 6 6 [ 1 9 6 0 ] ; E . K E S S L E R U . F . - C . C Z T G A N , Arch. Mikrobiol. 5 5 , 3 2 0 [ 1 9 6 7 ] ; E . K E S S L E R , Arch. Mikrobiol. 5 5 , 3 4 6 [ 1 9 6 7 ] ; F . - C . C Z Y G A N , in Vorbe-reitung [ 1 9 6 8 ] .
Der D e u t s c h e n F o r s c h u n g s g e m e i n s c h a f t danken wir für eine Sachbeihilfe, Herrn Dr. A. P R O X für die Aufnahme von Massenspektren und Herrn Dr. H. TSCHESCHE für Aminosäureanalysen.
ben 6.) Die in der Tabelle dargestellten Werte stammen aus einem solchen Versuch.
Bei der Milchsäurebildung fanden wir bei He-patom-Asciteszellen der Ratte, wie auch bei Walker-Asciteszellen nach Inkubation im HS eine signifikante Hemmung. An Leberexplantaten findet sich nach Zu-satz von HS eine Stoffwechselsteigerung 2. Das unter-schiedliche Verhalten der Hepatom-Asciteszellen könnte vielleicht dadurch erklärt werden, daß die Hepatomzel-len noch Leber-spezifische Eigenschaften besitzen.
Stdn. nach Zusatz Abweichung
der Seren A B B gegen A Walker-Asciteszellen (in % )
2 100 ± 2 83 ± 1 - 17 4 74 ± 3 60 ± 4 - 19
Hepatom-Asciteszellen 2 97 ± 2 100 ± 3 + 3 4 90 ± 6 89 ± 2 - 1
Tab. 1. Sauerstoffverbrauch von Walker- und Hepatom-Ascites-zellen der Ratte in vitro nach Inkubation in Normalserum (A) und Serum teilhepatektomierter Ratten (B) im gleichen An-satz. Die Werte entsprechen der Abnahme des Druckes in Brodie. Mittelwerte aus 3 gleichartigen Ansätzen mit Stan-dardabweichungen. Ein Ansatz bestand aus 0,6 ml Tumorzell-suspension (Walker: 4-104 Zellen pro /ul. Hepatom 2-104 Zel-len pro zur Erreichung vergleichbarer Sauerstoffumsätze)
und 1,4 ml Serum. 4 N. L . T R O T T E R , Cancer Res. 21, 778 [1961]. 5 F. J. M O Y A , Exp. Cell Res. 31, 457 [1963]. 6 H. W R B A and M. V O L M , Europ. J. Cancer 3, 143 [1967].
mangel isoliert worden (Zusammenfassung: *). Nach den bisherigen Untersuchungen handelt es sich haupt-sächlich um Echinenon (4-Oxo-/?-carotin), Canthaxan-thin (4.4'-Dioxo-/?-carotin) und Astaxanthin (3.3'-Di-oxi-4.4'-dioxo-/3-carotin) (vgl. 1. c.1 ' 2) . Auffallender-weise konnte ein Trioxo- bzw. Monooxi-dioxo-Derivat des yS-Carotins noch nicht nachgewiesen werden.
Kürzlich isolierten wir aus Chlorococcum. wimmeri Rabenhorst 213-43 und aus Aplanosporen von Haemato-coccus spec. 4, die wir aus einer durch diese Organis-men blutrot gefärbten Regenpfütze bei Erlangen sam-
2 F . - C . CZYGAN, Experientia [Basel] 20, 573 [1964] ; Z . Na-turforschg. 21 b, 197 [1966].
3 Nr. der Algensammlung PRINGSHEIM, Göttingen; vgl. W. K O C H , Arch. Mikrobiol. 47, 402 [1964].
4 Es gelang uns nicht, eine Reinkultur dieser Algen herzu-stellen.
![Synthese von optisch aktivem 6,11-Methylen-lipoxin B · den Eigenbedarf benötigten Lipid-Entzündungsmediatoren als „Organ“ fungieren. [10] Die AA 3 kann auf zwei unterschiedlichen](https://static.fdokument.com/doc/165x107/5d5d0be388c993be038bc9d6/synthese-von-optisch-aktivem-611-methylen-lipoxin-b-den-eigenbedarf-benoetigten.jpg)