Baukalke, Gips und Anhydrit - uni-due.de · IBPM ©2005 Prof. Setzer 1 IBPM Campus Essen IBPM D U I...
Transcript of Baukalke, Gips und Anhydrit - uni-due.de · IBPM ©2005 Prof. Setzer 1 IBPM Campus Essen IBPM D U I...

IBPM ©2005 Prof. Setzer 1
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und Materialwissenschaft
Baukalke, Gips und Anhydrit

IBPM ©2005 Prof. Setzer 2
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftInhaltsangabe
• Verfestigungsprozesse– Hydrolyse und Hydratation– hydratische Verfestigung– hydraulische Verfestigung– carbonatische Verfestigung
• Gips– Vorkommen– Brennen– Hydratstufen– Erhärtung
• Kalk– Vorkommen– Kristallmodelle– Brennen– Entsäuerung– Löschen– Kalkarten– Erhärtung von Luftkalken und hydraulischen Kalken

IBPM ©2005 Prof. Setzer 3
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftInhaltsangabe
• Zement– Zementarten– Dreistoffsystem– Klinkerphasen– Verhalten der Klinkermineralien– Hydratisierungsverlauf– Verfestigung– Gefügeentwicklung– Hydratisierung von C3S und C2S– Hydratisierung von C3A– Erstarrungsregelung– Hydratisierung von C4AF– Sulfattreiben– Carbonatisierung– Friedelsches Salz

IBPM ©2005 Prof. Setzer 4
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftVerfestigungsprozesse
Unter Verfestigung wird im Bauwesen in der Regela. der Übergang eines fluiden Mediums in ein
festes Medium oder b. der Übergang eines weniger festen Mediums in
ein Medium höherer Festigkeit verstanden.
• Die ablaufenden Verfestigungsprozesse können in mehrere Teilprozesse untergliedert werden.
• Unterscheidungskriterien sind die chemischen Umsetzungen bei der Verfestigung.
• Entscheidend sind die auftretenden Hydrolyse-und Hydratationsreaktionen.

IBPM ©2005 Prof. Setzer 5
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftHydrolyse
Unter Hydrolyse versteht man eine chemische Reaktion, bei der eine Verbindung durch Einwirkung von Wasser gespalten wird.Allgemein:
AB + H-OH → AH + B-OHInfolge der Hydrolyse kommt es zu einer Verschiebung des pH-Wertes.
Ca2SiO4 + 4•H2O → 2•Ca2+ + SiO44-+ 4•H2O → 2•Ca2+ + H4SiO4+ 4•OH-
Hier entsteht Kieselsäure, die fast undissoziiert vorliegt. Es kommt zu einem Überschuss an Hydroxidionen, was den pH-Wert >> 7 werden lässt.

IBPM ©2005 Prof. Setzer 6
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftHydratation
• Unter Hydratation versteht man allgemein die Anlagerung von Wasser an eine chemische Verbindung unter Bildung eines Hydrates.
CaSO4•½H2O+1,5 • H2O→CaSO4 • 2H2O• Das Wasser kann reversibel aufgenommen
werden.• Bei der Zementhydratation wird der Begriff weiter
gefasst.• Bei der Zementhydratation kommt es bei der
Reaktion zu einem „Verbrauch“ von Wasser. Unabhängig davon in welcher Form das Wasser reagiert, spricht man dennoch von einer Hydratation.

IBPM ©2005 Prof. Setzer 7
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftUnterschiedliche Arten der Verfestigung
• Es werden drei generell unterschiedliche Arten der Verfestigung bei mineralischen Bindemitteln unterschieden:– hydratische Verfestigung– hydraulische Verfestigung– carbonatische Verfestigung

IBPM ©2005 Prof. Setzer 8
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftHydratische Verfestigung
• Unter hydratischer Verfestigung versteht man die Reaktion eines Bindemittels mit Wasser, die unter Wasserverbrauch zu einem festen Endprodukt führt.
• Bei einem großen Wasserüberschuss und unter Wasser findet keine Verfestigung statt.
Gipsverfestigung:CaSO4•½H2O+1,5 • H2O→CaSO4 • 2H2O

IBPM ©2005 Prof. Setzer 9
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftHydraulische Verfestigung
• Zu Beginn der Reaktion findet eine Hydrolyse statt, falls die Ausgangsstoffe aus stärker basischen Kationen und schwächer sauren Anionen bestehen.
• Die Ausgangsstoffe werden aufgespalten und H2O wird fest eingebunden. Das Wasser wird nicht einfach angelagert sondern chemisch gebunden.
• Neben der chemischen Bindung werden auch noch H2O-Anteile physikalisch gebunden.
• Die hydraulische Erhärtung kann auch unter Wasser stattfinden und die gebildeten Produkte sind weitestgehend wasserfest.
Hydratation von C3S:2(3CaO•SiO2)+ 7H2O → 3CaO•2SiO2•4H2O + 3Ca(OH)2

IBPM ©2005 Prof. Setzer 10
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftCarbonatische Verfestigung
• Bei der carbonatischen Verfestigung wird atmosphärisches CO2 aufgenommen und chemisch gebunden.
Verfestigung von Kalkmörtel:Ca(OH)2 + CO2 + H2O → CaCO3 + 2H2O

IBPM ©2005 Prof. Setzer 11
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und Materialwissenschaft
Gips

IBPM ©2005 Prof. Setzer 12
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftGipsvorkommen
• Gips ist schwefelsaures Calcium, das in der Natur als Gipsstein vorkommt.
• Der Gipsstein wird als Dihydrat bezeichnet und hat die Form CaSO4*2H2O.
• Neben den reinen Naturvorkommen fällt das Dihydrat unter anderem auch noch als Nebenprodukt in der Rauchgasentschwefelung an.SO2 + H2O + ½O2 H2SO4
H2SO4 + Ca(OH)2 CaSO4*2H2O

IBPM ©2005 Prof. Setzer 13
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftGipsbrennen
• Beim Brennen des Rohgipses wird nur Kristallwasser ausgetrieben.
• Das Calciumsulfat wird nicht umgewandelt.• Je nach Brenndauer und Brenntemperatur bilden
sich unterschiedliche Modifikationen aus.130..180
4 2 4 2 2180
4 2 4 2
2 1 2 1,52 2
C
C
CaSO H O CaSO H O H O
CaSO H O CaSO H O
°
> °
⋅ ⎯⎯⎯⎯→ ⋅ +
⋅ ⎯⎯⎯⎯→ +
Halbhydrat
Anhydrit

IBPM ©2005 Prof. Setzer 14
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftHydratstufen des Calciumsulfats
HydratstufeChemische Formel
Bezeichnung Form
CaSO4*2H2OCalsiumsulfat-dihydrat Ausgangsstoff
CaSO4*1/2*H2O α 110
nasses Brennen, hohe Festigkeit
β 125
trockenes Brennen, niedrige Festigkeit
CaSO4 α 110β 290
CaSO4 Anhydrit II 300-500CaSO4 Anhydrit I 1200
Anhydrit III
Calciumsulfat-halbhydrat
techn. Entstehungs-temperatur in °C
Bemerkungen

IBPM ©2005 Prof. Setzer 15
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftGipserhärtung
• Gips ist ein nur an der Luft erhärtendes Bindemittel.• Man spricht von einer hydratischen Verfestigung.• Bei der Hydratation des Wasser-Gips-Gemisches finden
keine chemischen Umwandlungen statt.• Abbinden und Erhärten des Gipses ist ein
Kristallisationsvorgang.
2(CaSO4*½H2O)+3H2O 2(CaSO4*2H2O) + 38,6kJ/Formelumsatz
CaSO42H2O 2(CaSO4*2H2O) + 30,23kJ/mol

IBPM ©2005 Prof. Setzer 16
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKristallwasser
• Das zuvor ausgetriebene Kristallwasser wird wieder eingebaut.
• Dabei wird exakt soviel Wasser aufgenommen wie zur Bildung von CaSO4*2H2O erforderlich ist.
• Die Menge des erforderlichen Wasser hängt von der Restkristallwassermenge der Hydratphase ab.

IBPM ©2005 Prof. Setzer 17
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftBeispiel Stuckgips
CaO SO3 H2ODihydrat
CaSO4 2H2O
CaO SO3 H2O
CaSO4 ½H2O
1½H2O beim Brennen ausgefallenHalbhydrat
Brennen
CaO SO3
CaSO4 n*H2O
Gipsbrei
Anmachen
CaO SO3 H2O
CaSO4 2H2O
überschüssigesH2O verdunstet
Dihydrat(abgebundener
Gips)
Abbinden

IBPM ©2005 Prof. Setzer 18
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftAnregung von Anhydrit A II
Es werden drei Arten der Anregung unterschieden:– Sulfatische Anregung
Alkalisulfate FeSO4, ZnSO4,CuSO4
– Basische AnregungAlkalihydroxide Ca(OH)2, Portlandzement
– Saure AnregungH2SO4, KHSO4, NaHSO4

IBPM ©2005 Prof. Setzer 19
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und Materialwissenschaft
Kalk

IBPM ©2005 Prof. Setzer 20
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKalkvorkommen
• Calciumcarbonat tritt in drei Modifikationen auf, dem Calcit, Vaterit und Aragonit.
• Alle drei Modifikationen weisen dasselbe Molekulargewicht und bestehen zu 56,03% aus CaO und 43,97% aus CO2.
• Der Unterschied der Modifikationen liegt in ihrem zugrunde liegenden Kristallaufbau.
• Von den drei genannten Modifikationen ist lediglich Calcit unter normalen Bedingungen stabil.
• Vaterit und Aragonit sind metastabil.

IBPM ©2005 Prof. Setzer 21
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKristallmodelle

IBPM ©2005 Prof. Setzer 22
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKristallaufnahmen - Calcit

IBPM ©2005 Prof. Setzer 23
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKristallaufnahmen - Aragonit

IBPM ©2005 Prof. Setzer 24
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKalkbrennen
• Carbonate werden bei hohem Temperaturen in CaO und CO2 zersetzt.
•Der Brennprozess wird auch als Calcinierung oder Entsäuerung (Dissoziation) bezeichnet.•Die Dissoziationstemperatur und das Brennverhalten sind abhängig von:
•Kalksteinart•Verunreinigungen im Kalkstein•Gitterzustands des Calcits•Korngröße•CO2-Patialdruck im Brennaggregat

IBPM ©2005 Prof. Setzer 25
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und Materialwissenschaft
Schematische Darstellung des Entsäuerungsprozesse
Kalkstein bei Raumtemperatur
Ausdehnung vor der Entsäuerung
Beginn der oberflächlichen Entsäuerung
Zersetzung ist abgeschlossen; die CaO-Kristallitewachsen
die CaO-Kristallite wachsen weiter und sintern zusammen, Poren- und Probenvolumen nehmen ab

IBPM ©2005 Prof. Setzer 26
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftProzessparameter des Kalkbrennens
• Steigende Brenntemperaturen beschleunigen den Brennprozess.
• Zu hohe Brenntemperaturen wirken sich nachteilig auf das Endprodukt aus.– Größe der CaO-Kristalle nimmt zu– Packungsdichte der Kristalle nimmt zu– Porosität verringert sich– innere Oberfläche nimmt ab
• Löschreaktion mit Wasser erfolgt infolge dessen deutlich langsamer und träger.

IBPM ©2005 Prof. Setzer 27
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKalklöschen
• Die Umwandlung von Branntkalk CaO in Löschkalk Ca(OH)2 erfolgt in vier Phasen:
1. Wasseraufnahme (Adsorption von H2O-Molekülen)
2. Bildung metastabiler Oxidhydrate in der Zusammensetzung CaO*2H2O und CaO*H2O
3. Bildung von Calciumhydroxid (Portlandit)CaO*2H2O → Ca(OH)2+ H2O
4. Nachflockung und Agglomeration

IBPM ©2005 Prof. Setzer 28
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftGeschwindigkeit des Löschvorgangs
Der Löschvorgang erfolgt umso schneller und vollständiger:• je reiner der Branntkalk ist,• je frischer der Branntkalk ist,• je weicher er gebrannt wurde,• je reiner das Löschwasser ist,• je höher der Druck ist unter dem gelöscht wird.

IBPM ©2005 Prof. Setzer 29
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftTrockenlöschen - Nasslöschen
• Erfolgt das Löschen mit Wasserüberschuss, entsteht ein Kalkbrei und man spricht von Nasslöschen. (i.d.R. auf der Baustelle)
• Wird nur das stöchimetrisch erforderliche Wassermenge inklusive der verdampfende Wassermenge verwendet, entsteht Kalkpulver und man spricht von Trockenlöschen.

IBPM ©2005 Prof. Setzer 30
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKalkarten
• Bei Naturvorkommen – kein reiner Kalkstein - wird unterschieden in:– Luftkalke– Wasserkalke– hydraulische Kalke
• Unterscheidungskriterium ist der zunehmende Gehalt an Hydraulefaktoren.
Kalkart Anteile der Hydraulefaktoren(SiO2+Al2O3,Fe2O3) in %
Erforderliche Lufterhärtung in Tagen
Druckfestig-keit in N/mm²
Wasserkalk 10-15 7 1
hydraulischer Kalk 15-25 5 2hochhydraulischer Kalk 25-30 3 5

IBPM ©2005 Prof. Setzer 31
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftDreistoffdiagramm

IBPM ©2005 Prof. Setzer 32
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftErhärtungsprozess von Luftkalk
• Bei der Erhärtung von Kalkmörteln kommt es zu einer Bindung von Kohlendioxid aus der Umgebungsluft.
• Diese Erhärtungsart wird als Carbonaterhärtung bezeichnet, da als Endprodukt Calciumcarbonat entsteht.
• Man spricht auch von einer carbonatischenVerfestigung.

IBPM ©2005 Prof. Setzer 33
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftReaktionsgleichung
Die Reaktionsgleichung kann vereinfacht so beschrieben werden:
Ca(OH)2 + CO2 → CaCO3 + H2O + 112,9kJ/mol
Berücksichtigt man die für die Reaktion erforderliche Feuchtigkeit, muss man die Reaktion genauer formulieren:
Die Festigkeitsentwicklung erfolgt nicht durch den Verlust von Restfeuchtigkeit, sondern durch eine chemische Reaktion bei der Wasser freigesetzt wird.

IBPM ©2005 Prof. Setzer 34
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftReaktionsgeschwindigkeit
• In der Umgebungsluft sind lediglich 0,035 Vol.-% an CO2 enthalten.
• Infolge dessen verläuft die Carbonaterhärtung nur relativ langsam.
• Eine Erhöhung der CO2-Konzentration erhöht die Reaktionsgeschwindigkeit.
• Um die CO2-Konzentration zu erhöhen können Propangasbrenner eingesetzt werden (früher auch offene Koksöfen).

IBPM ©2005 Prof. Setzer 35
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftNebenprodukte
• Als Nebenprodukt bei der Carbonaterhärtung fällt Wasser an.
• Diese Wassermenge wird als Baufeuchtigkeit bezeichnet und muss über eine gute Lüftung abgeführt werden.
• Wird die Abtrocknungszeit zu gering gewählt, kann es im weiteren Baufortschritt bei nachfolgenden Gewerken zu Schäden kommen.

IBPM ©2005 Prof. Setzer 36
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftErhärtungsprozess von hydraulischem Kalk
• Hydraulische Kalke bestehen vorwiegend aus Calciumsilikaten, Calciumaluminaten, Calciumhydroxid und tonhaltigem Kalkstein.
• Diese Kalke erstarren und erhärten unter Wasser. Die Hydratationsprodukte sind wasserfest.
• Anders als bei den Luftkalken trägt das atmosphärische Kohlendioxid zwar zum Erhärtungsprozess bei, ist aber nicht alleiniger Motivator der Erstarrung.

IBPM ©2005 Prof. Setzer 37
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und Materialwissenschaft
Zement

IBPM ©2005 Prof. Setzer 38
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftZement
• Zement besteht aus Verbindungen von Calciumoxid mit Siliciumdioxid, Aluminiumdioxid und Eisenoxid.
• Die wichtigsten Rohstoffe sind natürliche Mineralien:– Kalkstein, Kreide– Ton, Feldspat– Quarzsand– Traß

IBPM ©2005 Prof. Setzer 39
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftZementarten
• Es werden drei Hauptarten von Zement unterschieden:– Portlandzement CEM I– Portlandkompositzement CEM II– Hochofenzement CEM III
• Portlandkompositzement und Hochofenzement werden aus Portlandzement unter Zugabe von Hüttensand, Flugasche, Puzzolanen und weiteren Stoffen hergestellt.

IBPM ©2005 Prof. Setzer 40
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftNomenklatur der Bestandteile
Bestandteil Darstellung
CaO C
SiO2 S
Al2O3 A
Fe2O3 F
MgO M
SO3 S
CaSO4 Cs,
Mn2O3
CS

IBPM ©2005 Prof. Setzer 41
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftDarstellung der Klinkerphasen
Klinkerphase FormelKurz-bezeichnung
Massenanteile im CEM I Klinker in %
Tricalciumsilicat (Alit) 3CaO•SiO2 C3S 60
Dicalciumsilikat (Belit) 2CaO•SiO2 C2S 15
Tricalciumaluminat 3CaO•Al2O3 C3A 11
Calciumaluminatferrit 4CaO•(Al2O3,Fe2O3) C4(A,F) 8
freier Kalk CaO C 1
freies Periklas MgO M 1

IBPM ©2005 Prof. Setzer 42
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftDreistoffsystem Portlandzement

IBPM ©2005 Prof. Setzer 43
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftZusammensetzung
Bestandteil Portlandzement Hochofenzement
CaO 64 53
SiO2 20 25
Al2O3 5 9
Fe2O3 2,5 1,6
MgO 0,1 0,5
SO3 1,5 3,5
Mn2O3 2,5 2,5
Da es sich um Mittelwerte handelt ist die Summe aller Bestandteile größer 100%.
Bei den Hochofenzementen wird zwischen Typ A und B unterschieden. Unterscheidungsmerkmal ist der unterschiedliche Gehalt an Hüttensand.

IBPM ©2005 Prof. Setzer 44
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftVerfestigung
• Bei der Verfestigung des Zements handelt es sich um eine hydraulische Verfestigung.
• Dabei werden die Ausgangsstoffe aufgespaltenund H2O wird fest eingebunden. Das Wasser wird nicht einfach angelagert sondern chemisch gebunden.
• Neben der chemischen Bindung werden auch noch H2O-Anteile physikalisch gebunden.
• Die hydraulische Erhärtung kann auch unter Wasser stattfinden und die gebildeten Produkte sind weitestgehend wasserfest.

IBPM ©2005 Prof. Setzer 45
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftHydratation von C3S und C2S
Die Hydratation von C3S und C2S kann schematisch wie folgt beschrieben werden:
3CaO•SiO2 + (3-a+b)H2O → aCaO•SiO2•bH2O + (3-a)Ca(OH)2
und
2CaO•SiO2 + (2-a+b)H2O → aCaO•SiO2•bH2O + (2-a)Ca(OH)2
Bei der Hydratation entstehen Calciumsilikathydrate (CSH-Phasen) ,mit variabler Zusammensetzung:
C3S + (x+y)H → CxSHy + zCHC2S + (2-x+y)H → CxSHy + (2-x)CH

IBPM ©2005 Prof. Setzer 46
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und Materialwissenschaft
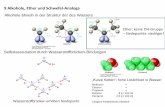
Hydratation von C3A ohne Sulfatanwesenheit
• C3A weist die höchste Reaktionsgeschwindigkeit aller Klinkermineralien auf.
• Ohne Anwesenheit von Sulfat hydratisiert C3A sofort zu Calciumaluminathydraten.
• Die Calciumaluminathydrate überbrückt augenblicklich den wassergefüllten Porenraum und führt zu einer Verfestigung.
2C3A + 21H → C4AH13 + C2AH8
• Infolge der sofortigen Verfestigung ist eine Verarbeitung des Materials nicht möglich.

IBPM ©2005 Prof. Setzer 47
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftHydratation des C4(A,F)
Die Hydratation von C4(A,F) erfolgt unter Beteiligung des zugegebenen Gipses und des bei der Hydratation von C3S und C2S entstandenen Ca(OH)2:
+ Ca(OH)2 + 3CaSO4 + 31H2O→ 3Ca•(Al2O3,Fe2O3)•3CaSO4•32H2O
+ Ca(OH)2 + CaSO4 + 11H2O → 3Ca•(Al2O3,Fe2O3)•CaSO4•12H2
+ 2Ca(OH)2 + 17H2O → 4CaO• (Al2O3,Fe2O3)•19H2O
2CaO•(Al2O3, Fe2O3)

IBPM ©2005 Prof. Setzer 48
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und Materialwissenschaft
Hydratation von C3A unter Sulfatanwesenheit
Die Hydratation von C3A erfolgt unter Beteiligung des zugegebenen Gipses und des bei der Hydratation von C3S und C2S entstandenen Ca(OH)2:
+ 3CaSO4 + 32H2O → 3Ca•Al2O3•3CaSO4• 32H2O
+ CaSO4 + 12H2O → 3Ca•Al2O3•CaSO4• 12H2O
+ Ca(OH)2 + 18H2O→ 4CaO•Al2O3•19H2O
3CaO•Al2O3

IBPM ©2005 Prof. Setzer 49
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKlinkerphasen
• Beim Brennen der eingesetzten Oxide entstehen die so genannten Klinkerphasen.
• Geringfügige Verschiebungen innerhalb der Menge der Ausgangsstoffe haben signifikante Auswirkungen auf die Zusammensetzung der Klinkerphasen.
• Zur vereinfachenden Darstellung der Klinkerphasen hat man sich auf Abkürzungen verständigt.

IBPM ©2005 Prof. Setzer 50
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftVerhalten der Klinkermineralien
Festigkeit
Klinkerphase Hydratationsprodukt Beginn Ende
C3S
CSH-Phase, abspalten von Ca(OH)2
schnell und hoch hoch schnell 500 J/g
C2S
CSH-Phase, abspalten von Ca(OH)3 niedrig hoch langsam 250 J/g
C3ACaSO4, Trisulfat und Monosulfat niedrig niedrig schnell 1330 J/g
C4(A,F) C4(A,F)H13 niedrig niedrig langsam 420 J/g
ErhärtenHydratationswärme

IBPM ©2005 Prof. Setzer 51
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftHydratationsverlauf

IBPM ©2005 Prof. Setzer 52
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftEinfluss des w/z-Wertes
Bei vollständiger Hydratation der Ausgangsprodukte werden 25 M-% des Wassers chemisch und 15 M-%physikalisch gebunden.

IBPM ©2005 Prof. Setzer 53
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftGefügeentwicklung
• Die Gefügeentwicklung kann in drei Stufen gegliedert werden.– Anmachphase
Es liegt eine Suspension von Zement und Wasser ohne Festigkeit vor. Die Oberfläche der Zementkörner ist mit einer dünnen Hydratschicht belegt.
– ErstarrungsphaseLange Kristallfasern breiten sich von der Oberfläche der Zementkörner aus und überbrücken die Zwischenräume. Je länger diese Phase anhält umso höher wird die Endfestigkeit.
– ErhärtungsphaseNoch bestehende Hohlräume werden mit kurzen Kristallfasern ausgefüllt.

IBPM ©2005 Prof. Setzer 54
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftKlassische Theorien der Zementerhärtung
Kristalltheorie Kolloidtheorie
1. Periode In Lösung gehen der Klinkerbestandteile, Hydrolyse + Hydratation, Übersättigte Lösung
Bildung kolloidaler Grund-masse aus Ca-Si-Hydrat, Ca-Al- und Ca-Fe-Hydrat, Gel
2.Periode Ausscheidung sich verfilzender, nadelförmiger Kristalle aus übersättigter Lösung
Schrumpfung des Hydrogels

IBPM ©2005 Prof. Setzer 55
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftErstarrungsregelung
• Dem Zement wird Gips zur Erstarrungsregelung beigemischt.
• In den ersten Minuten der Anmachphase bildet sich auf den Oberflächen der C3A-Kristallen ein Überzug aus Trisulfat.
• Die erhebliche Volumenzunahme wird ohne Schaden aufgenommen, da der Zementleim noch beweglich ist.
• Die Reaktion des C3A wird so verlangsamt, da der Wasserzutritt deutlich gebremst wird.
• Das Trisulfat bildet erst nach mehreren Stunden langprismatische, stäbchenförmige Trisulftakristalle, die eine Verzahnung und damit eine erste Verfestigung hervorrufen.

IBPM ©2005 Prof. Setzer 56
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftHydratationsverlauf

IBPM ©2005 Prof. Setzer 57
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und Materialwissenschaft
• Die Reaktionsgleichungen geben den Hydratationsverlaufnur angenähert wieder.
• Die reale Zusammensetzung der Hydratationsprodukteweicht von den stöchiometrischen Formeln mehr oder weniger stark ab.
• C3A und C2(A,F) hydratisieren nicht unabhängig voneinander.
• Die vom C2(A,F) gebildeten Fe3+-Ionen werden sowohl vom Ca4AH19 als auch vom Ettringit (Trisulfat) und vom Monosulfat aufgenommen.
• Häufig werden diese Hydrate deswegen zusammengefasst und es wird nur noch zwischen AFt-(Trisulfat) bzw. AFm-Phasen (Monosulfat) unterschieden.

IBPM ©2005 Prof. Setzer 58
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftReaktion eines Zementkorns

IBPM ©2005 Prof. Setzer 59
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftGrößenordnung
1 nm 30 nm 1 µm 30 µm 1 mm
Meso-gelporen
Pore
n
Mik
roge
lpor
en Mikro-kapillarporen
1 cm
Gefüg
e
Zuschlag
charakteristische Länge
ZuschlagSandZement
Sand ZuschlagZement
ZuschlagSandHydrate
AugeSEM Mikroskop
Meso-kapillarporen
Makro-kapillarporen
Haufwerks-poren

IBPM ©2005 Prof. Setzer 60
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftSulfattreiben
Wirken auf erhärteten Beton oder Mörtel sehr sulfathaltige Lösungen ein, so kommt es in Gegenwart von Calciumaluminat bzw. Calciumaluminathydraten zur Bildung von Trisulfat (Sekundär-Ettringit):
3CaO•Al2O3+3(CaSO4 •2H2O)+26H2O → 3CaO•Al2O3•CaSO4 • 32H2O
Der Übergang von C3A zu Trisulfat ist mit einer Zunahme des Molvolumens um den Faktor 7-8 verbunden. Dies führt zu einer erheblichen Sprengwirkung.

IBPM ©2005 Prof. Setzer 61
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftCarbonatisierung
Das bei der Hydratation gebildete Ca(OH)2 reagiert mit dem atmosphärischen CO2 als Base in einer Neutralisationsreaktion zu Calcit.
Ca(OH)2 + CO2 + H2O → CaCO3 + 2H2O
Diese Neutralisationsreaktion wird als Carbonatisierungbezeichnet.

IBPM ©2005 Prof. Setzer 62
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftCarbonatisierungsgeschwindigkeit
• Die Carbonatisierung verläuft wesentlich langsamer als die Hydratisierung.
• Die Eindringtiefe der Carbonatisierungsfrontschreitet mit einem Wurzel-Zeit-Gesetz voran:
y = c•√tmit
y = Carbonatisierungstiefec = Carbonatisierungskoeffizientt = Zeit in Jahren

IBPM ©2005 Prof. Setzer 63
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftEinflussparameter auf die Carbonatisierung
• Die Carbonatisierungsgeschwindigkeit hängt von folgenden Faktoren ab:– Betonzusammensetzung– Qualität der Nachbehandlung– Zusammensetzung des Zements– Temperatur – Luftfeuchtigkeit
• Unter Wasser kann keine Carbonatisierungstattfinden, da der CO2-Zutritt verhindert wird.

IBPM ©2005 Prof. Setzer 64
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftEinwirkung von CO2 auf Monosulfat
CO2
Aluminium-hydroxid
+
Gips
+
CalcitMonosulfat
Ettringit
Monosulfat
Porenlösung

IBPM ©2005 Prof. Setzer 65
IBPM
IBPMCampus Essen
D U I S B U R GE S S E N
Universität Institut fürBauphysik und MaterialwissenschaftFriedelsches Salz
Cl, NaClMonosulfat
Ettringit
MonosulfatPorenlösung
Friedelsches Salz
Wirkt Chlorid oder NaCl in hohen Konzentrationen auf den hydratisierten Zementstein ein, so kann mit CaCl2(Friedelsches Salz), ein Calcium-Aluminium-Chloridhydrat entstehen. 3Cao•Al2O3•CaCl2•10H2O










![VC,[ ;]gGT J HDFVT V[8,[ D:,S[ VFc,F ChZT · s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s s T T s s](https://static.fdokument.com/doc/165x107/5f0d1d827e708231d438c0d8/vc-ggt-j-hdfvt-v8-ds-vfcf-chzt-s-s-s-s-s-s-s-s-s-s-s-s-s-s-s-s-s-s-s.jpg)