Bulletin 3 2018 - CFCH · la recherche fondamentale − le plus souvent en laboratoire. Viennent...
Transcript of Bulletin 3 2018 - CFCH · la recherche fondamentale − le plus souvent en laboratoire. Viennent...

Bulletin no 3/18
Studien bei CFÉtudes en matière de mucoviscidose
Studi relativi alla FC

Nestlé Suisse S.A., Nestlé Health ScienceEntre-Deux-Villes, 1800 VeveyInfoline: 0848 000 303info@medical-nutriti on.chwww.nestlehealthscience.ch
300 kcal, 6 g Eiweiss pro Flasche ▪ mit oder ohne Nahrungsfasern ▪ Schoko, Vanille, Erdbeere, Banane 300 kcal, 6 g protéines par bouteille ▪ avec ou sans fi bres ▪ Chocolat, Vanille, Fraise, Banane
ab Jahrdès an1
Energiereiche Trinknahrungen mit angepasstem Eiweissprofil
für Kinder
Compléments nutritifs riches en énergie avec profil protéique
adapté aux enfants
Bei cystischer Fibrose ist die Nährstoffresorption im Verdauungstrakt beeinträchtigt. Hochkalorische Trinknahrungen können helfen, den dadurch entstehenden Mangel auszugleichen*.
En cas de mucoviscidose, l’absorption des nutriments est altérée dans le tube digestif. Un complément nutritif hypercalorique peut aider à combler ce manque*.
*htt ps://www.nhlbi.nih.gov/health/health-topics/topics/cf/

Editorial 4
Generalversammlung 2019 6
Studien bei CF 8
Adressen 34
Éditorial 4
Assemblée générale 2019 6
Études en matière de mucoviscidose 18
Adresses 34
Editoriale 4
Studi relativi alla FC 26
Indirizzi 34
Inhalt
Sommaire
Indice
Nestlé Suisse S.A., Nestlé Health ScienceEntre-Deux-Villes, 1800 VeveyInfoline: 0848 000 303info@medical-nutriti on.chwww.nestlehealthscience.ch
300 kcal, 6 g Eiweiss pro Flasche ▪ mit oder ohne Nahrungsfasern ▪ Schoko, Vanille, Erdbeere, Banane 300 kcal, 6 g protéines par bouteille ▪ avec ou sans fi bres ▪ Chocolat, Vanille, Fraise, Banane
ab Jahrdès an1
Energiereiche Trinknahrungen mit angepasstem Eiweissprofil
für Kinder
Compléments nutritifs riches en énergie avec profil protéique
adapté aux enfants
Bei cystischer Fibrose ist die Nährstoffresorption im Verdauungstrakt beeinträchtigt. Hochkalorische Trinknahrungen können helfen, den dadurch entstehenden Mangel auszugleichen*.
En cas de mucoviscidose, l’absorption des nutriments est altérée dans le tube digestif. Un complément nutritif hypercalorique peut aider à combler ce manque*.
*htt ps://www.nhlbi.nih.gov/health/health-topics/topics/cf/

4 | cf-bulletin nº3/2018
Editorial I Éditorial I Editoriale
Le secrétariat sera fermé du24 décembre 2018 au 4 janvier 2019 inclus.Merci de votre compréhension.
Die Geschäftsstelle bleibt vom 24. Dezember 2018bis und mit 4. Januar 2019 geschlossen.Danke für Ihr Verständnis.
Il segretariato rimane chiuso dal24 dicembre 2018 al 4 gennaio 2019 compreso. Grazie per la comprensione.
Liebe Leserin, lieber Leser
Sie werden sich fragen, warum wir ein Heft zu klinischen Studien machen, wo doch im Moment die neuen Medikamente in aller Munde sind. Ganz einfach: Bis neue Medikamente zu-gelassen werden können, braucht es vorher sehr viele Studien. Angefangen bei Grundla-genforschung, meist im Labor, über klinische Studien und Zulassungsstudien. Aber selbst wenn Medikamente bereits zugelassen sind, werden Studien durchgeführt, um weiterhin die Wirkung zu überprüfen und z. B. seltene Nebenwirkungen zu erkennen.
In diesem Heft möchten wir verschiedene Ar-ten von Studien vorstellen. Wir haben uns auf Studien beschränkt, mit denen Sie in Berüh-rung kommen könnten, das heisst, wir haben z. B. die Grundlagenforschung nicht mit ins Heft aufgenommen. Andreas Jung schreibt über Registerstudien, das heisst, über Studien, die anhand von Registerdaten durchgeführt werden. Eine jugendliche Patientin mit CF, die schon an zahlreichen klinischen Studien teilgenommen hat, schildert ihre Erlebnisse. Florian Singer stellt das sogenannte «Clini-cal Trials Network» (CTN) der europäischen CF-Organisation vor und ich schreibe über die verschiedenen Arten von klinischen Stu-dien.
Wir hoffen, dass Sie so einen Einblick in die Welt der klinischen Studien bekommen und freuen uns über Ihr Feedback. Viel Vergnü-gen bei der Lektüre.
Prof. Dr. med. Philipp Latzin, PhD, Abteilungs-leiter Universitätsklinik für Kinderheilkunde, Facharzt Pädiatrie und pädiatrische Pneumo-logie Inselspital / Universitätsspital Bern
Chère lectrice, cher lecteur,
Vous vous demandez probablement pour-quoi nous consacrons un bulletin à des études cliniques, alors que les noms de nouveaux médicaments sont actuellement sur toutes les lèvres. Tout simplement parce qu’un très grand nombre d’études préalables est nécessaire avant que de nouveaux médi-caments soient autorisés, à commencer par la recherche fondamentale − le plus souvent en laboratoire. Viennent ensuite les essais cliniques, puis les études en vue d’une au-torisation de mise sur le marché. Même une fois les médicaments autorisés, des études sont encore réalisées, pour vérifier leur ef-ficacité et détecter, par exemple, des effets secondaires rares.
Nous souhaitons, dans ce bulletin, vous présenter différents types d’études. Nous nous sommes limités à celles que vous pourriez être confronté-e-s. Nous avons, par exemple, exclu la recherche fondamentale de cette édition. Andreas Jung décrit des études basées sur les données de registres. Une jeune patiente atteinte de mucoviscidose qui a déjà participé à de nombreuses études cliniques décrit son expérience. Florian Singer présente le réseau « clinical trials network » (CTN) de la Société européenne de mucoviscidose. Quant à moi, je vous pro-pose un article sur différents types d’études cliniques.
Nous espérons vous offrir ainsi un aperçu de l’univers des études cliniques et attendons vos réactions avec impatience. Bonne lecture !
Prof Dr méd. Philipp Latzin, Ph.D., Chef de service, Département de pédiatrie, Pneumo-logie pédiatrique et pédiatrique, Inselspital /Hôpital universitaire de Berne
Care lettrici, cari lettori,
Vi chiederete perché dedichiamo un bollet-tino agli studi clinici, quando l’argomento attualmente sulla bocca di tutti sono i nuovi farmaci. La ragione è molto semplice: l’omo-logazione di nuovi medicamenti presuppone la realizzazione di numerosi studi, a comin-ciare dalle ricerche di base, che avvengono perlopiù in laboratorio, passando per gli studi clinici e gli studi condotti in vista della ri-chiesta di omologazione. Ma anche dopo l’omologazione dei medicamenti vengono realizzati degli studi, per continuare a testare i loro effetti e, ad esempio, individuare rare controindicazioni.
In questo numero presentiamo diversi tipi di studi in cui voi potreste incappare. Ciò significa che fra i vari contributi non figura ad esempio la ricerca di base. Andreas Jung scrive in merito a studi di registro, ovvero quelli effettuati sulla base di dati contenuti nei registri. Una giovane paziente con fibro-si cistica che ha già partecipato a numero-si studi clinici descrive le sue esperienze. Florian Singer presenta invece il cosiddetto «clinical trials network» (CTN) della Società europea di fibrosi cistica, mentre io descrivo i vari tipi di studi clinici esistenti.
Ci auguriamo che i nostri contributi vi aiutino a farvi un’idea del mondo degli studi clinici e saremo lieti di ricevere i vostri feedback. Buona lettura!
Prof. Dr. med. Philipp Latzin, Dottore di Ri-cerca, Dipartimento di Pediatria, Pediatria Specialistica e Pneumologia Pediatrica, Inselspital / Ospedale universitario Berna

5
Der Philips Luftreiniger unterstützt die Inhalationstherapie präventiv indem er 99.9% der luftübertragenen Allergene wie Pollen und Hausstaubmilben entfernt. E�zient, angenehm leise, schnell und unkompliziert zu benutzen.
Erfahren Sie mehr unterLuftreinigung: www.philips.ch/luftreiniger Inhalation: www.philips.ch/innospire-go
Kinderleicht durchatmen
Shield_White_2013
Version 1.1 – 25 October 2013

6 | cf-bulletin nº3/2018
Liebe MitgliederWir freuen uns, Sie auf die Generalver-sammlung der CFCH am 30. März 2019 in Bern (Unia, Weltpoststrasse 20) hinzu-weisen. Informationen zur Veranstaltung werden Sie zu einem späteren Zeitpunkt erhalten. Wir freuen uns auf Ihr zahlreiches Erscheinen! Im Rahmen der Generalversammlung der CFCH schreiben wir einen Ehrenpreis (Award) für Personen aus, die sich in besonderem Masse für die Anliegen von Menschen mit Cystischer Fibrose und der CFCH einsetzen oder durch grossen persönlichen Einsatz auf das Schicksal von Menschen mit CF aufmerksam machen. Beim Preis handelt es sich nicht um einen Geldpreis, sondern um eine persönliche Ehrung.
Chers membres,Nous vous annonçons d’ores et déjà que la prochaine assemblée générale de la CFCH aura lieu le 30 mars 2019 à Berne (Unia, Weltpoststrasse 20). Des informations plus détaillées sur la mani- festation vous parviendront plus tard. Nous nous réjouissons de votre présence !
La CFCH a décidé de mettre au concours un prix d’honneur (award) pour les personnes qui s’engagent particulièrement en faveur de la cause des malades de la mucoviscidose et de la CFCH ou qui, par un grand enga-gement personnel, font connaître le destin des personnes atteintes de mucoviscidose. Le prix en question n’est pas un prix en es-pèces, mais un prix d’honneur personnel.
Wie wird die Preisträgerin oder der Preisträger ausgewählt?
• Mitglieder und Regionalgruppen der CFCH können Personen nominieren (diese müssen nicht zwingend Mitglieder der CFCH sein).
• Es können Personen für die beiden Kate-gorien «Freiwillige» und «Professionals» nominiert werden.
• Der Vorstand trifft eine Vorauswahl von fünf Nominationen.
• Per Internet-Voting wird pro Kategorie eine der nominierten Personen gewählt.
• Ehrung der gewählten Personen am 30. März 2019.
Comment procéder pour sélectionnerle lauréat ou la lauréate ?
• Les membres et les groupes régionaux de la CFCH peuvent nominer des personnes (celles-ci ne doivent pas forcément être membres de la CFCH).
• Il est possible de nominer des personnes pour les deux catégories « bénévoles » et « professionnels ».
• Le Comité effectue une présélection de 5 nominations.
• Avant l’assemblée générale, les membres de la CFCH peuvent voter par Internet pour l’une des 5 personnes nominées par catégorie.
• Le prix sera décerné à des personnes élues le 30 mars 2019.
Wie nominieren?
Die folgenden Angaben sind nötig, um eine Nomination einzugeben:• Name, Adresse, Telefonnummer, E-Mail• Alter und Geschlecht, Foto der Person• Begründung der Nomination, wieso hat
die Person die Ehrung verdient?
Wir bitten um Eingabe der Nominationen bis zum 31. Dezember 2018 per Mail ([email protected]) oder Post (CFCH, Postfach 686, 3000 Bern 8). Herzlichen Dank für Ihre Mitarbeit!
Les indications suivantes sont indispen-sables pour transmettre une nomination • Prénom, nom, adresse, localité • N° de téléphone, e-mail• Age et sexe• Raisons de la nomination ; pourquoi la
personne a-t-elle mérité cet honneur ?• Une photo de la personne
Vous voudrez bien envoyer les nominations d’ici au 31 décembre 2018 (par mail: [email protected] ou par poste: CFCH, CP 686, 3000 Berne 8). Merci de votre collaboration !
Generalversammlung 2019 I Assemblée générale 2019

7Vifor Pharma engagiert sich im Kampf gegen Cystische Fibrose
Vifor Pharma s’engage pour la lutte contre la mucoviscidose

8 | cf-bulletin nº3/2018
Studien bei CF
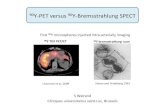
Praktisch gesehen sind Patientenregister grosse Datenbanken, in denen anonymisierte Gesundheitsdaten von Patienten mit seltenen Erkrankungen systematisch und standardi-siert erhoben werden. Solche überregionalen Datensammlungen sind heute in der Medizin weit verbreitet, da sie wichtige Informationen, beispielsweise zum Gesundheitszustand der Patienten, zur Wirksamkeit von Therapien oder zu Komplikationen einer bestimmten Erkrankung, liefern, wie sie durch regionale Beobachtungen (z. B. zentrumsbasiert) auf-grund der geringen Fallzahl der Patienten nicht möglich oder nicht repräsentativ wären. Dies kommt nicht nur dem wissenschaftlichen Fort-schritt, sondern letztlich auch den Patienten zugute, da sich die Qualität der Gesundheits-versorgung u. a. auch aufgrund registerba-sierter Erkenntnisse kontinuierlich verbessert. Hierbei spielen einerseits jährliche nationale und internationale Registerauswertungen, an-dererseits aber auch v. a. eine Vielzahl von Forschungsprojekten mit Registerdaten (so-genannte Registerstudien) eine wesentliche Rolle. Die wichtigsten Aufgaben von Patienten- registern zeigt Tabelle 1.
Das Europäische CF-RegisterSeit 2008 ist das Schweizer CF-Register Bestandteil des Patientenregisters der Euro-päischen Cystischen Fibrose Gesellschaft (ECFS Patient Registry, ECFSPR), wobei erst seit 2015 alle Schweizer CF-Zentren teil-nehmen. Es kann davon ausgegangen wer-den, dass seither bis auf wenige Ausnahmen alle CF-Patienten, die in der Schweiz be-treut werden, im ECFSPR gemeldet sind. Die
Schweiz leistet damit nicht nur einen wesent-lichen Beitrag zum Europäischen Register und registerbasierten Forschungsprojekten, sondern die CF-Zentren in der Schweiz kön-nen ihrerseits auf die nationalen und euro-päischen Daten zugreifen, diese auswerten und auf diese Weise wichtige Fragen der Forschung und der klinischen Versorgung beantworten.Für eine erfolgreiche Implementation und
Durchführung eines Registerprojekts sind verschiedene organisatorische Strukturen und personelle Ressourcen erforderlich, wie sie in Abbildung 1 beispielhaft am ECFSPR dargestellt sind. CF-Zentren und nationale Patientenorganisationen wie die CFCH arbei-ten zusammen, um eine möglichst vollstän-dige Meldung aller Patienten zu erreichen. Das nationale Steuerungskomitee – in der
Studien mit PatientenregisternText: Dr. med. Andreas Jung, Koordinator CF-Register Schweiz, Mitglied Executive Committee ECFSPRBild: www.ecfs.eu
Was sind Patientenregister? Das Bundesamt für Gesundheit definierte 2011 Patientenregister als «Datensammlungen, aus welchen neben epidemiologischen Analysen und Evaluation von Behandlungskonzepten auch die Ermittlung von Qualitäts-indikatoren hinsichtlich Monitoring der Versorgungsqualität und Qualität der Leistungserbringung ermittelt werden können. Sie enthalten Daten über die gesamte Behandlungskette, weshalb sie sich besonders für die Beurteilung von Versorgungs-systemen eignen».
Tabe
lle 1
Aufgaben BeispieleRegisterstudien • Beschreibung des Gesundheitszustands
• Identifizierung von krankheitsmodifizierenden Faktoren• Vorhersage der Lebenserwartung
Benchmarking • Überwachung der medizinischen Versorgungsqualität• Identifikation von Schwächen• Überwachung von Optimierungsmassnahmen
Pharmakovigilanz • Überprüfung der Sicherheit und Wirksamkeit von Medikamenten• Post-Marketing-Studien• Überwachung von Limitationen im Rahmen einer Medikamentenzulassung
National Steering Committee
ECFSPR
Executive CommitteeExecutive
Coordinator
Helpdesk
Steering Group
Scientific Committee
National Coordinator
CF-Zentren
Patienten- organisationen
Abbildung 1: Struktur des ECFSPR
Keypoint 3Verantwortliche und Delegierte
Keypoint 2Unterstützung der
Patienten-Organisationen
Keypoint 1Verpflichtung der Zentren

9
Schweiz ist dies die Swiss Working Group for Cystic Fibrosis (SWGCF) – entsendet einen nationalen Koordinator in die Steer-ing Group des Europäischen CF-Registers. Nähere Informationen zur Struktur des ECFSPR finden sich auf der Website (siehe Infobox).
RegisterstudienDas ECFSPR erstellt in jedem Jahr einen Jahresbericht, der eine umfassende wis-senschaftliche Auswertung aller Daten des Registers enthält. Die Jahresberichte ste-hen auf der Website der ECFS als auch auf derjenigen der CFCH zum Download bereit (siehe Infobox). Für Laien stellt das ECFSPR jedes Jahr einen verständlichen Kurzbericht («At-a-glance- Report») zur Verfügung, der ebenfalls heruntergeladen werden kann. Zudem findet sich auf der Website des ECFSPR eine interaktive Karte, auf der die wichtigsten Registerdaten aller teilnehmen-den Länder per Mausklick in einer konden-sierten Übersicht dargestellt werden (Ab-bildung 2).
Während die jährliche Auswertung der Registerdaten in erster Linie den Gesund-heitszustand von Menschen mit CF in einer Region beschreibt, ist es im Rahmen von gezielten Registerstudien möglich, wichtige wissenschaftliche Fragestellungen anhand einer sehr grossen internationalen Daten-bank zu beantworten. Hierfür können An-fragen zur Datenauswertung («Data Re-quests») an das ECFSPR gerichtet werden. Neben den teilnehmenden Ländern, CF-Zen-tren und dem ECFSPR Scientific Committee können auch nationale und internationale wissenschaftliche Arbeitsgruppen, die sich mit CF beschäftigen, als auch die Industrie Anträge auf eine Datenauswertung an das ECFSPR stellen. Die Anträge werden vom Scientific Committee des ECFSPR und von der Steering Group geprüft und nach erfolg-ter Empfehlung vom Executive Committee genehmigt. Sie müssen hierbei strengen wissenschaftlichen Kriterien genügen, eine klare und innovative Fragestellung enthalten
und dürfen nicht allein auf Marketinganalyse abzielen. Nach Beendigung der Forschungs-projekte werden die Ergebnisse in einem internationalen medizinischen Journal pub-liziert und so allen zugängig gemacht. Auf diese Weise konnten in den letzten Jahren wichtige Erkenntnisse, beispielsweise zur Gesundheit von Menschen mit CF, zum Ver-lauf der Lungenfunktion, zum Stellenwert von Komplikationen und zu Infektionen bei CF, gewonnen werden. Die Liste der Publi-kationen aus dem ECFSPR wächst kontinu-ierlich an und kann auf der Website eingese-hen werden (siehe Infobox).
BenchmarkingBenchmarking erlaubt ein Vergleich von Indikatoren der Qualität der medizini-schen Versorgung (=Benchmarks) einer bestimmten Population, z. B. der Men-schen mit CF in einem bestimmten Land oder einer Region. Wichtigstes Ziel des Benchmarkings ist es folglich, die Ver-sorgungsqualität für alle CF-Patienten in der Schweiz und in Europa auf dem best-möglichen Level sicherzustellen und zu harmonisieren. Hierfür werden in diversen
Projekten die Daten von verschiedenen Zentren oder Ländern verglichen, Proble-me und Schwächen identifiziert und analy-siert und in einem zweiten Schritt – sofern sinnvoll – gemeinsam Massnahmen zur Strukturoptimierung ergriffen. Wichtig ist die sorgfältige Analyse der identifizierten Unter-schiede zwischen den Zentren, da es häufig Gründe für unterschiedliche Outcomes gibt, die nicht in der Versorgungsqualität zu su-chen sind (z. B. kann der Durchschnitt der Lungenfunktion oder des BMI in Zentren niedriger sein, die mehr schwerkranke Pa-tienten als andere betreuen).
Auf europäischer Ebene steht ab 2019 in der Registersoftware, dem ECFSTracker Vers. 2.0, ein spezielles Modul zur Verfü-gung, das einen solchen Zentrums- und Ländervergleich direkt in der Software er-laubt, sofern alle teilnehmenden Zentren zustimmen. Auf nationaler Ebene hat sich die SWGCF zu einem Benchmarkingprojekt entschlossen, welches ebenfalls ab 2019 starten wird. Dieses hat zum Ziel, die Qua-lität der klinischen Versorgung zentrums-basiert zu analysieren und entsprechend
Abbildung 2: Interaktive Karte mit einer Kurzübersicht der wichtigsten Registerdaten für jedes teilnehmende Land, abrufbar auf der Website des ECFSPR.

10 | cf-bulletin nº3/2018
Studien bei CF
zu verbessern. Hierbei geht es explizit nicht um die Identifizierung von «besseren» oder «schlechteren» CF-Zentren oder um ein «Zentrums-Ranking»; vielmehr sollen lo-kale Stärken und Schwächen identifiziert und durch spezifische Massnahmen aus-geglichen werden. Auf diese Weise können letztlich alle CF-Zentren und CF-Patienten direkt vom CF-Register profitieren.
PharmakovigilanzPharmakovigilanz, oder auch Arzneimittel-sicherheit, beschreibt in erster Linie die laufende und systematische Überwachung der Wirksamkeit und der Sicherheit eines Arznei mittels ab Marktzulassung in sogenann-ten Post-Marketing-Studien. Solche Studien können analog zu konventionellen klinischen Studien durchgeführt werden; in den letzten Jahren haben sich jedoch Patientenregis-ter als Plattformen für Pharmakovigilanz- Studien etabliert. Die Software des ECFSPR (ECFSTracker) ermöglicht durch ihren mo-dularen Charakter jederzeit, spezifische Variablen für solche Projekte zu implemen-tieren; zudem ist die in wissenschaftlichen Studien unabdingbare rigide Standardisie-rung und Qualitätsüberprüfung der Daten-eingabe im ECFSTracker bereits etabliert und durch das ECFSPR fortlaufend sicher-gestellt. Dies hat dazu geführt, dass die eu-ropäische Zulassungsbehörde EMA (Euro-pean Medical Agency) das ECFSPR im Jahr 2018 als Plattform für Post-Marketing-Stu-dien (Post-Authorisation-Safety-Surveillan-ce (PASS)- und Post-Authorisation-Efficacy (PAES)-Studien) offiziell akkreditiert hat.
Ein prominentes und international viel beachte-tes Beispiel in der Schweiz für eine registerba-sierte Pharmakovigilanz ist die Überwachung der Wirksamkeit von Kalydeco® im Rahmen einer vom Bundesamt für Gesundheit (BAG) verpflichtend vorgegebenen Limitation für die Abgabe des Medikaments. Nach dieser müs-sen für eine Kostenerstattung von Kalydeco® (Therapiekosten knapp 300 000 CHF pro Jahr) eine vorgegebene minimale Verbesserung der Lungenfunktion oder des Schweisstests
erfüllt sein, was für jeden Patienten alle drei Monate im CF-Register dokumentiert und einmal jährlich ans BAG gemeldet werden muss. Zudem müssen die Anzahl und die Dauer von pulmonalen Exazerbationen lü-ckenlos dokumentiert werden. Hierfür wurde ein spezifisches Modul des ECFSTracker in den Schweizer CF-Zentren etabliert. Falls bei einem Patienten die vorgegebenen Kri-terien nicht oder nicht mehr erreicht werden, muss die Therapie in der Regel gestoppt wer-den, weil die Erstattungsfähigkeit in diesem Fall nicht gegeben ist.
FazitPatientenregister sind mehr als Datensamm-lungen; vielmehr helfen sie, den Gesund-heitszustand von Menschen mit spezifi-
schen Erkrankungen wie CF in der Schweiz und in Europa besser zu beschreiben und zu verstehen. Mittels Benchmarking tragen Register zur Verbesserung der Qualität der Patientenversorgung bei; zudem kann die Si-cherheit und Wirksamkeit von zugelassenen Medikamenten in Post-Marketing-Studien standardisiert überprüft werden. Letztlich dienen Patientenregister auch dem medi-zinischen Fortschritt, da hierdurch wissen-schaftliche Fragestellungen anhand sehr grosser Datenmengen auch bei seltenen Erkrankungen untersucht und beantwortet werden können.
InfoboxWeiterführende Informationen zum ECFSPR sowie alle Jahresberichte und Kurzberichte stehen unter den folgenden Links zum Download bereit:
Jahresberichte des Europäischen CF-Registers inkl. «At-a-glance-Reports» (Kurzberichte): https://www.ecfs.eu/projects/ecfs-patient-registry/annual-reports
Alle Jahresberichte und Kurzberichte finden sich immer auch auf der CFCH-Website: http://www.cfch.ch/dienstleistungen/forschung/ecfs-patientenregister/
Ausführliche Informationen zum ECFS-Patientenregister inkl. «Interactive Map»: https://www.ecfs.eu/ecfspr
Aktuelle wissenschaftliche Publikationen aus dem ECFSPR: https://www.ecfs.eu/projects/ecfs-patient-registry/articles

Text: Vanessa Waser (14 Jahre)Bilder: Vanessa Waser
Schon mehrmals wurde ich gefragt, was man eigentlich an einer Studie so macht und weshalb.
Als Erstes wird man immer gefragt, ob man an einer Studie mitmachen will, denn die meisten gehen nicht nur einen Tag, sondern mehrere. Das heisst, dass man vielleicht alle 3–4 Wochen für einen Tag ins Spital gehen muss und dort alle nötigen Sachen getestet werden. Wenn man dann zustimmt und mitmachen will, geht es meistens noch eine oder zwei Wochen, bis man den ers-ten Termin erhält. Man sollte sich das gut überlegen, ob man wirklich mitmachen will, denn es sind immer wieder Tage, die man nur im Spital verbringt, und meistens ist es ja da nicht so spannend. Beim ersten Ter-min wird alles Mögliche getestet und ein oder mehrere Fragebögen mit sehr vielen Fragen ausgefüllt. Beim zweiten wird es dann schon spannender, denn da muss man z. B. einen Lungenfunktionstest oder einen Schweisstest und vieles mehr machen. Na-türlich ist das nicht bei allen Studien so, es ist jede wieder anders. Was mich persön-lich am meisten stört, sind die ständigen Blutentnahmen, denn gerade letztes Mal mussten sie es dreimal versuchen, bis es endlich geklappt hat. Aber da bin ich ja auch ein bisschen selbst schuld, denn mit so was muss man halt rechnen, wenn man bei einer Studie mitmacht. Bis jetzt musste ich auch immer einen Schweisstest machen. Da sind so wie zwei kleine Knöpfe, dort fliesst ganz ganz wenig Strom durch und auf der Haut spürt man nur ein feines Kribbeln oder Ste-chen. Das geht aber nur fünf Minuten und dann ist es schon fertig. Danach bekommt
man so etwas wie eine Uhr, dort saugt es den Schweiss, den man produziert hat, auf. Genauso muss ich auch immer einen Lungen-funktionstest machen, aber den muss ich glaube ich nicht erklären, den kennen ja fast alle. Dazu kommen meistens noch die ganz normalen Tests, z. B. Körpergrösse, Gewicht oder Sauerstoffgehalt im Blut messen. Das Wichtigste hätte ich fast vergessen: Das Meiste, das alle bei jeder Studie machen müssen, ist warten, warten, und nochmals warten. Über die Daten dieser Medikamenten-studie darf man noch nicht sprechen, denn sie sind noch streng geheim.
Einmal konnte ich auch an einer MRT-Studie mitmachen. Das ist eine Magnet-Resonanz- Tomografie, da muss man ca. eine halbe Stunde ganz ruhig in einem Rohr liegen das vorne und hinten offen ist. Es ist sehr laut, darum bekommt man Kopfhörer mit Musik oder ein Hörspiel deiner Wahl. Dieses Rohr macht Fotos von deinem Körperinnern, die sehen dann aus wie Scheiben. Dadurch, dass es sehr laut ist, habe ich fast ein bisschen Angst gehabt. Da habe ich mir einfach vorgestellt, dass da kleine Zwerge oder Wichtel in dem Rohr sind, die einfach sehr laut Musik ma-chen, obwohl es sich ja nicht wie Musik an-
hört, aber die Zwerge oder Wichtel können halt nicht gut Musik machen.
Diese Studien werden eigentlich gemacht, damit man schauen kann, ob neue Sachen herausgefunden werden, oder ob die Medi-kamente wirken. Ich finde, das ist eine gute Sache, denn dadurch kann man vielleicht vielen anderen Personen helfen.
Bei diesen Studien wäre es gut, wenn man mitmachen würde, denn, wenn da niemand mitmachen würde, könnten keine neuen Me-dikamente oder Therapiemethoden heraus-gefunden werden.
Umso mehr wir bei den Studien mitmachen, umso mehr können sie bei der Forschung vorankommen und vielleicht sehr nützliche Medikamente oder Therapien entwickeln.
Ich mache bei diesen Studien mit, weil es mir vielleicht etwas hilft, und wenn es mir nichts hilft, dann vielleicht jemand anderem. So, jetzt hoffe ich, dass es einigermassen klar ist, was eine Studie ist und um was es geht.
Patientensicht
«Ich mache bei diesen Studien mit, weil es mir vielleicht etwas hilft, und wenn es mir nichts hilft, dann vielleicht jemand anderem.»
11

Studien bei CF
Das «European Cystic Fibrosis Society- Clinical Trials Network (ECFS-CTN)» möchte die klinische Forschung (Forschung am Pa-tienten) durch Vernetzung von Zentren fördern und stellt somit eine Chance für Schweizer CF-Patienten und CF-Zentren dar [2]. Wissens-austausch (Networking) zwischen Forschern wird via Meetings und anderen Medien geför-dert mit Patientenorganisationen und anderen Interessensvertretern wie dem «US Cystic Fibrosis Foundation-Therapeutic Develop-ment Network (CFF-TDN)».
Was ist das Ziel des ECFS-CTN?Gemeinsam sind wir «schlauer». Forschung trägt seit Jahren dazu bei, dass Kinder mit Cystischer Fibrose (CF) länger leben. Das CTN ist eine Non-Profit-Organisation mit dem Ziel, klinische Forschung zu intensi-vieren, um Patienten den Zugang zu neuen Medikamenten möglichst rasch zu ermögli-chen. Das ECFS-CTN bietet eine Plattform, um CF-Zentren zu vernetzen, die Qualität der CF-Zentren zu steigern und zu sichern, die Qualität von Studien zu überprüfen und even-tuell vor der Durchführung zu verbessern. Das CTN ist keine profitorientierte Institution, die auf «Auftrag» Forschungsprojekte durchführt (Contract Research Organisation, CRO).
Was macht das ECFS-CTN?Qualitätssicherung. Qualitativ hochwertige und zwischen Zentren vergleichbare Methoden
sind ein wichtiges Gütesiegel für CF-Zentren, die für pharmazeutische oder medizintechni-sche Unternehmen attraktiv sind («es muss nicht alles neu aufgebaut werden»). Ein wich-tiger Schwerpunkt des CTN ist daher die (i) Vereinheitlichung (Standardisierung), (ii) Si-cherung der Zuverlässigkeit (Validität) und allenfalls (iii) Implementierung neuer Un-tersuchungen am Patienten. Zum Beispiel die korrekte Messung der Lungenfunktion «Multiple Breath Washout» und Dokumenta-tion des «Lung Clearance Index (LCI)». Dazu erstellen ECFS-CTN-Experten Anleitungen (Standard Operating Procedures) und bieten Weiterbildung und Überprüfung von Untersu-chern (z. B. Lungenfunktions-Technikerinnen und -Techniker) an. Aktuell werden folgende Untersuchungen vom ECFS-CTN behandelt: Lungenfunktionsmessung, Lungen-Bildgebung, Entzündungsmarker, Mikrobiologie (Nachweis-verfahren etc.), Untersuchungsmethoden der Cystic-Fibrosis-Transmembrane-Conductance- Regulator(CFTR)-Funktion (nasale Potentialdif-ferenz, intestinale Kurzschlussstrom messung (ICM), Schweisstest) und die systematische Erfassung des Gedeihens.
Das ECFS-CTN kontrolliert CTN-Zentren. Zum Beispiel wird die Teilnahme an Studien und Patientenrekrutierung pro Jahr evaluiert. CTN-Forscher müssen das «Good Clinical Practice Training» gemacht haben [3]. CF-Zen-tren dürfen keine pharmazeutischen Studien
durchführen, die nicht zuvor auf Methodo-logie vom CTN überprüft wurden. Dies mit dem Ziel, Patienten nur in den effizientesten und sichersten Interventionsstudien einzu-schliessen.
Feedback und Peer-Review von StudienprotokollenECFS-CTN-Experten überprüfen geplante klinische Studienprotokolle von zum Beispiel pharmazeutischen Unternehmen, bevor die-se Studien in Europa durchgeführt werden können. Überprüft werden zum Beispiel Aus-wahl der Patientengruppen, Studien-Design (wie Verblindung), Sicherheitsaspekte, sta-tistische Methoden und Studienendpunkte (wie Lebensqualität, FEV1). Das CTN berät auch zu Stichprobengrösse-Berechnungen (Anzahl einzuschliessender Patienten) auf Basis eigener europäischer Registerdaten. Eine Studie kann nach negativem Bescheid des CTNs und fehlender Anpassung des Protokolls durch pharmazeutische Unter-nehmen nicht in CTN-Zentren durchgeführt werden.
Der Protokoll-Review benötigt max. 4–6 Wochen; die Kommission besteht aus 3 CF- Ärzten /Ärztinnen, 1 Studienkoordinator / in, 1 Statistiker/ in und 2 CF-Patienten und /oder Eltern von CF-Patienten. Meist geschieht diese CTN-Begutachtung vor der Begutachtung durch nationale Ethikkommissionen.
Warum vernetzen? Das European Cystic Fibrosis Society-Clinical Trials Network Text: PD Dr. med. Florian Singer, MD-PhD, FMH Facharzt für Kinder- und Jugendmedizin, FMH Schwerpunkt pädiatrische Pneumologie, Universitätsklinik für Kinderheilkunde, Inselspital / Universitätsspital Bern
Warum vernetzen? Gemeinsam sind wir «stärker ». Die Anzahl an CF-Patienten ist in der Schweiz und weltweit im Vergleich zu anderen chronischen Erkrankungen relativ klein [1]. Dies macht es für die wissenschaftliche Untersuchung neuer Therapien schwierig, Probanden mit zum Beispiel seltenem Genotyp einzuschliessen. Somit müssen die meisten Studien multi-zentrisch geplant werden.
12 | cf-bulletin nº3/2018

13
Zusammenarbeit mit PatientenDas CTN arbeitet mit nationalen Patienten-vereinigungen wie der CFCH eng zusammen. Somit gewinnen Patienten die Möglichkeit, Forscher auf eventuell unberücksichtigte Forschungsfelder hinzuweisen. Umgekehrt kann das CTN Unternehmen und Patienten informieren sowie Zentren und Patienten zur Teilnahme an klinischen Studien motivieren.
Die Situation in der SchweizDas CTN wurde auf Initiative der ECFS 2008 gegründet und bestand aus 18 Zentren in 8 europäischen Ländern. 2016 sind 43 Zentren aus 15 Ländern* aufgenommen worden. Darunter das erste gemeinsame pädiatri-sche und adulte CTN-Zentrum der Schweiz (Leitung Prof. Dr. Alexander Möller) mit dem Kinderspital Zürich (Dr. Andreas Jung) und dem Universitätsspital Zürich (PD Dr.
Christian Benden). 2018 hoffen wir auf die zusätzliche Aufnahme des gemeinsamen CF-Zentrums Bern in das CTN-Netzwerk unter der Leitung von PD Dr. Florian Singer. Dies ist ebenfalls ein gemeinsames Zentrum mit dem pädiatrischen Teil am Inselspital (Prof. Dr. Philipp Latzin) und dem adulten Teil am Inselspital (Prof. Dr. Thomas Geiser) sowie am Lindenhofspital (Dr. Reta Fischer). Bern und Zürich entsprechen den Kriterien, die gemäss ECFS ein CF-CTN-Zentrum auszeichnen. Es müssen eine bestimmte Anzahl an Patienten, personelle Ressour-cen, Erfahrung mit klinischen Studien und Infrastruktur vorhanden sein. CF-Zentren müssen Patienten gemäss ECFS-Thera-pie-Standards betreuen [4]. Durch zukünf-tige Kooperationen könnten weitere neue Schweizer ECFS-CTN-Zentren entstehen.
Appendix* Belgien, Dänemark, Deutschland, Frankreich, Irland, Israel, Italien, Grossbritannien, Nieder-lande, Polen, Portugal, Spanien, Schweden, Schweiz und Tschechische Republik.
Referenzen[1] Jenni OG, Sennhauser FH. Child Health Care in Switzer land 2016. doi:10.1016/j.jpeds.2016.04.056.
[2] European Cystic Fibrosis Society – Clinical Trials Network, www.ecfs.eu/ecfs_supported_initiatives/ecfs_cli-nical_trials_network/introduction, accessed on 22/10/2018.
[3] De Boeck K, Bulteel V, Tiddens H, Wagner T, Fajac I, Conway S, et al. Guideline on the design and conduct of cystic fibrosis clinical trials: The European Cystic Fibrosis Society-Clinical Trials Network (ECFS-CTN). J Cyst Fibros 2011;10:S67–74. doi:10.1016/S1569-1993(11)60010-6.
[4] Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, et al. ECFS best practice guidelines: the 2018 revision. J Cyst Fibros 2018;17:153–78. doi:10.1016/j.jcf.2018.02.006.
FEEL YOUR COLOURDISCOVER THE FLAVOUR
www.chiccodoro.com

14 | cf-bulletin nº3/2018
Studien bei CF
Typischerweise bekommt ein Teil der Patien-ten das Medikament und ein anderer Teil der Patienten (Kontrollgruppe) ein Plazebo – wer was bekommt, wird praktisch immer aus-gelost (randomisiert). Anschliessend wird verglichen, ob die Patienten einen besse-ren Verlauf der Erkrankung zeigen und/oder bestimmte Messparameter sich bei diesen Patienten verbessert haben (bei Patien-ten mit CF z. B. Gewicht, Lungenfunktion, Schweisstest, Anzahl der Exazerbationen).
Welche Phasen von klinischen Studien gibt es?Die Arzneimittelbehörden, die über eine Zu-lassung für ein Medikament entscheiden, verlangen die Durchführung von verschiede-nen «Phasen» von klinischen Studien, bevor ein Arzneimittel zugelassen werden kann. Typischerweise sind das die Phasen 0, I, II, III bis zur Zulassung und die Phase IV nach der Zulassung (Tabelle 1).
Praktisch alle Medikamente, die in den letz-ten Jahren neu für die Behandlung von CF zugelassen wurden, wurden vorher im Rah-men von klinischen Studien getestet. Dabei
kommt es natürlich auch immer wieder vor, dass die Ergebnisse z. B. nicht so ausfallen, wie man das erwartet hat, und die Medika-mente dann nicht zugelassen werden können – entweder weil sie keine bessere Wirksam-keit als ein Plazebo gezeigt haben oder weil viele Nebenwirkungen aufgetreten sind.
Wo kann ich Informationen über klinische Studien bei CF finden?Es gibt im Internet zahlreiche Seiten, die stets aktualisiert werden und seriös eine Übersicht von laufenden klinischen Studien anbieten. Die «Standard»-Website, bei der die Verantwortlichen der Studie jede Studie vor der Durchführung registrieren müssen, heisst https://clinicaltrials.gov. Hier findet man alle klinischen Studien, unabhängig von der Erkrankung, die dort registriert sind (Stand 27.10.2018: 288173 Studien). Man kann die Studien nach verschiedenen Such-filtern sortieren, z. B. «cystic fibrosis» (Anzahl Studien: 1033) und dann weiter nach anderen Kriterien gruppieren (z. B. Alter der Patienten, ob die Studie schon läuft oder nicht etc.).
Eine sehr gute Website ist die der ameri-
kanischen CF-Organisation (www.cff.org). Hier findet man unter der Rubrik «research» und «clinical trials» eine hervorragende Übersicht über klinische Studien, die im Moment bei CF laufen oder geplant sind. Ausserdem werden sehr gute generelle In-formationen zu Studien gegeben, u. a. auch, auf was man als CF-Betroffener achten sollte, wenn man sich überlegt, an einer klinischen Studie teilzunehmen.
Unter www.cff.org/trials/finder sind alle der-zeit laufenden klinischen Medikamenten- Studien bei CF aufgelistet (im Moment 160 Studien) und man kann unter jeder einzelnen Studie genauere Details dazu finden. Dort kann man die Auswahl zudem sehr einfach nach verschiedenen Kriterien filtern, damit man genau diejenigen Studien findet, die für einen selber bzw. die eigenen Kinder re-levant sind. Die Kriterien sind die folgenden: Alter, FEV1, Status der Studie («rekrutiert im Augenblick Patienten», «fast fertig mit der Rekrutierung», «abgeschlossen»), Ort der Studien durchführung, Typ der Mutation und thera peutischer Ansatz. Gerade die vielen ver-schiedenen Mechanismen unter dem Punkt therapeutischer Ansatz («therapeutic ap-proach») zeigen sehr schön, auf wie viel ver-schiedenen Gebieten im Moment klinische Studien bei CF-Patienten durchgeführt werden. Dazu gehören:• Wiederherstellung der CFTR-Funktion
(neue Medikamente) – 55 Studien • Verbesserung der mukoziliären Clearance
– 14 Studien
Klinische StudienText: Prof. Dr. med. Philipp Latzin, PhD, Abteilungsleiter Universitätsklinik für Kinderheilkunde, Facharzt Pädiatrie und pädiatrische Pneumologie Inselspital / Universitätsspital BernBild: Adobe Stock
Was ist eine klinische Studie? In einer klinischen Studie werden Medikamente im Rahmen eines vorher definierten Studien-designs an Patienten getestet. Heutzutage nehmen klinische Studien in der Medizin einen sehr hohen Stellenwert ein, weil man nur so standardisiert überprüfen kann, ob ein Medikament wirklich besser wirkt als ein Scheinmedikament (Plazebo).
Tabelle 1: die verschiedenen Phasen von klinischen StudienPhase Anzahl Personen Dauer Ziel0 ca. 10–20 Wochen Pharmakologische EigenschaftenI ca. 10–100 Monate Verträglichkeit bei GesundenII ca. 10–200 Monate /Jahre Überprüfung der Wirkung (IIa)
Überprüfung der Dosis (IIb)III ca. 50–10 000 Jahre Nachweis der Wirkung im randomisierten DesignIV ab ca. 100 Jahre Überprüfung der Wirkung im echten Leben
Erkennen von sehr seltenen Nebenwirkungen

15
• Entzündungshemmung – 11 Studien• Antibiotika – 33 Studien• Ernährung und Magen-Darm-Trakt – 19 Studien• Verhaltensforschung – 3 Studien• Beobachtungs-Studien – 21 Studien• Andere – 4 Studien
Dadurch, dass dies täglich aktualisiert wird, kann sich die Zahl der Studien natürlich bis zum Druck des vorliegenden Bulletins noch ändern.
Andere Arten von StudienEs gibt natürlich eine Vielzahl von anderen Arten von Studien, die nicht als «klinische Studien» registriert sind, aber trotzdem sehr wichtig sind, um die Diagnostik und Thera-pie von CF zu verbessern.
Darunter fallen einerseits sämtliche Grund-lagenstudien, die meist im Labor durchge-führt werden und praktisch immer vor den klinischen Studien laufen müssen, um zu testen, ob ein vielversprechendes Präparat wirklich das macht, was man denkt, bzw. um überhaupt ein vielversprechendes Präparat zu identifizieren. In diese Kategorie fallen auch viele Studien, die die Ursachen der Er-krankung erforschen und die Grundlage von allen diagnostischen und therapeutischen Ansätzen sind. Meist werden diese Studien an Zellen durchgeführt, teilweise auch an Tieren.
Viele wertvolle Informationen werden durch sog. Beobachtungsstudien gewonnen. Dies sind Studien, die «nur» beobachten. Zum Beispiel wird beobachtet, ob die Medikamen-te im echten Leben so gut wirken, wie man es denkt (Phase-IV-Studien). Oder man be-obachtet den natürlichen Verlauf der Erkran-kung systematisch, um Risikofaktoren für ei-nen schlechten Verlauf zu identifizieren (wie z. B. die sog. SCILD-Studie in der Schweiz: www.scild.ch). Beobachtungsstudien werden auch durchgeführt, um grundlegende Ände-rungen in der Diagnostik oder Therapie sys-tematisch zu überprüfen, wie z. B. nach der Einführung des Neugeborenen-Screenings in der Schweiz im Jahr 2011.
Um neue diagnostische Methoden zu über-prüfen, führt man zunächst meist sog. Ver-gleichsstudien durch. Dabei werden neue Methoden bei Patienten und gesunden Kon-trollen durchgeführt und man überprüft, ob die Methoden einen Unterschied zeigen und wie gross dieser ist. Anschliessend werden weite-re klinische Studien benötigt, bevor diese neu-en Methoden (wie z. B. die LCI-Messung) im klinischen Alltag angewandt werden können.
FazitKlinische und nicht-klinische Studien sind notwendig, damit ein neues Medikament oder ein neuer diagnostischer Test entwi-ckelt und bevor ein neues Medikament zu-gelassen werden kann. Damit diese Studien
erfolgreich durchgeführt werden können, müssen Patienten natürlich freiwillig an die-sen Studien teilnehmen. Die Teilnahme an Studien kann für Patienten zeitaufwendig und mühsam sein, aber unter Umständen auch eine grosse Chance darstellen, wenn z. B. schon lange vor der Zulassung der Zu-gang zu neuen Medikamenten ermöglicht wird. Alle Studien, die in der Schweiz durch-geführt werden, müssen vor Beginn von den kantonalen Ethik-Kommissionen genehmigt werden. Dadurch wird sichergestellt, dass für die teilnehmenden Patienten keine ethi-schen Bedenken bestehen und dass sich das Nutzen-Risiko-Verhältnis in einem an-gemessenen Rahmen bewegt.
Insgesamt kann man klar feststellen, dass es noch nie so viele klinische Studien bei CF gegeben hat wie im Moment. Das liegt einerseits an den «neuen» Medikamenten (Wiederherstellung der CFTR-Funktion) und der damit verbundenen Euphorie/Anreize auch für Pharma-Firmen. Andererseits haben die CF-Patientenorganisationen die Durch-führung von klinischen Studien für CF-Pa-tienten besser organisiert und strukturiert (siehe dazu auch den Artikel über das «Cli-nical Trials Network» in dieser Ausgabe). Diese Entwicklung wird erfreulicherweise dazu führen, dass in den nächsten Jahren weitere neue und zum Teil sehr vielverspre-chende Medikamente getestet und hoffent-lich auch zugelassen werden.


Offrir amour et accompagnement aux enfants atteints de mucoviscidose
Les enfants souffrant de la mucoviscidose doivent souvent effectuer des séjours de plusieurs semaines dans un service hospitalier spécialisé. Votre parrainage permet de soutenir une famille entière et d’alléger leurs soucis. Grâce à votre aide, les familles touchées peuvent en effet mieux accompagner leurs enfants, ce qui infl ue favorablement sur l’évolution de la maladie. Votre parrainage est donc primordial.
L’amour des parents est d’une importance décisive sur l’évolution de la maladie.
En versant 30 francs par mois, vous permettez à des enfants malades de bénéfi cier d’un accompagnement quotidien à l’hôpital.
http://www.cfch.ch/fr/soutenez-nous/parrainageCommandez notre brochure de parrainage ou faites-vous conseiller sans engagement et en toute confi dentialité par notre équipe compétente : tél. 031 313 88 45; [email protected]
« Quand Maman me tient la main à l’hôpital, je me sens mieux. »Patrick D., 7 ans, atteint de mucoviscidose.
Altenbergstrasse 29, case postale 686, 3000 Berne 8
CF-kranken Kindern Liebe und Begleitung schenken
Kinder, die an Cystischer Fibrose leiden, müssen häufi g mehrwöchige Aufenthalte in einem spezialisierten Spital auf sich nehmen. Mit einer Paten-schaft unterstützen Sie eine ganze Familie und verringern ihre Sorgen. Denn dank Ihrer Hilfe können betroffene Familien ihre Kinder besser begleiten, was meist zu einem günstigeren Krankheitsverlauf führt. Ihre Patenschaft hilft:
Die Liebe der Eltern ist für den Krankheitsverlauf von entscheidender Bedeutung
Mit nur 30 Franken pro Monat ermöglichen Sie betroffenen Kindern, auch im Spitalalltag begleitet zu werden
www.cfch.ch/unterstuetzen-sie-uns/patenschaftBestellen Sie unsere Patenschaftsbroschüre oder lassen Sie sich von uns beraten – unverbindlich, kompetent und vertraulich: Tel. 031 313 88 [email protected]
Altenbergstrasse 29 Postfach 686, 3000 Bern 8
«Wenn Mama im Spital meine Hand hält, geht es mir besser.» Patrick D., 7 Jahre, CF-Betroffener

18 | cf-bulletin nº3/2018
Études en matière de mucoviscidose
Concrètement, les registres de patient-e-s sont de vastes banques de données recen-sant de manière systématique et standar-disée les données médicales anonymisées de patient-e-s atteint-e-s de maladies rares. De nos jours, ces collections de données interrégionales sont très répandues en médecine, car elles fournissent de pré-cieuses informations sur l’état de santé des patient-e-s, l’efficacité des traitements ou encore les complications associées à une maladie donnée, et que ces informations ne peuvent être obtenues par des observations régionales (p. ex. effectuées dans un centre) ou ne seraient pas représentatives en raison du nombre restreint de cas. Les registres contribuent non seulement à l’avancée de la science, mais surtout au bien-être du patient. En effet, les résultats d’évaluations annuelles et internationales ainsi que les di-vers projets de recherche qui y font appel (appelés « études de registre ») jouent un rôle essentiel dans l’amélioration continuelle de la qualité des soins. Le tableau 1 illustre les principales fonctions des registres de patients.
Le Registre européen de la mucoviscidoseLe Registre suisse de la mucoviscidose fait partie du Registre de la Société Euro-péenne de la Mucoviscidose (ECFS Patient Registry, ECFSPR) depuis 2008, mais tous les centres suisses de la mucoviscidose n’y participent que depuis 2015. On peut donc partir du principe qu’à quelques exceptions près, tou-te-s les patient-e-s atteint-e-s de mucoviscidose traité-e-s en Suisse ont été
intégré-e-s à l’ECFSPR ces quatre dernières années. Non seulement la Suisse apporte une contribution essentielle au Registre eu-ropéen et aux projets de recherche basés sur ce registre, mais les centres suisses de la mucoviscidose peuvent aussi accéder aux données nationales et européennes, les éva-luer et donc répondre à d’importantes ques-tions de la recherche et des soins cliniques.Comme le montre la figure 1, qui illustre
l’ECFSPR, la création et la mise en œuvre réussies d’un projet de registre nécessitent diverses structures organisationnelles et d’importantes ressources en personnel. Les centres de la mucoviscidose et les organi-sations nationales de patient-e-s telle que la CFCH travaillent ensemble afin d’inscrire le plus grand nombre de patient-e-s pos-sible. Les comités de gestion nationaux – en
Registres de patients et études cliniquesTexte : Dr méd. Andreas Jung, Coordinateur du Registre suisse de la mucoviscidose, Membre du comité exécutif de l’ECFSPRImage : www.ecfs.eu
Que sont les registres de patients ? En 2011, l’Office fédéral de la santé publique a défini les registres de patients comme étant des collections de données qui permettent, outre les analyses épidémiologiques et l’évaluation de concepts thérapeutiques, de définir des indicateurs de qualité en matière de surveillance de la qualité des soins (monitoring) et de la qualité des prestations. Ils contiennent des données sur l’ensemble de la chaîne de traitement et sont donc particulièrement adaptés à l’évaluation des systèmes de soins.
Tabl
eau
1
Fonctions ExemplesÉtudes de registre • Description de l’état de santé
• Détermination des facteurs qui modifient la maladie• Prédiction de l’espérance de vie
Benchmarking • Surveillance de la qualité des soins médicaux• Identification des faiblesses• Surveillance des mesures d’optimisation
Pharmacovigilance • Vérification de la sécurité et de l’efficacité de médicaments• Études postmarketing• Surveillance des limitations dans le cadre de l’autorisation d’un médicament
National Steering Committee
ECFSPR
Executive CommitteeExecutive
Coordinator
Helpdesk
Steering Group
Scientific Committee
National Coordinator
Centres de la mucoviscidose
Organisations de patient-e-s
Figure 1: Structure de l'ECFSPR
Keypoint 3Responsables et délégués
Keypoint 2Soutien de la part des
organisations de patient-e-s
Keypoint 1Obligation des centres

19
Suisse, le Swiss Working Group for Cystic Fibrosis (SWGCF) – affectent un coordina-teur national au Steering Group du Registre de la Société Européenne de la Mucovis-cidose. Vous trouverez des informations dé-taillées sur la structure de l’ECFSPR sur le site (voir l’encadré).
Les études de registreL’ECFSPR élabore chaque année un rap-port annuel contenant une analyse scienti-fique complète de l’ensemble des données du registre. Vous pouvez télécharger les rapports annuels sur le site de l’ECFS et de la CFCH (voir l’encadré). L’ECFSPR pro-duit également chaque année une version abrégée téléchargeable du rapport (« At-a-glance-Report »), destinée au grand public. En outre, le site de l’ECFSPR est doté d’une carte interactive sur laquelle sont rassem-blées les principales données de registre de tous les pays participants (figure 2).
L’analyse annuelle des données de registre vise principalement à décrire l’état de santé des personnes atteintes de mucoviscidose dans une région donnée. Il est d’autre part possible, dans le cadre d’études de registre ciblées, de répondre à d’importantes ques-tions scientifiques à l’aide d’une très grande banque de données internationale. Des re-quêtes peuvent être adressées à l’ECFSPR en vue d’une analyse de données (« Data Requests »). Outre les pays participants, les centres de mucoviscidose et le Scientific Committee de l’ECFSPR, des groupes de travail internationaux consacrés à la muco-viscidose et l’industrie peuvent également soumettre une demande à l’ECFSPR. Elle est ensuite vérifiée par le Scientific Com-mittee et le Steering Group de l’ECFSPR puis autorisées à la suite d’une recomman-dation émise par l’Executive Committee. Elles doivent satisfaire des critères scienti-fiques stricts, représenter un enjeu clair et innovant et ne pas avoir une analyse mar-keting pour seul objectif. Les résultats des projets de recherche sont publiés dans une revue médicale internationale et donc ren-
dus accessibles à tous. Cette démarche a donné lieu à d’importantes découvertes ces dernières années, notamment en ce qui concerne la santé des personnes atteintes de mucoviscidose, l’évolution de la fonction pulmonaire, ainsi que l’importance des com-plications et des infections en cas de muco-viscidose. La liste des publications ne cesse de s’allonger ; elle peut être consultée sur le site de l’ECFSPR (voir l’encadré).
Le benchmarkingLe benchmarking permet la comparaison d’indicateurs de qualité des soins médicaux (les benchmarks) au sein d’une population définie, telles que les personnes atteintes de mucoviscidose dans un pays ou une ré-gion précise. L’objectif principal du bench-marking est donc de garantir une meilleure qualité des soins possible pour tou-te-s les patient-e-s atteint-e-s de mucoviscidose en Suisse et en Europe et de l’harmoniser. Pour ce faire, on compare les données de plusieurs centres ou pays. Les problèmes et faiblesses sont identifiés et analysés dans le cadre de divers projets puis, lors d’une étape subséquente, des mesures com-
munes sont employées afin d’optimiser les structures, le cas échéant. Les différences observées entre les centres doivent être soigneusement analysées, car des facteurs qui n’ont rien à voir avec la qualité des soins sont souvent en cause. Ainsi, la moyenne de la fonction pulmonaire ou l’IMC peuvent être inférieurs dans les centres qui prennent en charge davantage de patient-e-s gravement malades que d’autres.
Au niveau européen, un module spécial du logiciel du registre, le ECFSTracker Vers. 2.0, sera disponible dès 2019. Il servira à comparer les centres et les pays directe-ment dans le logiciel, pour autant que tous les centres participants l’autorisent. Au niveau national, le SWGCF a décidé d’un projet de benchmarking qui débutera éga-lement en 2019. Il vise à analyser la qua-lité des soins cliniques dans les centres et à les améliorer en conséquence. Il ne s’agit pas explicitement de déterminer quels centres sont « mieux » ou « moins biens » que d’autres ou d’établir un classement, mais plutôt d’identifier leurs forces et leurs faiblesses individuelles et de les équilibrer
Figure 2: Carte interactive avec aperçu des principales données de registre pour chaque pays participant, téléchargeable sur le site de l’ECFSPR.

20 | cf-bulletin nº3/2018
Études en matière de mucoviscidose
à l’aide de mesures spécifiques. De cette manière, l’ensemble des centres de muco-viscidose et des patient-e-s profiteront direc-tement du registre.
La pharmacovigilanceLa pharmacovigilance, aussi appelée « sécu-rité des médicaments », décrit en première ligne la surveillance constante et systéma-tique de l’efficacité et de la sécurité d’un médicament dès son autorisation de mise sous le marché, et ce dans le cadre d’études postmarketing. Ces études peuvent être menées de manière similaire aux études cliniques classiques. Ces dernières années, les registres de patient-e-s se sont toute-fois établis comme les plateformes utilisées dans le cadre des études de pharmacovili-gance. La structure modulaire du logiciel de l’ECFSPR (ECFSTracker) permet d’im-plémenter des variables spécifiques pour ce type de projets. De plus, les normes strictes et les contrôles rigoureux de la qua-lité des entrées de données indispensables aux études scientifiques sont déjà intégrés à l'ECFSTracker Vers. 2.0 et garantis en permanence par l’ECFSPR. Conséquence, l’Agence européenne des médicaments EMA (European Medical Agency) a officiellement accrédité l’ECFSPR en tant que plateforme destinée aux études postmarketing (étude de sécurité post-AMM (PASS) et étude d’effica-cité post-AMM (PAES)).
La surveillance de l’efficacité de Kalydeco® dans le cadre d’une limitation ordonnée par l’Office fédéral de la santé publique appli-quée à la remise du médicament est un exemple connu et suivi de près à l’internatio-nal en matière de pharmacoviligance basée sur les données de registres. Selon cette limitation, pour que Kalydeco® soit remboursé (les coûts de traitement annuels s’élèvent à 300 000 CHF), une amélioration minimale définie de la fonction pulmonaire ou du test à la sueur doit être atteinte, ce qui est docu-menté dans le registre de la mucoviscidose tous les trois mois pour chaque patient-e et doit être annoncé une fois par année à
l’OFSP. De plus, le nombre et la durée des exacerbations pulmonaires doivent être ri-goureusement documentés. Un module spé-cial a été créé à cet effet dans l’ECFSTracker des centres de mucoviscidose suisses. Si un-e patient-e ne répond pas ou plus à ces critères, le traitement doit en généralement être interrompu, car le médicament ne peut plus être remboursé.
RésuméLes registres de patients sont bien plus que des collections de données. Ils aident à mieux décrire et comprendre l’état de santé de personnes atteintes de maladies spéci-
fiques telle que la mucoviscidose en Suisse et en Europe. Grâce au benchmarking, ces registres contribuent à l’amélioration de la qualité des soins et permettent de vérifier de manière standardisée la sécurité et l’effica-cité de médicaments autorisés lors d’études postmarketing. Ils favorisent également les avancées de la médecine, car leurs vastes quantités de données permettent également d’analyser des problématiques qui ont trait aux maladies rares.
Encadré
Vous pouvez télécharger des informations détaillées sur l’ECFSPR ainsi que les versions complètes et abrégées des rapports annuels en cliquant sur le lien suivant :
Rapports annuels du Registre européen de la mucoviscidose et versions abrégées « At-a-glance-Reports » : https://www.ecfs.eu/projects/ecfs-patient-registry/annual-reports
Tous les rapports annuels, dans leur version complète et abrégée, se trouvent également sur le site de la CFCH : http://www.cfch.ch/dienstleistungen/forschung/ecfs-patientenregister/
Informations détaillées sur le registre de patients de l’ECFS et carte interactive : https://www.ecfs.eu/ecfspr
Publications scientifiques actuelles en lien avec l’ECFSPR : https://www.ecfs.eu/projects/ecfs-patient-registry/articles

21
Texte : Vanessa Waser (14 ans)Images : Vanessa Waser
Ce n’est pas la première fois que l’on me demande ce que l’on fait lors d’une étude clinique et pourquoi on le fait.
La première question que l’on vous pose toujours, c’est si vous voulez participer à une étude, car la plupart d’entre elles s’étalent sur plusieurs jours et non sur un seul. Autre-ment dit, à peu près toutes les trois à quatre semaines, vous devez passer une journée à l’hôpital pour vous soumettre à une série de tests nécessaires. Quand vous acceptez de prendre part, il s’écoule généralement encore une ou deux semaines jusqu’à ce que vous obteniez le premier rendez-vous. Il faut bien réfléchir à ses motivations, car ce seront des journées entières à l’hôpital, en général, rien de bien passionnant. Lors du premier rendez-vous, les médecins vous font passer toute une batterie de tests. Il faut remplir un ou plusieurs questionnaires et ils sont très longs. Au deuxième rendez-vous, les choses deviennent plus intéressantes, puisque l’on doit effectuer un test de la fonction pulmonaire, un test à la sueur, et beaucoup d’autres examens. Bien sûr, ce n’est pas comme ça pour toutes les études, elles diffèrent les unes des autres. Ce qui me dérange le plus, ce sont les prises de sang répétées. La dernière fois justement, ils ont dû s’y reprendre à trois reprises avant d’y arriver. Mais c’est un peu de ma faute… quand on participe à une étude, il faut s’y at-tendre. Jusqu’à présent, j’ai toujours dû me soumettre à un test à la sueur. On dirait deux petits boutons, un courant électrique de très très faible intensité les traverse et on sent uniquement un léger fourmillement ou pico-tement sur la peau. Cela ne dure que cinq
minutes, et c’est déjà fini. Le médecin place ensuite un objet qui ressemble à une montre et l’instrument absorbe la sueur que l’on produit. Puis, bien sûr un test de la fonction pulmonaire. Mais je crois que ce n’est pas la peine que je l’explique, quasiment tout le monde le connaît. Finalement, il y a les tests classiques comme la mesure de la taille, du poids ou du taux d’oxygène dans le sang. J’allais presque oublier l’essentiel : à chaque essai, on passe notre temps à attendre. Pour l’instant, il est interdit de divulguer les résul-tats de cet essai médicamenteux, puisqu’ils sont encore strictement confidentiels.
J’ai également participé une fois à une étude IRM. Une IRM, c’est une imagerie par réso-nance magnétique. Il faut rester tranquille-ment allongée environ une demi-heure dans un tunnel ouvert à l’avant et à l’arrière. La machine est très bruyante, c’est pourquoi on nous donne un casque avec de la musique ou un livre audio de notre choix. Ce tunnel prend des photos de l’intérieur du corps, comme si on le coupait en tranches. J’ai failli avoir un peu peur à cause du bruit de l'appa-reil. Alors je me suis imaginé que de petits nains ou lutins se trouvaient dans le tunnel et qu’ils jouaient de la musique très fort, bien
qu’on ne puisse pas parler de musique, mais bon, les nains ou les lutins ne sont pas des virtuoses.
Ces études sont conçues pour voir si l’on peut faire de nouvelles découvertes ou si les médicaments sont efficaces. Je pense que c’est une bonne chose. Il est peut-être possible d’aider ainsi de nombreuses autres personnes.
Ce serait bien qu’il y ait des volontaires. Si personne ne participe, il est impossible de trouver de nouveaux médicaments ou de nouvelles méthodes thérapeutiques.
Plus nous sommes nombreux à nous porter volontaires et plus les médecins peuvent faire avancer la recherche et peut-être mettre au point des médicaments ou des traitements efficaces.
Je participe à ces études, parce qu’elles m’apporteront peut-être un peu d’aide, et si elles ne m’apportent rien, alors elles seront peut-être utiles à quelqu’un d’autre. J’espère avoir plus ou moins clarifié ce qu’est une étude et quel en est l’enjeu.
Le point de vue d'une patiente
« Je participe à ces études, parce qu’elles m’apporteront peut-être un peu d’aide, et si elles ne m’apportent rien, alors elles seront peut-être utiles à quelqu’un d’autre. »

La Société européenne de la mucoviscidose et son réseau européen de recherche cli-nique (ECFS-CTN) souhaitent promouvoir la recherche clinique (recherche sur les patient-e-s) grâce à la mise en réseau des centres. Elle ouvre ainsi une perspective aux patient-e-s suisses atteint-e-s de mucovis-cidose et aux centres de traitement de cette maladie [2]. La mise en réseau de connais-sances (networking) entre les chercheurs /euses est favorisée par l’utilisation de mé-dias et par des réunions avec des associa-tions de patient-e-s et autres organisations de défense des intérêts comme l’US Cystic Fibrosis Foundation – Therapeutic Development Network (CFF-TDN).
Quel est l’objectif de l’ECFS-CTN ?L’union fait aussi l’« intelligence ». Depuis des années, la recherche contribue à prolonger la vie des enfants atteint-e-s de mucoviscidose. Le CTN est une organisation à but non lucra-tif qui entend accélérer la recherche clinique afin de permettre aux patient-e-s l’accès le plus rapide possible à de nouveaux médi-caments. L’ECFS-CTN offre une plateforme pour mettre en réseau les centres de la mucoviscidose, accroître et garantir leur ni-veau, mais aussi vérifier et éventuellement
améliorer la qualité des études avant la mise en pratique. Organisme à but non lucratif, le CTN ne réalise pas de projets de recherche sur « commande » (contract research orga-nisation, CRO).
Quelle est la mission de l’ECFS-CTN ?Assurance qualité. Les méthodes de haute qualité, et comparables entre les différentes structures, représentent un label de qualité important pour les centres de la mucovis-cidose, qui forment un pôle d’attraction pour les entreprises pharmaceutiques ou de tech-nologie médicale (« on ne reprend pas tout de zéro »). Les priorités du CTN sont donc (i) l’harmonisation (standardisation), (ii) la ga-rantie de fiabilité (validité) et éventuellement (iii) la mise en œuvre de nouvelles études sur le/la patient-e. Prenons l’exemple de la mesure correcte de la fonction pulmonaire Multiple-Breath Washout (MBW) et de la do-cumentation de l’indice de clairance pulmo-naire (LCI). Les spécialistes de l’ECFS-CTN établissent des directives (standard opera-ting procedures) et proposent des formations continues et un contrôle des examinateurs /trices (p. ex. des technicien-ne-s en fonc-tions pulmonaires). L’ECFS-CTN se penche actuellement sur les examens suivants :
mesure de la fonction pulmonaire, IRM des poumons, marqueurs de l’inflammation, mi-crobiologie (méthode de dépistage, etc.), méthodes d’analyse de la Cystic Fibrosis Transmembrane Conductance Regulator – CFTR (différence de potentiel nasal, courant de court-circuit au niveau de l’intestin [ICM], test à la sueur) et enregistrement systéma-tique du développement.
L’ECFS-CTN effectue un contrôle des centres CTN. La participation aux études et le recru-tement des patient-e-s sont ainsi évalués tous les ans. Les chercheurs/euses CTN sont tenu-e-s de suivre la formation « Good Cli-nical Practice Training » [3]. Les centres de la mucoviscidose ne sont pas autorisés à mener des études pharmaceutiques dont la méthodologie n’aurait pas au préalable été vérifiée par le CTN, et ce, afin de n’inclure les patient-e-s que dans les études d’inter-ventions les plus efficaces et les plus sûres.
Feedbacks et évaluation par les pairs des protocoles d’études cliniquesLes spécialistes de l’ECFS-CTN vérifient les protocoles d’études cliniques planifiés, par exemple, par les entreprises pharma-ceutiques, avant qu’ils ne soient menés en
Les (bonnes) raisons d’une mise en réseau. La Société européenne de la mucoviscidose et le réseau européen de recherche clinique Texte : Dr PD Florian Singer, MD-PhD, Médecin spécialiste en pédiatrie FMH, Formation approfondie en pneumologie pédiatrique FMH, Clinique universitaire pédiatrique, Inselspital / Hôpital universitaire de BerneImage : Adobe Stock
Les (bonnes) raisons d’une mise en réseau. L’union fait la « force ». Par rapport aux personnes affectées par d’autres maladies chroniques, le nombre de patient-e-s atteint-e-s de mucoviscidose est relativement faible en Suisse et dans le monde [1]. De ce fait, il est difficile d’inclure des sujets présentant, par exemple, un génotype rare pour l’étude scientifique de nouveaux traitements. Par conséquent, la planification de la plupart des études doit être multicentrique.
22 | cf-bulletin nº3/2018
Études en matière de mucoviscidose

23
Europe. Leurs contrôles portent notamment sur la sélection des groupes de patient-e-s, la conception des essais (comme les pro-cédures d’insu), les aspects de sécurité, les méthodes statistiques et les critères d’évaluation (qualité de vie, VEMS). Le CTN conseille également sur la taille des échan-tillons (nombre des patient-e-s à inclure dans l’étude) en s’appuyant sur ses données de registres au niveau européen. Une étude n’ayant pas obtenu un avis favorable du CTN et dont le protocole n’aura pas été révisé par les entreprises pharmaceutiques ne pourra être réalisée dans les centres CTN.
L’examen du protocole prend tout au plus 4 à 6 semaines. La commission mandatée est constituée de trois médecins spécialisé-e-s dans la mucoviscidose, d’un-e coordinateur /trice de l’étude, d’un-e statisticien-ne, de deux patient-e-s atteint-e-s de mucoviscidose ou parents de patient-e-s. Le plus souvent, l’ex-pertise de la CTN précède l’évaluation par les commissions nationales d’éthique.
Collaboration avec les patient-e-sLe CTN travaille en étroite collaboration avec des associations nationales de pa-tient-e-s telle que la CFCH. Les patient-e-s peuvent ainsi orienter les chercheurs/euses
vers d’éventuels champs d’investigation négligés. En contrepartie, le CTN peut in-former les entreprises et les patient-e-s et motiver ces derniers et les centres à prendre part aux essais cliniques.
Le point sur la situation en SuisseCréé en 2008 à l’initiative de l’ECFS, le CTN était composé de 18 centres répartis dans 8 pays européens. En 2016, il a accueilli 43 centres implantés dans 15 pays*. Par-mi eux, le premier centre CTN en Suisse regroupant adultes et enfants (dirigé par le Pr Alexander Möller) en collaboration avec l’hôpital pour enfants de Zurich (Dr Andreas Jung) et l’hôpital universitaire de Zurich (PD Dr Christian Benden). Nous espérons qu’en 2018, le centre conjoint de la mucoviscidose de Berne, dirigé par le PD Dr Florian Singer, sera intégré dans le réseau CTN. Il s’agit également d’un centre conjoint, dont le ser-vice pédiatrique est situé à l’Inselspital (Pr Philipp Latzin) et le service pour adultes est réparti entre l’Inselspital (Pr Thomas Geiser) et le Lindenhofspital (Dr Reta Fischer). Les sites hospitaliers de Berne et de Zurich sa-tisfont aux critères fixés par l’ECFS pour un centre CF-CTN. Celui-ci doit en effet dispo-ser d’un nombre déterminé de patient-e-s, de ressources en personnel, posséder une
expérience en études cliniques et être équi-pé d’une infrastructure adaptée. Les centres de la mucoviscidose sont tenus d’assurer le suivi des patient-e-s conformément aux stan-dards de soins de l’ECFS [4]. De nouveaux centres ECFS-CTN pourraient voir le jour en Suisse grâce à de futures coopérations.
Appendice* Allemagne, Belgique, Danemark, Espagne, France, Grande-Bretagne, Irlande, Israël, Italie, Pays-Bas, Pologne, Portugal, République tchèque, Suède et Suisse.
Références[1] Jenni OG, Sennhauser FH. Child Health Care in Switzer land 2016. doi:10.1016/j.jpeds.2016.04.056.
[2] European Cystic Fibrosis Society – Clinical Trials Network, www.ecfs.eu/ecfs_supported_initiatives/ecfs_cli-nical_trials_network/introduction, accessed on 22/10/2018.
[3] De Boeck K, Bulteel V, Tiddens H, Wagner T, Fajac I, Conway S, et al. Guideline on the design and conduct of cystic fibrosis clinical trials: The European Cystic Fibrosis Society-Clinical Trials Network (ECFS-CTN). J Cyst Fibros 2011;10:S67–74. doi:10.1016/S1569-1993(11)60010-6.
[4] Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, et al. ECFS best practice guidelines: the 2018 revision. J Cyst Fibros 2018;17:153–78. doi:10.1016/j.jcf.2018.02.006.

24 | cf-bulletin nº3/2018
Un groupe de patient-e-s reçoit générale-ment le médicament, alors que l’autre (le groupe de contrôle) reçoit un placebo. Les patient-e-s sont pratiquement toujours répar-ti-e-s dans les groupes de manière aléatoire (on appelle cela la randomisation). On vérifie ensuite si le médicament a un effet positif sur la maladie, ou s’il améliore certains pa-ramètres de mesure (chez les patient-e-s at-teint-e-s de mucoviscidose, il s’agit p. ex. du poids, de la fonction pulmonaire, du test à la sueur ou du nombre d’exacerbations).
Quelles sont les phases des études cliniques ?Les autorités responsables de la commercia-lisation des médicaments exigent la conduite de diverses « phases » d’études cliniques avant que leur utilisation ne puisse être autorisée. Il s’agit généralement des phases 0, I, II, III avant l’autorisation, puis de la phase IV (voir le tableau 1).
Pratiquement tous les médicaments nouvelle-ment autorisés pour le traitement de la muco-viscidose ces dernières années ont été testés
au préalable dans le cadre d’études cliniques. Il arrive parfois que les résultats ne corres-pondent pas aux attentes des chercheurs et que les médicaments ne puissent pas être autorisés, parce qu’ils n’ont pas été plus effi-caces que le placebo, ou parce qu’ils ont pro-voqué de nombreux effets secondaires.
Où puis-je trouver des informations sur les études cliniques relatives à la muco-viscidose ?De nombreux sites Internet régulièrement mis à jour et fiables donnent un aperçu des études cliniques en cours. Le site https://clinicaltrials.gov est le site le plus complet. En effet, les responsables de chaque étude doivent y enregistrer leur étude au préalable. On y trouve donc l’ensemble des études cli-niques enregistrées (288 173 études le 27 oc-tobre dernier), toutes maladies confondues. Différents filtres de recherche permettent de cibler les études sur la mucoviscidose (nombre d’études : 1033), puis les regrouper selon d’autres critères (âge des patient-e-s, étude déjà en cours ou non, ...).
La fondation américaine contre la muco-viscidose (www.cff.org) est également une excellente ressource. Sous la rubrique « Re-search », puis « Clinical trials », on y trouve une excellente vue d’ensemble des études cliniques prévues ou en cours sur la muco-viscidose. Ce site fournit en outre des in-formations générales d’excellente qualité, notamment ce à quoi une personne atteinte de mucoviscidose devrait prêter attention si elle songe à participer à une étude clinique.
Toutes les études cliniques en cours portant sur des médicaments destinés au traite-ment de la mucoviscidose sont listées sous www.cff.org/Trials/finder (160 à l’heure ac-tuelle). On trouve des informations détaillées pour chacune d’entre elles. La recherche peut être facilement ciblée à l’aide des critères suivants, qui permettent ainsi de trouver les études qui s’appliquent aux adultes ou aux enfants : âge, FEV1, statut de l’étude (recrute-ment en cours, presque terminé ou terminé), lieu de l’étude, type de mutation et approche thérapeutique. Les nombreux mécanismes présentés dans la section approche théra-peutique (« therapeutic approach ») illustrent très bien la multitude de domaines dans lesquels des études cliniques sont menées auprès de patient-e-s atteint-e-s de la muco-viscidose. En voici quelques-uns :• Récupération de la fonction CFTR (nouveaux médicaments), 55 études • Amélioration de la clairance mucociliaire,
14 études• Propriétés anti-inflammatoire, 11 études
Les études cliniquesTexte : Prof Dr méd. Philipp Latzin, Ph.D., Chef de service, Département de pédiatrie, Pneumologie pédiatrique et pédiatrique, Inselspital / Hôpital universitaire de BerneImage : Adobe Stock
Qu’est-ce qu’une étude clinique ? Une étude clinique vise à tester des médicaments auprès de patient-e-s selon un plan prédéfini (design de l’étude). Les études cliniques sont très importantes en médecine, car elles seules permettent de vérifier de manière standardisée si un médicament est vraiment plus efficace qu’un pseudo-médicament (le placebo).
Tableau 1 : Les différentes phases des études cliniques
Phase Nombre de participant-e-s Durée Objectif
0 Env. 10–20 semaines Propriétés pharmacologiquesI Env. 10–100 mois Tolérance chez des participant-e-s en bonne santéII Env. 10–200 mois/années Vérification de l’efficacité (IIa)
Vérification de la dose (IIb)III Env. 50–10 000 ans Attestation de l’efficacité dans un design randomiséIV Au moins 100 ans Vérification de l’efficacité dans la vie réelle
Identification d’effets secondaires rares
Études en matière de mucoviscidose

25
• Antibiotiques, 33 études• Alimentation et tractus gastro-intestinal, 19 études• Sciences du comportement, 3 études• Etudes d’observation, 3 études• Autres, 4 études
Ce site étant mis à jour quotidiennement, le nombre d’études peut avoir changé au mo-ment de la parution de cet article.
Autres types d’étudesDe nombreux autres types d’études ne sont pas enregistrés en tant qu’« études cliniques » mais tout de même essentiels à l’amélio-ration du diagnostic et du traitement de la mucoviscidose.
Parmi ceux-ci se trouve l’ensemble des études fondamentales menées généralement en labo-ratoire, et presque toujours avant les études cliniques afin d’évaluer si une préparation prometteuse a vraiment les effets qu’on pense ou pour trouver une préparation pro-metteuse. Font aussi partie de cette catégo-rie de nombreuses études consacrées aux causes de la maladie qui servent de base à toutes les approches diagnostiques et théra-peutiques. Ces études sont généralement me-nées sur des cellules, parfois sur des animaux.
Les études d’observation permettent de ré-colter une grande quantité d’informations.
Les chercheurs ne font alors « que » obser-ver, c’est-à-dire qu’ils observent si les médi-caments sont aussi efficaces dans des condi-tions de vie réelle que ce qu’on pense (il s’agit donc d’études de phase IV). Ils peuvent aussi observer l’évolution naturelle de la maladie et identifier les facteurs de risque d’une évolu-tion négative (comme c’est le cas de l’étude SCILD en Suisse : www.scild.ch). Les études d’observation servent également à vérifier de manière systématique d’éventuelles im-portantes modifications du diagnostic ou du traitement, comme c’est le cas en Suisse depuis l’introduction du dépistage néonatal en 2011.
Les études comparatives servent à évaluer de nouvelles méthodes diagnostiques. Elles consistent à employer de nouvelles mé-thodes thérapeutiques et à procéder à des contrôles de santé afin d’évaluer si et à quel point elles sont efficaces. Des études cliniques sont ensuite nécessaires afin de pouvoir utiliser ces nouvelles méthodes (telle que la mesure de l’ICP) dans la pratique clinique. RésuméLes études cliniques et non cliniques sont nécessaires au développement et à l’au-torisation d’un nouveau médicament ou test diagnostique. Les patient-e-s doivent bien entendu participer de manière volon-
taire à ces études afin qu’elles puissent être menées avec succès. La participation à des études cliniques est parfois difficile et chronophage, mais elle peut représenter une belle opportunité pour les patient-e-s, s’ils/elles accèdent à de nouveaux médica-ments bien avant que ceux-ci ne soient au-torisés sur le marché, par exemple. Toutes les études menées en Suisse doivent être approuvées par les commissions d’éthique cantonales avant d’être entamées. On s’as-sure ainsi qu’elles ne créent aucun problème éthique pour les participant-e-s et que le rapport entre les risques et les bénéfices demeure raisonnable.
Dans l’ensemble, on peut affirmer qu’il n’y a jamais eu autant d’études cliniques concer-nant la mucoviscidose qu’à l’heure actuelle. D’une part, les entreprises pharmaceutiques s’intéressent fortement aux « nouveaux » médicaments (rétablissement de la fonction CFTR). D’autre part, les organisations de patient-e-s atteint-e-s de mucoviscidose ont amélioré l’organisation et structuré la partici-pation des patient-e-s aux études cliniques (voir l’article sur le Clinical Trials Network de ce numéro). De nouveaux médicaments parfois très prometteurs pourront ainsi être testés ces prochaines années et, nous l’es-pérons, autorisés.
colter une grande quantité d’informations. bien entendu participer de manière volon

26 | cf-bulletin nº3/2018
Studi relativi alla FC
In termini pratici, i registri dei pazienti sono delle grandi banche dati che raccolgono in modo sistematico e standardizzata dati anonimizzati riguardanti la salute di pazienti affetti da malattie rare. Oggi, questo tipo di banche dati sovraregionali è molto diffuso nel campo della medicina, perché fornisce infor-mazioni importanti − ad esempio sullo stato di salute dei pazienti, sull’efficacia delle tera-pie oppure sulle complicanze di alcune pato-logie – che attraverso osservazioni regionali (ad es. centri regionali) non sarebbe possibile identificare o non sarebbero rappresentative a causa del numero ridotto di pazienti. Que-sto modo di procedere non è utile solo dal punto di vista dei progressi scientifici, bensì torna a vantaggio anche dei pazienti, poiché la qualità dell’assistenza sanitaria migliora costantemente proprio anche grazie alle co-noscenze basate sul contenuto dei registri. In tale contesto, svolgono un ruolo importante non solo le analisi annuali dei registri nazio-nali e internazionali, ma soprattutto la moltitu-dine di progetti di ricerca con i dati contenuti nei registri (i cosiddetti «studi di registro»). Nella tabella 1 sono illustrate le funzioni più significative dei registri dei pazienti.
Il registro europeo FCDal 2008 il registro svizzero della FC è par-te integrante del registro dei pazienti della European Cystic Fibrosis Society (ECFS Patient Registry, ECFSPR), sebbene tutti i centri svizzeri per la fibrosi cistica vi par-tecipino solo dal 2015. Si può presumere che da allora tutti i pazienti affetti da fibrosi cistica curati in Svizzera, salvo qualche ec-cezione, siano stati registrati presso l'ECF-SPR. In questo modo, la Svizzera non solo fornisce un contributo significativo al registro
europeo e ai progetti di ricerca basati sui registri, ma i suoi centri per la fibrosi cistica possono accedere ai dati nazionali ed euro-pei, analizzarli e in questo modo rispondere a importanti questioni relative alla ricerca e all’assistenza clinica.
Per realizzare e condurre con successo un progetto di registro sono necessarie varie strutture organizzative e delle risorse per-sonali, come quelle mostrate nella figura 1 riguardanti l’ECFSPR. I centri di FC e le
organizzazioni nazionali di pazienti, come la CFCH, collaborano per ottenere il mag-gior numero di registrazioni di pazienti. Il Comitato direttivo nazionale – in Svizzera, il Swiss Working Group for Cystic Fibrosis (SWGCF) – invia un coordinatore naziona-le presso lo Steering Group (gruppo diretti-vo) del Registro europeo della FC. Maggiori
Studi con registri di pazientiTesto: Dr. med. Andreas Jung, Coordinatore del registro FC in Svizzera, Membro dell’Executive Committee ECFSPRImmagine: www.ecfs.eu
Che cosa sono i registri dei pazienti? Nel 2011, l’Ufficio federale della sanità pubblica ha definito i registri dei pazienti delle raccolte dati da cui, oltre alle analisi epidemiologiche e alla valutazione di strategie terapeutiche, si possono determinare anche indicatori di qualità in relazione al monitoraggio della qualità delle cure e delle prestazioni fornite. Contengono dati relativi all’intera catena terapeutica, motivo per cui sono particolarmente adatti per valutare i sistemi di assistenza.
Tabe
lla 1
Funzioni EsempiStudi di registro • Descrizione dello stato di salute
• Identificazione dei fattori modificanti il decorso della malattia• Previsioni sull’aspettativa di vita
Benchmarking • Monitoraggio della qualità dell’assistenza medica• Indentificazione dei punti deboli• Monitoraggio delle misure di ottimizzazione
Farmacovigilanza • Analisi della sicurezza e dell’efficacia dei medicamenti• Studi di post marketing• Monitoraggio delle restrizioni in ambito di omologazione dei medicamenti
National Steering Committee
ECFSPR
Executive CommitteeExecutive
Coordinator
Helpdesk
Steering Group
Scientific Committee
National Coordinator
Centri FC
Organizzazioni di pazienti
Figura 1: Struttura dell’ECFSPR.
Keypoint 3Responsabili e delegati
Keypoint 2Sostegno alle organizzazioni
di pazienti
Keypoint 1Impegno dei centri

27
informazioni sulla struttura dell’ECFSPR sono disponibili sul sito Internet (si veda il riquadro informativo).
Studi di registroOgni anno l’ECFSPR redige un rapporto con-tenente un’analisi scientifica completa di tutti i dati presenti nel registro. I rapporti annuali per essere scaricati sui siti dell’ECFS e della CFCH (v. riquadro informativo). L’ECFSPR fornisce ogni anno un breve rapporto com-prensibile anche da un pubblico non specia-lizzato (At-a-glance-Report), che può pure essere scaricato. Inoltre, sul sito Internet dell’ECFSPR vi è una mappa interattiva che propone una panoramica sintetica del-le banche dati più importanti di tutti i paesi partecipanti (figura 2).
Mentre l’analisi annuale dei dati contenuti nel registro descrive principalmente lo stato di salute delle persone affette da fibrosi ci-stica residenti in una determinata regione, alcuni studi di registro mirati consentono di rispondere a importanti questioni scienti-fiche avvalendosi di una vasta banca dati internazionale. A tal proposito, le richieste di valutazione dei dati (Data Requests) possono essere indirizzate all’ECFSPR. Oltre ai paesi partecipanti, ai centri di FC e allo Scientific Committee (comitato scienti-fico) dell’ECFSPR, anche i gruppi di lavoro scientifici attivi a livello nazionale e inter-nazionale nell’ambito della fibrosi cistica e il settore industriale possono presen-tare delle richieste di valutazione dei dati all’ECFSPR. Queste richieste sono esami-nate dal comitato scientifico dell’ECFSPR e dal gruppo direttivo e approvate, su rac-comandazione, dall’Executive Commit-tee (comitato esecutivo). Esse devono sod-disfare criteri scientifici rigorosi, contenere un interrogativo chiaro e innovativo e non devono essere finalizzate esclusivamente alle analisi di marketing. Al termine dei progetti di ricerca, i risultati vengono pub-blicati in una rivista medica internazionale e quindi resi accessibili a tutti. In questo modo, negli ultimi anni è stato possibile ad
esempio acquisire importanti conoscenze sulla salute delle persone affette da FC, sul decorso della funzionalità polmonare, sull’importanza delle complicanze e sulle infezioni legate alla fibrosi cistica. L’elenco delle pubblicazioni dell’ECFSPR è in con-tinua crescita e può essere consultato sul sito Internet (v. riquadro informativo).
BenchmarkingIl benchmarking consente di confrontare gli indicatori della qualità dell’assistenza medi-ca (= benchmark) di una determinata popo-lazione, ad esempio delle persone affette da fibrosi cistica in un paese o una regione. L’obiettivo principale del benchmarking è garantire e armonizzare la miglior assisten-za possibile a tutti i pazienti affetti da FC in Svizzera e in Europa. A tal fine, in diversi progetti si confrontano i dati provenienti da vari centri o paesi, si identificano e si ana-lizzano i problemi e i punti deboli e, in una seconda fase – se necessario − si adottano misure congiunte per apportare migliorie a livello strutturale. È importante analizzare attentamente le differenze riscontrate tra i vari centri, poiché spesso i diversi risultati
ottenuti non sono riconducibili alla qualità dell’assistenza (la funzionalità polmonare media o l’IMC possono ad esempio risultare più bassi nei centri che si occupano mag-giormente di pazienti critici).
A livello europeo, a partire dal 2019 sarà dispo-nibile nel software di registro, l’ECFSTracker
Vers. 2.0, un modulo speciale che consentirà di confrontare centri e paesi direttamente nel software, a condizione che le strutture par-tecipanti diano il loro consenso. A livello na-zionale, il SWGCF ha deciso di lanciare un progetto di benchmarking, previsto anch’es-so per il 2019, allo scopo di analizzare la qualità dell’assistenza ospedaliera nei vari centri e se necessario di migliorarla. Il SW-GCF ci tiene a sottolineare che con questo progetto non si vuole identificare i «migliori» o i «peggiori» centri di FC o di stilare una classifica, ma piuttosto individuare a livello locale i punti di forza e i punti deboli, equi-librando poi la situazione grazie a misure specifiche. In questo modo, tutti i centri di FC e i pazienti affetti dalla malattia possono beneficiare direttamente del registro FC.
Figura 2: Mappa interattiva disponibile sul sito Internet dell’ECFSPR con una breve panoramica delle principali banche dati per ogni paese partecipante.

28 | cf-bulletin nº3/2018
Studi relativi alla FC
FarmacovigilanzaLa farmacovigilanza descrive principalmen-te il monitoraggio continuo e sistematico dell’efficacia e della sicurezza di un farmaco dal momento della sua omologazione. Ciò avviene in cosiddetti studi di post marke-ting, che possono essere condotti analo-gamente agli studi clinici convenzionali, anche se negli ultimi anni i registri dei pa-zienti si sono affermati come piattaforma per gli studi di farmacovigilanza. Grazie al suo carattere modulare, il software ECFSPR (ECFSTracker) consente di attuare varia-bili specifiche per tali progetti in qualsiasi momento. Inoltre, la rigida standardizzazio-ne e il controllo di qualità dei dati inseriti nell’ECFSTracker, indispensabili per la con-duzione di studi scientifici, sono già consoli-dati e garantiti in permanenza dall’ECFSPR. Per questo nel 2018 l’Agenzia europea per i medicinali (European Medical Agency, EMA) ha ufficialmente accreditato l’ECF-SPR come piattaforma per gli studi di post marketing (studi di Post-Authorisation Safety Surveillance, PASS e studi di efficienza PAES).
In Svizzera, un esempio importante di far-macovigilanza basata sui dati contenuti nei registri è oggetto di grande attenzione a livello internazionale. Si tratta del monito-raggio dell’efficacia del Kalydeco® nell’am-bito della limitazione vincolante stabilita dall’Ufficio federale della sanità pubblica (UFSP). Secondo questa limitazione, per poter rimborsare il Kalydeco® (i costi della terapia ammontano a quasi 300’000 fran-chi all’anno) è necessario ottenere un mi-glioramento minimo della funzionalità pol-monare o del test del sudore, risultati che devono essere documentati nel registro FC di ciascun paziente ogni tre mesi e se-gnalati all’UFSP una volta all’anno. Inoltre, il numero e la durata delle esacerbazioni polmonari devono essere debitamente do-cumentati. A tale scopo, nei centri di fibrosi cistica svizzeri è stato creato un modulo specifico dell’ECFSTracker. Se un pazien-te non soddisfa o non soddisfa più i criteri specificati, in linea generale la terapia deve
essere interrotta perché in questo caso il paziente non ha diritto al rimborso.
ConclusioneI registri dei pazienti sono molto più di sem-plici raccolte dati. Essi aiutano a descrive-re e comprendere meglio in Svizzera e in Europa lo stato di salute di persone con malattie specifiche come la fibrosi cistica. Tramite il benchmarking, i registri contribui-scono a migliorare la qualità dell’assistenza
ai pazienti e permettono inoltre di testate in modo uniforme in studi di post marketing la sicurezza e l’efficacia dei farmaci omo-logati. Infine, i registri dei pazienti sono utili anche per compiere progressi in cam-po medico, perché forniscono una grande quantità di dati, consentendo così esami-nare e rispondere a questioni scientifiche anche nel caso di malattie rare.
Riquadro informativoCliccando sui seguenti link è possibile trovare ulteriori informazioni sull’ECFSPR e scaricare tutti i rapporti annuali e i resoconti:
Rapporti annuali del registro europeo della fibrosi cistica, inclusi gli At-a-glance-Reports (resoconti): https://www.ecfs.eu/projects/ecfs-patient-registry/annual-reportsTutti i rapporti annuali e i resoconti si trovano anche sul sito della CFCH: http://www.cfch.ch/dienstleistungen/forschung/ecfs-patientenregister/
Informazioni dettagliate sul registro dei pazienti ECFS, inclusa la mappa interattiva: https://www.ecfs.eu/ecfspr
Pubblicazioni scientifiche attuali dell’ECFSPR: https://www.ecfs.eu/projects/ecfs-patient-registry/articles

Testo: Vanessa Waser (14 anni)Immagine: Vanessa Waser
Mi è stato chiesto più volte che cosa succe-de quando si partecipa a uno di questi studi e perché lo si fa.
Per prima cosa, ci viene sempre posta la domanda se desideriamo o meno prendere parte a uno studio, perché la maggior parte di essi non dura un giorno solo, bensì diversi giorni. Ciò significa che ci si dovrà recare in ospedale ogni 3-4 settimane per una gior-nata intera, durante la quale si viene sotto-posti a tutti i test necessari. Se si accetta di partecipare, solitamente ci vogliono una o due settimane prima che venga fissato il primo appuntamento. Consiglio di riflettere bene prima di prendere una decisione, per-ché si tratta pur sempre di giornate intere da trascorrere in ospedale e il più delle volte non è proprio eccitante... Durante il primo appuntamento, vengono effettuati tutti i test possibili e immaginabili e si devono compila-re uno o più questionari con moltissime do-mande. Al secondo appuntamento, le cose si fanno un po’ più interessanti: ad esempio, si è sottoposti al test di funzionalità polmo-nare, al test del sudore e molto altro ancora. Naturalmente ogni studio è diverso e non si fanno sempre le stesse cose. Personalmen-te, quello che mi infastidisce maggiormente sono i continui prelievi di sangue. L’ultima volta hanno dovuto provare tre volte prima che funzionasse. Devo ammettere però di essermela un po’ cercata, perché quando si decide di partecipare a uno studio bisogna aspettarsi una cosa del genere. Finora ho sempre dovuto sottopormi anche a un test del sudore. Ti applicano due piccoli pulsanti attraverso i quali scorre pochissima corrente elettrica. Sulla pelle si sente solo un legge-ro formicolio o una lieve puntura e non dura
più di cinque minuti. Poi ti danno una specie di orologio che assorbe il sudore prodotto. Vengo sempre sottoposta anche a un test di funzionalità polmonare, ma non credo di dover spiegare cos’è, perché lo conoscono praticamente tutti. Poi, ci sono i normali test che servono a misurare ad esempio l’altezza, il livello di ossigeno nel sangue e a control-lare il peso. Quasi mi dimenticavo... la cosa più importante: chi prende parte a uno studio deve sapere che la maggior parte del tempo dovrà aspettare, aspettare e ancora aspettare. Non si può parlare dei risultati di questo studio farmacologico perché sono ancora top secret.
Una volta ho partecipato anche a uno stu-dio di risonanza magnetica, durante il quale sono rimasta sdraiata e immobile per circa mezz’ora in un tubo aperto davanti e dietro. È un esame molto rumoroso e per questo si indossano delle cuffie attraverso le quali si può ascoltare musica o un programma ra-diofonico a scelta. Questo tubo scatta delle foto dell’interno del nostro corpo, come se venisse diviso in sezioni. Durante l’esame ero un po’ spaventata a causa del rumore. Così mi sono immaginata che all’interno del tubo ci fossero degli gnomi o degli elfi che suonavano a tutto volume, anche se il suono
che si sente è tutto fuorché musica. Ma in fondo sappiamo tutti che gli gnomi e gli elfi non sono bravi a suonare.
Questi studi sono condotti per vedere se si scoprono cose nuove o se i medicamenti funzionano. Penso che sia una buona cosa, perché grazie ad essi si possono forse aiutare molte altre persone.
È utile partecipare a questi studi, perché se nessuno lo facesse non sarebbe possibile scoprire nuovi medicamenti o terapie. Più partecipiamo a questo tipo di sperimenta-zioni, più progressi si compiono nel campo della ricerca, e questo permette di sviluppare medicamenti o terapie molto utili.
Io partecipo a questi studi perché potrebbero aiutarmi e, se così non fosse, magari potran-no aiutare altre persone. Ecco, ora spero che sia più o meno chiaro cos’è uno studio e per quale motivo viene fatto.
Dal punto di vista del paziente
«Io partecipo a questi studi perché potrebbero aiutarmi e, se così non fosse, magari potranno aiutare altre persone.»
29

Studi relativi alla FC
Lo «European Cystic Fibrosis Society – Cli-nical Trials Network (ECFS-CTN)» desidera promuovere la ricerca clinica (ricerca su pa-zienti) collegando fra di essi i centri di cura, offrendo così una chance ai pazienti svizzeri affetti da fibrosi cistica, nonché ai centri di cura specializzati nel trattamento di questa malattia [2]. La condivisione di conoscenze (networking) fra ricercatori, organizzazioni di pazienti e altri parte interessate, come lo «US Cystic Fibrosis Foundation – Thera-peutic Development Network (CFF-TDN)», è promossa attraverso incontri e altri mezzi d’informazione.
Qual è lo scopo della ECFS-CTN?Insieme siamo più «scaltri». La ricerca aiuta da anni i bambini affetti da fibrosi cistica a vi-vere più a lungo. Il CTN è un’organizzazione senza scopo di lucro che mira a intensificare la ricerca clinica per consentire ai pazienti di accedere il più rapidamente possibile a nuovi farmaci. Lo ECFS-CTN propone una piatta-forma per collegare fra di loro i centri di cura specializzati nel trattamento della fibrosi cistica, accrescerne e garantirne la qualità, nonché per monitorare la qualità degli stu-di ed eventualmente migliorarli prima della loro esecuzione. Il CTN non è un’istituzione orientata al profitto che realizza progetti di ricerca su mandato (Contract Research Or-ganisation, CRO).
Che cosa fa lo ECFS-CTN?Garanzia della qualità. L’uso di metodi di elevata qualità e facilmente comparabili rappresenta un sigillo di qualità per i centri di cura specializzati nel trattamento della FC e un’attrattiva per le aziende farmaceutiche o per quelle che lavorano nel campo della tecnologia medica («non bisogna rifare tutto dall’inizio»). Le priorità fondamentali del CTN sono quindi: (1) l’unificazione (standardizza-zione), (2) la garanzia dell’affidabilità (validità) e, se necessario, (3) la realizzazione di nuo-ve ricerche sui pazienti, come ad esempio la misurazione corretta della funzionalità polmo-nare «Multiple-Breath Washout» e la docu-mentazione «Lung Clearance Index (LCI)». Gli esperti dello ECFS-CTN elaborano delle istru-zioni (Standard Operating Procedures) e pro-pongono corsi di perfezionamento e verifiche di analisti (ad es. dei tecnici che si occupano dei test sulla funzionalità polmonare). Attual-mente lo ECFS-CTN si occupa dei seguenti controlli: test sulla funzionalità polmonare, imaging polmonare, marker infiammatorio, mi-crobiologia (metodo di rilevazione, ecc.), pro-ve diagnostiche della funzione del regolatore della conduttanza transmembrana della fibrosi cistica (differenza del potenziale nasale, mi-sura della corrente intestinale (ICM), test del sudore) e il controllo regolare dello sviluppo.
Lo ECFS-CTN controlla i centri di cura CTN, valutando ad esempio ogni anno la parteci-pazione agli studi e il reclutamento dei pa-zienti. I ricercatori del CTN devono aver svol-to il «Good Clinical Practice Training» [3]. I centri di cura specializzati nel trattamento della fibrosi cistica non possono eseguire studi farmaceutici, se prima la metodologia non è stata verificata dal CTN. L’obiettivo è di includere i pazienti soltanto negli studi di intervento più efficaci e sicuri.
Feedback e valutazione inter pares di protocolli di studioPrima che uno studio possa essere condot-to in Europa, gli esperti dello ECFS-CTN ne verificano i protocolli clinici pianificati, ad esempio, delle aziende farmaceutiche. I controlli riguardano ad esempio la scelta dei gruppi di pazienti, il disegno degli studi (come il mascheramento), gli aspetti relativi alla sicurezza, i metodi statistici e i parame-tri degli studi (qualità di vita, FEV1).
Il CTN offre la propria consulenza anche per stimare la dimensione dei campioni (numero di pazienti da includere) sulla base dei dati con-tenuti nel proprio registro europeo. Un centro di cura CTN non può realizzare uno studio se il CTN ha espresso un parere negativo e a se-guito del mancato adeguamento del protocollo da parte delle aziende farmaceutiche.
Perché è utile creare delle reti? Lo European Cystic Fibrosis Society - Clinical Trials Network Testo: PD Dr. med. Florian Singer, MD-PhD, Specialista FMH in pediatria, Formazione approfondita FMH in pnuemologia pediatrica, Clinica Universitaria di Pediatria, Inselspital / Ospedale universitario BernaImmagine: Adobe Stock
Perché è utile creare delle reti? Insieme siamo più forti. Il numero di pazienti affetti da fibrosi cistica in Svizzera e nel mondo è relativamente basso rispetto ad altre malattie croniche [1]. Ciò rende difficile includere nuovi soggetti, con ad esempio genotipi rari, nelle indagini scientifiche di nuove terapie. Una buona parte degli studi deve quindi essere condotta in modo multicentrico.
30 | cf-bulletin nº3/2018

31
La revisione del protocollo necessita al mas-simo di 4–6 settimane. La commissione è composta da 3 medici specialisti di fibrosi cistica, 1 coordinatore dello studio, uno stu-dioso di statistica e 2 pazienti affetti da FC e/o genitori di pazienti con FC. Nella mag-gior parte dei casi, la valutazione del CTN viene effettuata prima di quella condotta dalle commissioni di etica nazionali.
Collaborazione con i pazientiIl CTN collabora a stretto contatto con le or-ganizzazioni di pazienti (come la CFCH). In questo modo, i pazienti hanno la possibilità di informare i ricercatori su eventuali campi di ricerca non ancora esplorati. Dal can-to suo, il CTN può fornire informazioni alle aziende e ai pazienti, nonché incoraggiare i centri di cura e i pazienti a partecipare agli studi clinici.
La situazione in SvizzeraIl CTN è stato fondato nel 2008 su iniziativa della ECFS ed era inizialmente composto
da 18 centri di cura in 8 paesi europei. Nel 2016 contava 43 centri di 15 paesi diver-si*. Fra questi figurano il primo centro di cura CTN per pazienti pediatrici e adul-ti in Svizzera, sotto la guida del Prof. Dr. Alexander Möller, l’Ospedale pediatrico (Kinderspital) di Zurigo (Dr. Andreas Jung) e l’Ospedale universitario di Zurigo (PD Dr. Christian Benden). Nel 2018 ci auguriamo di poter aggiungere al CTN anche il centro di cura per la fibrosi cistica di Berna diret-to dal PD Dr. Florian Singer. Si tratta di un centro congiunto che comprende il reparto pediatrico dell’Inselspital (Prof. Dr. Philipp Latzin) e i reparti riservati ai pazienti adulti presso lo stesso nosocomio (Prof. Dr. Tho-mas Geiser) e il Lindenhofspital (Dr. Reta Fischer). Sia Berna che Zurigo soddisfano i criteri posti dalla ECFS per i centri di cura per malati di fibrosi cistica CTN, come la presenza di un certo numero di pazienti, risorse personali, esperienza con studi cli-nici e infrastruttura adatta. I centri di cura per malati affetti da FC devono assistere i
pazienti secondo gli standard della ECFS [4]. Grazie alle future collaborazioni, in Svizzera nei prossimi anni potrebbero sor-gere nuovi centri di cura ECFS-CTN.
Appendice* Belgio, Danimarca, Francia, Germania, Gran Bretagna, Irlanda, Israele, Italia, Paesi Bassi, Polonia, Portogallo, Repubblica Ceca, Spagna, Svezia, Svizzera.
Bibliografia[1] Jenni OG, Sennhauser FH. Child Health Care in Switzer land 2016. doi:10.1016/j.jpeds.2016.04.056.
[2] European Cystic Fibrosis Society – Clinical Trials Network, www.ecfs.eu/ecfs_supported_initiatives/ecfs_cli-nical_trials_network/introduction, accessed on 22/10/2018.
[3] De Boeck K, Bulteel V, Tiddens H, Wagner T, Fajac I, Conway S, et al. Guideline on the design and conduct of cystic fibrosis clinical trials: The European Cystic Fibrosis Society-Clinical Trials Network (ECFS-CTN). J Cyst Fibros 2011;10:S67–74. doi:10.1016/S1569-1993(11)60010-6.
[4] Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, et al. ECFS best practice guidelines: the 2018 revision. J Cyst Fibros 2018;17:153–78. doi:10.1016/j.jcf.2018.02.006.

32 | cf-bulletin nº3/2018
Studi relativi alla FC
In genere, una parte dei pazienti assume il farmaco mentre gli altri (il cosiddetto «grup-po di controllo») assumono un placebo. Chi riceve cosa è praticamente sempre il risulta-to di una scelta casuale, in virtù del principio di randomizzazione. Successivamente, si procede al confronto dei risultati per determi- nare se i pazienti mostrano un miglior decor-so della malattia e/o se alcuni parametri di misurazione risultano essere migliorati (nei pazienti affetti da fibrosi cistica, ad esempio, si misurano peso, funzionalità polmonare, test del sudore, numero delle esacerbazioni).
Quali sono le fasi degli studi clinici?Le autorità di controllo dei medicamenti com-petenti in materia di omologazione di farmaci esigono che vengano svolte diverse «fasi» di studi clinici prima che un farmaco venga omologato. Di norma devono essere realiz-zate le fasi 0, I, II, III fino all’omologazione e la fase IV dopo l’omologazione (tabella 1).
Praticamente tutti i farmaci omologati negli ultimi anni per il trattamento della fibro-si cistica sono stati testati in precedenza nell’ambito di studi clinici. Naturalmente, può
succedere che i risultati non corrispondano a quanto previsto e che i medicamenti non vengano omologati, o perché non hanno di-mostrato una migliore efficacia di un placebo, o perché si è constatata l’insorgenza di molti effetti collaterali.
Dove posso trovare informazioni su studi clinici condotti sulla fibrosi cistica?La rete propone numerosi siti seri e costan-temente aggiornati, che offrono una pano-ramica sugli studi clinici in corso. Prima di lanciare uno studio, i responsabili devono registrarlo sul sito https://clinicaltrials.gov. Su questo sito sono quindi pubblicati tutti gli studi clinici registrati, indipendentemen-te dalla malattia (in data 27.10.2018 erano registrati 288’173 studi). Gli studi possono essere selezionati in base a diversi filtri di ricerca, ad esempio «fibrosi cistica» (numero di studi: 1033) e poi raggruppati secondo altri criteri (ad esempio età dei pa-zienti, studio già in corso o solo previsto, ecc.)
Il sito dell’organizzazione americana per la fibrosi cistica (www.cff.org) è davvero ottimo.
Le rubriche «research» e «clinical trials» offrono un’eccellente panoramica degli studi clinici in corso o previsti relativi a questa patologia. Il sito fornisce inoltre eccellenti informazioni generali sugli studi, inclusi gli aspetti a cui i pazienti affetti da FC dovreb-bero prestare particolare attenzione prima di partecipare a uno di essi.
Alla pagina www.cff.org/Trials/finder si trova un elenco di tutti gli studi clinici farmacologici sulla fibrosi cistica attualmente in corso (al momento sono 160) con informazioni det-tagliate su ognuno di essi. È anche possibile selezionare facilmente i contenuti in base a diversi criteri, in modo da trovare, ad esem-pio, quali sono gli studi rilevanti per i pazienti adulti o per i bambini. I criteri sono i seguenti: età, FEV1, stato dello studio (reclutamento di pazienti in corso, reclutamento quasi termi- nato, reclutamento completato), luogo in cui è condotto lo studio, tipo della mutazione e approccio terapeutico. La molteplicità dei meccanismi catalogati sotto «approccio tera-peutico» (therapeutic approach) illustra bene la diversità degli ambiti in cui attualmente vengono condotti studi clinici su pazienti af-fetti da fibrosi cistica, come ad esempio:
• Ripristino della funzione CFTR (nuovi me-dicamenti) – 55 studi
• Miglioramento della clearance mucociliare – 14 studi
• Riduzione dei processi infiammatori – 11 studi• Antibiotici – 33 studi • Nutrizione e tratto gastrointestinale – 19 studi
Studi cliniciTesto: Prof. Dr. med. Philipp Latzin, PhD, responsabile del dipartimento Universitätsklinik für Kinderheilkunde, specialista in pediatria e in pneumologia pediatrica presso l’Inselspital / Ospedale universitario BernaImmagine: Adobe Stock
Che cos’è uno studio clinico? Uno studio clinico permette di testare dei farmaci sui pazienti nell’ambito di un disegno di studio predefinito. Al giorno d'oggi, gli studi clinici ricoprono un ruolo molto importante nella medicina. Sono infatti l’unica procedura che permette di verificare in maniera standardizzata se un farmaco sia davvero più efficace di un placebo.
Tabella 1: le varie fasi degli studi cliniciFase Numero di persone Durata Scopo0 ca. 10–20 Settimane Caratteristiche farmacologicheI ca. 10–100 Mesi Tollerabilità per le persone saneII ca. 10–200 Mesi /Anni Monitoraggio degli effetti (IIa)
Monitoraggio del dosaggio (IIb)III ca. 50–10'000 Anni Dimostrazione degli effetti in disegno randomizzatoIV Da ca. 100 Anni Monitoraggio degli effetti nella vita reale
Individuazione di effetti collaterali molto rari

33
• Ricerca comportamentale – 3 studi• Studi di osservazione – 21 studi• Altro – 4 studi La lista viene aggiornata quotidianamente, il numero di studi può quindi variare ancora prima della pubblicazione del bollettino.
Altri tipi di studiEsistono naturalmente molti altri tipi di studi che non sono registrati come «studi clinici», ma che sono comunque molto importanti per migliorare la diagnosi e il trattamento della fibrosi cistica.
In questa categoria rientrano tutti i cosiddet-ti «studi di base», che solitamente vengono condotti in laboratorio e vanno essere svolti quasi sempre prima di quelli clinici. Questi studi permettono di identificare i preparati promettenti, di verificare cioè se un preparato con grandi potenzialità generi realmente gli effetti sperati. In questa categoria figurano anche molti studi che analizzano le cause della malattia e che costituiscono la base di tutti gli approcci diagnostici e terapeutici. Questi studi solitamente sono condotti su cellule, a volte anche su animali.
Molte informazioni utili vengono raccolte grazie ai cosiddetti «studi osservazionali» che, come dice il nome stesso, servono «unicamente» a osservare. Permettono ad
esempio di controllare se i farmaci siano effettivamente efficaci nella vita reale (fase IV degli studi), oppure di osservare in modo sistematico il decorso naturale della malattia per identificare i fattori di rischio di un’evolu-zione negativa (ne è un esempio il cosiddet-to studio SCILD condotto in Svizzera: www.scild.ch). Gli studi osservazionali servono anche a esaminare in modo sistematico i cambiamenti sostanziali che intervengono nella diagnostica o nella terapia. Uno studio di questo tipo è stato condotto dopo l'intro-duzione dello screening neonatale in Sviz-zera nel 2011.
Per testare nuovi metodi diagnostici, solita-mente in un primo momento si effettuano i cosiddetti «studi comparativi», durante i quali vengono applicati nuovi metodi a per-sone malate e a controlli sani per verificare se insorgano delle differenze e quanto queste siano importanti. Prima che questi nuovi me-todi (ad es. la misurazione dell’LCI) vengano utilizzati nella prassi clinica, occorre tuttavia effettuare ulteriori studi.
ConclusioneGli studi clinici e non clinici sono necessari per sviluppare un nuovo farmaco o un nuovo test diagnostico e devono essere condotti anche prima dell’omologazione di un nuovo medicamento. Per garantirne l’efficacia,
i pazienti devono naturalmente prendervi parte volontariamente. La partecipazione può richiedere molto tempo ed essere impe- gnativa, ma rappresenta una grande oppor-tunità perché può ad esempio permettere di accedere a nuovi farmaci ben prima che vengano omologati. Tutti gli studi condotti in Svizzera devono prima essere approvati dalle commissioni etiche cantonali. I pazien-ti che vi partecipano non devono quindi ave-re nessuna remora di natura etica e gli studi garantiscono un appropriato rapporto rischi / benefici.
È doveroso constatare che non sono mai stati condotti così tanti studi clinici sulla fi-brosi cistica come in questo momento. Da un lato, ciò è dovuto ai nuovi farmaci (ripristino della funzione CFTR) e alla relativa euforia dimostrata dalle aziende farmaceutiche. Dall’altro, le organizzazioni dei pazienti af-fetti da fibrosi cistica hanno pianificato e strutturato meglio la realizzazione di studi clinici per malati di FC (si veda a tal proposi-to anche l'articolo sul clinical trials network pubblicato in questo numero del bollettino). Questa tendenza condurrà nei prossimi anni alla sperimentazione e, si spera, anche all'omologazione di nuovi farmaci, alcuni dei quali molto promettenti.
«unicamente» a osservare. Permettono ad medicamento. Per garantirne l’efficacia,

34 | cf-bulletin nº3/2018
Adressen | Adresses | Indirizzi
Vorstand / Comité / ComitatoCo-Präsident Ivo Hutzli, Derendingenstrasse 20, 4553 Subingen [email protected] 078 751 55 29Co-Präsident Reto Weibel, Astrastrasse 13b, 3612 Steffisburg [email protected] 079 334 65 08 Céline Guntern, Chemin du Mont-Gond 4, 1997 Haute-Nendaz [email protected] 027 288 66 88 Dr. med. Andreas Jung, Universitäts-Kinderspital, 8032 Zürich [email protected] 044 266 81 77 Peter Mendler, Stalden 34, 6344 Meierskappel [email protected] 041 790 36 60 Yvonne Rossel, Sulgenauweg 45, 3007 Bern [email protected] 079 275 05 80 Monika Steiner, Gurnigelstrasse 63, 3110 Münsingen [email protected] 079 666 27 24
Partner / Partenaires / Partenariaticf-physio, Fachgruppe Marianne Müller [email protected] 031 632 94 58Kommission Erwachsene Stephan Sieber, Grundstrasse 11, 8405 Winterthur [email protected] 052 202 60 91Fondation de la Mucoviscidose Avenue de Provence 12, 1007 Lausanne [email protected] 021 623 37 17FGLM 49 rue de Montchoisy, 1207 Genève [email protected] 022 736 02 59
Sozialdienste / Services sociaux / Servizi socialiInselspital Bern Doris Schaller [email protected] 031 632 82 21Lindenhofspital Bern Doris Schaller [email protected] 031 632 82 21Unispital Zürich André Königs [email protected] 044 255 19 58Kinderspital Zürich Tanja Hochstrasser [email protected] 044 266 35 17 Nora Tschudi [email protected] 044 266 79 13Kantonsspital St. Gallen Benita Hiensch [email protected] 071 858 35 70Ostschweizer Kinderspital Florence Eugster [email protected] 071 243 78 12CHUV Lausanne Gilbert Pieri (Pédiatrie) [email protected] 079 556 48 16 Aurélie Artibani Dondénaz (Adultes) [email protected] 021 314 60 97Kinderspital Luzern Stephanie Arnold [email protected] 041 205 35 50Lungenliga beider Basel Simone Scherz [email protected] 061 269 99 76Lega Polmonare Ticinese Francesca Gisimondo [email protected] 091 973 22 80
Regionalgruppenleiter / Responsables de groupes régionaux / Responsabili di gruppi regionaliAargau Michael Schibli, Hombergstrasse 2, 5000 Aarau [email protected] 079 754 33 04Basel Samuel Fandiño, Maienweg 9, 4310 Rheinfelden [email protected] Danièle Seiler, Werner-Abegg-Str. 47, 3132 Riggisberg [email protected] 031 809 39 64Oberwallis Christoph Kaisig, Terbinerstrasse 50, 3930 Visp [email protected] 027 946 65 10Ostschweiz Stefan und Nadia Wildhaber, Letzistrasse 18, 8732 Neuhaus [email protected] 055 282 11 21Innerschweiz vakantVaud / Fribourg Carine Fragnière, Route de la Préla 205, 1609 Fiaugères [email protected] 079 486 73 94 Anne-Marie Malizia, Chemin de Ponfilet 62, 1093 La Conversion [email protected] 021 791 59 86Neuchâtel / Jura Richard Crevoiserat, Rue Achille-Merguin 58, 2900 Porrentruy [email protected] 079 235 55 57 Marianne Delachaux, L′Esplanade 2, 2087 Cornaux [email protected] 079 658 42 52Valais romand Nathalie Neel-Rouvinez, Bau d'Alou 4, 3961 Grimentz [email protected] 079 757 45 28 Périne Vouillamoz, Tsavez 2C, 1955 Chamoson [email protected] 078 612 60 51Svizzera italiana Franz Schuler, Via Mezzaro 8, 6648 Minusio [email protected] 091 743 75 61 Fiorella Pezzotti, Via Borromini 6, 6830 Chiasso [email protected] 091 682 20 53Zürich Alexander Irion, Schwandelstrasse 29, 8800 Thalwil [email protected] 079 242 71 20
Stand am – État le – Stato il: 12.11.2018
Impressum

Impressum
Mitteilungsblatt der Schweizerischen Gesellschaft für Cystische Fibrose Bulletin d’information de la Société Suisse pour la MucoviscidoseBollettino d’Informazione della Società Svizzera per la Fibrosi Cistica
Die Inhalte widerspiegeln nicht zwingend die Positionen der CFCH.Les contenus ne reflètent pas forcément les positions de la CFCH.I contenuti non rispecchiano necessariamente il punto di vista della CFCH.
HerausgeberEditeurs responsables Editore responsabile
CFCHAltenbergstr. 29, PF 686, 3000 Bern [email protected] I www.cfch.ch
RedaktionskommissionCommission de la rédactionCommissione redazione
Marie-Christine Friedli, OltenPhilipp Latzin, [email protected]
DruckImpressionStampa
AbonnementAbbonamento
für CFCH-Mitglieder kostenlosgratuit pour les membres CFCHgratis per i membri CFCH
InserateAnnoncesInserzioni
BildquelleSource d’imagesFonte dell’immagine
www.pixabay.comwww.stock.adobe.com
Auflage / Tirage / Tiratura: 2100
Schweizerische Gesellschaft für Cystische Fibrose (CFCH)Société Suisse pour la Mucoviscidose (CFCH)Società Svizzera per la Fibrosi Cistica (CFCH)Altenbergstrasse 29, Postfach 686, 3000 Bern 8 Tel. 031 313 88 [email protected], www.cfch.ch
IBAN CH10 0900 0000 3000 7800 2
Mit freundlicher Unterstützung vonAvec l′aimable soutien deCon gentile sostegno di
RECREATE PMS(FROM PDF)
Güterstrasse 53072 Ostermundigen
wälti druckder glückliche wurf für ihre drucksachen
Stampa
wälti druck