chronOS. Knochenersatzmaterial. Osteokonduktiv ...synthes.vo.llnwd.net/o16/LLNWMB8/INT...
Transcript of chronOS. Knochenersatzmaterial. Osteokonduktiv ...synthes.vo.llnwd.net/o16/LLNWMB8/INT...
The answer tobone voids
chronOS. Knochenersatzmaterial.Osteokonduktiv, resorbierbar,synthetisch.
OptimierteosteokonduktiveMatrix
Anreicherung mitbiologischenFaktoren
Schneller Umbauinnerhalb von 6 bis18 Monaten
Synthes 1
Inhaltsverzeichnis
Einleitung
Klinische Beispiele
Eigenschaften und Vorteile
Bestellinformation
Bibliografie
Übersicht 2
Indikationen 3
Trauma und Orthopädie 4
Wirbelsäulenchirurgie 5
Optimierte osteokonduktive Matrix 6
Anreicherung mit biologischen Faktoren 7
Schneller Umbau innerhalb von 6 bis 18 Monaten 9
10
14
100%
90%
80%
70%
60%
50%
40%
30%
20%
10%
0%
100%
82.6%
56%
43.2%
34.6% 31.6%
2 Synthes chronOS. Knochenersatzmaterial Broschüre
Übersicht
chronOS ist ein vollsynthetisches und resorbierbares Kno-chenersatzmaterial, das aus reinem �-Trikalziumphosphat be-steht und dessen Druckfestigkeit in etwa derjenigen spongiö-sen Knochens entspricht. Die interkonnektierten Poren vonchronOS wirken als osteokonduktive Matrix für das Einwach-sen von Knochenzellen und Blutgefässen. Gewöhnlich er-folgt die Resorption von chronOS Implantaten und der Um-bau in körpereigenen Knochen innerhalb von 6 bis 18Monaten.
Einfache HandhabungchronOS ist ein gebrauchsfertiges Produkt. Um in Knochen-defekte von kritischer Grösse zu passen, ist es als Granulatverschiedener Grössen sowie als vorgeformte Zylinder, Blöckeund Keile erhältlich. chronOS Produkte kommen in derTrauma-, Wirbelsäulen- und Kranio-maxillofazial-Chirurgiezum Einsatz. Darüber hinaus sind mit chronOS vorgefüllteCages erhältlich, die als Implantate für die Wirbelkörper-Fusion eingesetzt werden.
Langjährige klinische ErfahrungchronOS Produkte werden seit mehr als 25 Jahren in vielfälti-gen Anwendungen erfolgreich eingesetzt. Schon 1988 wie-sen Eggli et al. auf die osteoklastische Resorption von chronOS hin. Im Jahr 1990 beschrieb Pochon chronOS (unterdem Namen Ceros-82) als vorteilhaftes Spongiosa-Knochen-ersatzmaterial für Knochendefekte bei Kindern. Seit diesenVeröffentlichungen haben verschiedene Studien das aus -gezeichnete klinische Verhalten von chronOS belegt (sieheBibliografie).
Keine Knochenentnahme erforderlichDie Entnahme autologen Knochenmaterials ist mit verschie-denen Nachteilen verbunden und kann zu Komplikationenführen. Schmerzen und andere Erkrankungen an der Entnah-mestelle sind dabei das grösste Problem. Abhängig von Ent-nahmestelle und Entnahmemenge leiden mehr als 30% derPatienten noch 2 Jahre nach ihrer Entlassung unter Schmer-zen an der Entnahmestelle (McKay, 2002). Des weiterenkann die unzureichende Menge oder Qualität von verfüg -barem autologem Material (z. B. bei Osteoporose) eine Knochenentnahme ausschliessen. chronOS ist eine ideale Alternative zu autologem Knochen. chronOS schliesst Erkran-kungen an Entnahmestellen aus und senkt die Gesamt- Operationsdauer. Aufgrund des synthetischen Ursprungs vonchronOS sind einheitliche Qualität und unbegrenzte Verfüg-barkeit gewährleistet.
Inzidenz von Schmerzen an der Entnahmestelle bei Autotransplantat-Kontrollpatienten (McKay, 2002)
Inzidenz von Schmerzen an der Entnahmestelle
Entlassung 6 Wochen 3 Monate 6 Monate 12 Monate 24 Monate% P
atie
nten
mit
Schm
erze
n an
der
Ent
nahm
este
lle
Synthes 3
Indikationen
chronOS Implantate sollten zur Auffüllung von Knochende-fekten oder als Augmentationsmaterial in Bereichen verwen-det werden, wo eher Spongiosa als kortikaler Knochen benö-tigt wird. Hierzu gehören die Auffüllung von Knochen-defekten nach Trauma, Rekonstruktion oder Korrektur innicht-lasttragenden Indikationen.Abhängig von ihrer Grösse können Defekte undefiniertergeometrischer Form mit Granulat oder mit Kombinationenaus Granulat und Blöcken aufgefüllt werden. Defekte mitdefinierter geometrischer Form können mit Blöcken, Keilenoder Zylindern aufgefüllt werden.
Trauma und OrthopädieZum Beispiel Auffüllung von Defekten durch Zysten oder Os-teotomien, Auffüllung von Defekten aus Impaktions-Fraktu-ren, Wiederauffüllung spongiöser Knochenentnahmestellen,Arthrodese, Non-Union und Pseudarthrose.
WirbelsäulenchirurgieZum Beispiel postero-laterale Fusion, interkorporelle Fusion(als Auffüllmaterial für Cage), Vertebrektomien (als Auffüll-material für die Wirbelkörperersatzimplantate), Wiederauf-füllung von Knochenentnahmestellen.
Kraniomaxillofazial-ChirurgieZum Beispiel Rekonstruktion von Unterkiefer-Zystendefektenund Defekten nach Zahnfachextraktion sowie Sinusmaxillaris.
4 Synthes chronOS. Knochenersatzmaterial Broschüre
Trauma und Orthopädie
– FallbeschreibungKorrektur einer Varus-Fehlstellung durch hohe Open-Wedge-Tibia-Osteotomie (OWHTO).
– BehandlungDie Osteotomie wurde medial mit einer TomoFix Plattestabilisiert, die Lücke mit einem zuvor mit Eigenblut desPatienten perfundierten chronOS Keil aufgefüllt.
– ResultatNach 12 Monaten war die Osteotomie verheilt undchronOS vollständig in körpereigenen Knochen umgebaut.
– LiteraturVan Hemert et al. 2004.
Postoperativ, 1½ Monate Postoperativ, 12 Monate
Präoperativ Postoperativ,3 Monate
Postoperativ,12 Monate
– FallbeschreibungWeibliche Patientin, 30 Jahre, vorstellig mit gebrochenemkleinen Finger der rechten Hand. Die Untersuchung ergabfolgenden Befund: Osteodystrophie und Tumor am proxi-malen Fingerglied.
– BehandlungStabile Osteosynthese mit Platte und Schrauben undAuffüllen des Knochendefekts mit chronOS Granulat (5 ml,�:1.4–2.8 mm). Zur besseren Stabilisierung wurde derkleine Finger während der auf den Eingriff folgenden 2Wochen am Ringfinger fixiert.
– ResultatEin Jahr nach dem Eingriff zeigte sich die Patientin sehrzufrieden und fühlte sich durch die leichte Flexions-/Exten-sionseinschränkung des proximalen Interphalangealgelenksnicht beeinträchtigt. Das chronOS Granulat war nahezuvollständig in körpereigenen Knochen umgebaut worden.
– LiteraturPhilippe Chelius, MD, Troyes, Frankreich.
Klinische Beispiele
Synthes 5
Intraoperativ Postoperativ Postoperativ,6 Monate
Postoperativ,3 Monate
Postoperativ,11 Monate
Wirbelsäulenchirurgie
– FallbeschreibungIdiopathische Skoliose bei Jugendlichen: Die Möglichkeit,ob chronOS Granulat eine dorsale Spondylodese erzielenkönnte, wurde ausgewertet. Es folgten klinische Unter -suchungen, Röntgen- und CT-Aufnahmen.
– BehandlungPosteriore USS-Titan-Fixation in Kombination mit postero-lateralem Knochentransplantat. Als Transplantat wurde in der einen Gruppe autologes Knochenmaterial vermischtmit chronOS Granulat, in der anderen Gruppe autologesKnochenmaterial vermischt mit allogenem Transplantatverwendet.
– ResultatBei beiden Gruppen hatten sich die posterolateralen Seg-mente nach 6 Monaten miteinander verbunden. Es wurdekeine Pseudarthrose festgestellt. Obwohl eine grosseMenge an Knochenersatzmaterial erforderlich ist, scheintchronOS in der Wirbelsäulenchirurgie eine ausgezeichneteAlternative zu allogenen Transplantaten zu sein.
– LiteraturMuschik et al. 2001.
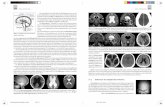
– FallbeschreibungPatient mit starken Rückenschmerzen, bisherige Therapie-versuche erfolglos, Diagnose: degenerative Bandscheiben-erkrankung L5-S1.
– BehandlungZur anterioren Lendenwirbelkörperfusion (ALIF) wurdenvorgefüllte chronOS Cages, SynCage PROmotive, perfun-diert mit entnommenem Knochenmark, in Kombinationmit posteriorer Fixation eingesetzt.
– ResultatAuf dem CT-Bild zeigt sich 3 Monate postoperativ der Kon-takt zwischen den Endplatten und den chronOS Implanta-ten durch die durchbrochene weisse Linie (Pfeil). 11 Monate postoperativ sind der chronOS Umbau und dieKnochenfusion nahezu vollständig abgeschlossen.
– LiteraturDr. med. Ch. Bach, Universitätsklinik Innsbruck, Österreich.
10%
20%
30%
40%
0% <100 160 240 320 400 500 >500
6 Synthes chronOS. Knochenersatzmaterial Broschüre
Optimierte MatrixOsteokonduktivität ist eine notwendige Voraussetzung fürden Umbauprozess. Sie wird im Wesentlichen von drei Fakto-ren beeinflusst: Die Gesamtporosität, die interkonnektiertenMakroporen und die Mikroporen. Bei der Entwicklung vonchronOS wurden diese Merkmale optimiert, um eine grösst-mögliche Ähnlichkeit mit spongiösem Knochen zu erzielenund damit ein ideales Gerüst für das Einwachsen von Knochengewebe bereitzustellen.
GesamtporositätDie Gesamtporosität von chronOS Granulat beträgt 60%, dieder Blöcke, Keile und Zylinder 70%. Damit profitiert chronOSvom höchsten Porositätsgrad, der ohne Beeinträchtigung dermechanischen Integrität möglich ist.
Interkonnektierte MakroporenDie Grösse der chronOS Makroporen liegt im Wesentlichenim Bereich zwischen 100 und 500 μm. Damit liegen optimaleBedingungen für die Vaskularisierung und Migration der Osteoklasten und Osteoblasten vor (Gazdag, 1995). Darüberhinaus sind die Makroporen interkonnektiert und ermög -lichen so die Knochenneubildung im gesamten Implantat.
Spongiosa
chronOS
Porengrösse, μm
Verteilung
Optimierte osteokonduktive Matrix
Verteilung der Makroporen: Über 95% der Makroporenhaben einen Durchmesser zwischen 100 und 500 μm.
MikoporenchronOS enthält Mikroporen. Mikroporen sind als die Zwi-schenräume innerhalb des Knochenersatzmaterials definiert,deren Durchmesser kleiner als 10 �m ist. Aufgrund der Mi-kroporosität erhält das Implantat eine grössere Oberflächeund ermöglicht die Zirkulation von Körperflüssigkeiten. Diesführt zu einer Beschleunigung des Umbauprozesses.
Synthes 7
BeschreibungDie Poren der chronOS Implantate enthalten ein erheblichesLuftvolumen. Perfusion des porösen Materials mit Knochen-mark oder Blut verdrängt diese Luft, wobei gleichzeitig Blut-zellen, Wachstumsfaktoren und, bei Perfusion mit Knochen-mark, Osteoprogenitorzellen in das Knochenersatzmaterialeindringen. Die Kombination von chronOS mit Knochenmarkbeschleunigt und verbessert die Osteointegration und ist eineausgezeichnete Alternative zu autologem oder allogenemKnochenersatzmaterial (Stoll et al. 2004 und Becker et al.2006).
DesignDamit sich das osteoinduktive und osteogene Potenzial vonautologem Knochenmark entfalten kann, hat Synthes daschronOS Perfusionskonzept entwickelt, das die effiziente in-traoperative Perfusion von chronOS Produkten mit patienten-eigenem Knochenmark ermöglicht.
Anreicherung mit biologischen Faktoren
chronOS Perfusionskonzept
Schritt 1Entnahme von Knochenmark
Schritt 2Perfusion unter Vakuum
Schritt 3Implantation von chronOS
8 Synthes chronOS. Knochenersatzmaterial Broschüre
Verbesserte OsteointegrationZur Beurteilung des osteoinduktiven und osteogenen Poten-zials autologen Knochenmarks wurde eine Tierstudie durch-geführt. Bei den mit Knochenmark perfundierten chronOSImplantaten konnte eine deutlich stärkere Osteointegrationals bei den mit Blut perfundierten Implantaten nachgewiesenwerden. In den Tibia von Schafen wurden Metaphysende-fekte kritischer Grösse mit chronOS Zylindern aufgefüllt. BeiPerfusion mit Knochenmark waren die chronOS Zylinder be-reits nach 12 Wochen nahezu vollständig in körpereigenenKnochen umgebaut. Bei den mit venösem Blut perfundiertenImplantaten war das Knochenersatzmaterial dagegen nochdeutlich sichtbar.Weitere Informationen siehe: Stoll et al. 2004 und Becker etal. 2006.
Zusätzliche Informationen über das chronOS Perfusionskon-zept können Sie dem entsprechenden Flyer (016.000.890)und der Operationstechnik (016.000.745) entnehmen.
Postoperativ, 12 Wochen Postoperativ, 12 Wochen
Postoperativ, 6 Wochen Postoperativ, 6 Wochen
Blut Knochenmark
0% 4
10%
20%
30%
40%
18.5 %
34.1%
7.5 %
28.1%
5.8 %
30.6%
12 24
20%
40%
60%
80%
23.3 % 20.7%
64.2 %
42.8%
69.7 %
49.0%
0% 4 12 24
Synthes 9
Schneller Umbau innerhalb von6 bis 18 Monaten
Die Resorption von �-Trikalziumphosphat (chronOS) erfolgt signifikant schnellerals die Resorption von Hydroxylapatit (Tiermodell, Einzelheiten siehe Buser etal. 1998).
�-Trikalziumphosphat (chronOS) wird schneller und effektiver in neuen körper-eigenen Knochen umgebaut als Hydroxylapatit (Tiermodell, Einzelheiten sieheBuser et al. 1998).
Umbau von chronOS und Ersatz durch körpereigenen Knochen (Tiermodell,24 Wochen). Um einige chronOS Granulate ist noch Geflechtknochen feststellbar,über anderen chronOS Granulate ist dagegen bereits Lamellenknochen erkennbaroder sie befinden sich bereits in der Markhöhle (Pfeil), wo sie durch Osteoklastenabgebaut werden (Buser et al. 1998).
Resorption von Knochenersatzmaterial
Ant
eil a
n G
esam
tdef
ektv
olum
en
Neubildung von körpereigenem Knochen
Ant
eil a
n G
esam
tdef
ektv
olum
en
Wochen postoperativ
Wochen postoperativ
Schnelle Resorption von �-TrikalziumphosphatUnterschiede in der chemischen Zusammensetzung von Bio-materialien haben tiefgreifende Auswirkungen auf ihr Verhal-ten in vivo. chronOS besteht aus reinem �-Trikalziumphosphatund gleicht in Struktur und chemischer Zusammensetzungnatürlichem Knochen. Die Osteoklasten resorbieren chronOSwie körpereigenen Knochen und bauen es sehr schnell ab.Hydroxylapatit wird dagegen nur sehr langsam resorbiert (Buser et al. 1998). Aufgrund ihrer chemischen Zusammen -setzung sind chronOS Implantate anfänglich röntgendicht.
Neubildung von körpereigenem KnochenZeitgleich mit der Resorption erfolgt die Knochenneubildung:Osteoklasten erzeugen entlang der Matrix Lakunen. Osteo-blasten füllen diese Lakunen durch Synthetisierung einer Ex-trazellulärmatrix, welche anschliessend kalzifiziert wird. Auf-grund der zuvor beschriebenen spezifischen chemischenZusammensetzung und optimierten Matrix, wird mit chronOSeine schnellere und effektivere Knochenneubildung erzielt alsmit anderen Knochenersatzmaterialien.
Umbau innerhalb von 6 bis 18 MonatenDer Schüssel zum Erfolg von chronOS ist der Umbauprozess.Resorption und Knochenneubildung erfolgen zeitgleich. BeimUmbau von Knochenersatzmaterial in natürlichen Knochenspielt das Timing eine entscheidende Rolle. Erfolgt die Resorp-tion zu schnell, finden die Osteoblasten die erforderlicheMatrix für die Neubildung von Knochen nicht mehr vor. Er-folgt die Resorption zu langsam oder unvollständig, kann dasKnochenersatzmaterial nicht innerhalb eines angemessenenZeitraums durch körpereigenen Knochen ersetzt werden.chronOS wurde so konzipiert, dass der Umbau innerhalbeines idealen Zeitraums erfolgt. Es wird in vivo innerhalb von6 bis 18 Monaten, abhängig von Indikation und Gesundheits-zustand des Patienten, vollständig durch körpereigenenKnochen ersetzt.
Keine unerwarteten, schädigenden NebenwirkungenAlle Untersuchungen gemäss ISO 10993 haben die ausge-zeichnete Biokompatibilität von chronOS bestätigt. In denmehr als 25 Jahren klinischer Anwendungen (siehe Bibliogra-fie) wurden keinen negativen Reaktionen beobachtet.
chronOS Hydroxylapatit
chronOS Hydroxylapatit
10 Synthes chronOS. Knochenersatzmaterial Broschüre
Bestellinformation
chronOS Preforms
chronOS Zylinder
Art. Nr. Durchmesser Länge Perfusionssystem
07.710.030S 8.5 mm 25 mm Spritze M
07.710.031S 9.5 mm 25 mm Spritze M
07.710.032S 10.5 mm 25 mm Spritze M
07.710.033S 12.5 mm 25 mm Spritze M
07.710.035S 14.0 mm 25 mm Spritze M
07.710.038S 15.15 mm 20 mm Spritze L
07.710.039S 17.55 mm 20 mm Spritze L
chronOS Blöcke
Art. Nr. Grösse (mm) Perfusionssystem
07.710.042S 5�5�10 Spritze S
07.710.045S 12.5�12.5�10 Spritze L
07.710.047S 20�20�10 Spritze L
chronOS Keile
Art. Nr. Winkel Grösse (mm) Perfusionssystem
07.710.050S 10° 25�20�6 Behälter
07.710.051S 14° 25�20�8 Behälter
07.710.052S 18° 25�20�10 Behälter
07.710.053S 22° 25�20�12 Behälter
07.710.054S 26° 25�20�14 Behälter
chronOS Keile, halbrund
Art. Nr. Winkel Grösse (mm) Perfusionssystem
07.710.057S 7° 25�35�7 Behälter
07.710.060S 10° 25�35�10 Behälter
07.710.063S 13° 25�35�13 Behälter
Synthes 11
chronOS Granulat*
Art. Nr. Durchmesser Inhalt
710.000S 0.5–0.7 mm 0.5 ml
710.001S 0.7–1.4 mm 0.5 ml
710.002S 0.7–1.4 mm 1.0 ml
710.003S 0.7–1.4 mm 2.5 ml
710.011S 1.4–2.8 mm 2.5 ml
710.014S 1.4–2.8 mm 5.0 ml
710.019S 1.4–2.8 mm 10.0 ml
710.021S 1.4–2.8 mm 20.0 ml
710.024S 2.8–5.6 mm 2.5 ml
710.025S 2.8–5.6 mm 5.0 ml
710.026S 2.8–5.6 mm 10.0 ml
710.027S 2.8–5.6 mm 20.0 ml
* chronOS Granulat ist nicht in einem Perfusionssystem er-hältlich. Es kann leicht in der sterilen Packung oder einersterilen Schale mit autologem Knochenmark oder Blutvermischt und perfundiert werden.
chronOS Einsätze für Cervios chronOS, keilförmig
Art. Nr. Höhe Passend für Perfusions-Cervios Cage system
710.921S 5 mm 889.921S Spritze S
710.922S 6 mm 889.922S Spritze S
710.923S 7 mm 889.923S Spritze S
710.924S 8 mm 889.924S Spritze S
710.925S 9 mm 889.925S Spritze S
710.926S 10 mm 889.926S Spritze S
chronOS Einsätze für Cervios chronOS, gewölbt
Art. Nr. Höhe Passend für Perfusions-Cervios Cage system
710.931S 5 mm 889.931S Spritze S
710.932S 6 mm 889.932S Spritze S
710.933S 7 mm 889.933S Spritze S
710.934S 8 mm 889.934S Spritze S
710.935S 9 mm 889.935S Spritze S
710.936S 10 mm 889.936S Spritze S
12 Synthes chronOS. Knochenersatzmaterial Broschüre
Bestellinformation
Cervio chronOS (vorgefüllt), keilförmig
Art. Nr. Höhe Perfusionssystem
870.921S 5 mm Spritze L
870.922S 6 mm Spritze L
870.923S 7 mm Spritze L
870.924S 8 mm Spritze L
870.925S 9 mm Spritze L
870.926S 10 mm Spritze L
Cervio chronOS (vorgefüllt), gewölbt
Art. Nr. Höhe Perfusionssystem
870.931S 5 mm Spritze L
870.932S 6 mm Spritze L
870.933S 7 mm Spritze L
870.934S 8 mm Spritze L
870.935S 9 mm Spritze L
870.936S 10 mm Spritze L
Plivios chronOS (vorgefüllt)
Art. Nr. Höhe Perfusionssystem
870.984S 7 mm Spritze L
870.985S 9 mm Spritze L
870.986S 11 mm Spritze L
870.987S 13 mm Spritze L
870.988S 15 mm Spritze L
870.989S 17 mm Spritze L
SynCage PROmotive (vorgefüllt), 24 x 30 mm, 12°
Art. Nr. Höhe Perfusionssystem
08.802.851S 12 mm Behälter
08.802.852S 13.5 mm Behälter
08.802.854S 15 mm Behälter
08.802.856S 17 mm Behälter
08.802.858S 19 mm Behälter
Synthes 13
SynCage PROmotive (vorgefüllt), 28 x 38 mm, 10°
Art. Nr. Höhe Perfusionssystem
08.802.871S 12 mm Behälter
08.802.872S 13.5 mm Behälter
08.802.874S 15 mm Behälter
08.802.876S 17 mm Behälter
08.802.878S 19 mm Behälter
SynCage PROmotive (vorgefüllt), 28 x 38 mm, 12°
Art. Nr. Höhe Perfusionssystem
08.802.899S 12 mm Behälter
08.802.900S 13.5 mm Behälter
08.802.901S 15 mm Behälter
08.802.902S 17 mm Behälter
08.802.903S 19 mm Behälter
System für Knochenmarkentnahme (Bone Marrow Aspirations System, BMAS)
Art. Nr. Durchmesser Länge Seitenlöcher Spritze
710.111S 11 ga 11 cm ja 20 ml
710.151S 11 ga 15 cm ja 20 ml
710.150S 11 ga 15 cm nein 20 ml
14 Synthes chronOS. Knochenersatzmaterial Broschüre
Bibliografie
Optimierte Matrix
Osteokonduktivität ist eine notwendige Voraussetzung fürden Umbauprozess. Sie wird im Wesentlichen von drei Fak-toren beeinflusst:
i) die Gesamtporosität:– Toth JM et al. (1995) Evaluation of porous biphasic calcium
phosphate ceramics for anterior cervical interbody fusion ina caprine model. Spine 20(20):2203–2210.
ii) die interkonnektierten Makroporen:– Lu JX, Flautre B et al. (1999) Role of interconnections in
porous bioceramics on bone recolonization in vitro andvivo. J Mater Sci Mater Med 10:111–120.
iii) die Mikroporen:– Chang BS et al. (2000) Osteoconduction at porous hy-
droxy-apatite with various pore configurations. Biomateri-als 21(12):1291–1298.
– Gazdag AR, Lane JM, Glaser D, et al. (1995) Alternatives toautogenous bone graft: efficacy and indications. J AmAcad Orthop Surg 3(1):1–8.
– Daculsi G. (1990) Effect of macroporosity for osseoussubstitution of calcium phosphate ceramics. Biomaterials11:86–87.
– Eggli PS et al. (1988) Porous hydroxyapatite and tricalciumphosphate cylinders with two different pore size rangesimplanted in the cancellous bone of rabbits: A comparativehistomorphometric and histologic study of bony ingrowthand implant substitution. Clin Orthop (232):127–138.
chronOS begünstigt den Umbauprozess
Die spezifische chemische Zusammensetzung und optimierteMatrix von chronOS ermöglicht den Umbauprozess (zeit-gleich ablaufende Resorption und Knochenneubildung).chronOS besteht aus reinem �-Trikalziumphosphat, das voll-ständig in Körpereigenen Knochen umgebaut wird.
i) chronOS Umbau in vivo: – Wheeler D. (2005) Grafting of massive tibial subchondral
bone defects in a Caprine Model using �-Tricalcium phosphate versus autograft. J Orthop Trauma19(2):85–91.
– Buser D et al. (1998) Evaluation of filling materialsin membrane protected bone defects: A com-perative histomorphometric study in the mandibleof miniature pigs. Clin Oral Implants Res 9 (3):137–150.
– Leutenegger H. (1993/94) Integration und Resorp-tion von Kalziumphoshatkeramiken zur Defekt -auffüllung bei Tibiakopffrakturen. Helv Chir 60:1061–1066.
– Waisbrod H et al. (1986) A pilot study of the valueof ceramics for bone replacement. Arch OrthopTrauma Surg 105:298–301.
ii) Die chemische Zusammensetzung ist wesentlich fürdie Resorption:– Koerten HK. (1999) Degradation of calcium phos-
phate ceramics. J Biomed Mater Res 44(1):78–86.– LeGeros RZ et al. (1988) Signifiance of the porosity
and physical chemistry of calcium phosphate ceramics: Biodegradation-bioresorption. Ann N YAcad Sci 523:268–271.
iii) Mikroporosität beschleunigt den Umbauprozess:– Yokozeki H et al. (1998) Influence of surface mi-
crostructure on the reaction of the active ceramicsin vitro. J Mater Sci: Mat in Med 9:381ff.
– Klein CP et al. (1985) Interaction of biodegradable �-whitlockite ceramics with bone tissue: An in vitrostudy. Biomaterials 6:189–198.
Anreicherung von chronOS mit biologischenFaktoren
Die biologischen Eigenschaften von chronOS könnendurch Anreicherung mit patienteneigenem Knochen-mark oder Blut verbessert werden; damit wird chronOS potenziell osteoinduktiv bzw. osteogen.
– Becker S et al. (2006) Osteopromotion by a �-TCP/bone marrow hybrid implant for use in spine sur-gery. Spine 31(1):11–17.
– Stoll T et al. (2004) New Aspects in Osteoinduction.Mat.-wiss. u. Werkstofftech 35(4):198–202.
Synthes 15
Mögliche Komplikationen bei der Entnahme autologenKnochens
Die Entnahme autologen Knochenmaterials ist mit verschie-denen Nachteilen verbunden und kann zu Komplikationenführen. chronOS ist eine ausgezeichnete Alternative zu auto-logem Knochen.
– Muschler GF et al. (2003) Spine fusion using cell matrixcomposites enriched in bone marrow-derived cells. ClinOrth Rel Res 407:102–118.
– McKay B, Sandhu HS. (2002) Use of recombinant humanbone morphogenetic protein-2 in spinal fusion applica-tions. SPINE 27(16S):66-85.
– Connolly J. (1995) Injectable bone marrow preparations tostimulate osteogenic repair. Clin Orth Rel Res 313:8–18.
– Tiedeman J et al. (1991) Healing of a large nonossifying fibroma after grafting with bone matrix and marrow. ClinOrth Rel Res 265:302–305.
– Connolly J et al. (1989) Autologous marrow injection fordelayed unions of the tibia: a preliminary report. J OrthTrauma 3(4) :276–282.
Klinische Studien
– Van Hemert W et al. (2004) Tricalcium phosphate granulesor rigid wedge preforms in open wedge high tibial os-teotomy: a radiological study with a new evaluation sys-tem. Knee 11(6):451–456.
– Pavlov PW. (2003) Anterior decompression for cervicalspondylotic myelopathy. Eur Spine J 12(Suppl 2):188–194.
– Muschik M et al. (2001) Beta-tricalcium phosphate as abone substitute for dorsal spinal fusion in adolescent idio-pathic scoliosis: Preliminary results of a prospective clinicalstudy. Eur Spine J 10:178–184.
– Pochon JP. (2000) (Case Report) Juvenile Knochenzysten;Die operative Versorgung juveniler Knochenzysten mitBeta-Tricalciumphosphat-Keramik (chronOS-Granulat).
– Muschik M et al. (2000) Beta-tricalcium phosphate as abone substitute and autograft for spinal fusion: A compar-ative prospective study in adolescent idiopathic scoliosis.
– Meiss L. (1999) Stimulation of bone regeneration by frag-mented cortical bone on porous calcium phosphate cera-mics (tricalcium phosphate and hydroxyapatite): An experi-mental study and preliminary clinical results. NeuereErgebnisse in der Osteologie Springer Willert+ Heug Hrsg.
– Pochon J-P. (1990) Knochenersatzplastiken mit Trikalzi-umphosphatkeramik im Kindesalter. Aktuelle Probl Chir Orthop (Switzerland) 36:1–51.
0123 016.
000.
305
SM
_707
856
AD
71
0900
03
© 0
2/20
09 S
ynth
es, I
nc. o
der
dere
n To
chte
rges
ells
chaf
ten
Alle
Rec
hte
vorb
ehal
ten
Synt
hes
ist
ein
Mar
kenz
eich
en v
on S
ynth
es, I
nc. o
der
dere
n To
chte
rges
ells
chaf
ten
Ö016.000.305öACàä
Alle Operationstechniken sind als PDF-Dateien abrufbar unter www.synthes.com/lit