Molekülchemie und Metallorganische Chemie (AC05) · Struktur (Pyramidalisierung) von EX 3 (X =...
-
Upload
nguyendung -
Category
Documents
-
view
227 -
download
1
Transcript of Molekülchemie und Metallorganische Chemie (AC05) · Struktur (Pyramidalisierung) von EX 3 (X =...

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
1 © 2011 David Scheschkewitz
SS 2013
David Scheschkewitz
Bachelor-Studiengang Chemie
Molekülchemie
und
Metallorganische Chemie (AC05)
1 SWS Vorlesung (12 Einzeltermine à 45 Minuten)
1 SWS Seminar (12 Einzeltermine à 45 Minuten)

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
2 © 2011 David Scheschkewitz
GLIEDERUNG Kapitel 1: Vorbemerkungen 1.1 Literaturempfehlungen
Anorganisch-chemische Lehrbücher
Nachschlagewerke
Hauptgruppenchemie
Komplexchemie 1.2 Einleitung
Abgrenzung von Molekülen und Komplexen gegenüber Festkörpern und Polymeren
Metalle, Nicht-Metalle, Halb-Metalle
Einteilung der Elemente
Ableitung Bändermodell
Einfluss der Temperatur auf die elektr. Leitfähigkeit
Oktettregel, Oxidationszahlen und Formalladungen Kapitel 2: Hydride, Halogenide und Chalcogenide 2.1. Gruppen 17 und 18
Interhalogene
Edelgashalogenide (Darstellung und Eigenschaften)
Molekülstrukturen (VSEPR)
Hydrolyse und andere Reaktivitäten: Edelgasoxide und -organyle 2.2. Gruppen 14 bis 16 (Halogenide)
Darstellung von Halogeniden der Gruppe 14
Hyper-koordinierte Verbindungen
Niedervalente Halogenide
Reinstsilicium-Darstellung 2.3. Gruppen 14 bis 16 (Hydride)
Darstellungsmethoden
Struktur (Pyramidalisierung) von EX3 (X = Halogen oder Wasserstoff)
Bindungsstärke, -polarität und Reaktivität
Marshsche Probe
CVD von Silanen, amorphes Silicium und Germanium 2.4. Gruppe 13
Halogenborane (Lewis-Acidität, niedervalente Vertreter, thermodynamische Stabilität)
Reaktivität (Donor-Akzeptor, Hydrolyse)
at-Komplexe (schwach koordinierende Anionen)
2-Elektronen-3-Zentren-Bindung
Borane und Carborane (Wade’sche Regeln, Neutroneneinfangtherapie) Kapitel 3: Metallorganik der Hauptgruppen-Metalle und Halb-Metalle 3.1. Gruppen 1 und 2
Synthese und Reaktivität von Lithiumorganylen
Schlenk-Gleichgewicht bei Grignardverbindungen
Carbenoide (Köbrich, Boche)

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
3 © 2011 David Scheschkewitz
3.2. Gruppe 13
Hydroborierung und Hydroaluminierung
Carbalane
Diborane(4) und Dianionen
Verbindungen der Oxidationsstufe +I
3.3. Gruppen 14 und 15
Synthese und Verwendung
Müller-Rochow Verfahren („Direkt“-Synthese)
Silikone
Cyclopentadienyl-Verbindungen (Austauschphänomene, Cp*Si-Kation) Kapitel 4: Metallorganik der Nebengruppenelemente 4.1. Carbonyle der Nebengruppen
ein- und zweikernige Carbonyle
Synthese (am Beispiel Mond-Prozess)
MO-theoretisches Bindungsmodell der M-CO-Bindung 4.2. Fischer und Schrock-Carbene
Bindungsmodell
Unterscheidungskriterien
Synthesemethoden
Alken-Metathese 4.3. Alken und Alkin-Komplexe
Dewar-Chatt-Duncanson Modell
Olefin-Polymerisierung nach Ziegler-Natta 4.4. Metallocene und verwandte Verbindungen
Ferrocene: Synthese, Struktur und Reaktivität
Halbsandwichkomplexe: Pianostuhl-Struktur
Petit’s Cyclobutadien-Komplex
Benzolkomplexe 4.5. Elementarreaktionen
oxidative Addition und reduktive Eliminierung
agostische Wechselwirkungen
- und -Hydridelimierung
oxidative Kupplung
Insertion von CO, Carbenen und Alkenen

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
4 © 2011 David Scheschkewitz
1. Vorabbemerkungen
1.1 Literaturempfehlungen
Riedel (Hrsg.), Alfasser, Janiak, Klapötke, Beyer, Moderne Anorganische Chemie,
3. Auflage, de Gruyter Verlag, Berlin 2007.
Ein durchaus umfassendes Lehrbuch, welches sich dadurch auszeichnet, dass die
verschiedenen Kapitel (Nichtmetallchemie, Festkörperchemie, Komplexchemie,
Organometallchemie, Bioanorganische Chemie) von anerkannten Experten ihres
jeweiligen Gebiets verfasst wurden. Sicherlich in vielerlei Hinsicht ein nützlicher
Begleiter für Fortgeschrittene. Enthält eine CD-Rom mit Übungsaufgaben. Nicht zu
verwechseln mit dem eher an Studenten im Nebenfach gerichteten Werk des Herausgebers.
Hollemann, Wiberg, Lehrbuch der Anorganischen Chemie, 102. Auflage, de
Gruyter Verlag, Berlin 2007.
Diese „Institution“ der Anorganischen Chemie ist nach über 100 Jahren so
umfassend geworden, dass es inzwischen von vielen eher als Nachschlagewerk
gesehen wird. Nils Wiberg schreibt selbst im Vorwort, es handele sich eigentlich um
drei Lehrbücher in einem, was sich auch im Umfang von fast 2000 Seiten
niederschlägt. Allerdings sind viele Kapitel des Buches so hinreißend gut
geschrieben und zeugen von der Leidenschaft des 2007 verstorbenen Autors zur
Chemie, dass eine über das Nachschlagen herausgehende Lektüre dringend empfohlen wird.
Insbesondere auch für die Nichtmetallchemie unentbehrlich.
Elschenbroich, Organometallchemie, 6. Auflage, Teubner Verlag, Wiesbaden 2008.
Das deutsche Standardwerk zur Organometallchemie für Hauptgruppenelemente
und Übergangsmetalle. Eines der wenigen Werke, das die Zusammenfassung dieser
beiden Teilgebiete vorexerziert und so den Inhalt dieser Vorlesung in weiten Teilen
abdeckt (Kapitel 3 und 4). Sehr zu empfehlen auch und besonders für Informationen
bezüglich der Elementarreaktionen von Übergangsmetallorganylen in katalytischen
Cyclen.
Gade, Koordinationschemie, 1. Auflage, Wiley-VCH, Weinheim 1998.
Ein anspruchsvolles Lehrbuch, das sich eindeutig an fortgeschrittene Studenten und
Forscher wendet. Die theoretischen Grundlagen der Komplexchemie sind ausführlich
erörtert. Nur begrenzt geeignet für diese Veranstaltung, da die metallorganische
Chemie der Nebengruppenelemente nur am Rande behandelt wird.
Steinborn, Grundlagen der metallorganischen Komplexkatalyse, 2. Auflage,
Teubner, Wiesbaden 2010.
Ein detailliertes Lehrbuch über die homogene Katalyse, dessen Hauptbestandteil
allerdings mit den verschiedenen Katalysecyclen außerhalb des Themenkreises
dieser Lehrveranstaltung liegt. Allerdings gibt es einem umfangreichen Abschnitt über
die metallorganischen Elementarreaktionen, der als Begleitmaterial sehr hilfreich sein
dürfte.
Steudel, Chemie der Nichtmetalle, 3. Auflage, de Guryter, Berlin 2008.
Auch wenn dieses Buch eine in meinen Augen irreführende Definition von Nichtmetallen hat (es
umschließt unter anderem Silicium, Germanium, Selen, und Tellur), auf der Basis, dass die Chemie
dieser Elemente typische Nichtmetallchemie wäre (was ist das?), ist es genau in den Abschnitten am
stärksten, wo es um die Behandlung von eindeutigen Nichtmetallen geht. Eine Fülle von Zitaten aus
der Primar- bis Tertiärliteratur (Originalliteratur, Referateliteratur, zusammenfassende Literatur) macht
das Buch zum Weiterlesen sehr nützlich.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
5 © 2011 David Scheschkewitz
1.2 Einleitung
Moleküle und Übergangsmetall-Komplexe zeichnen sich durch eine diskrete Molekülstruktur aus, d.h.
räumlich abgeschlossene Formeleinheiten, die auch im festen Zustand nur durch schwache
Wechselwirkungen (van-der-Waals oder Dispersionskräfte, Wasserstoffbrückenbindungen, etc.)
zusammengehalten werden. Für Moleküle kann somit ein physikalisch definiertes Molekulargewicht
angegeben werden. Historisch war die Eigenschaft eines Elements Moleküle zu bilden ein wichtiges
Kriterium zur Einordnung als Nichtmetall. Nichtmetalle wurden daher auch als Molekülbildner
bezeichnet. Seit dem Aufkommen der Komplexchemie nach Alfred Werner Ende des 19.
Jahrhunderts ist aber diese Einordnung weitgehend obsolet, da natürlich auch viele
Übergangsmetallkomplexe diskrete Moleküle darstellen.
Im Gegensatz zu Molekülen und Komplexverbindungen haben Festkörper zwar oft eine definierte
stöchiometrische Zusammensetzung, die allerdings der Einfachheit halber willkürlich auf das kleinste
gemeinsame Vielfache reduziert wird. Dieser empirischen Formel kommt in der Regel keinerlei
physikalische Bedeutung zu, da in den meisten Fällen nicht einmal Übereinstimmung mit der
Wiederholungseinheit des Festkörpers, der Elementarzelle, besteht.
Anders verhält es sich bei polymeren Verbindungen. Hier kann in der Regel keine exakte empirische
Formel festgelegt werden, da die Polymere zwar aus Molekülen bestehen, nämlich aus meist
kettenförmigen Wiederholungen einer bestimmten Formeleinheit, aber keine definierte Molekülgröße
aufweisen und auch oft in ihrer Struktur zahlreiche Variationen, z.B. in Form von Verzweigungen,
aufweisen. In diesem Sinne ist ein Polymer strenggenommen keine Reinsubstanz, sondern ein
Gemisch verschiedener Verbindungen. Allerdings gibt es auch für Polymere bestimmte
charakteristische Parameter, die eine adäquate Einordnung erlauben (z.B. die
Molekulargewichtsverteilung).
In dieser Vorlesung werden wir uns auf molekulare Verbindungen beschränken und allenfalls dann
auf Polymer- oder Festkörperstrukturen Bezug nehmen, wenn es der Zusammenhang erfordert (z.B.
bei den Silikonen, Kap. 3.3.).
Abbildung 1: Periodensystem der Elemente mit Einteilung in Nichtmetalle, Halbmetalle und Metalle.
Ein insbesondere aus der Sicht des Synthese (Reagenzien, Katalyse), aber zunehmend auch in der
Materialchemie wichtiger Zweig der Molekülchemie ist die metallorganische Chemie in all ihren
Ausprägungen. Eine Verbindung gilt dann als metallorganisch, wenn sie eine Metall-Kohlenstoff-
Bindung enthält.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
1 H He
2 Li Be B C N O F Ne
3 Na Mg Al Si P S Cl Ar
4 K Ca Sc Ti V Cr Mg Fe Co Ni Cu Zn Ga Ge As Se Br Kr
5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
6 Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
7 Fr Ra Ac
Nichtmetall(halb)metallisches
Allotrop bekanntHalbmetall oder
Metalloid
Übergangsmetall
(Erd)Alkalimetall

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
6 © 2011 David Scheschkewitz
Was aber ist ein Metall? Die gängige Definition verlangt, dass ein Metall als Element metallischen
Glanz aufweist und den elektrischen Strom und Wärme gut leitet. Da diese Kriterien gradueller Natur
sind, resultieren für das Periodensystem in etwa die in Abbildung 1 wiedergegeben Einordnungen.
Wir wollen daher eine etwas quantitativere Definition nach der elektronischen Struktur treffen.
Zunächst einmal erinnern wir uns daran, dass die Leitfähigkeit von Metallen mit dem Vorliegen eines
Gitters aus Metall-Kationen und dazwischen frei beweglichen Elektronen (einem Elektronen-„Meer“
oder -Gas) veranschaulicht werden kann (Abbildung 2a). Diese Vorstellung ist allerdings mit einem
modernen quantenmechanischen Verständnis kaum zu vereinbaren. Eine geeignetere Beschreibung
gelingt auf Basis der MO-Theorie mit dem sogenannten Bändermodell.
(a)
(b)
Abbildung 2: (a) Vorstellung eines Elektronengases in z.B. Lithium; (b) MO-theoretisch veranschaulichtes Bändermodell am Beispiel des
Berylliums. Der Einfachheit halber wird die dreifache Entartung des 2p-Niveaus in dieser simplen Betrachtung ignoriert.
Das Bändermodell lässt sich sehr gut ausgehend von den Orbitalen eines Metallatoms, z.B. des
Berylliums, veranschaulichen. Wir erinnern uns, dass die Linearkombination der Orbitale zweier
Atome die gleiche Anzahl an Molekülorbitalen erzeugt, von denen die eine Hälfte bindend und die
andere Hälfte antibindend ist. Wenn wir nun immer mehr Be-Atome einander näher bringen, erzeugen
wir gewissermaßen eine immer größere Anzahl an energetisch verschiedenen Molekülorbitalen.
Ohne den Versuch unternehmen zu wollen, dies streng mathematisch zu begründen, kann man leicht
einsehen, dass es bei einer gegen unendlich gehenden Anzahl von Atomen in der Größenordnung
der Avogadro-Zahl unmöglich wird diskrete Energieniveaus zu unterscheiden. Damit folgt zwanglos
eine Bandstruktur wie sie in Abbildung 2b dargestellt ist. Elektrische Leitfähigkeit resultiert bei
Vorliegen eines halbgefüllten Valenzbandes wie es z.B. bei Alkalimetallen der Fall ist oder bei
energetischer Überlappung von Valenz- und Leitfähigkeitsband wie im dargestellten Fall des
Berylliums. Die hohe elektrische Leitfähigkeit von = 106 bis 10
4 S cm−1
(Siemens pro cm ≡ Ω−1
cm−1) ist das wichtigste Kriterium für das Vorliegen eines Metalls.
Abbildung 3: Schematische Darstellung der Valenz- und Leitfähigkeitsbänder eines Nichtleiters bei 298 K und eines Halbleiters bei 0K und
298 K.
Natürlich kann sich zwischen einem gefüllten Valenzband und dem leeren Leitfähigkeitsband auch
eine mehr oder weniger große energetische Lücke auftun, die als Bandlücke bezeichnet wird. Je
nach Größe der Bandlücke unterscheidet man zwischen Halbleitern und Nichtleitern bzw.
Isolatoren. Halbleiter haben typischer Bandlücken zwischen 0.5 und 2.5 eV (z.B. Galliumarsenide
GaAs mit ca. 1.4 eV), während Nichtleiter größere Bandlücken aufweisen, z.B. der Diamant ca 5.5 eV
(Abbildung 3).* Halbleiter weisen trotz der vorhandenen Bandlücke eine signifikante elektrische
* Die gängigste Energieeinheit bei der Beschreibung von Halbleitern ist das Elektronenvolt (eV). Zur Erinnerung (1 eV ≡
1.602×10−19
J).

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
7 © 2011 David Scheschkewitz
Leitfähigkeit = 10 bis 10−6 S cm−1
auf (zum Vergleich Nichtleiter: = 10−10 bis 10−22
S cm−1). Dies ist
darauf zurückzuführen, dass die Bandlücke in einer Größenordnung liegt, in der aufgrund der zu
erwartenden Fermi-Dirac-Verteilung (einem Spezialfall der Boltzmann-Verteilung für Fermionen wie
z.B. Elektronen) eine deutliche Population des Leitfähigkeitsbandes zu Ungunsten des Valenzbandes
stattfindet (Abbildung 3). Dadurch steigt die Leitfähigkeit des Materials an. Hieraus leitet sich auch
das Hauptkriterium zur Unterscheidung von Leitern und Halbleitern ab. Da mit steigender Temperatur
das Leitfähigkeitsband immer stärker populiert wird, wird die elektrische Leitfähigkeit bei Halbleitern
mit steigender Temperatur größer, während die Leitfähigkeit von Metallen mit steigender Temperatur
sinkt.
Was bedeutet das für die Molekülchemie von Halbmetallen? Wie wir sehen werden, weist die
Molekülchemie von Halbleiterelementen (oder Halbmetallen) einige interessante Besonderheiten auf.
So spiegelt sich zum Beispiel die kleine Bandlücke der Halbleiterelemente im elementaren Zustand in
einem vergleichsweise geringen HOMO-LUMO-Abstand in vielen Verbindungen wieder. Da die
Grenzorbitale natürlich im starken Maße Einfluss auf Struktur und Reaktivität von Verbindungen
nehmen, ist dies ein entscheidender Punkt, der zur Erklärung vieler der zahlreichen Besonderheiten
schwererer Hauptgruppenelemente ab der 3. Periode herangezogen werden kann. Wie so oft verläuft
natürlich der Übergang zwischen Nichtmetallen, Halbmetallen und Metallen in der Praxis fließend, so
dass gerade in der Molekülchemie diese Einteilung sich als mehr oder weniger willkürlich erweist. Oft
genügt für eine Betrachtung in erster Näherung, wenn wir uns auf grundlegende Formalismen der
Elektronenbuchhaltung aus den ersten Semestern besinnen. Als da sind die 8-Elektronen-Regel,
Oxidationszahlen, formale Ladungen. Diese wollen wir daher an dieser Stelle kurz wiederholen.
Die Hauptgruppenelemente befinden sich im s- und p-Block des Periodensystems, da diese Elemente
nur über s- und p-Valenzelektronen verfügen. Es erweist sich in simplen quantenchemischen
Rechnungen und bestätigt sich in den empirischen Erfahrungen, auf denen das Periodensystem
basiert, dass z.B. das 4s-Niveau energetisch günstiger liegt, als das 3d-Niveau. Tatsächlich liegen die
d-Orbitale jeder einzelnen Schale energetisch so hoch, dass sie erst in der nächsthöheren Periode
mit Elektronen besetzt werden. Dies ist die Basis der 8-Elektronen-Regel, die besagt, dass jedes
Hauptgruppenelement acht Elektronen in seiner Valenzschale anstrebt und zur Vervollständigung
dieser acht Elektronen chemische Wechselwirkungen mit anderen Elementen oder sich selbst
eingeht. Wir werden insbesondere in Kapitel 1.1 und 1.2 Beispiele für Verbindungen antreffen, die
scheinbar diese Regel verletzen, aber im Einklang mit allen quantenchemischen Befunden eine
einfache Erklärung anbieten, die die Einhaltung der 8-Elektronen-Regel erlaubt. Die 8-Elektronen-
Regel gilt in auch nur annähernd realistischen Verbindungen ohne jede Ausnahme.
Abbildung 4: (a) Formale heterolytisch Bindungsspaltung zur Ermittlung von Oxidationszahlen; (b) formale heterolytische
Bindungsspaltung zur Ermittlung von Formalladungen.
Zwei Formalismen sind für eine funktionierende Elektronenbilanz von übergeordneter Bedeutung: die
Oxidationszahl und die Formalladung (Abbildung 4). Während die Ermittlung der Oxidationszahl auf
einer heterolytischen Bindungsspaltung beruht, nimmt man bei Prüfung auf ggfs. vorliegende
Formalladungen an, dass die Bindungselektronen gleichmäßig zwischen den Bindungspartnern
aufgeteilt sind (homolytische Bindungsspaltung). Im Anschluss wird dann die für jedes Atom
erhaltene Elektronenzahl von der Zahl der dem Element gemäß seiner Stellung im Periodensystem
theoretisch zustehenden Zahl an Elektronen abgezogen. Das Ergebnis entspricht je nach Art der

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
8 © 2011 David Scheschkewitz
formalen Bindungsspaltung entweder der Oxidationszahl oder der Formalladung (in Abbildung 4 am
Beispiel des Kohlenmonoxids grob wiedergegeben). Es sei eindrücklich darauf hingewiesen, dass die
Beherrschung dieser beiden Formalismen „im Schlaf“ eine notwendige Bedingung für eine
erfolgreiche Tätigkeit als Chemiker darstellt.
2. Hydride, Halogenide und Chalcogenide der Hauptgruppenelemente
Wir werden im Rahmen dieser Vorlesung weitgehend darauf verzichten, die Nichtmetallchemie zu
wiederholen, die in früheren Veranstaltungen abgedeckt wurde, und uns stattdessen auf die Hydride,
Halogenide und Chalcogenide beschränken. Ein deutlicher Schwerpunkt wird dabei auf
Verbindungen der Metalle und Halbmetalle des p-Blocks liegen, da sie (insbesondere die Halogenide)
Ausgangsmaterialien für eine reiche element- bzw. metallorganische Chemie bilden. Wir beschreiten
daher das Periodensystem vom Ende, d.h. von den Nichtmetallen, her und nähern und so
schrittweise den Metallen, dem eigentlichen Gegenstand dieser Vorlesung.
2.1 Gruppen 17 und 18
Die Elemente der Gruppe 17, d.h. die Halogene X, zählen in ihrer elementaren Form als zweiatomige
Moleküle zu den reaktivsten Elementen. Sie sind gemäß der vorherrschenden Trends im
Periodensystem sehr elektronegativ, wobei die Elektronegativität vom Fluor zum Iod (Astat sei hier
als künstliches Element mit verschwindend geringem praktischen Nutzen ausgeklammert) abnimmt.
Daher zeigen sie mit elektropositiven Elementen in der Regel stark ionische Bindungen (Halogen =
Salzbildner). In Form der Elemente bilden sie zur Vervollständigung des Elektronenoktetts in der
Valenzschale zweiatomige Moleküle mit thermodynamisch relativ schwachen X-X-Einfachbindungen.
Die Schwäche der Halogen-Halogenbindung ist leicht einzusehen, bedenkt man das Vorliegen von je
drei freien Elektronenpaaren und daher signifikanter Coulomb-Abstoßung der nicht-bindenden
Elektronen (Abbildung 5).
Abbildung 5: Zweiatomige Halogenmoleküle und ihre Dissoziation in die Elemente (Halogenradikale); Werte für
Bindungsdissoziationsenergie von Sanderson übernommen.1
Infolge der Schwäche der Halogen-Halogenbindung (Einfachbindung im Gegensatz zu den Gruppen
15 und 16) sind Halogene im atomaren Zustand, d.h. als Radikale, relativ stabil, was die Präferenz für
Radikalkettenreaktion von Halogenen zwanglos erklärt (z.B. zahlreiche Halogenierungen in der
Organischen Chemie). Allerdings bedarf der Bindungsbruch in der Regel entweder eines
Radikalstarters, der Bestrahlung (z.B. mit Sonnenlicht) oder der Erwärmung. Letzteres ist z.B. bei
Zündung eines Chlorknallgasgemisches (Wasserstoff und Chlor im Verhältnis 1:1) der Fall. Wir
werden hier allerdings auf eine Besprechung der Halogenhydride (besser Halogenwasserstoffe)
verzichten und uns stattdessen direkt den Interhalogenen zuwenden.
Übungsaufgaben Seminarteil
1) Ermitteln Sie die Oxidationszahlen der Sauerstoffatome in den folgenden Verbindungen und Ionen: a) O2, b) O3, c) CO2, d) OF2, e) XeO2, f) ClO4
−, g) PO3
3−.
2) Ermitteln Sie die Oxidationszahlen der Zentralatome in folgenden Verbindungen und Ionen: a) XeF4, b) ClF3, c) H2S, d) Cl3SiSiCl3, e) IO3
−, f) HC≡CH, g) SO2
3) Bestimmen Sie alle evtl. vorhandenen Formalladungen folgender Verbindungen unter der Annahme das die Oktettregel streng gültig ist: a) O3, b) H3BNH3, c) H2BNH2, d) BF3, e) XeF6, f) PCl5, g) SO4
2−.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
9 © 2011 David Scheschkewitz
Die Interhalogenverbindungen sind präparativ auf direkte, wenn auch nicht einfache Weise
zugänglich. In der Regel genügt einfaches Mischen der Elemente im richtigen Verhältnis (das
allerdings nicht notwendig das stöchiometrische sein muss!) sowie die Einstellung der richtigen
Drucks und der Temperatur (die allerdings auch nicht unbedingt strengen Gesetzmäßigkeiten folgt,
sondern empirisch optimiert werden muss). Die Trennung erfolgt durch fraktionierende Destillation
oder Kristallisation.
Bis auf I2Cl6 enthalten alle Vertreter der Interhalogene (außer den zweiatomigen Vertretern, Tabelle 1)
Chlor, Brom oder Iod als Zentralatom und das elektronegativste aller Halogene, das Fluor, als
Liganden. Da die Interhalogene sehr empfindlich gegenüber Hydrolyse sind, müssen sie mit
derselben Sorgfalt und identischen Sicherheitsvorkehrungen wie in der Chemie des elementaren
Fluors oder gasförmigem Fluorwasserstoff gehandhabt werden (Toxizität, Korrosivität).
Tabelle 1: Schmelz- und Siedepunkte sowie Farben von Interhalogenen im Vergleich mit denen von zweiatomigen, homonuklearen Halogenmolekülen
Mp [°C] Bp [°C] Farbe
F2 -219.6 -188.1 gelblich
Cl2 -101.5 -34.0 gelbgrün
Br2 -7.3 59 rostrot
I2 113.7 184.3 violett
ClF -155.6 -100.1 farblos
BrF -33 20 blass-braun
BrCl -66 5 rotbraun
ICl 27.2 100 rubinrot
IBr 41 116 schwarz
ClF3 -76.3 11.8 farblos
BrF3 8.8 125.8 beige
I2Cl6 101 - hellgelb
ClF5 -103 -13.1 farblos
BrF5 -60.5 41.3 farblos
IF5 9.4 104.5 farblos
IF7 6.5 4.8 farblos
Die Interhalogene folgen der allgemeinen Formel XFn, wobei n eine ungerade Zahl zwischen 1 und 7
darstellt. Warum keine Interhalogene mit einer geraden Anzahl Liganden? Die Elektronenbilanz
ergibt rasch, dass solche Verbindungen Radikale wären, deren Reaktivität naturgemäß hoch sein
sollte. Auch thermodynamisch wäre eine Disproportionierung solcher hypothetischer Radikale
(gemäß 2 XFn XFn+1 + XFn−1) daher vermutlich vorteilhaft.
Die Struktur von Interhalogenen in der Gasphase (!) lässt sich in den meisten Fällen mit dem VSEPR
Modell beschreiben.* So zeigen z.B. alle Halogentrifluoride T-förmige Strukturen und Pentafluoride
eine quadratisch-pyramidale Koordinationsumgebung. Im planaren I2Cl6 werden die beiden Iodatome
durch zwei der Chloridliganden verbrückt, was man als doppelte Donor-Akzeptor-Wechselwirkung
zwischen zwei monomeren ICl3-Einheiten auffassen kann (Abbildung 6a).
Abbildung 6: (a) Strukturen von Halogentrifluoriden und –pentafluoriden, sowie die dimere Struktur von ICl3. (b) Selektive Fluorierung von
Thioethern mit BrF3. (c) Gleichgewicht von ClF3 mit Fluorradikalen.
* Zur Erinnerung: das von Gillespie und Nyholm entwickelte VSEPR-Modell besagt, dass sich Zentren von Elektronendichte
(Bindungen oder Elektronenpaare; Doppel- und Dreifachbindungen sind jeweils nur ein solches Zentrum) weitest möglich „aus dem Weg gehen“. Demnach wird die sog. Pseudo-Struktur eines Moleküls durch einen Polyeder bestimmt, dessen Eckenzahl der Anzahl an Zentren der Elektronendichte entspricht. Die beobachtete Struktur erhält man durch Ignorieren jener Ecken, die durch ein freies Elektronenpaar besetzt sind.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
10 © 2011 David Scheschkewitz
Eine bemerkenswerte chemische Eigenschaft von Interhalogenen kann am Beispiel von BrF3
demonstriert werden. Durch die Abwesenheit protischer Reagentien oder Lösungsmittel (BrF3 darf
nie in protischen oder donorhaltigen Lösungsmitteln wie Wasser, Alkoholen oder Ethern gehandhabt
werden, sondern nur in Halomethanen wie Chloroform oder Methylenchlorid) wird das in BrF3
enthaltene Fluorid ausgesprochen nukleophil, wohingegen das Bromatom als eine sehr weiche
Lewis-Säure wirkt (Abbildung 6b). Diese Kombination macht BrF3 zu einem hochselektiven
Fluorierungsagenz in der organischen Synthese.2 Generell zeichnen sich die Interhalogene oft durch
sehr hohe Aktivität als Fluorierungsreagentien aus. ClF3 kann z.B. zur direkten Darstellung von
Uranhexafluorid aus Uran(IV)sulfat benutzt werden.3
In diesem Fall ist die bereits bei
Raumtemperatur hohe Reaktivität vermutlich auf ein Gleichgewicht mit ClF und Fluoratomen (bzw. -
radikalen) zurückzuführen (Abbildung 6c). Sowohl Chlor-, als auch Bromtrifluorid sind aufgrund ihrer
Bedeutung in der Synthese kommerziell erhältlich.
Edelgasverbindungen sind insofern mit den Interhalogenen verwandt, als dass sie im wesentlichen
über das elementare Fluor und dessen hoher Oxidationskraft zugänglich wurden. Die Chemie der
Edelgase nahm allerdings ihren Ausgang in der Beobachtung, dass das O2-Molekül sich mit
elementarem Fluor in Gegenwart von Platin zum entsprechenden Monokation oxidieren lässt
(Abbildung 7).4
Dies ermunterte Bartlett wegen der Ähnlichkeit der Ionisierungspotentiale von
Sauerstoff und Xenon zur Umsetzung von Platinhexafluorid mit dem bis dahin als inert geltenden
Edelgas. Auch wenn sein Vorschlag für die Konstitution der Verbindung sich später als falsch
herausstellte – das Produkt bestand vermutlich aus einem Gemisch von XeF+ PtF6
− and XeF
+ Pt2F11
−
– hatte er ohne jeden Zweifel die erste chemische Verbindung eines Edelgase überhaupt dargestellt.
Abbildung 7: Reaktionen von Sauerstoff und Xenon mit Platin(VI)fluorid (bei der Reaktion mit O2 in situ aus Platin und Fluor erzeugt).
In der Folge erwies sich, dass schon simples Stehenlassen eines Kolbens mit einem 1:1-Gemisch
aus Xenon und Fluor am Sonnenlicht ausreicht, die Reaktionsträgheit von Xenon zu überwinden.
Farblose Kristalle von Xenondifluorid scheiden sich bei diesem Experiment nach einigen Wochen ab
(Abbildung 8a). Zur Darstellung der höheren Xenonfluoride bedarf es erheblich drastischerer
Bedingungen: Mit fünf Äquivalenten Fluor bei erhöhtem Druck und Temperatur wird bevorzugt
Xenon(IV)fluorid gebildet. Mit einem großen Überschuss Fluor erhält man in Anwesenheit von
Nickelfluorid Xenon(VI)fluorid. In jedem Fall bedarf es aber einer Aufarbeitung der stets im Gemisch
anfallenden Xenonfluoride.
Abbildung 8: (a) Darstellung und (b) Reinigung von Xenonfluoriden aus den Elementen mit optimierten Reaktionsbedingungen (nicht-
stöchiometrisch).
Im Fall von XeF4 erfolgt die Trennung mit Vorteil unter Ausnutzung der Tatsache, dass das
Tetrafluorid ein relativ schlechter Fluorid-Donor ist. Zusammen mit Arsenpentaflourid bilden sowohl

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
11 © 2011 David Scheschkewitz
das Difluorid, als auch das Hexafluorid in BrF5-Lösung kationische und damit nichtflüchtige AsF6−
Salze, so dass Xenontetrafluorid bequem im Vakuum abkondensiert werden kann (Abbildung 8b).
Alle Xenonfluoride sind mehr oder weniger gegen Hydrolyse empfindlich, wobei die Geschwindigkeit
der Reaktion mit Wasser mit dem Fluorgehalt zunimmt. Während XeF2 langsam unter Zerfall in
Xenon, Sauerstoff und HF hydrolysiert, können durch (kontrollierte) Hydrolyse der höheren
Xenonfluoride eine Reihe von Xenonoxiden und Oxyfluoriden erhalten werden (Abbildung 9).
Abbildung 9: (a) Langsame Hydrolyse von Xenondifluorid. (b) schnelle Hydrolyse von Xenontetrafluorid zu Xenontrioxid. (c) Hydrolyse von
Xenonhexafluorid zu Xenonoxytetrafluorid und dessen Komproportionierung mit Xenontrioxid zu Xenondioxydifluorid.
Die gesamte Chemie des Xenons (die Chemie des Kryptons ist weit weniger entwickelt) ist zu
umfangreich um hier behandelt zu werden. Bei Interesse sei auf den exzellenten Übersichtsartikel
von Atwood verwiesen.5 Nur kurz erwähnt sei, dass es unter der Vielzahl von ionischen Verbindungen
mit Xenonkationen oder Xenaten (den Oxoanionen des Xenons) inzwischen auch Salze oder
salzartige Verbindungen mit Xe-N und Xe-C-Bindungen gibt. Ein besonders spektakuläres Beispiel
aus jüngerer Zeit wurde von der Seppelt-Gruppe in Berlin realisiert: Xenon als Ligand in einem
Übergangsmetallkomplex (Abbildung 10).6
Die Umsetzung von Gold(III)fluorid mit Xenon im
supersauren Milieu (HF/SbF5) liefert in einer Redox-Reaktion in nicht-spezifizierter Ausbeute einen
dikationischen Gold(II)komplex, in dem das Goldzentralatom in quadratisch-planarer
Koordinationsgeometrie von vier neutralen Xenonliganden umgeben ist.
Abbildung 10: (a) Darstellung eines Gold(II)-Kations mit vier neutralen Xenon-Liganden. (b) Struktur im Festkörper mit zwei langen
Kontakten zum den beiden Gegenionen ([Sb2F11]−)2.
Übungsaufgaben Seminarteil
1) Ermitteln Sie die Struktur folgender Verbindungen oder Ionen nach dem VSEPR Modell
und unter Anwendung Ihrer chemischen Kenntnisse und Intuition: a) Xe2F3+, b) SF4, c)
XeO64−
, d) BrF4−, e) PhICl2, f) (C5H5N)BrF3.
2) Stellen Sie stöchiometrische Gleichungen für folgende Reaktionen auf und diskutieren
Sie die geometrische Struktur der Produkte: a) XeOF4 mit 1 eq. SbF5, b) XeO3 mit 1 eq.
CsOH, c) BrF3 mit BrF3

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
12 © 2011 David Scheschkewitz
2.2 Gruppen 14 bis 16 (Halogenide)
Die schwereren Elemente der Gruppen 14 bis 16 zeigen alle halbmetallischen oder metallischen
Charakter, mit Ausnahme des Schwefels dessen Halogenide wir hier aber der Vollständigkeit halber
mit behandeln werden.* Grundsätzlich gibt es in der Chemie der Halbmetalle gewisse Ähnlichkeiten
und sie sollen daher zusammen erörtert werden. Die meisten ihrer Halogenide werden mehr oder
weniger direkt aus den Elementen dargestellt. Bisweilen werden dabei allerdings scheinbare Umwege
beschritten, um die Bildung unerwünschter Nebenprodukte zu minimieren, da bei der Direktsynthese
oft die höchstmöglichen Oxidationsstufen bevorzugt realisiert werden.
Schwefelhexafluorid ist ein ungewöhnlich reaktionsträges, farbloses Gas, das nur unter extremen
Bedingungen, z.B. durch Radiolyse einer wässrigen Lösung,7 zur Reaktion gebracht werden kann
(Abbildung 11). Selbst in geschmolzenen Alkalihydroxiden bei 500°C bleibt es erhalten. Aus dieser
Inertheit resultiert auch seine Ungiftigkeit, weshalb SF6 als Isolatorgas in Hochspannungsanlagen
(z.B. Transformatoren) Verwendung findet.
Selenhexafluorid ist demgegenüber hochtoxisch, obwohl es in reinem Wasser nicht hydrolysiert. Dies
wurde auf die langsame Hydrolyse zu HF im leicht basischen Milieu der Atemwege zurückgeführt.8
Tellurhexafluorid hydrolysiert bereits in neutralem, wässrigem Milieu zu verschiedenen Oxyfluoriden.
Die erhöhte Reaktivität ist mit Sicherheit kinetischen Ursprungs: Der höhere Atomradius des Selens
und vor allem des Tellurs erlaubt den nukleophilen Angriff, z.B. von Fluoridionen, wie durch die
Darstellung der Tellurate(VI) mit einem oder zwei Äquivalenten Fluorid gezeigt werden konnte. Die
Lewis-Acidität von TeF6 ist hinreichend für die praktisch irreversible Anlagerung eines Fluorids zum
pentagonal-bipyramidalen Heptafluorotellurat(VI), das in Anwesenheit eines Überschusses an Fluorid
im Gleichgewicht mit quadratisch anti-prismatischen Octafluortellurat(VI) steht.9 Erwartungsgemäß
werden auch mit anderen Lewis-Basen wie Aminen Lewis-Säure-Base Addukte gebildet. Generell
zeigen Selen und Tellur eine hohe Tendenz zur Ausbildung von at-Komplexen.
Die Halogenverbindungen niedrigerer Oxidationsstufen sind stets von höherer Reaktivität aufgrund
des deutlich verringerten räumlichen Anspruchs der Halogensubstituenten; sie hydrolysieren lebhaft
unter Bildung der entsprechenden Halogenwasserstoffe und Schwefeloxosäuren über intermediäre
Oxyhalogenide. Schwefeltetrafluorid, ein selektives Fluorierungsmittel in der Organischen Chemie,
entsteht durch Erhitzen von Cobalt(III)fluorid mit elementarem Schwefel. Aufgrund seiner
Wippenstruktur ist es ein Paradebeispiel für die Vorhersagekraft des VSEPR-Modells. Da die
Pseudostruktur die einer trigonalen Bipyramide ist, sind für SF4 im 19
F-NMR grundsätzlich zwei
Signale zu erwarten (für die äquatorialen und axialen Liganden). Allerdings erfolgt ein rascher
Austausch bei Raumtemperatur gemäß einer Berry-Pseudorotation (siehe unten), wodurch im Mittel
nur ein Signal beobachtet wird. Zahlreiche weitere Halogenide des Schwefels, Selens und Tellurs
sind bekannt, von denen einige auch E-E-Bindungen aufweisen, bei Interesse sei auf die
einschlägigen Lehrbücher verwiesen.
Abbildung 11: Beispiele für Darstellungsmethoden für Elementhalogenide der Gruppe 16 und Lewis-Acidität von Tellur(VI)fluorid.
* Vom metallischen Polonium, dem schwersten Element der Gruppe 16, sind nur radioaktive Isotope bekannt. Daher ist die
Chemie nicht annähernd so umfassend untersucht wie bei seinen leichteren Homologen, Schwefel, Selen und Tellur. Interessanterweise ist wie kürzlich erkannt wurde auch das einzige natürlich vorkommende Isotop des Bismuts radioaktiv, allerdings ist die Halbwertszeit so groß, dass Bismut für praktische Belange als stabiles Isotop gelten darf (P. de Marcillac, N. Coron, G. Dambier, J. Leblanc, J.-P. Moalic, Nature 2003, 422, 876. http://dx.doi.org/10.1038/nature01541

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
13 © 2011 David Scheschkewitz
Phosphorpentafluorid wird in der Regel nicht direkt aus den Elementen, sondern durch Umsetzung
des industriell bedeutsameren PCl5 mit Fluoriden, z.B. CaF2, dargestellt (Abbildung 12a). Das
Pentachlorid wird seinerseits durch oxidative Addition von elementarem Chlor an PCl3 dargestellt.
Im Festkörper liegt PCl5 als Ionenpaar aus [PCl6]−-Anionen und [PCl4]
+-Kationen vor. Die Chlorierung
von weißem Phosphor P4 bleibt auf der Stufe des dreiwertigen Halogenids stehen, wenn die Reaktion
in bereits vorgelegtem, siedendem PCl3 durchgeführt wird. Anders als im Fall der Gruppe 16-
Halogenide sind alle Phosphorhalogenide gegenüber der Hydrolyse mit Wasser empfindlich. Die
Phosphortrihalogenide werden weiterhin leicht zu den entsprechenden Phosphor(V)oxyhalogeniden
oxidiert. Inzwischen kennt man auch eine Reihe von Polyphosphorhalogeniden, die P-P-Bindungen
enthalten (z.B. das dem Bicyclobutan analoge P4Br2), die allerdings über den Status von
Laborkuriositäten bisher nicht hinausgekommen sind.
Arsen-, Antimon- und Bismuttrichloride werden üblicherweise aus den entsprechenden Oxiden durch
Umsetzung mit Chlorierungsagentien wie Thionylchlorid oder wässrige HCl-Lösung dargestellt. Hierin
kommt der stärker metallische Charakter dieser Elemente zum Ausdruck der eine erhöhte Basizität
der Oxide mit sich bringt, so dass die Chloride im Prinzip in simplen Säure-Base-Neutralisationen
zugänglich sind. Dies bedeutet keineswegs, dass die Chloride nicht feuchtigkeitsempfindlich sind;
allerdings können sie oft durch simplen Zusatz von Salzsäure regeneriert werden. Die fünfwertigen
Halogenide von Arsen und Antimon beschränken sich auf die Fluoride und Chloride, vom Bismut ist
sogar nur das Fluorid bekannt. Sie werden in der Regel aus den Trihalogeniden durch Umsetzung mit
elementarem Halogen dargestellt. Ähnlich wie beim Phosphor können Pentachloride durch
Umsetzung mit salzartigen Fluoriden oder Flußsäure in die entsprechenden Fluoride überführt
werden (Abbildung 12b). Die Kombination aus HF und SbF5 ist als „magische Säure“ bekannt
geworden, da das aus Fluorid und Antimonpentafluorid gebildete komplexe Anion ausgesprochen
gering nukleophil ist und damit die korrespondierende extrem schwache Base einer Supersäure
darstellt.
Abbildung 12: (a) Beispiele für Darstellungsmethoden von Phosphorhalogeniden. (b) Arsen und Antimonhalogenide und ihre Lewis-
Acidität.
Die trigonal-bipyramidalen P(V)-Verbindungen sind ein weiteres Standardbeispiel für die Gültigkeit
der Oktettregel. So lässt sich z.B. PF5 mit einer teilweise ionischen Grenzformel problemlos unter
Einhaltung dieser Regel beschreiben (Abbildung 13a). Da die insgesamt acht bindenden Elektronen
nun auf fünf Bindungen verteilt sind, ergibt sich eine Bindungsordnung von 4/5 für jede einzelne P-F-
Bindung. Die Berücksichtigung dieses ionischen Anteils an den Bindungen in PF5 veranschaulicht
zudem, warum stark elektronegative Substituenten besonders geeignet sind, hyperkoordinierte
Spezies zu stabilisieren.* Weiterhin wird eine zwanglose Erklärung für die konfigurative Instabilität der
* Elektronegative Atome haben energetisch niedriger liegende Atomorbitale, wodurch natürlich auch die Molekülorbitale der
involvierten Bindungen abgesenkt werden. Insgesamt werden so die antibindenden *-Orbitale erreichbarer und können leichter bindende Wechselwirkungen mit den zusätzlichen Liganden eingehen.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
14 © 2011 David Scheschkewitz
trigonalen Bipyramide geliefert: obwohl die Fluoratome in axialen und äquatorialen Positionen
offensichtlich chemisch inäquivalent sind, findet man im 19
F-NMR Spektrum selbst bei −150°C nur ein
Resonanzsignal.10
Dies wird durch eine Tunnelprozess, die bereits erwähnte Berry-Pseudorotation,
erklärt, bei der die beiden axialen Fluor-Liganden (F1) sich nach „unten“ bewegen, während zwei
äquatoriale Fluoratome (F2) nach „oben“ klappen (Abbildung 13b). Dies geschieht über einen
quadratisch-pyramidalen Übergangszustand. Es muss aber betont werden, dass dieser Prozess
zweifellos intramolekular abläuft und nicht etwa, wie man aufgrund des zuvor Erläuterten auch
vermuten könnte, intermolekular über ionische Zwischenstufen.11
Abbildung 13: (a) Negative Hyperkonjugation zur Beschreibung von hyperkoordinierten (nicht „hypervalenten“ - sic!) Verbindungen am
Beispiel des Phosphorpentafluorids. (b) Berry-Pseudorotation.
Da wir hier Brom- und Iod-Verbindungen weitgehend ausklammern, sei eine Bemerkung zur Stärke
der Lewis-Acidität erlaubt. Generell nimmt die Acidität der Halogenverbindung als Funktion des
Halogens in der Reihe F < Cl < Br < I ab, da die Orbitalüberlappung des vakanten Orbitals des
Elementhalogenids (das ja dessen Lewis-Acidität bedingt) mit den freien Elektronenpaaren des
Halogens und damit die Stärke der sogenannten -Rückbindung mit zunehmender Größe des
Halogenatoms schlechter wird. Allerdings ist gleichzeitig die Stabilisierung der Hyperkoordination von
der Elektronegativität der Substituenten abhängig, so dass die pentavalenten Brom- und
Iodverbindungen sehr instabil werden oder gar - wie im Fall des Arsen, Antimons und Bismuts - gar
nicht bekannt sind. In diesen Fällen ist eine reduktive Eliminierung elementaren Halogens zum
dreiwertigen Elementhalogenid energetisch begünstigt.
Dies mag man als ersten Hinweis darauf nehmen, dass sich für Hauptgruppenelemente allgemein
eine Zunahme der Stabilität der niedrigeren Oxidationsstufen von den leichteren zu den schwereren
Elementen einer Gruppe zu beobachten ist (allerdings ist z.B. in der Gruppe 16 keine klare Tendenz
erkennbar). Dieser Effekt ist besonders stark zwischen der 3. und 4. Periode (also vom Si zum Ge
und vom P zum As) sowie zwischen der 5. Und 6. Periode (also vom Sn zum Pb und vom Sb zum Bi).
Hierfür wurde gemeinhin die Kontraktion der Valenzorbitale aufgrund des erstmaligen Auftretens der
d- bzw. f-Schalen verantwortlich gemacht, deren Elektronen die Kernladung nur unvollkommen
abschirmen. Man spricht in diesem Zusammenhang auch von der Übergangsmetall- und
Lanthanoidenkontraktion. Da aufgrund ihres kernnahen Anteils an Elektronendichte besonders die
s-Orbitale von der höheren effektiven Kernladung betroffen sind (vgl. radiale
Elektronendichteverteilung), stehen sie für die Bindungsbildung bei den schwereren Elementen der
Hauptgruppen nur noch eingeschränkt zur Verfügung (Inert-Pair-Effekt).
Abbildung 14: Entwicklung der Ionisierungsenergie der s-Valenzorbitale in den Gruppen 13 bis 15 und Perioden 2 bis 6.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
15 © 2011 David Scheschkewitz
Allerdings gibt es gute Gründe diese Erklärung als unzureichend abzulehnen. Zum Beispiel folgt aus
der Beobachtung, dass die s-Orbitalionisierungsenergien zwar drastisch von der 2. zur 3. Periode
abnehmen, aber ansonsten nur geringfügig variieren, eine nur unwesentliche energetische
Absenkung der s-Valenzorbitale von der 3. zur 6. Periode (Abbildung 14). Tatsächlich ist die Stabilität
kleiner Oxidationsstufen bei den schwereren Elementen wohl eine Kombination aus relativistischen
Effekten (Spin-Bahn-Kopplung) und des Einflusses der Substituenten (Orbitalüberlappung und
Elektronegativitäten).12
Letzterer ist aller Wahrscheinlichkeit nach der dominierende Effekt. Im
Rahmen dieser Vorlesung mag es aber genügen, das bloße Vorhandensein eines solchen Effektes
zu konstatieren.*
Ähnlich wie im Fall der Gruppen 17 und 18 nehmen die Oxidationsstufen in den Gruppen 14 bis 16 in
Zweierschritten ab, beginnend von der größtmöglichen Oxidationsstufe gemäß der Position im
Periodensystem (Vermeidung von Radikalen). Jedoch beobachtet man aufgrund der sich
verringernden Zahl der freien Elektronenpaare (und folglich der geringeren elektrostatischen
Abstoßung) von der Gruppe 17 hin zur Gruppe 14 eine zunehmende Tendenz zur Ausbildung von
Element-Element-Bindungen (deren homolytische Spaltung ja eben die erwähnten Radikale erzeugt).
Halogenide mit Element-Element-Bindungen spielen also zunehmend eine Rolle, wodurch formale
Oxidationsstufen außerhalb der gerade beschriebenen Zweierschritte möglich werden.
In der Gruppe 14 ist der Trend zu niedrigeren Oxidationsstufen erstmalig so ausgeprägt, dass er auch
präparativ nutzbar wird. Tatsächlich spielen Verbindungen der Oxidationsstufe +II eine entscheidende
Rolle als Intermediate in vielen großtechnischen Prozessen. Einen dieser Prozesse, den Siemens-
Prozess zur Darstellung hochreinen Siliciums (Abbildung 15), werden wir an dieser Stelle besprechen
und die Rolle der Verbindungen niedriger Oxidationsstufen anhand eines vereinfachten Beispiels
beleuchten.
Abbildung 15: Fließdiagramm des Siemens-Prozesses zur Darstellung hochreinen Siliciums.
Im Siemensprozess wird das im Lichtbogenverfahren metallurgisch gewonnene Rohsilicium mit
Chlorwasserstoffgas bei ca. 300°C zu Trichlorsilan und Wasserstoff umgesetzt. Als leichtflüchtige
Flüssigkeit (Sdp. 32°C) lässt sich Trichlorsilan hervorragend durch fraktionierende Destillation über
lange industrielle Kolonnen auf sehr hohe Reinheiten bringen. Im Anschluss erfolgt dann
elektrothermische Zersetzung in Anwesenheit von Wasserstoff bei ca. 1000°C an einer
stromdurchflossenen Siliciumbrücke (zur Erinnerung: die Leitfähigkeit von Halbleitern nimmt mit der
Temperatur). Hierbei bildet sich neben dem elementaren Silicium auch HCl-Gas, das - wie auch der
Wasserstoff - im Kreis zurückgeführt wird. Auf diese Weise wird ein geschlossenes System etabliert,
wodurch die Stoffbilanz des gesamten Prozesses in der Theorie ganz ausgezeichnet wäre. In der
Praxis werden allerdings nicht unerheblich Mengen an Nebenprodukten und Begleitstoffen gebildet.
* In der Vorlesung AC06 „Metallorganische Chemie“ im Masterstudiengang werden wir versuchen, den Inert-Pair Effekt durch
qualitative MO-theoretische Betrachtungen zu erklären.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
16 © 2011 David Scheschkewitz
Insbesondere die zur Erzielung hoher Reinheitsgrade erforderliche mehrfache Destillation schlägt in
der Energiebilanz der Siliciumaufreinigung ungünstig zu Buche.
Die Rolle des Wasserstoffs bei der thermischen Zersetzung von Trichlorsilan verkompliziert
mechanistische Betrachtungen, so dass wir uns der Einfachheit halber eine wasserstoffreie Variante
des Siemens-Prozesses anschauen wollen, in der das Trichlorsilan direkt zu Silicium,
Chlorwasserstoff und Tetrachlorsilan zersetzt wird.* Hierbei wird pro Mol elementaren Siliciums ein
Mol Tetrachlorsilan gebildet. Der erste und elementarste Schritt ist die Eliminierung von HCl, wobei
Silicium(II)chlorid gebildet wird, auch unter der Bezeichnung Dichlorsilylen bekannt. Dichlorsilylen ist
das schwerer Homologe von Dichlorcarben, das in der organischen Synthese in Anwesenheit einer
Base wie z.B. Hydroxid aus Chloroform gebildet wird, und mit seinem formalen Elektronensextett eine
Elektronenmangelverbindung darstellt. Dieser Elektronenmangel bewirkt eine hohe Affinität zu
externen Donoren (vgl. Halogenide der Gruppen 15 und 16). Die Rolle des Donors spielen in diesem
Fall in Ermangelung von grundsätzlich besser geeigneten Basen (wie z.B. Aminen) die -Bindungen
der im Produktgemisch vorhandenen Moleküle. Im Endeffekt führt das zur oxidativen Addition dieser
-Bindungen an Dichlorsilylen. Dieser Vorgang der Silylen-Bildung gefolgt von oxidativer Addition
einer Si-Cl-Verbindung wird beliebig oft wiederholt, so dass im Verlauf der Abscheidungsreaktion das
Siliciumgerüst sukzessive erweitert wird (Abbildung 16). Die Komplexität der ablaufenden Prozesse
könnte vermuten lassen, dass eine Reihe von Nebenprodukten anfällt, jedoch sorgt fortwährende
Equilibrierung aller stattfindenden Reaktion im Endergebnis für ein hochreines Produkt.
Abbildung 16: (a) Die direkte thermische Zersetzung von Trichlorsilan in Abwesenheit von Wasserstoff. (b) Die ersten Schritte des
Mechanismus der Abscheidung elementaren Siliciums aus der Gasphase frei nach Krasnova.13
Viele der höheren Silane wie Disilane und Trisilane stellen unter Ausschluss von Sauerstoff und
Feuchtigkeit stabile Verbindungen dar. Zwar stellt die gezielte Synthese solcher Verbindungen den
präparativen Chemiker oft vor Selektivitätsprobleme, dennoch kennt man ähnlich wie bei den Alkanen
verzweigte Vertreter wie z.B. iso-Pentan-Analoga oder auch polycyclische Derivate wie ein
adamantanartiges Persiladerivat (Si9R16, Ausschnitt aus der diamantartigen Struktur des elementaren
Siliciums).14
Im Falle von Silicium und Germanium sind im Gegensatz zu den Gruppen 15 und 16
selbst längste homonukleare Ketten relativ stabil, die sog. Polysilane, die interessante elektronische
Eigenschaften aufweisen und in der AC06 Vorlesung im Masterstudiengang behandelt werden. Die
relative Stärke der Si-Si-Einfachbindung ist zwanglos auf die Abwesenheit von sich abstoßenden
freien Elektronenpaaren zurückzuführen.
* Auf den ersten Blick mag dieses Verfahren weniger ökonomisch erscheinen. Da aber das Tetrachlorsilan in die Trichlorsilan-
Darstellung zurückgeführt werden kann, ist es durchaus konkurrenzfähig. Im übrigen lässt sich die Bildung von Tetrachlorsilan wie auch höherer Silane nicht völlig vermeiden.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
17 © 2011 David Scheschkewitz
Das Auftreten von Silicium(II)chlorid als wichtiges Intermediat industrieller Prozesse ist ein weiterer
Beleg für die steigende Stabilität kleinerer Oxidationsstufen im Fall schwerer werdender Elemente der
Gruppe 14. Während Trichlorsilan bei Raumtemperatur sehr starker Basen (wie N-heterocyclischer
Carbene) bedarf, um die Eliminierung von HCl zu forcieren, genügt im Falle von Trichlorgerman
bereits die schwache Base Dioxan, um in guten Ausbeuten GeCl2·Dioxane-Addukt zur erhalten
(Abbildung 17). Für Zinn und Blei sind die Chloroform-Analoga bereits so instabil, dass sie bei
Raumtemperatur nicht existenzfähig sind. Zinn(II)chlorid bildet eine im Festkörper polymerartig
vernetzte Struktur und ist in Alkoholen und Ethern gut löslich, während Blei(II)chlorid eine ionische
Struktur aufweist (PbCl2-Typ), in der jedes Pb2+
-Kation von neun Chlorid-Ionen umgeben ist (vgl. auch
die Salzsäuregruppe im Kationentrennungsgang).
Abbildung 17: Die Stabilität von Element(II)chloriden der Gruppe 14.
2.3 Gruppen 14 bis 16 (Hydride)
In der Gruppe 16 kennt man nur die zweiwertigen Hydride, was als Beleg dafür gelten mag, dass zur
Stabilisierung der höheren Oxidationsstufen elektronegative Substituenten erforderlich sind
(Absenkung der *-Niveaus). Die Acidität der Gruppe 16 Hydride steigt vom Wasser (das nicht
Gegenstand dieser Vorlesung sein soll) zum Tellurhydrid als Folge der durch den hohen s-Charakter
der drei freien Elektronenpaare verringerten Basizität des Anions, also der konjugierten Base. Dieser
Trend findet sich in den Gruppen 14 und 15 reproduziert, allerdings sinkt die Acidität in Richtung der
Kohlenstoffgruppe (Tabelle 2, vgl. Trends im Periodensystem). Besonders auffällig ist, dass die
Bildungsenthalpie der Hydride mit dem Atomgewicht der Elemente dramatisch zunimmt, so dass bis
auf H2S alle schwereren Hydride der Gruppen 14 bis 16 bezüglich des Zerfalls in die Elemente
endotherme Verbindungen darstellen, ein Umstand der zur Verwendung in der
Gasphasenabscheidung der entsprechenden Metalle oder Halbmetalle günstig sein sollte.
Übungsaufgaben Seminarteil
1) Ordnen Sie die folgenden Halogenide nach Ihrer Acidität: PF5, PF3, TeF6, TeF3. Schlagen
Sie vor, wie die Reihenfolge experimentell überprüft werden könnte.
2) Warum ist PbCl2 in verdünnter Salzsäure praktisch unlöslich, aber gut löslich in
konzentrierter Salzsäure?
3) Für welche Elemente E der Gruppe 14 läuft die folgende Reaktion freiwillig ab?
EO2 + 4 HCl ECl4 + 2 H2O
4) Wie reagiert Schwefeltetrafluorid mit den folgenden Reagenzien: a) SbF5; b) Me4NF;
c) ClF; d) H2O?

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
18 © 2011 David Scheschkewitz
Tabelle 2: Schmelz- und Siedepunkte, pKs-Werte (1. Dissoziationsstufe) sowie Bildungsenthalpien der Hydride der Gruppen 14 bis 16 in wässriger Lösung.15
pKs Bp [°C] Mp [°C] Hf[kJ mol-1]
H2O 15.7 100 0 -242
H2S 7 -60.5 -83 -20
H2Se 3.7 -41.5 -66 30
H2Te 2.6 -4 -51
pKs Bp [°C] Mp [°C]
H3N 35 -34 -78 -46
H3P 27 -88 -134 +10
H3As 23 -63 -117 +66
CH4 55 -162 -183 -75
H4Si 35 -111 -185 +34
H4Ge 25 -88 -165 +91
Alle Hydride der Gruppen 14 bis 16 sind generell hochreaktiv und daher sehr giftige Verbindungen,
was ihre großtechnische Nutzung nicht unproblematisch macht. Daher finden sie trotz ihrer hohen
Flüchtigkeit und der mehr oder weniger leichten Zersetzung nur sporadisch Verwendung (Ausnahme:
Silane zur Abscheidung von amorphen Silicium). In der Gruppe 16 ist die Gasphasenabscheidung
direkt aus den Elementen weiter verbreitet, was z.B. beim Selen und Tellur aufgrund der niedrigen
Siedepunkte problemlos machbar ist (Se: 685°C, Te: 988°C). Im Übrigen wird in der Regel nicht, wie
man erwarten könnte, das Element abgeschieden, sondern die bei weitem überwiegende Menge als
Übergangsmetall-Chalcogenide. Der Halbleiter Cadmiumtellurid (CdTe) kommt z.B. zur Darstellung
von Solarzellen sowohl in kristalliner als auch amorpher Form zum Einsatz.16
Phosphan PH3, Arsan AsH3 und Stiban SbH3 sind wegen ihrer dem Silan SiH4 ähnlichen
physikalischen Eigenschaften ideale Beimischung bei der Abscheidung von n-gedoptem amorphem
Silicium. Die Beimischung der fünfwertigen Atome zum Silicium erzeugt einen Elektronenüberschuss
im Leitfähigkeitsband und modifiziert so die Leitfähigkeit des Materials. Alle schwereren Hydride der
Gruppe 15 sind, wie Silan, hochentzündlich (selbstentzündlich außer bei SbH3) und hochgiftig
(knoblauchartiger Geruch). Arsan und Stiban sind wegen ihrer endothermen Bildungsenthalpie
instabil gegen die Zersetzung in die Elemente, worauf die Marsh’sche Probe zum Nachweis von
Arsen und Antimon beruht, wobei deren basischen Oxide durch Umsetzung mit elementarem Zink in
salzsaurer wässriger Lösung in die Hydride und letztlich die Elemente überführt werden (Abbildung
18).
Die zunehmende Pyramidalität (kleiner H-E-H Winkel) in der Reihe von NH3 < PH3 < AsH3 < SbH3 <
BiH3 ist auf den zunehmenden s-Charakter des freien Elektronenpaares zurückzuführen und hängt im
Übrigen mit dem Inert Pair Effekt zusammen. Eine exaktere Erklärung für dieses Phänomen werden
wir wie bereits erwähnt in der Vorlesung AC06 im Master-Studiengang kennenlernen.
Abbildung 18: Darstellung einiger Hydride der Gruppen 14 und 15.
Auch der Zinnnachweis in der qualitativen Analyse beruht möglicherweise auf der Bildung von
Stannan(IV). In der Leuchtprobe (H2S-Gruppe des Kationentrennungsgangs) werden
Zinnverbindungen zunächst mit naszierendem Wasserstoff (Zn und HCl) behandelt, ein Reagenzglas
in die Mischung getaucht und in die Brennerflamme gehalten. Die blaue Fluoreszenz, die man bei
Anwesenheit von Zinn beobachtet, kann zur quantitativen Analyse von Organostannanen(VI) z.B. in
Muscheln benutzt werden.17

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
19 © 2011 David Scheschkewitz
Eine Ausnahme in Hinsicht seiner Reaktivität stellt GeH4 dar. So ist es gegenüber sauerstoffreiem
Wasser inert. Erst der Zusatz hoher Konzentrationen an Hydroxid-Ionen führt zu seiner Hydrolyse,
während bei SiH4 bereits katalytische Mengen an Base die vollständige Hydrolyse zu Kieselsäure,
Si(OH)4, und Wasserstoff bewirken. Auch von Sauerstoff wird es erst bei 180°C zu GeO2 und Wasser
oxidiert, während Silan mit Sauerstoff explosionsartig reagiert. Die unerwartet hohe Stabilität von
German ließ Allred und Rochow folgern, dass der Unterschied der Elektronegativitäten zwischen
Silicium und Germanium deutlich größer ist als die nach der Pauling-Methode ermittelten Werte
(Pauling: Ge = 2.01, Si = 1.90, C = 2.55). In der von ihnen vorgeschlagenen Skala kommt
Germanium eine Elektronegativität zu, die die Zwischenstellung dieses Elements bezüglich seines
chemischen Verhaltens deutlicher betont (Allred-Rochow: Ge = 2.02, Si = 1.74, C = 2.50).18
Während Trichlorsilan trotz seiner relativen Instabilität bereits ein gutes Beispiel für das beinah
beliebige Verhältnis von Halogenen und Wasserstoff in Silanen darstellt, verhält es sich in den
Gruppen 15 und 16 nicht ganz so einfach. Für Gruppe 16-Verbindungen sind keine stabilen gemischt-
substituierten Verbindungen dieser Art bekannt. Dies ist auf die extrem hohe Neigung zur Abspaltung
von HCl zurückzuführen und damit der Abscheidung des entsprechenden Elements. Eine probate
Methode zur Darstellung längerkettiger Sulfane ist folgerichtig die Umsetzung von H2S mit SCl2 unter
Abspaltung von HCl. In der Gruppe 15 kennt man einige wenige gemischte Hydrid/Fluorid-
Verbindungen vor allem für den fünfwertigen Phosphor, dessen Tendenz zur HF-Eliminierung weniger
stark ausgeprägt ist.
Obwohl einige längerkettige Sulfane bekannt sind, steigt die Tendenz zur Kettenbildung, wie man es
von der zweiten Periode her kennt, deutlich in Richtung der Gruppe 14 an. Wie schon erwähnt gibt es
eine Reihe wohl charakterisierter höherer Silane (Tabelle 3). Die SiH-Funktionalität lässt sich mit
einer Vielzahl von Halogenierungsreagentien (CBr4, SOCl2, N-Halogensuccinimid, etc.) in die
entsprechenden Halogensilane überführen. Die Umkehrung der Reaktion, d.h. die Darstellung der H-
substituierten Silane aus den Halogenderivaten gelingt z.B. mit LiAlH4. Durch geeignete Wahl der
Reagenzien lässt sich erreichen, dass die Reaktionen auf „halber“ Strecke stehen bleiben, und so
partiell halogenierte Silane zugänglich werden.
Tabelle 3: Eigenschaften der höheren Silane (aus Hollemann, Wiberg, Lehrbuch der Anorganischen Chemie).
In jüngster Zeit hat das ursprünglich von Hengge und Mitarbeitern beschriebene Cyclopentasilan19
für
einige Aufmerksamkeit gesorgt. Shimoda und Mitarbeiter entwickelten eine Methode um ein
Cyclopentasilan-basiertes [SiH2]n-Polymer/-oligomer in Toluol-Lösung mit Tintenstrahltechnik auf ein
Glassubstrat aufzubringen. Durch Erhitzen auf 300°C konnten sie so sowohl kristallines, als auch
amorphes Silicium unter Wasserstoffabspaltung in gedruckten Schaltkreisen erzeugten (Abbildung
19).20

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
20 © 2011 David Scheschkewitz
Abbildung 19: Darstellung von Cyclopentasilan (der Vollständigkeit halber aber im teilweisen Vorgriff auf Kapitel 3) und
Photopolymerisierung zum druckbaren Polysilan.
Silicium kristallisiert unter Normalbedingungen in seiner -Modifikation, die identisch mit der
Diamantstruktur ist (Zinkblende (ZnS)-Strukturtyp). Aufgrund der Verwendung des Siliciums in der
Form von „Wafern“ in der Halbleiterindustrie sind besonders die Oberflächen und damit bestimmt
Netzebenen von Interesse. Die Si(100) oder Si(110)-Flächen werden für die Wafer-Oberfläche
verwendet, während Si(111) als sogenannter „Ätzstop“ bezeichnet wird, da sie sich als besonders
resistent gegenüber dem Angriff durch Hydroxid-Ionen erweist (Abbildung 20),* wodurch ein
kontrolliertes Anätzen der Si(100) und Si(110)-Flächen zur Erzeugung isolierender SiO2-Domänen bei
der Herstellung von Mikrochips überhaupt erst ermöglicht wird.
Abbildung 20: Siliciumoberflächen nach der NIST Surface Structural Database.
Die Reaktivität der Oberfläche wird wesentlich von der Zahl der freien Valenzen der einzelnen
Oberflächenatome bestimmt. Während Si(100) zwei freie Valenzen pro Si-Atom aufweist, ist es im
Fall von Si(111) nur eine. Zwar sättigen sich die freien Valenzen durch die sog. Rekonstruktion
formal ab, indem sie untereinander Si-Si-Wechselwirkungen ausbilden, dennoch bedingt der
geringere Sättigungsgrad die höhere Reaktivität von Si(100).
Die Struktur von amorphem Silicium (a-Si) ist unbekannt (amorph). Da die Bandlücke aber signifikant
größer als beim kristallinen Silicium ist, wird angenommen, dass es neben der vom kristallinen
Silicium bekannten diamantartigen Struktur nanoskalige Bereiche mit clusterartigen Substrukturen
gibt. Diese Substrukturen bedingen die größere Bandlücke des amorphen a-Si. Das Ausmaß solcher
Unregelmäßigkeiten in der Struktur kann durch die Abscheidungsbedingungen gesteuert werden,
indem unterschiedliche Menge Wasserstoff als Trägergas bei der Thermolyse von SiH4 eingesetzt
werden.21
Der auf diese Weise variierte Restwasserstoffgehalt des a-Si:H stellt die „Stellschraube“
dar, mit der die Bandlücke beeinflusst wird: je mehr Wasserstoff, desto größer die Bandlücke
(Abbildung 21a).
* Zur Erinnerung: Die drei Zahlen in Klammern hinter dem Elementsymbol (oder der Formel der Verbindung) sind die Miller-
oder auch hkl-Indizes. Sie stehen für die Zahl der Elementarzellen zwischen den Schnittpunkten mit der x- (h), y- (k), und z-Achse des Koordinatensystems und dem Ursprung. Das Thema der Reaktivität von Siliciumoberflächen wird in der Vorlesung AC06 im Master-Studiengang vertieft werden.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
21 © 2011 David Scheschkewitz
(a)
(b)
Abbildung 21: (a) Lineare Abhängigkeit der optischen Bandlücke vom Wasserstoffgehalt von wasserstoffhaltigem amorphen Silicium, a-Si-
H.21 (b) Auf DFT-Level berechnete Struktur eines Si100H20-Clusters. Hervorgehoben sind ein deltaedrischer Bereich und Si-Atome mit einem,
zweien oder gar keinem H-Substituenten, sowie ein Dimer das jenem der Si(100)-Fläche verwandt ist.22
Aufgrund der Schwierigkeiten mit der Bestimmung der Struktur der clusterartigen Domänen im
amorphen Silicium greift man notgedrungen auf Modellverbindungen zurück. In einer DFT-basierten
Simulation beobachtete man im Laufe der sukzessiven Verkleinerung des Wasserstoffgehalts eines
Si100-Clusters eine zunehmende Verzerrung der Struktur von der diamantartigen des kristallinen
Siliciums. Wie für das amorphe Silicium postuliert, bilden sich deltaedrische Domänen aus und es
zeigen sich terminale Si-Atome mit unterschiedlichem Substitutionsgrad. Selbst der Si(100)
Oberfläche topologisch verwandte Dimere sind im Si100H20-Cluster anzutreffen (Abbildung 21b).22
2.4 Gruppe 13 (Halogenide und Hydride)
Die dreiwertigen Halogenide der Gruppe 13 zeigen bezüglich ihrer Lewis-Acidität eine ähnliche
Tendenz wie in den späteren Gruppen des Periodensystems. Die Acidität nimmt z.B. in der Reihe BF3
< BCl3 < BBr3 < BI3 zu, obwohl die Elektronegativität der Halogene gleichzeitig abnimmt. Dies liegt im
wesentlichen an zwei Faktoren: Zum einen, wird die Überlappung der nichtbindenden Orbitale des
Halogens mit dem vakanten pz-Orbital des Gruppe 13 Elements mit zunehmender Größe schlechter.
Zum anderen, vereinfacht der größer werdende Kovalenzradius des Zentralatoms sowie die längeren
Übungsaufgaben Seminarteil
1) Reihen Sie auf der Grundlage des Gelernten die Gruppe 14 Hydriden nach ihrer
Tendenz zur Deprotonierung an. Warum sind bei den schwereren Elementen der Gruppe
14 praktisch nur Alkalimetallhydride zur Deprotonierung der E-H-Verbindungen geeignet?
2) Die freien Valenzen in elementarem Silicium lassen sich durch Wasserstoff absättigen.
Schlagen Sie Methoden, vor wie die so erzeugten Si-H-Bindungen in andere
Funktionalitäten überführt werden können.
3) Warum kennt man keine homoleptische hyperkoordinierte Elementhydride der Gruppen
14 bis 16?
4) Welche Produkte erwarten Sie bei der Reduktion von Ph2SiCl2 mit elementarem Natrium
in thf?

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
22 © 2011 David Scheschkewitz
B-X-Bindungen die Koordination einer externen Lewis-Base und erhöhen damit die Acidität der
Elektronenmangelverbindung.*
Die geringere Acidität von Bortrifluorid im Vergleich zu den schwereren Halogeniden des Bors schlägt
sich auch in seinem Hydrolyseverhalten nieder. Selbst bei stöchiometrischem Einsatz eines
Äquivalents H2O wird ein komplexes Gemisch verschiedener Borsäuren gebildet,23
aus dem durch
Destillation oder Kristallisation unter geeigneten Bedingungen das Mono- und Dihydrat isoliert werden
können. Tetrafluoroborsäure wird in einem Zwischenschritt aus BF3 und aus teilweise bereits erfolgter
Hydrolyse der B-F-Bindungen stammendem Fluorwasserstoff gebildet (Abbildung 22). Mit einem
Überschuss an Wasser reagieren alle Bortrihalogenide unter vollständiger Hydrolyse zu B(OH)3. Die
relative Geschwindigkeit der Reaktion nimmt aber vom Trifluorid zum Triiodid zu.
Abbildung 22: Hydrolyseverhalten von Bortrifluorid.
Alle im obigen Gleichgewicht vorkommenden Verbindungen stellen sehr starke Brönstedt-Säuren dar.
Die Tetrafluoroborsäure ist in der präparativen Chemie besonders nützlich. Als Supersäure ist ihr
Anion, das Tetrafluoroborat, von ausgesprochen geringer Nukleophilie und gehört damit zur Klasse
der schwach koordinierenden Anionen. Organische Borate wie B(C6F5)4− sind zeigen noch geringere
Nukleophilie und werden in der Vorlesung AC06 vertiefend behandelt werden.
Die subvalenten Halogenide mit einer Oxidationsstufe, die genau um zwei kleiner ist als die
größtmögliche, werden mit steigender Ordnungszahl des Elements stabiler (wie in der
Kohlenstoffgruppe). Dieser Effekt wird, wie bereits erwähnt, am besten unter Zuhilfenahme der MO-
Theorie mit schlechterer Überlappung der Orbitale an Zentralatom und den Substituenten erklärt. Die
höhere Stabilität von Indium und Thallium(I)-Verbindungen lässt sich anschaulich in einem
Kreisprozess auf Basis experimentell zugänglicher Daten darstellen (Abbildung 23).24
Man erkennt,
dass die Disproportionierung von gasförmigem Tl(I) und In(I) zum Element und dreiwertigem
Halogenid in jedem Fall exotherm ist, allerdings für Indium und Thallium in weit weniger starkem
Maße als für Aluminium oder gar Bor. Daraus folgt, dass der hohe Energiegewinn beim Übergang der
Element(I)halogenide von der Gasphase zum Festkörper die Disproportionierungsenergie für
Thallium (und mit Einschränkung auch Indium) mühelos überkompensiert.
Abbildung 23: Thermodynamische Stabilität der einwertigen Halogenide gegenüber der Disproportionierung.
* Es sei allerdings darauf hingewiesen, dass die Größe der Iodatome in Bortiiodid im Prinzip die Lewis-Acidität verringern
sollte, da die Substituenten sich im Fall des Lewis-Säure-Base-Addukts wegen der formalen sp3-Hybridisierung näher
kommen (idealisierte Bindungswinkel sp3 109.5° vs. 120° für sp
2).

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
23 © 2011 David Scheschkewitz
Alle Halogenide der Gruppe 13 sind Elektronenmangelverbindungen. Dieses Elektronendefizit ist bei
den Monohalogeniden noch stärker ausgeprägt (zwei vakante Orbitale), so dass die Monohalide des
Bors ausschließlich in Form von Clustern bekannt sind, z.B. B9X9.25
Die Natur der in diesen Clustern
enthaltenen Mehrzentrenbindungen werden wir am Beispiel der Hydride näher erläutern (siehe
unten). Bei hohen Temperaturen in der Gasphase allerdings können BF oder BCl durch Reduktion
der Trihalogenide z.B. mit Kupfer in monomerer Form erzeugt werden. Unter geeigneten
Bedingungen reagieren die Monohalogenide mit noch vorhandenem Trihalogenid zu Diboranen(4)*
X2B-BX2 in einer oxidativen Addition, ähnlich der von SiCl2, während der Zersetzung von
Trichlorosilan im Siemens-Prozess (vgl. dort).
Andererseits bilden die Subhalide als starke Lewis-Säuren leicht Donor-Akzeptor Wechselwirkungen
mit Lewis-Basen aus. Die instabilen Monohalogenide des Aluminiums können durch Donoren
hinreichend für eine Charakterisierung bei Raumtemperatur stabilisiert werde. Hierbei gilt es zu
bedenken, dass das einwertige EX-Fragment durch Koordination einer Lewis-Base isoelektronisch zu
den zweiwertigen Subhalogeniden der Gruppe 14 wird. Aus der Kohlenstoffchemie bekannte
Strukturmotive sollten folglich anzutreffen sein. So wurde z.B. die tetramere Struktur des NMe3-
Addukts von Aluminium(I)bromid durch Röntgenbeugung als ein cyclobutanartiger Vierring
bestimmt.26
Es zersetzt sich beim Erwärmen über 90°C zu metallischem Aluminium und AlBr3.
Bezüglich der Hydride der Elemente der Gruppe 13 beschränken wir uns im wesentlichen auf das
Element Bor. Die Hydride der schweren Elemente sind vor allem als at-Komplexe relevant, z.B.
LiAlH4, das in der Organischen Chemie ein gängiges Reagenz zur Reduktion von
Carbonylverbindungen zu Alkoholen darstellt, aber auch (wie im vorangegangenen Abschnitt
gesehen) zur Reduktion von Halogenid-Funktionen zu den entsprechenden Hydriden.
Die Borane stellen ihrerseits das Paradebeispiel für Elektronenmangelverbindungen dar. Da dem
Wasserstoffsubstituenten freie Elektronenpaare zur intramolekularen Befriedigung des
Elektronenbedarfs des Borzentrums fehlen, werden stattdessen sogenannte Zwei-Elektronen-Drei-
Zentren Bindungen (2e-2c) ausgebildet. Diese Erkenntnis geht auf Überlegungen von Longuet-
Higgins aus den 1940er Jahren zurück, die er bereits als Student im zweiten Studienjahr in Oxford
anstellte.27
Die von ihm vorgeschlagene Struktur von Diboran(6) enthält pro Boratom zwei terminale
und ein verbrückendes Wasserstoffatom, wobei in jeder BHB-Brücke zwei Elektronen zwischen den
drei Zentren geteilt werden (Abbildung 24).
Die Synthese der Borane beginnt in der Regel mit Diboran(6), das sich z.B. aus BF3·Diethyletherat
und Natriumborhydrid darstellen lässt. Wie viele Borane ist auch das gasförmige B2H6 an der Luft
pyrophor und daher mit großer Vorsicht zu handhaben. Die hohe Reaktionswärme bei der Oxidation
von Boranen mit Luftsauerstoff wollte man sich in den 1950er Jahren für den Antrieb von Raketen zu
Nutze machen. Diese Anwendung wurde aufgrund des entstehenden festen Boroxids sowie einer zu
raschen Verbrennungsrate allerdings relativ schnell verworfen.
Abbildung 24: Synthese und Struktur von Diboran(6) (B2H6) und die 2-Elektronen-3-Zentren-Bindung (2e3c).
Die höheren Borane, die durch möglichst kontrollierte Thermolyse von Diboran(6) entstehen, waren
zu Zeiten von Longuet-Higgins bahnbrechender Arbeit zwar bekannt, aber physikalische
Informationen, aus denen man Schlüsse auf ihre Struktur hätte ziehen können, waren praktisch nicht
verfügbar. So wundert es kaum, dass Longuet-Higgins und sein Tutor, Ronald Bell, in ihren
Überlegungen zur Struktur dieser Borane völlig falsch lagen. Tatsächlich sind die 2e3c-Bindungen
nicht auf BHB-Brücken beschränkt, sondern treten ebenso in BBB-Einheiten auf. Stabile höhere
Borane sind z.B. Pentaboran(9) (B5H7) oder Hexaboran(12) (B6H10). Angesichts des geringen
* Die Ziffer in Klammern hinter dem Wort „Diboran“ steht für die Zahl der Substituenten. Zur Struktur von Diboran(6) siehe
weiter unten im gleichen Abschnitt.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
24 © 2011 David Scheschkewitz
Wasserstoffgehalt dieser Borane kann man aus heutiger Sicht erahnen, dass Mehrzentrenbindungen
in diesen Verbindungen eine Rolle spielen. Die auf diese Weise erhaltenen Strukturen sind mehr oder
weniger kompakte dreidimensionale Gebilde, die eine hohe Zahl an Element-Element-Bindungen
aufweisen und daher als Cluster bezeichnet werden.
Die meisten Borancluster werden relativ leicht zu Anionen deprotoniert. Als am stabilsten erweisen
sich dabei Dianionen der allgemeinen Formel BnHn2−
, deren Strukturen geschlossenen Polyedern
entsprechen, darunter die platonischen Körper Oktaeder und Ikosaeder (nicht aber Würfel oder
Tetraeder). Diese polyedrischen Strukturen dieser Dianionen sind stets aus Dreiecksflächen
aufgebaut. Aufgrund ihres geschlossenen Aufbaus werden sie als closo-Borane bezeichnet. Aus der
Beobachtung, dass neutrale wasserstoff-substituierte Borane immer die eine oder andere Vierecks-
oder Fünfecksfläche enthielten oder gar noch offenere Strukturen zeigten, entwickelten Wade und
Mitarbeiter einen Satz von Elektronenzählregeln, die es erlauben Strukturen von Boranen mit einiger
Verlässlichkeit vorherzusagen und daher als Wade-Regeln Eingang in die Literatur gefunden haben.
Die empfohlene Vorgehensweise beim Abzählen der Gerüstelektronen ist wie folgt:
1) Bestimmen Sie die Zahl der Gerüstatome n.
2) Bestimmen Sie die Gesamtzahl an Gerüstelektronen SE (für engl. skeletal electrons).
Die Gerüstatome tragen zu SE die Zahl ihrer Valenzelektronen minus zwei, also Bor,
Aluminium 1, Silicium 2, Phosphor 3 usw. Vollständig gefüllte d-Schalen werden hierbei
nicht berücksichtigt.*
3) Subtrahieren Sie die Zahl der Ladungen (mit Vorzeichen!).
4) Addieren Sie die Zahl der durch Substituenten zur Verfügung gestellten Elektronen (ein
radikalischer Rest, z.B. eine Methylgruppe oder ein Halogen, stellt ein Elektron zur
Verfügung, ein n-Donor, z.B. ein Phospan deren zwei).
5) Die effektive Zahl an Gerüstelektronen SE als Funktion der Zahl der Gerüstatome n
bestimmt nun den Polyeder des Clusters (Abbildung 25):
SE Cluster-Typ Polyeder
2n hypercloso mit n Ecken
2n + 2 closo mit n Ecken
2n + 4 nido mit n + 1 Ecken, von denen eine unbesetzt bleibt
2n + 6 arachno mit n + 2 Ecken, von denen zwei unbesetzt bleiben
2n + 8 hypho mit n + 3 Ecken, von denen drei unbesetzt bleiben
6) Bei den nido-Spezies wird die Ecke mit der höchsten Konnektivität entfernt.
7) Die arachno-Species wird vom nido-Fall abgeleitet, indem man eine zusätzliche Ecke
entfernt, die der ersten fehlenden Ecke benachbart ist, wobei es vermieden wird
Gerüstatome mit nur zwei Nachbarn zu erzeugen.
* Beachten Sie, dass es eine Reihe von Versionen der Elektronenzählregeln nach Wade gibt. Wir verwenden die Variante, die
sich zwanglos aus dem VSEPR-Modell ableitet: Jedes Gerüstatom setzt a priori zwei seiner Elektronen entweder für eine Bindung zu einem Wasserstoff bzw. einem anderen Substituenten ein oder verwendet sie in einem nach außen gerichteten freien Elektronenpaar. Daher stehen für Clusterbindungen zunächst eine um zwei geringere Zahl an Elektronen zur Verfügung als Valenzelektronen vorhanden sind. Je nach Art des Substituenten werden in einem späteren Schritt 0, 1 oder 2 Elektronen wieder hinzugezählt. Grundsätzlich steht es Ihnen aber völlig frei, beliebige andere Zählsysteme zu verwenden.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
25 © 2011 David Scheschkewitz
Abbildung 25: Polyeder mit Eckenzahl von vier bis zwölf. Rot hervorgehoben sind vorgeschlagene Zeichenhilfen. Blau und
rote Kugeln kennzeichnen die zu entfernenden Ecken.
Carborane leiten sich formal von den Boranclustern ab, indem eine BH-Einheit durch eine CH-Einheit
austauscht wird. Hierbei sind vor allem die ikosaedrischen Dicarbadodekaborane von Bedeutung. Sie
entstehen durch Umsetzung von B10H14 mit Acetylenen unter Abspaltung von zwei Äquivalenten
Wasserstoff. Das so erhaltene 1,2-Dicarbadodekaboran-Derivat bezeichnet man in Anlehnung an die
Regioisomerie des Benzols als ortho-Isomeres. Die 1,7- und 1,12-Isomere werden dementsprechend
als meta- und para-Isomeres geführt. Sie entstehen bei definierten Temperaturen aus der ortho-
Verbindung. Das para-Derivat ist thermodynamisch am stabilsten.
Carborane werden in 10
B-angereicherter Form wegen ihres hohen Borgehalts und dem großen
Neutroneneinfangquerschnitt des Bors in der sog. Neutroneneinfangtherapie zur Behandlung
bestimmter Krebsarten eingesetzt. Diese beruht auf der Freisetzung eines energiereichen -
Teilchens aus einer angeregten Form von 11
B nach
10
B + n 11
B* 7Li +
4He
2+.
Carborane genießen gegenüber kohlenstoffreien Boranen den Vorzug sich leicht in der
Kohlenstoffposition mit spezifisch wirksamen pharmazeutischen Seitenketten funktionalisieren zu
lassen. Hierdurch können die Borancluster im Körper gezielt dorthin gebracht werden wo die
Bestrahlung mit thermischen Neutronen erfolgen soll (d.h. an den Ort des Tumors oder der
Metastasen).
Übungsaufgaben Seminarteil
1) Welche Struktur leitet sich nach den Waderegeln für folgende Verbindungen ab:
a) C2B4H6; b) B10H8(PMe3)2; c) B7H14; d) Al12Br122−
?
2) Zur Darstellung von 1,2-Dicarbadodekaboran wird B10H14 in Gegenwart einer Lewisbase
mit Acetylen umgesetzt. Diskutieren Sie den Mechanismus dieser Reaktion.
3)

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
26 © 2011 David Scheschkewitz
3. Metallorganik der Hauptgruppen-Metalle und Halb-Metalle
Als Vater der systematischen Organometallchemie gilt der Engländer Edward Frankland, der in seiner
Marburger Zeit bei Robert Bunsen im Jahr 1848 die Organozinkverbindungen Et2Zn und EtZnI durch
Reduktion von Ethyliodid mit metallischen Zink erhielt. (Abbildung 26)* Frankland entdeckte in der
Folge auch Alkylquecksilber-Derivate, RHgCl und R2Hg,28
die für viele Jahrzehnte neben den
Zinkverbindungen die präparativ wichtigste Klasse an Organometallverbindungen darstellten, da sie
durch Transmetallierung eine Reihe weitere Hauptgruppenorganyle zugänglich machten.†
Dimethylquecksilber ist durch die massenweise Vergiftung von Anwohnern der Minamata-Bay
(Hunter-Russell-Syndrom) und resultierende Missbildungen bei Neugeborenen (und Erwachsenen) zu
trauriger Berühmtheit gelangt. Wasserlösliches MeHg+ war durch mikrobiellen Abbau von
elementarem Quecksilber entstanden, das mit dem Abwasser in die Bucht eingeleitet worden war.29
In jüngerer Zeit hat die tödliche Vergiftung der kanadischen Professorin Karen Wetterhahn für
Schlagzeilen gesorgt, die den Berichten nach durch nur wenige Tropfen Me2Hg auf einem
Latexhandschuh hervorgerufen wurde.
Abbildung 26: Synthese und von Alkylzink und -quecksilberverbindungen nach Frankland.
Die Metallorganik der Hauptgruppenmetalle und Halbmetalle verzichtet daher heute gerne auf die
Verwendung der gefährlichen organischen Quecksilberverbindungen. Man beginnt stattdessen
Synthesen oft mit den reaktiven Organylen der Gruppen 1 und 2, die anschließend in einer
Salzmetathese mit geeigneten Elementhalogeniden umgesetzt werden. Die Direktsynthese von
metallorganischen Verbindungen der Gruppen 13 bis 16 gelingt unter Umständen auch, erfordert aber
in der Regel einen beträchtlichen apparativen Aufwand, da das Metall in einer hochreaktiven Form,
z.B. durch Kondensation aus der Gasphase im Ultrahochvakuum, vorliegen muss. Wir wollen daher
die Reihenfolge aus Kapitel 2 umkehren und das vorliegende Kapitel mit der metallorganischen
Chemie der Alkali- und Erdalkalimetalle beginnen.
3.1 Gruppen 1 und 2
Die Organyle der Alkali- und Erdalkalimetalle haben gemeinsam, dass der überwiegende Teil
präparativ nützlicher Derivate sich auf jeweils nur ein Element der Gruppe beschränkt. Bei den
Alkalimetallen finden insbesondere in der organischen Chemie fast ausschließlich Lithium-Organyle
Verwendung, da die schwereren Alkalimetallderivate weniger gut zugänglich sind und gemeinhin
auch als zu reaktiv angesehen werden.
Die ersten Alkaliorganyle (Natrium und Lithium) wurden 1909 von Wilhelm Schlenk sen. und Johanna
Holtz durch Transmetallierung von Alkylquecksilberverbindungen dargestellt.30
Den Durchbruch als
leicht zugängliche Reagenzien verschaffte ihnen aber der von der Olefin-Polymerisation bekannte
Karl Ziegler mit seiner Arbeit zur Direktdarstellung aus organischen Halogeniden und elementarem
Lithium, da diese Methode die Verwendung der giftigen Quecksilberderivate vermied.31
Ziegler
erkannte bereits damals, dass die Polarität und Donorkapazität des eingesetzten Lösungsmittels für
den Erfolg der Synthese von entscheidender Bedeutung ist. Bei Durchführung der Darstellung von
z.B. nBuLi in Diethylether sanken die erzielbaren Ausbeuten wegen der Homokupplung des Produktes
(Wurtz-Kupplung) mit Ausgangsmaterial drastisch.
* Historisch Interessierte können in Franklands Originalarbeit nachschlagen, allerdings nicht ohne sich der altersbedingten,
zahlreichen Fehler in der Publikation bewusst zu sein: E. Frankland, Liebigs Ann. Chem. 1849, 71, 213. http://dx.doi.org/10.1002/jlac.18490710206
† Diese Arbeiten führte Frankland am Imperial College in London durch. Sie kosteten zwei seiner Assistenten das Leben. Für
eine authentische Beschreibung eines Vergiftungsfalls mit Dimethylquecksilber (der Betroffene hatte 6 kg (!) Me2Hg innerhalb von drei Monaten im Labor hergestellt) siehe: J. Pazderová, A. Jirásek, M. Mráz, J. Pechan, Int. Arch. Occ. Env. Health 1974, 33, 323. http://dx.doi.org/10.1007/BF00538936

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
27 © 2011 David Scheschkewitz
Abbildung 27: Synthese und von Aryllithium-Verbindungen nach (a) Schlenk und (b) Ziegler.
Die üblichen Darstellungsmethoden für Alkyllithium-Verbindungen umfassen neben der erwähnten
Direktsynthese und Transmetallierung vor allem die Deprotonierung acider Kohlenwasserstoffe, den
Metall-Halogen-Austausch und die Carbolithiierung von Alkenen und Alkinen.
Tabelle 4: Säurestärke einiger Kohlenwasserstoffe nach Elschenbroich - Organometallchemie (pKs-Werte in aprotischen Medien bestimmt, aber auf die vertrauten Werte im wässrigen Milieu umgerechnet).
Verbindung pKs-Wert Verbindung pKs-Wert
C4H10 44 HC≡CH 24
Benzol 37 Cyclopentadiene 15
Toluol 35 O2N-CH3 10
Ph3CH 30 HCN 9.4
Die Deprotonierung organischer Verbindungen gelingt umso leichter, je acider das zu entfernende
Proton ist. Die Acidität einer Verbindung hängt maßgeblich von der Stabilität des durch
Deprotonierung entstehenden Anions ab. Bei Cyclopentadien z.B. ist das Anion, also
Cyclopentadienid Hückel-aromatisch* und daher besonders stabil, Cyclopentadien damit eine relativ
starke Säure (Tabelle 4). Im Sinne einer Säure-Base-Reaktion besteht in der Regel ein Gleichgewicht
zwischen den beiden involvierten Lithium-Organylen, dass aber aufgrund durch Verwendung von
Reagentien mit leicht flüchtigen Protonierungsprodukten bequem zur Produktseite verschoben
werden kann. Aus diesem Grund, aber auch wegen des sehr hohen pKs-Wertes von Methan (ca. 48),
ist MeLi ein bevorzugtes Deprotonierungsreagenz. Gemäß dem Massenwirkungsgesetz ist die
korrespondierende Base umso stärker, je schwächer die entsprechende Säure ist, d.h. je höher deren
pKs-Wert. Durch Verwendung von Hilfsbasen (wie z.B. N,N‘-Tetramethylethylendiamin, tmeda) kann
die Basizität der Organolithium-Verbindung weiter erhöht werden. Der Einsatz chiraler Hilfsbasen
(z.B. (−)-Spartein, ein zweibasiges chirales Amin) ermöglicht außerdem eine enantioselektive
Reaktionsführung.32
Der Metall-Halogenaustausch findet vor allem zur Darstellung aromatischer Organolithium-
Verbindungen Verwendung und wurde erstmalig von Gilman und Wittig unabhängig voneinander
beschrieben.33
Vor allem dann, wenn in der protonierten Form der carbanionischen Zielverbindung
acidere Protonen vorhanden sind, als das zu entfernende, bietet diese Methode Vorteile. Dies ist zum
Beispiel im Mesitylen der Fall, das neun benzylische und drei aromatische Protonen enthält, womit
auch kinetisch die benzylische Deprotonierung klar bevorteiligt sein sollte. Die Umsetzung von
Mesitylbromid mit Alkyllithium-Verbindungen (z.B. nBuLi) ergibt in guter Ausbeute Mesityllithium, das
zwar auch direkt mit metallischem Lithium zugänglich ist, dann aber vom anfallenden LiBr abgetrennt
werden muss.
Der Mechanismus des Metall-Halogenaustausches wird erstaunlicherweise auch nach über 70
Jahren noch kontrovers diskutiert. Eine plausible Möglichkeit wurde bereits von Wittig vorgeschlagen.
Demnach verläuft die Reaktion im Sinne einer -Bindungsmetathese mit einem viergliedrigem
Übergangszustand (Abbildung 28a). Da die Reaktion in der Regel reversibel ist, muss für eine
vollständige Umsetzung eine Komponente aus dem Gleichgewicht entfernt werden, z. B. unter
Ausnutzung der relativen Schwerlöslichkeit der gebildeten Aryllithium-Verbindung. Eine weitere
Möglichkeit stellt, wie im Fall von tBuLi, der Einsatz von zwei Äquivalenten des Lithiumorganyls dar,
* Im Lithiumcyclopentadienid (und anderen Cp-Verbindungen) liegt meist ein
5-Koordinationsmodus von Cp
− an Li
+ vor. Das
bedeutet, dass alle fünf Kohlenstoffatome gleichermaßen koordinieren: Cp− hat also eine Haptizität von 5. Die Haptizität wir
durch den griechischen Buchstaben Eta (; sprich hapto) mit einer darauf folgenden hochgestellten Zahl ausgedrückt.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
28 © 2011 David Scheschkewitz
wodurch das Koppelprodukt tBuLi deprotoniert und letztlich als Isobuten und Isobutan aus dem
Reaktionsgemisch entweicht (Abbildung 28b).
Abbildung 28: (a) Metall-Halogen-Austausch und der von Wittig dafür vorgeschlagene Metathese-Mechanismus. (b)
Verwendung von zwei Äquivalenten tBuLi zur restlosen Entfernung des gebildeten
tBuBr aus dem Reaktionsgemisch.
Die Carbolithiierung von C-C-Mehrfachbindungen funktioniert besonders bei elektronenarmen
Alkenen und Alkinen, z.B. solchen mit Phenylgruppen wie Styrol-Derivaten, und konjugierten Dienen.
Dies impliziert einen nukleophilen Additionsmechanismus und tatsächlich wirkt der Zusatz von
mehrzähnigen Donorliganden wie tmeda aufgrund der so erhöhten Nukleophilie des Carbanions auf
die Reaktion beschleunigend. Als Produkte erhält man erhält entsprechend verlängerte Lithium-
Organyle, im Fall der Alkine handelt es sich um substituierte Vinyllithium-Derivate (Abbildung 29).*
Abbildung 29: Carbolithiierung von (a) Alkenen (enantioselektiv mit (−)-Spartein) und (b) konjugierten Dienen. (c) Anionische
Polymerisation von Isopren zu Synthesekautschuk.
Durch Verwendung chiraler Hilfsbasen (z.B. Spartein) kann auch die Carbolithiierung auf
enantioselektive Weise durchgeführt werden.34
Ausgehend von konjugierten Dienen werden durch
Carbolithiierung über Allyllithiumderivate interne Alkene (1,2-disubsituierte C=C-Bindung)
zugänglich.35
Formal findet bei der Reaktion von 1,3-Dienen eine 1,4-Addition statt, was sich z.B. an
der Regioselektivität bei der Produktion von Synthesekautschuk durch anionische Polymerisation von
Isopren festmachen lässt.
Neben den genannten Reaktivitäten, die zur Erzeugung von anderen Lithium-Organylen dienen,
werden Organolithium-Verbindungen vor allem für einfache Additionsreaktion an heteronukleare
Mehrfachbindungen eingesetzt, insbesondere in Carbonyl-Verbindungen (Erzeugung von Alkoholen),
Iminen (Erzeugung von Aminen), Nitrile (Erzeugung von Iminen). Den Synthesemöglichkeiten sind
hier praktisch keine Grenzen gesetzt. Der präparative Wert der Carbolithiierung liegt vor allem auch in
der Möglichkeit zur weiteren Funktionalisierung nach erfolgter Reaktion durch Umsetzung mit
geeigneten Elektrophilen.
Der Strukturchemie der Lithium-organischen Verbindungen kommt eine große Bedeutung für die
Reaktivität zu. Ihr Assoziationsgrad in Lösung, d.h. die Zahl der Moleküle, die in Lösung durch
ionische Wechselwirkungen zu einem clusterähnlichen Oligomeren assoziiert sind, hängt sehr stark
von der Wahl des Lösungsmittels sowie der Anwesenheit etwaiger Hilfsbasen ab. In apolaren
* Terminale Alkine sind für die Carbolithiierung nicht geeignet, da das alkinische Proton so acide ist, dass bevorzugt eine
Deprotonierung zu Alkinyllithium-Verbindungen stattfindet. Die Dreifachbindung des Alkinyllithium-Derivats ist für die Carbolithiierung wegen ihres Elektronenreichtums deaktiviert.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
29 © 2011 David Scheschkewitz
Lösungsmitteln, wie z.B. Kohlenwasserstoffen, werden regelmäßig Oligomere mit einem
Assoziationsgrad > 2 gebildet. So kristallisiert nBuLi aus Kohlenwasserstoffen als Hexamer, MeLi als
Tetramer. Die Struktur von MeLi kann als verzerrter Würfel verstanden werden, ein sog.
Heterocuban (Abbildung 30a).
nBuLi kristallisiert je nach Lösungsmittel als Dimer mit einer Li2-verbrückten Struktur (tmeda),
36
Tetramer mit MeLi-analogen Heterocuban-Struktur oder Hexamer mit einem durch n-Butylgruppen
sechsfach überkapptem trigonal-antiprismatisch verzerrtem Oktaeder (Abbildung 30b).37
Als
Faustregel gilt: je höher die Polarität des Lösungsmittels und der sterische Anspruch der organischen
Gruppe, desto geringer der Assoziationsgrad, desto höher die Nukleophilie des Lithiumorganyls.
Die Natur der Li-C-Bindung wie auch evtl. Wechselwirkungen zwischen Lithiumatomen in den
oligomeren Clustern ist nachwievor Gegenstand von Diskussionen. Es erscheint aber klar, dass die
Li-C-Bindung überwiegend ionischer Natur ist, wenn auch signifikante kovalente Anteile (bis zu 30%)
eine Rolle spielen dürften. Bezüglich der Li-Li-Wechselwirkungen herrscht Uneinigkeit, ob der
Zusammenhalt durch rein elektrostatische Anziehung zwischen Anion und Kation bewirkt wird, oder
ob direkte bindende Interaktionen vorhanden sind. Die Fragen sind insofern miteinander verknüpft,
als dass ein höherer kovalenter Anteil in der Li-C-Bindung die Besetzung von Orbitalen am Li
impliziert, die dann naturgemäß in die Lage versetzt würden, clusterartige Bindungen zu unterhalten.
(a)
(b)
Abbildung 30: (a) Struktur des Methyllithium-Tetramers und (b) des nBuLi-Hexamers im Festkörper (nur die -
kohlenstoffatome sind dargestellt), aus Kohlenwasserstoffen kristallisiert.
Die Reaktivität der Lithium-organischen Verbindungen hängt also sehr stark von der Polarität des
Lösemittels ab, gleichzeitig - wie schon Ziegler erkannte - verringert sich auch die Stabilität und
Lagerfähigkeit von Lösungen der Reagentien. In diesem Zusammenhang gilt es einen geeigneten
Kompromiss bezüglich Nukleophilie, Basizität und Reduktionspotential der Lithium-Organyle zu
finden: Besonders in apolaren Lösemitteln muss man die Möglichkeit von
Elektronentransferprozessen - also Redoxchemie - in Konkurrenz zur eigentlich erwünschten
nukleophilen Substitution oder Addition mit berücksichtigen. Ein anderer wichtiger Zersetzungspfad
von Lithium-organischen Verbindungen ist die sogenannte -Hydrid-Eliminierung unter Fällung von
festem Lithiumhydrid und Bildung eines Alkens. Hydride sind keine ausgesprochen guten
Abgangsgruppen, so dass diese Reaktionen üblicherweise langsam verlaufen.
Es gibt inzwischen aber auch eine umfangreiche Chemie funktionalisierter Lithium-Organyle. Wir
beschränken uns hier auf -funktionalisierte Derivate, und zwar genauer auf die sogenannten
Carbenoide. In Carbenoiden trägt das anionische Kohlenstoffzentrum neben dem Lithium-Atom eine
gute Abgangsgruppe wie z.B. ein Halogen. Dieses Gebiet wurde pionierartig von Köbrich in den
1960er Jahren bearbeitet.38
Köbrich gelang die Synthese von Carbenoiden durch Deprotonierung von
z.B. Dichlormethan bei −140°C unter Verwendung eines speziellen Lösemittel-Gemisches mit sehr
niedrigem Schmelzpunkt, der sog. Trapp-Mischung (üblicherweise Et2O, thf und Pentan in variablen
Verhältnissen). Erst in den 1990er Jahren wurden die ersten Kristallstrukturanalysen von Chlor-
Carbenoiden durch Boche und Mitarbeitern vorgelegt.39
Die Chemie der Erdalkalimetall-Organyle wurde bis vor wenigen Jahren fast ausschließlich von den
Grignard-Verbindungen dominiert. Dies ist nicht mehr uneingeschränkt der Fall, wie in der AC06-
Vorlesung im Masterstudiengang gezeigt werden wird. Dennoch machen Ihre leichte präparative
Zugänglichkeit die Grignard-Verbindungen zu bevorzugten Übertragungsreagentien für organische

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
30 © 2011 David Scheschkewitz
Gruppen in der präparativen Chemie. Ihre Darstellung gelingt bequem durch die Direktsynthese aus
geeigneten organischen Halogeniden und elementarem Magnesium, in der Regel in Donor-
Lösemitteln wie Tetrahydrofuran oder Diethylether (Abbildung 31). In Lösung herrscht ein
kompliziertes Gleichgewicht, das erstmalig von W. Schlenk postuliert wurde und daher unter dem
Namen Schlenk-Gleichgewicht Eingang in die Literatur gefunden hat. In diesem Gleichgewicht führt
ein stetiger Austausch von Liganden am Magnesium-Zentralatom zum Vorliegen verschiedener
dimerer Spezies. In diesem Dimeren nehmen die Halogenid-Liganden bevorzugt verbrückende
Positionen ein, aber selbst Alkylgruppen finden sich in den Brücken wieder, wodurch deren
Wanderung von einem Magnesiumzentrum zum anderen zwanglos erklärt werden kann. Die
Diorganylverbindungen können durch Fällung von MgBr2 aus dem Gleichgewicht durch Zusatz von
1,4-Dioxan in reiner Form isoliert werden.
Abbildung 31: Schlenk-Gleichgewicht in Donor-Lösemittel L (L = thf, Et2O; R = Alkyl, Aryl; X = Cl, Br, I).
Bei Vorliegen sehr acider CH-Bindungen können auch Grignard-Verbindungen durch Deprotonierung
erzeugt werden, z.B. werden terminale Alkine in der Regel glatt von EtMgBr deprotoniert, das
seinerseits sehr leicht aus EtBr und Mg-Spänen in Tetrahydrofuran erhalten wird. Eine weitere, eher
spezielle Methode zur Darstellung von Magnesium-Organylen ist die Umsetzung der entsprechenden
Lithium-Verbindung mit frisch hergestelltem MgBr2 im Sinne einer Transmetallierung. Das MgBr2 wird
dabei durch Umsetzung von metallischem Magnesium mit 1,2-Dibromethan in Diethylether
gewonnen, da käufliches MgBr2 mit den gängigen Methoden wie Erhitzen im Hochvakuum kaum
genügend gründlich zu trocknen ist.
Die Reaktivität von Grignard-Verbindungen ähnelt jener der entsprechenden Lithium-Organyle (vgl.
Schrägbeziehung im PSE). Allerdings ist das Reduktionspotential der Magnesiumderivate niedriger
als bei Lithium-Verbindungen, so dass die Redoxchemie hier eine geringere Rolle spielt. Während
Lithium-Verbindungen aufgrund ihrer sehr raschen Oxidation an Luftsauerstoff stets unter einer
Schutzgasatmosphäre gehandhabt werden müssen, sind Lösungen von Grignard-Verbindungen in thf
oder Et2O bei Ausschluss von Luftfeuchtigkeit (z.B. CaCl2-Trockenrohr) in der Regel für den Einsatz
in der Synthese ausreichend stabil.*
* Natürlich reagieren auch Mg-Organyle über längere Zeiträume mit Sauerstoff, dennoch genügt die Verringerung des O2-
Partialdrucks durch den Eigendampfdruck des Lösungsmittels, um die Reaktion gegenüber der präparativ erwünschten hinreichend zu verlangsamen.
Übungsaufgaben Seminarteil
1) Welche Produkte erwarten Sie bei der Umsetzung von nBuLi mit -Diketonen?
2) Machen Sie einen plausiblen Strukturvorschlag für aus Diethylether kristallisiertem 2,4,6-
Trimethoxyphenyllithium. Begründen Sie Ihren Vorschlag. Wie würden Sie die
Verbindung herstellen?
3) Spekulieren Sie, welche Reaktionen Mesityllithium beim Erhitzen in Tetrahydrofuran
eingeht. Begründen Sie einzelne Reaktionschritte.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
31 © 2011 David Scheschkewitz
3.2 Gruppe 13
In der Borgruppe wird auch die metallorganische Chemie vom intrinsischen Elektronenmangel der
dort befindlichen Elemente bestimmt. Auch in der Gruppe 13 ist die metallorganische Chemie eines
Elements bei weitem am besten entwickelt. Bortrihalogenide und eine Reihe donorstabilisierter
Borane wie H3B·SMe2 sind als Einstiegspunkte in die bororganische Chemie kommerziell erhältlich
oder leicht zugänglich. Waren die organische Verbindungen des Bors zunächst hauptsächlich als
nicht isolierte Zwischenprodukte in der organischen Synthesechemie von Bedeutung, so gibt es heute
eine Vielzahl von Anwendungen stabiler borhaltiger organischer Verbindungen vom Polymer über
Elektrolyte zu Kreuzkupplungsreagentien (Suzuki-Kupplung) und Lewis-sauren (Co-)Katalysatoren.
Nachwievor ist die Hydroborierung eine der wichtigsten Darstellungsmethoden für Organobor-
Verbindungen. Bereits in den 1940er Jahren hatte man beobachtet, dass Diborane(6) in reiner Form
langsam mit Styrol und anderen Alkenen reagiert.40
H. C. Brown fand, dass katalytische Mengen an
Donorlösungsmitteln die Reaktion dramatisch beschleunigen und machte die Methode populär, indem
er die bereits erwähnte einfache Darstellungsmethode für Diboran(6) aus BF3·Etherat und NaBH4
entwickelte. Brown bekam 1979 zusammen mit Georg Wittig den Nobelpreis für Chemie verliehen. In
seinem Nobelvortrag schildert auf eloquente Weise die Rolle des Militärs (insbesondere im
Zusammenhang mit dem Manhattan-Projekt) bei den wie so oft zufälligen Entwicklungen, die zur
systematischen Erforschung der Hydroborierungsreaktion führten.41
Aufgrund der positiven Partialladung am Bor-Atom
verläuft die Addition von Boranen an die C-C-
Mehrfachbindung nach Anti-Markovnikov, d.h. die Boryl-
Gruppe ist an das geringer substituierte Kohlenstoffatom
gebunden.* Bei Verwendung von BH3 (in Form von B2H6
oder Donor-stabilisiert) als Hydroborierungsreagenz ist es
häufig nicht möglich, die Reaktion auf der Stufe der BH2-
Verbindung anzuhalten. Sterisch anspruchsvoll
substituierte Borane lösen nicht nur dieses Problem, sondern erhöhen zudem die Selektivität der anti-
Markovnikov-Addition. Ein besonders populäres Boran ist z.B. 9-BBN (9-Borabicyclo[3.3.1]nonan),
dass auf einfache Weise durch Umsetzung von 1,5-Cyclooctadien mit BH3 erzeugt wird (Abbildung
32). Chirale Borane erlauben eine enantioselektive Reaktionsführung.
In der organischen Synthese werden die Organylborane wegen ihrer Empfindlichkeit gegenüber Luft
und Wasser in den seltensten Fällen isoliert. In einer Eintopfreaktion werden sie direkt in die
entsprechenden Derivate überführt; die meisten dieser Derivatisierungen verläuft bei optisch aktiven
Verbindungen unter Retention der Konfiguration mit guten bis ausgezeichneten
Enantiomerenüberschüssen (Abbildung 33). Zum Einen werden die Primärprodukte der
Hydroborierung so in Alkohole oder Carbonsäuren†
überführt, zum anderen erlauben sie die
Reduktion von Alkenen zu Alkanen unter milden Bedingungen sowie deren reduktive Kupplung. Mit
Chloraminen lassen sich Boryl-Gruppen gegen unterschiedlich substituierte Aminogruppen
austauschen.
* Zur Erinnerung: Halogenwasserstoffe, HX, addieren nach Markovnikov mit umgekehrter Regioselektivität. Dies ist auf die
Polarisierung des Alkens durch den +I-Effekt der Alkylgruppen zurückzuführen bzw. auf die Stabilisierung des Intermediats. † Dies ist natürlich im Prinzip nur eine Durchoxidation des ansonsten entstehenden primären Alkohols mithilfe des stark
oxidierenden Chromats.
Abbildung 32: Darstellung von 9-Borabicyclo[3.3.1]nonan.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
32 © 2011 David Scheschkewitz
Abbildung 33: Hydroborierung und Folgereaktionen mit den erhaltenen Alkylboranen nach Brown.
Die Hydroborierung von Alkinen verläuft sinngemäß und soll hier nicht näher besprochen werden. Es
sei allerdings auf die zusätzliche Schwierigkeit einer doppelten Hydroborierung der C-C-
Dreifachbindung hingewiesen.
Neben der Hydroborierung werden Organylborane auch mit Vorteil aus Halogen- oder Alkoxyboranen
dargestellt. Als besonders gut geeignet erweist sich, neben den gasförmigen Bortrihalogeniden, das
Diethyletherat des Bortrifluorids, welches in reiner Form einer farblosen, bei 100°C siedenden
Flüssigkeit darstellt. Je nach organischem Rest werden die Substituenten über Lithium- oder
Magnesiumorganyle eingeführt (Abbildung 34a). Hierbei sind mögliche Selektivitätsprobleme
bezüglich der Mono-, Di- und Trisubstitution zu berücksichtigen. Der Einsatz von Trimethoxyboran als
Elektrophil kann bisweilen Abhilfe schaffen, da der Methoxy-Substituent eine schlechter
Abgangsgruppe darstellt und mithin das intermediär auftretende Alkylborat gegenüber der
Eliminierung von Lithium-Methanolat eine gewisse Stabilität aufweist und so die Zweitsubstitution
unterdrückt wird. Zur Zersetzung des Borats kann dann z.B. mit Me3SiCl erfolgen, es reicht mitunter
aber auch die Verwendung von zwei Äquivalenten B(OMe)3 (Abbildung 34b).
Abbildung 34: Alkylborane durch Salzmetathese aus Lithium- und Magnesiumorganylen und Bortrihalogenide oder
Trimethoxyboran.
Grundsätzlich ist im Laboratoriumsmaßstab die Salzmetathese mit Lithium- und Magnesiumorganylen
auch geeignet, die entsprechenden Aluminiumorganyle darzustellen. In der Praxis findet sie aber nur
für exotischere Aluminiumverbindungen mit sperrigen organischen Resten Anwendung, da viele
kleinere Aluminiumorganyle aufgrund ihrer Bedeutung in zahlreichen industriellen Verfahren (z.B.
Ziegler-Natta-Polymerisation von Alkenen) kommerziell erhältlich sind.
Triethylaluminium, AlEt3, wird großtechnisch nach dem Zieglerschen Direktverfahren dargestellt
(Abbildung 35). Hierbei wird metallisches Aluminiumpulver mit Wasserstoff und einem terminalen
Alken (häufig Isobuten) direkt zu Trialkylaluminium umgesetzt.* Das Verfahren basiert auf der
mehrfachen, reversiblen Hydroaluminierung des Alkens. Durch Verwendung eines höheren
* Die Reaktion funktioniert bemerkenswerterweise nur in Gegenwart des eigentlichen Produkts, des Trialkylaluminiums.
Insofern kann man sie als autokatalytische Reaktion auffassen.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
33 © 2011 David Scheschkewitz
Wasserstoffanteils sind mit dem Direktverfahren auch Dialkylaluminiumhydride zugänglich (z.B. iBuAlH, DIBAL). Da die Stabilität der Trialkylaluminane mit zunehmender Zahl der Verzweigungen in
-Stellung zum Aluminiumzentrum abnimmt (vermutlich sterische Gründe), können ausgehend von
Triisobutylaluminium und terminalen Alkenen eine Vielzahl von Derivaten dargestellt werden.
Mechanistisch läuft dabei eine mehrfache Dehydroaluminierung unter Freisetzung von Isobuten mit
anschließender Hydroaluminierung des vorgelegten terminalen Alkens ab.*
Abbildung 35: Das Direktverfahren zur R3Al-Darstellung nach Ziegler.
Im Gegensatz zu Direktverfahren beruht die Aufbau-Reaktion nach Ziegler, bei der
Triethylaluminium mit ca. 100 bar Ethen bei moderaten Temperaturen von ca. 100°C umgesetzt wird,
nicht auf der Hydroaluminierung sondern auf der konzeptionell verwandten Carboaluminierung, also
der Insertion von Ethen in die Al-C-Bindung (Abbildung 36).† Hierbei wird die C2H4-Einheit wiederholt
in die Al-C-Bindung insertiert, so dass im Endeffekt geradzahlige an das Aluminiumzentrum
gebundene Alkylreste entstehen. Nach Oxidation mit Luftsauerstoff und Hydrolyse erhält man primäre
Alkohole, die als Ausgangsmaterial für biologisch abbaubare Tenside verwendet werden.
Abbildung 36: Die Aufbaureaktion zur Darstellung langkettiger terminaler Olefine bzw. primärer Alkohole nach Ziegler.
Im Vergleich zu jenen der Hydroborierung ist die systematische Untersuchung der primären
metallorganischen Reaktionsprodukte der Hydroaluminierung und der Hydrogallierung ein
ausgesprochen junges Forschungsgebiet. Zwar sind diese Reaktionen als solche in der organischen
Synthese seit langem bekannt, nur schloss man aus der Ähnlichkeit der Folgeprodukte nach
wässriger Aufarbeitung, dass sie nach ähnlichem Muster und mit ähnlichen Zwischenprodukten
verlaufen würde wie die Hydroborierung. Dies trifft im Fall der Alkylaluminane, d.h. den Produkten der
Hydroaluminierung der C-C-Doppelbindungen von Alkenen, in den meisten Fällen zu. Die Reaktionen
sind allerdings unkatalysiert bei Raumtemperatur oft so langsam, dass für praktische Anwendungen
auf hohe Drücke oder Temperaturen zurückgegriffen werden muss (siehe Aufbaureaktion und
Direktverfahren).42
Im Gegensatz zu Trialkylboranen zeigen Trialkylaluminane mit hinreichend kleinen Resten eine
dimere Struktur, in der die beiden Aluminiumatome mit zwei Alkylresten in der Art eines Diborans(6)
verbrückt sind. Offensichtlich ist ein solches Arrangement der einfachen Stabilisierung durch induktive
Effekte überlegen, falls um das Elektronenmangelzentrum genügend Platz vorhanden ist.
* Trimethylaluminium kann aus naheliegenden Gründen nicht nach diesem Verfahren dargestellt werden. Man bedient sich
stattdessen der Umsetzung von MeCl mit Aluminium zum sogenannten Sesquichlorid, Me3Al2Cl3, das anschließend durch Reduktion mit Natrium in AlMe3 überführt wird. Durch partielle Hydrolyse mit substöchiometrischen Mengen an Wasser erhält man aus AlMe3 das sogenannte Methylaluminoxan (MAO), eine schlecht definierte Al-O-Clusterverbindung, die noch unhydrolysierte Al-Me-Einheiten enthält. MAO spielt eine wichtige Rolle als Co-Katalysator der Ziegler-Natta-Polymerisation.
† Die Aufbaureaktion ist heute praktisch vollständig durch Olefinmetathese-Verfahren verdrängt (z.B. Shell Higher Olefine
Process - SHOP)

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
34 © 2011 David Scheschkewitz
Im Gegensatz zu den Alkenen reagieren elektronenarme Alkine in der Regel bereits bei
Raumtemperatur und darunter. Sorgfältige präparative Untersuchungen durch Uhl und Mitarbeiter aus
jüngster Zeit, dass im Fall des Aluminiums clusterartige Verbindungen eine Rolle spielen können, die
in ihrer Struktur an Boran- oder Carboran-Cluster erinnern.43
Zwar liefert die Reaktion von
Phenylacetylen mit Dimethylaluminiumhydrid bei Raumtemperatur zunächst nur ein klassisches*
Aluminylalkin (oder auch Aluminium-Alkinid), da dessen Reaktivität durch den elektropositiven
Aluminyl-Substituenten abgesenkt wird, aber längeres Erhitzen mit einem geeigneten Überschuss an
Me2AlH führt zu Bildung verschiedener Carbalane, von denen eines beispielhaft in Abbildung 37
gezeigt ist.
Abbildung 37: Produkte der Reaktion von Phenylacetylen mit Dimethylaluminiumhydrid unter verschiedenen
Reaktionsbedingungen.
In jüngerer Zeit wächst das Interesse für niedervalente Derivate der Gruppe 13, die durch
raumerfüllende Substituenten stabilisiert sind. Im Fall des Bors beruht diese Chemie vor allem auf
Verbindungen der formalen Oxidationsstufe +II. Diese Diborane(4) werden zum einen durch die
bereits geschilderte Hochtemperatursynthese erhalten, zum anderen mit apparativ weniger
aufwendigen Mitteln durch Reduktion von (Me2N)2BCl mit metallischem Natrium. (Me2N)2BCl wird
durch Umsetzen von Bortrichlorid mit vier Äquivalenten Me2NH dargestellt wird.
Tetrakis(dimethylamino)diboran(4) ist eine praktisch luftstabile farblose Flüssigkeit. Sie kann mit
MeOH und etherischer HCl-Lösung in das entsprechende Methoxy-Derivat überführt werden. Ähnlich
wie Trimethoxyboran ist Tetramethoxydiboran(4) hinreichend elektrophil, um mit sterisch
anspruchsvollen Lithium- oder Magnesiumorganylen zu mehr oder weniger stabilen organischen
Derivaten umgesetzt zu werden.
Abbildung 38: Darstellungssequenz von Tetramethoxydiboran(4).
Zahlreiche Diborane(4) sind bekannt und werden in der organischen Synthese für Diborierungen von
Alkenen und Alkinen eingesetzt.44
Hartwig und Mitarbeiter berichteten zudem über die Aktivierung von
CH-Bindungen in simplen Alkanen durch Pinakol-substituierte Diborane(4) in Gegenwart von Iridium
oder Rhodium-Katalysatoren.45
Hierbei wird eine selektive Aktivierung einer terminalen CH-Bindung
unter gleichzeitiger Bildung des Borans, (RO)2BH, beobachtet. Die hohe Reaktivität von Diboranen(4)
beruht auf dem energetisch tiefliegenden LUMO dieser Verbindungen, das -bindenden Charakter
zwischen den beiden Boratomen hat. Dies führt auch dazu, dass alle Diborane(4) leicht zu
Radikalmonoanionen oder gar Dianionen reduzierbar sind.46
Aluminium, Gallium und Indium zeigen, wie bereits diskutiert, eine zunehmende Präferenz für die
Oxidationsstufe +I. Ästhetisch besonders ansprechend sind die tetraedrischen Derivate, die von Uhl
und Mitarbeitern dargestellt wurden (Abbildung 39).47
Während die Gallium-Verbindung in Lösung in
einem konzentrationsabhängigen Gleichgewicht in das monomere Ga(I)R dissoziiert, bleiben sowohl
der In4, als auch der Al4-Tetraeder überraschenderweise nach kryoskopischen
Molmassenbestimmungen in Lösung auch nach Verdünnung erhalten. Alle E(I)-Tetraeder reagieren
leicht mit elementaren Chalkogenen oder Chalkogen-Donoren zu den entsprechenden
* Der Begriff “klassisch“ meint in diesem Zusammenhang, dass nur elektronenpräzise Bindungen vorliegen, also keine
2-Elektronen-Mehrzentrenbindungen.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
35 © 2011 David Scheschkewitz
Heterokubanen, wobei in jede E-E-Bindung ein Chalkogen-Atom insertiert. Die Heterocubane sind ein
gutes Beispiel für stets wiederkehrende Strukturmotive in der Chemie der Hauptgruppenelemente.
Man vergleiche z.B. mit der Struktur des tetrameren MeLi oder auch mit der Oxidation des P4-
Tetraeders in weißem Phosphor zu P4O6 bzw. P4O10 (dort jedoch Kanten- statt
Flächenüberbrückung).
Abbildung 39: Darstellung der Gruppe 13(I)-Tetraeder sowie ihre Umsetzung mit Chalkogenen oder Chalkogen-Donoren zu
den entsprechenden Heterocubanen (R = C(SiMe)3).
Das entsprechende Thallium(I)-Tetramer zeigt interessanterweise keine regulär tetraedrische
Struktur, sondern ist in der Art verzerrt, dass die organischen Reste deutlich vom Schwerpunkt des
Tetraeders in der Art eines dreidimensionalen „Schaufelrads“ abgewinkelt sind.48
Hierin kommt die
immer geringer werdende Hybridisierungsneigung beim Gang die Gruppe hinab zum Ausdruck, d.h.
das freie Elektronenpaar am Thallium-Zentrum bleibt stereoaktiv.
3.3 Gruppe 14 und 15
Die Metallorganik der beiden Gruppen 14 und 15 weist aufgrund der Schrägbeziehungen im
Periodensystem einige Parallelen auf. Zwar ist aufgrund der Stellung im Periodensystem Silicium das
Element, das man für den Vergleich mit Kohlenstoff gefühlsmäßig als erstes heranziehen würde; nicht
umsonst aber wurde Phosphor als die eigentliche Kohlenstoff-Kopie bezeichnet, da die
Elektronegativitäten dieser beiden Elemente ähnlichere Werte aufweisen.* Neben der äußerst
vielfältigen elementorganischen Chemie des regulär tri-, tetra- oder pentakoordinierten Phosphors,
lässt sich in vielen (teils mehrfach) ungesättigten Strukturmotiven aus der klassischen Organischen
Chemie Kohlenstoff formal durch Phosphor substituieren (Abbildung 40).
* Ein Klassiker bereits nach wenigen Jahren ist das Buch von Dillon, Mathey und Nixon geworden: Phosphorus - The Carbon
Copy, Wiley VCH, Weinheim 1998.
Übungsaufgaben Seminarteil
1) Was für ein Produkt erwarten Sie für die doppelte Hydroborierung des Alkins HC≡CMe in
Abwesenheit eines Katalysators und warum? Wie verhält es sich wohl bei der
metallkatalysierten Diborierung des gleichen Alkins?
2) Durch vollständige Reduktion des Diborans(4), Mes2B-B(Mes)Ph, mit Lithium wird eine
dem Ethen isoelektronische Verbindung erhalten. Welche B-B-Bindungslänge erwarten
Sie für das Produkt im Vergleich zum neutralen Diboran? Begründen Sie Ihre Aussage.
3) Die Heterokubane, die durch Umsetzung der tetraedrischen Element(I)-Organyle der
Gruppe 13 mit Chalkogendonoren entstehen, können ebenfalls als Tetramere aufgefasst
werden. Schlagen Sie vor wie man die entsprechenden Monomere stabilisieren könnte.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
36 © 2011 David Scheschkewitz
Abbildung 40: Beispiele ungesättigter organischer Verbindungsklassen und ihre Phosphoranaloga.
Allerdings bedarf die Darstellung dieser Phosphoranaloga oft gänzlich verschiedener synthetischer
Protokolle und es gilt naturgemäß stets die um eins höhere Zahl der Valenzelektronen des Phosphors
zu berücksichtigen. Insbesondere müssen bei den niedervalenten Vertretern, die koordinativ
ungesättigten Phosphoratome kinetisch durch sterisch anspruchsvolle Substitution oder
thermodynamisch z.B. durch Koordination an ein Übergangsmetallzentrum stabilisiert werden. Die
Synthese eines stabilen Diphosphens (R = Mes* = 2,4,6-tBu3C6H2) durch Yoshifuji et al. trug Anfang
der 1980er zur Widerlegung der sog. Doppelbindungsregel bei.49
Diese empirische Regel besagte,
dass Elemente ab der 3. Periode (der 2. Langperiode) nur äußerst instabile Mehrfachbindungen
auszubilden in der Lage seien.
Trotz der unzweifelhaft vielfältigen Verwendung von Organophosphor-Verbindungen
(Pflanzenschutzmittel, Photosensitizer, Brandschutzmittel, Vorstufen für Halbleiter etc.) verzichten wir
wegen der Vielzahl der bekannten Synthesen auf eine umfassende Besprechung ihrer Chemie an
dieser Stelle: Oft wird auf Variationen der Wurtz-Kupplung (z.B. PhBr und PCl3 mit Natrium ergibt
PPh3) oder der Addition von PH3 an C-C-Mehrfachbindungen zurückgegriffen (z.B. tBuPH2 durch
säurekatalysierte Addition an Isobuten; Anti-Markovnikov; Abbildung 41a). Auch Direktsynthesen aus
weißem oder rotem Phosphor finden Anwendung. Beispielhaft seien die Umsetzungen von weißem
Phosphor mit PhLi zur Darstellung von Phenylphosphan (Abbildung 41b), sowie die Arylierung von
rotem Phosphor unter Friedel-Crafts-Bedingungen mit Phenyliodid genannt (Abbildung 41c).
Abbildung 41: Einige Darstellungsmethoden von Phosphororganylen: (a) Sauer-katalysierte (Markovnikov)50
und radikalische
Addition (anti-Markovnikov) von PH3 an Isobuten.51
(b) Darstellung von Phenylphosphan durch Addition von PhLi an weißen
Phosphor und anschließender Hydrolyse.52
(c) Durch Lewis-Säure katalysierte erschöpfenden Arylierung von rotem Phosphor
durch Phenyliodid.53
Als Pionier auf dem Gebiet der metallorganischen Chemie des Siliciums gilt Frederick Stanley
Kipping. Er war bereits Anfang des 20. Jahrhunderts daran interessiert Parallelen zwischen
Organischer Chemie und der Chemie des Siliciums aufzuzeigen. Unter anderem bemühte er sich,
Analoga des Ethylens („Silico-Ethylen“; heute: Disilen) darzustellen. Seine irrtümliche Kurznachricht
über die Darstellung von Disilenen54
wurde später von ihm selbst korrigiert und die Produkte der
Reduktion von Dichlorsilanen spekulativ als Cyclotetrasilan und eine nicht näher bestimmte isomere
Verbindung identifiziert.55
Erst drei Jahrzehnte später war es dann Gilman vorbehalten, das
Kippingsche Produkgemisch korrekt als verschiedene cyclische Oligomere (SiPh2)n (n = 4 bis 6) und

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
37 © 2011 David Scheschkewitz
Polysilan zu charakterisieren.56
Kippings Erfolglosigkeit bei der Darstellung von Disilenen war Teil der
empirischen Grundlage der Doppelbindungsregel. Polysilane sind in letzter Zeit aufgrund ihrer
elektronischen Eigenschaften erneut in den Blickpunkt gerückt.57
Abbildung 42: Frederik S. Kipping (links) und die Schwierigkeiten bei der Analyse der Zusammensetzung des
Produktgemisches der Reduktion von Diphenyldichlorsilan.
Einer ähnlichen Fehlinterpretation* unterlag Paul Ehrlich für das Salvarsan, einem Medikament zur
Behandlung der Syphilis, der eine As=As-Doppelbindung als zentrales Strukturelement dieser durch
Reduktion der entsprechenden Dichlorarsonsäure erhaltenen Verbindung vorschlug. Obwohl man
sehr schnell übereinkam, dass die wahre Struktur wohl ringförmige Oligoarsane verschiedener Größe
enthalten müsse, dauerte es bis vor wenigen Jahren bis dies durch Elektrospray-
Massenspektrometrie zweifelsfrei bestätigt wurde.58
Einen weiteren Meilenstein stellen Kippings Versuche zur Erzeugung von Silico-Ketonen dar, für die
er den Begriff Silikone prägte. Durch Eliminierung von Wasser aus Silandiolen (vor allem Ph2Si(OH)2)
sollten Verbindungen mit Si=O-Doppelbindung erzeugt werden. Kipping erkannte bereits, dass diese
„Silikone“ vermutlich oligomerer oder polymerer Natur seien, aber ignorierte ihr hohes
Anwendungspotential zur Kunststofferzeugung.
Die von Kipping verwendeten Organosiliciumverbindungen wurden mit größter Wahrscheinlichkeit
über die von Grignard kurz zuvor beschriebenen Magnesiumorganyle dargestellt,† eine in damaliger
Zeit präparative Komplikation, der das intensivere Studium insbesondere der Silikone zusätzlich zum
Mangel an analytischen Methoden behinderte. Heutzutage sind die Silikone, die bei Weitem
verbreiteteste Klasse anorganischer Polymere. Sie bestehen aus Siloxanbindungen (Si-O-Si), die im
Vergleich zur Ether-Bindung häufig in Richtung Linearität aufgeweitet sind (-Rückbindung in *-
Orbitale) und zudem eine hohe konformative Flexibilität aufweisen. Polysiloxane sind je nach
verwendeten Monomeren linear oder verzweigt, was eine weitgehende Steuerung der
Produkteigenschaften erlaubt. Sie werden folglich in allen Bereichen des täglichen Lebens eingesetzt
(als Zusätze für Farben, Lacke, Pflegeprodukte, Nahrungsmittel oder als Reinstoffe in der Form von
Ölen und Kunststoffen für Dichtmassen, hitzebeständige Formen, medizinische und plastisch-
kosmetische Anwendungen etc.; Abbildung 43).
* Es sei darauf hingewiesen, dass derartige Fehlinterpretationen die Konstitution von Verbindungen betreffend wegen der
damals zur Verfügung stehenden vergleichsweise unbefriedigenden apparativen Möglichkeiten (praktisch keine Spektroskopie, Röntgenographie) keineswegs selten waren.
† Zu jener Zeit war das Zitierverhalten nach heutigem Standard unvollständig. Oft - wie auch in diesem Fall - wurden
Vorarbeiten weitgehend ignoriert und Hinweise zur Darstellung der Ausgangsmaterialien unterblieben häufig.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
38 © 2011 David Scheschkewitz
Abbildung 43: Einige Produkte in verschiedenen Fertigungsstadien auf der Basis von Polysiloxanen (von rechts nach links:
chemikalienresistente Schläuche, hochvernetztes Rohsilikonpolymer, chirurgische Implantate, Silikondichtmittel,
hitzebeständige Pinsel).
Schematisch kann die Darstellung von Polysiloxanen durch die Polykondensation von Silandiolen
verstanden werden. Hierbei wird formal ein Molekül Wasser pro Siloxan-Bindung eliminiert. Die von
Kipping erträumten Silico-Ketone spielen allerdings wohl nicht einmal als kurzlebige Intermediate eine
Rolle.* Tatsächlich greift bei der säurekatalysierten Variante das Sauerstoffatom einer Hydroxygruppe
intermolekular ein zweites durch Protonierung am Sauerstoff aktiviertes Silandiol nukleophil an. Die
anschließende Eliminierung von Wasser aus dem kurzlebigen Dimer mit pentakoordiniertem
Siliciumzentrum führt zur Ausbildung der Siloxanbindung (Abbildung 44). Die Polykondensation wird
ebenso durch Base katalysiert; hier dürfte die Deprotonierung einer Hydroxygruppe der einleitende
Schritt sein.
Abbildung 44: Mechanismus des ersten Schritts der Polykondensation von Silandiolen.
Die Variabilität von Polysiloxanen steht jener der organischen Polymere in nichts nach. Vielmehr
können Modifikationen auf erheblich gezieltere Weise erreicht werden, da 1.) für den
Kondensationsschritt verschiedenartigste Abgangsgruppen auf einfachste Weise eingeführt werden
können (Acetate sind recht beliebt) und 2.) ein theoretisch unbegrenzter Baukasten an vorgebildeten
Siloxan-Monomren für verschiedenste Verzweigungsgrade zur Verfügung steht. Die einfachsten
mononuklearen Bausteine werden üblicherweise nach dem Grad der Funktionalisierung als M, D, T
und Q-Einheiten abgekürzt (Abbildung 45).
Abbildung 45: Einfache mononukleare Polysiloxan-Monomere in der Form der Chloride und ihre gängige Bezeichnung in der
Siloxan-Chemie (R = Me, Ph).
Je nach Verwendung und Anteil der verschiedenen Monomere werden die Polymere bezeichnet. Ein
Polymer aus Monomeren in der Zusammensetzung M: 40%, T: 35%, Q: 25% heißt folglich MTQ-
Polysiloxan.
* Durch Einsatz verschiedener Stabilisierungsstrategien (sterisch, sowie Donor-Akzeptor-Stabilisierung) kennt man heute eine
Handvoll stabiler Derivate, die allerdings für Kondensationsreaktionen nur noch eingeschränkt geeignet sind. Für eine kurze Zusammenfassung aktueller Entwicklungen auf dem Gebiet der Si=E-Doppelbindung (E = Element der Gruppen 15 oder 16) siehe: D. Scheschkewitz, Angew. Chem. 2011, 123, 3174. http://dx.doi.org/10.1002/ange.201007688

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
39 © 2011 David Scheschkewitz
Wegen seiner Sonderstellung als Kettenfortpflanzungseinheit bei der Polysiloxandarstellung ist die
industriell bedeutendste metallorganische Verbindung des Siliciums das Dimethyldichlorsilan.
Heutzutage wird dieses wichtigste Ausgangsmaterial im Megajahrestonnen-Maßstab hergestellt.
Diese imposante Entwicklung seit Kippings Zeiten ist vor allem auf die Einführung des
Direktverfahrens nach Müller und Rochow zurückzuführen, bei dem Methylchlorid direkt mit
gepulvertem Silicium unter Beimengung katalytischer Mengen Kupfer im Wirbelschichtreaktor
umgesetzt wird.
Das Müller-Rochow-Verfahren ähnelt konzeptionell der Darstellung von Trichlorsilan und soll daher
nicht im Detail besprochen werden. Es sei nur erwähnt, dass auch in diesem Fall Silylene, d.h. Si(II)-
Verbindungen als Intermediate eine Rolle spielen dürften und daher ein relativ komplexes
Produktgemisch erzeugt wird. Es besteht hauptsächlich aus Me2SiCl2, sowie den anderen denkbaren
Methylchlormonosilanen, aber auch aus ökonomisch unerwünschten Di- und Oligosilanen. Die
Zusammensetzung des Produktgemisches hinsichtlich der Bedürfnisse der Silikonindustrie kann vor
allem durch Variation der Katalysatorzusammensetzung gesteuert werden.
Bezüglich seiner metallorganischen Verbindungen nimmt das Germanium insofern eine
Sonderstellung ein, als dass aufgrund des hohen Preises bisher praktisch keine Anwendungen
bekannt sind. Zudem sind die Eigenschaften der germaniumorganischen Verbindungen denen der
entsprechenden Siliciumderivate in vieler Hinsicht ähnlich, dass sich der preisliche Mehraufwand
auch für Nischenanwendungen nicht lohnt. Unterschiede gibt es insbesondere in der Stabilität der E-
E und E-C-Bindungen, die vom Kohlenstoff zum Blei hin kontinuierlich abnehmen. So werden z.B.
Alkylsilane von elementarem Chlor in der Peripherie chloriert, wohingegen analoge Alkylgermane
unter Spaltung der Ge-C-Bindung reagieren. Die Verwendung von Zinn- und vor allem Bleiorganylen
ist seit vielen Jahren wegen ihrer hohen Toxizität rückläufig. Tetraethylblei war jahrzehntelang die
meistproduzierte metallorganische Verbindung und fand bis zum Verbot in den 1990er Jahren als
Antiklopfmittel in Ottokraftstoffen Verwendung.
Alkylierte (und sogar teilweise vinylierte und phenylierte) Germanium, Arsen- und
Antimonverbindungen können in einer der Synthese von Dimethyldichlorsilan verwandten Methode
direkt aus den Elementen und organischen Halogeniden hergestellt werden.59
Die Methode versagt
allerdings bei den schwereren Elementen Zinn, Blei und Bismut, so dass diese in der Regel durch
verschiedenen Transmetallierungsreaktionen dargestellt werden.
Eine interessante Besonderheit bieten die Cyclopentadienyl-substituierten Derivate. Da alle
schwereren Hauptgruppenelementverbindungen aufgrund der energetisch relativ tiefliegenden *-
Orbitale einen gewissen Lewis-sauren Charakter haben, neigen Sie zur Ausbildung von Donor-
Akzeptorbindungen. Wie wir bereits gesehen haben, sind zur Isolierung solcher hyperkoordinierter
Verbindungen aber sehr elektronegative Substituenten erforderlich. Dennoch resultiert die
Zugänglichkeit der antibindenden Orbitale in einer mehr oder minder schnellen Wanderung der
schweren Elemente über den Cyclopentadienylrest, so dass die C-Atome auf der NMR-Zeitskala
äquivalent werden können. Die Reaktion verläuft nach dem in Abbildung 46 dargestellten
Mechanismus über eine Intermediat/Übergangszustand mit 2-gebundenem Cyclopentadienylrest und
wird als 1,2-metallatrope Verschiebung bezeichnet.60
Abbildung 46: (a) Vermutlicher Mechanismus der 1,2-metallatropen Verschiebung in elementorganischen Cyclopentadienyl-
Derivaten. (b) Jutzis Silicocen und die Abspaltung eines Pentamethylcyclopentadienyl-Restes durch Protonierung.
Die Erweiterung der Koordinationssphäre durch den Cyclopentadienylrest kann zur Darstellung
stabiler Si(II)-Derivate ausgenutzt werden, wie Jutzi und Mitarbeiter gezeigt haben (Abbildung 46b).

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
40 © 2011 David Scheschkewitz
Das stabile Decamethylsilicocene61
wird durch Einwirkung von Supersäuren in ein sehr
ungewöhnliches Si(II)-Kation überführt.62
In diesen Verbindungen sind aufgrund des inhärenten
Elektronenmangels der niedervalenten Siliciumverbindungen die Cp-Reste 5-gebunden.
4. Metallorganik der Nebengruppenelemente
Vor Alfred Werners Arbeiten zur Koordinationschemie von Übergansmetallen aus dem späten 19.
Jahrhundert gab es zahlreiche Bemühungen die Chemie der Übergangsmetalle mit der aus der
organischen Chemie bekannten Wertigkeit und damit konstanten oder multiplen Proportionen und
eine der Wertigkeit entsprechenden Zahl kovalenter Bindungen zu erklären. Nur sehr eingeschränkte
strukturchemische Informationen standen zur Verfügung, wodurch eine Reihe aus heutiger Sicht
bizarrer Vorschläge für den Aufbau z.B. oktaedrischer Ammoniakate der Übergangsmetalle gemacht
wurden.* Die Erkenntnisse von Werner über die dative Natur der Bindung von Liganden an das
Übergangsmetallzentrum lösten dieses Problem mit einem Schlag.
Es ist daher fast ein wenig ironisch, dass man in jüngster Zeit zu erkennen beginnt, dass die
Unterschiede zwischen Hauptgruppenelementen und Übergangsmetallen keineswegs so dramatisch
sind wie Werners Annahmen der Konstitutionstheorie zu implizieren scheinen. Der einzige qualitative
Unterschied liegt in der speziellen Natur der d-Orbitale mit einer zusätzlichen Knotenebene und den
damit verbundenen Folgen für die Symmetrie der betreffenden Fragmentorbitale. Ansonsten bewegen
sich die Unterschiede cum grano salis auf quantitativer Ebene (z.B. Höchstzahl der Liganden).
Gerade in der metallorganischen Chemie der Übergangsmetalle zeigt sich deutlich, dass sowohl die
gängigen Bindungsmodelle als auch die wichtigsten Elementarreaktionen konzeptionell mit jenen der
Hauptgruppenchemie eng verwandt sind. Wir werden uns also in diesem Kurs zunächst auf die
Nebengruppen-Carbonyle konzentrieren, und damit auf die Bindeglieder zwischen der klassischen
Komplexchemie und der Metallorganischen Chemie, die ja oft durch das Vorliegen einer M-C-Bindung
definiert wird.
4.1 Carbonyle der Nebengruppen
Die Chemie der Übergangsmetallcarbonyle geht auf den deutschen Chemiker Ludwig Mond zurück,
der 1890 die Synthese des ersten Metallcarbonyls [Ni(CO)4] entwickelte. Das Mond-Verfahren zur
Reinigung von Nickel nutzt die Bildung des leichtflüchtigen [Ni(CO)4] im Sinne einer Transportreaktion
aus. Dabei wird Nickel im Kohlenmonoxidstrom von kälteren in heißere Bereiche des Reaktors
transportiert und seine Reinheit sukzessive erhöht (Abbildung 47a). Allgemein erfolgt die Synthese
von Metallcarbonylen entweder aus dem Metall selbst im CO-Strom oder durch Reduktion von
* Vgl. Lutz Gade, Koordinationschemie für einen umfassenden historischen Überblick.
Übungsaufgaben Seminarteil
1) Schlagen Sie eine sinnvolle Synthese für Jutzis Decamethylsilicocen vor. Nach welchem
Reaktionsmechanismus verläuft wohl die Umsetzung dieser Verbindung mit einer
Supersäure?
2) Bei der Direktsynthese von Me2SiCl2 nach Müller-Rochow spielen Silylene, also Si(II)-
Verbindungen eine entscheidende Rolle. Entwickeln Sie einen Mechanismus, der sowohl
der Bildung des gewünschten Produktes, als auch von Disilanen Rechnung trägt.
3) Paul Ehrlich nahm fälschlich an, dass Salvarsan eine As-As-Doppelbindung aufweist.
Wie würden Sie heutzutage überprüfen, ob eine von Ihnen synthetisierte Verbindung
eine solche Bindung enthält?

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
41 © 2011 David Scheschkewitz
Metallsalzen in Gegenwart von CO. Mehrkernige Metallcarbonyle lassen sich z.B. durch Bestrahlung
erzeugen (Abbildung 47b). Alle Metallcarbonyle sind auf zweierlei Art giftig, sowohl als Schwermetall-,
als auch als Kohlenmonoxid-Quellen.
Abbildung 47: (a) Schematische Darstellung des Mond-Verfahrens zur Reinigung von Nickel. (b) Weitere Verfahren zur
Darstellung homoleptischer Metallcarbonyle.
Bei allen Metallcarbonylen lässt sich die Stabilität der Komplexe sowie deren Struktur anhand der 18-
Elektronenregel (Sidgwick-Regel) mit gutem Erfolg abschätzen. Die einkernigen Komplexe [Ni(CO)4],
[Fe(CO)5] und [W(CO)6] weisen alle 18 Elektronen in ihrer Valenzschale auf. Beim Übergangsmetalle
mit ungeradzahliger Valenzelektronenzahl bilden bevorzugt Dimere, wie z.B. [Mn2(CO)10], das man
sich als zwei Mn(CO)5-Fragmenten mit je 17 Elektronen, die durch eine Mn-Mn-Bindung verknüpft
sind. Bei mehrkernigen Carbonylen kommen dann verbrückende CO-Einheiten zum Tragen, wenn die
Koordinationssphäre ansonsten unvollständig wäre oder eine unsymmetrische Koordination
erzwungen würde. Strenge Vorhersageregeln gibt es hier nicht, schwerere Übergangsmetalle z.B.
neigen zu unverbrückten Strukturen.
Die M-CO-Bindung besteht aus einer -Hinbindung in vakante d-Orbitale durch das freie
Elektronenpaar am Kohlenstoff und einer Rückbindung von besetzten d-Orbitalen in das antibindende
*-Orbital von CO (Abbildung 32). Diese Verhältnisse implizieren eine Verringerung der
Bindungsordnung der C-O-Bindung und einen gewissen M-C-Doppelbindungsanteil. Tatsächlich
findet man eine gute Korrelation der C-O-Streckschwingung mit der Art des verbleibenden
Metallfragments.
Abbildung 48: Schematische MO-Betrachtung der Bindungsverhältnisse in Übergangsmetallcarbonylen.
Die wirklichen MO-theoretischen Verhältnisse sind komplizierter, immerhin müssen mehrere
Metallcarbonylwechselwirkungen erfasst werden, für die aus Gründen der Symmetrie nicht nur das
dz2-Orbital verantwortlich sein kann. Die M-CO-Bindung ist aber in vielerlei Hinsicht prototypisch für
eine ganze Reihe metallorganischer Liganden und wir kommen daher zu Vergleichszwecken
wiederholt auf sie zurück.
4.2 Fischer und Schrock Carbene
Die Grenzorbitale von Carbenen :CR2 und Kohlenmonoxid weisen deutliche Parallelen hinsichtlich
ihrer Symmetrie auf, sie sind isolobal.* Das HOMO ist in beiden Fällen ein nichtbindendes -artiges
Orbital und das LUMO ein vakantes Orbital mit -Symmetrie. Wie das Kohlenmonoxid sind damit
Carbene gute -Donoren und je nach Art der Substituenten mehr oder weniger gute -Akzeptoren.
* Die Isolobalbeziehung werden wir in der Vorlesung AC06 - Metallorganische Chemie im Masterstudiengang näher kennenlernen. Sie beruht auf der Hoffmannschen Hypothese, dass die Energie und Symmetrie der Grenzorbitale wesentlich die Reaktivität von Verbindungen bestimmen.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
42 © 2011 David Scheschkewitz
Auf dieser Basis wird grundsätzlich zwischen zwei Hauptklassen an Carbenkomplexen
unterscheiden: den Fischer- und den Schrock-Carbenen.
Fischer-Carbene tragen Donorsubstituenten am Carben-Kohlenstoff, wodurch dessen intrinsischer
Elektronenmangel gemildert wird, d.h. das LUMO energetisch angehoben. Dadurch findet in Fischer-
Carbene nur eine begrenzte Rückbindung vom Metall zum vakanten pz-Orbitals des Carbenzentrums
statt.*
Fischer-Carbene sind z.B. durch nukleophilen Addition von Lithiumorganylen an
Übergangsmetallcarbonyle zugänglich (Abbildung 49).
Abbildung 49: Synthese, elektronische Struktur und Reaktivität von Fischer-Carbenkomplexen.
Bezüglich der Reaktivität ist eine strenge Unterscheidung zwischen mesomeren und induktiven
Effekten zu treffen: Durch die elektronegative Natur vieler -Donorsubstituenten üben diese
gleichzeitig, ebenso wie das elektronenarme Metallfragment, einen substantiellen -I-Effekt aus,
wodurch das Kohlenstoffatom deutlich elektrophilen Charakter erhält. Zum Beispiel reagieren Fischer-
Carbene mit Aminen oder anderen Nukleophilen unter Substitution der Alkoxygruppe am Carben-
Kohlenstoff.
Schrock-Carbenkomplexe werden in der Regel aus Übergangsmetallalkylverbindungen dargestellt,
wobei diese präperativ, genau wie Hauptgruppenalkyle, durch Salzmetathese aus den
entsprechenden Übergangsmetallhalogeniden und Alkyllithiumverbindungen erhalten werden. Inter-
oder intramolekulare Deprotonierung geeigneter Vorläufer liefert neutral oder kationische Carbene
des Schrock-Typs, deren Carbenliganden ohne Donor-Stabilisierung auskommen.
Die prototypische Synthese von (neo
Pent)3Ta=C(H)tBu ist die Umsetzung von (
neoPent)3TaCl2 mit neo-
Pentyllithium, die zur Isolierung des ersten donorfreien Carbenkomplexes durch Richard Schrock
führte.63
Lange Zeit war unklar, ob der homoleptische neo-Pentylkomplex ein Intermediat dieser
Synthese darstellt. Es konnte aber schließlich NMR-spektroskopisch und durch Isotopenmerkierung
gezeigt werden, dass intermediär Pentakis(neo-pentyl)tantal entsteht, welches unter Eliminierung von
iso-Butan (also intramolekularer Deprotonierung) den t-Butylcarben-Komplex bildet.64
Abbildung 50: Synthese des prototypischen Schrock-Carbenkomplexes.
In Schrock Carbenen reagiert das Carbenzentrum als Nukleophil wie durch zahlreiche einfache
Derivatisierungsreaktionen gezeigt werden konnte. In Metathese mit Ketonen, die konzeptionell der
Wittig-Reaktion von Phosphoranen (Yliden) ähnelt, wirken Tantalalkylidene (so der alternative Name
für donorfreie Carbenkomplexe) als Überträger substituierter Methylenfragmente. Die logische
Fortführung dieser Reaktion führte letztlich zur Entwicklung der Alkenmetathese für die Richard
Schrock gemeinsam mit Grubbs und Chauvin im Jahre 2005 den Nobelpreis für Chemie erhielt. Die
Alken-Metathese beruht auf der reversiblen Bildung von Metallacyclobutanen durch [2+2]-
Cycloaddition eines Alkens an ein Schrcok-Carben. Die Umkehrreaktion kann nun entweder zurück
zu den Edukten führen, oder bei Spaltung der anderen beiden Bindungen zu neuen Produkten.
* Weiterhin findet sich in vielen Lehrbüchern ein Hinweis auf die geringe Oxidationsstufe des späten Übergangsmetalls in
Komplexen des Fischer-Typs. Dies erscheint aus didaktischer Sicht wenig hilfreich, da diese beiden Umstände a priori für stärkere Rückbindung des ÜM-Zentrums zum Carbenkohlenstoff sorgen sollten. Man bedenke aber, dass wie stets die wirklichen elektronischen Verhältnisse durch die hier verwandten Modelle nur grob angenähert werden.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
43 © 2011 David Scheschkewitz
4.3 Alkenkomplexe
Eine freie Koordinationsstelle an einem Übergangsmetallzentrum kann nicht nur durch n-Donoren wie
Phospane abgesättigt werden. -Elektronen sind im Prinzip ebenso gut geeignet. Dies führt zu den
zahlreichen Übergangsmetall-Verbindungen des Cyclopentadienids, das in den meisten Fällen als 5-
Ligand fungiert. Zahlreiche sogenannte Sandwich- und Halbsandwichkomplexen wie z.B. die
Metallocene sind bekannt. In bestimmten Fällen kann selbst der eigentlich stabile 5-gebundene
Cyclopentadienylrest auch als hemilabiler Ligand wirken und so eine freie Koordinationsstelle zur
Verfügung stellen, indem er intermediär in den 3- Koordinationsmodus wechselt. Man spricht dann
von der sog. Ringslippage.
Abbildung 51: Schematische Darstellung der Grenzorbitale der Bindung in Alkenkomplexen, sowie Resonanzstrukturen von p-
Komplex und Metallacyclopropan nach dem Dewar-Chatt-Duncanson Modell
Bezüglich des Bindungsmodells sollen uns hier aber vor allem 2-gebundene Alkene und Alkine
interessieren. Auch hier ergeben sich bemerkenswerte Analogien zu den Bindungsverhältnissen in
der Metall-CO-Bindung. Die -Hinbindung in Alkenkomplexen geschieht durch Donation des HOMOs
des Alkens in ein freies d-Orbital geeigneter Symmetrie. Die Rückbindung geschieht von einem
besetzten d-Orbital in das p*-Orbital des Alkens. Für Alkine gilt eine analoge Bindungssituation.
Mit stärker werdender Rückbindung nimmt nach dem Dewar-Chatt-Duncanson Modell der
Metallacyclopropancharakter des Komplexes zu Ungunsten des -Komplexcharakters zu. Folglich
beobachtet man bei weniger zur Rückbindung befähigten elektronenarmen
Übergangsmetallkomplexen eine geringe Abweichung von der planaren Alkenstruktur (sp2-
Hybdridisierung bleibt erhalten), während die zunehmende Population des antibindenden LUMOs des
Alkens bei elektronenreichen Fragmenten mit starker Rückbindung die Bindungsordnung der C-C-
Bindung verringert (sp3-Hybridisierung, Abwinkelung der Substituenten des Alkens).
Bei der Olefinpolymerisation nach Ziegler und Natta geht man davon aus, dass das Alken in einem
ersten Schritt an den Übergangsmetallkatalysator koordiniert, um anschließend in die M-C-Bindung
der wachsenden Polymerkette zu insertieren (siehe 4.4).
4.4 Elementarreaktionen
In der homogenen Komplexkatalyse gibt es bestimmte Elementarreaktionen, die immer wieder in
katalytischen Cyclen auftauchen (Abbildung 52). Eine grundlegende Beherrschung dieser simplen
Reaktionsschritte erlaubt die rasche Entwicklung spekulativer, katalytischer Zyklen, die dann
experimentell oder theoretisch untermauert werden können.
Abbildung 52: Einige Elementarschritte der homogenen Komplexkatalyse: 1) Komplexierung und Dekomplexierung von
Liganden oder Substraten; 2) agostische Wechselwirkung mit E-H (oder auch E-E) Bindungen; 3) oxidative Addition und
reduktive Eliminierung; 4) Insertion von Carbenen und Alkenen (oder auch CO) in M-H (oder auch M-E) Bindungen.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
44 © 2011 David Scheschkewitz
Die wichtigste Voraussetzung für eine katalytische Aktivität ist das Vorliegen einer freien
Koordinationsstelle am Übergangsmetall. Diese kann entweder als solche bereits vorhanden sein,
d.h. es liegt ein intrinsischer Elektronenmangelkomplex vor, oder durch Dekomplexierung des
Substrats oder eines labilen Liganden in situ erzeugt werden. In den meisten Fällen ist letzteres der
Fall; insbesondere in katalytischen Zyklen treten intermediär fast immer koordinativ gesättigte
Komplexe auf.
Die freie Koordinationsstelle wird oft zunächst von einer -Bindung des Substrats koordiniert; dies
kann eine E-H-, E-E oder E-X-Bindung sein, wobei E allgemein ein Hauptgruppenelement ab der
ersten Langperiode bezeichnet und X ein Halogen oder andere Abgangsgruppe darstellt (Abbildung
52). Diese Bindungssituation kann wahlweise als agostische Wechselwirkung, -Koordination oder
2e3c-Bindung bezeichnet werden.
Konzeptionell besteht kein wesentlicher Unterschied, nur bezüglich der Verwendung gibt es
bestimmte Präferenzen: während die ersten beiden Bezeichnungen in der Übergangsmetallchemie
gebräuchlicher sind, kennen Sie die letztere im Zusammenhang mit den
Elektronenmangelverbindungen der HG-Elemente wie den Boran oder Carboran-Clustern. Die
agostische Wechselwirkung ist weiterhin eng verwandt mit der Koordination eines Alkens in der Form
eines -Komplexes, die Ausbildung eines Metallacyclopropans nach dem Dewar-Chatt-Duncanson
Modell entspräche demgemäß der folgenden oxidativen Addition.
Der Übergang zwischen agostischer Wechselwirkung und oxidativer Addition kann entweder als
Kontinuum (Resonanzstrukturen) oder als Abschreiten eines Reaktionspfades mit diskreten
Intermediaten aufgefasst werden. Welche dieser beiden Situationen im Einzelfall vorliegt, hängt vom
jeweiligen System ab und kann a priori nicht entschieden werden. Die Umkehrung der oxidativen
Addition wird als reduktive Eliminierung bezeichnet.
Die in Abbildung 52 unter Punkt 4) dargestellten Insertionen von externen Substraten (Carben, Alken
oder Kohlenmonoxid) können mit Vorteil auch als substratzentrierte Reaktionen betrachtet werden.
Eine solche Betrachtungsweise legt nahe, dass es sich hier strenggenommen nicht um eine neue
Klasse von Elementarschritten handelt, sondern stattdessen eine Addition der M-H- oder M-C-
Bindung an das jeweilige Substrat erfolgt. Insbesondere bei Alkenen ist dies sinnvoll: man erkennt,
dass im Grunde eine Hydrometallierung bzw. Carbometallierung der C-C-Doppelbindung vorliegt.
Abschließend sei darauf hingewiesen, dass sämtliche Elementarschritte der homogenen
Komplexkatalyse ihre Entsprechung in Reaktionen aus der metallorganischen Chemie der
Hauptgruppenelemente finden. Eine umfassende Beherrschung des in dieser Vorlesung und dem
dazugehörigen Gelernten ist also nicht nur von akademischem Interesse, sondern erleichtert auch für
diejenigen von Ihnen, die mit der Hauptgruppenchemie in Zukunft nur noch peripher in Kontakt
kommen werden, das Verständnis von Vorgängen weit über den eigentlichen Themenblock hinaus.

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
45 © 2011 David Scheschkewitz
Literatur
1 R. T. Sanderson, J. Am. Chem. Soc. 1983, 105, 2259. http://dx.doi.org/10.1021/ja00346a026
2 S. Rozen, Acc. Chem. Res. 2005, 38, 803. http://dx.doi.org/10.1021/ar040270c
3 N. S. Nikolaev, Y. P. Shishkov, Atomic Energy 1963, 15, 753. http://dx.doi.org/10.1007/BF01119171
4 N. Bartlett, Proc. Chem. Soc. 1962, 218. http://dx.doi.org/10.1039/PS9620000197
5 Übersichtsartikel: D. A. Atwood in Encyclopedia of Inorganic Chemistry, (Ed. B. King), 2
nd Edition, Wiley
2005, S. 3651ff. 6 S. Seidel, K. Seppelt, Science 2000, 290, 117. http://dx.doi.org/10.1126/science.290.5489.117
7 K. D. Asmus, W. Gruenbein, J. H. Fendler, J. Am. Chem. Soc. 1970, 92, 2625.
http://dx.doi.org/10.1021/ja00712a006 8 U. Elgad, H. Selig, Inorg. Chem. 1975, 14, 140. http://dx.doi.org/10.1021/ic50143a031
9 K. Christe, J. C. P: Sanders, G. J. Schrobilgen, W. W. Wilson, J. Chem. Soc., Chem. Commun. 1991, 837.
http://dx.doi.org/10.1039/C39910000837 10
R. S. Berry, J. Chem. Phys. 1960, 32, 933. http://dx.doi.org/10.1063/1.1730820 11
M. E. Cass, K. K. Hii, H. S. Rzepa, J. Chem. Educ. 2006, 83, 336. http://dx.doi.org/10.1021/ed083p336.2 12
P. Schwerdtfeger, G. A. Heath, M. Dolg, M. A. Bennett, J. Am. Chem. Soc. 1992, 114, 7518. http://dx.doi.org/10.1021/ja00045a027
13 E. A. Chernyshev, T. L. Krasnova, E. S. Abramova, E. A. Abronin, A. B. Petrunin, A. P. Sergeev, Russ. Chem.
Bull. 1997, 46, 1582. http://dx.doi.org/10.1007/BF02502944 14
J. Fischer, J. Baumgartner, C. Marschner, Science 2005, 310, 825. http://dx.doi.org/10.1126/science.1118981
15 Daten wurden aus folgenden Quellen zusammengetragen: (a) P. G. Sennikov, J. Phys. Chem. 1994, 98, 4973.
http://dx.doi.org/10.1021/j100070a006; (b) R. Steudel, Chemie der Nichtmetalle; (c) P. L. Robinson, W. E. Scott, J. Chem. Soc. 1932, 972. http://dx.doi.org/10.1039/JR9320000972; (d) http://www.docstoc.com/docs/57069738/pKas-of-Binary-Acids; (e) http://encyclopedia.airliquide.com/encyclopedia.asp ; (f) S. Aldridge, A. J. Downs, Chem. Rev. 2001, 101, 3305. http://dx.doi.org/10.1021/cr960151d; (g) D. W. Smith, J. Chem. Educ. 1988, 65, 414. http://dx.doi.org/10.1021/ed065p414; (h) http://www.guidechem.com/dictionary/7782-65-2.html
16 T. L. Chu, S. S. Chu, F. Firszt, H. A. Naseem, R. Stawski, J. Appl. Phys. 1985, 58, 1349.
http://dx.doi.org/10.1063/1.336106 17
G. B. Jiang, P. S. Maxwell, K. W. Michael Siu, V. T. Luong, S. S. Berman, Anal. Chem. 1991, 63, 1506. http://dx.doi.org/10.1021/ac00015a002
18 A. L. Allred, E. G. Rochow, J. Inorg. Nucl. Chem. 1958, 5, 269.
http://dx.doi.org/10.1016/0022-1902(58)80004-4 19
E. Hengge, G. Bauer, Angew. Chem. 1973, 85, 304. http://dx.doi.org/10.1002/ange.19730850709 20
T. Shimoda, Y. Matsuki, M. Furusawa, T. Aoki, I. Yudasaka, H. Tanaka, H. Iwasawa, D. Wang, M. Miyasaka, Y. Takeuchi, Nature 2006, 440, 783. http://dx.doi.org/10.1038/nature04613
21 T. F. Schulze, L. Korte, F. Ruske, B. Rech, Phys. Rev. B 2011, 83, 165314.
http://dx.doi.org/10.1103/PhysRevB.83.165314 22
D. K. Yu, R. Q. Zhang, S. T. Lee, J. Appl. Phys. 2002, 92, 7453. http://dx.doi.org/10.1063/1.1513878 23
C. A. Wamser, J. Am. Chem. Soc. 1951, 73, 409. http://dx.doi.org/10.1021/ja01145a134 24
C. Lohmeier, D. Loos, H. Schnöckel, Angew. Chem. Int. Ed. 1996, 35, 129. http://dx.doi.org/10.1002/anie.199601291
25 W. Hönle, Y. Grin, A. Burkhardt, U. Wedig, M. Schultheiss, H. G. von Schnering, R. Kellner, H. Binder, J. Solid
State Chem. 1997, 133, 59. http://dx.doi.org/10.1006/jssc.1997.7309 26
M. Mocker, C. Robl, H. Schnöckel, Angew. Chem. 1994, 106, 1860. http://dx.doi.org/10.1002/ange.19941061731
27 C. Longuet-Higgins, R. P. Bell, J. Chem. Soc. 1943, 255. http://dx.doi.org/10.1039/JR9430000250
28 E. Frankland, B. F. Duppa, J. Chem Soc. 1863, 16, 415. http://dx.doi.org/10.1039/JS8631600415
29 P. P. Powell, South. Med. J. 1991, 84, 1352. http://journals.lww.com/smajournalonline/toc/1991/11000
30 W. Schlenk, J. Holtz, Ber. Chem. Gesell. 1917, 50, 262. http://dx.doi.org/10.1002/cber.19170500142
31 K. Ziegler, H. Colonius, Liebigs Ann. Chem. 1930, 479, 135. http://dx.doi.org/10.1002/jlac.19304790111
32 D. Hoppe, T. Hense, Angew. Chem. Int. Ed. 1997, 36, 2282. http://dx.doi.org/10.1002/anie.199722821
33 (a) H. Gilman, A. L. Jacoby, J. Org. Chem. 1938, 3, 108. http://dx.doi.org/10.1021/jo01219a003 (b) G.
Wittig, U. Pockels, H. Dröge, Chem. Ber. 1938, 71, 1903. http://dx.doi.org/10.1002/cber.19380710922

AC05 – Molekülchemie und Metallorganische Chemie David Scheschkewitz
46 © 2011 David Scheschkewitz
34
S. Norsikian, I. Marek, J.-F. Normant, Tetrahedr. Lett. 1997, 38, 7523. http://dx.doi.org/10.1016/S0040-4039(97)10022-3
35 S. Norsikian, M. Baudry, J. F. Normant, Tetrahedr. Lett. 2000, 41, 6575.
http://dx.doi.org/10.1016/S0040-4039(00)01091-1 36
M. A. Nichols, P. G. Williard, J. Am. Chem. Soc. 1993, 115, 1568. http://dx.doi.org/10.1021/ja00057a050 37
T. Kottke, D. Stalke, Angew. Chem. 1993, 105, 619. http://dx.doi.org/10.1002/ange.19931050433 38
Übersichtsartikel: G. Köbrich, Angew. Chem. 1972, 84, 557. http://dx.doi.org/10.1002/ange.19720841202 39
A. Müller, M. Marsch, K. Harms, J. C. W. Lohrenz, G. Boche, Angew. Chem. 1996, 108, 1639. http://dx.doi.org/10.1002/ange.19961081328
40 F. G. A. Stone, H. J. Emeléus, J. Chem. Soc. 1950, 2755. http://dx.doi.org/10.1039/JR9500002755
41 Übersichtsartikel: H. C. Brown, Angew. Chem. 1980, 92, 675. http://dx.doi.org/10.1002/ange.19800920905
42 G. Wilke, H. Müller, Liebigs Ann. Chem. 1960, 629, 222. http://dx.doi.org/10.1002/jlac.19606290117
43 Übersichtsartikel: W. Uhl, Coord. Chem. Rev. 2008, 252, 1540. http://dx.doi.org/10.1016/j.ccr.2008.01.026
44 S. Trudeau, J. B. Morgan, M. Shrestha, J. P. Morken, J. Org. Chem. 2005, 70, 9538.
http://dx.doi.org/10.1021/jo051651m 45
H. Chen, S. Schlecht, T. C. Semple, J. F. Hartwig, Science 2000, 287, 1995. http://dx.doi.org/10.1126/science.287.5460.1995
46 W. J. Grigsby, P. P. Power, Chem. Eur. J. 1997, 3, 368. http://dx.doi.org/10.1002/chem.19970030308
47 Übersichtsartikel: W. Uhl, Naturwissenschaften 2004, 91, 305.
http://dx.doi.org/10.1007/s00114-004-0534-8 48
W. Uhl, S. U. Keimling, K. W. Klinkhammer, W. Schwarz, Angew. Chem. Int. Ed. 1997, 36, 64. http://dx.doi.org/10.1002/anie.199700641
49 M. Yoshifuji, I. Shima, N. Inamoto, K. Hirotsu, T. Higuchi, J. Am. Chem. Soc. 1981, 103, 4587.
http://dx.doi.org/10.1021/ja00405a054 50
C. J. Kalbick, M. A. Kuck, D. H. Valentine, US Patent No. 5260485, 1993. http://worldwide.espacenet.com 51
A. R. Stiles, F. F. Rust, W. E. Vaughan, J. Am. Chem. Soc. 1952, 74, 3282. http://dx.doi.org/10.1021/ja01133a018
52 M. M. Rauhut, A. M: Semsel, J. Org. Chem. 1963, 28, 471. http://dx.doi.org/10.1021/jo01037a048
53 H.-J. Cristau, J. Pascal, F. Plenat, Tetrahedron Lett. 1990, 38. 5463.
http://dx.doi.org/10.1016/S0040-4039(00)97873-0 54
F.S. Kipping, Proc. Chem. Soc., London 1911, 27, 143. http://dx.doi.org/10.1039/PL9112700131 55
F.S. Kipping, J. E. Sands, J. Chem. Soc., Trans. 1921, 119, 830. http://dx.doi.org/10.1039/CT9211900830 56
H. Gilman, G. L. Schwebke, J. Organomet. Chem. 1965, 3, 382. http://dx.doi.org/10.1016/S0022-328X(00)80191-6
57 Übersichtsartikel: R. D. Miller, J. Michl, Chem. Rev. 1989, 89, 1359. http://dx.doi.org/10.1021/cr00096a006
58 N. C. Lloyd, H. W. Morgan, B. K. Nicholson, R. S. Ronimus, Angew. Chem. Int. Ed. 2005, 44, 941.
http://dx.doi.org/10.1002/anie.200461471 59
L. Maier, E. G. Rochow, W. C. Fernelius, J. Inorg. Nucl. Chem. 1961, 16, 213. http://dx.doi.org/10.1016/0022-1902(61)80492-2
60 Übersichtsartikel: P. Jutzi, Chem. Rev. 1986, 86, 983. http://dx.doi.org/10.1021/cr00076a002
61 P. Jutzi, U. Holtmann, D. Kanne, C. Krüger, R. Blom, R. Gleiter, I. Hyla-Kryspin, Chem. Ber. 1989, 122, 1629.
http://dx.doi.org/10.1002/cber.19891220906 62
P. Jutzi, A. Mix, B. Rummel, W. W. Schoeller, B. Neumann, H.-G. Stammler, Science 2004, 305, 849. http://dx.doi.org/10.1126/science.1099879
63 R. R. Schrock, J. Am. Chem. Soc. 1974, 96, 6796. http://dx.doi.org/10.1021/ja00828a061
64 L. Li, M. Hung, Z. Xue, J. Am. Chem. Soc. 1995, 117, 12746. http://dx.doi.org/10.1021/ja00156a011
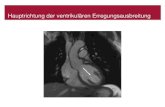



![Metallkomplexe mit biologisch wichtigen Liganden, LXVIII ... · R. Bergs, K. Sünkel, W. Beck 2429 Notiz / Note Metallkomplexe mit biologisch wichtigen Liganden, LXVIII[1] Metallorganische](https://static.fdokument.com/doc/165x107/5d66bbe188c9937b6e8bd214/metallkomplexe-mit-biologisch-wichtigen-liganden-lxviii-r-bergs-k-suenkel.jpg)














