Nucleinsäuren mit metallvermittelten Basenpaaren
Transcript of Nucleinsäuren mit metallvermittelten Basenpaaren

nicht natürliche Basenpaare ent-wickelt, um so die Anwendbarkeit von DNA zu erweitern. Diese künst-lichen Basenpaare beruhen wie ihre natürlichen Vorbilder oft auf Was-serstoffbrückenbindungen; es gibt aber auch Beispiele für eine Assozia-tion über rein hydrophobe Wechsel-wirkungen.
Funktionalisierung mit Metallionen
� Eine völlig andere Herangehens-weise, um die Anwendbarkeit von DNA zu erweitern, ist die Funktio-nalisierung von Nucleinsäuren durch Anknüpfen von Metallionen oder Metallkomplexen. Durch die Modifizierung einzelner Nucleoba-sen lässt sich sequenzspezifisch me-tallierte DNA synthetisieren. In zahl-reichen Beispielen gelang durch die Verknüpfung der natürlichen Bau-steine der DNA mit Liganden eine solche Modifizierung. So kann der Ligand 2,2'-Bipyridin als zusätzli-cher Substituent an natürliche Nu-cleobasen eingeführt oder direkt in das Zucker-Phosphat-Rückgrat im-plementiert werden.
Im Gegensatz dazu werden bei ei-ner erstmals im Jahr 1999 beschrie-benen Strategie zur Funktionalisie-rung von Nucleinsäuren komple-mentäre Nucleobasen formal durch Liganden substituiert: Anstatt die
� Seit mehr als 50 Jahren ist be-kannt, dass die DNA als Doppelhelix vorliegt. Zusammengehalten wird sie unter anderem durch Wasser-stoffbrückenbindungen zwischen je-weils gegenüberliegenden, komple-mentären Nucleobasen. Dieses in Jahrmillionen evolutionär optimier-te Biomolekül besticht durch seine Fähigkeit zur exakt vorhersagbaren, reversiblen Selbstassoziation sowie durch seine hohe Stabilität. DNA ist durch automatisierte Festphasen-synthese oder biochemische Metho-den einfach zugänglich, so dass Nu-cleinsäuren und Nucleinsäureanalo-ga einen festen Platz als Bausteine in Biotechnik und Materialwissen-schaften gefunden haben.
Da die Zahl natürlicher Nucleo-basen in der DNA auf vier und die der Basenpaare entsprechend auf zwei begrenzt ist, wurden zahlreiche
Jens Müller
Nucleinsäuren, die Träger der Erbinformation, haben sich mittlerweile als Bau steine für die
Nanotechnik etabliert. Mit künstlichen, metallvermittelten Basenpaaren ist es möglich, diese
Bausteine mit zusätzlichen Funktionalitäten zu versehen.
Nucleinsäuren mit metallvermittelten Basenpaaren
�Bioanorganische Chemie�
natürlichen Nucleobasen mit Ligan-den zu verknüpfen, werden sie bei diesem Ansatz als Ganzes ersetzt (Abbildung 1).1–3) Die künstlichen Nucleobasen sind meist nicht in der Lage, Wasserstoffbrücken zu ihrem komplementären Bindungspartner zu bilden, sondern benötigen ein Metallion. Diese metallvermittelten Basenpaare ermöglichen es, die DNA-Doppelhelix auch in ihrem In-nern mit Metallionen zu funktionali-sieren.
Schon seit den 1990er Jahren gibt es Berichte, dass natürliche, nicht modifizierte DNA in Gegenwart zweiwertiger Metallionen in alka-lischem Milieu eine neue Konforma-tion, genannt M-DNA, einnimmt. Für die M-DNA wurden als zugrun-de liegendes Strukturmerkmal me-tallvermittelte Basenpaare vor-geschlagen. Insofern lässt sich die Synthese von Nucleinsäuren mit künstlichen, metallvermittelten Ba-senpaaren auch als Bottom-up-Ap-proach zur Generierung von M-DNA betrachten. Allerdings wer-den sowohl der Strukturvorschlag als auch die Bildung von M-DNA noch kontrovers diskutiert. Das In-teresse an M-DNA resultiert aus ei-nem Bericht über ihre „metallähn-liche Leitfähigkeit“.4)
Als Nucleobasen in metallvermit-telten Basenpaaren dienen unter-schiedliche Liganden: Es gibt Bei-
� QU ERGELESEN
�� DNA lässt sich mit Metallionen funktionalisieren.
Zu ihnen zählen Ag+-, Cu2+-, Fe2+-, Hg2+-, Mn2+-,
Ni2+- und Pd2+-Ionen.
�� Auch längere metallierte Doppelhelices sind
möglich – der bisherige Rekord liegt bei 19
aufeinander folgenden Metallobasenpaaren.
�� Metallmodifizierte Nucleinsäuren könnten sich
für die enantioselektive Synthese, molekulare
Magnete oder Metallionensensoren als geeignet
erweisen.
120
Nachrichten aus der Chemie | 57 | Februar 2009 | www.gdch.de/nachrichten

spiele mit einzähnigen Liganden wie Pyridin oder Triazol, mit zweizähni-gen Liganden wie Hydroxypyridon, mit dreizähnigen Liganden wie Pyri-din-2,6-dicarboxylat, und selbst der vierzähnige Ligand Salen kann ein metallvermitteltes Basenpaar auf-bauen (Abbildung 2, S. 122). Koor-dinierende Atome sind Sauerstoff, Stickstoff und / oder Schwefel, so dass die bisher beschriebenen Basen-paare fähig sind, eine große Band-breite von Metallen zu binden – un-ter anderem Ag+, Cu2+, Fe2+, Hg2+, Mn2+, Ni2+ und Pd2+.
Frühere Arbeiten waren meist Machbarkeitsstudien und be-schränkten sich auf Doppelhelices aus überwiegend natürlichen Nu-cleobasen mit nur einem oder zwei metallvermittelten Basenpaaren. Da-gegen gibt es mittlerweile immer mehr Doppelhelices mit zehn und mehr direkt aufeinander folgenden, metallvermittelten Basenpaaren. Ei-ne solche direkte Folge entspricht dem für M-DNA postulierten Auf-bau und ist deshalb ein lohnendes Syntheseziel.
Bildung längerer Metallionen-Stapel
� Die erste systematische Arbeit zu unterschiedlich langen Doppelheli-ces mit bis zu fünf aufeinander fol-genden Metallobasenpaaren er-schien im Jahr 2003.5) Verwendet wurde das Hy droxy pyridon- Cu2+- Hydroxy pyridon- System; durch ESR-Spektroskopie ließ sich die Wechselwirkung benachbarter Me-tallionen untersuchen. Die Cu2+-Io-nen in diesen Metallobasenpaaren koppeln ferromagnetisch miteinan-der und bilden so kurze magnetische Ketten. Der aus den ESR-Spektren geschätzte Abstand der Metallionen zueinander beträgt 3,7 ± 0,1 Å und liegt damit im Bereich des Abstands benachbarter Basenpaare in natürli-cher DNA (etwa 3,4 Å).
Ein anderes spektakuläres Resul-tat war die im Jahr 2006 publizierte Charakterisierung mehrerer Doppel-helices, die gleichzeitig unterschied-liche Metallionen an vordefinierten Positionen binden.6) Erreicht wurde
Abb. 1. DNA-Doppelhelix aus natürlichen und metallvermittelten Basenpaaren.
� Memo: DNA-Struktur
A-, B- und Z-Konformationen
(Abbildung unten).
Die thermische Stabilität einer
solchen Helix wird durch ihren
Schmelzpunkt beschrieben.
Dieser Schmelzpunkt bezeichnet
jedoch keinen Phasenübergang,
vielmehr geht die DNA von der
geordneten helicalen Struktur zu
den Einzelsträngen über.
Die DNA-Doppelhelix wird durch
Wasserstoffbrückenbindungen
zwischen einander gegenüberlie-
genden Nucleobasen sowie durch
die Stapelwechselwirkung be-
nachbarter Basenpaare zusam-
mengehalten. Die Doppelhelix ist
prinzipiell in der Lage, verschiede-
ne Konformationen einzuneh-
men. Am bekanntesten sind die
dies durch Kombination metall -vermittelter Basenpaare, nämlich Hydroxypyridon-Cu2+-Hydroxypy-ridon in Verbindung mit Pyridin-Hg2+-Pyridin und Salen-Cu2+ in Ver-
bindung mit Thymin-Hg2+-Thymin. Diese Arbeiten stellten klar, dass metallvermittelte Basenpaare einen einfachen Zugang zu eindimen si -onalen Arrays unterschiedlicher
Nachrichten aus der Chemie | 57 | Februar 2009 | www.gdch.de/nachrichten
Metallierte DNA �Magazin� 121

modifizierten DNA-Doppelhelix von mehr als 42 °C für ein einziges Salen-Cu2+-Basenpaar deutlich.8)
Wo sind die Metallionen?
� Es gibt zahlreiche Versuche, DNA-Doppelhelices mit metallver-mittelten Basenpaaren strukturell zu charakterisieren. Die bis dato einzige Kristallstruktur eines sol-chen Duplex zeigt den Einfluss, den das Metallion auf die Gesamt-struktur ausübt:9) Obwohl eine Sequenz gewählt wurde, die übli-cherweise in der B-Konformation kristallisiert, und das Pyridin-2,6-dicarboxylat-Cu2+-Pyridin-Sys-tem in dieser Sequenz nur zwei der natürlichen Basenpaare ersetzt, ähnelt die Konformation des erhal-tenen Duplex stark einer Z-DNA.
Möglicherweise führt die Vorlie-be des Cu2+-Ions für verzerrt okta-edrische Koordinationsumgebun-gen zu diesem unerwarteten Struk-turtyp: Die beiden künstlichen Nu-cleobasen Pyridin-2,6-dicarboxylat und Pyridin stellen eine quadra-tisch planare Koordinationssphäre zur Verfügung, und das Metallion rekrutiert die Sauerstoffatome einer Guanin-Ketogruppe und eines Furanose-Rings aus den jeweils benachbarten Basenpaaren als zu-sätzliche Liganden für die axialen Positionen. Die mit dieser Orientie-rung der Nucleoside einhergehende zickzackartige Anordnung der DNA-Stränge ist charakteristisch für die biologisch ansonsten äußerst seltene Z-Konformation der DNA.
Interessanterweise weist die Un-tersuchung derselben Sequenz in Lösung auf das Vorliegen entweder eines Gemisches aus B- und Z-DNA oder einer intermediären Konforma-tion hin. Eine endgültige und direk-te strukturelle Bestätigung dafür, dass DNA mit metallvermittelten Ba-senpaaren auch die typische B-Kon-formation annehmen kann, in der die Metalle im Innern der Helix auf-gereiht sind wie Perlen auf einer Schnur, steht daher zurzeit noch aus.
Metallionen in mehr oder weniger beliebiger Reihenfolge eröffnen. So synthetisierte Doppelhelices enthiel-ten bis zu zehn aufeinander folgende, künstliche Basenpaare.
Dass auch eine noch längere kon-tinuierliche Folge metallvermittelter Basenpaare möglich ist, zeigte die Veröffentlichung eines 1-Desaza -adenin-Ag+-Thymin-Basenpaars im Jahr 2007, von dem 19 benachbarte Einheiten in einer Doppelhelix an-geordnet werden konnten (Abbil-dung 3).7) Dieses Basenpaar nimmt insofern eine Sonderstellung ein, als hier zusätzlich zu den koordinativen Bindungen an das zentrale Silberion noch die Möglichkeit für eine Was-serstoffbrückenbindung besteht. Die Kombination der beiden Bindungs-arten führt zu einem metallionen-funktionalisierten Basenpaar, das in seiner thermischen Stabilität (etwa 2 °C pro Basenpaar) seinen natürli-chen Vorbildern ähnelt. So kann ei-ne reversible Selbstassoziation des Duplex auch mit langen Abfolgen von Metallobasenpaaren erreicht werden.
Auch das bereits erwähnte Salen-Cu2+-Basenpaar hat eine Sonderstel-lung, da es nicht nur über koor-dinative Bindungen an ein zentrales Metallion, sondern nach seiner In-situ-Bildung aus zwei Salicylal-dehyd-Nucleosiden und einem Mo-lekül Ethylendiamin auch über eine kovalente Bindung zusammen-gehalten wird. Im Vergleich zum 1-Desazaadenin-Ag+-Thymin-Basen-paar steht es daher am entgegen-gesetzten Ende der Stabilitätsskala. Dies macht der enorme Anstieg des Schmelzpunkts einer entsprechend
Abb. 4. Bildung von Netzwerkstrukturen durch metallierte
Nucleoside.
Abb. 3. Mögliche Struktur eines DNA-Duplex
mit kontinuierlichem Metallionen-Stapel.
O N
OH
HO NO
OH
OH
O NNN
OH
HO NN N
O
OH
OH
Ag
O
O
O
OCu
O
OH
HO
O
OH
OH
NN
OO
OO
CuO
OH
HO
O
OH
OH
N N
O OCu
a) b)
c) d)
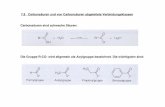
Abb. 2. Beispiele für metallvermittelte Basenpaare: a) Triazol-Ag+-Triazol,11)
b) Hydroxypyridon-Cu2+-Hydroxypyridon,5) c) Pyridin-2,6-dicarboxylat-Cu2+-Pyridin,9) d) Salen-Cu2+.8)
Nachrichten aus der Chemie | 57 | Februar 2009 | www.gdch.de/nachrichten
�Magazin� Metallierte DNA 122

Mögliche Anwendungen
� Metallmodifizierten Nucleinsäu-ren bietet sich die Aussicht auf zahl-reiche Anwendungen. So wurde das Salen-Basenpaar vor dem Hinter-grund entwickelt, dass Komplexe dieses Liganden für ihre heraus-ragenden katalytischen Eigenschaf-ten bekannt und daher häufig in der asymmetrischen Katalyse zu finden sind.8) Von der Kombination eines solchen Metallkomplexes mit dem chiralen Strukturgerüst der DNA er-hofft man sich eine noch höhere En-antioselektivität der katalysierten Reaktion.
Für das Hydroxypyridon-Cu2+- Hydroxypyridon-Basenpaar wurde bereits weiter oben auf die ferromag-netische Kopplung zwischen den Metallionen direkt benachbarter Ba-senpaare hingewiesen.5) Eine Wei-terentwicklung solcher Systeme zu molekularen Magneten ist wohl nur eine Frage der Zeit.
Zum Einsatz metallmodifizierter Nucleinsäuren bei der Generierung von funktionalisierten Netzwerk-strukturen existieren erste Machbar-keitsstudien (Abbildung 4, S. 122).10) Mit 2,2'-Bipyridin als Nucleobase in Kombination mit oktaedrisch koor-dinierenden Metallionen bietet sich die Möglichkeit, drei Doppelhelices zu verknüpfen. So können sich defi-nierte Nanostrukturen bilden. Sol-che Konstrukte wurden als binäre Informationsspeicher und als supra-molekulare Käfigmoleküle zur kon-trollierten Freisetzung eingeschlos-sener Makromoleküle vorgeschla-gen.
Auch eine Anwendung als Metall ionensensor ist denkbar: Bei geeigneter Wahl der DNA-Sequenz erhält man Nucleinsäuren, die in Gegenwart bestimmter Metallionen eine andere Konformation einneh-men als in deren Abwesenheit.11) Diese Konformationsänderung sicht-bar zu machen – etwa durch ein Fluoreszenzsignal – wäre ein Weg zu modular aufgebauten Metallionen-sensoren.
Metallvermittelte Basenpaare sind nicht auf DNA beschränkt. Auch bei anderen Nucleinsäuren und Nu-
cleinsäureanaloga wie RNA,12) PNA (peptide nucleic acid)13, 14) und GNA (glycol nucleic acid)15) gelang der Einbau solcher künstlichen Basenpaare. Es ergibt sich so ein ein-facher Zugang zu strukturell ver-wandten, in den chemischen und den physikalischen Eigenschaften jedoch sehr unterschiedlichen Su-pramolekülen, die sich positions -spezifisch mit Metall ionen funktio-nalisieren lassen.
Literatur
1) J. Müller, Eur. J. Inorg. Chem. 2008, 3749.
2) G. H. Clever, C. Kaul, T. Carell, Angew.
Chem. 2007, 119, 6340.
3) K. Tanaka, M. Shionoya, Coord. Chem.
Rev. 2007, 251, 2732.
4) A. Rakitin, P. Aich, C. Papadopoulos,
Y. Kobzar, A. S. Vedeneev, J. S. Lee, J. M. Xu,
Phys. Rev. Lett. 2001, 86, 3670.
5) K. Tanaka, A. Tengeiji, T. Kato, N. Toyama,
M. Shionoya, Science 2003, 299, 1212.
6) K. Tanaka, G. H. Clever, Y. Takezawa,
Y. Yamada, C. Kaul, M. Shionoya, T. Carell,
Nat.Nanotech. 2006, 1, 190.
7) F.-A. Polonius, J. Müller, Angew. Chem.
2007, 119, 5698.
8) G. H. Clever, K. Polborn, T. Carell, Angew.
Chem. 2005, 117, 7370.
9) S. Atwell, E. Meggers, G. Spraggon,
P. G. Schultz, J. Am. Chem. Soc. 2001,
123, 12364.
10) N. Düpre, L. Welte, J. Gómez-Herrero,
F. Zamora, J. Müller, Inorg. Chim. Acta,
doi: 10.1016/j.ica.2007.12.005.
11) D. Böhme, N. Düpre, D. A. Megger,
J. Müller, Inorg. Chem. 2007, 46, 10114.
12) S. Johannsen, S. Paulus, N. Düpre,
J. Müller, R. K. O. Sigel, J. Inorg. Biochem.
2008, 102, 1141.
13) A. Küsel, J. Zhang, M. Alvariño Gil,
A. C. Stückl, W. Meyer-Klaucke, F. Meyer,
U. Diederichsen, Eur. J. Inorg. Chem.
2005, 4317.
14) R. M. Franzini, R. M. Watson, G. K. Patra,
R. M. Breece, D. L. Tierney, M. P. Hendrich,
C. Achim, Inorg. Chem. 2006, 45, 9798.
15) M. K. Schlegel, L.-O. Essen, E. Meggers,
J. Am. Chem. Soc. 2008, 130, 8158.
Jens Müller, Jahrgang 1971,
ist seit dem Jahr 2008 Profes-
sor für anorganische Chemie
an der Westfälischen Wil-
helms-Universität Münster.
Sein Forschungsinteresse gilt
insbesondere der bioanorganischen Chemie
von Nucleinsäuren.
Nachrichten aus der Chemie | 57 | Februar 2009 | www.gdch.de/nachrichten
Metallierte DNA �Magazin� 123
GDCh-Karriereserviceund StellenmarktVarrentrappstraße 40-4260486 Frankfurt am Main
Tel. 0 69/7917-665Fax 0 69/7917-322
E-Mail [email protected]@gdch.de
STELLENANGEBOTE
VERANSTALTUNGEN
INFORMATIONEN
RUND
UM
STUDIUM
BERUF
UND
KARRIERE