Quantitative CT des Kniegelenks zur Arthrosediagnostik...femoropatellaris). • dem Kniekehlengelenk...
Transcript of Quantitative CT des Kniegelenks zur Arthrosediagnostik...femoropatellaris). • dem Kniekehlengelenk...

Aus dem Institut für Medizinische Physik
Friedrich-Alexander-Universität Erlangen-Nürnberg
Direktor: Prof. Dr. W. A. Kalender
Quantitative CT des Kniegelenks zur
Arthrosediagnostik
Inaugural-Dissertation
zur Erlangung der Doktorwürde
der Medizinischen Fakultät
der Friedrich-Alexander Universität
Erlangen-Nürnberg (Dr. rer. biol. hum.)
vorgelegt von
Peter Zerfaß
aus Stuttgart / Baden-Württemberg


Gedruckt mit Erlaubnis der Medizinischen Fakultät der Friedrich-Alexander-Universität
Erlangen-Nürnberg
Dekan: Prof. Dr. J. Schüttler
Referent: Prof. Dr. Kl. Engelke
Korreferent: Prof. Dr. Dr. h.c. W. Kalender
Tag der mündlichen Prüfung: 14. September 2010


Danksagung Besonderen Dank geht an Prof. Dr. Willi A. Kalender und Prof. Dr. Klaus Engelke
für das interessante Thema, ein anregendes Umfeld und ein immer offenes Ohr.
Dank an Dr. Oleg Museyko, Jing Lu und Fabian Eisa für konstruktiven Input.
An meine Eltern, Geschwister und Freunde für die moralische Unterstützung.
Im Gedenken an meine kürzlich verstorbene Großmutter.

Inhaltsverzeichnis
1 Einleitung und Problemstellung ..............................................1 2 Medizinischer Hintergrund......................................................4
2.1 Medizinische Grundlagen...................................................................................... 4 2.1.1 Definition Arthrose..........................................................................................4 2.1.2 Anatomie des Knies.........................................................................................4 2.1.3. Osteoarthrose des Knies .................................................................................6
2.2 Bildgebung des Knies............................................................................................ 7 2.2.1 Radiographie....................................................................................................7 2.2.2 Magnetresonanztomographie ..........................................................................9 2.2.3 Ultraschall (US).............................................................................................10 2.2.4 CT / QCT.......................................................................................................11
2.3 Diagnostik und Behandlung ................................................................................ 16 2.3.1 Diagnostik......................................................................................................16 2.3.2 Behandlung....................................................................................................18
2.4 Segmentierung medizinischer Daten ................................................................... 18 2.4.1 Thresholding und Regionenwachstumsverfahren .........................................20 2.4.2 Live-wire .......................................................................................................21 2.4.3 Aktive Konturen / Ballons.............................................................................22 2.4.4 Morphologische Operationen ........................................................................23
3 Segmentierung des Knies .......................................................24 3.1 Periosteale / Endosteale Segmentierung.............................................................. 24
3.1.1 Maskenvolumen ............................................................................................25 3.1.2 Periosteale und endosteale Segmentierung ...................................................27
3.2 Segmentierung Wachstumsfuge .......................................................................... 27 3.2.1 Benutzerinteraktion .......................................................................................32 3.2.2 Vorsegmentierung .........................................................................................33 3.2.3 Chainmailing .................................................................................................34 3.2.4 Nachbearbeitung............................................................................................40
3.3 Segmentierung des Gelenkspalts ......................................................................... 41 3.3.1 Chamfer Maps ...............................................................................................41 3.3.2 Definition des Gelenkspaltvolumens.............................................................43
4 Auswertevolumen....................................................................46 4.1 Knochenkoordinatensystem ................................................................................ 46
4.1.1. Fibuladetektion .............................................................................................46 4.1.2. Anatomische Koordinatensysteme ...............................................................47
4.2 Auswertevolumenunterteilung............................................................................. 48
5 Analyse .....................................................................................50 5.1 Einleitung ............................................................................................................ 50
5.1.1 Knochenmineraldichte...................................................................................50 5.1.2 Gelenkspalt ....................................................................................................51
5.2 Texturparameter................................................................................................... 52 5.2.1 Grauwertprofile .............................................................................................53 5.2.2 Entropie .........................................................................................................54 5.2.3 Homogenität ..................................................................................................55 5.2.5 Lokale und Globale Anisotropie ...................................................................56 5.2.6 Fraktale Parameter.........................................................................................58
5.2.6.1 Variogramm........................................................................................... 58

Inhaltsverzeichnis
5.2.6.2 Differentielles Box Counting................................................................. 59
6 Validierung ..............................................................................61 6.1 Einfluss der Maskenvolumen auf die periosteale Segmentierung....................... 62 6.2 Einfluss der Saatpunkte auf die Auswertevolumen............................................. 63 6.3 Einfluss des Rekonstruktionsausschnitts auf das Knochenkoordinatensystem... 65 6.4 Reproduzierbarkeit Inter- / Intraoperator-Vergleich ........................................... 66
6.4.1 Reproduzierbarkeit der Auswertevolumen....................................................66 6.4.2 Reproduzierbarkeit der Analyseparameter ....................................................68
6.5 Diagnostische Relevanz....................................................................................... 72 6.5.1 Gelenkspalt ....................................................................................................73 6.5.2 Kortikales Volumen.......................................................................................74 6.5.3 BMD..............................................................................................................76 6.5.4 Grauwertprofile .............................................................................................76 6.5.5 Entropie .........................................................................................................79 6.5.6 Homogenität ..................................................................................................80 6.5.7 Total Variation...............................................................................................80 6.5.8 Globale Anisotropie.......................................................................................81 6.5.9 Lokale Anisotropie ........................................................................................81 6.5.10 Variogramm.................................................................................................82 6.5.11 Differentielles Box Counting ......................................................................83 6.5.12 Zusammenfassung der diagnostisch relevanten Parameter .........................83
6.6 Diskriminanzanalyse ........................................................................................... 84
7 Diskussion und Ausblick ........................................................87
8 Zusammenfassung...................................................................89
Literaturverzeichnis...................................................................91
Lebenslauf .................................................................................102




1 Einleitung und Problemstellung
Die Kniegelenksarthrose (Gonarthrose) ist eine degenerative, nicht entzündliche
Verschleißerscheinung des Kniegelenks. Beim Auftreten einer synovitischen
Gelenkschwellung oder eines Gelenkergusses spricht man von einer aktivierten
Arthrose. Sie ist eine der volkswirtschaftlich bedeutenden chronischen Krankheiten und
trägt zu einem erheblichen Anteil aller Arbeitsunfähigkeitstage,
Rehabilitationsmaßnahmen und Frühberentungen bei. Im Jahr 2004 wurden in der
Bundesrepublik Deutschland 6,77 Mrd. Euro für die Behandlung aller Arten der
Arthrosen aufgewandt, wobei Kniegelenksarthrosen die häufigste Erkrankungsform
darstellten [89]. Separate Angaben zur Gonarthrose, speziell für Deutschland, sind nicht
verfügbar, jedoch lassen entsprechende Studien aus dem nahen europäischen Ausland
darauf schließen, dass zwischen 5 und 15 Prozent aller Menschen über 55 Jahren an
einer im Röntgenbild auffälligen Kniegelenksarthrose leiden [85].
Die Empfehlung zur Diagnose beschränkt sich derzeit auf planare Röntgenaufnahmen
des Knies in drei Ebenen und der Auswertung von Gelenkspaltbreite sowie der
Beschaffenheit der Knochenoberfläche [116]. Die Struktur des subchondralen Knochens
wird gegenwärtig in der Bewertung des Grades der Osteoarthrose (OA) nicht
berücksichtigt. Verfahren die den Gelenkknorpel direkt abbilden (wie Magnetresonanz-
und Ultraschalluntersuchungen), spielen derzeit in der Diagnostik eine untergeordnete
Rolle [113].
Durch Knorpelabbau bei OA und Schonhaltung auf Grund von Schmerzen entstehen
Veränderungen der Belastungsverhältnisse im Gelenk. Der Knochen reagiert auf diese
Veränderungen mit einer Adaption der Dicht und/oder einer Anpassung der trabekulären
Struktur [15]. Es ist jedoch umstritten, ob zuerst eine Veränderung des Knorpels oder
des subchondralen Knochens eintritt [14, 83, 101, 118].
Dies motivierte die Arbeit aus CT-Aufnahmen Informationen zu extrahieren, mit deren
Hilfe nicht nur die Knochenoberfläche, sondern auch die Knochendichte und
Trabekelstruktur hinsichtlich der Umbauprozesse während des Fortschreitens der
Krankheit evaluiert werden können. Zentraler Bestandteil der Arbeit ist daher die
Segmentierung im Bereich von Femur und Tibia. Vor allem wird auf die Segmentierung
der Wachstumsfuge als unveränderliche Struktur innerhalb des Knochens und der

1 Einleitung und Problemstellung
2
Definition von anatomisch verankerten VOIs eingegangen.
Die bisherigen Arbeiten zur Analyse subchondraler, trabekulärer Strukturen platzieren
Auswertevolumen (volumes of interest, VOIs) relativ zur Knochenoberfläche [10, 16,
48, 95, 111] oder legen diese rein manuell fest [25, 26, 72, 87]. Eine manuelle
Vorgehensweise birgt die Gefahr von Veränderungen der Lage der Auswertevolumen
abhängig von der auswertenden Person. Eine Platzierung relativ zur periostealen
Oberfläche kann zu Variabilität auf Grund von Knochendeformationen als Folge
fortschreitender Krankheit führen. Beides wirkt sich negativ auf die Reproduzierbarkeit
der Ergebnisse aus. Ein Teil der Arbeit motiviert sich folglich aus dem Anspruch,
Knochenkoordinatensysteme zu definieren, welche im Inter-/ Intraoperator-Vergleich
reproduzierbar sind. Allen Verfahren sollten 3D-Agorithmen zugrunde liegen, deren
Ergebnisse bei Bedarf manuell korrigiert werden können. Soweit dem Autor bekannt, ist
dies die erste Arbeit, die OA im klinischen CT an Patientenstudien erforscht und dabei
ausschließlich (fast) vollautomatische 3D-Segmentierungsalgorithmen verwendet.
Die Knochenqualität wird derzeit hauptsächlich als Knochenmineraldichte (bone
mineral density, BMD) erfasst. Adaptionsprozesse betreffen jedoch nicht nur reine
Mineralgehaltsänderungen sondern auch Änderungen der Trabekelstruktur selbst.
Strukturparameter beschreiben die Beschaffenheit des trabekulären Knochens. Arbeiten
auf diesem Gebiet führen üblicherweise eine Binarisierung der medizinischen Daten zur
Extraktion des Trabekelnetzwerks durch [12, 19, 36, 52, 58, 94], um dieses
anschließend durch histomorphometrische Parameter zu beschreiben (trabecular
spacing, trabecular thickness, etc.). Die Wahl des Binarisierungsalgorithmus hat jedoch
erheblichen Einfluss auf die Ergebnisse [28, 102]. Daher soll in dieser Arbeit statt der
üblichen histomorphometrischen Parameter die Textur des subchondralen Knochens
quantifiziert werden. Die Analyse der Texturparameter kann auf eine dedizierte
Binarisierung der trabekulären Strukturen verzichten.
Ein weiteres Kriterium zur Diagnose der OA ist die Verringerung des Gelenkspalts im
Röntgenbild (joint space narrowing, JSN). Da es sich beim Gelenkspalt nicht um eine
eigenständige Struktur im Knie handelt, welche daher auch nicht segmentiert werden
kann, ist eine rein manuelle Bestimmung subjektiv. Es wurde folglich ein Algorithmus
entwickelt, um den Gelenkspalt vollautomatisch zu bestimmen.

1 Einleitung und Problemstellung
3
Kapitel 2 gibt einen Überblick über die Osteoarthrose des Knies. Nach einer Einführung
in die generellen anatomischen Verhältnisse im Kniegelenk wird die Genese der OA
erläutert und es werden spezifische Veränderungen aufgezeigt, anhand derer eine OA
diagnostiziert wird. Im weiteren Verlauf werden verschiedene Bildgebungsmodalitäten
hinsichtlich ihres Einsatzes zur OA Diagnostik betrachtet. Weiterhin findet sich hier ein
Überblick über die gängigen Segmentierungsverfahren für medizinische Bilder.
Kapitel 3 befasst sich mit der Segmentierung des Kniegelenks. Es wird detailliert auf
die Methodik der Segmentierung der periostealen und endostealen Volumen sowie der
Wachstumsfugen für Femur und Tibia eingegangen. Der letzte Abschnitt beschäftigt
sich mit der Bestimmung des Gelenkspalts.
In Kapitel 4 werden die Knochenkoordinatensysteme erläutert und wie diese mit der
Platzierung der Auswertevolumen zusammenhängen.
Kapitel 5 zeigt Algorithmen für die Quantifizierung von Gelenkspalt, Knochendichte
und trabekulärer Struktur auf. Die Analyseverfahren verzichten auf den
Binarisierungsschritt und werden grauwertbasiert durchgeführt.
In Kapitel 6 erfolgt die Validierung der Software. Insbesondere wird die
Reproduzierbarkeit der Analyse untersucht. Weiterhin wird in zwei Gruppe (gesund –
krank) untersucht, in wieweit die hier benutzten Strukturparameter zur Diagnose von
OA sinnvoll eingesetzt werden können
Kapitel 7 fasst die Arbeit zusammen und gibt einen Ausblick auf zukünftige
Erweiterungen.

2 Medizinischer Hintergrund
4
2 Medizinischer Hintergrund
2.1 Medizinische Grundlagen
2.1.1 Definition Arthrose
„Arthrose ist ein über das normale alterungsbedingte Maß hinausgehender
Gelenkverschleiß. Ursache ist meist eine übermäßige Belastung (z.B. Übergewicht),
Fehlstellung der Gelenke (angeboren oder durch Verletzung) oder
Knochenerkrankungen (z.B. Osteoporose). Sie geht mit knöcherner Deformierung der
(primär nicht entzündeten) Gelenke einher (Arthrosis deformans) und tritt auch als
Spätfolge der Arthritis (sekundäre Arthrose) und bei Überbeanspruchung mit
Ergussbildung und sekundärer Entzündung auf“ [89]
Es ist anzumerken, dass es sich hierbei um einen nicht reversiblen, degenerativen
Prozess handelt, für den es bislang keine vollständige Heilungsmöglichkeit gibt. Eine
möglichst frühzeitige Erkennung ist daher wünschenswert, um Maßnahmen treffen zu
können, die dem weiteren Verschleiß entgegenwirken oder ihn zumindest verlangsamen.
2.1.2 Anatomie des Knies
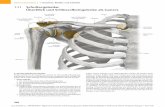
Das Kniegelenk ist das größte Gelenk im menschlichen Körper (Abb.1). Es setzt sich
aus zwei Einzelgelenken zusammen:
• dem Kniescheibengelenk zwischen Femur und Patella (Articulatio
femoropatellaris).
• dem Kniekehlengelenk zwischen den Femurkondylen und dem
Schienbeinknochen (Articulatio femorotibialis).
Genaugenommen gehört auch noch das Gelenk zwischen Wadenbein und Schienbein
zum Knie (Articulatio tibiofibularis). Die vorliegende Arbeit konzentriert sich aber
ausschließlich auf Veränderungen des Kniekehlengelenks.

2.1 Medizinische Grundlagen
5
Abbildung 1: Kniegelenk [38]
Im Schlittengelenk zwischen Femur und Tibia reiten die jeweiligen Kondylen im engen
Kontakt aufeinander. Sie sind von hyalinem Knorpel - einer extrem glatten, weißlichen
Schicht - überzogen. Der Knorpel hat eine charakteristische räumliche Struktur, die ihm
seine hohe Elastizität gegenüber Deformationen verleiht. Nahe am Knochen sind die
Knorpelfasern fast parallel zur Knochenoberfläche ausgerichtet. In mittlerem Abstand
zum Knochen gehen sie mehr und mehr in eine dazu orthogonale Richtung über,
während sie an den Kontaktflächen zwischen den Knorpelschichten von Femur und
Tibia wiederum parallel zur Knochenoberfläche ausgerichtet sind [74]. Der hyaline
Knorpel gilt als immunologisch privilegierte Region, die viele potentielle Autoantigene
enthält, aber weitgehend frei von Immunzellen ist. Da er nicht mit Blutgefäßen
durchzogen ist, und zu dick ist um durch Diffusion alleine versorgt zu werden, müssen
Nährstoffe durch die Walkbewegung während des Gehens bzw. Laufens bis zu den
tiefer liegenden Chondrozyten gepresst werden.
Die Gelenkflächen schließen nicht bündig miteinander ab, was zu einem
ungleichmäßigen Spalt führt. Halbmondförmige Faserscheiben (die Menisken), welche
über Ligamente sowohl mit dem Schienbein als auch mit dem Oberschenkelknochen
verbunden sind, gleichen diese Inkongruenz aus. Stabilisiert wird das Knie durch einen
umfangreichen Bänderapparat welcher hauptsächlich aus den Kreuz- und
Kollateralbändern sowie dem Kniescheibenband besteht. Speziell soll hier noch auf
Strukturen im Ober- bzw. Unterschenkelknochen verwiesen werden: den
Wachstumsfugen (Abb. 2).

2 Medizinischer Hintergrund
6
Abbildung 2: Wachstumsfugen sichtbar als trabekuläre Strukturänderung innerhalb von Tibia und
Femur (Pfeile) [38]
In der embryonalen Entwicklung des Menschen sind die Ober- und
Unterschenkelknochen nicht als Ganzes angelegt sondern als Knorpelstab, dessen Mitte
einen Knochenkern enthält. Nach und nach wird der Knorpel reduziert unter
gleichzeitigem Aufbau von Knochensubstanz. Später füllen sekundäre Knochenkerne
den Epiphysenraum aus. Nach der Geburt geht weiteres Längenwachstum des Knochens
von der Epiphysenfuge aus. Mit Abschluss des Wachstums - mit etwa dem zwanzigsten
Lebensjahr - verknöchert auch dieser Teil. Diese Wachstumsfuge bildet ab diesem
Zeitpunkt somit eine unveränderliche Struktur innerhalb des Knochens [49]. Nach
Verknöcherung der Epiphysenfuge wächst dieser Bereich durch periosteale Apposition,
so dass die Wachstumsfuge im Allgemeinen nicht eindeutig bis zur Knochenoberfläche
definiert ist.
2.1.3. Osteoarthrose des Knies
Bei der Klassifikation des Krankheitsbildes ist zunächst zwischen primärer und
sekundärer Arthrose zu unterscheiden. Bei der primären Arthrose nimmt man eine
Minderwertigkeit des Knorpelgewebes an. So können beispielsweise genetische
Ursachen zu einer fehlerhaften Ausbildung des hyalinen Knorpels führen.
Mögliche Faktoren, die zum Auftreten einer sekundären Arthrose beitragen können,
sind vielfältig. Metabolische Störungen oder trophische Defizite können zu einer

2.2 Bildgebung des Knies
7
verminderten Funktionalität der synovialen Flüssigkeit führen, was die Gleitfähigkeit
bzw. die Versorgung des Knorpels negativ beeinflussen kann. Fehlstellungen des
Gelenks (Varus-/Valgus-Stellung) können Auflageflächen vermindern und somit den
spezifischen Druck an diesen Stellen beträchtlich erhöhen, was zu einer Überbelastung
im Knorpel führt. Übergewicht wirkt sich ähnlich negativ auf die
Belastungsverhältnisse aus [3]. Verschiedene medikamentöse Behandlungen haben
nachteiligen Einfluss auf die Knorpelbeschaffenheit. So führen Antibiotika auf Basis
von Gyrasehemmern in schlecht vaskularisiertem Gewebe zu Chelatbildung und
Knorpelabbau. Letztlich können Änderungen im Knochen selbst, wie etwa eine
Knochendichteverringerung, eine Arthrose begünstigen. Kreuzbandrisse (insbesondere
die des vorderen Kreuzbandes) erhöhen das Risiko, 10 bis 20 Jahre später an einer
Arthrose des Knies zu erkranken deutlich [29]. Die Häufigeitsverhältnisse zwischen
primärer und sekundärer Arthrose sind nicht eindeutig geklärt. Es ist im Einzelfall oft
nicht eindeutig entscheidbar welcher Fall vorliegt. Da die Osteoarthrose anfänglich oft
beschwerdefrei verläuft ist ebenfalls umstritten, ob Knorpel- oder
Knochenveränderungen zuerst auftreten [83].
2.2 Bildgebung des Knies
2.2.1 Radiographie
Planare Röntgenaufnahmen sind derzeit das Standardverfahren zur Arthrosediagnostik
[113]. Es gibt jedoch keine eindeutige Vorgabe über die Stellung des Patienten während
der Aufnahme. Die Aufnahme erfolgt zumeist in anetrior-posterior (a.-p.) Richtung im
Stehen, entweder aufrecht oder unter Flexion des Knies zwischen 30° und 45°. Allein
die Flexion kann hierbei zu einem signifikanten Unterschied der Gelenkspaltbreite bis
zu 2mm führen [42] (Abb. 5). Röntgenaufnahmen bilden für jeden Bildpunkt eine
Summierung der Schwächung jedes einzelnen Volumenelements entlang des Strahlwegs
von der Röntgenquelle zur Aufnahmeebene (Röntgenfilm oder Flachbilddetektor) ab.
Volumetrische Information geht hierdurch verloren. Insbesondere Änderungen der
trabekulären Struktur in Tibia und Femur sind nur schwer zu beurteilen, wenn diese
nicht mit einer wesentlichen Erhöhung oder Verringerung der Knochenmineraldichte
einhergehen. BMD alleine ist nicht eindeutig mit der Veränderung der
Belastungsverhältnisse korreliert, jedoch besteht eine Korrelation zum subchondralen
Knochenverschleiß, welcher im Röntgenbild sichtbar ist [79].

2 Medizinischer Hintergrund
8
Abbildung 3: Planare Röntgenaufnahme eines belasteten Knies aufrecht (links) und unter 30°
Flexion (rechts) [42]
Um den Gelenkspalt unter normierten Positionierungsverhältnissen akkurat zu
vermessen, kommen stereotaktische Frames (z.B. Synaflexer [21, 57]) zum Einsatz
(Abb. 4).
Abbildung 4: Synarflex Frame [17]

2.2 Bildgebung des Knies
9
2.2.2 Magnetresonanztomographie
Die Magnetresonanztomographie, heute im Allgemeinen als magnetic resonance
imaging, (MRI) bezeichnet, nutzt den Eigendrehimpuls sowie das magnetisches
Dipolmoment von –zumeist - Wasserstoff. Durch Anlegen eines starken, statischen
Magnetfelds und Einstrahlen einer charakteristischen Anregungsfrequenz
(Larmorfrequenz) lassen sich die Spins der Wasserstoffatome phasensynchron
auslenken. Die ausgelenkten Dipolmomente induzieren dabei in Empfängerspulen ein
Signal mit charakteristischen Abklingkonstanten T1 (für Spin-Gitter Relaxation) und T2
(für Spin-Spin Relaxation). Gradientenfelder zur Schichtselektion, Phasenkodierung
und Frequenzkodierung ermöglichen ein Zuordnen der einzelnen Signale zu definierten
Raumpunkten. Durch Gewichtung der T1 bzw. T2 Signale in Kombination mit
verschiedenen Anregungspulsformen können verschiedene Gewebearten unterschiedlich
stark hervorgehoben werden.
Da hyaliner Knorpel viel Wasser enthält, eignet sich die Magnetresonanztomographie
zur direkten Abbildung des Knorpelzustands (Abb. 5)
Abbildung 5: Magnetresonanzaufnahme
Die Aufnahmedauer, in der das Knie absolut still gelagert werden muss um
Bewegungsartefakte zu vermeiden, ist relativ hoch (10-15 Minuten). Dies ist für
manchen älteren Patienten nicht zumutbar. Metallimplantate jeglicher Art können in
ihrer Funktion beeinträchtigt werden (z.B: Herzschrittmacher oder Insulinpumpen).
Jegliches Metall im Körper (z.B. nicht abnehmbare Piercings oder implantierte

2 Medizinischer Hintergrund
10
Elektroden) kann durch die induzierten Wirbelströme erwärmt werden, was zu
Verbrennung führen kann. Dies gilt sogar für Tätowierungen auf Basis von
metallhaltigen Pigmenten [63].
Zurzeit ist eine MR-Untersuchung kostenintensiver als die alternativen bildgebenden
Verfahren (Tab. 1). MRI liefert nur Auskunft über das Knorpelvolumen, nicht jedoch
über die Knorpelstruktur. Das Knorpelvolumen ist allerdings nicht linear mit dem
Fortschreiten der Arthrose korreliert, da es in frühen Stadien zu Schwellungen des
hyalinen Knorpels kommen kann. Ein Befund mittels MRI ist daher nicht immer
eindeutig [113]. Durch den hohen Kontrast von Wasser kann MRI Aufschluss über
Entzündungen und Ödeme liefern.
Der Einsatz der MRI beschränkt sich derzeit im Allgemeinen auf medizinische Studien,
die auf Grund von fehlenden vollautomatischen Verfahren einen hohen Anspruch an die
auswertenden Personen stellen [17]. Zur Arthrosediagnostik wird bei der MRT die
Struktur des Knochens momentan nicht herangezogen. Es ist jedoch inzwischen
möglich, die Struktur wiederzugeben, indem man das umgebende Knochenmark
abbildet [27].
2.2.3 Ultraschall (US)
Im Bereich der Arthrosediagnostik lassen sich durch Ultraschallverfahren bereits kleine
Ansammlungen von Flüssigkeiten darstellen. Das Echomuster erlaubt eine
Differenzierung zwischen Verdickung der Gelenkkapsel (Synovialitis) und Synovia-
Vermehrung (z.B. als Folge einer aktivierten Arthrose).
Doppler-Verfahren können zudem Fließgeschwindigkeiten der Flüssigkeiten in der
Struktur sichtbar machen. Partikel, die sich relativ zum Ultraschallkopf bewegen,
verursachen hierbei eine Frequenzverschiebung des zurückgeworfenen Signals [91].
Arthrosen mit sekundärer Entzündungsreaktion/Ergussbildung (aktivierte Arthrosen)
liefern auf Grund von höherem Flüssigkeitsdurchsatz, bei Farbdoppler-Aufnahmen
deutlich höhere Signale als inaktive Gelenkprozesse. Osteophytenbildung und sonstige
oberflächennahe Knochenveränderungen sind im Ultraschallbild ebenfalls zu erkennen.
Nachteilig stellt sich das niedrige Signal-Rauschverhältnis von Ultraschallaufnahmen

2.2 Bildgebung des Knies
11
dar (Abb. 6). Insbesondere im Hinblick auf eine semi-/vollautomatische Auswertung der
Bilder durch computergestützte Algorithmen ist dies problematisch. Ultraschall ist
derzeit nicht für die Verlaufsbeurteilung von arthrotischen Vorgängen validiert [113].
Abbildung 6: Ultraschallaufnahme des Knies [88]
Vorteile von Ultraschalluntersuchungen sind die vergleichsweise geringen Kosten,
weitreichende Verfügbarkeit von Geräten und der geringe zeitliche Aufwand einer
Untersuchung.
2.2.4 CT / QCT
Bei modernen computertomographischen Geräten werden fächerförmig Röntgenstrahlen
von einer Röntgenröhre zu einem gegenüberlegenden Detektor, bestehend aus einem
oder mehreren Detektorzeilen, ausgesandt. Durch Rotation um den Patienten werden
aus verschiedenen Blickwinkeln Fächerprojektionen ermittelt. Für eine vollständige
Rekonstruktion sind Projektionen über mindestens 180° erforderlich, welche mittels
Rückprojektion zu einem dreidimensionalen Datensatz zusammengesetzt werden [84].
Jedem Volumenelement (Voxel) wird ein Hounsfield-Wert (HU) zugewiesen welcher als
Grauwert im Bild kodiert wird. Die Auswahl eines Faltungskerns während der
Rekonstruktion bestimmt in wie weit ein Kompromiss zwischen Schärfe und Rauschen
eingegangen wird. Ein harter Faltungskern zeigt mehr Details verstärkt jedoch im
Gegenzug das Bildrauschen (Abb. 7)

2 Medizinischer Hintergrund
12
Abbildung 7: Rekonstruktion mit weichem (links) und hartem Faltungskern (rechts)
Volumetrische Aufnahmen erfolgen durch den Vorschub des Tisches, auf dem der
Patient liegt, bzw. durch Bewegen der rotierenden Anordnung entlang der Längsachse
des Patienten. Dies führt zu einer spiralförmigen Aufnahme des gesamten Volumens.
Rekonstruktionen definierter Schnittebenen werden durch Interpolation errechnet.
Die Auflösung eines CT-Geräts wird durch die Punktbildfunktion (point spread
function) charakterisiert. Diese wird durch die Abbildung eines dünnen Drahts in
Richtung der Rotationsachse ermittelt. Die Punktbildfunktion führt zu einem
Verschmieren scharfer Kanten im Aufgenommenen Bild und hat somit direkten Einfluss
auf die erreichbare Auflösung.
HU und Knochenmineraldichte (bone mineral density, BMD) sind linear voneinander
abhängig. Durch gleichzeitige Aufnahme eines Referenzphantoms mit bekannter
äquivalenter Knochendichte lässt sich die Knochenmineraldichte von Auswertevolumen
nicht nur qualitativ sondern auch quantitativ wiedergeben. Wir verwenden das von
Kalender entwickelte Osteo-Phantom [7]. Es enthält in seinen 2 Kammern zum einen
wasseräquivalentes Polyethylen, zum anderen eine definierte Konzentration von
200mg/cm3 Kalziumhydroxylapatit. (Abb. 8, links).

2.2 Bildgebung des Knies
13
Abbildung 8: Referenzphantom mit 2 Kammern (links), Rekonstruktionen mit kleinerem
Bildausschnitt und unterschiedlichen Faltungskernen (mitte, rechts)
Die Bestimmung von BMD erfolgt über die gerätespezifische Kalibriergleichung:
mCTCTBMD gemgem ⋅∆+= )(
Mit ∆CT als der Differenz zwischen Messwert der wasseräquivalenten Phantomkammer
und dem CT-Nominalwert:
0CTCTCT soll −=∆
Und der Steigung m der Kalibriergerade aus:
02000200
0200 200
CTCT
S
CTCT
BMDBMDm
−⋅=
−−
=
Hierbei sind CT0 und CT200 die gemessenen CT-Werte der beiden Kammern und S der
Korrekturparameter des Phantoms. Der Korrekturparameter wird für jedes Phantom
einzeln ermittelt und beinhaltet den Effekt von Konzentrationsschwankungen bei der
Herstellung.
Die effektive Strahlendosis einer CT Aufnahmen des Knies (ca. 0,17mSv) [109] sind
zwar höher als bei planaren Röntgenaufnahmen (etwa 0,015mSv), jedoch liegt die
effektive Dosis noch unter der mittleren jährlichen Belastung aus natürlichen Quellen
von 2-3 mSv [7].
Im Bereich der Osteoporoseforschung gibt es eine Vielzahl von Arbeiten, die sich mit
der Analyse der Trabekelstruktur unter Verwendung von CT-Daten beschäftigen [55, 61,

2 Medizinischer Hintergrund
14
67]. Es liegt daher nahe zu untersuchen, ob ähnliche Veränderungen bei Osteoarthrose
in longitudinalen oder lateraler Studien auftreten.
Mikro-CT-Aufnahmen und histologischen Untersuchungen zeigen, dass sich die
subchondrale Knochendicke bei auftretender OA verringert [81, 84] (Abb 9).
Abb 9: Histologische Schnitte einer Tierkadaver-Studie (Labradorhunde) ohne OA (links) und
mit OA (rechts) [84]
Ebenso hat eine Patientenstudie bei rheumatischer Arthritis bereits vor Einsetzen von
oberflächlichen Knorpelveränderungen eine Verringerung der gelenknahen
Knochenmasse festgestellt [81]. Auch bei einem Riss des vorderen Kreuzbandes,
welches ein häufiger Auslöser für eine spätere OA ist, konnte eine Adaption der
Knochendichte beobachtet werden [13]. Es besteht daher Grund zur Annahme, dass
auch bei OA im CT-Bild eine messbare Änderung der Knochenparameter eintreten wird.
In dieser Arbeit wurde untersucht ob eine solche Änderung mittels klinischer CT-
Aufnahmen quantifizierbar ist.

2.2 Bildgebung des Knies
15
In Tabelle 1 sind die verschiedenen Aufnahmemodalitäten einander gegenübergestellt.
Methode MRT US Röntgen CT
Analyse Weichgewebe,
Knochen-oberfläche
Weichgewebe, Knochen-oberfläche
Knochen-oberfläche,
BMD, Gelenkspalt
Knochen-oberfläche,
BMD, Gelenkspalt,
Trabekel-struktur
Dauer 10-20 Minuten sofort sofort <30 Sekunden
Auflösung hoch (0,5mm) gering mittel
(wegen Super-position)
hoch (0,3mm)
Signal/Rausch-Verhältnis
hoch niedrig hoch hoch
Kontraindikation
Metall und implantierte Geräte
- - Metall
Kosten [59] 140€ 12€ 13€ ca. 110€ Strahlenbelastung
- - ca. 0,015mSv Ca. 0,17mSv
Verfügbarkeit gering hoch hoch mittel
Tabelle 1: Zusammenfassende Gegenüberstellung der bildgebenden Verfahren
Die Daten auf die sich diese Arbeit bezieht wurden im Rahmen der multizentrischen,
randomisierten POLKA (Protelos evaluation in knee osteoarthritis) Studie
aufgenommen (Tab. 2). Protelos ist ein Strontiumranelat, das in der Osteoporosetherapie
angewandt wird. Es soll im Rahmen der Studie auf Effektivität hinsichtlich OA
untersucht werden.
Scanner Siemens Sensation 4 und Siemens Sensation 64
Kathodenspannung 120kV
Röhrenstrom 255mAs
Gantry tilt 0°
Pitch 1
Tischhöhe 150cm
Rekonstruktionsfelder 190mm, 130mm, 130mm (zentriert auf Gelenkspalt)
Faltungskerne u40, u40, u70
Kollimation 0,5mm
Rekonstrierte Voxelgröße 0,25mm x 0,25mm x 0,3mm
Rekonstruktionsmatrix 512 x 512
Patientenlage FFS (feet first supine)
Tabelle 2: Scanprotokoll der POLKA Studie

2 Medizinischer Hintergrund
16
2.3 Diagnostik und Behandlung
2.3.1 Diagnostik
Das Standardverfahren bei Verdacht auf Osteoarthrose sind nach wie vor planare
Röntgenaufnahmen. Bei unklarem Befund wird im Allgemeinen eine MRI-
Untersuchung veranlasst [113].
Die Schwere der Krankheit wird über die Kellgren-Lawrence-Skala (KL-Skala)
bewertet [56]. Die Beschreibung ist jedoch nicht eindeutig, da inzwischen mehrere
unterschiedliche Varianten der Skala in der Literatur publiziert sind [92].
Auf der KL-Skala werden 4 Stadien unterschieden:
Grad 1: Mögliche Verringerung des Gelenkspalts, möglicherweise
Osteophytenbildung
Grad 2: Sichtbare Verringerung des Gelenkspalts, sichtbare Osteophytenbildung
Grad 3: Sichtbare Verringerung des Gelenkspalts, deutliche Osteophytenbildung,
beginnende Sklerose des Knorpels, möglicherweise Deformation der periostealen
Oberfläche
Grad 4: Deutliche Verringerung des Gelenkspalts, ausgeprägte
Osteophytenbildung, starke Sklerotisierung des Knorpels, und sichtbare Deformation
der periostealen Oberfläche
Es ist anzumerken, dass die KL-Skala keine Aussage darüber macht, in welcher Lage
das Knie aufgenommen wurde. Ein wesentlicher Faktor in der Auswahl eines KL-
Grades ist die Verminderung der Gelenkspaltbreite (joint space narrowing, JSN).
Studien zeigen, dass der Beugewinkel und auch die Belastungsverhältnisse während der
Aufnahme erheblichen Einfluss auf die Bewertung des JSN haben können [3, 63, 112].
Alternativ zur KL Skala kann eine Bewertung über die Ahlbäck Skala erfolgen [1].
Hierzu werden zwei Aufnahmen (anterior-posterior und sagittal) unter Belastung des
Knies angefertigt.

2.3 Diagnostik und Behandlung
17
Grad 1: Verringerung des Gelenkspalts (Gelenkspalt <3mm)
Grad 2: Gelenkspalt stellenweise nicht mehr messbar
Grad 3: Kleinere Läsionen der Knochenoberfläche (<5mm)
Grad 4: Moderate Läsionen der Knochenoberfläche (5-10mm)
Grad 5: Ausgeprägte Läsionen der Knochenoberfläche (>10mm)
Grad 1 der Ahlbäck-Skala entspricht in etwa einem Grad 3 auf der KL-Skala, während
Ahlbäck-Grade 2-5 auf der KL-Skala einem Grad 4 zugeordnet werden. Somit lässt sich
über die KL-Skala eine differenziertere Aussage über das Frühstadium der Krankheit
geben, während die Ahlbäck Skala die Veränderungen bei fortgeschrittener OA genauer
charakterisiert.
Patienten gehen üblicherweise erst nach Auftreten von Beschwerden zur Untersuchung.
Die Korrelation zwischen Schmerzempfinden und Grad der Arthrose ist jedoch
umstritten. Während einige Studien eine Verbindung zwischen Schmerzen und
Fortschritt der Krankheit zeigen [41, 99] ist bei anderen keine signifikante
Korrelationen zu erkennen [86, 108].

2 Medizinischer Hintergrund
18
2.3.2 Behandlung
Behandlungsansätze werden individuell auf den Patienten zugeschnitten. Dies erfolgt in
Abhängigkeit von der Ursache - falls diese bekannt ist - dem Alter und dem Grad der
Arthose. In frühen Stadien kann eine Physiotherapie und eine Änderung der
Belastungsverhältnisse (z.B. durch orthopädische Einlagen) ein Fortschreiten Der
Krankheit verlangsamen. Im Allgemeinen wird eine Kräftigung des Muskel- und
Sehnenapparates empfohlen, um die Belastung des Kniegelenkknorpels zu verringern.
Die Gleiteigenschaften des Kniegelenks können durch das Einbringen von
Hyaluronsäure temporär verbessert werden. Bei fortgeschrittener Erkrankung sind
operative Eingriffe indiziert. Diese reichen von minimalinvasiven Ansätzen
(Arthroskopie mit begleitender Knorpelglättung, Abrasionscherondoplastik und
Mikrofrakturierungen zur Erzeugung von Narbengewebe) über Umstellungsoperationen
zur Verringerung von Varus-/Valgustellungen bis hin zum kompletten Ersatz des
Gelenks durch eine Gelenkprothese [80].
2.4 Segmentierung medizinischer Daten
Die Segmentierung medizinischer Daten ist der Prozess, durch den einzelne
Bildelemente eines medizinischen Datensatzes, einer Gewebeklasse oder anatomische
Struktur zugeordnet werden. Das Ziel ist es durch die Segmentierung Regionen zu
extrahieren, die in anschließenden Schritten gesondert behandelt werden. Einerseits
erlaubt dies die dedizierte Analyse von funktional zusammengehörenden Unterregionen,
andererseits können durch die so gewonnene Reduktion des Suchraums weitere
Verarbeitungsschritte wesentlich effizienter durchgeführt werden.
Medizinische Datensätze stellen eine besondere Herausforderung für die Segmentierung
dar. Häufig werden bei der Aufnahme Kompromisse zwischen Auflösung bzw. Signal-
Rauschverhältnis und dem zumutbarem Energieeintrag (Strahlenbelastung bei
Röntgenverfahren, sowie Wärmeenergie bei Ultraschall) oder Aufnahmedauer (MRI)
eingegangen. Artefakte, die bei den verschiedenen Modalitäten auftreten, kommen
erschwerend hinzu.
Unterschiedliche Gewebearten, die im Bild durch ähnliche Grauwerte wiedergegeben
werden, lassen sich nur schwer voneinander trennen. Bei MR-Aufnahmen sind dies

2.4 Segmentierung medizinischer Daten
19
Gewebe mit ähnlichen Wasserstoffkonzentrationen. In CT-Aufnehmen sind es
Strukturen mit ähnlicher Schwächung, die einen geringen Kontrast aufweisen.
Das Einbringen von Kontrastmitteln oder eine Veränderung des Aufnahmeprotokolls
(T1/T2-Gewichtung, verschiedene Spin/Echo Sequenzen bzw. Wahl einer anderen
Kathodenspannung) ermöglichen in vielen Fällen eine Erhöhung des Gewebekontrasts.
Es existiert derzeit kein Standardsegmentierungsverfahren, das bei allen
Fragestellungen der medizinischen Segmentierung befriedigende Ergebnisse liefert.
Daher ist es notwendig für jede spezielle Anwendung die gängigen Verfahren an die
vorliegenden Daten anzupassen bzw. Hybridverfahren zu entwickeln, die die Vorzüge
mehrerer Methoden vereinen.
Segmentierungsverfahren lassen sich z.B. nach dem Grad des eingebrachten Vorwissens
über die zu segmentierende Struktur in verschiedene Klassen unterteilen [60, 60, 82]
(Tab. 3).
Vorwissen Beispielalgorithmen
Kein Vorwissen
• Manuelle Segmentierung
• Schwellwertverfahren
• Regionenwachstumsverfahren
Lokale Grauwertschwankung • Live-wire
• Lokale, adaptive Schwellwerte
Form-/ Strukturinvarianz • Erwartungsmaximierung (z.B.
neuronale Netze oder Markov random field Klassifikator )
Globale Form • Aktive Konturen (Snakes, Balloons)
• Level-set Verfahren
Lokale Geometrie • Hierarchische Abstandsverfahren
Globales anatomisches Modell • Atlas basierte Verfahren
• Shape models
Tabelle 3: Überblick Segmentierungsverfahren

2 Medizinischer Hintergrund
20
Die meisten der in Tabelle 3 Aufgeführten Verfahren (atlasbasierte Segmentierung,
aktive Konturen, Schwellwertverfahren, Regionenwachstum, Klassifikatoren,
manuelle/schichtweise Segmentierung, etc.) wurden in der Literatur bereits zur
Segmentierung des Knies angewandt [98].
In der hier vorliegende Arbeit wurde Wert auf eine möglichst automatische
Segmentierung unter Verwendung von 3D-Verfahren gelegt. Im Folgenden soll auf
einige Segmentierungsverfahren gesondert eingegangen werden, die im Verlauf der
Arbeit zur Anwendung kamen.
2.4.1 Thresholding und Regionenwachstumsverfahren
Thresholding-Verfahren klassifizieren eine Struktur nach Zugehörigkeit der Bildpunkte
zu einem definierten Grauwertbereich. Dieser Wertebereich kann entweder vorgegeben
sein oder adaptiv nach den lokalen Gegebenheiten berechnet werden (z.B. über ein
lokales Histogramm) [96]. Thresholding alleine garantiert nicht, dass die gefundenen
Regionen zusammenhängend sind.
Regionenwachstumsverfahren nutzen zusätzlich Nachbarschaftsbeziehungen zwischen
den einzelnen Bildpunkten. Ausgehend von einem oder mehreren Saatpunkten werden
die benachbarten Volumenelemente (Voxel) auf Zugehörigkeit zur selben Gewebeklasse
untersucht. Das Verfahren wird iterativ auf die neu gefundenen Voxel angewandt bis
keine neuen Elemente mehr gefunden werden [40]. Regionenwachstumsverfahren
garantieren ein zusammenhängendes Gebiet, sind jedoch häufig nicht in der Lage sich
berührende Regionen mit ähnlichen Grauwerten voneinander zu trennen.
Zur Segmentierung von Strukturen mit deutlichem Kontrast zu ihrem Umfeld haben
sich auf diesen beiden Verfahren basierende Ansätze bewährt. Schwacher Kontrast zu
benachbarten Regionen führt allerdings zu Auslaufen (Regionenwachstumsverfahren)
oder Übersegmentierung (Thresholding). Starke Grauwertschwankungen innerhalb der
Struktur selbst können zudem zu einem Problem bei der Wahl des zulässigen
Grauwertbereichs führen.

2.4 Segmentierung medizinischer Daten
21
2.4.2 Live-wire
Live-wire [5] ist ein semiautomatischer Algorithmus, der einen optimalen Pfad
zwischen einem benutzergewählten Anfangs- und Endvoxel sucht. Für jeden Grauwert
oder Grauwertübergang wird ein Kostenwert definiert. Ein Dijkstra- oder A*-
Algorithmus [22, 97] ermittelt den Pfad, welcher die Summe aller berührten
Kostenwerte minimiert.
In Pseude-Code stellt sich der Algorithmus folgendermaßen dar:
Gegeben sei ein Netzwerk G(N, E) aus N Knoten und E Kanten und positiven Kosten
Dij für jeden Übergang zwischen benachbarten Knoten i,j aus N. Der kürzeste Pfad
zwischen einem Startvoxel (S) und der Menge aller Knoten (P) ergibt sich dann anhand
der folgenden Vorgehensweise:
Schritt 1:
NjfürdDDSP SjsjS ∈=== ≠,0},{
Finde den nächsten Nachbarn j ∉ P so dass:
jPj
i DD∉
= min
Setze }{ iPP ∪=
Falls P bereits alle Voxel im Suchraum enthält wird abgebrochen bzw. bei einer Suche
zwischen zwei dedizierten Punkten wird abgebrochen, sobald der Zielvoxel in P
enthalten ist.
Ursprünglich für eindimensionale Kantendetektion konzipiert, sind inzwischen auch
Varianten erprobt, die 2D Konturen bzw. 3D Objekte segmentieren können [39, 77].
Live-wire zeichnen sich durch Robustheit gegenüber Fehlstellen in der Struktur und, bis
zu einem gewissen Grad, gegenüber Rauschen aus. Allerdings erfordert der Algorithmus
ein hohes Maß an Benutzerinteraktion sowie eine sorgfältige Auswahl der Parameter für
die Kostenfunktion.

2 Medizinischer Hintergrund
22
2.4.3 Aktive Konturen / Ballons
Aktive Konturen-Verfahren führen ist die Segmentierung eines Gebietes, ausgehend von
einer Anfangskontur durch. Die Kontur wird auf Grund eines Energieterms deformiert
[32, 54, 66].
Parameterdarstellung einer Kurve:
3)( ℜ→sc mit
=)(
)(
)(
)(
sz
sy
sx
sc
wobei c(s) zweimal stetig differenzierbar sei.
Der Energieterm setzt sich aus innerer Energie S(c) und äußerer Energie P(c)
zusammen.
)()()( cPcScE +=
mit der inneren Energie:
dss
c
s
ccS
2
2
2
2
1
0
12
1)(
∂∂+
∂∂= ∫ ωω
und der äußeren Energie:
))(),(),(())(),(),(())(( 3 szsysxIszsysxPscP ∇−== ω
(wobei I(x,y,z) die Intensität des Voxles mit den Koordinaten x,y,z bezeichnet)
ergibt sich die Gesamtenergie:
∫∫ +
∂∂+
∂∂=
1
0
2
2
2
2
1
0
1 ))((2
1)( dsscPds
s
c
s
ccE ωω
mit ω1, ω2, ω3 als Gewichtungsparameter.

2.4 Segmentierung medizinischer Daten
23
Das Verfahren berechnet für eine Initialkontur eine Energie E*(c). Durch Variation der
einzelnen Knoten ändert sich der Energieterm bis eine Konfiguration erreicht ist, bei der
die Gesamtenergie minimal wird.
Aktive Konturen benötigen eine gute Initalkontur, sowie eine gute Parametrisierung der
einzelnen Kräfte. Einerseits macht die Natur der Parametrisierung sie robust gegenüber
Bildrauschen, andererseits ist durch die Initialkontur die Topologie der Struktur bereits
vorgegeben, was sich besonders bei pathologisch veränderten Strukturen als Problem
erweisen kann. Besonders der hohe Parametrisierungsaufwand erschwert einen Einsatz
als vollautomatisches Segmentierungsverfahren bei stark heterogenen Strukturen wie
den Wachstumsfugen (siehe Kap. 3.3).
2.4.4 Morphologische Operationen
Die in dieser Arbeit angewandten Dilatations- und Erosionsoperatoren sind strikt
genommen keine eigenständigen Segmentierungsverfahren. Sie werden jedoch häufig
im Verbund mit anderen Verfahren eingesetzt um glattere Oberflächen zu gewährleisten
und kleinere Fehlstellen zu korrigieren. Prinzipiell handelt es sich hierbei um
Nachbearbeitung der Kontur segmentierter Binärvolumen mit einem binären
Faltungskern definierter Größe und Form [29]. Zentriert um jedes Konturvoxel werden
die Voxel des Faltungskerns addiert (Dilatation) bzw. subtrahiert (Erosion). Ein Opening
besteht aus einem Erosions- mit anschließendem Dilatationsschritt und ermöglicht es
kleinere Inseln aus einzelnen Voxeln zu entfernen sowie Spitzen im
Segmentierungsvolumen abzuschneiden. Closing verwendet die Operatoren in
umgekehrter Reihenfolge um kleine Löcher zu schließen oder unterbrochene Strukturen
zu verbinden. Es gibt noch weitere morphologische Operationen (z.B. Hit-and-Miss,
Sobel Operator, etc.) die aber im Rahmen dieser Arbeit keine Anwendung fanden.

3 Segmentierung des Knies
24
3 Segmentierung des Knies
3.1 Periosteale / Endosteale Segmentierung
Wesentlicher Bestandteil der Arbeit ist die Segmentierung des Knies, der
Wachstumsfuge und des Gelenkspalts. Abbildung 10 zeigt den Verlauf der Analyse so
wie er in dieser Arbeit implementiert wurde und in den folgenden Abschnitten im Detail
besprochen wird.
Abbildung 10: Überblick Programmablauf

3.1 Periosteale / Endosteale Segmentierung
25
Ziel des Segmentierungsschritts ist es, eine richtige und wiederholbare Segmentierung
der relevanten Strukturen zu gewährleisten. Zur Extraktion der Tibia- und
Femuroberflächen wurde ein Algorithmus adaptiert, wie er zur Segmentierung des
proximalen Femur in [56] beschrieben wurde. Zunächst wird dem Benutzer der
Datensatz in MPR-Ansichten (multiplanar reconstruction) präsentiert (Abb. 11).
Abbildung 11: Kniedatensatz in sagittaler, koronaler und transversaler Ansicht
3.1.1 Maskenvolumen
Zunächst müssen Femur und Tibia getrennt voneinander segmentiert werden. Die
eigentliche Segmentierung beginnt mit einem Regionenwachstumsverfahren. Wie in
Kapitel 2.4.1 beschrieben, besteht beim Regionenwachstumsverfahren die Gefahr, dass
der Algorithmus von einer Struktur in eine andere überspringt, wenn diese sich berühren
oder durch Artefakte oder Bildrauschen scheinbare Verbindungen hergestellt werden.
Fortschreitende OA zeichnet sich durch eine Verringerung des Gelenkspalts, Ausbildung
von Osteophythen und eine asymmetrische Schonhaltungen aus. Diese Veränderungen
gehen mit einer medialen und/oder lateralen Reduktion des Abstands der
Gelenkoberflächen einher, was die Gefahr eines Überspringens des Algorithmus von
Femur zu Tibia erhöht (Abb. 12). Auch können Kalzifizierungen des Knorpels ähnliche
Grauwerte aufweisen wie Knochenmaterial und somit eine scheinbare Brücke zwischen
den zu segmentierenden Knochen bilden. Um dieses Überspringen zu verhindern,
werden vom Benutzer zwei Kugeln als Maskenvolumen in den Datensatz eingebracht –
üblicherweise im Bereich der Femurkondylen. Die Größe der Kugeln ist frei wählbar.
Bei Bedarf können die Kugeln zu 3D Rotationsellipsoiden deformiert werden.
y
z
x
z
x
y

3 Segmentierung des Knies
26
Abbildung 12: Durch Osteophyten verringerter Gelenkspalt (links, Pfeil). Kalzifizierung im
Gelenkspalt (mitte, Pfeil), Bildrauschen (rechts)
Das Volumen der Kugeln wird vom ersten Segmentierungsschritt ausgenommen.
Beginnt man also mit der Segmentierung der Tibia so können diejenigen Knochenteile
des Femurs, die sich in unmittelbarer Nähe zur Tibia befinden, maskiert werden (Abb.
13) [115].
Abbildung 13: Maskenvolumen
Eine der Kugel dient zudem als Region, innerhalb der ein Histogramm für die
nachfolgende Segmentierung berechnet wird. Zur Festlegung der minimalen und
maximalen Schwellwerte für das nachfolgende Regionenwachstumsverfahren wird ein
Fitting zweier Gaußscher Normalverteilungen an das Histogramm durchgeführt. Um
genug Weichgewebe für das Histogramm mit einzubeziehen, und somit die Berechnung
der Schwellwerte für das Regionenwachstumsverfahren robuster zu machen, wird diese
Kugel um den Faktor 1,5 vergrößert. Dieses Verfahren wurde analog schon bei der
Segmentierung des proximalen Femurs angewandt [53].

3.2 Segmentierung Wachstumsfuge
27
3.1.2 Periosteale und endosteale Segmentierung
Die Segmentierung der periostealen Oberfläche wird durch das Setzen zweier
Saatpunkte -jeweils einen im kortikalen Bereich des Femurs und einen im kortikalen
Bereich der Tibia- initiiert. Zunächst wird die Tibiaoberfläche mittels eines
Regionenwachstumsverfahrens mit adaptivem Schwellwert grob vorsegmentiert [53,
71]. In einem zweiten Schritt wird die Oberfläche mittels morphologischer Operationen
(closing) und einem automatischen, schichtweisen filling fein segmentiert. Zuletzt wird
über einen marching cube Algorithmus [68] die Oberfläche extrahiert und mit einem
smoothing Filter nachbearbeitet.
Anschließend wird die segmentierte Tibiaoberfläche als Maskenvolumen gesetzt und
derselbe Algorithmus segmentiert die periosteale Oberfläche des Femurs (Abb. 14,
links).
Abbildung 14: Periosteale (links) und endosteale Segmentierung (rechts)
3.2 Segmentierung Wachstumsfuge
Aus Studien im Bereich der Osteoporose ist bekannt, dass sich z.B. die Knochendichte
(BMD) altersabhängig ca. 1% pro Jahr ändert [4, 105]. Dies erfordert eine präzise
Segmentierung. Messverfahren mit denen Knochendichte oder auch
Strukturunterschiede quantifiziert werden sollen müssen also einen sehr kleinen
Reproduzierbarkeitsfehler aufweisen.

3 Segmentierung des Knies
28
Das bedeutet, dass die Auswerteregionen (VOIs) in den Datensätzen der Initial- und
Folgeuntersuchungen am selben Ort positioniert werden müssen. Dies kann mit Hilfe
von wieder auffindbaren Fixpunkten gewährleistet werden, an denen sich die Lage der
VOIs orientiert. Fixpunkte können manuell gesetzt oder automatisch gefunden werden.
Es ist allerdings wünschenswert ein automatisches Verfahren zu entwickeln, das diese
Fehlerquelle zwischen verschiedenen Anwendern minimiert.
Osteoarthrose ab einem Kellgren-Lawrence Grad von 2 zeichnet sich durch eine
Veränderung der Knochenoberfläche aus, so dass dort keine verlässlichen Punkte für die
Verankerung des Koordinatensystems als invariant vorausgesetzt werden können (Abb.
15).
Abbildung 15: Veränderungen der Knochenoberfläche. Osteophyten (links). MR-Aufnahme mit
Geröllzyste (rechts) [73]
Mögliche Unterschiede der Positionierung des Knies während der beiden Aufnahmen in
longitudinalen Studien schließen zudem die Nutzung von Fixpunkten im proximalen
Femur bzw. der distalen Tibia aus. Es kann nicht gewährleistet werden, dass identische
Bereiche in beiden Aufnahmen abgebildet werden. Auf der Knochenoberfläche im
Bereich zwischen Gelenkspalt und Wachstumsfuge konnte kein typisches Merkmal
identifiziert werden, das einer vollautomatischen Segmentierung zugänglich ist.
Eine Lösung besteht in der Nutzung einer Struktur innerhalb des Knochens nahe des
Gelenks: der Wachstumsfuge (siehe Kap. 2.1.2). Die Ausbildung dieser Struktur ist mit
etwa dem zwanzigsten Lebensjahr abgeschlossen und verändert sich danach nicht mehr

3.2 Segmentierung Wachstumsfuge
29
[49]. Dies stellt keine Einschränkung der Einsetzbarkeit der Software dar, da
Osteoarthrose eine Krankheit ist, die fast ausschließlich ältere Menschen betrifft.
Als Ausgangsdaten stehen 2 Rekonstruktionen der CT Aufnahme mit unterschiedlichem
Faltungskern zur Verfügung (siehe Kap. 2.2.4). Für die Segmentierung der
Wachstumsfuge wurde die Rekonstruktion mit Hilfe des weichen Kerns gewählt. Grund
für diese Wahl ist das geringere Bildrauschen und verminderte Störeinflüsse durch die
weniger auffällige Trabekelstruktur.
Die Wachstumsfuge ist generell als lokale Veränderung der Trabekelstruktur im
Metaphysenbereich zwischen Diaphyse und Epiphyse zu erkennen. Erschwerend wird
die Segmentierung dadurch, dass dieser Übergang nicht immer durchgängig sichtbar ist.
Selbst bei sichtbarer Wachstumsfuge ist deren Charakterisierung nicht trivial, da im CT-
Bild der Kontrast stark variieren kann (Abb. 16 oben, mitte). In manchen Datensätzen
ist sie nur stückweise oder fast gar nicht sichtbar (Abb. 16, unten).

3 Segmentierung des Knies
30
Abbildung 16: Sagittale und koronale Ansicht verschiedener Datensätze mit kontrastreicher
(oben) und kontrastarmer Wachstumsfuge (mitte, unten)
In der Umgebung der periostealen Oberfläche ist die Position der Wachstumsfuge oft
nicht vorhanden, da hier der Knochen nach Abschluss des Zusammenwachsens von
Epiphyse und Diaphyse durch periosteale Apposition wächst. Im CT-Bild ergibt sich
folglich häufig der Eindruck eines Auffächerns der Wachstumsfuge zur
Knochenoberfläche hin (Abb. 17).
Abbildung 17: Unbestimmtheit der Wachstumsfuge nahe der periostealen Oberfläche (Pfeile)

3.2 Segmentierung Wachstumsfuge
31
Anforderungen an das Segmentierungsverfahren:
• minimale Benutzerinteraktion
• lokal kontrastarme Bereiche der Wachstumsfuge können überbrückt werden
• robust gegen globale Kontrastverminderung
• automatischer Ausschluss von Randgebieten
Zunächst wurden zwei Standardverfahren zur Segmentierung der Wachstumsfuge
erprobt. Im Rahmen einer vorangegangener Doktorarbeiten am Institut [71] wurde
bereits ein Algorithmus zur Verwendung von aktiven Konturen implementiert. Es
konnte jedoch keine geeignete Parametrisierung der Bildkräfte gefunden werden,
welche eine zuverlässige Segmentierung der Struktur gewährleistete. Zudem ist der
manuelle Aufwand zur Definition einer guten Initialkontur unverhältnismäßig hoch. In
manchen Datensätzen ist die Wachstumsfuge über weite Bereiche kontrastarm und
somit ist dort ein Anhalten der aktiven Kontur nicht gesichert. Bei großen Löchern kann
es in diesem Fall zu Ausstülpungen der Kontur kommen, die je nach Lage der
Initialkontur und Kraftrichtung in die Epiphyse bzw. in die Diaphyse hineinreichen.
Als Zweites wurde ein Live-wire Ansatz verfolgt. Ausgehend von einem zentralen
Saatpunkt sollten radial Strahlen bis zur endostealen Grenzfläche gefunden und
anschließend zu einer Oberfläche ergänzt werden. Wie beim aktiven Konturenansatz
konnte keine geeignete Parametrisierung für den Energieterm gefunden werden, die
stabile Ergebnisse lieferte. Das Fehlen eines definierten Endpunktes auf der Oberfläche
des endostealen Volumens erfordert einen unvertretbar hohen Benutzeraufwand, da alle
Endpunkte manuell gesetzt werden mussten.
Zur Lösung des Problems wurde ein neuer Segmentierungsalgorithmus auf Basis eines
von innen nach außen wachsenden Chainmails entwickelt.

3 Segmentierung des Knies
32
3.2.1 Benutzerinteraktion
Die Chainmailsegmentierung initiiert der Benutzer durch das Setzen eines Saatpunkts in
der Wachstumsfuge (Abb. 18, links). Es ist zweckmäßig - jedoch nicht zwingend
erforderlich - diesen ungefähr in die Mitte der Wachstumsfuge zu legen. Der Saatpunkt
hat zweierlei Funktion:
• Es wird durch ihn diejenigen Region eingeschränkt, in welcher nach der
Wachstumsfuge gesucht wird.
• Der Saatpunkt dient als Ankerpunkt für die Datenstruktur, die zur
Segmentierung benutzt wird.
Bei Wachstumsfuge mit geringem Kontrast kann der anfängliche Saatpunkt dem
Algorithmus eine wichtige Hilfestellung geben, da er automatisch als ein korrekt
identifizierter Punkt auf der Wachstumsfuge angenommen wird. Die Auswirkung einer
Fehlplatzierung des Saatpunkts wird in Kapitel 6.2 untersucht.
Als Vorwissen für die Einschränkung des Suchbereichs wird angenommen, dass der
Patient in liegender Position aufgenommen wurde und die Ober- und
Unterschenkelknochen ungefähr in Richtung der z-Achse des CT-Scans ausgerichtet
sind. Laut Aufnahmeprotokoll werden die Probanden in FFS-Lage (feet first supine) mit
ausgestrecktem Bein aufgenommen. Der Suchraum wird auf einen Bereich innerhalb
der periostealen Oberfläche und einer Umgebung von ±30 Schichten in z-Richtung um
den Saatpunkt beschränkt (Abb. 18, rechts). Bei Bedarf kann dieser Bereich über die
GUI erweitert oder eingeschränkt werden. Durch eine grobe Vorsegmentierung werden
nun erste, mögliche Bereiche der Wachstumsfuge identifiziert.
Abbildung 18: Schematische Darstellung von Saatpunkt und Suchraum für die Segmentierung
der Wachstumsfuge der Tibia
z
x

3.2 Segmentierung Wachstumsfuge
33
3.2.2 Vorsegmentierung
Der Suchbereich wird für jede x/y-Koordinate in einzelne z-Kolumnen aufgeteilt.
Innerhalb jeder Kolumne wird jenes Voxel identifiziert, das die höchste Differenz zum
mittleren Grauwert in einer bestimmten Nachbarschaft aufweist (Abb. 19).
Als bester Kompromiss zwischen Vorsegmentierungsergebnis und Rechenaufwand
stellte sich eine Nachbarschaft mit Ausdehnung von ±2 Voxeln in x- und y-Richtung
sowie ±4 Voxeln in z-Richtung heraus (5x5x9 Kern). Kleinere Kerne waren stark
anfällig gegenüber Bildrauschen, während größere Kerne bei stark erhöhter Rechenzeit
keine wesentlich besseren Ergebnisse lieferten.
Die Grauwertdifferenz dg im Punkt x0, y0, z0 mit dem Grauwert g(x0, y0, z0) ergibt sich
aus:
225
)(
)(0,0
2
2
2
2
4
4,0
0,0,0
kji j k
i
g
zyxg
zyxgd++
−= −= −=+∑∑∑
−=
Abbildung 19: Wachstumsfuge vor (links) und nach der Vorsegmentierung (rechts)
Wie aus Abbildung 19, rechts ersichtlich, kommen bereits einige Punkte der
Vorsegmentierung auf der Wachstumsfuge zu liegen. Jedoch weichen immer noch viele
Punkte von der gesuchten Struktur ab.
An dieser Stelle wurde versucht, mittels Filter und morphologischen Operationen eine
Verbesserung des Ergebnisses zu erreichen. Vorsegmentierte Punkte, die sich nicht auf
der Wachstumsfuge befinden, waren jedoch nicht zuverlässig, von korrekt

3 Segmentierung des Knies
34
klassifizierten Punkten zu unterscheiden. Der Grund hierfür liegt darin, dass es sich
häufig nicht um einzelne Ausreißer, sonder um größere Cluster von fehlsegmentierten
Punkten handelt.
3.2.3 Chainmailing
Die Wachstumsfuge selbst bildet eine in sich eine stetige, in erster Näherung
differenzierbare, Oberfläche. Mittels einer Chainmail-Datenstruktur, die diese
Eigenschaften berücksichtigt, konnte das Segmentierungsergebnis wesentlich verbessert
werden. Ein Chainmail ist eine Datenstruktur, die in der Computergrafik bisher primär
zur Weichgewebesimulation, haptischen Exploration und Darstellung deformierbarer
Objekte mit interaktiven Frameraten verwendet wird [33, 34, 62, 65]. Es handelt sich
dabei um eine n-fach verlinkte Liste, wobei jedes Listenelement einem Kettenglied des
Chainmails entspricht. Die räumliche Dimension des Chainmails beträgt n/2. Diese
Datenstruktur zeichnet sich durch eine Beweglichkeit benachbarter Kettenglieder,
innerhalb eines limitierten Rahmens, zueinander aus (Abb. 20). Parametrisiert wird
diese Beweglichkeit durch minimale und maximale Abstände minDx, maxDx, minDy,
maxDy, etc. Der mögliche Bewegungsspielraum gegenüber dem Nachbarn ergibt sich
somit zu:
M
DyDyDy
DxDxDx
Vert
Horiz
minmaxmax
minmaxmax
−=−=
Der Zusammenhang der benachbarten Kettenglieder verleiht der Struktur eine definierte
Topologie. Über die Parametrisierung der maximalen Auslenkungen können
Vorzugsrichtungen und Steifigkeit der Gesamtstruktur vorgegeben werden. Die
Deformation eines Chainmails geschieht über iterative Weitergabe von Auslenkungen.
• Ein Kettenglied wird ausgelenkt
• Werden die zulässigen Auslenkungsbereiche gegenüber den Nachbarn
überschritten, so werden diese Nachbarn verschoben, bis sie wieder einen
zulässigen Abstand zum ersten Knoten erreichen.
• Verletzt diese Auslenkung die Rahmenbedingungen weiterer Kettenglieder, so
werden diese ihrerseits verschoben, etc.

3.2 Segmentierung Wachstumsfuge
35
Abbildung 20: Beispielhafte Darstellung einer zweidimensionalen Chainmail-Struktur mit 2
Freiheitsgraden. Zulässige Positionen zweier Nachbarknoten sind innerhalb der gestrichelten
Bereiche.
Die Deformationsfront setzt sich sukzessive fort, bis das Netz wieder eine zulässige
Gesamtkonfiguration eingenommen hat. Häufig werden zum Abschluss ein oder
mehrere Relaxationsschritte durchgeführt, um den mittleren Abstand der einzelnen
Kettenglieder untereinander zu minimieren.
Abbildung 21 zeigt eine Deformation eines eindimensionalen Chainmails mit nur einem
Freiheitsgrad in x-Richtung. Der schwarze Knoten wird zunächst bewegt. Nach der
Deformation befinden sich die beiden mit ’’1’’ bezeichneten Knoten in nicht zulässiger
Distanz zum bewegten Knoten. Der linke Knoten ist dabei näher als minDx während der
rechte Knoten weiter entfernt ist als maxDx (schraffierte Linien). Die Knoten werden
soweit bewegt, bis sie wieder innerhalb des zulässigen Bereichs zu liegen kommen.
Anschließend werden deren Nachbarn überprüft. Im gezeigten Fall ist Knoten ’’2’’ noch
zu bewegen bevor das Netz insgesamt wieder eine regelkonforme Konfiguration
aufweist
minDx
maxDx
maxVertDy = maxDy - minDy
minDy
maxDy
maxHorizDx = maxDx - minDx
linker Nachbar
unterer Nachbar

3 Segmentierung des Knies
36
Abbildung 21: Deformationsbeispiel anhand eines eindimensionalen Chainmails mit einem
Freiheitsgrad in x-Richtung (siehe Text).
Für die Segmentierung der Wachstumsfuge wurde eine zweidimensionale Grundstruktur
mit einem Freiheitsgrad gewählt. Jede ganzzahlige x/y-Koordinate besitzt maximal ein
Kettenglied. Relativbewegungen in x- und y-Richtung wurden untersagt. Beweglichkeit
in z-Richtung wurde auf ±2 Voxel limitiert, da die Wachstumsfuge beim verwendeten
Aufnahmeprotokoll in erster Nährung in der x/y-Ebene liegt (Abb. 22).

3.2 Segmentierung Wachstumsfuge
37
minDx = maxDx = +1 Voxel für linken Nachbarn (maxHorizDx = 0)
minDx = maxDx = -1 Voxel für rechten Nachbarn (maxHorizDx = 0)
minDy = maxDy = +1 Voxel für vorderen Nachbarn (maxVertDy = 0)
minDy = maxDy = -1 Voxel für hinteren (maxVertDy = 0)
minDz = 0, maxDz = ±2 Voxel
Abbildung 22: Parametrisierung der Knoten des Chainmails.
Das Chainmail wird nicht von Beginn an vollständig generiert sondern schrittweise,
ausgehend vom benutzerdefinierten Saatpunkt, aufgebaut.

3 Segmentierung des Knies
38
In Pseudo-Code stellt sich der Vorgang wie folgt dar:
1. Generiere einen Chainmailknoten im Saatpunkt und fixiere diesen.
2. So lange neue Knoten generiert wurden
3. Generiere Nachbarknoten im Abstand von einem Voxel in x- und
y-Richtung, falls diese noch nicht vorhanden sind und der neue Knoten
sich noch innerhalb des endostealen Maskenvolumens befindet.
4. Falls für die neuen Knoten bereits unverbundene Nachbarn in x-
oder y- Richtung bestehen, verbinde diese.
5. Suche für jeden Knoten innerhalb seiner Beweglichkeitsgrenzen in
z-Richtung nach einem Punkt aus der Vorsegmentierung.
6. Falls Punkt gefunden:
7. Knoten wird an gefundenem Punkt verankert.
8. Falls kein Punkt gefunden:
9. Knoten bleibt frei schwebend und kann seine Beweglichkeit
an neue Nachbarn weitergeben.
Die Beweglichkeit freier Knoten addiert sich dabei zu neu generierten Nachbarknoten,
wie in Abb. 23 gezeigt.

3.2 Segmentierung Wachstumsfuge
39
Abbildung 23: Schematische Darstellung des iterativen Suchverfahrens für ein eindimensionales
Chainmail mit einem Freiheitsgrad in y-Richtung von ±1 Voxel. a) Nachbarpunkte generieren
und verlinken, b) Suche nach erreichbaren Punkten aus Vorsegmentierung, c), d), e) zweite und
dritte Iteration f) Relaxation
Neu generierter Knoten mit Bewegungsspielraum
Frei schwebender Knoten
Fixierter Knoten
Punkt aus Vorsegmentierung
Benutzerdefinierter Saatpunkt
f) e)
d) c)
b) a)

3 Segmentierung des Knies
40
3.2.4 Nachbearbeitung
Vom Netz nicht erfasste Punkte aus der Vorsegmentierung werden verworfen. Wie in
Abb. 17 angedeutet, ist die Lage der Wachstumsfuge nahe der periostealen Oberfläche
zunehmend unbestimmt. Es werden daher alle Voxel aus dem Netz entfernt, die sich
innerhalb einer Distanz von 20 Voxeln zur segmentierten Knochenoberfläche befinden
(empirisch gefundener Parameter). Als letzter Schritt wird eine Relaxation des Netzes
mittels bilinearer Interpolation durchgeführt (Abb. 23f)
Abbildung 24 zeigt exemplarisch ein Segmentierungsergebnis nach der
Vorsegmentierung und nach Ablauf der Segmentierung und Relaxation.
Abbildung 24: Oben: Originalbild. Mitte: Vorsegmentierungsergebnis. Unten: nach
Chainmailing, Relaxation und Abschneiden oberflächennaher Punkte

3.3 Segmentierung des Gelenkspalts
41
3.3 Segmentierung des Gelenkspalts
Wesentliches diagnostisches Merkmal für die OA ist der Zustand des Gelenkspalts.
Während planare Röntgenaufnahmen eine quantitative Auswertung der Spaltbreite
erlaubt können dreidimensionale CT-Datensätze zusätzlich detailliertere Auskunft über
das Spaltvolumen liefern. Ohne direkte Abbildung des Knorpels ist eine sinnvolle
Definition des Spaltvolumens zudem hilfreich bei der Ermittlung derjenigen Flächen,
die mit Gewicht belastet werden. Unterhalb dieser Flächen werden die größten
Veränderungen im subchondralen Knochen erwartet.
Der Gelenkspalt selbst ist keine eigenständige, anatomische Struktur und somit den
üblichen Segmentierungsverfahren nicht zugänglich. Er ist im CT-Bild weder durch
einen besonderen Grauwertbereich, noch durch eine spezielle Textur oder gar eine klare
Abgrenzung gegenüber dem umliegenden Gewebe gekennzeichnet. Eine manuell
unterstütze Segmentierung birgt das Risiko hoher Variabilität. Es wurde daher eine
Methodik entwickelt den Gelenkspalt vollautomatisch, nur auf Grund der bisherigen
Segmentierungsergebnisse, zu ermitteln.
3.3.1 Chamfer Maps
Die Grundlegende Idee stammt aus der Feldphysik. Es werden die beiden
Kniegelenksknochen als Bestandteile eines Kondensators modelliert. Nach Auffinden
der Äquipotentialflächen (in diesem Fall Äquidistanzflächen) zwischen den Knochen
lässt sich der Gelenkspalt als das Volumen beschreiben, in dem Feldlinien ausgehend
von der Tibia sich ausschließlich näher an die Femur bewegen und umgekehrt (Abb.
25).
Abbildung 25: Äquidistanzflächen für Tibia (links) sowie Tibia und Femur überlagert (rechts).
Dargestellte Abstände der Äquidistanzflächen zur Knochenoberfläche der Ursprungsstruktur sind
10, 30, 50, 70 und 90 Voxel

3 Segmentierung des Knies
42
Um die Äquipotentialflächen zu berechnen, werden für Femur und Tibia ausgehend von
deren periostealen Oberflächen Chamfer Distanzkarten berechnet [31] (Abb. 26). Alle
Oberflächenvoxel der Ursprungsstruktur werden zunächst ermittelt und deren
Distanzwert d auf Null gesetzt. Für jeden Voxel werden dessen Nachbarn in einer 6-
Nachbarschaft untersucht. Sollte dessen Distanzwert noch unbestimmt oder größer als
d+1 sein, so wird sein Distanzwert auf d+1 gesetzt und der Voxel in der Liste der zu
verarbeitenden Voxel aufgenommen. Nur Voxel die außerhalb der periostealen
Segmentierung des Ursprungsknochens liegen, werden berücksichtigt.
Iterativ wird die Liste abgearbeitet bis Distanzwerte für das gesamte Volumen berechnet
wurden. Um Rechenzeit zu sparen, werden nur Werte für Bereiche ermittelt, die sich
innerhalb der Bounding-Box der Vereinigung beider Gelenksknochen befinden.
Weiterhin wird der Suchraum in z-Richtung durch die z-Koordinaten der Schichten
beschränkt, in denen die Massenschwerpunkte der Wachstumsfugen liegen.
Eine bessere Approximation der euklidischen Distanz kann auf Kosten von erhöhtem
Rechenaufwand mit Hilfe von größeren Nachbarschaftsbereichen erreicht werden. In
der Praxis zeigte sich dadurch jedoch kein Unterschied im Endergebnis, weswegen die
Implementierung einer einfachen Manhattan-Distanz gewählt wurde.
Abbildung 26: Beispielhafte Chamfer Distanzkarten ausgehend von Struktur 1 (links) und
Struktur 2 (rechts).
1
1
1
1 1
1 1
1 1
1
1
2
2
2 2
2 2
2
2 3
3
3
3
3 3
3
4
4
4 4
4
5 5
5 6 6
7 7 6
Struktur 2
Struktur 1
1
1
1
1 1
1 1
1 1
1
1
1
2
2
2 2
2 2
2
2 3
3
3
3
3 3
3
4
4
4 4
4
5 5
5 6 6
7 7 6
Struktur 2
Struktur 1
5
6
5
3 4
3 3
4 5
7
8
2
2
4
2 2
3 4
6
1 1
1
3
1
2 3
5
1
2
1 2
4
1 3
1 1 2
2 1 1
Struktur 2
Struktur 1

3.3 Segmentierung des Gelenkspalts
43
3.3.2 Definition des Gelenkspaltvolumens
Die beiden Distanzkarten werden überlagert und Feldlinien in beide Richtungen
berechnet. Die Zugehörigkeit eines Voxel zu einer Feldlinie wird in Pseudo-Code wie
folg bestimmt:
1. Bestimme alle Voxel mit Distanzwert 1 von der Tibiaoberfläche und schreibe
sie in die zu untersuchende Voxelliste
2. Für jeden Voxel in der zu untersuchenden Voxelliste
3. Ermittle seine Distanzwerte in den Tibia- und Femurdistanzkarten
und finde seine Nachbarn
4. Ermittle von diesem diejenigen Nachbarn, welche einen höheren
Distanzwert in der Tibiadistanzkarte aufweisen.
5. Ermittle die Distanzwerte für diese Nachbarn in der
Femurdistanzkarte
6. Wenn alle solche Nachbarn einen kleineren oder gleichen Wert in
der Femurdistanzkarte aufweisen wie der zu untersuchende Voxel dann
gehört dieser Voxel zum Gelenkspalt
7. Falls noch nicht vorhanden: Addiere die gefilterten Nachbarvoxel
zur zu untersuchenden Voxelliste
8. Wiederhole das Verfahren ausgehend von der Femur (mit vertauschten Tibia-
und Femurdistanzkarten)
9. Closing Operator
10. Ergebnis der Segmentierung ist die Schnittmenge beider Durchläufe.
Zweidimensionales Beispiel siehe Abb. 27.

3 Segmentierung des Knies
44
Abbildung 27 links oben: ein zu überprüfender Voxel (grau); rechts oben: Nachbarn mit höherem
Tibiadistanzwert (Pfeile); links unten: linker Nachbarvoxel hat einen höheren Femurdistanzwert
– grauerVoxel nicht zum Gelenkspalt. Rechts unten: Endergebnis nach Prüfung aller Voxel
1
1
1
1 1
1 1
1 1
1
1
1
2
2
2 2
2 2
2
2 3
3
3
3
3 3
3
4
4
4 4
4
5 5
5 6 6
7 7 6
Struktur 2
Struktur 1
1
1
1
1 1
1 1
1 1
1
1
1
2
2
2 2
2 2
2
2 3
3
3
3
3 3
3
4
4
4 4
4
5 5
5 6 6
7 7 6
Struktur 2
Struktur 1
5
6
5
3 4
3 3
4 5
7
8
2
2
4
2 2
3 4
6
1 1
1
3
1
2 3
5
1
2
1 2
4
1 3
1 1 2
2 1 1
Struktur 2
Struktur 1
Struktur 2
Struktur 1

3.3 Segmentierung des Gelenkspalts
45
Beispiel eines Gelenkspaltvolumens an einem Patientendatensatz siehe Abb. 28.
Abbildung 28: Ansichten des Gelenkspaltvolumens. Unterhalb der Kondylen (sagittal oben links,
koronal oben rechts). Im Interkondylenbereich (sagittal unten links). Anterior-Bereich (koronal
unten rechts)

4 Auswertevolumen
46
4 Auswertevolumen
In der Literatur werden subchondrale Auswertevolumen meist manuell bestimmt. In
Kadaverstudien wurden Auswertevolumen z.B. ex-vivo anhand von vorher
eingebrachten Schadstellen [70] oder subjektiv nach vermuteter Region größter
Belastung [116] definiert. In QCT und Röntgenbildern wurden die VOIs häufig manuell
gesetzt [110] oder anhand von manuell gesetzten Hilfspunkten orientiert [48]. In dieser
Arbeit werden die VOIs ausschließlich automatisch, auf Grund der bisherigen
Segmentierungsergebnisse, bestimmt.
4.1 Knochenkoordinatensystem
Mit Hilfe der in Kapitel 3 segmentierten Bereiche lassen sich Auswertevolumen
vollautomatisch in den Datensatz positionieren. Es werden VOIs in unterschiedlichem
Abstand unterhalb der belasteten Oberflächen definiert, um zu untersuchen, in wieweit
sich kortikaler und subchondraler Knochen auf Grund von OA verändert. Die VOIs
werden zudem in mediale und laterale Bereiche aufgeteilt. Der Grund hierfür ist, dass
OA häufig einseitig auftritt. Möglicherweise ist das Verhältnis zwischen medialer und
lateraler Seite besonders aussagekräftig [45].
4.1.1. Fibuladetektion
Zur Unterscheidung von linkem und rechtem Knie führen wir zunächst eine
automatische Detektion der Fibula durch (Abb. 29). Hierzu werden in den unteren 60
Schichten des Datensatzes nach Voxeln mit Grauwerten im Knochenbereich gesucht
(HU Werte > 300) welche nicht bereits zum periostealen Bitvolumen gezählt werden.
Sind mehr dieser Voxel in der rechten Hälfte des Datensatzes (x-Koordinaten größer als
xmax/2), so handelt es sich um ein linkes Knie. Dieses Verfahren nimmt an, dass der
Patient auf dem Rücken liegend und mit dem Kopf in positive z-Richtung gescannt wird
- was dem geforderten Scanprotokoll entspricht (FFS). Die Entscheidung über welches
Knie gescannt wurde dient später der vollautomatischen Einteilung der VOIs in mediale
und lateral Bereiche.

4.1 Knochenkoordinatensystem
47
Abbildung 29: Transversaler Schnitt des Tibiaschafts mit unsegmentierter Fibula (Pfeil)
4.1.2. Anatomische Koordinatensysteme
Die Ermittlung der anatomischen Koordinatensysteme (anatomical coordinate system,
ACS) für Femur und Tibia erfolgt vollautomatisch. Ursprung der ACS ist jeweils der
Massenschwerpunkt der segmentierten Wachstumsfugen. Die Hauptachse A1 wird als
Verbindung zwischen dem Massenschwerpunkt der jeweiligen Wachstumsfuge und dem
Massenschwerpunkt der unteren 10 Schichten (Tibia) bzw. der oberen 10 Schichten
(Femur) des periostealen Volumens definiert (Abb. 30, links).
Es werden im Massenschwerpunkt der Wachstumsfugen senkrecht zur Achse A1
Strahlen ausgesandt und deren Austrittspunkte aus der periostealen Oberfläche ermittelt.
Die zweite Achse A2 ist der Strahl, welcher das Knochenvolumen auf kürzestem Weg
durchquert (Abb. 30 mitte und rechts). A3 ergibt sich aus dem Kreuzprodukt der beiden
ersten Achsen. Das Ergebnis sind zwei voneinander unabhängige anatomische
Koordinatensysteme.
Abbildung 30: Links: Achse A1 des Koordinatensystems. Es sind jeweils die 10 Schichten
markiert in denen der zweite Punkt für die Hauptachse ermittelt wird (schwarze Linien).
Mitte/Rechts: A2 für Femur und Tibia

4 Auswertevolumen
48
4.2 Auswertevolumenunterteilung
Es werden für Femur und Tibia jeweils 8 Auswertevolumen in der Epiphyse definiert.
Zunächst werden die Kontaktflächen zwischen den periostealen Oberflächen von Femur
bzw. Tibia und dem Gelenkspaltvolumen ermittelt. Von dort aus werden Strahlen in
Richtung der Wachstumsfuge propagiert. Für die Berechnung der Strahlrichtung wird
die Regressionsebene an die Wachstumsfuge über eine least squares fit berechnet [24].
Aufhängepunkt der Regressionsebene ist der Massenschwerpunkt der Wachstumsfuge.
Die Strahlrichtung ergibt sich dann aus der Normalenrichtung der Regressionsebene.
Abbruchkriterium für die Länge des Strahls ist entweder ein Auftreffen auf einen Punkt
der Wachstumsfuge oder auf die Regressionsebene.
Jeweils ein Drittel des Strahls wird einer von 3 subchondralen VOIs zugeordnet. Von
der, dem Spalt benachbarten, subchondralen Region wird noch eine kortikale VOI
abgespalten. Voxel außerhalb der endostealen Segmentierung werden hierbei der
kortikalen VOI zugeordnet.
Mittels einer Trennebene, festgelegt durch die Normale in Richtung der
Knochenkoordinatenachse A3 und dem Massenschwerpunkt der Wachstumsfuge,
werden die VOIs anschließend in laterale und mediale Bereiche aufgeteilt (Abb. 31).
Über die Seite, auf der die Fibula detektiert wurde, wird entschieden, welche Bereiche
als lateral und welche als medial gekennzeichnet werden.

4.2 Auswertevolumenunterteilung
49
Abbildung 31: Auswertevolumen in koronaler (oben, links) und sagitaller Ansicht (oben, rechts).
Kortikale VOI (türkis), erste subchondrale VOI (rot), zweite subchondrale VOI (grün), dritte
subchondrale VOI (blau)
Im Folgenden werden die VOIs mit FK bzw. TK für die kortikalen Regionen von Femur
und Tibia bezeichnet. Entsprechend sind FS1, FS2, FS3 und TS1, TS2, TS3 die
Bezeichnungen der ersten, zweiten und dritten subchondralen Regionen vom
Gelenkspalt aus gesehen.

5 Analyse
50
5 Analyse
5.1 Einleitung
In diesem Kapitel werden die einzelnen Parameter beschrieben, die zur Untersuchung
der VOIs herangezogen wurden. Es wird diskutiert, welche Veränderungen bei
fortschreitender OA bei ihnen zu erwarten sind. In der klinischen Praxis werden derzeit
bei Röntgenaufnahmen ausschließlich Gelenkspaltbreite, der Ausprägungsgrad von
Osteophyten und das Vorhandensein von Geröllzysten berücksichtigt [63, 80]. Wird eine
MRI-Aufnahme veranlasst, so kommt noch die Knorpeldicke hinzu [25].
5.1.1 Knochenmineraldichte
Für alle VOIs werden mit Hilfe der Kalibrierung die Knochenmineraldichte (BMD) der
einzelnen Voxel bestimmt. Anschließend wird über alle Voxel einer VOI gemittelt [71].
Knochenmineralgehalt und Knochenmineraldichte stehen im Zusammenhang über:
Volumen
BMCBMD =
Bei osteoarthrotischen Veränderungen erwarten wir eine Änderung der
Knochenmineraldichte in Bereichen in denen starke Mehr- bzw. Minderbelastung
auftreten.
• Überbelastung, die anfänglich zum Abbau des Knorpels führt, geht einher mit
einer Verringerung von BMD durch unvollständige Mineralisierung der Trabekel
[10, 15]
• In Tierstudien wurde hingegen nach einer anfänglichen BMD-Abnahme im
weiteren Verlauf der OA eine BMD-Zunahme beobachtet [11, 104]
• OA tritt häufiger medial als lateral auf. Daher ist mit einer Verschiebung im
Verhältnis zwischen medialem und lateralem BMD zu rechnen [30].
Durch die Wahl der VOIs ergibt sich zudem die Möglichkeit zur Erstellung eines BMD-
Profils in Abhängigkeit des Abstands zur Gelenksoberfläche. Bei fortschreitender
Krankheit sollte sich in dieser Richtung eine Änderung im BMD-Verlauf ergeben.

5.1 Einleitung
51
5.1.2 Gelenkspalt
Wie in [116] beschrieben ist die Gelenkspaltbreite eine wichtige diagnostische Hilfe zur
Bewertung fortschreitender OA. Aus der in 3.3 segmentierten Gelenkspalt-VOI lassen
sich mehrere diagnostische Parameter bestimmen:
• Gelenkspaltvolumen
• Minimale Gelenkspaltbreite
• Mittlere Gelenkspaltbreite
• Verhältnis von minimalem Gelenkspaltabstand zu mittlerem Gelenkspaltabstand
• Verhältnis Gelenkspaltvolumen zu kortikalem Volumen
Bei zunehmender OA verringert sich im Röntgenbild die Gelenkspaltbreite, was sich
auch im Gelenkspaltvolumen widerspiegeln sollte. Es ist zu untersuchen, ob sich dies
im CT-Bild nachvollziehen lässt und welcher der beiden Parameter ein besserer
Indikator für OA ist. Das Verhältnis von Gelenkspaltvolumen zu kortikalem Volumen
wird gebildet, um ein Maß zu erhalten, das unabhängiger von der absoluten Größe des
Knies ist.
Die minimale Gelenkspaltbreite wird mit Hilfe der in Kapitel 3.3.1 bestimmten
Chamfer-Distanzkarten ermittelt.
Es gibt Umstände, die zu einer Variabilität der minimalen Gelenkspaltbreite führen
können und daher dessen diagnostischen Wert mindern:
• Das Spaltmaß kann sich auf Grund von unterschiedlichen Belastungen während
der Zeit vor dem Scan verändern. So ist z.B. zu erwarten, dass - wie bei den
Bandscheiben der Wirbelkörper - Flüssigkeit aus dem Knorpel im Kniegelenk
während des Tages bei vorwiegend stehender oder gehender Betätigungen
verdrängt wird. Dies kann dazu führen, dass die Gelenkspaltbreite nach aktiven
Phasen geringer ausfällt als nach Ruhephasen.
• Durch die Art der Lagerung des Knies auf der Liege kann es leicht zu
Streckungen/Beugungen des Knies kommen. Bei geringer Gelenkspaltbreite
können solche minimalen Einwirkungen bereits erhebliche prozentuale
Unterschiede hervorrufen. Ältere Leute sind bisweilen nicht in der Lage, wie

5 Analyse
52
vom Aufnahmeprotokoll gefordert, das Knie durchzustrecken.
• Die Segmentierung der periostealen Oberflächen ist an Stellen, an denen der
Gelenkspalt sehr eng ist, besonders kritisch. Gerade solche Stellen bedürfen
häufig manueller Korrektur. Inter-Benutzervariabilität macht sich an dieser
Stelle besonders bemerkbar (siehe Kapitel 6)
• Derzeit wird die Bestimmung des minimalen Gelenkspalts nur in einem Punkt
vorgenommen. Eine mögliche Erweiterung besteht darin, die Abstandsmessung
nicht nur punktuell sondern in einem größeren Bereich durchzuführen, um ein
reproduzierbareres Maß zu erhalten.
5.2 Texturparameter
BMD/BMC sind zur Quantifizierung der Trabekelstruktur nicht geeignet. Zur
Untersuchung der Änderung der Trabekelstruktur bei auftretender OA wurden daher
Texturparamenter angewandt. Die Voxelgröße der vorliegenden Daten (0,254mm x
0,254mm x 0,3mm) liegt oberhalb des Durchmessers einzelner Trabekel (0,1 bis
0,2mm), so dass eine direkte Segmentierung der Trabekel nicht vielversprechend
erscheint.
Übliche Verfahren zur Analyse trabekulärer Struktur mit Hilfe histomorphometrische
Parameter wie Trabekelanzahl, Trabekelabstand und Verhältnis von Knochenvolumen
zu Gesamtvolumen [9, 24, 43] setzten eine Binarisierung der Daten voraus [19, 36, 52,
59, 94, 114]. Eine Binarisierung ist jedoch ein arbiträrer Vorgang, da sie, je nach
Methodik, einen globalen oder lokalen Schwellwert voraus setzt, der Knochen von
Knochenmark unterscheidet. Um diese Abhängigkeit zu vermeiden wurden weitere
Methoden entwickelt (z.B. fuzzy distance [58]). Doch selbst hier sind letztlich
Schwellwerte vorzugeben. Diese Arbeit greift ausschließlich auf Algorithmen zurück,
deren Ergebnisse direkt auf der Grauwertverteilung basieren und die daher keinen
Binarisierungsschritt erfordern.
Mittels Texturanalyse lässt sich z.B. die Verteilung, Anisotropie und der fraktale
Charakter von Regionen quantifizieren. Texturanalyse wird in unterschiedlichsten
Bereichen bereits erfolgreich eingesetzt. Beispielhaft sei hier die Klassifizierung von
Gesteinsproben [64], die Abgrenzung von landschaftlichen Nutzflächen aus
Sattelitenaufnahmen [18] und sogar die Unterscheidung von Weinsorten anhand der

5.2 Texturparameter
53
charakteristischen Textur ihrer Schwebestoffe genannt [103].
In dieser Arbeit wird untersucht, inwieweit mit Hilfe dieser Parameter zwischen
Gruppen von gesunden und OA-Patienten diskriminiert werden kann – d.h. inwieweit
diese Parameter zur Diagnose von OA eingesetzt werden können (Kap. 6). BMD-Werte
sind mit Grauwerten durch eine lineare Skalierung verknüpft (siehe Kap. 2.2.4), daher
sind die gefundenen Grauwert-Texturen auch als BMD-Texturen interpretierbar.
5.2.1 Grauwertprofile
Das Ziel dieses Verfahrens ist es, ein Profil der Grauwertverteilung in Abhängigkeit
zum Abstand vom Gelenkspalt zu erstellen. Basierend auf Raycasting-Verfahren [106]
werden, ausgehend von Punkten am Übergang des kortikalen Knochens zum
Gelenkspalt, Strahlen in Richtung der Normalen der Regressionsebene der
Wachstumsfuge untersucht. Für jeden Voxel jedes Strahls (s) wird ein Distanzwert vom
Gelenkspalt berechnet. Für jeden Distanzwert (d) kann man somit ein mittlerer
Grauwert definieren:
∑=
=s
ii dgdg
0
)()(
Der Verlauf der mittleren Grauwerte in Abhängigkeit vom Abstand zum Gelenkspalt ist
in Abbildung 32 exemplarisch für einen gesunden Probanden und einen Patienten mit
OA dargestellt.
Abbildung 32: Beispiel Grauwertprofile
Tibia Grauwertverteilung (osteoarthrotisch KL 2-3)
0,5
0,6
0,7
0,8
0,9
1
1,1
1 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37 39 41 43
Abstand zum Gelenkspalt [Voxel]
Gra
uwer
t (re
lativ
)
Tibia Grauwertverteilung (gesund)
0,5
0,6
0,7
0,8
0,9
1
1,1
1 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37 39 41 43
Abstand zum Gelenkspalt [Voxel]
Gra
uwer
t (re
lativ
)

5 Analyse
54
Wie in histologischen Schnitten bei OA sichtbar (Abb. 9) ist eine Reduktion der
kortikalen Dicken und eine erhöhte Trabekularisierung der Übergänge zwischen
kortikalen und subkortikalen Bereichen zu beobachten. Daher erwarten wir eine
Veränderung des Kontrasts zwischen kortikaler und S1 VOI im Verlauf der Krankheit.
5.2.2 Entropie
Die Shannon'sche Entropie (H) ist ein Begriff aus der Informationstheorie [76]. Sie ist
ein Maß für den Informationsgehalt einer Folge von Symbolen aus einer
gedächtnislosen Quelle und ist definiert als:
∑∈
⋅−=Zz
zz ppH 2log
wobei z ein Symbol des endlichen Alphabets Z (hier Grauwertbereich) darstellt und pz
die Wahrscheinlichkeit des Auftretens dieses Zeichens angibt. Das Ergebnis erhält die
Einheit 'bit'.
Normiert wird die Entropie in der Regel über die maximal mögliche Entropie desselben
Alphabets, wobei die gleiche Wahrscheinlichkeit für das Auftreten jedes einzelnen
Symbols (Grauwerts) vorausgesetzt wird (N = Z, pz = 1/N)
NpN
NNH i
N
i
1,log
1log
12
12max =∀=⋅−= ∑
=
somit ergibt sich die Normierung zu:
∑∑==
≤⋅−=⋅−=Z
iiiNi
Z
ii
ii pp
N
pp
H
H1log
log
log
2
2
max
In computertomographischen Daten können die Grauwerte einzelner Voxel als
individuelle Werte aus einem Alphabet aufgefasst werden, dessen Umfang dem
Grauwertumfang im jeweiligen Auswertebereich entspricht. Da der Grauwertbereich in
CT-Bildern sehr groß ist, und somit die Gefahr besteht, dass für jeden Grauwert nur ein
einzelner Voxel gefunden wird, führen wir ein Rebinning durch. Um die
Vergleichbarkeit verschiedener VOIs zu erreichen, wird das Grauwertspektrum in 100
gleichmäßige Teile zwischen dem jeweils minimal und maximal in der VOI

5.2 Texturparameter
55
vorkommenden Grauwert partitioniert. Das Rebinning führt zudem zu einer impliziten
Rauschunterdrückung.
Die Wahrscheinlichkeit der einzelnen Partitionen ergibt sich dann aus:
VOI
ii N
Np =
Hierbei ist Ni die Anzahl der Volumenelemente, die in die Grauwertpartition i fallen und
NVOI die Anzahl aller Volumenelemente der VOI. Durch die Festlegung auf 100
Partitionen für alle VOIs kann eine Normierung über Hmax entfallen.
Die Entropie macht eine Aussage über die Gleichverteilung der Grauwerte innerhalb
einer VOI. Für 100 Partitionen ergibt sich ein maximaler Informationsgehalt von
log2100 bit (ca. 6,6 bit) wenn alle Grauwerte mit der gleichen Wahrscheinlichkeit
auftreten. Ungleichmäßige Verteilungen der Grauwerte (z.B. durch klar abgegrenzte
Trabekelstrukturen) führt zu einer niedrigen Entropie, während eine gleichmäßigere
Verteilung der Grauwerte (z.B. durch viele kleine Trabekel) über den gesamten
Grauwertbereich in einer Entropie nahe dem theoretischen Maximum resultiert.
5.2.3 Homogenität
Als zweites Maß für die Gleichförmigkeit einer VOI wird die Homogenität (Hom.) der
Grauwerte berechnet, die sich aus der normierten quadratischen Abweichung zum
Mittelwert der VOI ergibt.
∑=
−=VOIN
ii
VOI
ggN
Hom0
2)(1
Die Homogenität erhält im Gegensatz zur Entropie die volle Bandbreite des
Grauwertspektrums. Sie ist jedoch nur aussagekräftig, wenn keine globaler
Grauwertgradienten über das Volumen vorliegen, wie das z.B. bei MR-Bildern der Fall
sein kann. Die Homogenität ist identisch mit der Standardabweichung der Grauwerte.
5.2.4 Total Variation
Unter Total Variation (TV) innerhalb eines Bereichs versteht man den normierten

5 Analyse
56
lokalen Grauwertunterschied der Voxel zu ihren Nachbarn [20]. Es wird eine 6-
Nachbarschaft ausgewertet. Die Total Variation ergibt sich dann zu
TV= 1NVOI∑i= 0
NVOI
TVlokal
2111111,, )))(
6
1(( −+−+−+ +++++−= zzyyxxzyxlokal gggggggTV
Ähnlich der Homogenität ist sie ein Maß für die Schwankung der Grauwerte in der VOI
- jedoch in einer lokaleren Umgebung - und ist somit unabhängiger von globalen
Gradienten.
5.2.5 Lokale und Globale Anisotropie
Durch eine einseitig erhöhte Belastung am osteoarthrotischen Knie ist ein Umbau der
subchondralen Trabekelstruktur zu erwarten. In stärker belasteten Bereichen bilden sich
möglicherweise vermehrt trabekuläre Strukturen, die in Kraftrichtung weisen, während
geringer belastete Bereiche unter Umständen einen umgekehrten Trend erkennen lassen.
In der Literatur gibt es eine Vielzahl von Definitionen zur Anisotropie von trabekulären
Strukturen ([100] bietet eine Übersicht). Diese Maße setzten jedoch eine Binarisierung
der Trabekelstruktur voraus.
Zur Quantifizierung der Anisotropie basierend auf Grauwertbildern wurden zwei neue
Maße eingeführt:
• globale Anisotropie ist ein Maß, das die globale Varianz der Gerichtetheit
innerhalb einer VOI quantifiziert.
• lokale Anisotropie bildet die Varianz der Gerichtetheit in Abhängigkeit von der
lokalen Umgebung eines jeden Voxels ab.
Die Berechnung der globalen Anisotropie benötigt zuerst den mittleren
Grauwertgradienten. In jedem Voxel i mit den Koordinaten x,y,z ist der
Grauwertgradient in einer 6-er Nachbarschaft definiert durch:

5.2 Texturparameter
57
∂∂
∂∂
∂∂
=z
g
y
g
x
gv iii
i ,,r
Über alle Voxel gemittelt erhält man den mittleren Grauwertgradienten.
∑=
=VOIN
ii
VOI
vN
v0
1 rr
und schließlich über die normierte Summe der Unterschiede zum Mittelwert die globale
Anisotropie
∑=
∠=VOIN
ii
VOIglobal vv
NA
0
),(1 rr
Zur Berechnung der lokalen Anisotropie definieren wir in der Umgebung jedes Voxel
einen lokalen Mittelwert
∑ ∑ ∑+
−=
+
−=
+
−=
≠∩∩=1
1
1
1
1
1,,,,, }0{,
26
1 x
xi
y
yj
z
zkkjizyxlokal kjivv
rr
∑=
∠=VOIN
ilokali
VOIlokal vv
NA
0
),(1 rr
In (Abb 33) sind schematisch zwei Ausschnitte einer ROI skizziert. Die Pfeile geben
den Grauwertgradienten des jeweiligen Voxel an. Beide Gebiete besitzen den gleichen
mittleren Grauwertgradienten. In Abb. 33 links ist die lokale Anisotropie kleiner als die
globale Anisotropie, da es sich um eine stückweise gleichförmige Struktur handelt:
°=°+°+°+°=
°=°+°+°+°=
5,224
045450
454
45454545
lokal
global
A
A
In Abb. 33 rechts ist hingegen die lokale Anisotropie größer:

5 Analyse
58
°=°+°+°+°=
°=°+°+°+°=
454
45454545
5,224
450450
lokal
global
A
A
Abbildung 33: Beispiele für globale und lokale Anisotropie. Links: niedrige lokale und hohe
globale Anisotropie. Rechts: niedrige globale und hohe lokale Anisotropie.
5.2.6 Fraktale Parameter
Fraktale Analysen bieten eine weitere Möglichkeit Texturparameter zu bestimmen. Sie
beinhalten Aussagen der Selbstähnlichkeit von Strukturen über Größenskalen hinweg
(z.B. Raumausfüllung, Grauwert, Grauwertdifferenzen, etc.). Eine Kenngröße ist die
fraktale Dimension, die dem Grenzwert des untersuchten Parameters über die
Größenskalen hinweg entspricht. In makroradiographischen Aufnahmen konnten
fraktale Parameter bereits Aufschluss über Änderungen der OA geben [47, 75].
5.2.6.1 Variogramm
Das Variogramm beschreibt die Differenz der Grauwerte zwischen Volumenelementen
definierter Distanz d [37]. Wobei g|i-d| den Grauwert im Abstand d zum Volumenelement
i angibt. Nd bezeichnet die Anzahl der Punkte g|i-d| welche für Distanz d vom Punkt gi in
der VOI existieren
)1
(1
)(00∑∑
==
−=Nd
iij
d
N
jVOI
ggNN
dVarVOI
Für unterschiedliche Werte von d erhält man Punktepaare (d, Var(d)) im Variogramm,
die sich über eine Regressionsgerade beschreiben lassen. Üblicherweise folgt das
Variogramm jedoch keinem linearen Verlauf sondern erreicht, je nach Art der Daten,
mehr oder weniger schnell ein Plateau. Daher ist es unumgänglich sich bei der Analyse
auf eine Maximaldistanz festzulegen für die die Regressionsgerade berechnet wird. Für
die vorliegenden Daten ist ein Plateau ab d = 3 Voxel zu beobachten (Abb. 34).

5.2 Texturparameter
59
Abbildung 34: Variogramm für gesunde Probanden (links) und solche mit OA(rechts). Gut zu
erkennen ist die Sättigung nach einem Abstand von 3 Voxeln.
5.2.6.2 Differentielles Box Counting
Mittels Box Counting lässt sich die fraktale Dimension einer Oberfläche bzw. eines
Volumens bestimmen. Hierfür ist eine Binarisierung der Daten notwendig. Der
Binarisierungsschritt soll aber wegen der in 5.2 angesprochenen Problematik vermieden
werden. Hier kommt differentielles Box Counting zum Einsatz [6].
Um die Vorgehensweise zu erläutern, wird zuerst reguläres Box Counting beschrieben.
Beim regulären Box Counting wird das zu segmentierte Objekt binarisiert. Das
Gesamtvolumen wird anschließend in sukzessiv kleinere Kuben, ähnlich einem Octree-
Verfahren unterteilt [8]. Für jede Größenskala e der Unterteilung ergibt sich somit eine
Anzahl von Kuben, die benötigt werden, um die Struktur völlig zu überdecken. Die
Dimension d errechnet sich aus dem Grenzwert des Verhältnisses der zur Überdeckung
benötigter Kuben zur Gesamtzahl der Kuben im Volumen (Ne(S)) [6].
01
~)( >efüre
SNde
Für diskrete Werte von e lassen sich gewonnene Ergebnisse in ein doppelt
logarithmisches Diagramm eintragen und eine Regressionsgerade ermitteln. Die
Steigung d der Regressionsgeraden entspricht der fraktalen Dimension. Im Unterschied
zum normalen Box Counting benötigt differentielles Box Counting keinen
Binarisierungsschritt. Es wird für jeden Skalierungsschritt e innerhalb eines Kubus der
maximale und minimale Grauwert ermittelt. Abhängig vom mittleren Grauwert im

5 Analyse
60
Bereich wird der Box eine virtuelle 'Höhe' über dem Datensatz zugewiesen (Abb. 35).
Die Anzahl der möglichen Höhenniveaus hängt hierbei vom aktuellen Skalierungsschritt
ab. Somit wird jeder Kubus nicht komplett der Struktur zugerechnet sondern erhält, je
nach Höhe des erreichten Niveaus, nur eine partielle Zugehörigkeit.
Abbildung 35: Zweidimensionales Beispiel für differentielles Box Counting mit partieller
Zugehörigkeit zur Region - je nach Grauwert
Ähnlich wie bei einem Variogramm erlaubt differentielles Box Counting eine Aussage
über das lokale Grauwertverhalten über Größenskalen hinweg. Bei OA kommt es
möglicherweise zu einer Reduktion der Dicke der kortikalen Schicht (oder einer
Verdichtung), was eine Verminderung (Erhöhung) der Fraktalen Dimension nach sich
ziehen würden.
Grauwert
x
y

5.2 Texturparameter
61
6 Validierung
Validierung der Software kann über folgende Methoden erfolgen:
• Richtigkeit
• Präzision
• Einfluss von Benutzerinteraktionen und Rekonstruktionsfeld
• Diagnostische Relevanz der Analyseparameter
In Ermangelung eines Goldstandards oder eines bekannten Messphantoms konnte in
dieser Arbeit keine Untersuchung auf Richtigkeit durchgeführt werden.
Die Präzision wurde durch die Auswertung des Variationskoeffizienten der Ergebnisse
aus der Segmentierung von 10 Datensätzen durch 4 Benutzer (Interoperator Variabilität)
und der dreifachen Segmentierung derselben 10 Datensätze durch einen Benutzer
(Intraoperator Variabilität) ermittelt.
Untersucht wurden jeweils die Variationskoeffizienten bzw. Abweichungen von:
1) Größe der einzelnen Auswertevolumen
2) Volumen des Gelenkspalts
3) minimale Gelenkspaltbreite
4) Ursprung der Knochenkoordinatensysteme
5) Richtung der Knochenkoordinatensysteme (Ausrichtung der Trennebene
zwischen medialen und lateralen Volumen)
Variation von Benutzerinteraktionen und Rekonstruktionsfeld wurden untersucht durch:
1) Einfluss von Variation der Lage der Maskenvolumen auf die periostealen
Segmentierung
2) Einfluss von Variation der Lage des Saatpunktes auf die Segmentierung der
Wachstumsfuge
3) Einfluss der Variation des Rekonstruktionsausschnitts auf die Lage des ACS

6 Validierung
62
Die in Kapitel 5 beschriebenen, diagnostischen Parameter wurden mit Hilfe von t-Tests
und einer multivariaten Diskriminanzanalyse dahingehend untersucht, ob sie in der
Lage sind zwischen gesunden und OA-Gruppen zu trennen. Die Richtigkeit des
periostealen und endostealen Segmentierungsalgorithmus wurde bereits in [53] anhand
eines bekannten Phantoms nachgewiesen.
6.1 Einfluss der Maskenvolumen auf die periosteale Segmentierung
Es wird die Unabhängigkeit der periostealen Segmentierung von der Lage der
Maskenvolumen untersucht (siehe Kap. 3.2.1). Ein Datensatz wurde 5mal mit
unterschiedlicher Positionierung der Maskenvolumen segmentiert und die
resultierenden periostealen Volumen miteinander verglichen (Abb. 36). Innerhalb des
Maskenvolumens einer der Kugeln wird ein Histogramm berechnet. Anhand des
Histogramms werden Schwellwerte für das adaptive Regiongrowing ermittelt [53].
Vorausbedingung für eine erfolgreiche Berechnung der Schwellwerte ist, dass das
Maskenvolumen keine luftgefüllten Voxel enthält. Eine solche Lage führt zu keinem
Segmentierungsergebnis und wurde daher im Test nicht berücksichtigt. Um den Test auf
den Einfluss der Maskenvolumen zu beschränken wurde auf eine anschließende,
manuelle Verbesserung der periostealen Segmentierung verzichtet.
a) b) c)
d) e)
Abbildung 36: Lage der Maskenvolumen im Test: a) empfohlene Lage zur Maskierung der
Femurkondylen, b) Maskenvolumen in axialer Lage, c) kleine Maskenvolumen in abaxialer Lage,
d) kleine Maskenvolumen in axialer Lage, e) Maskenvolumen in asymmetrischer Lage

6.2 Einfluss der Saatpunkte auf die Auswertevolumen
63
Variationskoeffizienten des Volumens:
100
)(1
1
% 1
2
⋅−
−=
∑=
Vol
VolVolN
CV
N
nn
Das Segmentierungsergebnis der periostealen Oberfläche wirkt sich zudem direkt auf
die Bestimmung des Gelenkspalts aus. Besonders die minimale Gelenkspaltbreite ist
empfindlich gegenüber Segmentierungsunterschieden (Tab. 4). Diese Abweichung wird
genauer in Kapitel 6.4.1 diskutiert. Die Veränderung auf Grund der Repositionierung
der Maskenvoilumen ist, mit Ausnahme der minimalen Gelenkspaltbreite, geringer als
1%.
Periosteales Volumen (Tibia)
Periosteales Volumen (Femur)
Gelenkspalt-volumen
Gelenkspalt minimale
Breite
Gelenkspalt mittlere Breite
CV[%] 0,50 0,10 0,66 3,79 0,84
Maximale Abweichung [%]
0,57 0,15 0,99 6,78 0,97
Tabelle 3: Reproduzierbarkeit der periostealen Segmentierung bei unterschiedlicher Platzierung
der Maskenvolumen
6.2 Einfluss der Saatpunkte auf die Auswertevolumen
Die einzig obligatorische Benutzerinteraktion nach Abschluss der endostealen
Segmentierung besteht aus dem setzen zweier Saatpunkte. Diese sollen jeweils
möglichst zentral in die Wachstumsfugen platziert werden. Um den Einfluss schlecht
gesetzter Saatpunkte auf die Segmentierung und die Analyse zu untersuchen, wurde ein
Datensatz fünfmal analysiert. Basierend auf identischen periostealen und endostealen
Segmentierungen wurde zunächst eine Segmentierung der Wachstumsfugen mit korrekt
gesetztem Saatpunkt durchgeführt. Anschließend wurden die Segmentierungsvorgänge
für die Wachstumsfugen wiederholt, wobei jeweils die Saatpunkte um 10 Voxel in
positive und negative x- bzw. y-Richtung verschoben wurden. Fehlplatzierungen dieser
Größenordnung sind bereits mit bloßem Auge leicht als solche zu erkennen und stellen
daher einen worst-case dar.

6 Validierung
64
Die Variationskoeffizienten für die Auswertevolumen und für die BMD-Werte bezogen
auf die Werte der korrekten Segmentierung wurden ermittelt (Abb. 37, 38).
Tibia, Volume, CV(RMS)
0
0,5
1
1,5
2
2,5
3
3,5
4
K med. K lat. S1 med. S1 lat. S2 med. S2 lat. S3 med. S3 l at.
[%]
Femur, Volume, CV(RMS)
0
0,5
1
1,5
2
2,5
3
3,5
4
4,5
5
K med. K lat. S1 med. S1 lat. S2 med. S2 lat. S3 med. S3 l at.
[%]
Abbildung 37: Variationskoeffizienten für Auswertevolumen bei Variation der Saatpunkte für die
Wachstumsfuge
Tibia, BMD, CV(RMS)
0
0,2
0,4
0,6
0,8
1
1,2
K med. K lat. S1 med. S1 lat. S2 med. S2 lat. S3 med. S3 l at.
[%]
Femur, BMD, CV(RMS)
0
0,2
0,4
0,6
0,8
1
1,2
1,4
1,6
K med. K lat. S1 med. S1 lat. S2 med. S2 lat. S3 med. S3 l at.
[%]
Abbildung 38: Variationskoeffizienten für BMD bei Variation der Saatpunkte für die
Wachstumsfuge
Die periostealen und endostealen Segmentierungen geben im Wesentlichen das
Volumen der kortikalen VOIs vor. Aus diesem Grund ist die Variabilität dort relativ
gering. Eine Erklärung für die hohe Variabilität der S1 VOIs ergibt sich daraus, dass
diese im Vergleich zu den anderen subchondralen VOIs kleiner ist, da von ihnen noch
die kortikalen Volumen abgetrennt werden (siehe Kap. 4.2). Wie sich im weiteren
Verlauf zeigen wird sind hauptsächlich die kortikalen Volumen für diagnostische
Zwecke von Interesse. Hier sind die Schwankungen des BMD durch Fehlplatzierung
der Saatpunkte <0,5%.

6.3 Einfluss des Rekonstruktionsausschnitts auf das Knochenkoordinatensystem
65
6.3 Einfluss des Rekonstruktionsausschnitts auf das Knochenkoordinatensystem
Die Hauptachse des Knochenkoordinatensystems ist abhängig von der Lage des
Massenschwerpunkts der jeweiligen Wachstumsfuge sowie dem Massenschwerpunkt
der oberen 10 Schichten (Femur) bzw. unteren 10 Schichten (Tibia) der periostealen
Segmentierung (siehe Abb. 30 und Kap 4.1.2). Wird der Patient in baseline und follow-
up Scans anders positioniert, kann es sein, dass ein unterschiedlicher Ausschnitt des
Knies im Datensatz sichtbar ist. Damit werden andere Schichten zur Berechnung des
Masseschwerpunkts im proximalen Femur- und distalen Tibiabereich herangezogen.
Um diese Variabilität zu simulieren wurden die Bereiche für die Berechnung dieser
Massenschwerpunkte variiert.
In 5 Datensätzen wurden die periostealen und endostealen Volumen sowie die beiden
Wachstumsfugen segmentiert. Zu diesen Segmentierungsergebnissen wurden die
Knochenkoordinatensysteme je dreimal bestimmt. Der Ausschnitt für die Berechnung
des proximalen Femur- und distalen Tibiaschwerpunkts der Hauptachse wurde wie folgt
variiert:
• Berechnung der Massenschwerpunkte anhand der Schichten 0-10 der
periostealen Segmentierung vom oberen Ende (Femur) und unteren Ende (Tibia)
des Datensatzes
• Berechnung der Massenschwerpunkte anhand der Schichten 10-20 der
periostealen Segmentierung vom oberen Ende (Femur) und unteren Ende (Tibia)
des Datensatzes
• Berechnung der Massenschwerpunkte anhand der Schichten 20-30 der
periostealen Segmentierung vom oberen Ende (Femur) und unteren Ende (Tibia)
des Datensatzes
• Die Änderung des Hauptvektors durch die Verschiebung des
Rekonstruktionsausschnitts betrug im Mittel weniger als 0,001° mit einer
Standardabweichung von ebenfalls kleiner als 0,001°.

6 Validierung
66
6.4 Reproduzierbarkeit Inter- / Intraoperator-Vergl eich
Für die folgenden Untersuchungen wurden jeweils 10 Patientendatensätze von vier
verschiedenen Benutzern für einen Interoperator-Vergleich analysiert. Dieselben
Datensätze wurden zusätzlich dreimal von einem Benutzer für einen Intraoperator-
Vergleich ausgewertet.
Zur Auswertung wurde das quadratische Mittel der Standardabweichung (root mean
square of standard deviation, SDRMS) sowie der Variationskoeffizient (CVRMS)
herangezogen [35]. Sie werden für m Datensätze über:
∑=
=m
j
jRMS m
SDSD
1
2
∑=
=m
j
jRMS m
CVCV
1
2
berechnet.
6.4.1 Reproduzierbarkeit der Auswertevolumen
Die Inter- und Intraoperator-Variabilität der VOIs wurde bestimmt. Für Femur und Tibia
wurden kortikale und jeweils drei subchondrale Volumen untersucht (Abb. 39) (TK,
TS1, TS2, TS3, FK, FS1, FS2, FS3). Jedes dieser Volumen wurde in ein mediales und
laterales Subvolumen unterteilt.. Zusätzlich wurde das Gesamtvolumen aller VOIs
(Total Volume) in Femur und Tibia und das Gelenkspaltvolumen ausgewertet (Abb. 40).

6.4 Reproduzierbarkeit Inter- / Intraoperator-Vergleich
67
Abbildung 39: Auswertevolumen
Volumen, Tibia CV(RMS)
02468
10121416
K to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Volumen, Femur CV(RMS)
0
2
4
6
8
10
12
14
K to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Abbildung 40: Variationskoeffizienten für Auswertevolumen im Inter-/Intraoperator-Vergleich
Eine Erklärung für die geringere Variabilität der Femur-Auswertevolumen ist, dass diese
Bereiche im Schnitt 56% größer sind als jene der Tibia. Besonders die kortikalen
Bereiche von Femur und Tibia haben ein geringes Volumen und sind umso anfälliger
gegenüber kleinste Veränderungen in den Schwellwerten des adaptiven Regiongrowing-
Verfahrens
Zusätzlich zu den Knochen-VOIs wurden noch die Reproduzierbarkeit des
Gelenkspaltvolumens, der minimalen Gelenkspaltbreite, der mittleren

6 Validierung
68
Gelenkspaltbreite, der Lage der Massenschwerpunkte der Wachstumsfugen sowie die
Normalenrichtungen der Trennebenen zwischen medialen und lateralen Bereichen
untersucht (Tab. 6).
Maß Interoperator Intraoperator
Gelenkspalt Volumen CV[%] 1,29±0,84 0,47±0,21
Minimale Gelenkspaltbreite CV[%] 16,85±11,34 16,69±12,36
Mittlere Gelenkspaltbreite CV[%] 1,21±0,67 0,76±0,42
Ursprung Tibia Koordinatensystem
Abweichung vom Mittel [mm] 0,76±0,09 0,48±0,14
Ursprung Femur Koordinatensystem
Abweichung vom Mittel [mm] 0,57±0,08 0,37±0,06
Normalenrichtung Trennebene (Tibia) [°] 2,62±0,42 1,78±0,49
Normalenrichtung Trennebene (Femur) [°] 2,30±0,38 1,57±0,48
Tabelle 6:Reproduzierbarkeitsmaße
Besonders Auffällig ist der große Fehler im Bezug auf die minimale Gelenkspaltbreite.
Osteoarthrose zeichnet sich unter anderem durch einen stark verringerten Gelenkspalt
aus. Daher ist die minimale Gelenkspaltbreite anfällig gegenüber kleinsten
Veränderungen des Segmentierungsergebnisses. Die Gelenkspaltbreite an der engsten
Stelle bewegt sich für die untersuchten Datensätze im Bereich von 1,5 bis 6mm. Eine
Abweichung der Segmentierung um einen Voxel entspricht bei einer Auflösung in z-
Richtung von 0,3mm bereits einer Änderung der Gelenkspaltbreite um 5 bis 20%. Hier
ergibt sich ein Ansatz für eine zukünftige Verbesserung der Software.
6.4.2 Reproduzierbarkeit der Analyseparameter
Für die Diagnostik von größerer Bedeutung ist die Reproduzierbarkeit der einzelnen
Analyseparameter. In den Auswertevolumen wurden BMD, Entropie, Homogenität,
lokale und globale Anisotropie, Total Variation, Variogramm sowie differentielles Box
Counting auf Inter- und Intraoperator-Variabilität hin untersucht (Abb.41-48). In den
folgenden Diagrammen sind die prozentuale Änderung der Variationskoeffizienten der
jeweiligen VOIs in den kombinierten VOIs (tot.) und in den medialen (med.) und
lateralen (lat.) sub-VOIs dargestellt.

6.4 Reproduzierbarkeit Inter- / Intraoperator-Vergleich
69
BMD, Tibia CV(RMS)
0
2
4
6
8
10
12
14
K to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
BMD, Femur CV(RMS)
0123456789
K to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Abbildung 41: Variationskoeffizienten für BMD im Inter-/Intraoperator-Vergleich
Volumen und BMD zeigen derzeit - besonders im Interoperator-Vergleich - noch zu
hohe Variabilitäten. Hier muss in Zukunft untersucht werden, welchen Einfluss z.B. die
automatische endosteale Segmentierung auf die Resultate hat. Eine weitere Möglichkeit
den Einfluss unterschiedlicher Segmentierungen zu verringern ist die Limitierung des
Raycasting-Verfahrens durch die Regressionsebene der Wachstumsfuge (anstatt wie
bisher einer Kombination aus segmentierter Wachstumsfuge und Regressionsebene -
wie in Kap. 4.2 beschrieben)
Entropie, Tibia CV(RMS)
00,20,40,60,8
11,21,41,61,8
K to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Entropie, Femur CV(RMS)
00,20,40,60,8
11,21,41,61,8
K to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Abbildung 42: Variationskoeffizienten für Entropie im Inter-/Intraoperator-Vergleich

6 Validierung
70
Homogenität, Tibia CV(RMS)
0
0,5
1
1,5
2
2,5
3K
tot.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Homogenität, Femur CV(RMS)
00,5
11,5
22,5
33,5
44,5
K t
ot.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Abbildung 43: Variationskoeffizienten für Homogenität im Inter-/Intraoperator-Vergleich
Globale Anisotropie, Tibia CV(RMS)
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
K to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Globale Anisotropie, Femur CV(RMS)
00,05
0,10,15
0,20,25
0,30,35
0,40,45
K t
ot.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Abbildung 44: Variationskoeffizienten für globale Anisotropie im Inter-/Intraoperator-Vergleich
Lokale Anisotropie, Tibia CV(RMS)
0123456789
10
K to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Lokale Anisotropie, Femur CV(RMS)
0
0,5
1
1,5
2
2,5
3
3,5
K to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Abbildung 45: Variationskoeffizienten für lokale Anisotropie im Inter-/Intraoperator-Vergleich

6.4 Reproduzierbarkeit Inter- / Intraoperator-Vergleich
71
Total Variation, Tibia CV(RMS)
0
0,5
1
1,5
2
2,5K
to
t.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Total Variation, Femur CV(RMS)
0
0,2
0,4
0,6
0,8
1
1,2
1,4
K t
ot.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Abbildung 46: Variationskoeffizienten für Total Variation im Inter-/Intraoperator-Vergleich
Variogramm, Tibia CV(RMS)
0
1
2
3
4
5
6
7
K t
ot.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Variogramm, Femur CV(RMS)
0123456789
K t
ot.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Abbildung 47: Variationskoeffizienten für die Steigung des Variogramms im Inter-/Intraoperator-
Vergleich
Differentielles Box Counting, Tibia CV(RMS)
00,20,40,60,8
11,21,41,61,8
2
K t
ot.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Differentielles Box Counting, Femur CV(RMS)
0
0,20,4
0,60,8
1
1,21,4
1,6
K t
ot.
med
.
lat.
S1
tot.
med
.
lat.
S2
tot.
med
.
lat.
S3
tot.
med
.
lat.
[%] Inter
Intra
Abbildung 48: Variationskoeffizienten für differentielles Box Counting im Inter-/Intraoperator-
Vergleich

6 Validierung
72
Wie zu erwarten sind die Werte für Intraoperator-Variabilität konsistent besser als jene
im Interoperator-Vergleich. Mit Ausnahme von BMD, Homogenität und lokaler
Ansiotropie sind die Abweichungen im kortikalen Bereich im Mittel kleiner als 1%. Im
nächsten Kapitel wird auf die Auswirkung dieser Diskrepanzen – insbesondere in den
kortikalen Bereichen - näher eingegangen.
6.5 Diagnostische Relevanz
20 Datensätze von Patienten ohne osteoarthrotische Veränderungen wurden mit 20
Datensätzen von Patienten mit fortgeschrittener Osteoarthrose (Kellgren-Lawrence
Grad 2-3) verglichen. Das Durchschnittsalter der gesunden Probanden lag bei 39,3 ± 9,5
Jahren (in der OA-Gruppe bei 64,5 ± 11,0 Jahren). Für zukünftige Arbeiten wäre eine
Kontrollgruppe mit ähnlicher Altersstruktur von Vorteil. Der Altersunterschied wird
später, bei einer multimodalen Diskriminanzanalyse (Kap. 6.6), noch genauere
Beachtung finden.
Zunächst wurden jeweils zweiseitige t-Tests mit der Nullhypothese für gleichen
Mittelwert zum Signifikanzniveau 0,05 durchgeführt. Die folgenden Tabellen beinhalten
jeweils das überprüfte Maß, die Mittelwerte und Standardabweichungen für gesunde
und osteoarthrotische Gruppen sowie die Wahrscheinlichkeit eines Fehlers erster
Ordnung für Testergebnisse mit signifikantem Unterschied. Obwohl alle VOIs
untersucht wurden, werden im Folgenden nur signifikante Ergebnisse aufgeführt.
Für die Validität der Anwendung eines t-Tests muss die Normalverteilung der
Datenreihen gegeben sein. Es wurde dies mittels eines Shapiro-Wilk Signifikanztests
überprüft [93]. Die Vergleichbarkeit der Varianzen ist ebenfalls Voraussetzung des
durchgeführten t-Tests. Prüfung auf diese Voraussetzung wurde mit Hilfe eines F-Tests
durchgeführt [90].
Es wurden zuerst Parameter untersucht, welche in der herkömmlichen Diagnostik der
Osteoarthrose angewendet werden: Gelenkspaltsbreite sowie Veränderungen der
oberflächennahen VOIs (Osteophytenbildung).

6.5 Diagnostische Relevanz
73
6.5.1 Gelenkspalt
Um die Diagnostik in Analogie zu planaren Röntgenaufnahmen nachzuvollziehen,
wurde die Veränderung der minimalen und mittleren Gelenkspaltbreite untersucht. Bei
den meisten Fällen von OA ist die Veränderung des Gelenkspalts einseitig stärker betont
[30]. Die mittleren und minimalen Gelenkspaltbreiten sind abhängig von der natürlichen
Größe des Knies der Patienten. Um eine Normierung durchzuführen - und die
asymmetrische Veränderung zu erfassen - wurde zusätzlich das Verhältnis aus
minimaler zu mittlerer Gelenkspaltbreite untersucht. Eine weitere Methode die
Gelenkspaltveränderung zu normieren, besteht darin, sie auf das Volumen der Summe
aus tibialem und femoralem kortikalen Volumen zu beziehen (Tab. 7).
Maß Kontrolle OA p-Wert
Mittlere Gelenkspaltbreite [mm]
6,49±0,67 6,13±0,63 0,05
Minimale Gelenkspaltbreite [mm]
2,25±0,48 1,71±0,49 <0,001
Minimale Breite zumittlerer Breite
0,34±0,05 0,28±0,07 <0,01
Gelenkspaltvolumen zu kortikalem Volumen
1,71±0,22 1,93±0,25 <0,01
Tabelle 7:Diagnostik, Gelenkspalt
Das Gelenkspaltvolumen selbst unterschied sich nicht signifikant zwischen den
untersuchten Gruppen. Der signifikante Unterschied im Verhältnis vom
Gelenkspaltvolumen zum kortikalen Volumen beruht wahrscheinlich einzig auf der
Volumenänderung der kortikalen VOIs (sieher6.5.2). Zudem wurde untersucht, ob sich
das Verhältnis des Gelenkspaltvolumens zu den S1 Volumen
1S
tGelenkspal
Vol
Volr =
bzw. zum Gesamtvolumen der VOIs

6 Validierung
74
321 SSSK
tGelenkspal
VolVolVolVol
Volr
+++=
als diagnostisches Maß eignet. Für beide Verhältnisse konnte jedoch, weder für Tibia
noch für Femur, ein signifikanter Gruppenunterschied festgestellt werden.
6.5.2 Kortikales Volumen
Es ist zu vermuten, dass Osteophyten zu einer Vergrößerung der kortikalen VOIs führen
(Tab. 8). Es wurde das Verhältnis des kortikalen Volumens zum S1 Volumen untersucht.
1S
K
Vol
Volr =
Dieser Ansatz ergibt sich aus der Überlegung, dass das erste subchondrale Volumen als
erstes Drittel der Distanz zwischen Gelenkspalt und Wachstumsfuge definiert ist (siehe
Kap. 4.2). Das kortikale Volumen wird davon ausgehend als dasjenige Volumen
definiert, welches durch Subtraktion des endostealen Volumens übrig bleibt. Eine
Vergrößerung des kortikalen Volumens sollte somit eine Verkleinerung des ersten
subchondralen Volumens nach sich ziehen und umgekehrt. Das Verhältnis zwischen
beiden sollte sich besonders auffällig ändern. Antagonistisch zu diesem Ansatz ist die
Tatsache, dass OA mit einer Verminderung der Dicke der kortikalen Schicht einhergeht
(Abb. 9)
Osteoarthrose tritt hauptsächlich auf der medialen Seite des Kniegelenks auf [30]. In
Zusammenhang mit den oben angeführten Überlegungen wurde untersucht, ob sich in
den kortikalen Volumen eine Verschiebung von medialer zu lateraler Seite feststellen
lässt.
VOI Kontrolle OA p-Wert
Vol TK, gesamt / Vol TS1 0,79±0,20 0,66±0,12 <0,05
Vol FK, gesamt / Vol FS1 0,54±0,11 0,43±0,05 <0,05
Vol TK medial / lateral 1,11±0,13 1,21±0,22 0,05
Vol FK medial / lateral 0,77±0,21 0,86±0,13 0,05
Tabelle 8:Diagnostik, kortikale Volumen

6.5 Diagnostische Relevanz
75
Die relativen kortikalen Volumen der gesunden Patienten waren im Mittel größer als
jene der erkrankten. Dickenreduktion des kortikalen Bereichs bei fortschreitender OA
[46] trägt anscheinend mehr zur Veränderung des Volumens in diesem Stadium der
Krankheit bei als das Anwachsen von Osteophyten. Das Verhältnis zwischen kortikalem
und S1 Volumen ist in der Tibia größer, da die S1 Volumen wesentlich kleiner sind,
während die kortikalen Dicken für Femur und Tibia in etwa gleich sind (vgl. Abb. 31,
oben).
Es zeigt sich jedoch eine Verschiebung hin zu einem höheren Verhältnis von medialem
zu lateralem Volumen bei OA-Patienten. Dies entspricht der Erwartung, dass im Mittel
die mediale Seite mehr und die laterale Seite weniger belastet wird, da OA häufiger
medial als lateral auftritt [30]. Zu den ausgewerteten Datensätzen gab es keine Angaben,
ob es sich um mediale oder laterale OA handelt. Durch einbringen dieser, zusätzlichen
Information lässt sich in Zukunft möglicherweise die Aussagekraft dieses Parameters
erhöhen.
Teil der Dickenreduktion ist vermutlich auf die Methode zurückzuführen, mit der die
endosteale Oberflächen segmentiert werden. Es wird nach [53] ein Grauwertprofil
ausgehend von der Oberfläche erstellt, das bis zu einem Abfall um 50% des Grauwertes
den Bereich der periostealen Region zuzählt. Durch die in der Literatur in
histologischen Schnitten beobachtete erhöhte Porosität im Übergangsbereich zwischen
kortikaler VOI und S1 [84] kann es daher dazu kommen, dass poröse kortikale Bereiche
zum S1 Volumen gezählt werden. Gleichzeitig bleibt durch Ausschluss der porösen
Bereiche aus der kortikalen Region der BMD dieser VOI weitgehend konstant. Der
Einfluss der endostealen Segmentierung auf das Analyseergebnis ist in Zukunft näher zu
betrachten. Eine alternative Bestimmung der kortikalen VOI und die Definition
weiterer, Gelenkspaltnaher VOIs erscheinen hierfür aussichtsreich. Der Verlauf des
Knochendichte mit Abstand zum Gelenkspalt wird eingehender in 6.5.4 untersucht.
Ein Kriterium der KL-Skala sind Veränderungen des Knochenoberfläche (Osteophyten).
Oberflächennahe Veränderungen sind möglicherweise besser zu charakterisieren wenn
die VOIs näher am Gelenkspalt positioniert werden. Auch ist zu überlegen, ob
Osteophyten getrennt betrachtet werden sollten. Die derzeitige Definition der VOIs
beschränkt sich auf Regionen, die durch den Gelenkspalt begrenzt werden. Osteophyten

6 Validierung
76
treten jedoch häufig an den Rändern des Tibiaplateaus bzw. der Femurkondylen auf,
was dazu führen kann, dass sie mit der hier vorgestellten Segmentierungsmethodik nicht
vollständig erfasst werden.
6.5.3 BMD
Kadaver- und MicroCT-Studien haben gezeigt, dass ein Unterschied in der trabekulären
Struktur zwischen gesunden und OA-Patienten besteht [48, 84, 110]. Dort wurde
untersucht, ob sich daraus auch Veränderungen der Knochenmineraldichte (BMD)
ergeben. In dieser Arbeit konnte jedoch in keinem der kortikalen oder subchondralen
Volumen signifikante BMD-Unterschiede festgestellt werden. Selbst unter der
Annahme, dass OA meist medial auftritt, konnte in den Verhältnissen zwischen
medialem und lateralem BMD der einzelnen sub-VOIs kein signifikanter Unterschied
beobachtet werden. In Zukunft sollte untersucht werden, ob eine zusätzliche Aufteilung
der Subvolumen in anteriore/posteriore VOIs (wie z.B. in [48]) bessere Ergebnisse
liefert.
6.5.4 Grauwertprofile
Als Maß zur Beschreibung der BMD-Verteilung in Belastungsrichtung wurden
Grauwertprofile in Abhängigkeit vom Abstand zum Gelenkspalt ausgewertet. Hierzu
wurden wie in Kap. 5.2.1 beschrieben, Grauwertprofile für Tibia und Femur erstellt und
für die beiden Gruppen miteinander verglichen. Abbildungen 49 und 50 zeigen
Grauwertprofile von jeweils 10 kranken und 10 gesunden Probanden für Femur und
Tibia. Zur besseren Vergleichbarkeit wurden die Profile jeweils auf den maximalen
Grauwert normiert.

6.5 Diagnostische Relevanz
77
Abbildung 49: Grauwertverteilung, Tibia (normiert)
Abbildung 45: Grauwertverteilung, Femur (normiert)
Geringe BMD-Werte bei geringem Abstand zum Gelenkspalt (1-2Voxel) sind auf
Partialvolumenartefakte zurückzuführen. Es zeigt sich in allen Datensätzen ein Anstieg
auf ein Maximum des BMD in der kortikalen VOI. Anschließend folgt ein
kontinuierlicher Abfall auf Werte von ca. 60-70% des Maximums mit zunehmendem
Abstand zum Gelenkspalt.
In der Tibia lässt sich eine Veränderung des Grauwertprofils im Übergang zwischen
kortikalem und S1 Volumen bei OA Patienten erkennen. Zunächst scheint der Abfall des
BMD stärker - im Vergleich zu gesunden Probanden - während sich anschließend eine
BMD Plateau ergibt (Pfeile in Abb. 49). Obwohl in der Analyse der einzelnen VOIs
nicht signifikant war ist eine Veränderung des BMD-Profils zwischen den beiden

6 Validierung
78
Gruppen dennoch erkennbar. In der Literatur ist im Tiermodell in histologischen
Schnitten eine Veränderung der Trabekularisierung in diesen Bereichen zu beobachten
[46] (Abb. 9).
Es wird vermutet, dass bei gesunden Probanden die Knochenmineraldichte mit der
Distanz zur periostealen Oberfläche stetig abfällt, während bei OA Patienten zunächst
ein Bereich erhöhter Porosität zwischen kortikalem und subchondralem Bereich
entsteht, der den Grauwertgradienten in diesem Abschnitt vermindert. Zu subchondralen
Bereichen, mit größerem Abstand zum Gelenkspalt hin, fällt der Gradient wieder stärker
ab, um ab der Mitte der S1 VOI wieder einen vergleichbaren Verlauf mit gesunden
Patienten anzunehmen. Diese Änderung des Grauwertgradienten im porösen Abschnitt
macht sich als ein erhöhtes Maximum der zweiten Ableitung des Profils in einem
Abstand von etwa 4-5 Voxeln zur Tibiaoberfläche bemerkbar (Abb. 51, Bereich der
Partialvolumenartefakte wurde abgeschnitten).
Abbildung 51: Grauwertverteilung, Tibia, 2. Ableitung
Die Varianzen der beiden Datenreihen erreichen nicht die von einem F-Test geforderte
Güte, weswegen hier ein t-Test mit unterschiedlicher Varianz verwendet wurde (Tab. 9).
Maß Kontrolle OA p-Wert
Tibia, Maximum der 2. Ableitung
0,0087±0,0025 0,0210±0,0095 <0,01
Tabelle 9: Grauwertverteilung, Tibia, 2. Ableitung

6.5 Diagnostische Relevanz
79
6.5.5 Entropie
Entropie spiegelt die Gleichverteilung von Grauwerten innerhalb einer VOI wider. Mit
auftreten der erhöhten Trabekularisierung im Übergangsbereich zwischen kortikaler uns
S1 VOI erhalten wir einen größeren Grauwertbereich über den unser Rebinning
stattfindet (siehe 5.2.2). Dies führt, zusammen mit einer verminderten Homogenität
(siehe 6.5.6), zu einer Erhöhung der Entropie in den kortikalen VOIs (Tab. 10).
VOI Kontrolle OA p-Wert
TK, gesamt 5,68±0,09 5,75±0,10 <0,01
TK, medial 5,73±0,06 5,80±0,11 <0,01
TS1, gesamt 5,56±0,13 5,47±0,14 <0,05
TS1, lateral 5,51±0,09 5,37±0,16 <0,01
TS2, medial 5,37±0,12 5,44±0,11 <0,05
FK, gesamt 5,49±0,09 5,59±0,12 <0,01
FK, medial 5,56±0,12 5,65±0,12 <0,05
FK, lateral 5,49±0,10 5,60±0,13 <0,01
FS1, medial 5,37±0,12 5,44±0,11 <0,05
FS2 lateral 5,36±0,11 5,32±0,10 <0,05
Tabelle 10: Entropie [bit]
In den subchondralen VOIs ist der Unterschied zwischen Kontroll- und OA-Gruppe
nicht mehr eindeutig. Ein Grund für die fallenden Entropiewerte in S1 ist
möglicherweise auf die - in Kapitel 6.5.2 diskutierte - Verschiebung der Grenze
gegenüber der kortikalen VOI zurückzuführen. Die Interpretation Der Entropieänderung
von trabekulärem Knochen ist schwierig. Die teilweise ansteigenden, teilweise
fallenden Entropiewerte in den S1 und S2 VOIs zwischen gesunder und OA-Gruppe
bedürfen weitergehender Untersuchung.

6 Validierung
80
6.5.6 Homogenität
Homogenität beschreibt die Standardabweichung des BMD um den Mittelwert (Tab.11)
VOI Kontrolle OA p-Wert
TK, gesamt 279±19 305±33 <0,01
TK, medial 278±19 312±36 <0,001
FK, gesamt 242±21 271±29 <0,001
FK, medial 243±27 274±33 <0,01
FK, lateral 235±22 262±30 <0,01
Tabelle 11: Homogenität [HU]
Wie erwartet, erhöht sich die Standardabweichung des BMD in den kortikalen
Bereichen bei auftretender OA. Eine größere Standardabweichung der Grauwerte lässt
sich durch eine gleichmäßigere Verteilung der Voxel über den Grauwertbereich erklären.
Dies geht konform mit der Beobachtung aus der Entropieänderung.
6.5.7 Total Variation
Wie bereits bei den globalen Grauwertmaßen zu beobachten erhöht sich auch die lokale
Inhomogenität (Tab. 12).
Maß Kontrolle OA p-Wert
TK, gesamt 260±23 277±31 <0,05
TK, medial 261±27 279±36 <0,05
TK, lateral 260±21 276±30 <0,05
FK, gesamt 246±25 275±32 <0,01
FK, medial 254±29 284±35 <0,01
FK, lateral 239±24 267±32 <0,01
Tabelle 12: Total Variation [HU]
Eine lokale Zunahme der Inhomogenität lässt sich in mehrere Hinsicht interpretieren.
Einerseits kann es sich um eine Abnahme gerichteter Strukturen in Belastungsrichtung
handeln. Andererseits ist auch eine Zunahme von Querverbindungen zwischen
Trabekeln möglich. Beide Hypothesen würden durch die Messergebnisse der lokalen
Anisotropie gestützt (6.5.9).

6.5 Diagnostische Relevanz
81
6.5.8 Globale Anisotropie
Globale Anisotropie bezieht sich auf die Richtungsänderung der Grauwertgradienten
einzelner Voxel gegenüber dem mittleren Grauwertgradienten der Gesamtregion. Es
konnte zwischen gesunden und erkrankten Probanden in keiner VOI signifikante
Unterschied festgestellt werden.
6.5.9 Lokale Anisotropie
Lokale Anisotropie gibt den lokalen Unterschied des Grauwertgradienten im Bezug auf
das Mittel der direkten Umgebung an (Tab. 13)
Maß Kontrolle OA p-Wert
TK, gesamt 14,96±0,78 13,39±1,00 <0,001
TK, medial 14,76±0,72 13,47±1,10 <0,001
TK, lateral 14,44±1,02 13,02±1,25 <0,001
TS2, gesamt 18,86±0,29 18,64±0,31 <0,05
TS2, medial 18,74±0,35 18,53±0,29 <0,05
TS2, lateral 18,74±0,30 18,52±0,37 <0,05
TS3, gesamt 18,94±0,27 18,72±0,28 <0,05
TS3, medial 18,81±0,31 18,60±0,29 <0,05
TS3, lateral 18,82±0,30 18,62±0,33 <0,05
FK, gesamt 15,85±0,53 14,49±0,37 <0,001
FK, medial 15,37±0,59 14,36±0,48 <0,001
FK, lateral 15,99±0,67 14,41±0,55 <0,001
Tabelle 13: lokale Anisotropie [°]
In allen signifikant unterschiedlichen Bereichen ist eine Verminderung der lokalen
Anisotropie von gesunder zu OA-Gruppe zu beobachten. Die Differenz wird als eine
geringere Ausprägung von quer verlaufenden Trabekeln zwischen den, in
Hauptkraftrichtung verlaufenden, Trabekeln interpretiert. Dies deckt sich mit den oben
erwähnten Beobachtungen im MicroCT und histologischen Untersuchungen am
Tiermodell sowie in Kadaverstudien am Menschen [2, 46, 84]. Während die kortikalen
VOIs bei gesunden Subjekten weitgehend homogen zu sein scheinen, bilden sich im
Verlauf der OA am Übergang zwischen kortikalen und subchondralen Schichten

6 Validierung
82
zunehmend gerichtete Strukturen aus. In der Tibia ist auch in den S2 und S3 VOIs eine
stärkere lokale Gerichtetheit zu erkennen. Die Signifikanz ist jedoch hier um 3
Größenordnungen geringer als in den kortikalen Bereichen.
6.5.10 Variogramm
Abbildung 52: Beispiel-Variogramme (kortikale VOI der Tibia)
Im Variogramm sind die unterschiedlichen Steigungen zwischen den beiden Gruppen zu
erkennen (Abb. 52). Auch hier macht sich die Verringerung der Querverstrebungen in
einem erhöhten Grauwertunterschied über größere Distanzen bemerkbar. In Tabelle 14
sind die mittleren Steigungen der Variogramme für die signifikant unterschiedlichen
VOIs dargestellt.
Maß Kontrolle OA p-Wert
TK, gesamt 28,01±2,63 34,37±3,57 <0,001
TK, medial 29,33±2,49 35,74±3,10 <0,001
TK, lateral 30,51±2,76 36,03±4,90 <0,001
FK, gesamt 20,74±2,48 28,75±3,05 <0,001
FK, medial 24,58±3,00 31,61±3,73 <0,001
FK, lateral 22,56±2,21 29,82±3,37 <0,001
Tabelle 14:Steigung der Regressionsgerade des Variogramms [HU/Voxel]
Die erhöhte Variabilität der Grauwerte im Einzugsbereich des Variogramms bestätigt die
Ergebnisse aus den Abschnitten über Entropie, Homogenität und Total Variation.

6.5 Diagnostische Relevanz
83
6.5.11 Differentielles Box Counting
Eine Trabekularisierung des Übergangs zwischen kortikaler und S1 VOI führt in den
kortikalen VOIs zu einer Verringerung der Überdeckung des Volumens. Dies spiegelt
sich in einer geringeren fraktalen Dimension wider (Tab. 15).
Maß Kontrolle OA p-Wert
TK, gesamt 2,54±0,04 2,50±0,03 <0,001
TK, medial 2,54±0,04 2,50±0,04 <0,001
TK, lateral 2,53±0,04 2,48±0,04 <0,001
FK, gesamt 2,58±0,03 2,51±0,03 <0,001
FK, medial 2,55±0,04 2,50±0,03 <0,001
FK, lateral 2,58±0,03 2,51±0,04 <0,001
Tabelle 15:Box Counting, fraktale Dimension
Dass bei differentiellem Box Counting die fraktale Dimension in der OA-Gruppe
geringer ausfällt, während diese im Variogramm höher ist, liegt an den verschiedenen
Parametern, deren fraktales Verhalten in den beiden Verfahren gemessen werden.
Differentielles Box Counting misst den Grenzwert der Überdeckung des Volumens mit
trabekulären Strukturen (Grauwert) während ein Variogramm das fraktale Verhalten der
Grauwertdifferenz charakterisiert.
6.5.12 Zusammenfassung der diagnostisch relevanten Parameter
Fast alle Texturparameter sind ausschließlich im Bereich der kortikalen VOIs
signifikant unterschiedlich zwischen gesunden und OA-Patienten. Auch zeigt sich eine
weitgehende Symmetrie des Unterschieds in Femur und Tibia - sowohl in Bezug auf die
Richtung der Unterschieds als auch in Bezug auf welche VOIs signifikante unterschiede
aufweisen. Dies verdeutlicht die Notwendigkeit gelenksnahe Regionen genauer zu
untersuchen. Regionen in weiterer Entfernung zum Gelenkspalt zeigten in diesem
Kollektiv nur in Ausnahmefällen signifikante Unterschiede. Es kann sein, dass auf
Grund der geringen Anzahl von Datensätzen die statistische Aussagekraft zu gering ist.
Die beobachteten Unterschiede der gemessenen Parameter zwischen den Gruppen
stehen, mit Ausnahme der BMD-Veränderungen, im Einklang mit den in der
Literaturrecherche gefundenen Kadaverstudien, MicroCT-Aufnahmen und Tiermodellen
[2, 46, 48, 84].

6 Validierung
84
6.6 Diskriminanzanalyse
In den bisherigen Abschnitten wurden nur einzelne Parameter auf Signifikanz geprüft.
Im Folgenden wird untersucht, wie gut sich mit Hilfe mehrerer Parameter zwischen
gesunder und OA-Gruppe diskriminieren lässt. Da das Alter der beiden Gruppen
signifikant unterschiedlich ist muss dieser Parameter in die Betrachtung mit
aufgenommen werden. Die Diskriminanzanalyse wurde in SPSS 17 durchgeführt. Nur
signifikant unterschiedliche Parameter aus den vorhergegangenen Abschnitten wurden
berücksichtigt:
• Minimaler Spaltabstand
• Mittlerer Spaltabstand
• Verhältnis aus minimalem zu mittlerem Spaltabstand
• Verhältnis von Spaltvolumen zu den kortikalen Volumen
• Verhältnis der Volumen TK/TS1 und FK/FS1
• Verhältnis des TK medial und TK lateral Volumens (bzw. des FK medial und FK
lateral Volumens)
• Entropie in TK und FK sowie TS1, TS2, FS1 und FS2
• Homogenität in TK und FK
• Total Variation in TK und FK
• Lokale Anisotropie in TK und FK sowie TS2 und TS3
• Variogramm in TK und FK
• Fraktale Dimension (Differentielles Box Counting) in TK und FK
In Fällen, in denen sowohl eine gesamt-VOI, als auch deren mediale und laterale sub-
VOIs signifikante Unterschiede zeigten, wurde nur die gesamt-VOI in die
Diskriminanzanalyse aufgenommen. Der Grund hierfür ist die größere Signifikanz der
gesamt VOIs gegenüber den sub-VOIs.
Die deutlich jüngere Altersstruktur der Kontrollgruppe erlaubt bereits mit Hilfe des
Alters alleine eine gute Diskriminanz zwischen den beiden Gruppen (Tab. 16).

6.6 Diskriminanzanalyse
85
Vorhergesagte Gruppenzugehörigkeit
Kontrolle OA Gesamt
Kontrolle 17 3 20
OA 4 16 20
Tabelle 16:Trennung auf Grund des Alters
Durch Eliminierung der weniger signifikanten Parameter ergab sich zuletzt eine Kombination aus lokaler Ansiotropie in der kortikalen VOI des Femur, dem Alter und dem Verhältnis zwischen den Volumen von kortikaler und erster subchondraler VOI in der Tibia (Tab. 17) als optimal, um OA von gesunden Datensätzen zu unterscheiden.
Vorhergesagte Gruppenzugehörigkeit
Kontrolle OA Gesamt
Kontrolle 20 0 20
OA 0 20 20
Tabelle 17:Trennung durch lokale Anisotropie FK, Alter und Verhältnis TK zu TS1 Volumen
Über die Strukturmatrix werden die Beiträge zur Gruppentrennung (Tab 18). Die Werte
sind um die Korrelation der Variablen zueinander bereinigt.
Maß Funktion FK, lokale Anisotropie -,756
Alter ,638
TK Volumen / TS1 Volumen -,184
Tabelle 18:Strukturmatrix der signifikantesten Parameter
Hierbei zeig sich die lokale Anisotropie als besonders geeignet eine Diskriminierung
zwischen OA und gesunden Patienten durchzuführen. Auf die beiden Gruppen
angewandt erzielt dieser Parameter alleine bereits eine perfekte Einteilung. Durch die
Hinzunahme der beiden anderen Parameter wird lediglich die Trennschärfe erhöht.
Nach Elimination der lokalen Anisotropie in FK und des Verhältnisses von TK Volumen
zu TS1 Volumen wurde die Diskriminanzanalyse erneut durchgeführt. Mit Hilfe einer

6 Validierung
86
Kombination aus Variogramm (FK), Alter, minimalem Gelenkspaltabstand, und
Homogenität (FK) konnte erneut eine bessere Unterscheidung als mit Alter alleine
getroffen werden. Lediglich ein OA Patient wurde mit dieser Kombination von
Parametern falsch klassifiziert.
Für einen dritten Lauf wurden die oben angeführten Parameter - mit Ausnahme des
Alters - aus der Analyse entfernt. Eine Kombination aus Alter und der FK fraktalen
Dimension nach dem differentiellen Box Counting Verfahren führte zu einer
Klassifikation - wobei auch nur ein OA-Patient der falschen Gruppe zugeordnet wurde.
• Folgende Kombinationen waren ebenfalls der reinen Klassifikation mittels des
Alters überlegen:
• Alter und Entropie (FK)
• Alter und Variogramm (TK)
• Alter und Entropie (TK)
• Alter, Homogenität (FK) und mittlerer Gelenkspaltabstand
Es zeigt sich also, dass die gemessenen Parameter in der Lage sind die Trennschärfe
zwischen den Gruppen zu erhöhen. Eine Größere Gruppenstärke und eine der
Altersgruppe der OA-Patienten besser angepasste Kontrollgruppe kann hier in Zukunft
sicher bessere Aussagen darüber machen, welche Parameter zur Diskriminierung – und
im weiteren Verlauf der Studie zur Verlaufskontrolle – herangezogen werden können.

7 Diskussion und Ausblick
87
7 Diskussion und Ausblick
In dieser Arbeit wurde eine Methode zur dreidimensionalen Segmentierung und
quantitativen Analyse von CT-Daten für osteoarthrotische Prozesse im Knie vorgestellt.
Die erstellte Software ermöglicht die präzise Messung diagnostisch relevanter
Parameter in anatomisch definierten Regionen. Durch die weitgehend vollautomatische
Segmentierung, Analyse und die Minimierung der Anzahl der Benutzereingriffe wird
der Einfluss von Benutzerinteraktionen auf das Ergebnis verringert.
Da sich die Krankheit durch eine Veränderung der Knochenoberfläche auszeichnet,
wurde zur Definition von Knochenkoordinatensystemen die Wachstumsfuge als
unveränderliche Struktur herangezogen. Zu ihrer Segmentierung wurde ein neuartiger
Algorithmus basierend auf einer Chainmail Datenstruktur entwickelt. Der Algorithmus
ist in der Lage extrem kontrastarme Strukturen zu erkennen, ohne aufwändige
Parametrisierung oder Definition von Initialzuständen (wie bei aktiven Konturen oder
Live-Wire). Die Anwendung dieses Algorithmus auf andere, schwer zu segmentierende
Strukturen im medizinischen Umfeld soll in der Zukunft untersucht werden.
Ein weiterer, neuer Segmentierungsalgorithmus extrahiert vollautomatisch den
Gelenkspalt. Auch dieser Algorithmus kann möglicherweise in der Segmentierung von
anderen arthrotischen Gelenken oder als Segmentierung für die Zwischenräume von
Wirbelkörpern zum Einsatz kommen.
Die benutzten Texturparameter werden bereits in vielen Bereichen der
Charakterisierung von Knochenstrukturen angewandt. Der neu entwickelte Parameter
der lokalen Anisotropie kann möglicherweise auch bei den hier am Institut laufenden
Untersuchungen zur Osteoporose zum Einsatz kommen.
Auf Grund der stark unterschiedlichen Altersstruktur zwischen OA- und Kontrollgruppe
konnte nicht entschieden werden, ob der Unterschied primär auf das Alter oder die
krankheitsbedingten Veränderungen zurückzuführen ist. Trotz des starken
Altersunterschieds zwischen den Gruppen konnte in der multivariaten
Diskriminanzanalyse nachgewiesen werden, dass einige der Parameter noch einen
signifikanten Beitrag leisten. Dies lässt eine weitere Untersuchung von OA an

7 Diskussion und Ausblick
88
klinischen CT-Aufnahmen mittels Textur- und Geometrieparametern sinnvoll
erscheinen.
In Zukunft ist zu prüfen, ob die Definition des endostealen Volumens noch verbessert
werden kann, da sich hier besonders durch die Dickenminderung der kortikalen Schicht
[46] Variabilitäten ergeben, die sich auf die Analyseergebnisse auswirken. Es war
überraschend, dass die subchondralen VOIs (S1-S3) in der multivariaten Analyse keine
Rolle spielten. Möglicherweise ist dies auf die zu geringe Gruppenstärke der
Auswertung zurückzuführen.
Auch ist zu überlegen, ob eine Modifikation der VOIs durch Einführung mehrerer,
näher am Gelenkspalt gelegener VOIs bessere Ergebnisse liefert. Eine Unterteilung in
anteriore und posteriore Regionen wie in [48] könnte zudem weitere diagnostische
Merkmale liefern. Zusätzliche Informationen zu den Patientendaten (z.B. ob es sich um
eine laterale oder mediale OA handelt) kann mit Hilfe der medialen/lateralen VOIs in
Zukunft dedizierter untersucht werden.
Eine, besser der Altersstruktur der Patientengruppe angepasste, Kontrollgruppe ist
notwendig, um die aus den t-Tests gefundenen signifikanten Änderungen zwischen OA
und Kontrolle durch eine altersadjustierte, binäre, logistische Regression zu überprüfen.
Zuletzt ist die Software auf die die baseline und follow-up Datensätze der POLKA-
Studie anzuwenden sobald diese verfügbar sind. Da die Studie von 2 auf 3 Jahre
Laufzeit verlängert wurde, konnte dieser Teil nicht mehr in die hier vorliegende Arbeit
einfließen.

8 Zusammenfassung
89
8 Zusammenfassung
Hintergrund und Ziele: Osteoarthrose ist eine weit verbreitete Krankheit, deren frühe
Erkennung und genaue Charakterisierung volkswirtschaftlich von Bedeutung ist.
Klinische CT-Daten können hierfür mehr Informationen liefern als herkömmliche
Röntgenaufnahmen – insbesondere im Bereich der kortikalen und subchondralen
Knochenstruktur. Diese Arbeit zielte darauf ab osteoarthrotische Veränderungen des
Knies zu quantifizieren. Besonderer Wert wurde auf eine Vorgehensweise mit minimaler
Benutzerinteraktion gelegt, um Inter- und Intraoperator-Variabilitäten zu minimieren.
Methoden: Anhand von klinischen CT-Daten der multizentrischen, longitudinalen
POLKA-Studie wurden Segmentierung und Analyse durchgeführt. Periosteale und
endosteale Volumen von Tibia sowie Femur wurden analog zum in [71] beschriebenen
Verfahren ermittelt. Über die Segmentierung der Wachstumsfugen mit einem neuen
Chainmail-Segmentierungsalgorithmus konnten eindeutige Orientierungspunkte
bestimmt werden. Ein Verfahren zur automatischen Bestimmung des Gelenkspalts
wurde entwickelt. Alle Verfahren zur Segmentierung wurden als 3D-Verfahren
implementiert. Mit Hilfe von anatomischen Koordinatensystemen wurden
Auswertevolumen in definierten Abständen zum Gelenkspalt, nach medialer und
lateraler Seite getrennt, platziert. Textur-, BMD- und Geometrie-Parameter wurden
innerhalb der VOIs quantifiziert. Ausschließlich Analyseverfahren, welche keine
weitere Binarisierung der Daten benötigen, kamen zum Einsatz.
Ergebnisse: Alle vorliegenden Datensätze konnten segmentiert und analysiert werden.
Im Inter-(Intra-)operator-Vergleich zeigten die Analyseergebnisse derjenigen Parameter,
die signifikant zwischen gesunden und OA-Gruppen diskriminieren konnten, eine
geringe Variabilität. Im Mittel lag der CV[%] für Entropie bei 0,5% (0,3%);
Homogenität: 1,2% (1,0%); lokale Anisotropie 3% (1,5%); Total Variation 0,5% (0,5%);
Variogramm 2,2% (1,0%); Differentielles Box Counting 0,5% (0,3%). Die Stabilität der
Segmentierungsergebnisse wurde durch Variation der Benutzereingaben überprüft.
Änderung der Saatpunkte des Chainmailings führte im Mittel zu 1% Änderung in BMD.
Verschiebung der Maskenvolumen änderte die periosteale Segmentierung um weniger
als 1%. Veränderung des Betrachtungsausschnitts änderte die Lage des ACS im Schnitt
um weniger als 0,001°. Die genannten Parameter waren in der Lage in univariaten Tests

8 Zusammenfassung
90
zwischen gesunder und OA-Gruppe zu unterscheiden. Die Altersstruktur zwischen OA-
und Kontrollgruppe war signifikant unterschiedlich. In multivariaten
Diskriminanzanalyse mit unterschiedlichen Parameter-Pools wurde jeweils mindestens
ein Parameter identifiziert, der zusätzlich zum Alter einen signifikanten Beitrag zur
Gruppendiskriminierung beitrug. Einzig für BMD und globale Anisotropie konnten
keine signifikanten Unterschiede ermittelt werden.
Praktische Schlussfolgerungen: Die Auswertung von Knochenveränderungen -
bedingt durch osteoarthrotische Prozesse - lässt sich an klinischen CT-Datensätzen
quantifizieren. Trotz der Auswirkungen der Krankheit auf Gelenkspalt und
Knochenoberfläche können im Knocheninneren unveränderliche Punkte zur Definition
eines stabilen Knochenkoordinatensystems gefunden werden. Textur- und
geometriebasierte Analyseverfahren sind in der Lage zusätzliche Informationen zu den
herkömmlichen, diagnostischen Parametern (Gelenkspaltbreite und
Osteophytenbildung) zu liefern.

Literaturverzeichnis
91
Literaturverzeichnis
[1] Ahlbäck S., Osteoarthrosis of the knee: a radiographic investigation, Acta.
Radiol. Diagn., Suppl. 277, pp. 7-72, 1968
[2] Amanai T., Micro-CT analysis of experimental candida osteoarthritis in rats,
Micropathologia, Mycopathologia, Vol. 166(3), pp. 133-141, 2008
[3] Anderson J., Felson D., Factors associated with osteoarthritis of the knee in
the First National Health and Nutrition Examination Survey (NHANES I):
Evidence for an association with overweight race and physical demands of
work, Am. J. Epidemiol. Vol. 128(1): 179-189, 1998
[4] Bakhireva L.N., Barrett-Connor E., Kritz-Silverstein D., Morton D.J.,
Modifiable predictors of bone loss in older men: A prospective study, Am. J.
Prev. Med., Vol. 26(5) pp. 432-442, 2004
[5] Barrett W.,MortensenE., Interactive live-wire boundary extraction, World
Congress on Medical Physics and Biomedical Engineering 2006 IFMBE
Proceedings, Vol 14(15), pp. 2636-2638, 2006
[6] Barros M., Sobreira F., Accuracy of lacunarity algorithms in texture
classification of high spatial resolution images from urban areas, The
International Archives of the Photogrammetry, Remote Sensing, and Spatial
Information Sciences. Vol. 37(3b). Beijing, China, pp.417-422, 2008
[7] Bernhard-Ströl C., Hachenberger C., Trugenberger-Schnabel A., Bundesamt
für Strahlenschutz (Hrsg.), BMU Jahresbericht 2007, Bundesamt für Umwelt
(Hrgb), Naturschutz und Reaktorsicherheit, Bonn, 2007
[8] Black P., Dictionary of Algorithms and Data Structures, U.S. National Institute
of Standards and Technology (online),
http://www.itl.nist.gov/div897/sqg/dads/ , 2008
[9] Bobinac D., Spanjol J., Zoricic S., Maric I., Changes in articular cartilage and
subchondral bone histomorphometry in osteoarthritic knee joints in humans,
Bone Vol.32(3), pp. 284-290, 2003
[10] Bolbos R.I., Zuo J., Banerjee S., Link TM., Ma C.B., Li X., Majumdar S.,
Relationship between trabecular bone structure and articular cartilage
morphology and relaxation times in OA of the knee joint using parallel MRI at
3T, Osteoarthritis cartilage, Osteoarthr. Cartilage Vol.16(10), pp. 1150-1159,
2008

Literaturverzeichnis
92
[11] Bouchgua M., Alexander K., Carmel E.N., d'Anjou M.A., Beauchamp G.,
Richard H., Laverty S. (2009) Use of routine clinical multimodality imaging in a
rabbit model of osteoarthritis part II: bone mineral density assessment,
Osteoarthr.Cartilage. Vol.17(2), pp. 197-204
[12] Boutrey N., B. Cortet, P. Dubois, X. Marchandise, A. Cotten, Trabecular bone
structure of the calcaneous: Preliminary in vivo MR imaging assessment in men
with osteoporosis, Radiology. Vol.227(3), pp. 708-717, 2003
[13] Boyd S.K., Matyas J.R., Wohl G.R., Kantzas A., Zernicke R.F., Early regional
adaptation of periarticular bone mineral density after anterior cruciate ligament
injury, J Appl. Physiol .Vol.89(6), pp. 2359-2364, 2000
[14] Brosseau L., Wells G.,Tugwell P., Egan M., Dubouloz CJ., Casimiro L. Robinson
V. A., Pelland L. McGowan J., Ottawa panel evidence based clinical practice
guidelines for therapeutic exercises and manual therapy in the management of
osteoarthritis, Phys. Ther. Vol. 85(9), pp. 907-971, 2005
[15] Buckland-Wright J.C., Subchondral bone changes in hand and knee
osteoarthritis detected by radiography, Osteoarthr. Cartilage.Vol. 12 Suppl. A:
pp. 10-19, 2004
[16] Buckland-Wright J.C.,Messent E.A.,Bingham C.O.,Ward R.J., Tonkin J.,A 2yr
lomgitudinal radiographic study examining the effect of bisphosphonate
(risedronate) upon subchondral bone loss in osteoarthritic knee patients,
Rheumatology Vol. 46(2), pp. 257-264, 2007
[17] Charles H.C., Kraus V.B., Ainslie M., Hellio Le Graverand-Gastineau
M.P.(2007) Optimization of fixed-flexion knee radiograph, Osteoarthr. Cartilage.
Vol.15(11), pp.1221-1224
[18] Coburn, A. Roberts,A multiscale texture analysis procedure for improved forest
stand classification, Int. J. Remote. Sense., Vol. 25(20), pp. 4287 - 4308, 2004
[19] Cortet B., Dubois P., Boutry N., Bourel P., Cotten A., Marchandise X., Image
analysis of the distal radius trabecular network using computed tomography,
Osteoporos, Int. 1Vol.9(5), pp. 410-419, 1999
[20] Cunha A., Darbon J., Chan T., Toga A., Fast and accurate feature detection and
triangulation using total variation filtering of biological images, 4th IEEE
International Symposium on Biomedical Imaging: From Nano to Macro
(ISBI'07), Washington, pp. 680-683, 2007

Literaturverzeichnis
93
[21] Deep K., Norris M.,Smart C., Senior C., Radiographic measurement of joint
space height in non-osteoarthritic tibiofemoral joints, J. Bone Joint Surg. Br.
Vol.85(7), pp. 980-982, 2003
[22] Dijkstra E. (1959) A note on two problems in connexion with graphs,
Numerische Mathematik, Vol. l(1), pp. 269 - 271
[23] Ding M., Hvid I., Quantification of age-related changes in the structure model
type and trabecular thickness of human tibial cancellous bone, Bone, Vol.26(3),
pp 291-295, 1999
[24] Draper N.R., Smith H. (1998) Applied Regression Analysis, Wiley Series in
Probability and Statistics, Wiley & Sons, New York
[25] Eckstein F., Buck R.J., Burstein D., Charles H.C., Crim J., Hudelmaier M.,
Hunter D.J., Hutchins G., Jackson C., Kraus V.B., Lane N.E., Link T.M.,
Majumdar L.S., Mazzuca S., Prasad P.V., Schnitzer T.J., Taljanovic M.S., Vaz A.,
Wyman B., Le Graverand M.P., Precision of 3.0 tesla quantitative magnetic
resonance imaging of cartilage morphology in a multicenter clinical trial, Ann.
Rheum. Dis. Vol.67(12), pp.1683-1688, 2008
[26] Eckstein F., Hudelmaier M., Cahue S., Marshall M., Sharam L., Medial-to-
lateral ratio of tibiofemural subchondral bone area is adapted to alignment and
mechanical load, Calcified Tissue Int.Vol. 84(3), pp. 186-194, 2009
[27] Eckstein F., Noninvasive study of human cartilage structure in MRI, Cartilage
and Osteoarthritis, Methods in Molecular Medicine, Vol. 101, pp. 191-217, 2004
[28] Elmoutaouakkil A., Peyrin F., Elkafi J., Laval-Jeantet A., Segmentation of
cancellous bone from high-resolution computed tomography images: Influence
on trabecular bone measurement, IEEE Trans Med Imaging. Vol.21(4), pp. 354-
362, 2002
[29] Felson D.T., Lawrence R.C., Dieppe P.A., Hirsch R., Helmick C.G., Jordan J.M.,
Kington R.S., Lane N.E., Nevitt M.C., Zhang Y., Sowers M., McAlindon T.,
Spector T.D., Poole A.R., Yanovski S.Z., Ateshian G., Sharma L., Buckwalter
J.A., Brandt K.D., Fries J.F., Systemic risk factors for osteoarthritis, in
Osteoarthritis: new insights. Part 1: The disease and its risk factors, Ann.
Intern. Med. Vol.133, pp. 637-639, 2000

Literaturverzeichnis
94
[30] Felson D.T., Nevitt M.C., Zhang Y., Aliabadi P., Baumer B., Gale D., Li W., Yu
W., Xu L., High prevalence of lateral knee osteoarthritis in Beijing Chinese
compared with Farmingham caucasian subjects, Arthritis Rheum. Vol.46(5),
pp.1217-22, 2002
[31] Fouard C., Malandain G., 3-D chamfer distances and norms in anisotropic grids,
Image Vision Comput. Vol. 23(2), pp. 143-158, 2005
[32] Fripp J., Warfield S.K., Crozier S. Ourselin S., Automatic segmentation of the
knee bones using 3D active shape models, ICPR, Proceedings of the 18th
International Conference on Pattern Recognition, Vol.1, pp. 167-170, 2006
[33] Gibson S. (1997) 3D ChainMail: A fast algorithm for deforming volumetric
objects, Proc. Symp. Interactive 3D Graphics, Rhode Island, pp. 149-154, 1997
[34] Gibson S., Beyond Volume Rendering: Visualization, haptic exploration, and
physical modeling of voxel based objects, Proc. 6th Eurographics Workshop on
Visualization and Scientific Computing, Chia, Italien, pp. 149-154, 1997
[35] Glüer C.C., Blake G., Lu Y., Blunt B.A., JergasM., Genant H.K, Accurate
assessment of precision errors: How to measure the reproducibility of bone
densiometry techniques, Osteoporos. Int., Vol. 5,(4), pp. 262-270, 1995
[36] Gordon C., Lang T., Augat P., Genant H.K., Image-based assessment of spinal
trabecular bone structure from high-resolution CT images, Osteoporos. Int.
Vol.8(4), pp. 317-325, 1998
[37] Gough J., Kent J., Higgins P., Ellison L., Variogram methods for the analysis of
bony trabecular shadows in plain radiographs, Int. J. Biomed. Comput.
Vol.35(2), pp.141-153, 1994
[38] Gray H., Standring S. (Ed.), Anatomy of the human body, (40. Auflage),
Elsevier, Chatswood, Australien, 2008
[39] Hamarneh G., Yang J., McIntosh X., Langille M., 3D live-wire-based semi-
automatic segmentation of medical images, Proc. of SPIE, Vol. 5747, pp. 1597-
1603, 2005
[40] Harlick R., Shapiro L., Image segmentation techniques, CVGIP - Graph. Model.
Im., Vol. 29, pp. 100-132, 1985

Literaturverzeichnis
95
[41] Hayes C.W., Jamadar D.A., Welch G.W., Jannausch M.L., Lachance L.L., Capul
D.C., Sowers M.R., Osteoarthritis of the knee: Comparison of MR imaging
findings with radiographic severity measurements and pain in middle-aged
women, Radiology Vol.237(3), pp. 998-1007, 2005
[42] Hellio Le Graverand M.P., Mazzuca S., Duryea J., Brett A., Radiographic
grading and measurement of joint space width in osteoarthritis, Rheum. Dis.
Clin. N. Am., Vol.35(3),pp. 485-502, 2009
[43] Hildebrand T., Laib A., Müller R., Dequeker J., Rüegsegger P., Direct three-
dimensional morphometric analysis of human cancellous bone: microstructural
data from spine, femur, iliac crest, and calcaneous, J Bone Miner Res., Vol.
14(7), pp. 1167-74, 1999
[44] Hoffman H., Kleinken B. (Hrgb), Dornbach F. (Ed.) (2008) Gebührenordnung
für Ärzte (GOÄ) / UV-GOÄ, pp. 349-366, Deutscher Ärzte-Verlag, Köln
[45] Hunter D., Sharma L., Skaife T., Alignment and osteoarthritis of the knee, J.
Bone Joint Surg., Vol.91, pp. 85-89, 2009
[46] Intema F., Hazewinkel H.A., Gouwens D., Bijlsma J.W., Weinans H., Lafeber
F.P., Mastbergen S.C., In early OA, thinning of subchondral plate is directly
related to cartilage damage: result from a canine ACLT-menisectomy model,
Osteoarthr. Cartilage. Vol.18(5), pp. 691-698, 2010
[47] Jennane R., Harba R., Lemineur G., Bretteil S., Estrade A., Benhamou C.L.,
Estimation of the 3D self-similarity parameter of trabecular bone from its 2D
projection, Med. Image Anal., Vol. 11(1), pp. 91-98, 2007
[48] Johnston J., Masri B., Wilson D., Computed tomography topographic mapping
of subchondral density (CT-TOMASD) in osteoarthritic and normal knees:
methodological development and preliminary findings, Osteoarthr. Cartilage.
Vol.17(10), pp.1319-1326, 2009
[49] Kahle W., Leonhardt H., Platzer W., Locomotor system, color atlas/text of
human anatomy, Vol. 1 (6. Auflage), Thieme, Stuttgart, 2008
[50] Kalender W.A., C. Suess, A new calibration phantom for quantitative computed
tomography, Med. Phys., Vol.14(5), pp. 863-866, 1987
[51] Kalender W.A. Computed Tomography: Fundamentals, System Technology,
Image Quality, Applications, (2nd Edition), Publicis Corporate Publishing,
Erlangen, 2006

Literaturverzeichnis
96
[52] Kalpakcioglu B., Morshed K.S., Engelke K., Genant H.K., Advanced imaging of
the macrostructure and microstructure of bone, J. Bone Joint Surg. Am. Vol.90
Suppl. 1, pp. 68-78, 2006
[53] Kang Y., 3D quantitative computed tomography (QCT) of the proximal femur,
Dissertation am Institut für Medizinische Physik, Erlangen, Friedrich-
Alexander-Universität Erlangen-Nürnberg, Erlangen, 2002
[54] Kass M., Witkin A., Terzopoulos D., Snakes: Active contour model, Int. J.
Comput. Vision, Vol. 1(4), 1087 pp. 321-331, 1987
[55] Kazakia G., Majumdar S., New imaging technologies in the diagnosis of
osteoporosis, Rev. Endocr. Metab. Dis. Vol. 7(1-2), pp. 67-74, 2006
[56] Kellgren, J. Lawrence, Radiological assessment of osteo-arthrosis, Ann Rheum
Dis 16, 494-501, 1957
[57] Kothari M., Guermazi A., von Ingersleben G., Miaux Y., Sieffert M., Block J.E.,
Stevens R., Peterfy C.G., Fixed-flexion radiography of the knee provides
reproducible joint space width measurements in osteoarthritis, Eur. Radiol., Vol.
14(9), pp. 1568-1573, 2004
[58] Krebs A., Graeff C., Frieling I., Kurz B., Timm W., Engelke K., Glüer CC., High
resolution tomography of vertebrae yields accurate information on trabecular
distances if processed by fuzzy 3D segmentation approaches, Bone, Vol.44(1),
pp.145-152, 2009
[59] Kumasaka S., Kiyohara S., Takahashi T., Asai H., Kashima I., Morphologically
extracted trabecular skeleton superimposed upon digital radiograph structure, J.
Bone. Miner. Metab. Vol.18(4), pp. 208-211, 2000
[60] Lakare S., Kaufman A., 3D segmentation techniques for medical volumes,
Dissertation at the Center for Visual Computing, Department of Computer
Science, State University of New York, New York, 2000
[61] Lee S., Lee J.W., Jeong J.W., Yoo D.S., Kim S., A perliminary study on
discrimination of osteoporotic fractured group from nonfractured group using
support vector machines, Proc. IEEE Eng. Med. Biol .Soc. 2008; pp.474-477,
2008
[62] LeFol T., Haigeron P., Lucas A., Tool/tissues interaction modeling for
transluminal angioplasty simulation, Proc IEEE Eng. Med. Biol. Soc. 2007,
pp.1734-1737, 2007

Literaturverzeichnis
97
[63] Leinsinger G., Hahn K., Indikationen zur Bildgebenden Diagnostik, Springer,
Berlin, 2001
[64] Lepistö L., Kunttu I., Autio J., Visa A., Rock image classification using non-
homogenous textures and spectral imaging, Proceedings WSCG 2003, Plzen,
Tschechien, pp. 82-86, 2003
[65] Li Y., Brodlie K., Phillips N., Real-time soft tissue modelling for webbased
surgical simulation: Surfacechainmail, Stud Health Technol Inform. Vol.85 pp.
261-267, 2007
[66] Liang J.,McInerney T., Terzopoulos D., Interactive medical image segmentation
with united snakes, Lecture Notes In Computer Science, Proceedings of the
Second International Conference on Medical Image Computing and Computer-
Assisted Intervention, Cambridge, UK, Vol. 1679, pp.116-127, 1999
[67] Link T.M., Majumdar S., Grampp S., Guglielmi G., van Kuijk C., Imhof H.,
Glueer C., Adams J.E., Imaging of trabecular bone in osteoporosis, Eur Radiol.
Vol.9(9), pp.1781-1788, 1999
[68] Lorensen W., Cline H., A high resolution 3D surface construction algorithm,
ACM SIGGRAPH Computer Graphics, Vol. 21(4), pp. 163-169, 1987
[69] Mao Z., Manuel J., Tavares S., Natal Jorge M., A review on the current
segmentation algorithms for medical images, Comput. Method. Biomec., Vol.
13(2), pp. 235-246, 2010
[70] Marijnissen A.C., van Roermund P.M., TeKoppele J.M., Bijlsma J.W., Lafeber
F.P., The canine ‘groove’ model, compared with the ACLT model of
osteoarthritis, Osteoarthr. Cartilage, Vol. 10(2), pp. 145-155, 2002
[71] Mastmeyer A., Segmentierung der Wirbelsäule und Definition anatomischer
Koordinatensysteme für quantitative Computertomographie (QCT), Dissertation
am Institut für Medizinische Physik, Universität Erlangen-Nürnberg, Shaker,
Erlangen, 2006
[72] Matsui, M. Shimizu, H. Tsuji, Cartilage and subchondral bone interaction of
osteoarthritis of human knee joint: A histological and histomorphometric study,
Microscopy Research and Technique, Microsc Res Tech. 5/1997 15;37(4):333-
42.
[73] McLennan M., What’s causing the knee pain?, Vol.17(4) Parkhurst Exchange,
Montreal, Canada, 2009

Literaturverzeichnis
98
[74] Melrose J., Smith S., Ghosh P., Histological and immunohistological studies on
cartilage, Cartilage and Osteoarthritis Methods in Molecular Medicine, Vol.
101, pp. 39-63, 2004
[75] Messent E, Buckland-Wright J, Blake G., Fractal analysis of trabecular bone in
knee osteoarthritis (OA) is a more sensitive marker of disease status than bone
mineral density (BMD), Calcif. Tissue Int., Vol.76(6), pp. 419-425, 2005
[76] Mildenberger O., Informationstheorie und Kodierung, (2. Auflage), Vieweg,
Wiesbaden, 1997
[77] Mortensen E., Barrett W., Interactive segmentation with intelligent scissors,
Graphical Models and Image Processing, Vol. 60(5), pp. 349-384, 1998
[78] Muraoka T., Hagino H., Okano T., Enokida M., Teshima R., Role of subchondral
bone in osteoarthritis development, arthritis and Rheumatism, Arthritis Rheum.,
Vol. 56(10), pp. 3366–3374, 2007
[79] Neogi T., Nevitt M., Niu J., Sharma L., Roemer F., Guermazi A., Lewis CE.,
Torner J., Javaid K., Felson D., Subchondral bone attrition may be a reflection
of compartment specific mechanical load: MOST Study, Ann. Rheum. Dis. Vol.
69(5), pp. 841-844, 2010
[80] Niggli A., Gonarthrose: Diagnostik und Therapie, Grundversorger Kongresse
PrimaryCare Vol.3, pp. 89–92, 2003
[81] Njeh C., Genant H. K., Bone loss: Quantitative imaging techniques for assessing
bone mass in rheumatoid arthritis, Arthritis Res., Vol. 2(6), pp. 446–450, 2000
[82] O'Donnell, Semi-automatic medical image segmentation, Masters Thesis,
Massachusets Institute of Technology - AI Lab, Cambridge, Mass., 2001
[83] Otte P., Der Arthrose-Prozeß, Gelenkerhaltung-Gefährdung-Destruktion, Teil 1:
Osteochondrale Strukturen, Novartis Pharma Verlag, Basel, 2002
[84] Patel V., Issever A.S., Burghardt A., Laib A., Ries M., Majumdar S., MicroCT
evaluation of normal and osteoarthritic bone structure in human knee specimen,
Journal of Orthopaedic Research, Jorthop. Res. Vol. 21(1), pp. 6-13, 2003
[85] Peat G., McCarney R., Croft P., Knee pain and osteoarthritis in older adults: A
review of community burden and current use of primary health care, Ann.
Rheum. Dis. Vol. 60(2), pp. 91–97, 2001

Literaturverzeichnis
99
[86] Phan C., Link T., Blumenkrantz G., Dunn T., Ries M., Steinbach L., Majumdar
S., MR imaging findings in the follow-up of patients with different stages of knee
osteoarthritis and the correlation with clinical symptoms, Eur. Radiol. Vol.
16(3), pp. 608-618, 2006
[87] Podsiadlo, L. Dahl, M. Englund, L.S. Lohmander, G. Stachowiak, Differences in
trabecular bone texture between knees with and without radiographic
osteoarthritis detected by fractal methods, Osteoarthritis and Cartilage, Volume
16, Issue 3, 3/2008, Pages 323-329
[88] Ray J., Clancy W., Lemon R., Semimembranosus tendinitis: An overlooked
cause of medial knee pain, Am. J. Sports Med. Vol.16(4), pp. 347-351, 1988
[89] Robert Koch Institut (Hrgb), Gesundheit in Deutschland,
Gesundheitsberichterstattung des Bundes, Berlin, 2006
[90] Sachs L., Angewandte Statistik – Anwendung statistischer Methoden, (11.
Auflage), Springer, Berlin 2004
[91] Saied A., Laugier P., High-resolution ultrasonography for analysis of age- and
disease-related cartilage changes, Cartilage and Osteoarthritis Methods in
Molecular Medicin, Vol. 101, pp. 249-265, 2004
[92] Schiphof D., Boers M., Bierma-Zeinstra S., Differences in descriptions of
Kellgren and Lawrence grades of knee osteoarthritis, Ann. Rheum. Dis. Vol. 67,
pp. 1034-1036, 2008
[93] Shapiro S., Wilk M., An analysis of variance test for normality (for complete
samples), Biometrika Vol.52(3-4), pp. 591–611, 1965
[94] Showalter C., Clymer B., Richmond B., Powell K., Three-dimensional texture
analysis of cancellous bone cores evaluated at clinical CT resolutions,
Osteoporos. Int. Vol. 17(2), pp. 259-266, 2006
[95] Sniekers Y.H., Intema F., Lafeber F.P., van Osch G.J., van Leeuwen J.P., Weinans
H., Mastbergen S.C., A role for subchondral bone changes in the process of
osteoarthritis; a micro-CT study of two canine models, BMC Musculoskelet.
Disord., Vol. 9, p. 20, 2008
[96] Sonka M., Hlavac V., Boyle R., Image processing, analysis and machine vision
(2nd edition), Brooks/Cole Publishing Company, Lenexa, Kansas, 1999
[97] Stout B., The basics of A* for path planning, Game Programming Gems, Charles
River Media, Clifton Park, New York, 2000

Literaturverzeichnis
100
[98] Sun Y., Teo E.C., Zhang Q.H., Discussion of knee joint segmentation, Intl. Conf.
on Biomedical and Pharmaceutical Engineering 2006, Singapur, Research
Publishing Service, Singapur, 2006
[99] Szebenyi B., Hollander A.P., Dieppe P., Quilty B., Duddy J., Clarke S., Kirwan
J.R., Associations between pain, function, and radiographic features in
osteoarthritis of the knee, Arthritis. Rheum. Vol.54(1), pp. 230-235, 2006
[100] Tabor Z., Rokita E., Quantifying anisotropy of trabecular bone from gray-level
images, Bone, Vol. 40(4), pp. 966-972, 2007
[101] Takashi S., Yasuaki, N. Takahashi N., Yoshitaka, M., Osteoarthritis of the knee
and nearby disease, N. Engl. J. Med., Vol.354, pp. 841-848, 2006
[102] Veenland J, Grashuis J., Weinans H., Ding M., Vrooman H., Suitability of texture
features to assess changes in trabecular bone architecture, Pattern Recogn.
Lett., Vol. 23(4), pp. 395-403, 2002
[103] Wan Y., Sun X. Guo R., Shape and structure features based chinese wine
classification, CINC '09, International Conference on Computational
Intelligence and Natural Computing, Wuhan, China pp. 39-43, IEEE, 2009
[104] Wang S., Experimental arthritis: in vitro and in vivo models, Dissertation,
University Eindhoven, 2008
[105] Warming L., Hassager C., Christiansen C., Changes in bone mineral density
with age in men and women: a longitudinal study, Osteoporos. Int. Vol.13(2),
pp.105-112, 2002
[106] Watt A., Watt M., Advanced Animation and Rendering Techniques Theory and
Practice, pp. 305-312. Addison-Wesley, Sheffield 1992
[107] Wehrli F.W., Song H.K., Saha P.K., Wright A.C., Quantitative MRI for the
assessment of bone structure and function, NMR Biomed. Vol. 19(7), pp. 731-
736, 2006
[108] Wenham C., Conaghan P., Imaging the painful osteoarthritic knee joint: What
have we learned, Nat. Clin. Pract. Rheumatol.Vol. 5(3), pp. 149-158, 2009
[109] White D., Chelule K., Seedhom B., Accuracy of MRI vs. CT imaging with
particular reference to patient specific templates for total knee replacement
surgery, Int. J. Med. Robot. Vol.4(3), pp. 224-231, 2008

Literaturverzeichnis
101
[110] Wolski M., Podsiadlo P., Stachowiak G.W., Lohmander L.S., Englund M.,
Differences in trabecular bone texture between knees with and without
radiographic osteoarthritis detected by directional fractal signature method,
Osteoarthr. Cartilage, Vol. 18(5), pp. 684-690, 2010
[111] Wrigley T., Creaby M., Bennell K., Peripheral quantitative computed
tomography (pQCT) of tibial subchondral bone in knee osteoartritis, Arthritis
Rheum. Vol. 58(9), pp. 2776–2785, 2008
[112] Yamanaka N., Takahashi T., Ichikawa N., Yamamoto H., Posterior-anterior
weight-bearing radiograph in 15° knee flexion in medial osteoarthritis, Skeletal
Radiol., Vol. 32(1), pp. 28-34, 2003
[113] Zacher J., Carl H.D., Swoboda B., Backhaus M., Bildgebung bei der Arthrose
peripherer Gelenke, Zeitschrift für Rheumatologie, Vol. 66(3), pp. 257-266,
2007
[114] Zaia A., Eleonori R., Maponi P., Rossi R., Murri R., Medical imaging and
osteoporosis: Fractal’s lacunarity analysis of trabecular bone in MR images,
Proc. 18th IEEE Symposium Computer-Based Medical Systems 2005. pp. 3-8,
IEEE, 2005
[115] Zerfass P, Museyko O., Bousson V., Laredo J.-D., Kalender W.A., Engelke K.,
Segmentation of the knee for analysis of osteoarthritis, Bildverarbeitung für die
Medizin 2009, Informatik aktuell, Vol. 1(3), p. 52-55, 2009
[116] Zhang W., Doherty M., Peat G., Bierma-Zeinstra M.A., Arden N.K., Bresnihan
B., Herrero-Beaumont G., Kirschner S., Leeb B.F., Lohmander L.S., Mazières
B., Pavelka K., Punzi L., So A.K., Tuncer T., Watt I., Bijlsma J.W., EULAR
Evidence based recommendations for the diagnosis of knee Osteoarthritis, Ann.
Rheum. Dis. Vol. 69(3), pp. 483-489, 2010
[117] Zhang Z., Micro-CT and mechanical evaluation of subchondral trabecular bone
structure between postmenopausal women with osteoarthritis and osteoporosis,
Osteoporos. Int. Vol. 21(8), pp. 1383-1389, 2010
[118] Zoppi M., Beneforti E., Joint pain, Curr. Pain Headache R. Vol. 3(2), pp. 121-
129, 1999

Lebenslauf
Name Peter Michael Zerfaß
Geboren 31.8.1971, Stuttgart
Staatsangehörigkeit deutsch
Werdegang
1983 – 1991 Andreae Gymnasium, Herrenberg
Abschluss: Abitur
1991 – 1992 Zivildienst
Körperbehindertenförderung Neckar-Alb, Mössingen
1992 - 2000
Universität Karlsruhe (TH)
Studium der Elektrotechnik Vertiefungsrichtung biomedizinische Elektrotechnik
Abschluss: Diplom-Ingenieur (Dipl.-Ing.)
Diplomarbeit: „Interaktive Deformation von Dreiecksnetzenzur Segmentation Tomographischer Aufnahmen“
03.2000 – 09.2004
Forschungszentrum caesar, Bonn
Wissenschaftlicher Mitarbeiter,
Gruppe Surgical Systems Lab
04.2005 – 11.2006 Locasoft GmbH, Bonn
Projektmanager
10.2004 – 12.2004
Deutsche Angestellten Akademie (DAA), Bonn
Weiterbildung Projektmanagement
Abschluss: Zertifizierter Projektmanager
12.2006-03.2010
Institut für Medizinische Physik,
Friedrich-Alexander- Universität Erlangen-Nürnberg
Wissenschaftlicher Mitarbeiter
08.2010- 4Plus GmbH, Erlangen
Software-Architekt

Summary
Background: It is of economic importance to characterize and detect the early onset of
OA, since it is a wide spread medical condition. Clinical CT-data can provide more
information than standard X-ray - especially regarding cortical and subchondral bone
structure. This thesis aims to quantify changes occurring in the osteoarthritic knee.
Special emphasis was put on establishing a workflow with minimal user interaction in
order to minimize inter- and intra-operator variability.
Methods: Clinical CT-data taken from the multi-center, longitudinal POLKA study
were segmented and analyzed. Periosteal and endosteal volumes of interest (VOIs) in
the tibia and femur were determined similar to the approach used in [71]. By
segmenting the growth plates, using a new chain mail segmentation algorithm we could
identify salient points within the bone. A method for automatic definition of the joint
space was developed. All segmentation methods were implemented using a full 3D
approach. With the aid of bone coordinate systems VOIs were placed at defined
distances to the joint space, and divided into medial and lateral compartments. Analysis
within the volumes was done using texture and geometry based parameters. Only
algorithms which do not require a binarisation as a preprocessing step were used.
Results: All available datasets could be analyzed and segmented. Those parameters
which showed significant change between an OA- and a control-group showed little
intra- /interoperator-variability. On average the CV[%] was for entropy 0,5% (0,3%);
homogeneity: 1,2% (1,0%); local anisotropy 3% (1,5%); total variation 0,5% (0,5%);
variogram 2,2% (1,0%); differential box counting 0,5% (0,3%). Stability of the
segmentation results was checked by simulated variation in user input. Change in
seedpoint location changed BMD by about 1%. Relocation of the masking volumes led
to changes in the segmentation results by less than 1%. Changes of field of view altered
the anatomical coordinate systems by less than 0.001° on average. Mean age
compositions between OA and control groups varied significantly. However, a
discriminant analysis was still able to show that using the above mentioned parameters
improved the delineation between the two groups. Only BMD and global anisotropy
measures did not vary significantly between the two groups.
Conclusions: Analysis of bone structure changes, due to osteoarthritic processes, can be

quantified based on clinical CT-data. Despite the impact of the disease on the joint space
and the bone surface it is possible to find fixed points for the definition of a stable bone
coordinate system. Texture and geometry based analysis methods are able to supply
additional information in addition to the common diagnostic parameters (joint space
width and osteophyte formation.