Schulcurriculum Chemie Mittelstufe - hfg-oberkirch.de · Neutralisation (Natronlauge mit...
Transcript of Schulcurriculum Chemie Mittelstufe - hfg-oberkirch.de · Neutralisation (Natronlauge mit...
1
Schulcurriculum HFG Oberkirch – Chemie –
Klasse 8UE 1: Stoffe und Reaktionen
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
12 Untersuchung von Reinstoffen Eigenschaftskombinationenzur Kennzeichnung vonStoffen
wichtige Eigenschaften undKombinationen vonEigenschaften (Farbe, Geruch,Aggregatzustand,Schmelztemperatur, Siedetemperatur,Verformbarkeit, elektrischeLeitfähigkeit, Dichte, Löslichkeiten)ausgewählter Stoffe angeben (Luft,Stickstoff, Sauerstoff, Kohlenstoffdioxid,Wasser, Wasserstoff, Chlor, Eisen,Kupfer, Silber, Magnesium, Natrium,Natriumchlorid, Natriumhydroxid,Magnesiumoxid
Stoffeigenschaften experimentellermitteln(Schmelztemperatur, Siedetemperatur,Farbe, Geruch, Dichte,elektrische Leitfähigkeit, Löslichkeit);
Stationenlernen:Stoffuntersuchungenu. Trennverfahren,ModellComputeranimation
NaPhäPhysik
2
Gemische homogen,heterogenLösungen
Mülltrennung u. -wieder-verwertung
ein sinnvolles Ordnungsschema zurEinteilungder Stoffe erstellen (Stoff, Reinstoff,Element, Verbindung,Metall, Nichtmetall, Stoffgemisch,Lösung, Emulsion,Suspension);
Ausgewählte Trennmethodenzur Gewinnung vonReinstoffen (z. B. Destillation)
Einführung u. Anwendung desTeilchenmodellsAggregatzustände u. Diffusion
das Teilchenmodell zur Erklärung vonAggregatzuständen,Diffusions- und Lösungsvorgängenanwenden
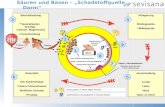
Exotherme u. endothermeReaktionenAktivierungsenergie,Katalysator
chemische Reaktionen unter stofflichenundenergetischen Aspekten erläutern(endotherme undexotherme Reaktionen,Aktivierungsenergie, Katalysator
bei chemischen ExperimentennaturwissenschaftlicheArbeitsweisen anwenden (ErfassungdesProblems, Hypothese, Planung vonLösungswegen, Prognose,Beobachtung, Deutung undGesamtauswertung,Verifizierung und Falsifizierung
3
UE 2: Luft und Sauerstoff; Oxide
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
8 Die Luft als Gasgemisch u.ihre Zusammensetzung
Nachweise wichtiger Stoffe beziehungsweiseTeilchenbeschreiben (Sauerstoff, Kohlenstoffdioxid)
Eigenschaften v. Sauerstoff
Oxidation als Reaktion mitSauerstoff
Verbrennung
Redoxreaktionen als Sauerstoffübertragung(oderals Wasserstoffübertragung oder alsElektronenübergang erklären)
Exkursion
Oxide des Kohlenstoffs:Vorkommen, Entstehung,Eigenschaften
Vulkanismus wichtige Eigenschaften und Kombinationenvon Eigenschaften (Farbe, Geruch,Aggregatzustand, SmT, SdT, Verformbarkeit,elektr. Leitfähigkeit, Dichte, Löslichkeiten)ausgewählter Stoffe angeben(Kohlenstoffdioxid)
Exkursion
Reduktion als Umkehrung derOxidationRedoxreaktion
mit Laborgeräten sachgerecht umgehen unddie Sicherheitsmaßnahmen anwenden
unter Beachtung der Sicherheits-maßnahmeneinfache Experimente durchführen,beschreiben und auswerten
Praktikum:Reduktion einesMetalloxids
BrandverhütungBrandbekämpfung
Handhabung eines Feuer-löschers; Besuch beiFeuerwehr
Maßnahmen zum Brandschutz planen,durchführenund erklären
Recherche, PPTProjektExkursion
4
UE 3: Wasser und Wasserstoff
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
8 Eigenschaften u. Bedeutungdes Wassers
Löslichkeit v. Sauerstoffim Hinblick auf das Lebenim Wasser
die besonderen Eigenschaften vonWasser erklären
Biologie
Saure, neutrale u. alkalischeLösungen
Möglichkeiten derBehandlung saurer u.alkalischer Abwässer
Beispiele für alkalische und saureLösungen angeben(Natronlauge, Ammoniaklösung,Salzsäure, Kohlensäure, Lösung einerweiteren ausgewählten Säure)
die Bedeutung saurer, alkalischer undneutraler Lösungen für Lebewesenerörtern
Salzbildung aus Säure undMetall, Namen der Salze,chemische Formeln überOxidationszahlen erstellen
Oxidationszahl
Indikatoren, pH-Skala bei wässrigen Lösungen dieFachausdrücke „sauer“,„alkalisch“, „neutral“ der pH-Skalazuordnen
Stationenlernen
Synthese u. Analyse v. Wasser ein sinnvolles Ordnungsschema zurEinteilung der Stoffe erstellen (Stoff,Reinstoff, Element, Verbindung,Metall, Nichtmetall, Stoffgemisch,Lösung, Emulsion, Suspension);
Eigenschaften u. Bedeutung v.Wasserstoff
Wasserstoff alsEnergieträger
die Bedeutung des Wasserstoffs alsEnergieträger erläutern
5
UE 4: Quantitative Beziehungen
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
12 Gesetz von der Erhaltung derMasse u. Gesetz der konstan-ten Massenverhältnisse
Massengesetze anwenden (Gesetz vonder Erhaltungder Masse, Gesetz der konstantenMassenverhältnisse);
ein einfaches quantitatives Experimentdurchführen(Ermittlung einesMassenverhältnisses);
Praktikum: ErmittelneinesMassenverhältnisses
Atommodell v. DALTON an einem Beispiel die Leistungen einerForscherpersönlichkeitbeschreiben (BERZELIUS, CURIE,LIEBIG, PAULING, WÖHLER)
Modell Physik
Chemische FormelAtom u. MolekülAtomare Masseneinheit,Atom- u. Molekülmasse,
den Aufbau ausgewählter Stoffedarstellen undTeilchenarten zuordnen (Atom,Molekül, Ion);den Informationsgehalt einerchemischen Formelerläutern (Verhältnisformel,Molekülformel, Strukturformel);
Gruppenarbeit
Satz v. AvogadroReaktionsgleichung alsquantitative Beschreibungeiner Reaktion
Reaktionsschemata (Wortgleichungen)als qualitative Beschreibung vonStoffumsetzungen undReaktionsgleichungen als quantitativeBeschreibung des Teilchenumsatzesformulieren
6
UE 5: Periodensystem und Atombau
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
8 Periodensystem alsOrdnungsprinzip u.InformationsschemaChem. Verwandtschafteneiner Elementgruppe zeigen.(z. B. Reaktivität derAlkalimetalle gegenüberWasser)
Das eingeführte Atom-modell soll Grundlage fürdie Bindungslehre sein.
das Kern-Hülle-Modell von Atomen(Protonen, Elektronen, Neutronen)beschreiben
Gruppenarbeit Physik
Kern-Hülle-Modell Historische Ableitung energetisch differenzierte Atomhülle(Ionisierungsenergie) beschreiben
GruppenpuzzleGruppenarbeit
Bohrsches AtonmodellKugelwolkenmodellZusammenhang zwischenAtombau u. Stellung im PSE
verschiedene Informationsquellen zurErmittlung chem. Daten nutzenein Erklärungsmodell für die
7
Klasse 9
UE 1: Alkalimetalle und Calcium
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
4 Die Elementgruppe derAlkalimetalle
wichtige Eigenschaften und Kombinationen vonEigenschaften (Farbe, Geruch, Aggregatzustand,Schmelztemperatur, Siedetemperatur,Verformbarkeit, elektrischeLeitfähigkeit, Dichte, Löslichkeiten) ausgewählterStoffe angeben (Natrium, Natriumchlorid)
Die Elementgruppe derErdalkalimetalle
wichtige Eigenschaften und Kombinationen vonEigenschaften (Farbe, Geruch, Aggregatzustand,Schmelztemperatur, Siedetemperatur,Verformbarkeit, elektrischeLeitfähigkeit, Dichte, Löslichkeiten) ausgewählterStoffe angeben (Magnesium)
Kohlensäure u. ihre Salze(Wenn nicht schon in Kl. 8)
Kalk, Wasserhärte
unter Beachtung der Sicherheitsmaßnahmeneinfache Experimente durchführen, beschreiben u.auswerten
Praktikum:BacktreibmittelWasserhärtebe-stimmungMesswerterfassungmit dem Computer
Alkalimetallhydroxide undErdalkalihydroxide und ihrewässrigen Lösungen
wichtige Eigenschaften und Kombinationen vonEigenschaften (Farbe, Geruch, Aggregatzustand,Schmelztemperatur, Siedetemperatur,Verformbarkeit, elektrische Leitfähigkeit, Dichte,Löslichkeiten) ausgewählter Stoffe angeben(Natriumhydroxid, Magnesiumoxid)
Praktikum:Untersuchung einesAbflussreinigers
8
UE 2: Halogene
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
4 Halogene als Elementgruppe Bei der Behandlung v.Halogenen sollte auf diegesundheitlichen Aspektev. Halogenen eingegangenwerden
Die Schülerinnen und Schüler könnenwichtige Eigenschaften undKombinationen vonEigenschaften (Farbe, Geruch,Aggregatzustand, Schmelztemperatur,Siedetemperatur, Verformbarkeit,elektrische Leitfähigkeit, Dichte,Löslichkeiten) ausgewählterStoffe angeben (Chlor)
an einem ausgewählten Stoff schädlicheWirkungen auf Luft, Gewässer oderBoden beurteilen undGegenmaßnahmen aufzeigen
Reaktionen der Halogene Iodiertes Kochsalz,Fluoride,heimische Salzlagerstätten Exkursion Erdkunde
Chlorwasserstoff undBildung von Salzsäure
9
UE 3: Atombindung und molekulare Stoffe; Ionenbindung und Salze
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
30 Typische Eigenschaftenmolekularer Stoffe
die Molekülbildung durchElektronenpaarbindung unter Anwendung derEdelgasregel erläutern (bindende u. nichtbindende Elektronenpaare)
Moleküle;Zusammenhalt im Moleküldurch Atombindung(Nichtmetalle)
Molekülstrukturen mit Sachmodellendarstellen (Kugel-Stab-Modell,Kalottenmodell)
Bau von MolekülenMolekülformel mit Elektro-nenpaaren (LEWIS-Schreibweise)
den räumlichen Bau von Molekülen mithilfeeines geeigneten Modells erklären
Modell
ElektronegativitätPolare Atombindung
Dipol-Dipol-WechselwirkungenWasserstoffbrückenWasser alsLösungsmittel
polare u. unpolare Elektronenpaar-bindungenunterscheiden (Elektronegativität)
den Zusammenhang zwischen Molekülstrukturu. Dipol-Eigenschaft herstellen
die besonderen Eigenschaften von Wassererklären (räumlicher Bau des Wasser-Moleküls, Wasserstoffbrücken)erläutern, wie positiv u. negativ geladene Ionenentstehen (Elektronenübergänge,Edelgasregel)
Computeranimation
Salzbildung durch Reaktion v.Metall mit Nichtmetall
das Donator-Akzeptor-Prinzip am Beispiel vonElektronen- und Protonenübergängenanwenden (Reaktion eines Metalls mit einemNichtmetall)
Praktikum
10
Elektronenübergangsreaktion Oxidationszahl Redoxreaktionen als Elektronenübertragungerklären
Physik
Eigenschaften u. Bau vonIonenverbindungenVerhältnisformel
Ionenwanderung die Ionenbindung erklären u. damit typischeEigenschaften der Salze begründen
Modell
Elektrolyse das Donator-Akzeptor-Prinzip am Beispiel vonElektronen- und Protonenübergängenanwenden (Elektrolyse einer Salzlösung)
Physik
Protonenübergangsreaktionen(Säure-Base-Chemie)
die typischen Teilchen in sauren u.alkalischen Lösungen nennen (Oxonium-Ionen, Hydroxid-Ionen)
Nachweise wichtiger Stoffe beziehungsweiseTeilchen beschreiben (saure, neutrale,alkalische Lösungen)
Ammoniak u. Ammonium-salze
am Beispiel eines Stoffes, der Gegenstand deraktuellen gesellschaftlichen Diskussion ist,die Bedeutung der Wissenschaft Chemie u.der chem. Industrie für eine nachhaltigeEntwicklung darstellen
Wichtige Säuren u. ihre SalzeVier Salzbildungsarten
Salzbildungsarten
WichtigeMineralstoffe u. ihreBedeutung
die Bedeutung saurer, alkalischer u. neutralerLösungen für Lebewesen erörtern
wichtige Mineralstoffe u. ihre Bedeutungangeben (Natrium-, Kalium-, Ammonium-Verbindungen, Chlorid, Sulfat, Phosphat,Nitrat)
11
UE 4: Quantitative Beziehungen
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzunge
nNL
Stoffmenge u. ihre EinheitMolMolare Masse
wichtige Größen erläutern(Teilchenmasse, Stoffmenge, molareMasse, Stoffmengenkonzentration
Berechnungen durchführen und dabeiauf den korrekten Umgang mit Größenund deren Einheiten achten
Stoffmengenkonzentration Berechnung vonReaktionsansätzen vonMetall (Metalloxiden) mitsauren Lösungen
Neutralisation(Natronlauge mit Salzsäure)
eine Titration zurKonzentrationsermittlung einer Säuredurchführenden PC für Recherche, Darstellung vonMolekülmodellen u.Versuchsauswertung einsetzen
Praktikum: TitrationGruppenarbeitMesswerterfassung mitdem Computer
12
Klasse 10 UE 1: Einfache Kohlenwasserstoffe
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
10 Organische Chemie WÖHLER an einem Beispiel die Leistungen einerForscherpersönlichkeit beschreiben (BERZELIUS,CURIE, LIEBIG, PAULING, WÖHLER)
Physik
Alkane Sicherheitserziehung:Umgang mit leichtentzündlichenStoffen
den räumlichen Bau von Molekülen mithilfe einesgeeigneten Modells erklären
Struktur u. Eigenschaften
Strukturisomerie u.Nomenklatur
VAN-DER-WAALS-Kräfte
Molekülstrukturen mit Sachmodellen darstellen(Kugel-Stab-Modell, Kalottenmodell)
typische Eigenschaften ausgewählter organischerStoffe beschreiben (Alkan)
zwischenmolekuare Wechselwirkungen (VAN-DER-WAALS-Wechselwirkungen
Modelle
Gruppenarbeit
Kohlenwasserstoffe alsEnergieträger
die Rolle der Kohlenwasserstoffe als Energieträgerbeurteilen
am Beispiel eines Stoffes, der Gegenstand deraktuellen gesellschaftlichen Diskussion ist, dieBedeutung der Wissenschaft Chemie u. der chem.Industrie für eine nachhaltige Entwicklungdarstellen)
Gruppenpuzzle
Exkursion, z.B.Wärmekraftwerk
Alken Kohlenstoffverbindungen mithilfe funktionellerGruppen ordnen (Zweifachbindung zwischenKohlenstoff-Atomen)
Nachweise wichtiger Stoffe beziehungsweiseTeilchen beschreiben (Alken)
13
UE 2: Reaktionen von Alkanen und Alkenen; Alkohole, Aldehyde, Ketone
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
12 Halogenierung v. Alkanen alsradikalische Substitution
Licht als Energieform Physik
Eigenschaften v.Halogenalkanen
Toxische WirkungKlimaveränderungInsektizide
Referate, Computer,PPT
ErdkundeBiologie
Addition bei Alkenen (ohneMechanismus)Alkohole:Vorkommen, Eigenschaften u.Struktur; Wasserstoffbrücken
Gärung: „vis vitalis“
Alkohole als Treibstoff
Gefahren desAlkoholmiss-brauchs
Verkehrserziehung
Änderungen von Stoffeigenschafteninnerhalb einer ausgewähltenhomologen Reihe beschreiben (Alkanole)
zwischenmolekuare Wechselwirkungen(VAN-DER-WAALS-Wechselwirkungen,Dipol-Wechselwirkungen,Wasserstoffbrücken) nennen u. erklären
die Gefahren des Alkohols als Suchtmittelerläutern
Projekt: Bierbrauen,Backen, AlcotestExkursion: Brauerei
ReferatExpertenbefragung
Oxidationsprodukte v.Alkoholen: Aldehyde, KetoneEigenschaften u. Struktur
einfache Experimente mit organischenVerbindungen durchführen (Oxidationeines Alkanols)
Kohlenstoffverbindungen mithilfefunktioneller Gruppen ordnen(Hydroxyl-, Aldehyd-, Ketogruppe)
typische Eigenschaften ausgewählterorganischer Stoffe beschreiben( Alkanole, ein Alkanal, Aceton)
Praktikum:FEHLINGsche Probe
14
UE 3: Carbonsäuren, Ester, Fette
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
16 Alkansäuren alsOxidationsprodukte v.Aldehyden
typische Eigenschaften ausgewählter organischer Stoffebeschreiben( Alkansäuren)
Eigenschaften u. Struktur amBsp. der EssigsäureEssig
Reaktionen von Säuren mit Wasser alsProtonenübergang erkennen und erläutern
PraktikumProjekt: Herstellungeines Obst- oderWeinessigs
Geschichte„Essigtopf“
Organische Säuren alsnatürliche Bestandteile v.Lebensmitteln
Milchsäure,Weinsäure,Oxalsäure,Zitronensäure
Gruppenarbeit,PlakatPräsentation,Computer
Einfache Untersuchungs-methoden
pH-Messungen eine Titration zur Konzentrationsermittlung einer Säuredurchführen
den PC für Versuchsauswertung einsetzen
Praktikum:Bestimmung desGesamtsäuregehaltsin Milchproduktenu. Säften durchTitration
Ester, VeresterungEigenschaften u. Verwendungv. Estern
ausgewählte organische Reaktionstypen nennen u.erkennen (Esterbildung als Kondensationsreaktion)
typische Eigenschaften ausgewählter organischer Stoffebeschreiben(Ester)
einfache Experimente mit organischen Verbindungendurchführen (Estersynthese)
das Aufbauprinzip von Makromolekülen an einemBeispiel erläutern
Praktikum: Ester-synthese
15
FetteZusammensetzung u. Eigen-schaften pflanzlicher u.tierischer FetteFettspaltung
die Verwendung ausgewählter organischer Stoffe inAlltag oder Technik erläutern (Methan, Ethen, Ethanol,Aceton, Essigsäure)
Praktikum:Margari-neherstellung
Biologie
UE 4: Anorganische Kohlenstoffverbindungen und Kohlenstoffkreislauf
Std. Inhalte Hinweise Bezug zum Lehrplan„Die SchülerInnen können…“
Methoden Ver-netzungen
12 Geochemischer Kohlenstoff-kreislauf
(Möglichkeit des Einstiegs inKlasse 10)
Die chem. Grundlagen für einenKohlenstoffkreislauf in der belebten oderunbelebten Natur darstellen u. die Rolle dernachwachsenden Rohstoffe erläutern
Erdkunde,Biologie
1
Schulcurriculum HFG Oberkirch – Chemie –
Kursstufe Basiskurs, 2-stündig
UE 1: Naturstoffe
Std. ThemenKerncurriculum (K)Schulcurriculum (S)
Vorschläge zur Auswahl
Umsetzungsimpulse und Bezüge zuElemente Chemie Kursstufe
(ISBN 978-3-12-756820-2)
Bezug zu den Bildungsstandards„Die SchülerInnen können…“
K 15 Moleküle des Lebens Kap. 4 Naturstoffe
4.6 Kohlenhydrate im Überblick4.7 Monosaccharide4.9 Disaccharide4.12 Polysaccharide4.18 Strukturen der Aminosäuren4.21 Peptide und Proteine4.22 Eigenschaften und Nachweis vonProteinen4.23 Struktur der Proteine4.24 Denaturierung4.25 Bedeutung von Proteinen4.31 Nucleinsäuren
Die drei Naturstoffgruppen Kohlenhydrate,Proteine und Nucleinsäuren an ihrerMolekülstruktur erkennen (Polymere, Monomere);
Die Funktionen von Kohlenhydraten, Proteinen undNucleinsäuren in Lebewesen beschreiben(Energieträger, Bausubstanz, Informationsträger);
Kohlenhydrate oder Proteine charakterisieren(Molekülstruktur und Eigenschaften, sowieVorkommen und Bedeutung);
Die Verknüpfung von Monomeren beiKohlenhydraten oder Proteinen darstellen;
2
4.7 Monosaccharide- V2 Silberspiegelprobe (Tollensprobe)4.15 Praktikum Kohlenhydrate- V2 Silberspiegelprobe (Tollensprobe)- Glucotest-GOD-Test4.22 Eigenschaften und Nachweis vonProteinen- Biuretreaktion, B3, V2
Kohlenhydrate und Proteine mit einfachenLabormethoden nachweisen (Brennprobe, GOD-Test, Tollens-Probe, Biuret- oder Ninhydrin-Reaktion).
S Vorschläge zur Auswahl fürdas Schulcurriculum
4.1 Chiralität als Voraussetzung fürSpiegelbildisomerie4.3 Optische Aktivität4.4 Fischer-Projektionsformeln4.10 Gewinnung von Rübenzucker4.13 Stärke und Cellulose als nachwachsendeRohstoffe4.14 Ökobilanzen4.27 Enzyme – Bau und Wirkungsweise4.29 Impulse: Kohlenhydrate und Proteine inder Küche4.30 Exkurs: Fasern
3
UE 2: KunststoffeStd. Inhalte Umsetzungsimpulse und Bezüge zu
Elemente Chemie Kursstufe(ISBN 978-3-12-756820-2)
Bezug zu den Bildungsstandards„Die SchülerInnen können…“
K 12 Kunststoffe 6.1 Eigenschaften und Struktur der Kunststoffe Kunststoffe typisieren (zum Beispielmechanische, thermische Eigenschaften,Molekülstruktur, Thermoplaste, Duroplaste,Elaste);
6.2 Kunststoffe durch Polymerisation das Prinzip der Polymerisation auf eingeeignetes Beispiel anwenden;
6.4 Kunststoffe durch Polykondensation6.11 Impulse Biologisch abbaubare Kunststoffe
das Prinzip der Polykondensation undHydrolyse aus dem Leitthema „Moleküle desLebens“ auf die Bildung von Kunststoffenübertragen;
6.2 Kunststoffe durch Polymerisation- V1 Bildung von Polystyrol- V2 Bildung von Polymethacrylsäure-methylester6.4 Kunststoffe durch Polykondensation- V1 Polykondensation von Glycerin undButandisäure- V2 Nylonherstellung6.11 Impulse: Biologisch abbaubare Kunststoffe- V1 Synthese von Polymilchsäure6.12 Praktikum: Herstellung von Kunststoffen- V4 Ein Kunststoff aus Alltagschemikalien
jeweils ein Experiment zur Herstellung einesPolymerisats und eines Polykondensatsdurchführen;
4
6.2 Kunststoffe durch Polymerisation- Werkstoffe und Gebrauchsartikel aus: Polyethen,Polypropen, Polystyrol, Polyvinylchlorid,Polyacrylnitril, Polymethacrylsäuremethylester,Polytetrafluorethen6.3 Copolymere- ABS-Copolymere- Styrol-Butadien-Copolymere6.4 Kunststoffe durch Polykondensation- Werkstoffe und Gebrauchsartikel aus:Polyesterharzen, Polyamiden6.5 Kunststoffe durch Polyaddition- Elastanfasern6.6 Verarbeitung von Kunststoffen6.7 Kunststoffe im Alltag
zeigen, wie das Wissen um Struktur undEigenschaften von Monomeren und Polymerenzur Herstellung verschiedener Werkstoffegenutzt wird;
6.7 Kunststoffe im Alltag Vorteile und Nachteile bei der Verwendung vonMassenkunststoffen erläutern;
6.8 Verwertung von Kunststoffabfällen6.11 Impulse: Biologisch abbaubare Kunststoffe
verschiedene Möglichkeiten der Verwertungvon Kunststoffabfällen beschreiben undbewerten (Werkstoffrecycling,Rohstoffrecycling, energetische Verwertung,Nachhaltigkeit).
S Vorschläge zur Auswahl fürdas Schulcurriculum
6.7 Kunststoffe im Alltag6.9 Silikone6.10 Carbonfasern
5
UE 3: Reaktionsgeschwindigkeit und chemisches Gleichgewicht
Std. Inhalte Umsetzungsimpulse und Bezüge zuElemente Chemie Kursstufe
(ISBN 978-3-12-756820-2)
Bezug zu den Bildungsstandards„Die SchülerInnen können…“
15 Chemische Gleichgewichte Kap. 2 Reaktionsgeschwindigkeit und chemischesGleichgewicht
2.10 Chemische Reaktion und Gleichgewichts-einstellung2.12 Praktikum: Gleichgewichtseinstellung im Modell
an Beispielen die Bedingungen für dieEinstellung eines chemischenGleichgewichts erklären (Ester-Gleichgewicht, Ammoniak-Gleichgewicht);
2.13 Das Massenwirkungsgesetz das Massenwirkungsgesetz auf homogeneGleichgewichte anwenden;
2.15 Beeinflussung des chemischen Gleichgewichts das Prinzip von LE CHATELIER auf
verschiedene Gleichgewichtsreaktionenübertragen;
2.18 Die Ammoniaksynthese die gesellschaftliche Bedeutung derAmmoniak-Synthese erläutern;
Faktoren nennen, welche dieGleichgewichtseinstellungen bei derAmmoniak-Synthese beeinflussen undmögliche technische Problemlösungenkommentieren;
2.18 Die Ammoniaksynthese- Die großtechnische Ammoniaksynthese2.19 Exkurs: Fritz Haber
die Leistungen von HABER und BOSCH
präsentieren;
6
Kap. 3 Säure-Base-Gleichgewichte
3.2 Säure-Base-Theorie nach BRØNSTED Säuren und Basen nach BRØNSTED
definieren;
3.3 Autoprotolyse des Wassers und pH-Wert den pH-Wert über die Autoprotolyse desWassers erklären
Auswahl aus:3.4 Die Stärke von Säuren und Basen3.5 pH-Werte wässriger Lösungen- Reaktionen von Säuren und Basen, Kationen undAnionen mit Wasser3.6 Puffersysteme3.8 Säure-Base-Titrationen3.12 Praktikum: Säuren und Basen in Produkten desAlltags
Säure-Base-Reaktionen durchführen undReaktionsgleichungen für verschiedeneSäure-Base-Reaktionen in wässrigenLösungen angeben.
S Vorschläge zur Auswahl fürdas Schulcurriculum
Reaktionsgeschwindigkeit
2.1 Die Geschwindigkeit von Reaktionen2.2 Praktikum: Geschwindigkeit von Reaktionen2.3 Konzentration und Reaktionsgeschwindigkeit2.4 Kollisionsmodell2.5 Reaktionsgeschwindigkeit und Zerteilungsgrad2.7 Reaktionsgeschwindigkeit und Temperatur2.8 Katalyse
7
Weitere 3.4 Die Stärke von Säuren und Basen3.5 Puffersysteme3.6 Impulse: Die Bedeutung von Puffersystemen3.8 Säure-Base-Titrationen3.9 Titration und Indikatoren3.10 Halbtitration3.11 Impulse: Titration theoretisch und praktisch3.12 Praktikum: Säuren und Basen in Produkten desAlltags
8
UE 4: Elektrische Energie und ChemieStd. Inhalte Umsetzungsimpulse und Bezüge
zuElemente Chemie Kursstufe
(ISBN 978-3-12-756820-2)
Bezug zum Lehrplan„Die SchülerInnen können…“
14 Elektrische Energie undChemie
Kap. 7 Redoxreaktionen undElektrochemie
7.1 Oxidation und Reduktion7.4 Die Redoxreihe
Reaktionsgleichungen für Redoxreaktionen formulieren undden Teilreaktionen die Begriffe Elektronenaufnahme(Reduktion) und Elektronenabgabe (Oxidation) zuordnen;
7.5 Galvanische Elemente7.13 ElektrochemischeStromerzeugung7.15 Impulse:Brennstoffzellentechnik
Redoxreaktionen beschreiben, die der Umwandlung vonchemischer Energie in elektrische Energie dienen(Galvanische Zellen, Brennstoffzellen);
die Bedeutung einer Brennstoffzelle für die zukünftigeEnergiebereitstellung erläutern;
7.11 Elektrolysen in wässrigenLösungen
Elektrolysen als erzwungene Redoxreaktionen erklären.
S Vorschläge zur Auswahl fürdas Schulcurriculum
7.6 ElektrochemischeSpannungsreihe7.3 Praktikum: Redoxtitration7.10 Exkurs: Leitfähigkeitstitration7.13 ElektrochemischeStromerzeugung (Batterien undAkkumulatoren)7.16 Korrosion undKorrosionsschutz7.17 Praktikum: Korrosion undKorrosionsschutz
9
Weitere Themen für das SchulcurriculumStd. Inhalte Umsetzungsimpulse und Bezüge zu
Elemente Chemie Kursstufe(ISBN 978-3-12-756820-2)
Bezug zu den Bildungsstandards„Die SchülerInnen können…“
S Aromaten
Vorschläge zur Auswahl fürdas Schulcurriculum
Kap. 5 Aromaten
5.1 Erforschung des Benzols5.2 Bindungsverhältnisse imBenzolmolekül5.3 Mesomerie und Aromatizität5.7 Wichtige Benzolderivate
S Tenside und Waschmittel
Vorschläge zur Auswahl fürdas Schulcurriculum
Kap. 8 Fette und Tenside
8.8 Verseifung von Fetten8.9 Amphiphile Eigenschaften von Seife8.10 Seife, ein Tensid8.11 Nachteile von Seifen8.12 Tenside als waschaktive Substanzen8.13 Inhaltsstoffe von Waschmitteln
S Farbstoffe
Vorschläge zur Auswahl fürdas Schulcurriculum
Kap. 9 Farbstoffe
9.1 Licht und Farbe9.2 Struktur und Farbe9.3 Naturfarbstoffe9.4 Azofarbstoffe9.5 Küpenfärbung am Beispiel des Indigo9.7 Praktikum: Farbstoffe
K 56 Stunden
1
Schulcurriculum HFG Oberkirch – Chemie –
Kursstufe Neigungskurs, 4-stündig
UE 1: Chemische Energetik
Std. ThemenKerncurriculum (K)Schulcurriculum (S)
Vorschläge zur Auswahl
Umsetzungsimpulse undBezüge zuElemente ChemieKursstufe(ISBN 978-3-12-756820-2)
Bezug zu den Bildungsstandards„Die SchülerInnen können…“
K 15 Chemische Energetik 1.1 Chemische Reaktionund Wärme
Offene, geschlossene und isolierte Systeme definieren.
1.1 Chemische Reaktionund Wärme
- exotherme undendothermeReaktionen
1.3 Innere Energie undEnthalpie
1.5Verbrennungsenthalpien- Brennwert, Heizwert
Chemische Reaktionen unter stofflichen und energetischenAspekten (exotherm, endotherm, Brennwert, Heizwert) erläutern
2
1.5 Praktikum:Bestimmung derReaktionswärme
1.6 Praktikum:Bestimmung vonEnthalpien
1.8 Praktikum:Reaktionsenthalpien
Eine kalorimetrische Messung planen, durchführen und auswerten(Reaktionsenthalpie)
1.7 Bildungsenthalpien undReaktionsenthalpien
Den Satz von der Erhaltung der Energie auf chemischeReaktionen anwenden und Reaktionsenthalpien berechnen
1.9 Die Richtung spontanerVorgänge
1.10 Entropie
1.11 Impulse:Wahrscheinlichkeit
Die Entropie als Maß für die Wahrscheinlichkeit eines Zustandesbeschreiben
Änderungen der Entropie bei chemischen Reaktionen abschätzen
1.12 Freie Enthalpie Die GIBBS-HELMHOLTZ-Gleichung auf geeignete Beispieleanwenden (Freie Reaktionsenthalpie)
An Beispielen die Grenzen der energetischen Betrachtungsweiseaufzeigen.(metastabiler Zustand und unvollständig ablaufendeReaktionen)
3
UE 2: Reaktionsgeschwindigkeit und chemisches Gleichgewicht
Std. Inhalte Umsetzungsimpulse und Bezüge zuElemente Chemie Kursstufe
(ISBN 978-3-12-756820-2)
Bezug zu den Bildungsstandards„Die SchülerInnen können…“
K 15 Chemische Gleichgewichte 2.10 Chemische Reaktion undGleichgewichtseinstellung
2.11 Praktikum: Umkehrbarkeit undGleichgewicht
umkehrbare Reaktionen und die Einstellung eineschemischen Gleichgewichts beschreiben(Veresterung und Ester-Hydrolyse);
2.12 Praktikum: Gleichgewichtseinstellungim Modell
ein Modellexperiment zurGleichgewichtseinstellung durchführen;
2.13 Das Massenwirkungsgesetz
2.14 Impulse: Berechnungen zum MWG
das Massenwirkungsgesetz zur quantitativenBeschreibung von homogenenGleichgewichtsreaktionen anwenden;
2.15 Beeinflussung des chemischenGleichgewichts2.17 Impulse: Das MWG im www
das Prinzip von LE CHATELIER zur Beeinflussungvon Gleichgewichten anwenden (Änderungen vonKonzentrationen, Druck und Temperatur);
2.15 Beeinflussung des chemischenGleichgewichts- Gleichgewicht und Katalysator
die Rolle eines Katalysators für dieGleichgewichtseinstellung erläutern;
4
2.18 Die Ammoniaksynthese
2.19 Exkurs: Fritz Haber
die Leistungen von HABER und BOSCH
präsentieren;
Faktoren nennen, welche die Gleichgewichts-einstellung bei der Ammoniak-Synthesebeeinflussen und mögliche technischeProblemlösungen kommentieren
die gesellschaftliche Bedeutung der Ammoniak-Synthese erläutern
S Vorschläge zur Auswahl fürdas Schulcurriculum
Reaktionsgeschwindigkeit
2.1 Die Geschwindigkeit von Reaktionen2.2 Praktikum: Geschwindigkeit vonReaktionen2.3 Konzentration undReaktionsgeschwindigkeit2.4 Kollisionsmodell2.5 Reaktionsgeschwindigkeit undZerteilungsgrad2.6 Energieverlauf beim Wechsel einesBindungspartners2.7 Reaktionsgeschwindigkeit undTemperatur2.8 Katalyse
Weitere 2.20 Exkurs: Lösungsgleichgewichte2.21 Exkurs: Aggregatzustand undGleichgewicht
5
UE 3: Säure-Base-Gleichgewichte
Std. Inhalte Umsetzungsimpulse undBezüge zuElemente ChemieKursstufe(ISBN 978-3-12-756820-2)
Bezug zu den Bildungsstandards„Die SchülerInnen können…“
K 22 Säure-Base-Gleichgewichte 3.2 Säure-Base-Theorienach BRØNSTED
3.3 Autoprotolyse desWassers und pH-Wert
die Gleichgewichtslehre auf Säure-Base-Reaktionen mit Wasseranwenden;
Säure-Base-Reaktionen mithilfe der Theorie von BRØNSTED
beschreiben;
das Donator-Akzeptor-Prinzip auf Säure-Base-Reaktionenübertragen;
die Autoprotolyse des Wassers erläutern und den pH-Wertdefinieren;
3.4 Die Stärke von Säurenund Basen
Säuren und Basen mithilfe der pKS-Werte (Säurestärke)beziehungsweise pKB-Werte (Basenstärke) klassifizieren
3.5 pH-Werte wässrigerLösungen
pH-Werte von Lösungen einprotoniger, starker Säuren und vonHydroxid-Lösungen berechnen;
im Näherungsverfahren pH-Werte für Lösungen schwacherSäuren und Basen berechnen;
3.6 Puffersysteme
3.7 Impulse: Bedeutungvon Puffern
Puffersysteme und deren Bedeutung an Beispielen erklären;
6
3.8 Säure-Base-Titrationen
3.11 Impulse: Titrationtheoretisch und praktisch
3.12 Praktikum Säuren undBasen in Produkten desAlltags
Säure-Base-Titrationen zur Konzentrationsbestimmung planenund experimentell durchführen;
3.9 Titration und Indikator die Säure-Base-Theorie auf Indikatoren anwenden.
S Vorschläge zur Auswahl fürdas Schulcurriculum
3.1 Exkurs: DieEntwicklung des Säure-Base-Begriffs
3.5 pH-Werte wässrigerLösungen
- Salzlösungen3.10 Exkurs: Halbtitration
7
UE 4: NaturstoffeStd. Inhalte Umsetzungsimpulse und
Bezüge zuElemente ChemieKursstufe(ISBN 978-3-12-756820-2)
Bezug zum Lehrplan„Die SchülerInnen können…“
K 30 Naturstoffe 4.1 Chiralität alsVoraussetzung fürSpiegelbildisomerie
die Chiralität am räumlichen Bau von Molekülen erkennen (asymmetrischesKohlenstoff-Atom);
4.4 Fischer-Projektionsformeln4.11 Impulse Modelle –Projektionen – Formeln4.5 Exkurs: Weitere Regelnzur Fischer-Projektion4.6 Kohlenhydrate imÜberblick4.7 Monosaccharide
4.9 Disaccharide
4.11 Impulse: Modelle –Projektionen – Formeln
4.12 Polysaccharide
die Monomere biologisch wichtiger Makromoleküle nennen undderen Strukturformeln in der Fischer-Projektion angeben (D-Glucose, D-Fructose, L--Aminosäuren);
Mono- und Disaccharide in Projektionsformeln nach FISCHER undHAWORTH darstellen (D-Isomere, - und -Form);
die Monomere biologisch wichtiger Makromoleküle nennen undderen Strukturformeln in der Fischer-Projektion angeben (D-Glucose, D-Fructose, L--Aminosäuren);
Mono- und Disaccharide in Projektionsformeln nach FISCHER undHAWORTH darstellen (D-Isomere, - und -Form);
Vorkommen, Verwendung und Eigenschaften vonMonosacchariden, Disacchariden und Polysaccharidenbeschreiben (Glucose, Fructose, Maltose, Cellobiose, Saccharose,Stärke, Amylose und Cellulose);
die glykosidische Bindung erläutern; das Prinzip der Kondensationsreaktion anwenden, um die Vielfalt
als Ergebnis der Wiederholung einfacher Prozesse begründen; die Funktion biologisch wichtiger Stoffe aus dem räumlichen
Aufbau ihrer Moleküle begründen (Stärke, Cellulose, Enzyme,DNA);
8
4.10 Gewinnung vonRübenzucker
4.13 Stärke und Celluloseals nachwachsendeRohstoffe
4.14 Ökobilanzen
Beispiele für die Nutzung nachwachsender Rohstoffe nennen(Ökobilanzierung);
4.15 Praktikum:Kohlenhydrate- Glucotest – GOD-Test- Silberspiegelprobe(Tollensprobe)
Nachweisreaktionen auf Zucker und Proteine experimentelldurchführen (GOD-Test, Tollens-Probe, Biuret- oder Ninhydrin-Reaktion);
4.18 Strukturen derAminosäuren
die Monomere biologisch wichtiger Makromoleküle nennen undderen Strukturformeln in der Fischer-Projektion angeben (D-Glucose, D-Fructose, L--Aminosäuren);
4.21 Peptide und Proteine die Primärstruktur eines Peptids aus vorgegebenen Aminosäurendarstellen;
das Prinzip der Kondensationsreaktion anwenden und die Vielfaltals Ergebnis der Wiederholung einfacher Prozesse begründen;
4.22 Eigenschaften undNachweis von Proteinen
Nachweisreaktionen auf Zucker und Proteine experimentelldurchführen (GOD-Test, Tollens-Probe, Biuret- oder Ninhydrin-Reaktion);
4.23 Struktur der Proteine die Sekundär-, Tertiär- und Quartärstruktur von Proteinenerläutern
;4.24 Denaturierung Denaturierungsvorgänge und deren Bedeutung erklären;
9
4.25 Bedeutung vonProteinen
4.27 Enzyme – Bau undWirkungsweise
4.28 Beeinflussung derEnzymaktivität
die Funktion biologisch wichtiger Stoffe aus dem räumlichenAufbau ihrer Moleküle begründen (Stärke, Cellulose, Enzyme,DNA);
4.30 Exkurs: Fasern Beispiele für die Nutzung nachwachsender Rohstoffe nennen(Ökobilanzierung);
4.31 Nucleinsäuren – vomGen zum Protein
die Funktion biologisch wichtiger Stoffe aus dem räumlichenAufbau ihrer Moleküle begründen (Stärke, Cellulose, Enzyme,DNA);
mithilfe von Modellen den Aufbau der DNA erklären unddarstellen (Phosphorsäureester, Desoxyribose, Basenpaarungdurch Wasserstoffbrücken);
Vorkommen und Bedeutung der DNA erklären.
10
S Vorschläge zur Auswahl fürdas Schulcurriculum
4.2 Exkurs: Bedeutungchiraler Moleküle in derMedizin
4.3 Optische Aktivität
4.16 Zuckerersatzstoffe
4.20 Trennung vonAminosäuren
4.23 Struktur der ProteineExkurs: Haarformung undProteinstruktur
-4.26 Impulse:Aminosäuren im Alltag
4.29 Impulse:Kohlenhydrate undProteine in der Küche
4.31 Nucleinsäuren – vomGen zum Protein- Replikation der DNA- Polymerase-Kettenreaktion (PCR)
11
UE 5: AromatenStd. Inhalte Umsetzungsimpulse und
Bezüge zuElemente ChemieKursstufe(ISBN 978-3-12-756820-2)
Bezug zu den Bildungsstandards„Die SchülerInnen können…“
K 6 Aromaten 5.1 Erforschung desBenzols
Eigenschaften, Vorkommen und Verwendung von Benzolbeschreiben;
am Beispiel des Benzols die mögliche Gesundheitsproblematikeiner chemischen Substanz erläutern;
bei Diskussionen um gesundheitsgefährdende Stoffe fachlichfundiert argumentieren (MAK, TRK);
5.2 Bindungsverhältnisseim Benzolmolekül
5.3 Mesomerie undAromatizität
5.5 Halogenierung desBenzols
Grenzen bisher erarbeiteter Bindungsmodelle angeben undunerwartete Eigenschaften des Benzols aus der besonderenMolekülstruktur erklären (delokalisierte Elektronen, Mesomerie,KEKULÉ);
12
5.7 WichtigeBenzolderivate
5.8 Exkurs: Acidität vonPhenol und Basizität vonAnilin
Säurewirkung vonPhenol
5.10 Impulse: Aromaten imAlltag
die Bedeutung oder Verwendung weiterer wichtiger Aromaten inNatur, Alltag und Technik beschreiben, sowie die systematischenNamen und Strukturformeln dieser Aromaten angeben (Phenol,Toluol, Benzaldehyd, Benzoesäure, Styrol, Phenylalanin).
S Vorschläge zur Auswahl fürdas Schulcurriculum
5.4 Exkurs:Delokalisierung undStabilisierung5.6 Exkurs:Reaktionsmechanismen imVergleich5.8 Exkurs: Acidität vonPhenol und Basizität vonAnilin5.9 Exkurs: ASS – einJahrhundertarzneimittel5.10 Impulse: Aromaten imAlltag
13
UE 6: Kunststoffe
Std. Inhalte Umsetzungsimpulse undBezüge zuElemente ChemieKursstufe(ISBN 978-3-12-756820-2)
Bezug zum Lehrplan„Die SchülerInnen können…“
K 18 6.1 Eigenschaften undStruktur der Kunststoffe
den Zusammenhang zwischen den Eigenschaften von Kunststoffen undihrer Molekülstruktur erläutern (Thermoplaste, Duroplaste, Elaste,STAUDINGERs Theorie der Makromoleküle);
6.2 Kunststoffe durchPolymerisation
die Teilschritte einer Polymerisationsreaktion mit Strukturformelnund Reaktionsgleichungen beschreiben (radikalischePolymerisation, Startreaktion, Kettenwachstum, Abbruchreaktion);
6.2 Kunststoffe durchPolymerisation6.3 Copolymere6.4 Kunststoffe durchPolykondensation6.5 Kunststoffe durchPolyaddition6.12 Praktikum:Herstellung vonKunststoffen
das Prinzip von Kunststoffsynthesen erläutern (Polymerisation,Polykondensation und Polyaddition) und die Kenntnisse aufgeeignete Beispiele anwenden (Monomer und Polymer, Polyethen,Polyvinylchlorid, Polyamid, Polyester, Polyurethan);
darstellen, wie das Wissen um Struktur und Eigenschaften vonMonomeren und Polymeren zur Herstellung verschiedenerWerkstoffe genutzt wird;
Polymere selbst herstellen (Polymerisat, Polykondensat);
6.6 Verarbeitung vonKunststoffen
darstellen, wie das Wissen um Struktur und Eigenschaften vonMonomeren und Polymeren zur Herstellung verschiedenerWerkstoffe genutzt wird;
14
6.7 Kunststoffe im Alltag Lösungsstrategien zur Verwertung von Kunststoffabfällen darstellen(Werkstoffrecycling, Rohstoffrecycling, energetische Verwertung;Nachhaltigkeit);
Aspekte der Nachhaltigkeit beim Einsatz von Kunststoffenzusammenstellen (PET-Flaschen, Kraftfahrzeugteile).
S Vorschläge zur Auswahl fürdas Schulcurriculum
6.7 Kunststoffe im Alltag6.9 Exkurs Silikone6.10 Exkurs: Carbonfasern
15
K 7: Redoxreaktionen und Elektrochemie
Std. Inhalte Umsetzungsimpulse undBezüge zuElemente ChemieKursstufe(ISBN 978-3-12-756820-2)
Bezug zum Lehrplan„Die SchülerInnen können…“
K 24 Elektrochemie 7.1 Oxidation undReduktion
das Donator-Akzeptor-Prinzip auf Reaktionen mitElektronenübergang anwenden (Oxidation, Reduktion, Angabe vonRedoxpaaren);
7.2 Oxidationszahlen undRedoxgleichungen7.8 Impulse: Aufstelleneiner Redoxgleichung
Redoxreaktionen mithilfe von Oxidationszahlen identifizieren;
7.4 Die Redoxreihe den Aufbau einer galvanischen Zelle beschreiben;
7.5 Galvanische Elemente den Aufbau einer galvanischen Zelle beschreiben; die wesentlichen Prozesse bei Elektrolysen und galvanischen Zellen
nennen und beschreiben; elektrochemische Experimente durchführen und auswerten;
7.6 Die elektrochemischeSpannungsreihe
den Aufbau und die Funktion der Standard-Wasserstoff-Halbzelleerläutern;
die Tabelle der Standardpotenziale zur Vorhersage vonelektrochemischen Reaktionen anwenden;
elektrochemische Experimente durchführen und auswerten;
16
7.7 Die Nernst-Gleichung den Zusammenhang zwischen Ionen-Konzentration und messbarerPotenzialdifferenz in galvanischen Zellen erläutern;
elektrochemische Experimente durchführen und auswerten;
7.11 Elektrolysen inwässrigen Lösungen
die wesentlichen Prozesse bei Elektrolysen und galvanischen Zellennennen und beschreiben;
elektrochemische Experimente durchführen und auswerten;
7.13 ElektrochemischeStromerzeugung7.15 Impulse:Brennstoffzellentechnik
herkömmliche Stromquellen mit aktuellen und zukunftsweisendenEntwicklungen bei elektrochemischen Stromquellen(Brennstoffzelle) vergleichen;
Möglichkeiten zur elektrochemischen Speicherung von Energiebeschreiben;
elektrochemische Experimente durchführen und auswerten;
7.14 Praktikum:Spannungsquellen
elektrochemische Experimente durchführen und auswerten.
17
S Vorschläge zur Auswahl fürdas Schulcurriculum
7.3 Redoxtitration7.7 Die Nernst-Gleichung- Nernst-Gleichung fürbeliebige Redoxpaare- Bestimmung vonLöslichkeitsprodukten7.10 Exkurs:Leitfähigkeitstitration7.11 Elektrolysen inwässrigen Lösungen- Alkalichloridelektrolyse7.12 Exkurs: QuantitativeBetrachtung derElektrolyse7.16 Exkurs: Korrosionund Korrosionsschutz7.17 Praktikum: Korrosionund Korrosionsschutz
18
Weitere Themen für das Schulcurriculum
Std. Inhalte Umsetzungsimpulse undBezüge zuElemente ChemieKursstufe(ISBN 978-3-12-756820-2)
Bezug zum Lehrplan„Die SchülerInnen können…“
S Tenside und Waschmittel
Vorschläge zur Auswahl fürdas Schulcurriculum
Kap. 8 Fette und Tenside
8.8 Verseifung von Fetten8.9 AmphiphileEigenschaften von Seife8.10 Seife, ein Tensid8.11 Nachteile von Seifen8.12 Tenside alswaschaktive Substanzen8.13 Inhaltsstoffe vonWaschmitteln
Farbstoffe
Vorschläge zur Auswahl fürdas Schulcurriculum
Kap. 9 Farbstoffe
9.1 Licht und Farbe9.2 Struktur und Farbe9.3 Naturfarbstoffe9.4 Azofarbstoffe9.5 Küpenfärbung amBeispiel des Indigo9.7 Praktikum: Farbstoffe
K 130 Stunden