Vorlesung Anorganische Chemie IV / CHE 316 Anorganische...
Transcript of Vorlesung Anorganische Chemie IV / CHE 316 Anorganische...

12 ps
1.0 s
10 s
10.0 ns
2.1 ns
39.8 ns
1900 1950 2000 2050Wavenumbers/cm
-1
Abso
rban
ce
Ab
sorb
ance C
hang
e
1.0 mOD
a
b
ACIV-FS15-1
Vorlesung Anorganische Chemie IV / CHE 316
Anorganische Reaktionsmechanismen
Roger Alberto, Felix Zelder FS 2015
kobs = (k1k2[CN–] + k–1k–2)/(k–1 + k2[CN–])
222
2
2
232
totobstot CokCocA
HAKk
dt
dH

ACIV-FS15-2
1. Allgemeines
Einige Begriffe: Elementarreaktion, Reaktionsmechanismus, Kinetik,
Reaktionsprofil, Aktivierungsparameter, ...
1.2 Mechanismus und Struktur
1.3 Gesamtreaktion und Reaktionsgeschwindigkeit
1.4 Einfache Reaktionsschemen
1.5 Steady state Approximation
1.6 Das vorgelagerte Gleichgewicht
1.7 Katalyse und Enzym katalysierte Reaktion
1.8 Kompetitive Inhibitoren
Inhaltsverzeichnis

ACIV-FS15-3
2. Herleitung des Reaktionsmechanismus
2.1 Abhängigkeiten von [H+]
2.2 Komplexbildung
2.3 Theorie des Uebergangszustandes
2.4 Zusammengesetzte Reaktionen
2.5 Mikroskopische Reversibilität
2.6 Diffusionskontrollierte Reaktionen
2.7 Kinetischer Isotopeneffekt
2.8 Nicht-kinetische Methoden
2.9 Simulationen von Reaktionsmechanismen mit KinTek®
(Quer durch die Vorlesung)
3. Lösungsmittel Aspekte
3.1 Lösungsmittel als Säure/Base-Systeme
3.2 Donor- Akzeptorverhalten
3.3 Brönsted Säuren als Lösungsmittel
3.4 Supersäuren
Inhaltsverzeichnis

ACIV-FS15-4
4. Reaktionen von Verbindungen der p-Block-Elemente
4.1 Atom- und Gruppenübertragungsreaktionen
4.2 Substitutionen an trivalenten Hauptgruppenzentren (KZ = 3)
4.3 Substitutionen an tetravalenten Hauptgruppenzentren (KZ = 4)
4.4 Substitutionen an pentavalenten Hauptgruppenzentren (KZ = 5)
4.5 Substitutionen an hexavalenten Hauptgruppenzentren (KZ = 6)
4.6 Intramolekulare Umlagergungen
4.7 Atomtransfer-Redoxreaktionen
4.8 Radikalreaktionen
4.9 Sonstige Reaktionen
Inhaltsverzeichnis

ACIV-FS15-5
5. Ligandsubstitutionen in Komplexen
5.1 Substitutionen in oktaedrischen Komplexen
5.2 Wasserselbstaustauschreaktionen - Anation
5.3 Substitutionen in quadratisch planaren Komplexen
5.4 Der trans Effekt
5.5 Substitutionen in metallorganischen Komplexen
5.6 Photochemische Substitutionen
5.7 Intramolekulare Umlagerungen
5.8 Grubbs Olefin Metathesis
6. Redoxreaktionen von Komplexen
6.1 Reaktionen nach dem Aussensphärenmechanismus
6.2 Gesamtreaktion und Reaktionsgeschwindigkeit
6.3 Der Begegnungskomplex
6.4 Der Elektronentransfer Schritt
6.5 Marcus-Hush Korrelation
6.6 Reaktionen nach dem Innensphärenmechanismus
6.7 Nicht-komplementäre Redox-Reaktionen
Inhaltsverzeichnis

ACIV-FS15-6
• Robert B. Jordan,
Reaction Mechanisms of Inorganic and Organometallic
Systems, Oxford University Press, 2007 (Third Edition)
• Jim D. Atwood,
Inorganic and Organometallic Reaction Mechanisms, VCH,
1997 (Second Edition)
• M.L. Tobe, J. Burgess
Inorganic Reaction Mechanisms, Addison Wesley Longman, Essex UK, 2000
• R.K. Sharma
Inorganic Reaction Mechanisms, Discovery Publishing House, 2007
• James H. Espenson
Chemcial Kinetics and Reaction Mechanisms, McGraw Hill 2002
Inhaltsverzeichnis

ACIV-FS15-7
• Reaktionsmechanismus
• Elementarreaktion (-prozess)
• Kinetik
• Geschwindigkeitsgesetz
• Geschwindigkeitsbestimmender Schritt
• Reaktand, Edukt, Produkt
• Vorgelagertes Gleichgewicht
• Aktivierungsenergie, -enthalpie, -entropie
• Aktivierter Komplex, Übergangszustand
• Reaktionsordnung
• Molekularität
• Reaktionskoordinate
• Reaktionsprofil
• (Thermodynamische) Stabilität Instabilität
• (Kinetische) Inertheit Labilität
Einige Begriffe im Zusammenhang mit chemischen Reaktionen
Inhaltsverzeichnis

ACIV-FS15-8
Reaktionsgeschwindigkeit
v = -d[A]
dt= -
d[B]
dt
d[P]
dt= = k2 · [A] · [B]
Thermodynamik und Kinetik

ACIV-FS15-9
Empirisch: Arrhenius-Gleichung
k = A · exp(-Ea/RT) Ea: Arrhenius-Aktivierungsenergie
A: Frequenzfaktor
Modell des Übergangszustands: Eyring-Gleichung
(2) k =kB · T
h· exp(-G /RT) =
kB · T
h·exp(S# /R) ·exp(- H# /RT)
kB: Boltzmann-Konstante, T: abs. Temperatur, h: Planck-Konstante
kB·T/h 1013 sec-1 bei 25°C
G# : freie Aktivierungsenthalpie
H# : Aktivierungsenthalpie
S# : Aktivierungsentropie
Aktivierungsenergie

ACIV-FS15-10
Beispiel: Produktbildung über Zwischenprodukt im Gleichgewicht
A + B Z Pk1 k3
k2
d[A] /dt = d[B]/dt = -k1 · [A] ·[B] + k2 ·[Z]
d[Z] /dt = k1 · [A] ·[B] - k2 ·[Z] - k3 ·[Z]
d[P]/dt = -d[Z] /dt = k3·[Z] = f([A], [B])
A + B Z PK k3
K = k1
k2
= [Z]
[A] · [B]
d[P]/dt = k3 ·[Z] = k3·K ·[A] ·[B]; k3 · K = konst.
Mechanismus und Kinetik (Geschwindigkeitsgesetz)
Gleichungssystem:
Beispiel: schnelles vorgelagertes Gleichgewicht

ACIV-FS15-11
Beispiel: Z sei ein kurzlebiges Zwischenprodukt (k1 k2 + k3)
Stationäritätsprinzip, es gilt d[Z]/dt = 0
[Z] =k1
k2 + k3
·[A] ·[B]
v = k3 ·[Z] = k3 · k1
k2 + k3
·[A] ·[B];k3 · k1
k2 + k3
= konst.
Mechanismus und Kinetik (Geschwindigkeitsgesetz)
d[Z]/dt = 0 = k1 · [A] ·[B] - k2 ·[Z] - k3 ·[Z]
R + R‘
R : R‘P : P‘
P + P‘
k1 k2 k3
E
O
k1
k2
k3
R + R‘
R : R‘P : P‘ P + P‘
E
O
E
R
E
O
k1
k3
k2
A + Bz P
k1
k2
k3
z
PA + B

ACIV-FS15-12
- Elementarreaktion: kleinste Einheit einer chemischen Reaktion auf molekularer Ebene
- Reaktionsmechanismus: Satz von Elementarreaktionen, beschreibt Gesamtreaktion
-Aufstellung von kinetischen Schemata Geschwindigkeitsgesetz
Verständnis der Reaktionsvorgänge
Bedeutung von Elementarreaktionen
Elementarreaktionen
H2O2 + H2 no reaction
H2O2 + H2 + Fe2+ Fe2+/Fe3+ + 2 H2O
Fe2+ + H2O2 Fe3+ + OH- + OH
OH + H2O2 H2O + HO2
HO2 + H2O2 H2O + O2 + OH

ACIV-FS15-13
1) Elektronentransferreaktionen (ohne Bindungsbildung/-bruch)
Fe(bpy)32+ + Ru(bpy)3
3+ Fe(bpy)33+ + Ru(bpy)3
2+
2) Bildung oder Bruch einer Bindung: H+ + H- / H—H
Homolyse: I — I I· + I·
Heterolyse: Me3N — BF3 Me3N + BF3
Einteilung von Elementarreaktionen
3) Bruch einer Bindung und simultaner Bildung einer neuen
R—H + OH R + H2O

ACIV-FS15-14
4) Simultaner Bruch von 2 Bindungen und Bildung von 2 neuen (selten)
O
NO
O
+ ONO
O
N
O
+ OO + NO
Charakteristische Merkmale von Elementarreaktionen
a) Die Molekularität übersteigt selten 3
4 I2 + S2O32- + 10 OH- 8 I- + 2 SO4
2- + 5 H2O
kein Elementarprozess mehrstufig
b) Die Strukturänderung (Reaktanden Produkte) sollte
bei einem Elementarprozess minimal sein
Einteilung von Elementarreaktionen

ACIV-FS15-15
Geometrie und Mechanismus: k = p · Z · e-Ea/RT
Sterischer Faktor p wird durch die geometrische Anordnung der
kollidierenden Moleküle beeinflusst.
Einfluss von: - Atom- und Ionengrösse
Beispiel: Perchlorate und Periodate sind starke Oxidationsmittel.
Periodate sind grösser und reagieren schneller.
Beispiel: H2O2 H2O + 1/2 O2 I
H2S2 H2S + S II
I exothermer als II, aber II schneller als I
-Molekülgeometrie
SF4 hydrolysiert sehr schnell
SF6 hydrolysiert sehr langsam
1.2 Mechanismus und Struktur

ACIV-FS15-16
"least energy pathway" und das Kriterium der maximalen Überlappung
„Reaktionspfad mit minimaler Energie“ kontrolliert durch HOMO/LUMO- Wechselwirkung
s = 0
s < 0
s > 0
Orbitalkontrolle
Mechanismus und Struktur

ACIV-FS15-17
- HOMO/LUMO-Wechselwirkung von Molekülen als Kriterium für den Reaktionspfad
- Erhaltung der Orbitalsymmetrie (Woodward-Hoffmann Regeln)
AttraktiveRepulsive
Wechselwirkung
Mechanismus und Struktur

ACIV-FS15-18
Bruttoreaktion
A + B = PModellierung
Erfahrung und Intuition
Vorschlag für Mechanismus
theoretisches v-Gesetz
Prognosen über Zwischenprodukte,
Wirkung von Einflussgrössen, etc.
Experimente
Kinetische Messungen
Experimentelles
v-Gesetz
Exp. Prüfung der
Modellaussagen
Modell, das die vorhandenen exp.
Befunde konsistent erklärt
Prognose erfüllt
Übereinstimmung
ja
Mechanismus Geschwindigkeitsgesetzeindeutig
mehrdeutig
nein
Algorithmus zur Lösung eines Mechanismus

ACIV-FS15-19
Die Gesamtreaktion zeigt die Summe aller beteiligten Teilchen
2 Fe2+ + Tl3+ 2 Fe3+ + Tl+
- bedeutet nicht, dass v = k [Fe2+]2 [Tl3+]
- Die Reaktionsgeschwindigkeit wird sicher proportional zur Konzentration sein,
das Geschwindigkeitsgesetz muss aber experimentell hergeleitet werden
tatsächlich wird gefunden
Die Stöchiometrie der Reaktion definiert aber die Zeitabhängigkeit aller Teilchen
][Tl][Fe
]Tl[][FeK
322
2
1
3
Falls keine Zwischenprodukte in signifikanter Konzentration auftreten, gilt
)][Tl]([Tl)][Fe]([Fe2
1)][Tl]([Tl)][Fe]([Fe
2
10t0
3t
3t
30
3t
20
2
dt
]d[Tl
dt
]d[Fe
2
1
dt
]d[Tl
dt
]d[Fe
2
1 332
1.3 Gesamtreaktion und Reaktionsgeschwindigkeit
v1 = k [Fe2+] [Tl3+]

ACIV-FS15-20
Ein Reaktionsmechanismus ist die Gesamtheit einer Anzahl von Teilschritten
2 Fe3+ + Tl+ 2 Fe2+ + Tl3+
Diese Teilschritte heißen Elementarreaktionen:
Repräsentieren die einfachsten molekularen Kombinationen
Elementarreaktionen sind uni-, bi- oder sehr selten termolekular
Viele Reaktionen, welche termolekular scheinen, stellen sich als bimolekular heraus
Fe3+ + Tl+ Fe2+ + Tl2+
Tl2+ + Fe3+ Fe2+ + Tl2+
2 mal eine bimolekulare Elementarreaktion
Gesamtreaktion und Reaktionsgeschwindigkeit

ACIV-FS15-21
Geschwindigkeitsgesetze können auch von Teilchen abhängen, welche
nicht explizit in der Gleichung auftreten
[(H2O)5CrCl]2+ + H2O [(H2O)5Cr(OH2)]3+ + Cl-
v1 = k1 [(OH2)5CrCl][H2O]
]CrClO)[(H][H
kk
dt
]CrClO)d[(H 252
21
252
][H
kk
dt
]CrClO)dln[(H
]CrClO)[(H
]/dtCrClO)d[(H 21
252
252
252
Gesamtreaktion und Reaktionsgeschwindigkeit

ACIV-FS15-22
Auf der anderen Seite können Teilchen, welche in der Reaktionsgleichung
auftauchen, für das Geschwindigkeitsgesetz bedeutungslos sein
[(NH3)5CoBr]2+ + X- [(NH3)5CoX]2+ + Br-
kann auf Grund der Stöchiometrie nicht vorausgesagt werden!
X- = Cl-, CN-, NCS- etc.
v = k [(NH3)5CoBr]
[(NH3)5CoBr]2+ [(NH3)5Co(OH2)]3+ [(NH3)5CoX]2+
zusammengesetzt aus komplexen Elementarreaktionen
Gesamtreaktion und Reaktionsgeschwindigkeit

ACIV-FS15-23
Faktoren, welche die Reaktionsgeschwindigkeit beeinflussen:
- Konzentrationen: wenigstens einer der Reaktanden wird die Reaktion beschleunigen
- Produkte können katalytisch wirken oder inhibierend
- Verunreinigungen können beschleunigend oder verlangsamend wirken
- Druck / Temperatur / Strahlung
- Lösungsmittel: Polarität, Viskosität, Donor-Akzeptor-Wirkungen, Salzeffekte, Puffer etc.
-Konzentrationsabhängigkeiten determinieren den Mechanismus,
wenn alles andere konstant gehalten wird
Gesamtreaktion und Reaktionsgeschwindigkeit

ACIV-FS15-24
Kinetik 1. Ordnung
- kann integriert werden
- HWZ unabhängig von [A0]
Graphische Darstellung ln[A]t vs. t linear
Steigung ist -k
Wie feststellen, dass Reaktion wirklich 1. Ordnung?
k[A]dt
dP
dt
dAA P
- lineare Regression muss genauen Wert geben
- [A]0 über breiten Bereich variieren k konstant
- Jeden Punkt [A]t auf [A]0 beziehen und k berechnen Mittelwert oder Trends?
t
0
[A]
[A]ln
t
1k Kinetik pseudo 1. Ordnung k1 kobs
1.4 Einfache Reaktionsschemen

ACIV-FS15-25
Im Geschwindigkeitsgesetz
ist [B]0 >> [A]0 d.h. [B](t) = [B]0 = konstant
v = kobs [A]
Graphische Darstellung von kobs vs [B]0 gibt lineare Beziehung mit k1 als Steigung
A + B P v = k1 [A] [B]
1. Ordnung mit kobs = k1 [B]0
Kinetik 2. Ordnung A + A P
kt[A]
1
[A]
1
0t
[A]t = [A]0 - k [A]0 · t [A]t
Graphische Darstellung
[A]t vs. t [A]0 [A]tergibt Steigung - k
Einfache Reaktionsschemen
d[A]
dt= -k[A]2
“lineare” Beziehung
y=mx+b

ACIV-FS15-26
Abhängigkeit:
A + B P
Im Geschwindigkeitsgesetz:
kann direkt integriert werden
1:1 Stöchiometriek[A][B]dt
d[A]
t
0
00t [A][A][B][B]
+ [A]t
dtk[A])[A](Δ
dA
0
tΔk[A]
[B]ln
[A]
[B]ln 0
0
0
t
t
Einfache Reaktionsschemen
Kinetik 2. Ordnung A + A P
t1/2 = 1
k·[A0]abhängig von der Anfangskonzentration!
allgemeine Reaktion:

ACIV-FS15-27
Falls die Bedingungen [B]0 = [A]0 sind, kann die Reaktion nicht mit diesem
Zusammenhang untersucht werden
dann:
Für allgemeine Stöchiometrien wird [A] durch a[A] und [B] durch b[B] ersetzt
0tkΔ
0
00t
[A]e[B]
[A]Δ[A]
0
2k[A]dt
d[A]
Einfache Reaktionsschemen

ACIV-FS15-28
Einfache Reaktionsschemen
Einige Zeitabhängigkeiten für eine Kinetik 2. Ordnung
0
0.2
0.4
0.6
0.8
1
1.2
0 2000 4000 6000 8000 10000 12000 14000 16000 18000
K = 0.01 M-1 s-1
k = 0.001 M-1 s-1
k = 0.0001 M-1 s-1
2nd ordre kinetics A + B → C
[A0] = [B0] = 1M

ACIV-FS15-29
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1
0 20000 40000 60000 80000 100000 120000 140000 160000 180000
k= 10-4 M-1 s-1
k= 10-5 M-1 s-1
k= 10-6 M-1 s-1
Einfache Reaktionsschemen
Einige Zeitabhängigkeiten für eine Kinetik 2. Ordnung

ACIV-FS15-30
kobs ist dann im einfachsten Fall k1 [B]0
für v = -k1 [A] [B] kann [B]0 >> [A]0 gewählt werden
Kinetik 2. Ordnung vs. Kinetik pseudo 1. Ordnung
0
obs
[B]
kk
Evaluation graphisch
Kurve geht durch 0-Punkt
Oft wird aber keine Linearität erhalten,
da der Mechanismus komplexer ist
oder
6 mögliche Abhängigkeiten
von B sind
k1 + k2[B] k1 + k2/[B] k1[B] + k2[B]2
k1[B]/(1 + k2[B]) k1[B]2/(1 + k2[B]) k1 + k2[B] + k3/[B]
Einfache Reaktionsschemen

ACIV-FS15-31
Man verfolgt die Reaktion mit UV/Vis Spektroskopie
Beispiel für eine Reaktion 2. Ordnung
einfacher Elektronentransferprozess
Fe3+ + Np3+ Fe2+ + Np4+
[Np3+]0 = 1.53 · 10-4 M , [Fe3+]0 = 2.24 · 10-4 M
Absorption für t = 0.351
Zeit/ s: 0 2.5 3.0 4.0 5.0 7.0 10.0 15.0 20.0
Absorption: 0.100 0.228 0.242 0.261 0.277 0.300 0.316 0.332 0.341
daraus kann k für v = -k [Np3+] [Fe3+] auf verschiedene Arten berechnet werden
Einfache Reaktionsschemen

ACIV-FS15-32
Reversible Reaktionen
Reversible Reaktionen A Pk+1
k-1
[P]k[A]kdt
dA11 , im Gleichgewicht 0
dt
dA
[A]0 + [P]0 = [A]e + [P]e = [A]t + [P]t
k+1 [A]e = k-1 [P]e1
1
e
e
k
kK
[A]
[P]
umgewandelt und integriert
[A]t = [A]e + ([A]0 - [A]e)(exp[-(k1 + k-1)t])
ln([A]t - [A]e) vs. t gibt Steigung k1 + k-1
Einfache Reaktionsschemen

ACIV-FS15-33
ke = k+1 + k-1 oder
k+1 + k-1 ist die beobachtete, scheinbare Geschwindigkeitskonstante ke
K1
kk,
K1
kk e
11e
1
[A]t fällt mit ke ab t½ = ln2/ke ke berechenbar
Wenn P in ein weiteres Ggw involviert,
dann ist t½= ln2/k1
respektive wenn k-1 << k+1
Einfache Reaktionsschemen

ACIV-FS15-34
Konsekutive Reaktionen PIA 21kk
[A]kdt
dA1 ][Ik
dt
dP[I],k[A]k
dt
dI221
nach [A] auflösen, in einsetzten und integrierendt
dI
t))kexp(t)k(exp(kk
[A]k[I] 21
12
01t
explizit lösbar, auch [P]t
wird im radioaktiven Zerfall, aber auch sehr oft bei chemischen Reaktionen gefunden
I kann ein echtes Zwischenprodukt sein oder ein kurzlebiger Übergangszustand
Einfache Reaktionsschemen

ACIV-FS15-35
)k(k
)/kln(kt 0
dt
dI
12
12max
[I]t wird durch ein Maximum laufen
Ableitung der Geschwindigkeitskonstanten k1 und k2 einer biexponentiellen Reaktion
entweder graphische Analyse oder nicht lineares least square fitting der Daten
Einfache Reaktionsschemen

ACIV-FS15-36
Konsekutiv Reaktionen mit einer reversiblen Elementarreaktion
A I Pk1 k2
k-1
Geschwindigkeitsgesetze: [I]k[A]kdt
d[A]11
[I]k[I]k[A]kdt
d[I]211
[I]kdt
d[P]2
)texp(
k)texp(
k[A]k[A] 3
3
232
2
22
32
01t
Innerhalb der gültigen Grenzen heisst dieses Prinzip: steady state approximation
Bei vielen Reaktionen ist I sehr reaktiv und reagiert schnell zum Produkt oder zum Edukt
kann explizit gelöst werden, macht aber für reale chemische Reaktionen wenig Sinn
Approximationen, chemisch sinnvoll
Einfache Reaktionsschemen

ACIV-FS15-37
physikalische Konsequenz: 0dt
dI oder k1[A] - k-1[I] - k2[I] = 0
mit im steady state21
1
kk
[A]k[I]*
man erhält dt
dP[A]
kk
kk
dt
dA
obsk
21
21
Konsequenz aus gilt streng natürlich nicht, da sonst auch0dt
dI 0
dt
dA
tk
0
21
1ss
sse[A]kk
k[I]
sehr klein, da k-1 + k2 >> k1
1.5. Steady state Approximation
[I]* kann nun in den Geschwindigkeitsgesetzen substituiert werden

ACIV-FS15-38
Beispiel: SN1 Reaktion wird auch in anorganischer Chemie häufig angetroffen, aber hier
als D (dissoziativ) Mechanismus bezeichnet
RX R+ + X-k1
k-1
R+ + Y- RYk2
steady state: 0]][Y[Rk]][X[Rk[RX]kdt
dR211
[Y]k[X]k
[RX]k][R
21
1ss
eingesetzt:][Yk][Xk
][RX][Ykk
dt
d[RY]
dt
d[RX]
21
21
Diese Gleichung erlaubt auch, für verschiedene Fälle k1, k-1, k2 zu unterscheiden
Steady state Approximation

ACIV-FS15-39
Der geschwindigkeitsbestimmende Schritt
Gewähltes Schema für steady state approximation
A I Pk1 k2
k-1
21
21obs
kk
kkk
falls k2 >> k-1 kobs = k1
es folgt: PIA 1k
Wenn k2 langsam ist im Vergleich zu k1, dann ist steady state nicht erfüllt und das
Schema muss als konsekutiv mit irreversiblen Schritten behandelt werden
schnell
k
1ist ein Mass für die „Lebenszeit“ der Reaktion
1. Reaktion (k1 + k-1)-1 , 2. Reaktion k2
-1
Damit wird k1 zum geschwindigkeitsbestimmenden Schritt
Steady state Approximation

ACIV-FS15-40
2
1
21
21
21obs kK
k
kk
kk
kkk
Beispiel:
Das allgemeine Geschwindigkeitsgesetz ist
2. Fall k-1 >> k2
][Fek][Fek
][TI][Fekk
dt
]d[TI2
2
3
1
322
21
Fe2+ + TI3+ Fe3+ + TI2+k1
k-1
Fe2+ + TI2+ Fe3+ + TI+k2
Jetzt wird k2 geschwindigkeitsbestimmend, da sich k1 schnell einstellt. Wir sprechen von
vorgelagertem Gleichgewicht
Netto: 2 Fe2+ + TI3+ 2 Fe3+ + TI+
Steady state Approximation

ACIV-FS15-41
falls k-1 [Fe3+] << k2 [Fe2+] dann
falls k-1 [Fe3+] >> k2 [Fe2+] dann
Darstellung als Reaktionsprofil
14
2
10
2
8
11 s10k;10k;10k1;(a)k
182
82
1011 s10k;10k;10k1;(b)k
]][TI[Fekdt
]d[TI 321
][Fe
]]2[TI[Fe2
k1
Kdt
]d[TI3
32
Reaktionsprofil für zwei Typen von Geschwindigkeitskonstanten
Steady state Approximation
A I Pk1 k2
k-1 k-2

ACIV-FS15-42
Man definiert einen „excess rate step E“ für jeden Schritt
A I Pk1 k2
k-1
21
11
21
2111
kk
[A]kk
kk
[A]kk[A]kE
Welches ist nun der geschwindigkeitsbestimmende Schritt ?
Es muss nicht a priori derjenige sein,
welcher den energetisch höchst liegenden Übergangszustand hat
Es wird ein „Kontrollfaktor“ eingeführt, welcher für jede Elementarreaktion betrachtet wird
Falls ein Schritt einen höheren Faktor hat als andere geschwindigkeitsbestimmend
Steady state Approximation
21
2-22
kk
[P]kkE
und

ACIV-FS15-43
Der Schritt
mit der kleinsten Differenz zwischen Vorwärtsrate und Gesamtgeschwindigkeit wird
geschwindigkeitsbestimmend da er keinen Überschuss produziert
Beispiel 2 vf = 1·[A]0 und E1 = 104· [A]0
A I P104 Schritt 1: vf + E1 = 104 · [A]0
Schritt -1: vr + E1 = 104 · [A]0Schritt 2: vf + E2 = [A]0 (da k-2 = 0, E2 = 0)10-6
Steady state Approximation
102
da Schritt 2 am nächsten bei vf ist, wird er” rate controlling”
Rate Constants, s-1
k1 k-1 k2 Case RCS
1 10-2 102 k2 >>k1 >>k-1 1
104 106 102 k-1 >>k1 >>k2 2
102 106 104 k-1 >>k2 >>k1 2
1 102 104 k2 >>k-1 >>k1 1
102 1 10-2 k1 >>k-1 >>k2 2
1 10-4 10-2 k1 >>k2 >>k-1 2
1 102 102 k2 = k-1 >>k1 None
2 1 1 k1 > k-1 = k2 None

ACIV-FS15-44
Da die beteiligten Komplexe A und P 18 e- Spezies sind, ist die Annahme, dass I in
kleinen konstanten Konzentrationen auftritt, gerechtfertigt
Beispiel für Reaktion mit steady state Bedingung:
Entsprechend wirdCN][CHk[THF]k
CN][CHkkk
321
321obs
Re
OC CO
Re
OC COCO
Re
OC THFCO
Re
OC NCCH3CO
h 1
k1
k 2k
A I P
Photolytische Abspaltung von CO Liganden in Gegenwart von koord. Lösungsmitteln
Steady state Approximation
see A.A. Bengali et al. Organometallics, 2003, 22, 5436

ACIV-FS15-45
[CH3CN] und [THF] sind konstant und >> [Re]
Produktebildung kann spektroskopisch verfolgt werden
CN]a)[CH-(k 12.3
CN][CHkkk
3
*
3
*
1obs
Entsprechend wird die Gleichung modifiziert
[ACCN][THF][THF] 0 CN][CH
[THF]a
3
und
Steady state Approximation

ACIV-FS15-46
gefundene Konstanten k1 [sec-1]
Aus dem graphischen Zusammenhang kobs vs. [CH3CN] kann nun k1 und k*
mit der Methode des kleinsten Quadrates gefunden werden
Cp*[Re]: 9.24 0.5
Tp*[Re]: 2.85 0.13
Tp[Re]: 0.29 0.01
H = 24 0.9 kJ/mol
S = 9.2 2.7 e.n.
Interpretation: kobs steigt mit steigender [ACCN], erreicht aber einen konstanten
Wert für grosses [ACCN]
dann wird k1 geschwindigkeitsbestimmend
Steady state Approximation

ACIV-FS15-47
Neben der steady state Approximation gibt es weitere Annäherungen
Diese hängen von der relativen Grösse der verschiedenen k‘s untereinander ab
A I Pk1 k2
k-1
dann ist für [k+1 + k-1] >> k2t
1
1t [A]
k
kI
wichtig: [I] muss nicht sehr klein sein und 0dt
dI
1.6 Das vorgelagerte Gleichgewicht
welches sich schnell einstellt und während der ganzen Reaktion erhalten bleibt.
falls k1 >> k2 kann erster Schritt kann als Gleichgewicht betrachtet werden,

ACIV-FS15-48
Abhängigkeiten: [I]kdt
d[P]
dt
d[I]
dt
d[A]2
ergibt:tk
11
01t
peekk
[A]k[I]
mit kpe =
11
21pe
kk
kkk
umgewandelt ergibt sich: tk
11
01- peekk
[A]k[A]
tk
0tpee1 [A][P]
K)(1
kK)k(k 2
obspe
Unter Berücksichtigung der Gleichgewichtskonstanten kann auch geschrieben werden
Schnelles vorgelagertes Gleichgewicht wird häufig bei Ligandsubstitutionen gefunden
Das vorgelagerte Gleichgewicht

ACIV-FS15-49
1.7 Katalyse und Enzym katalysierte Reaktion
der Katalysator zirkuliert zwischen inaktiver und aktivierter Form,
er kann aber auch mit einem Produkt in WW treten
- Wenn [S] >> [Kat] ist die Reaktion 0. Ordnung, da der Katalysator in seiner
Gesamtheit aktiv ist (Sättigung)
- Ein Katalysator erniedrigt nicht nur Ea
er bewirkt vor allem einen unterschiedlichen Reaktionsweg
der Katalysator existiert in wenigstens zwei Formen …
… als solcher und aktiviert zusammen mit dem Substrat
-Ein (guter) Katalysator ist in viel geringeren Konzentrationen als das Substrat vorhanden

ACIV-FS15-50
Bei kleinen Konzentrationen ist die Reaktion in Bezug auf [S] 1. Ordnung
Dieser Zusammenhang wird als Michaelis-Menten* Kinetik beschrieben
[S]K
[S]Vv
m
max
M-M Gleichung
Km: [S] bei welcher v =vmax/2 wird, d.h. je kleiner Km umso effizienter der Katalysator
Km ist M-M Konstante [dim=M]
Katalyse und Enzym katalysierte Reaktion
see K.A. Johnson et al. Biochemistry, 2011, 50, 8264

ACIV-FS15-51
Mathematische Umwandlung ergibt:
Wobei vi (Anfangsgeschwindigkeit) als Funktion von [S]0 bestimmt wird.
Aus dem linearisierten Plot lässt sich Vmax resp. Km herauslesen.
Wie lassen sich Vmax etc. auf k‘s umrechnen ?
Ein typisches Reaktionsschema für katalysierte Reaktion wurde schon besprochen
Katalyse und Enzym katalysierte Reaktion
0max
m
maxi [S]
1
V
K
V
1
v
1

ACIV-FS15-52
Die Anfangsgeschwindigkeit ist
E + S E•S Pk1 k2
k-1
S][Ekdt
dPv 2
i
i
[E][S]k[ES]kk[ES]0dt
d[ES]011
21
01
kk
[E][S]k[ES]
im steady state
mit [E] = [E]0 – [ES] folgt
01
21
00ss
[S]k
kk
[S][E]S][E
01
21
002
i
i
[S]k
kk
[S][E]k
dt
dPv
Es ist chemisch sinnvoll, die steady state Approximation anzuwenden
entsprechend für die Anfangsgeschwindigkeit:
Katalyse und Enzym katalysierte Reaktion

ACIV-FS15-53
dass Vmax = k2[E]0
Der Vergleich mit der M-M Gleichung zeigt,
und1
21m
k
kkK
oft wird k2 als kcat bezeichnet
Das System gleicht in gewisser Weise demjenigen stöchiometrischer Systeme,
ausser dass da der Katalysator nicht verbraucht wird
Aus der Ermittlung von Vmax und Km lässt sich direkt k2
resp. die Vorgleichgewichtskonstante herauslesen
Katalyse und Enzym katalysierte Reaktion

ACIV-FS15-54
Beispiel:
folgende vi wurden gemessen
O CH3
O
+ H2OAC
OH +
CH3HO
O
[PhOAc], 10-4 M: 22.5 16.3 12.6 9.73 8.45 7.18 6.21 5.55
vi, ·10-7 l·mol-1s-1: 7.24 6.35 5.32 4.61 4.53 4.02 3.38 3.26
Die Hydrolyse von Phenylacetat wird durch Acetyl-cholinesterase katalysiert
Wie gross sind die M-M Konstanten ?
Katalyse und Enzym katalysierte Reaktion

ACIV-FS15-55
Gewisse Substanzen binden an den Katalysator und inhibieren ihn
Eine solche Inhibition unterliegt einem Gleichgewicht
E + I EI kI
Aus der erweiterten Bilanz: [E] = [E]0 – [ES] – [EI]
ergibt sich
0
I
m
002
[S]K
[I]1K
[E][S]k
iν
1.8 Kompetitive Inhibitoren
Wird in I die Struktur systematisch variiert, wird die Spezifität des Katalysators bestimmt
Aus der Variation von [I] lässt sich nun Ki herausholen (wie?)
vi = initial rate

ACIV-FS15-56
Der Weg vom Geschwindigkeitsgesetz zum Mechanismus ist nicht Routine und
umfasst mehrere Schritte (s. Folie 18)
1.Aus den experimentellen Messungen werden die Konzentrationsabhängigkeiten
hergeleitet
2.Aufstellen eines Reaktionsschema‘s, welches diesen Abhängigkeiten genügt
3. Bei mehreren Möglichkeiten, Experimente, welche Möglichkeiten ausschließen
TI3+ + Hg22+ TI+ + 2Hg2+
][Hg
]][Hg[TIv
2
2
2
3
[TI]3+ + [Hg2
2+] - [Hg2+] oder [TIHg3+]
2. Reaktionsmechanismus aus Geschwindigkeitsgesetzen
Die Konzentrationsabhängigkeiten zeigen Übergangszustand (und Ladung)

ACIV-FS15-57
Im kinetischen Gesetz kommt vor
2[MnIII(Mb)] + [S2O4]2- 2[MnII(Mb)] + 2SO2
242 ]O[S
2
1
Damit ist der Übergangszustand [MnII(Mb)(SO2)]
Da nur „die Hälfte von [S2O4]2- erscheint,
wird der v-bestimmende Schritt die Reaktion von [SO2]•- mit [MnII(Mb)] sein
- positive Terme: Anzahl parallel laufender Vorwärtsreaktionen,
- negative Terme: bezeichnen Rückreaktionen
3I- + H2O2 + 2H+ I3- + 2H2O
v = k1[I-][H2O2] + k2[I
-][H2O2][H+]
zwei Wege mit [(H2O2)(I-)] und [(H3O2
+)(I-)]
Reaktionsmechanismus aus Geschwindigkeitsgesetzen

ACIV-FS15-58
Beispiel einer verzweigten Reaktion
Das kinetische Gesetz zeigt, was im v-bestimmenden Schritt passiert
Die SN2 Reaktion beinhaltet eine Rückreaktion
RX + Y- RY + X-k1
k-1
v = k1[RX][Y-] - k-1[RY][X-]
und damit entsteht ein negativer Term
RX R+ + X-
k-1
k1RY YR 2
k
H ROH OHR 3k
2321
321
k][Yk][Xk
k][Yk[RX]k
dt
d[RX]
Reaktionsmechanismus aus Geschwindigkeitsgesetzen

ACIV-FS15-59
Beispiel:
]][Cl][Fe[Crk][H
]][Fe[Crkv 32
2
32
1
Der 2. Term: Cl- vermittelte Reaktion.
Der Mechanismus dieses Weges ist aber nicht eindeutig, weil:
Die Reaktion von Cr2+ mit Fe3+ in salzsaurer Lösung zeigt das Geschwindigkeitsgesetz
23 FeClClFe
2222 CrClFek
CrFeCl 3
KFeCl CrClClCr2
KCrCl
223 CrClFeFeCrCl 4k
im ersten Fall ist k3 = k2 / KFeCl im zweiten Fall ist k4 = k2 / KCrCl
Reaktionsmechanismus aus Geschwindigkeitsgesetzen
Der 1. Term: direkte Reaktion zwischen Cr2+ und Fe3+, umgekehrt proportional zum pH

ACIV-FS15-60
Es wird sehr oft festgestellt, dass Reaktionen pH-abhängig sind,
obwohl manchmal [H+] nicht explizit im v-Gesetz auftaucht
Dies ist vor allem dann der Fall, wenn nur die protonierte (oder deprotonierte)
Form aktiv ist und das Produkt bildet
Ein einfaches Schema: [AH+] A + H+Ka
[AH+] Pk1
Der Anteil aktiver Spezies [HA]+ ist durch Ka definiert
][HK
][H
[A]][AH
][AHf
a
AH
2.1 Abhängigkeiten von [H+]
Verteilungskoeffizienten
Da pH abhängige Reaktionen in Puffern gemacht werden,
bleibt fHA im Laufe der Reaktion konstant !

ACIV-FS15-61
Entsprechend ist die deprotonierte Form:][HK
K
[A]][AH
[A]f
a
aA
Das Geschwindigkeitsgesetz ist:
Eingesetzt und umgewandelt ergibt sich für kobs][HK
][Hkk
a
1obs
Reaktion pseudo-erster Ordnung wenn wir z. Bsp [A] analytisch verfolgen können.
Abhängigkeiten von [H+]
d[P]
dt= k1·[HA]T
*·fHA= k1[HA+]
[H+] = konst.
daraus lässt sich k1 und Ka experimentell bestimmen !!
* [A]T = totale Konzentration von Teilchen mit A (also auch HA) zur Zeit t

ACIV-FS15-62
Dies ergibt pH-Abhängigkeiten der Form
Die Situation ist leicht anders, wenn die konjugierte Base das aktive Teilchen ist
Frage: Wie kann aus einer solchen Abhängigkeit
Ka bestimmt werden ?
[AH+] H+ + AKa
A + H+ Pk2
Dann wird ][HK
][HKkk
a
a2obs
Abhängigkeiten von [H+]

ACIV-FS15-63
Wenn Säure und konjugierte Base reaktive Teilchen sind:
Dieses Verhalten wird häufig bei Enzym Kinetik gefunden
z. Bsp. Zersetzung von Perbenzoesäure
2 C6H5CO3H 2 C6H5CO2H + O2
[C6H5CO3]- + C6H5CO3H Pk1
2a
2a12
])[H(K
][C][HKk
dt
]d[O
Mit [C] = [HA] + [A] ergibt sich für eine solche Reaktion
Die Reaktion ist 2. Ordnung; v-Gesetz suggeriert die bimolekulare Reaktion
der Säure mit der konjugierten Base (Herleitung finden)
Abhängigkeiten von [H+]
entsteht eine pH-Abhängigkeit mit Maximum

ACIV-FS15-64
A + L ALKL
resp.
2.2 Komplexbildung
Neben pH-Gleichgewichten gibt es verwandte Gleichgewichte
Dissoziations-/Assoziationsreaktionen, welche ähnlich behandelt werden können
Komplexierung – Dekomplexierung
Ionenpaarbildung,
chargetransfer Komplexbildung etc.
Komplexbildung: Wie bei Säure-Base Gleichgewichten
Praxis: wie bei pH Abhängigkeit wird eine der Konzentrationen (hier L) konstant gehalten
Verteilungskoeffizient ist damit in der Reaktion konstant!
[A]
[A]T
1
1+K·[L]fA = = K·[L]
1+K·[L]fAL =

ACIV-FS15-65
Ein typisches Reaktionsschema für Substitutionen ist folgendes
A + L ALK
AB
kA kAL
B B
Eine Substitution kann direkt erfolgen mit kA
oder über ein gekoppeltes Teilchen AL mit kAL (L z.Bsp. Lösungsmittel)
Komplexbildung
[L]
[L]T
1
1+K·[A]fL = =
K·[A]
1+K·[A]fAL =
[AL]
[L]T=
d[AB]
d[t]= ka·[A]·[B] + kAL[AL]·[B]
[A] und [AL] kann mit fA und fAL ausgedrückt werden (L konstant und K bekannt)
[B][A]K[L]1
K[L]kkT
ALA

ACIV-FS15-66
Fälle: 1 >> K[L] dann [B]K[L])[A]k(kv TALA
[B][A]K[L]1
K[L]kv T
AL
dann
Fall 3: Wenn nur A reaktiv ist oder AL totes Ende
dann [B][A]K[L]1
kv T
A
(AL sehr klein)
Fall 2: ausgeglicheneres Gleichgewicht, aber nur AL reaktiv
Komplexbildung

ACIV-FS15-67
Beispiel:
- die Reaktion ist pseudo 1. Ordnung bei [SO4]2- Überschuss
- die Reaktion erreicht ab einer gewissen [SO4]2- ein Plateau
Geschwindigkeitskonstant:][SOk'1
]k[SOk
2
4
2
4obs
Mechanismen: dissoziativ SN1
[Co(NH3)5H2O]3+ {Co(NH3)5}3+ + H2O
k1
k-1
K oft separat bestimmbar, vereinfacht oft die Behandlung des gesamten Systems
Komplexbildung
[Co(NH3) 5(OH2)]3+ + [SO4]
2- [Co(NH3) 5(SO4)]+ + H2O
{Co(NH3)5}3+ + [SO4]
2- [Co(NH3) 5(SO4)]+

ACIV-FS15-68
k wird dann und1
21
k
kk
1
2
k
kk'
und das Plateau (maximales v) wird für k1 erreicht
Es gibt aber noch eine weitere mechanistische Möglichkeit
[Co(NH3) 5(H2O)]3+ + SO42- {Co(NH3)5(H2O)}{ SO4}
KIP
Dann wird die Geschwindigkeitskonstante ][SOK1
][SOKkk
2
4IP
2
4IP3obs
Entspricht einer Vorgleichgewichtssituation
Ein solcher Mechanismus wir auch als D (Langford Gray) bezeichnet
Komplexbildung
{Co(NH3)5(H2O)}{ SO4} [Co(NH3) 5(SO4)]+
k3

ACIV-FS15-69
Fall 1 wäre vom eintretenden Liganden unabhängig (vmax), Fall 2 nicht
Man findet
Welcher Mechanismus könnte dieses Gesetz erklären?
[L]k'1
k[A]
dt
dB
Ob das Plateau KIP oder k1 ist, lässt sich manchmal aus den Größen abschätzen
Komplexbildung
Beispiel: folgende Isomerisierungsreaktion wird beobachtet

ACIV-FS15-70
/RTEaeAk
A ist der vor-exponentielle oder Frequenzfaktor, Ea die Aktivierungsenergie
/RTH/RSB eeh
Tkk
Übergangszustand Theorie:
= Übergangsfaktor, üblicherweise = 1 kB: Boltzmann h: Planck
2.3 Theorie des Übergangszustandes
Reaktionsgeschwindigkeiten nehmen (fast) immer mit steigender Temperatur zu
Der Zusammenhang k vs. Ea kann nach der Arrheniusgleichung beschrieben werden
k bezieht sich auf die Gesamtreaktion resp. den geschwindigkeitsbestimmenden Schritt
A und Ea werden als temperaturunabhängig betrachtet, was meistens recht gut stimmt

ACIV-FS15-71
Datenermittlung: bestimmen von kobs (T)
RT
ElnAlnk a plot lnk vs. 1/T liefert A und Ea
Entsprechend:RT
ΔH
R
S
h
kln
T
kln B
ln(k/T) vs. T-1 liefert H (Steigung)
Der y-Achsenabschnitt S unter Berücksichtigung von ln(kB/h) = 23.76
Verbinden von Übergangszustand und Arrhenius
RTEH a
2.6 kJ/mol bei RT
und 13.2)4.58(logAS
Aus den Aktivierungsparametern lassen sich Rückschlüsse auf den Mechanismus ziehen
Theorie des Übergangszustandes

ACIV-FS15-72
Die meisten Reaktionen sind nicht einfache Elementarreaktionen
Ein übliches Schema aus den pH-Abhängigkeiten
AH+ H+ + AKa
A + B Pk2
][H
][B][AHKkv a2
Die zusammengesetzte Geschwindigkeitskonstante ist k2·KA
Anwendung von Übergangszustand und van‘t Hoff
RT
Hexp
R
Sexp
RT
Hexp
R
Sexp
h
Tkk
θa
θa22B
RT
HHexp
R
SSexp
h
Tkk
θa2
θa2B
2.4 Zusammengesetzte Reaktionen

ACIV-FS15-73
Das Temperaturprofil kann hier linearisiert werden.
Man bekommt aber nicht H sondern -H - H
auch Fall, wo Reaktionsgeschwindigkeit mit steigender Temperatur abnimmt
steady state System: A + B Ik3
k-3
I Pk4
k-3 >> k4 dann: [A][B]k
kkv
3
43
Das Vorgleichgewicht muss bekannt sein, um die Aktivierungsparameter zu bestimmen
Wie müssen die Parameter sein,
damit bei der Gesamtreaktion eine scheinbar negative Aktivierungsenergie auftritt?
Zusammengesetzte Reaktionen

ACIV-FS15-74
RT
HHHexp
R
SSSexp
h
Tkk 433433B
Parallelreaktionen: A
P1
P2
k1
k2
)[A]k(kk[A]dt
d[A]21
RT
Hexp
R
Sexp
RT
Hexp
R
Sexp
h
Tkk 2211B
Wenn dieses Schema auf die Theorie des Übergangszustandes angewendet wird:
Es entsteht ebenfalls ein lineares Temperaturprofil,
dessen Parameter sich aus den Faktoren der einzelnen Reaktionen zusammensetzen
Zusammengesetzte Reaktionen

ACIV-FS15-75
Das Temperaturprofil dieser Reaktion ist nicht linear
A + B Ik1
I Pk2
k-1
[A][B]kk
kk
dt
dP
21
21
Es kann aber in zwei lineare Profile zerlegt werden, welche dann k1 und k2 liefern
wie vorher, aber Rückreaktion muss berücksichtigt werdenkomplexerer Fall:
Nicht lineares Temperaturprofil
Wie sieht die Form für den Übergangszustand aus ?
Zusammengesetzte Reaktionen

ACIV-FS15-76
Aus der thermodynamischen Gleichung VdPdTSdG
folgt: PRT
Vlnklnk 0
Wobei angenommen wird, dass V unabhängig vom Druck ist
lnk hängt direkt linear vom Druck ab
Aktivierungsvolumen
Dieser Zusammenhang ist nun ein Druckprofil und V lässt sich als Steigung berechnen
(siehe auch später)

ACIV-FS15-77
Die Reaktionsmechanismen für die Hin- und die Rückreaktion sind identisch,
also Spiegelbilder und folgen dem gleichen Reaktionsprofil
OHFeNCSO)(HO)Fe(HNCS 22
52362
ist pH-abhängig und kann mit dem Schema
A I I Pk1
k-1
k2
k-2
2.5 Mikroskopische Reversibilität
Das Prinzip der mikroskopischen Reversibilität besagt:
Dieses Prinzip gilt auch, wenn mehrere Pfade oder Gleichgewichte involviert sind
Wäre das Prinzip nicht erfüllt, entstehen Widersprüche z. Bsp. mit der Thermodynamik
Beispiel: Die Reaktionsgeschwindigkeit für

ACIV-FS15-78
][FeNCS][H
kk]][NCS[Fe
][H
kk
dt
]d[FeNCS 221
321
2
und dem Geschwindigkeitsgesetz
beschrieben werden
Im Gleichgewicht wird: 0dt
]d[FeNCS2
und
][H
kk
][H
kk
][NCS]O)[Fe(H
]FeNCSO)[(HK
21
21
ee362
e2
52
Mikroskopische Reversibilität

ACIV-FS15-79
e2
1ee3
1 ][FeNCSk][NCS][Fek
und
e
e2
2
e
ee3
2][H
][FeNCSk
][H
][NCS][Fek
daraus folgt
2
2
1
1
k
k
k
kK
Ohne Berücksichtigung der Teilschritte wäre K also pH-abhängig,
Widerspruch zur Reaktionsgleichung
Das Problem wird gelöst,
wenn die mikroskopische Reversibilität für alle Teilgleichgewichte berücksichtigt wird
Mikroskopische Reversibilität

ACIV-FS15-80
Die Frequenz ist demnach über das Fick‘sche Gesetz der Diffusion festgelegt
Ohne Herleitung erhält man aus diesem Gesetz in Lösung
ABABdc DrNπ4000k
daraus ergibt sich kdc 6109 M-1 sec-1
2.6 Diffusionskontrollierte Reaktionen
Wenn die Geschwindigkeit einer Reaktion durch
die Zusammentreff Wahrscheinlichkeit definiert ist sprechen wir von
diffusionskontrollierter Reaktion
wobei rAB der Reaktionsradius, DAB = DA + DB die Diffusionskonstante ist,
welche typischerweise 10-9 m2 sec-1 beträgt
und von der Viskosität des Lösungsmittels abhängt

ACIV-FS15-81
kdc wenig von Reaktionspartnern abhängig,
A
BA
r6
TKD mit = Viskosität
ein grosses Molekül diffundiert langsamer, hat aber einen grösseren Reaktionsquerschnitt
Für andere Lösungsmittel:Diffusionsfaktoren nach Stokes-Einstein involvieren
n-Pentane 2.15 3.1·1010
Diethyl ether 2.22 3.0·1010
Acetone 3.16 2.1·1010
Benzene 6.03 1.1·1010
Water 8.98 7.4·109
Acetic acid 11.6 5.7·109
Benzonitrile 14.5 4.6·109
Ethylene glycol 136 4.9·108
Cyclohexanol 410 1.6·108
Glycerol 9450 7.0·106
Solvent /10-4 kg m-1 s-1 kdc/L mol-1 s-1
3
TR0008kdc
unter der Annahme, dass vA vB
Aus kdc: Aktivierungsenergien berechnen Ea 4 - 20 kJ/mol
Diffusionskontrollierte Reaktionen

ACIV-FS15-82
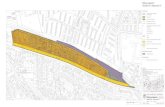
12 ps
1.0 s
10 s
10.0 ns
2.1 ns
39.8 ns
1900 1950 2000 2050Wavenumbers/cm
-1
Abso
rban
ce
Ab
sorb
ance C
hang
e
1.0 mOD
a
b

ACIV-FS15-83

ACIV-FS15-84
2m
m
H
D
DR
HR
2.7 Kinetischer Isotopeneffekt
Der Einsatz von Isotopen liefert oft wichtige Hinweise für einen postulierten Mechanismus
Wenn die Reaktionsgeschwindigkeit vom Isotop abhängt,
ist diese Bindung im Mechanismus involviert
Meistens wird nur H/D betrachtet, da bei schwereren Elementen
der Effekt gering und nur schwer beobachtbar ist
Aus dem harmonischen Oszillator
und der Annahme, dass die Kraft-
konstanten R-H und R-D gleich sind, folgt:

ACIV-FS15-85
Arrhenius:
2RT
)N(hexp
k
k DRHR
D
H
und für den Fall R = C folgt kH/kD = 7.8
entsprechend:
C-H 2900 7.8
O-H 3300 10.3
N-H 3100 8.9
S-H 2600 6.3
Bond H/cm-1 kH/kD
Kinetischer Isotopeneffekt
Differenz der Aktivierungsenergien ist gleich der Differenz im Grundzustand, da
im Übergangszustand die R-H(D) Bindung gebrochen
H0
D0
Da
Ha EEEE

ACIV-FS15-86
NO2 + H+NO2+
+k
H NO2
und nichtk
NO2
NO2+
+ H+
H
Beispiel: Nitrierung von C6H6 zeigt keinen Isotopeneffekt
Kinetischer Isotopeneffekt

ACIV-FS15-87
Daraus können Reaktivitäten systematisiert werden
2.8 Nicht-kinetische Methoden zur Bestimmung von Mechanismen
Bis jetzt: Aspekte, welche direkt aus den kinetischen Gesetzen resultieren
Interaktion Thermodynamik - Kinetik
Diese Beziehung wird als Linear Free Energy Relationship LFER bezeichnet
G Werte werden mit der Natur von Substituenten oder Liganden korreliert
Beispiel folgende Ligandsubstitution

ACIV-FS15-88
oder logk1 = logK + logk-11
1
k
kK
(1) X- = F-
(2) X- = H2PO4-
(3) X- = Cl-
(4) X- = Br-
(5) X- = I-
(6) X- = NO3-
Nicht-kinetische Methoden zur Bestimmung von Mechanismen
Wenn im Übergangszustand Co fünffach koordiniert ist, wird wegen dem
Prinzip der mikroskopischen Reversibilität k-1 konstant sein
Daher muss eine LFER zwischen logk1 und logK als Funktion von X vorhanden sein

ACIV-FS15-89
Umgekehrt, wenn ein Übergangszustand mit siebenfacher Koordination im
Übergangszustand auftritt, muss logk-1 vs. logK eine lineare Kurve mit Steigung 1 geben
Eine der ältesten LFER aus der organischen Chemie ist die Hammett Beziehung
Sie korreliert die Reaktivität von meta- und parasubstituierten Aromaten
mit einem gemeinsamen Substrat
Nicht-kinetische Methoden zur Bestimmung von Mechanismen

ACIV-FS15-90
The Monsanto Acetic Acid Process
The synthesis of acetic acid from methanol is probably the most important
industrial process in homogenous catalysis
worldwide requirements are about 5.5 106 t/a
Monsanto process invented 1966, before
oxidation of ethanol
oxidation of acetaldehyde
naphta oxidation
Carbonylation of methanol (Co-catalyst)
Carbonylation of methanol (Rh-catalyst)
H3COH + CO H3CCOOH[cat]

ACIV-FS15-91
Naphta oxidation BP 65-70 185 48
MeOH / CO (Co cat) 90 230 600
MeOH / CO (Rh cat) 99 150-200 30-60
MeOH / MeOAc carbonylation (Rh cat) high 150-200 30-50
selectivity T/°C p/atm
Comparison of the processes
The catalytic cycle looks as follows
6 (!) reactions are interlinked to form one closed working catalytic system
RhI CO
I CO
1a
RhI CO
I CO
Me
I
2a
RhI I
I CO
COMe
3a
RhOC I
I CO
COMe
I4a
+ CH3-I
+ CO
- CH3COI
H2O
The Monsanto Acetic Acid Process

ACIV-FS15-92
Many studies focused on the rds of the cycle, namely
[RhI2(CO)2]- + H3C-I {RhI3(CH3)(CO)2}
-
polar solvents and addition of I- accelerate the reaction
{RhI3(CH3)(CO)2}- (2a) difficult to detect spectroscopically
The next step, CO insertion, is fast
{RhI3(CH3)(CO)2}- [RhI3(CO-CH3)]
-
1a 2a
3a2a
very careful analysis of the i.r. spectra
2a and 3a become „visible“
The Monsanto Acetic Acid Process

ACIV-FS15-93
RhI CO
I CO
Me
I
2a
: increases and decreases with 1a
1H and 13C NMR in deep cold solution of CH3-I confirm the finding from i.r.
i.r. pattern discloses a fac,cis-dicarbonyl structure
The detection of 2a allows for determination of the individual steps
The Monsanto Acetic Acid Process

ACIV-FS15-94
[Rh(CO)2I2]- + MeI
k1
k-1
[MeRh(CO)2I3]k2
k-2
[(MeCO)Rh(CO)I3
1a 2a 3a
rate constant:
ratio of concentrations:
[1a]
[2a]can be estimated from i.r. intensities which allows for the determination of k2
RhI I
I CO
COMe
3a
can be isolated RhI I
I CO
COMe
3a
heating in the presence of exc. H3C-I
allows for the determination of k-2
label exchanges between COCH3 and CO
The Monsanto Acetic Acid Process

ACIV-FS15-95
from these experiments, a complete set of data could be deduced
The Monsanto Acetic Acid Process

ACIV-FS15-96
RhI CO
I CO
1a
RhI I
I CO
COMe
3a
RhOC I
I CO
COMe
4a I
what about the remaining processes leading to acetic acid ?
+ CO red. elim.
- H3C-COI
3a is immediatly trapped by CO
4a eliminates H3C-COI rather slowely (t1/2 = 12h at r.t.
difficulty to measure accurate kinetics (due to traces of water)
[Rh(CO)2I2]- + 2HI [Rh(CO)2I4]
- + H2
RhOC I
I CO
COMe
I
4a
RhI CO
I CO
1a MeC
NR1R2
O
RhI CO
I CO
1a
+Me
CI
O
+direct attack
red. elim.amine attack
The Monsanto Acetic Acid Process

ACIV-FS15-97
conversion of other alkyl-iodides to acids
CO
RhI I
I CO
RhI CO
I COI
H
RhI
I COI
RhI CO
I COI
CO
RhI I
I CO
H
RhI
I COI
RhI CO
I COI
CO
RhI I
I CO
acid acid
acid
other alkenes can be used by substituting ethen
isomerization of alkenes or conversion to acids
further reactions
RhI CO
I CO
1a
HI / C2H4
The Monsanto Acetic Acid Process