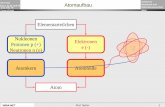
02 Struktur Elektronik Atom
-
Upload
agung-ace-chen -
Category
Documents
-
view
549 -
download
48
Transcript of 02 Struktur Elektronik Atom
Struktur Elektronik AtomReview
Spektrum Emisi Kontinu
Spektrum Emisi Garis (diskontinu)
Spektrum Emisi Hidrogen
Persamaan Gelombang Schrdinger
= fungsi gelombang elektron E = energi total V = energi potensial
Bilangan Kuantum1.
2.
3.
4.
n, bilangan kuantum utama bilangan positif dari 1 s.d. l, bilangan kuantum momentum sudut, bilangan dari n-1 s.d. 0 ml, bilangan kuantum magnetik, bilangan dari -l, (-l + 1),,0,,(+l 1), +l ms, bilangan kuantum spin, bilangan + dan -
Set bilangan kuantum yang mungkin untuk n=1 dan n=2
Hubungan antara bilangan momentum sudut l dan arah orbital
Harga l0 1
Orbitals p
23
df
Set bilangan kuantum yang mungkin untuk n=3
Hubungan antara bilangan momentum sudut l dan jumlah orbital
Harga l
Jumlah Orbital
0 1 2 3
1 3 5 7
Bentuk-bentuk Orbital Atom1. Orbital S
Fungsi Radial Inti untuk Elektron dalam Orbital 1s, 2s, & 3s Atom Hidrogen
2. Orbital p
Fungsi Radial Inti untuk Elektron dalam Orbital 2p & 3p
Fungsi Distribusi Radial Inti untuk Elektron dalam Orbital 2s VS 2p
3. Orbital d
4. Orbital f Orbital f lebih rumit daripada orbital d Terdapat 7 orbital f : 4 di antaranya memiliki 8 lobe 3 sisanya terlihat seperti orbital dz2, namun memiliki 2 cincin berbentuk donat Orbital ini jarang terlibat dalam ikatan
Bilangan Kuantum Atom Multielektron
Bilangan kuantum masing-masing elektron saling berinteraksi. Momentum sudut orbital dan spin elektron bergabung membentuk bilangan kuantum baru, yaitu L, S, dan J. Bilangan kuantum ini dituliskan sebagai term symbol, yang menggambarkan energi dan simetri suatu atom atau ion dan menentukan transisi yang mungkin antara tingkat-tingkat energi yang berbeda.
L = jumlah bilangan kuantum momentum sudut orbital S = jumlah bilangan kuantum spin J = jumlah bilangan kuantum momentum sudut Hasil interaksi antara momentum sudut orbital (ml) dan momentum sudut spin (ms) disebut dengan gandengan RussellSaunders atau gandengan LS.
GANDENGAN RUSSELL-SAUNDERS (RS)
a. Interaksi Elektrostatik Dalam Atom Logam bebas : Tiap harga gandengan Russell-Saunders mempunyai ciri : 1. Resultan momen sudut orbital B.K.L L mempunyai harga |l1+l2|, |l1+l2-1|, |l1-l2|
l=0 adalah orbital s; l=1 adalah orbital p; l=2 adalah orbital d. Misal untuk 2 elektron tunggal dengan l1=l2=1 makaL=|l1+l2|=2; |l1+l2-1|=1; |l1-l2|=0
Simbol yang dipakai sama seperti pada elektron tapi ditulis dengan huruf besar, yaitu S, P, D, F, G, H, dsb. Masing-masing untuk harga L=0, 1, 2, 3, 4, 5, dsb.
2. Resultan momen sudut spin B.K.S. Jumlah spin, Massa=(2S+1), s adalah jumlah B.K. Spin untuk elektron tunggal, s=+ atau s= - Untuk 2 elektron, harga s dapat :
a. , S=|++|=1. b. , S=|+-|=0 Untuk 2 elektron tunggal S=1 maka massa =|2S+1|=3
b. INTERAKSI MAGNETIK ATAU GANDENGAN SPIN-ORBIT
Interaksi magnetik akan menghasilkan keadaan dengan ciri jumlah sudut B.K.J, dengan harga |L+S|, |L+S-1|, .|L-S|. Misal untuk 3F :
L=3 F S=1 MS=(2S+1)=3 J=|L+S|=4; |L+S-1|=3; |L-S|=2
Dari data di atas, menunjukkan keadaan atomnya : 3F , 3F , 3F 4 3 2
Keadaan Dasar Suatu Atom1. Mempunyai harga MS maksimum.2. Untuk MS maksimum maka keadaan dasarnya adalah dengan harga L maksimum yang didapat dari m, maksimum. Misalnya : d2 ml 2
1 0 -1 -2
ml = |2+1| = 3L 3. Bila orbital itu berisi : a. Kurang dari setengahnya (untuk orbital d, n5) maka keadaannya dengan harga J terbesar dengan energi terendah. Misal d8 : ml 2 1 0 -1 -2 ml = |-2 - 1| = 3 L F S maksimum = + = 1 MS = |2S+1| = 3 J maksimum = |L+S| = 4
Keadaan dasarnya :
3F
4
KEADAAN DASAR DARI ION-ION dnELEKTRON dd1 d2 d3 d4 d5 d6 d7 d8 d9
ml
2
1
0
-1
-2
S
L2 3 3 2 0 2 3 3 2
SIMBOL2D 3F 4F 5D
1 3 2
2
5 2 23
6S5D 4F 3F 2D
1
2
Simbol untuk dn
d10-n
Sifat Magnetik Atom1.
2.
3.
Diamagnetik - tidak tertarik oleh medan magnet - terjadi jika suatu atom hanya terdiri dari elektron-elektron yang berpasangan Paramagnetik - tertarik oleh medan magnet - terjadi jika suatu atom mengandung elektronelektron yang tidak berpasangan Feromagnetik elektron-elektron yang tidak berpasangan membentuk kelompok secara teratur (domain magnet) bahkan ketika tidak terpengaruh medan magnet
tanpa medan magnet
dalam medan magnet
Paramagnetik
Feromagnetik