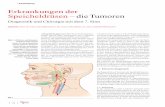
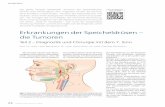
Analyse des Anreicherungsverhaltens von Mamma-Tumoren in ...
Allgemein · mucinös, endometrioid, hellzellig,transitional) und entspreched des...
Transcript of Allgemein · mucinös, endometrioid, hellzellig,transitional) und entspreched des...

Allgemein
Prinzipiell müssen Ovarialzysten, die vorwiegend funktionell sind, von genuinen Ovarialtumoren abgegrenzt werden. Funktionelle Ovarialzysten sind:
• Follikelzyste • polyzystisches Ovar • Corpus-luteum-Zyste und • Thekaluteinzyste.
(Information für Patienten zum Thema "Ovarialzysten")
Differentialdiagnosen zu funktionellen Ovarialzysten und genuinen zystischen Ovarialtumoren sind die Hydrosalpinx als Restzustand nach Adnexitis oder bei abflußgestörter Tuba uterina und Paraovarialzysten. Paraovarialzysten werden entwicklungsgeschichtlich als Überreste des Wolff’schen Ganges gedeutet und haben daher keinen direkten Bezug zum Ovar. Funktionelle Ovarialzysten sind ca. zehnmal häufiger als genuine Ovarialtumoren. Sie können durch diagnostische Maßnahmen, wie gynäkologische Untersuchung, Ultraschall oder Computertomogramm, häufig nicht von genuinen Ovarialtumoren unterschieden werden. Daher ist die operative Abklärung, z. B. durch Laparoskopie (Video 1 , 2 ; Gutachten), notwendig, wenn sich die Zyste nach hormoneller Behandlung mit östrogenbetonten Kontrazeptiven nicht zurückbildet oder Ovarialtumoren durch Stieldrehung zur Entwicklung aktuer Beschwerden führen.
Bei den genuinen Ovarialtumoren unterscheidet man
• epitheliale Tumoren, • Keimstrang-Stroma-Tumoren und • Keimzell-Tumoren.
Epitheliale Tumoren werden wiederum in
• benigne Tumoren, • Borderline-Tumoren und • maligne Tumoren untergliedert.
Von den benignen Ovarialtumoren kommen am häufigsten das
• seröse Zystadenom, • mucinöse Zystadenom, • endometroide Zystadenom, • Brennertumor und das • Adenoakanthom vor.
Benigne Ovarialtumoren können als Vorstufen der malignen Varianten angesehen werden. Dieser Zusammenhang kann allerdings nur aus morphologischen Beobachtungen abgeleitet

werden, bei denen benigne und maligne Komponenten in einem Tumor direkt nebeneinander vorkommen. Das genaue biologische Potential der benignen Tumoren ist jedoch unbekannt, da Verlaufsbeobachtungen nicht vorliegen.
Borderline ("low malignant potential") Tumoren des Ovars
Morphologie
Die Proliferation des Oberflächenepithels des Ovars führt bei den epithelialen Tumoren zu zellulären Veränderungen, die sich beim Borderline-Tumor dadurch auszeichnen, daß
• stratifiziertes, mehrschichtiges Epithel, • zelluläre Atypie, • zunehmende mitotische Aktivität und • fehlende destruierende Invasion vorliegen.
Bei der histologischen Untersuchung eines Borderline-Tumors muß pro Zentimeter Tumor mindestens ein histologischer Schnitt angefertigt werden, um ein invasives Geschehen auszuschließen. Tumoren der Stadien I, II, III oder IV unterscheiden sich morphologisch nicht voneinander. Man differenziert bei den Borderline-Tumoren des Ovars verschiedene histologische Typen, von denen die häufigsten im folgenden angegeben sind.
Diagnose
Die Verdachtsdiagnose auf einen Borderline-Tumor wird am häufigsten durch Ultraschalluntersuchung gestellt. Sonographisch erkennt man eine nach außen hin glattwandige Zyste, die nach innen eine oder mehrere solide zapfenförmige Auflagerungen aufweist. Der Inhalt ist serös oder mucinös. Bei der klinischen Untersuchung fällt eine Resistenz im Bereich eines oder beider Eierstöcke auf. Die Oberfläche ist meist glatt und im Douglas werden überlicherweise keine Implantate getastet. Die endgültige Diagnose wird operativ (laparoskopisch oder per laparotomiam) gestellt.

Staging
Unabhängig von der Größe und dem Aussehen des Primärtumors muß bei der chirurgischen Abklärung eine Peritonealzytologie entnommen werden. Liegt primär Flüssigkeit im Douglas vor, so wird diese Flüssigkeit aspiriert und zytologisch untersucht. Andernfalls muß mit 50 bis 100 ml Kochsalz das kleine Becken gespült und die Lavageflüssigkeit der zytologischen Untersuchung zugeführt werden. Eine partielle Omentektomie sowie eine pelvine und paraaortale Lymphonodektomie sind weitere obligate Bestandteile des Staging. Sämtliche auf Tumor verdächtige Areale der peritonealen Oberflächen im Abdomen müssen biopsiert werden; zudem sind systematische Biopsien vom Peritoneum des kleinen Beckens, den parakolischen Rinnen und vom Diaphragma angezeigt. 21 % der Borderline-Tumoren werden im Stadium III bzw. IV diagnostiziert.
Diese Verteilung der Stadien zeigt die Notwendigkeit des sorgfältigen chirurgischen Stagings, da bei alleiniger Entfernung des Tumors Absiedlungen übersehen werden.
Die intraperitoneale und retroperitoneale Aussaat sind die wichtigsten Prognosefaktoren: so lag die Rezidivrate bei Patientinnen mit intraperitonealer Aussaat oder Befall der retroperitonealen Lymphknoten bei 50 %. Der Lymphknotenstatus korrelierte dabei nicht mit der Ausdehnung der Erkrankung.

Alle Patientinnen mit negativen Lymphknoten waren nach einer medianen Beobachtungszeit von 41,5 Monaten rezidivfrei (n=27). Von Patientinnen mit positiven Lymphknoten waren dagegen nur 86 % rezidivfrei (6 von 7).
Prognose
Die 5-Jahres-Überlebensrate für alle Stadien der Borderline-Tumoren liegt bei 95 %, für das Stadium I und II bei 97 % und für die Stadien III und IV bei 88 %.
Diese Raten sind signifikant höher als für das invasive epitheliale Ovarialkarzinom. Rezidive, die nach Borderline-Tumoren auftreten, können durch drei Mechanismen erklärt werden:
• Fehldiagnose oder inadäquates Tumorsampling: Der Originaltumor war in Wirklichkeit ein invasives Karzinom.
• langsames Wachstumspotential: Langsame Tumorproliferation und schlechtes Ansprechen auf Chemo- oder Radiotherapie.
• Umwandlung der Zellen in invasive Zellinien: Eine zurückgelassene Zellinie eines Borderline-Tumors entwickelt sich über eine gewisse Zeitspanne in ein invasives Karzinom.

Der Ploidiegehalt der Borderline-Tumoren scheint von prognostischer Bedeutung. Patientinnen mit aneuploiden Tumoren haben eine signifikant verringerte Überlebensrate gegenüber Patientinnen mit euploiden Tumoren.
Dabei korreliert der Ploidiegehalt mit dem Stadium der Erkrankung: im Stadium IA sind nur 30 % der Tumoren aneuploid, während im Stadium III 70 % der Tumoren aneuploid sind. Es ist jedoch unklar, ob der Ploidiegehalt als unabhäniger Prognosefaktor gelten kann.
Therapie
Beim Stadium I ist eine eingeschränkte chirurgische Behandlung mit einseitiger Adnexektomie möglich und bei Nulliparae kann in Ausnahmefällen auch eine teilweise Erhaltung der Ovarien angestrebt werden. Die Mitentfernung des Uterus oder des kontralateralen Ovars bei einseitigem Tumor verbessert die Prognose nicht (Tazelaar et al. 1985). Besteht kein Kinderwunsch und ist die Patientin bereits peri- oder postmenopausal, so sollte auch im Stadium I eine Entfernung von beiden Ovarien und Uterus erfolgen. Die Entnahme von Anteilen des großen Netzes, Peritonealbiopsien und pelvinen sowie paraaortalen Lymphknoten ist unabhängig von der Ausdehnung des Tumorleidens und von evtl. noch bestehendem Kinderwunsch obligat (siehe Staging). Die Wertigkeit der adjuvanten Chemotherapie oder intraperitonealen Radiotherpie bei Borderline-Tumoren des Ovars Stadium II - IV wurde bisher nicht systematisch untersucht.

Von den 93 Patientinnen, die eine adjuvante Therapie erhalten hatten, waren 83 % rezidivfrei, während dies bei der Gruppe ohne adjuvante Therapie für nur 48 % der Patientinnen galt. Trotzdem sind Daten dieser kleinen Fallstudie keinesfalls beweisend, da kein prospektiver randomisierender Vergleich durchgeführt wurde.
Pseudomyxoma peritonei
Das Pseudomyxoma peritonei stellt ein seltenes und fatales Krankheitsbild dar. Ausgangspunkt ist eine semimaligne Neoplasie des Ovars oder der Appendix. Die Prävalenz beträgt 2 in 10 000 Laparotomien. Die Verstreuung von Zysteninhalt führt zu massiven intraabdominalen Ansammlungen von mucinösem Material, welches im weiteren zu abdominaler Schmerzsymptomatik, Gewichtsverlust, gastrointestinalen Beschwerden und schließlich zum Tod durch Ileus führt (Mann et al., 1990).
Pathogenese
Der Entstehungsmechanismus des Pseudomyxoma peritonei ist nicht geklärt. Alternativ handelt es sich um Metastasen eines ausdifferenzierten mucinösen Adenokarzinoms oder um benigne Neoplasien des Ovars oder der Appendix, wobei entweder
• eine spezielle Reaktion des Peritonealepithels auf das gelartige Material, das von der Zyste abgesondert wird, entsteht,
• mucinöses Epithel, das bei der Ruptur einer Zyste austritt, sich im Bereich des Peritoneums implantiert und anschließend proliferiert oder
• tumorigene Stimuli multifokale Neoplasien oder Metastasen der Peritonealoberfläche verursachen (Mann et al., 1990).
Morphologie
Folgende morphologische Kriterien müssen für die Diagnose Pseudomyxoma peritonei vorliegen:
• mucinös, zystadenomatös, ausdifferenzierter Tumor, • unregelmäßige Mucinansammlung im Stroma mit Zylinderepithelfragmenten und

• "Goblet-Cells" (Kelch-Zellen) im Epithel des Ovarialtumors und in den peritonealen Metastasen (Michael et al., 1987).
Klinik
Die durchschnittliche Überlebenszeit liegt bei 4,2 Jahren und die Langzeitüberlebensrate bei nur 10 %, was signifikant schlechter ist als für mucinöse Borderline-Tumoren (20-Jahre- Überlebensrate 85 %) (Michael et al., 1987).
Therapie
Eine aggressive chirurgische Resektion aller Läsionen ist die Standardtherapie. Die Wertigkeit einer adjuvanten intraabdominalen photodynamischen Therapie (Sindelar et al., 1991) oder einer intraperitonealen Chemotherapie (Sugarbaker et al., 1990) wird in Studien evaluiert.
Epitheliales Ovarialkarzinom
Epidemiologie
Ovarialkarzinome haben die höchste Mortalitätsrate aller gynäkologischen Karzinome. In den USA treten pro Jahr 24 000 neue Fälle auf, wovon mehr als die Hälfte (13 600 Frauen) sterben. Der Inzidenzgipfel liegt zwischen 50 und 70 Jahren bei 62 Jahren. Während in der Prämenopause nur 7 % aller Ovarialtumoren maligne entarten, sind in der Postmenopause 30 % aller Ovarialtumoren bösartig. Für die Frau beträgt das lebenslange Risiko, an einem Ovarialkarzinom zu erkranken, 1,4 %.
Faktoren für und gegen die Entstehung des Ovarialkarzinoms (Brinton and Hoover, 1992)
Risikofaktor Geschätztes relatives Risiko
Ovarialkarzinom i. d. Familienanamnese
3-4
In Nordamerika u. Nordeuropa lebende Frauen
2-5
Infertilitäts-Anamnese 2-5
Nulligravidität 2-3
Hoher Sozio-ökonomischer Status 1,5-2
Perineale Talkexposition 1,5-2
Späte Menopause 1,5-2
Frühe Menarche 1,5
Zustand nach Hysterektomie 0,5-0,7
Orale Antikonzeption 0,3-0,6

Die überwiegende Mehrzahl (95 %) aller Ovarialkarzinome sind sporadisch und nur 5 % sind durch eine familiäre Belastung bedingt:
• Organspezifisches familiäres Ovarialkarzinom • Familiäres Mamma-Ovarkarzinom-Syndrom • Lynch II Syndrom: Colon-Ovarialkarzinom.
Beim organspezifischen familiären Ovarialkarzinom liegt der Altersgipfel ca. 10 Jahre früher als beim nicht familiärem Ovarialkarzinom. Frauen mit erst- oder zweitgradigen Verwandten, die vor dem 50. Lebensjahr an einem Ovarialkarzinom erkranken, haben ein erhöhtes Risiko, ein defektes Gen zu tragen.
Das familiäre Mamma-Ovarialkarzinom-Syndrom ist mit dem BRCA1-Gen auf Chromosom 17Q assoziiert. Frauen mit einem Mammakarzinom haben insgesamt ein 2 bis 4fach erhöhtes Risiko, an einem Ovarialkarzinom zu erkranken.


Das Lynch II Syndrom stellt eine Kombination des Lynch I Syndrom (familiäres Colonkarzinom) mit Ovarial-, Endometrium-, Mamma- und anderen Karzinomen aus dem Gastrointestinal- und Urogenitaltrakt dar. Das Risiko für ein Ovarialkarzinom ist bei Frauen aus solchen Familien gegenüber der Normalbevölkerung um das 3fache erhöht.
(Video "Krukenberg-Tumor mit Ovarmetastasen" )
Langzeitanwendung von oralen Kontrazeptiva kann das Risiko für die Entstehung eines Ovarialkarzinoms vermindern: Das relative Risiko bei Anwendung von oralen Kontrazeptiva kann auf 0,6 (um 40 %) gesenkt werden, der protektive Effekt ist bereits nach 3 bis 6 Einnahmemonaten vorhanden und hält bis zu 15 Jahre an (CDC and NIH Study Group, 1987).

Morphologie
(Video "Ovarialtumoren" )
Histologische Klassifikation der Ovarialtumoren aus R. L. Voet, Color Atlas of Obstetric and Gynecologic Pathology, 1997.
Bemerkungen zur histologischen Klassifikation: Aufbau des Ovars aus 3 histogenetisch unterschiedlichen Geweben. Dementspechend unterscheidet die WHO Klassifkation drei Tumorhaupttypen:
I Oberflächenepithel-Tumoren: Ausgangspunkt: Proliferation des Müllerschen Oberflächenepithels
II Keimstrang-Stroma-Tumoren:
Ausgangspunkt: endokrin differenziertes Gonaden-Mesenchym
III Keimzelltumoren: Ausgangspunkt: omnipotente Keimzelle
Die epithelialen Ovarialtumoren werden ferner unterklassifiziert entsprechend der verschiedenen Differenzierungsrichtungen des Müllerschen Oberflächenepithels (serös, mucinös, endometrioid, hellzellig,transitional) und entspreched des Proliferationsgrades jeweils in benigne Tumoren, an der Grenze zu maligne stehende Borderline Tumoren und in maligne Tumoren invasive Karzinome).
I. Oberflächenepitheltumoren
A. Seröse Tumoren 1.Benigne a)Zystadenom und papiläres Zystadenom b)Oberflächenpapillom c)Adenofibrom und Zystadenofibrom 2.Borderline-Tumoren (Tumor mit niedrig malignem Potenial) a)zystische Tumoren und papillär zystische Tumoren b) Oberflächenpapillom c) Adenofibrom und Zystadenofibrom 3.Maligne a) Adenokarzinom, papilläres Adenokarzinom, papilläres Zystadenokarzinom b) papilläres Oberflächenkarzinom c)malignes Adenofibrom und Zystadenofibrom B.Muzinöse Tumoren: vom endozervikalen Typ vom intestinalen Typ 1.Benigne a)Zystadenom und papiläres Zystadenom

b)Oberflächenpapillom c)Adenofibrom und Zystadenofibrom 2.Borderline-Tumoren (Tumore mit niedrig malignem Potenial) a)zystische Tumoren und papillär zystische Tumoren b) Oberflächenpapillom c) Adenofibrom und Zystadenofibrom 3.Maligne a) Adenokarzinom, papilläres Adenokarzinom, papilläres Zystadenokarzinom b) papilläres Oberflächenkarzinom c)malignes Adenofibrom und Zystadenofibrom C.Endometrioide Tumoren 1.Benigne a)Zystadenom und papiläres Zystadenom b)Oberflächenpapillom c)Adenofibrom und Zystadenofibrom 2.Borderline-Tumoren (Tumore mit niedrig malignem Potenial) a)zystische Tumoren und papillär zystische Tumoren b) Oberflächenpapillom c) Adenofibrom und Zystadenofibrom 3.Maligne a) Adenokarzinom, papilläres Adenokarzinom, papilläres Zystadenokarzinom, Adenokarzinom mit squamöser Differenzierung b) papilläres Oberflächenkarzinom c)malignes Adenofibrom und Zystadenofibrom D. Klarzellige Tumoren 1.Benigne 2.Borderline-Tumoren 3.Maligne E. Transitionalzell-Tumoren 1.benigne (Brenner Tumor) 2.Borderline Tumor (poliferierender Brenner Tumor) 3.maligner Brenner Tumor 4.Transitionalzell-Karzinom (non-Brenner-Type) F. Maligner Müllerscher Mischtumor 1. homologer Typ 2. heterologer Typ G. Plattenepitheltumoren H. Epitheliale Mischtumoren II. Keimstrang-Stroma-Tumoren A. Granulosa-Zell-Tumor 1. juveniler Typ 2. erwachsener Typ B. Tumoren der Theka-Fibromgruppe C. Sertoli-Zell-Tumor D. Sertoli-Leydig Tumor E. Gynandroblastom F. Steroid (lipid) Zell Tumor III. Keimzelltumoren A. Dysgerminom B. Dottersacktumor (verschiedene Differenzierungen) C. Embryonales Karzinom D. Choriokarzinom E. Polyembryona F. Teratome 1.Unreif 2.Reif a)solide b)zystisch ("Dermoidzyste")

3. monodermal IV. Mesenchymale Tumoren V. Sekundäre (metastatische) Tumoren VI. Varia (Information für Patienten zum Thema "Ovarialkarzinom")
Screening
Die Sonographie hat für die Erkennung von Ovarialkarzinomen eine Sensitivität von 95 %. Die Bestimmung des Tumormarkers CA 125 hat eine Sensitivität von 50 % beim Stadium I und von 60 % beim Stadium I + II. Die Kombination von Sonographie und CA 125 erkannte 14 Karzinome in einem Kollektiv von 27 000 Frauen mit erhöhtem Risiko für ovarielle Karzinome. Für die definitive Diagnose eines Karzinoms waren hierbei 4 Operationen notwendig. Bei einer Prävalenz von 0,05 % für das Ovarialkarzinom muß ein Test eine Sensitivität von 100 % und eine Spezifität von 99 % haben, um einen positiven Vorhersagewert von 4,8 % zu erreichen.
Das bedeutet, daß in einem Nicht-Risikokollektiv bzw. der Normalbevölkerung 20 Tumoren operativ abgeklärt werden müssen, um ein Karzinom zu finden. Bisher ist allerdings nicht gewährleistet, daß eine Kombination von Screening Verfahren wie Sonographie und CA 125 in einer Nicht-Risikopopulation eine Spezifität von 99 % erreicht.
Bei der sonographischen Beurteilung von Ovarialtumoren werden verschiedene Kriterien verwandt, die zwischen benigne und maligne unterscheiden können (Granberg et al., 1990):
• Größe mehr als 5 cm • Echogenität hoch (solide Tumoren) • Aussehen multilokulär • Abgrenzung irregulär • Aszites vorhanden • papilläre intrazystische Formationen.

Zusätzlich scheint ein hoher diastolischer Flow durch vermehrte Neovaskularität ein zusätzliches Kriterium für die Diagnose "maligne" zu sein (Hata et al., 1989; Bourne et al., 1989; Fleischer et al., 1991; Kurjak et al., 1991; Kawai et al., 1992; Weiner et al., 1992; Schneider et al., 1993). Die sonograpische Untersuchung und/oder die CA 125 Bestimmung ist bisher nicht in das Routinevorsorgeprogramm integriert. Allerdings sollte bei Frauen mit familiärer Belastung alle 6 Monate eine sonographische Untersuchung durchgeführt werden. Nach Abschluß der reproduktiven Phase kommt eine prophylaktische Oophorektomie vor allem bei Frauen mit zwei Verwandten 1. Grades mit Ovarialkarzinom in Frage, wobei die Oophorektomie aufgrund des multilokulären Entstehungsmechanismus des Ovarialkarzinoms auch keine absolute Sicherheit gibt. Die Prophylaxe durch Einnahme von oralen Kontrazeptiva hat bei familiärer Belastung keinen bewiesenen Effekt. Bei Patientinnen mit Verdacht auf Lynch II Sydrom sollten zusätzlich eine Mammographie, Koloskopie und Endometriumbiopsie in regelmäßigen Abständen erfolgen.
Frauen mit BRCA1- oder BRCA 1-/BRCA2 - Mutation: Der Vorteil eines intensivierten Screenings konnte bisher noch nicht gezeigt werden.

Diagnose
Das Erstsymptom bei fortgeschrittenem Ovarialkarzinom besteht meist in der Zunahme des Bauchumfanges (Video ). Frühformen, bei denen noch keine intraperitoneale Aussaat und keine Aszitesbildung vorliegen, werden meist nur im Rahmen der Vorsorgeuntersuchung entweder durch Palpation oder Sonographie erkannt. Durch Palpation oder Ultraschall aufgefallende Ovarialtumoren werden laparoskopisch und histologisch (Schnellschnitt) weiter abgeklärt.
Zur obligaten Diagnostik vor Erstoperation eines wahrscheinlich weit fortgeschrittenen Ovarialkarzinoms zählen folgende Untersuchungen:
1. Labor: Tumormarker CA 125 und CA 19-9, bei V. a. Keimzelltumoren, AFP und HCG, übliche präoperative Diagnostik (Blutbild, Elektrolyte, Gerinnung, Leber- und Nierenwerte) 2. Ultraschall 3. Darmdiagnostik (Magen-Darm-Passage, Rektoskopie, Koloskopie) 4. Mammografie 5. Rö-Thorax 6. CT oder MRT Becken und Abdomen zur präoperativen Stadieneinteilung Bei laparoskopischer Abklärung ist wichtig, daß keine intraoperative Ruptur verursacht wird, da sowohl bei Borderline-Tumoren als auch beim invasiven Karzinom sowie bei Keimstrang-Stroma- oder Keimzell-Tumoren potentiell Zellen in die Bauchhöhle verschleppt werden können, was eine anschließende Chemotherapie notwendig machen kann.
Die laparoskopische Diagnostik erlaubt jedoch, mit hoher Sensitivität und Spezifität Karzinome und Borderline-Tumoren zu erkennen und entsprechend zu behandeln.

Besteht laparoskopisch der Verdacht, daß es sich um keine benigne Zyste handelt, so sollte im Regelfall das Ovar laparoskopisch abgesetzt und in einen Bergebeutel gebracht werden. Die Zyste kann im Bergebeutel punktiert und ohne Verschleppung von Tumorzellen durch die Bauchdecke entfernt werden.
TVS = Transvaginal-Sonographie

Staging
Stadieneinteilung (UICC, 1992)
TNM-Kategorien FIGO-Stadien
TX Primärtumor kann nicht beurteilt werden.
T0 Kein Anhalt für Primärtumor.
T1 I Tumor begrenzt auf Ovarien.
T1a IA Tumor auf ein Ovar begrenzt; Kapsel intakt, kein Tumor auf der Oberfläche des Ovars.
T1b IB Tumor auf beide Ovarien begrenzt; Kapsel intakt, kein Tumor auf der Oberfläche der beiden Ovarien.
T1c IC Tumor begrenzt auf ein oder beide Ovarien mit Kapselruptur, Tumor an Ovaroberfläche oder maligne Zellen im Aszites oder bei Peritonealspülung.
T2 II Tumor befällt ein oder beide Ovarien und breitet sich im Becken aus.
T2a IIA Ausbreitung auf und/oder Implantate an Uterus und/oder Tube(n).
T2b IIB Ausbreitung auf andere Beckengewebe.

T2c IIC Ausbreitung im Becken (IIA oder IIB) und maligne Zellen im Aszites oder bei Peritonealspülung.
T3 und/oder N1 III Tumor befällt ein oder beide Ovarien, mit mikroskopisch nachgewiesenen Peritonealmetastasen außerhalb des Beckens und/oder regionäre Lymphknotenmetastasen.
T3a IIIA Mikroskopische Peritonealmetastasen jenseits des Beckens.
T3b IIIB Makroskopische Peritonealmetastasen jenseits des Beckens, größte Ausdehnung 2 cm oder weniger.
T3c
und/oder N1
IIIC Peritonealmetastasen jenseits des Beckens, größte Ausdehnung mehr als 2 cm, und/oder regionäre Lymphknotenmetastasen.
M1 IV Fernmetastasen (ausschließlich Peritonealmetastasen).
Anmerkung: Metastasen an der Leberkapsel entsprechen T3/Stadium III, Leberparenchymmetastasen M1 / Stadium IV. Um einen Pleuraerguß als M1/Stadium IV zu klassifizieren, muß ein positiver zytologischer Befund vorliegen.
Histopathologisches Grading
GX Differenzierungsgrad kann nicht beurteilt werden G1 hoch differenziert G2 mittelgradig differenziert G3 gering differenziert und undifferenziert
Das Staging des Ovarialkarzinoms sollte immer chirurgisch erfolgen. Ausnahmen stellen fortgeschrittene Karzinome mit deutlicher Einschränkung des Allgemeinbefindens und eingeschränkter Operabilität dar. Hierbei kann eine wenig invasive Methode zur histologischen oder zytologischen Abklärung dienen (Punktion, Laparoskopie, Tumormarker). Nach adjuvanter Chemotherapie und Reduktion der Tumormasse kommt dann potentiell die sekundäre chirurgische Behandlung in Frage.
Prognose</A>
CA 125 ist ein wertvoller Tumormarker im Rahmen der Verlaufskontrollstudie des Ovarialkarzinoms. CA 125 ist v. a. beim fortgeschrittenem Ovarialkarzinom (Stadium III & IV) und bei den histologischen Typen "serös" und "undifferenziert" erhöht.
Sensitivität des Tumormarkers Ca 125 in Abhängigkeit vom Tumorstadium
Autor Stadium (FIGO)
I und II III und IV
(Bast, Jr. et al., 1983) 100 % 95 %
(Tholander et al., 1985) 39 % n.u.

(Graves, 1990) 67 % 88 %
(Castelli et al., 1987) 40 % 95 %
(Mann et al., 1988) 23 % n.u.
(Kudlacek et al., 1989) 33 % 71 %
(Vardi et al., 1989) n.u. 77 %
n.u. = nicht untersucht
Sensitivität des Ca 125 vs Histologie zum Zeitpunkt der Primäroperation
Histologie serös muzinös endom. undiff.
Grenzwert 35 U/ml
(Kaesemann et al., 1986)
88 % 60 % 69 % 95 %
(Sevelda et al., 1987) 91 % 92 % 83 % 100 %
(Halila et al., 1988) n. u. 40 % n.u. n.u.
(Gadducci et al., 1992)
84 % 67 % 80 % 95 %
Grenzwert 65 U/ml
(Fioretti et al., 1986) 83 % 33 % 25 % 71 %
(Kaesemann et al., 1986)
80 % 40 % 62 % 90 %
(Sevelda et al., 1987) 88 % 77 % 83 % 100 %
(Gadducci et al., 1992)
80 % 50 % 40 % 95 %
n.u. = nicht untersucht
Falsch positive Werte können im Rahmen der präoperativen Abklärung bei Endometriose, Myomen und allen entzündlichen Erkrankungen des Bauchfells vor. Eine Reihe anderer Tumormarker wurde im Zusammenhang mit den Ovarialkarzinom untersucht, haben aber keine klinische Bedeutung erlangt.
Übersicht über die diagnostische Wertigkeit verschiedener Tumormarker beim Ovarialkarzinom vor der Primäroperation

Sensitivität Spezifität
CA 125 (Bartel et al., 1989; Sevelda et al., 1987; Yabushita et al., 1990)
78 - 92 % 95 - 100 %
CA 15-3 (Baum et al., 1987; Panici et al., 1989; Scambia et al., 1990)
71 - 87 % 100 %
CA 19-9 (Schwartz et al., 1987; Yabushita et al., 1990)
33 - 48 % 81 - 90 %
Ca 72-4 (Gadducci et al., 1990; Scambia et al., 1990)
44 - 74 % 93 - 100 %
CEA (Fioretti et al., 1986; Panza et al., 1988)
19 - 31 n.a.
D-Dimer (Schröck et al., 1985)
97 % 97 %
TPA (Schröck et al., 1986; Kreienberg and Melchert, 1985; Fioretti et al., 1986, Yabushita et al., 1990)
53 - 81 % n.a.
CASA (Yabushita et al., 1990)
76 % 97 %
Frühes Ovarialkarzinom
Die Prognose des frühen Ovarialkarzinoms ist für das Stadium IA oder IB, Grading I oder II exzellent. Ob eine adjuvante Chemotherapie bei diesen Stadien die Prognose verbessert, ist nicht erwiesen.

Bei Stadium IA oder IB mit Grading III sowie beim Stadium IC und IIA, IIB und IIC sollte unabhängig vom Grading eine adjuvante Therapie erfolgen. Hierbei erscheinen die intraperitoneale Radiotherapie und Chemotherapie gleichwertig.
Entscheidend ist, daß die Stadieneinteilung (Stadium I) durch ein komplettes Staging, daß neben der Entfernung des inneren Genitales die radikale Omentektomie und die pelvine und paraaortale Lymphonodektomie einschließt, abgesichert wurde. Nur wenn chirurgisch komplett gestaged wurde, kann die Diagnose mit Sicherheit gestellt werden (Gutachten).
Neben dem Grading scheint als histologischer Subtyp vor allem das klarzellige Karzinom beim frühen Ovarialkarzinom eine deutlich schlechtere Prognose zu haben: so hatten Patientinnen mit Stadium IA oder IB und Grading I oder II und der histologischen Diagnose Klarzellkarzinom ein 30 % Rezidivrisiko (Young et al., 1990). Eine second look Abklärung entweder durch Laparoskopie oder Laparotomie scheint vor allem bei Patientinnen mit Symptomen indiziert, da hier bei bis zu 80 % ein Rezidiv nachgewiesen werden kann (Walton et al., 1987).
Fortgeschrittenes Ovarialkarzinom
Die Prognose bzw. Überlebensrate beim fortgeschrittenen Ovarialkarzinom ist außer vom Stadium vor allem vom größten Durchmesser des postoperativ verbliebenen Tumorrests als stärksten und unabhänigen Prognoseindikator abhängig (Hacker et al., 1983).
Patientinnen, die bis auf Resttumordurchmesser von weniger als 5 mm "debulked" werden konnten, haben eine signifikant bessere Überlebenschance als Patientinnen mit größeren Tumorresten. Daher sollte die chirurgische Erstbehandlung so ausgedehnt wie möglich sein. Die weitere Prognose der Erkrankung wird außerdem vom retroperitonealen Lymphknotenstatus, vom Lebensalter der Patientin und der präoperativ bestimmten Aszitesmenge beinflußt. Das histologische Grading des Tumors scheint nur in den früheren Tumorstadien bedeutsam zu sein, obwohl hierüber noch keine allgemeine Übereinkunft besteht.
In Zukunft liegt das Hauptanliegen bei der Therapie des Ovarialkarzinoms in einer Individualisierung der Therapie, um diese an das jeweilige spezifische Risiko der einzelnen

Patientin anzupassen. Hilfreich hierfür könnten neue tumorbiologische Prognosefaktoren sein, welche Frauen mit hohem und niedrigem Risiko unterscheiden lassen. Für Hochrisikofälle erschließt sich derzeit die Möglichkeit einer Ausweitung der Therapie auf aggressivere Methoden, die jedoch nur gezielt und in klinischen Studien angewendet werden sollten.
Tumorbiologische Prognosefaktoren mit hoher Aussagekraft sind: - Proliferationsparameter: s-Phase-Gehalt, Ploidität, Ki-67-Antigen - Parameter der invasiven und metastatischen Kapazität: Urokinase, Urokinaseinhibitor PAI-1
Therapie

Chirurgie
Das frühe als auch das fortgeschrittene Ovarialkarzinom sollten primär, falls es der Allgemeinzustand der Patientin zuläßt, operativ behandelt werden, um eine histologische Diagnose (im Schnellschnitt) zu ermöglichen. Mittels Laparotomie oder Laparoskopie wird das Abdomen exploriert.
Die operative Behandlung des Ovarialkarzinoms macht eine große Erfahrung und eine spezielle Ausbildung erforderlich. Deshalb sollte bei Feststellung eines schwierigen Operationssitus und dem Fehlen entsprechender Voraussetzungen die Sicherung der Diagnose durch Biopsie aus dem Ovarialtumor erfolgen und der Eingriff als Probelaparotomie beendet werden. Inkomplette Operationen können durch Überweisung der Patientin in ein entsprechend ausgerüstetes operatives Zentrum zu einer Komplettierungsoperation ergänzt werden. Häufig läßt sich ein als zunächst inoperabel eingeschätztes Ovarialkarzinom bei entsprechenden perioperativen Versorgungsmöglichkeiten eines großen Krankenhauses doch noch vollständig resezieren.
Es wird Aszites oder Spülflüssigkeit zur zytologischen Untersuchung entnommen. Beim frühen einseitigen Ovarialkarzinom und noch bestehendem Kinderwusch kann eine einseitige Salpingoophorektomie durchgeführt werden. Bei Frauen ohne Kinderwunsch werden beide Eierstöcke und Gebärmutter entfernt. Im weiteren ist bei der Diagnose Ovarialkarzinom ein komplettes Staging notwendig, was die Entfernung des großen Netzes, der pelvinen und paraaortalen Lymphknoten bis in Höhe des Nierenstiels, sowie von multiplen Peritonealbiopsien einschließt. Alle verdächtigen Areale sollten biopsiert und entfernt werden. Beim fortgeschrittenen Ovarialkarzinom sind diese beschriebenen Strukturen intra- und retroperitoneal sehr häufig von Tumor infiltriert. Es können breitflächig ausgedehnte oder

einzelstehende Tumorinfiltrationen im Bereich aller peritonealen Überzugsflächen inklusive Dünn- und Dickdarmserosa bestehen. Hier führen sie häufig zur Einengung des Darmlumens, so daß Darmresektionen notwendig werden können. Häufig gelingt dies jedoch unter Erhaltung der Kontinenz und ohne einen Anus praeternaturalis. Ziel der Operation beim fortgeschrittenen Ovarialkarzinom ist ein ausgedehntes "debulking", wobei die Tumorresektion soweit gehen sollte, daß makroskopisch kein Tumor mehr erkennbar ist. Hierbei kann neben dem konventionellen Abtragen mit Skalpell und Blutstillung mittels hochfrequenter Elektrokauterisation oder Argonbeam auch der Cavitron Ultrasonic Aspirator (CUSA) hilfreich sein. Allerdings muß beachtet werden, daß diese Methode auch zu Gerinnungsstörungen führen kann. Nach der primären chirurgischen Behandlung sollte bei der Patientin so schnell wie möglich eine Chemotherapie durchgeführt werden. Idealerweise geschieht dies am 5. bis 7. postoperativen Tag.
Chemotherapie (AWMF - Leitlinie - maligne Ovarialtumoren)
Kriterien zur Beurteilung des Chemotherapieerfolges (Meden, 1996)
Vollremission (complete remission, CR):
• Kein Nachweis direkter und indirekter Tumorparameter für mindestens 4 Wochen • Normalisierung der Laborwerte
Teilremission (partial remission, PR):
• Reduktion der meßbaren Tumorparameter um > 50% im Vergleich zur Situation vor Behandlungsbeginn
• Dauer dieser Reduktion ≥4 Wochen • Keine neuen Metastasen aufgetreten
Stabile Krankheitsphase (no change, NC):
• Tumorgröße unverändert • Kein Tumorwachstum > 25 %
Progredienz (progression, P):
• Tumorwachstum > 25 % gegenüber Vortherapie
Adjuvante Chemotherapie beim Ovarialkarzinom im Stadium I
Low risk (Stadium Ia/Ib G1): Patientinnen mit einem hochdifferenzierten Ovarialkarzinom der Stadien Ia und Ib (FIGO) profitieren nicht von einer adjuvanten Chemotherapie. Die 5-Jahres-Überlebensrate liegt nach adäquatem Staging und chirurgischer Primärtherapie bei größer als 90 %.
High risk (Stadium Ia/Ib, G3 und Ic): Eine Absenkung des Rezidivrisikos ist bei diesen Patientinnen durch eine adjuvante Therapie wahrscheinlich, eine Verlängerung der Lebenszeit ist möglich.
Primärtherapie der Stadien II - IV

Durch die Einführung von Pallitaxel Mitte der 90er Jahre in die primäre Chemotherapie des fortgeschrittenen Ovarialkarzinoms konnten Fortschritte bezüglich des Therapieansprechens und der Dauer der Remission verzeichnet werden.
Die Kombination Platin / Paclitaxel ist der Kombination aus Platin und einem Akylaus überlegen. Dies konnten zwei große randomisierte Studien (McGuire, 1996, Piccart, 2000) belegen. Gleichzeitig wurde nachgewiesen, daß Carboplatin und Cisplatin äquieffektiv sind (Neijt et al., 2000) bei deutlich reduzierter Langzeittoxizität von Carboplatin. Aus diesen Gründen ist heute die Kombination aus Carboplatin und Taxol weltweit Standard in der postoperativen primären Chemotherapie des Ovarialkarzinoms.
Taxol-Carboplatin-Protokoll
Paclitaxel (Taxol) 175-185 mg/m2 als 3 h-Infusion Carboplatin AVC 5 - 6 (Calvert-Formel) jeweils Tag 1, Wiederholung Tag 21 für 6 Zyklen Kosten pro Zyklus: ca. 1800 Euro
Eine Umfrage der AGO (du Bois) zeigte, daß nur etwa 38 % der Patientinnen diese Standard-Chemotherapie aus Carboplatin und Paclitaxel in Krankenhäusern der Grund- und Regelversorgung erhielten.
Normalerweise werden sechs Zyklen Chemotherapie im 3wöchigem Abstand verabreicht, wobei Leukozyten und Thrombozyten zwei Wochen nach Therapie und einen Tag vor einem neuen Zyklus kontrolliert werden müssen. Der niedrigste Wert (Nadir) wird bei platinenthaltenden Schemata zwei Wochen nach Therapie erwartet. Liegen die Leukozyten bei der Nadirzählung unter 1 000 oder die Thrombozyten bei weniger als 50 000, so sollte die Dosierung im nächsten Zyklus um 25 % reduziert werden. Liegen am Tag vor einem erneuten Chemotherapiezyklus die Leukozyten unter 3 000 oder die Thrombozyten unter 100 000, so sollte keine Behandlung durchgeführt werden. Haben sich die Leukozyten und Thrombozyten dann nach einer weiteren Woche wieder erholt, so sollte die Dosierung trotzdem um 25 % verringert werden. An weiteren Parametern neben Leukozyten und Thromozyten sollten das Hämoglobin, die Nierenwerte sowie die Elektrolyte sorgfältig überwacht werden. Gastrointestinale Nebenwirkungen können durch die Behandlung mit dem Antiemetikum Ondansetron normalerweise beherrscht werden. Ondansetron wird in einer Dosierung von 0,3 mg/kg 30 Minuten vor der Chemotherapie über 15 Minuten in 50 ml Kochsalz intravenös verabreicht, gefolgt von 20 mg Dexamethasonnatriumsulfat 15 Minuten vor Behandlung über einen Zeitraum von 15 Minuten intravenös in 50 ml Kochsalz. Vier Stunden nach der Chemotherapie kann Ondansetron in einer Dosierung von 0,4 mg/kg per os verabreicht werden.
Chemotherapie bei Progression oder Rezidiv
Trotz deutlich verbesserter Therapieergebnisse bei der Primärbehandlung des Ovarialkarzinoms wird dennoch die Mehrzahl der Patientinnen mit fortgeschrittenem Ovarialkarzinom ein Rezidiv erleiden.
In der Rezidivsituation muß sehr sorgfältig zwischen möglichem Benefit und Belastung für die Patientin unterschieden werden:

• rezidivfreies Intervall größer 6 Monate: platinsensibel, platinhaltige Reinduktionstherapie möglich
• rezidivfreies Intervall kleiner 6 Monate: platinresistent
Monotherapieergebnisse mit unterschiedlichen Substanzen (Etoposid (oral), Topotecan, Treosulfan, Doxorubicin, Gemcitabine, Mitoxantron) führen zu Ansprechraten von maximal 20 %.
Die intraperitoneale und intrapleurale Applikation von Zytostatika als Palliativmaßnahme wurde in mehreren klinischen Studien untersucht und hat sich als nicht effektiv und als damit nicht sinnvoll erwiesen. Die ungleichmäßige Verteilung in Folge von Kammerung und postoperativen Adhäsionen verhindert eine kontrollierte Wirksamkeit und führt andererseits zu toxischen Konzentrationen an anderer Stelle. Die regionale Chemotherapie wird deshalb als ungünstige Therapievariante angesehen.
Strahlentherapie
Die Strahlentherapie gehört bei der Behandlung des Ovarialkarzinoms v. a. aufgrund der erhöhten Morbidität nicht zur Standardtherapie. Daher scheint die Ganzabdomenbehandlung v. a. nach Tumorreduktion unter 2 cm Restgröße mit 5-Jahres-Überlebensraten einherzugehen, die dann auch mit Chemotherapie vergleichbar sind.
Ergebnisse der Strahlentherapie beim Ovarialkarzinom
Art der Therapie Pat. (n) Stadien Ergebnisse
pelv. RT vs.
pelv. RT & Chemo. vs.
pelv. RT & abd. RT (Dembo et al., 1979)
43
76
76
I-III 5-Jahres-Überlebensrate und Rezidiv-Häufigkeit durch abd. RT verbessert
pelv. RT vs.
pelv. RT & abd. RT (Delclos and Smith, 1975)
47
147
I-IV höhere 5-Jahres-Überlebensrate bei abd. RT (43% vs. 31%)
pelv. RT +/- Chemo. vs.
pelv. RT & abd. RT (Dubois et al., 1985)
58
52
I-III Vorteile für abd. RT nur im Stadium II

abd. RT= Ganzabdomenbestrahlung
pelv. RT =Beckenbestrahlung
Langzeitergebnisse nach Ganzabdomenbestrahlung in Abhängigkeit von der Resttumorgröße
Tumorrest vor RT < 2cm
Tumorrest vor RT ≥ 2 cm
rezidivfreie Überlebensrate nach 10 Jahren (in %)
(Dembo et al., 1983)
38 6
rezidivfreie Überlebensrate nach 15 Jahren (in %)
(Martinez et al., 1985)
50 14
rezidivfreie Überlebensrate nach 10 Jahren (in %)
(Fuller et al., 1987)
62 0
Überlebensrate nach 10 Jahren (in %)
(Weiser et al., 1988)
42 10
Überlebensrate nach 6 Jahren (in %)
(Goldberg and Peschel, 1988)
41 n.a.
Immuntherapie
Neuere Untersuchungen lassen erwarten, daß mit der Immuntherapie eine Möglichkeit zur Ergänzung und Verbesserung der Standardtherapie des Ovarialkarzinoms zur Verfügung steht.
Prinzipien der Immuntherapie:
I. Parenterale Gabe von Antikörpern gegen Tumorantigene (z.B. CA 125) II. aktive Immunisierung (Vakzination) mit autologen, gereinigten Tumorzellen
III. Gabe von mit Chemotherapeutika, Toxinen oder Isotopen ("Radioimmuntherapie"), konjugierten, monoklonalen Antikörpern.

Gentherapie und Ovarialkarzinom
Gentherapie ist definiert als der Transfer von genetischem Material in eine Zielzelle, um mit der Funktion eines Genes zu interferieren, eine verlorengegangene Funktion wieder herzustellen oder eine neue Funktion zu initiieren. Ursprünglich wurde Gentherapie initiiert, um vererbliche genetische Erkrankungen zu therapieren. Da jedoch die meisten humanen Tumoren das Ergebnis von erworbenen genetischen Veränderungen sind, kann Gentherapie auch potentiell für die Behandlung von malignen Erkrankungen herangezogen werden. Fortschritte in Molekularbiologie, Tumorbiologie, Virologie und Immunologie haben zur Entwicklung von verschiedenen Therapieansätzen und Gentransferstrategien geführt, die erlauben, das gewünschte genetische Material zu übertragen.
Von besonderem Interesse sind Studien mit dem Tumorsuppressorgen p53 oder der "Suizidgentherapie".
Gentherapeutische Vektorstrategien beim Ovarialkarzinom
Für eine erfolgreiche Gentherapie müssen verschiedene Kriterien erfüllt sein.
• Das therapeutische Gen muß durch einen geeigneten Vektor an die Zielzelle gebracht werden.
• Nachdem das Gen an die Zielzelle gebracht wurde, muß eine Expression des therapeutischen Gens auf kontrollierbarem Level erfolgen.
• Das Einbringen des therapeutischen Gens und seine Expression dürfen für Patientin und die Umgebung nicht schädigend sein.
Beim Ovarialkarzinom begünstigen der leichte Zugang zur Peritonealhöhle und die Begrenzung der Erkrankung auf die Bauchhöhle die Entwicklung von Gentherapiestrategien. Eine Anzahl von viralen und nichtviralen Vektorsystemen wurde für die Genübertragung entwickelt. Ein Vektor muß effizienten in vivo Gentransfer erlauben. Rekombinante Retroviren und rekombinante Adenoviren erlauben ein effizientes Übertragen von Genen auf die Tumorzellen in situ. Zudem wurden beim Ovarialkarzinom nichtvirale Liposomen als Vektoren eingesetzt. Eine Gentherapie innerhalb der Peritonealhöhle erlaubt, daß keine Organe außerhalb der Peritonealhöhle in die Behandlung mit einbezogen werden. Der Nutzen eines Genvektorsystems wird zum einen durch die Effizienz des Gentransfers, zum anderen durch das Verhältnis von Sicherheit zu Toxizität bestimmt. Klinische gentherapeutische Phase I Studien haben zum Ziel, die Effizienz des Gentransfers zu verbessern.
Gentherapiebehandlungsstrategien
Gentherapiebehandlungsstragien zielen vor allem auf spezifische Veränderungen von Tumorzellen und pathophysiologische Veränderungen in Tumoren. Als Strategien werden die molekulare Chemotherapie, die Kompensierung von Mutationen, die Immunpotenzierung und die Veränderung der Chemoresistenz eingesetzt.
Molekulare Chemotherapie
Bei der molekularen Chemotherapie werden genetisch codierte Toxine in Tumorzellen eingebracht und selektiv exprimiert, um eine Eliminierung des Tumors zu erreichen. Der therapeutische Index einer konventionellen pharmakologischen Chemotherapie besteht in dem

unterschiedlichen toxischen Effekt für normale und maligne Zellen. Bei der Gentherapie soll das Toxin selektiv in die Tumorzelle eingebracht und exprimiert werden, um den therapeutischen Index zu verbessern. Die Toxinexpression kann durch direkte oder indirekte Strategien erreicht werden.
Molekulare Chemotherapie: Beim direkten Vorgehen wird ein Gen benutzt, das für ein Toxin codiert. Beim indirekten Vorgehen wird eine Vorstufe des Toxins eingesetzt, das durch ein Gen-codiertes Enzym aktiviert werden muß, um in ein toxisches Metaboliten umgewandelt zu werden. Selektive Bereitstellung oder selektive Expression des benötigten Enzyms verbessert den therapeutischen Index.
Beim direkten Vorgehen wird ein Gen benutzt, das für ein Toxin codiert. Beim indirekten Vorgehen wird eine Vorstufe des Toxins eingesetzt, das in einem toxischen Metaboliten aktiviert werden muß, um schließlich zum Zelltod zu führen. Die Spezifität der Tumorzerstörung besteht bei diese Methode darin, daß entweder die Zielzelle durch das Toxin transduziert wird oder transcriptionelle Aktivatoren der Zielzelle benötigt werden, um das Toxingen zu aktivieren (transductional targeting versus transcriptional targeting). Bei der indirekten molekularen Chemotherapie wird das Cytosin-Deaminase-Gen oder das Herpes simplex-Virus Thymidin Kinase-Gen (HSV-TK) benutzt. Cytosin-Deaminase ist ein Enzym, das in prokaryonten Systemen vorkommt und 5-Fluorozytosin in 5-Fluorouracil umwandelt. Da 5-Fluorouracil beim Ovarialkarzinom nur einen limitierten Effekt hat, wird es bei diesem Tumor nicht eingesetzt. Thymidin Kinase ist ein Enzym, das im Rahmen der DNA-Synthese aktiv ist. Die Expression der HSV-TK ist nicht schädigend für Säugetierzellen. In replizierenden Tumorzellen führt die Expression der viralen Thymidin Kinase jedoch zur erhöhten Sensitivität gegenüber Nucleosiden sowie Ganciclovir und Acyclovir. Monophosphorylierung von Ganciclovir durch HSV-TK führt zu einem zytotoxischen Effekt durch die virale Thymidinkinase. Ganciclovir wird durch verschiedene zelluläre Faktoren in eine Triphosphatform phosphoryliert, die in die zelluläre DNA incorporiert wird. Incorporierung der Triphosphatform des Ganciclovirs führt zu Inhibierung von DNA-Synthese und RNA-Polymerase-Aktivität, was wiederum zum Zelltod führt. Da die Säugetierthymidinkinase eine viel geringere Affinität zu Ganciclovir hat, sind normale Zellen resistent gegen den toxischen Effekt von Ganciclovir, wenn dieses Nucleosid in niedrigerer Dosierung verabreicht wird. Replizierende Tumorzellen, die zu einer erhöhten Expression des viralen Thymidinkinasegenes transduziert wurden, besitzen eine verstärkte Zytotoxizität gegen Ganciclovir. Zudem wurde nach Transduktion mit dem Thymidinkinasegen gefunden, daß eine größere Anzahl von Tumorzellen zerstört wurden als erwartet war. Dies wird als das sogenannte "Bystander Effekt" bezeichnet: Endozytose von toxischen Zellresten, Exposition

gegenüber löslichen Toxinen, Zerstörung von Blutgefäßen oder Transfer von phosphorylierten Ganciclovirmolekülen von HSV-TK-positiven Zellen in HSV-TK-negative Zellen durch gap junctions können diesen Effekt erklären.
Kompensierung von Mutationen
Die gezielte Ablation von dominanten Onkogenen, der Ersatz eines veränderten Tumor Suppressorgenes oder die Interferenz mit der Funktion eines Wachstumsfaktors oder ihres Rezeptors kann durch Kompensierung von Mutationen erreicht werden. Ziel der Gentherapie ist entweder direkt die DNA, die Messenger-RNA oder das Proteinprodukt. Oligodeoxynucleotide können an ein dominantes Onkogen auf dem DNA-Level eingesetzt werden und bilden eine Triple Helix. Solch eine Struktur kann durch die Assoziation einer Einzelstrang-DNA mit Doppelstrang-DNA geformt werden, wenn diese auf einem Strang reich an Purinen und auf einem anderen Strang reich an Pyrimidinen ist. Somit kann ein Triplex formendes Oligonucleotid gewählt werden, das als Ziel eine Polypurin-Polypyrimidin enthaltende doppelsträngige DNA hat. Solche Regionen werden häufig in der Regulatorregion Upstream der Zielgene gefunden. Triplex formende Oligonucleotide wurden gegen den C-myc-Promoter, den epidermalen Wachstumsfaktor Receptor Promotor, den erbB-2 Promotor und den H-ras Promotor entwickelt. Die antisense Technologie wird genutzt, um dominante Onkogene auf dem Messenger-RNA-Level anzugreifen. Antisense Oligonucleotide sind RNA-Sequenzen, die zu der Messenger- RNA des interessierenden Genes komplementär sind. Antisense Oligonucleotide binden an die Ziel mRNA und blockieren ein weiteres Ablesen am genetischen Material durch Einschränkung des Transportes, den Stop der Translation oder Initiierung von Degradation der Messenger-RNA.
Mutationskompensierung und Antisense: Antisense-Oligonukleotide sind komplimentär zur messengerRNA (mRNA) des interessierenden Gens, sie binden an die Ziel-mRNA und verhindern die weitere Verarbeitung der genetischen Information.
Optimale Ziele für Antisense Ablation stellen solche Gene dar, von denen keine physiologischen Messenger RNAs vorkommen und damit durch die Antisense RNA ausgeschaltet werden.. Ziele der Antisense Ablation sind mutierte Formen von K-ras und H-ras sowie c-myb, c-myc, insulinähnlicher Wachstumsfaktor 1 Rezeptor, bcr-abl und das p 53-Gen.

Ribozyme sind kleine Oligoribonucleotide, die RNA-Spaltreaktionen an sequenzspezifischen Orten katalysieren. Die "hammer-head" Klasse der Ribozyme kann in eine charakteristische Sekundärstruktur falten, die einem Hammer ähnlich ist und den Ziel RNA-Strang im Bereich von GUA-, GUC oder GUU-Tripletsequenzen spaltet. Ein synthetisches hammer-head-Ribozym kann gegen ein spezifisches Messenger-mRNA-Molekül gerichtet werden. Antisense Sequenzen müssen benutzt werden, die mit der Messenger-RNA an den Stellen hybridisieren, die direkt neben den gewünschten Schnittstellen liegen. Dominante Onkogene, wie H-ras und bcr-abl wurden im Rahmen der Krebsgentherapie durch Ribozyme als Ziel behandelt. Tumor-suppressorgene sind sowohl für die Reparatur von DNA-Schäden als auch für die Induktion von Apoptose und programmierten Zelltod wichtig. Veränderungen des Tumor-Suppressor-Gens p53 werden in 45 % bis 80 % aller primären Ovarialkarzinome gefunden. Eine Wiederherstellung von Tumor-Suppressor-Genen haben sich auf p53, das Retinoblastomogen und BRCA1 focusiert. Dominante negative Mutationen sind Veränderungen der Gensequenz, die nach Translation zu einem Protein führen, das keine Funktion aufweist.
Durch die heterologe Expression eines mutanten Proteins kann die normale Funktion der nativen Genproduktion der Zelle inhibiert werden. Dominante negative Mutationen werden vor allem zur Inhibierung von Proteinen angewandt, die in Multimere assoziieren müssen, um ihre Funktionen auszüben. Mehrere überexprimierte Tyrosinkinase Wachstumsfaktor Rezeptorproteine bestehen aus oligomeren funktionellen Einheiten, die als gute Ziele für die Inhibierung durch dominante negative Mutationen dienen (epidermaler Wachstumsfaktorrezeptor, IGF-1-Rezeptor, Thrombozyten-VEGF-Rezeptor). Single-Chain-Antikörper stellen eine zusätzliche neue Strategie für die Ablation von Proteinprodukten eines dominanten Onkogenes dar. Diese Moleküle bestehen aus einer antigenbindenden variablen leichten und schweren Kette eines Immunglobulinmoleküls, welches durch einen Peptid-Spacer verbunden wird. Die Expression einer subzellulären (im endoplasmatischen Retikulum) Form des Single-Chain-Antikörpers, der gegen ein Onkogenprodukt gerichtet ist, kann dazu führen, daß das entstehende Protein eingeschlossen wird.

Dies verhindert die Tanslokation auf die Oberfläche der Zelle und unterbricht den autokrinen Wachstumsfaktorzyklus, der zur malignen Transformation führt. Intrazelluläre Expression von Single-Chain-Antikörper gegen erb-2 und epidermalen Wachstumsfaktorrezeptor führen zur down-Regulierung der Expression an der Zelloberfläche und auch Inhibierung der zellulären Proliferation.
Immunpotenzierung
Erkenntnisse aus der Tumorimmunologie haben zur Entwicklung von Genstrategietherapien geführt, die auf tumorassoziierten Antigenen basieren und der Fähigkeit des Immunsystems, diese Moleküle zu erkennen und damit die Zerstörung einer Tumorzellpopulation einzuleiten. Dieser Vorgang wird Immunpotenzierung genannt. Man unterscheidet zwei Konzepte, die passive und die aktive Immuntherapie.

Immunpotenzierung: Immunpotenzierung umfaßt Techniken, die zur Verstärkung der Expression bekannter Tumorantigene oder zur Steigerung der Zytokinproduktion führen, um die Immunantwort gegen Tumorzellen zu verbessern.
Bei der passiven Immuntherapie werden präformierte immunologische Elemente benutzt, die die Immunantwort gegen Tumorzellen augmentiert. Tumorinfiltrierende Lymphozyten oder tumorassoziierte Lymphozyten werden isoliert und in vitro expandiert. Nach Expansion werden die Lymphozyten wieder in die Patientin eingebracht. Zusätzlich kann Gentransfertechnologie benutzt werden, um die expandierte Zellpopulation zu modifizieren, um die Produktion von Zytokinen zu verstärken oder Bewegungsmuster der tumorassoziierten Lymphozyten vor Reimplantation zu beeinflussen. Studien in der passiven Immuntherapie haben sich vor allem auf die Reorientierung der immunologischen Verhaltensmuster von CD8 positiven Tumor infiltrierenden Lymphozyten konzentriert, die durch genetische Veränderungen chimäre Antikörper/T-cell Rezeptorgene exprimieren. Zudem wurden Lymphozyten dahingehend genetisch verändert, daß sie Interleukin-2 und Tumornekrosefaktor alpha in erhöhter Konzentration sezernieren. Die aktive Immuntherapie initiiert oder augmentiert eine Immunantwort gegen vorher nicht erkannte oder schwach immunogene Tumorantigene. Aktive Immuntherapie beinhaltet Techniken, die die Expression von bekannten Tumorantigenen erhöhen oder die lokale Konzentration von Zytokinen und kostimulatorischen Molekülen augmentieren, um die Immunantwort gegen noch unidentifizierte Tumorantigene zu erhöhen. Anstrengungen bzgl. Augmentierung der Immunantwort durch erhöhte Expression von bekannten Tumorantigenen haben sich darauf konzentriert, Konstrukte herzustellen, die diese tumorassoziierten Antigene codieren, um eine Immunantwort gegen das fremde Antigen einzuleiten. Studien, die das humane carcinoembryonale Antigen benutzten, haben gezeigt, daß eine humorale und zelluläre Immunantwort sowie ein Schutz gegen syngenes carcinoembryonales Antigen exprimierende Kolonkarzinomzellen erreicht werden können. Bei Patientinnen mit Ovarialkarzinom wurden zytotoxische T-Zellen gegen das erb-2 Oncoprotein nachgewiesen, was suggeriert, daß dieses Molekül als tumorassoziiertes Antigen fungieren kann. Um eine Immunantwort gegen unbekannte Antigene auszulösen wurden Genstrategietherapien entwickelt, die eine lokale immunologische Antwort unterstützen. Tumorzellen werden genetisch modifiziert, um die Antigen-Erkennung von tumorassoziierten Antigenen zu verstärken. Gene, die für Zytogene, akcessorische Moleküle oder MHC-Antigene codieren, werden benutzt. Dieser Ansatz wird "genetische Tumorvaccine" genannt und wurde auch beim Ovarialkarzinom eingesetzt.

Chemoresistenz (Multi-Drug Resistance, MDR)
Die Antwort von Krebszellen auf Chemotherapie hängt vor allem von der Dosierung ab. Eine intensivierte konventionelle Chemotherapie hindert die Tumorzelle am Überleben. Epitheliale Tumoren besitzen jedoch das drug efflux pump glycoprotein (p170) und die MDR1 cDNA. Dies hat dazu geführt, das MDR1-Gen in hämatopoetische Stammzellen zu transferieren, um eine Resistenz gegen konventionelle chemotherapeutische Agentien zu erreichen.
Second look Operation oder Nachschauoperation
Deutlich voneinander zu differenzieren sind folgende verschiedene Arten operativer Eingriffe nach der Primäroperation des Ovarialkarzinoms:
I. Komplettierungsoperation nach inkomplettem ersten Eingriff II. Sekundäres Debulking (Interventions-Laparotomie nach Remission auf initiale
Chemotherapie) III. Second look Operation IV. Nachoperation bei Tumorpersistenz trotz vollständiger Chemotherapie ("second
effort") V. Operation beim Rezidiv (Früh- oder Spätrezidiv)
VI. Palliative Operation
Der Begriff der "Second look" (SLO) Operation steht für die aus diagnostischen Gründen durchgeführte und geplante Zweitlaparotomie beim Ovarialkarzinom, wenn nach Operation und Chemotherapie (4 bis 6 Zyklen) mit klinischen, laborchemischen und apparativen Methoden eine Komplettremission festgestellt und mit anderen Methoden kein persistierender Tumor nachgewiesen werden kann. Der Tumormarker CA 125 zeigt, wenn erhöht, das Vorhandensein von Tumor mit 100 % Genauigkeit an, ein negatives CA 125 kann jedoch Tumor nicht ausschließen. Auch andere nicht-invasive Untersuchungsmethoden können den Nachweis einer echten Vollremission nicht führen. Deshalb besteht die einzige Möglichkeit, Tumorfreiheit nachzuweisen, in der Durchführung der second look Operation.
Übersicht über die diagnostische Wertigkeit verschiedener Tumormarker vor einer Second look Operation
Sensitivität Spezifität positiv-prädiktiver Wert
negativ-prädiktiver Wert
CA 125
(Fioretti et al., 1992; Meier et al., 1988; Schwartz et al., 1987)
33-48 % 93-10% 91-100% 44-60%
CA 15-3
(Panici et al., 1989)
69%* 100% 100% 77%
CA 72-4 38% 100% 100% 43%

(Scambia et al., 1990)
D-Dimer
(Khoo et al., 1988)
91% 50% 66% 82%
CASA
(Ward et al., 1993)
56% 8% 77% 71%
* vorwiegend große Tumormassen
Aus dem Ergebnis einer second look Operation können folgende Therapieoptionen abgeleitet werden:
• "Consolidation"-Therapie: adjuvante Chemotherapie, um ein Rezidiv nach negativer second look OP zu verhindern
• "Salvage" - Therapie: Versuch der kurativen Chemotherapie bei positiver second look mit "sekundärem debulking".
Mehrere Studien haben jedoch gezeigt, daß die Überlebenszeit durch die second look Operation nicht beeinfluß wird, wobei die Operationen ein Risiko für die Patientin darstellt. Deshalb wird eine strenge Indikationsstellung zur second look Operation gefordert, und sie sollte nicht mehr fester Bestandteil der Primärtherapie des Ovarialkarzinoms sein.
Bei echten Rezidiven nach optimaler primärer Tumorreduktion können erneute operative Eingriffe jedoch sinnvoll sein. Es besteht die Chance, nochmals Tumorfreiheit durch Entferung des Rezidives zu erreichen, wodurch positive Effekte auf die Überlebenszeit zu erwarten sind. Alte Patientinnen, die bei der Erstoperation Resttumor hatten oder in einem schlechten Allgemeinzustand sind, haben keinen Nutzen von einer second effort Operation.

Die Radiotherapie nach second look kann bei auf kleine Areale begrenztem Tumorbefall als alternatives Verfahren dienen. Hierbei ist die Überlebensrate auch eng mit dem primären Tumorstadium bzw. dem Ergebnis der second look Operation korreliert.
Extraovarielles peritoneales serös papilläres Karzinom
Neben dem primären Ovarialkarzinom ist ein von Peritoneum ausgehender metastasierender Tumor nicht selten und wird unter dem Verdacht eines Ovarialkarzinoms operiert. Folgende Synonyme werden für dieses Krankheitsbild verwandt:
• Mesodermoma • Papilläres Karzinom des Peritoneum • Serös papilläres Karzinom • Seröser Tumor des Beckens • Ovarielles Karzinom - Syndrom von normaler Größe • multifokale extraovarielles seröses Karzinom • extraovarieller Tumor des serös papilläres Typs • papillär seröser Tumor des Peritoneum • extraovarielles peritoneales serös papilläres Karzinom.
Zur Einordnung unter einen der oberen Begriffe müssen beide Ovarien entweder normal groß sein oder dürfen nur durch einen benignen Prozeß vergrößert sein. Die extraovarielle Beteiligung muß größer sein als ovarielle. Es sollten keine ovariellen Komponenten vorliegen oder die Oberfläche ohne Nachweis einer kortikalen Invasion betroffen sein oder Oberfläche und Rinde sind zu einer Größe unter 5x5 mm involviert. Histologisch sollten seröse Veränderungen im Sinne eines papillären Adenokarzinoms vorherrschen (Bloss et al., 1993).
Zwischen 9 und 15 % aller Ovarialkarzinome sind peritoneale Karzinome (Fromm et al., 1990, Lele et al., 1988, Dalrymple et al., 1989; Killackey et al., 1993).
Als Entstehungsmechanismus werden angeführt:
1. Peritoneum und embryonales "Keimepithel" des Ovars entstammen demselben mesodermalen Ursprung und unterliegen deshalb dem gleichen Entartungsrisiko (Müller’sches Epithel und peritoneales Mesothel gehen aus Zölomepithel hervor).
1. Karzinome des Peritoneum gehen von maligne veränderten Zellnestern aus, die als ovarielles Restgewebe auf dem embryonalen "Weg" der Urkeimzellen im Bauchraum verblieben sind (Migration der Urkeimzellen aus dem Dottersack über Mesodem in Urogenitalleiste).
Die Symptome entsprechen den des fortgeschrittenen Ovarialkarzinoms mit rascher abdomineller Umfangszunahme, Bauchschmerz und tastbarem Tumor.
Im CT oder MRT bzw. bei der operativen Exploration erkennt man multifokale peritoneale Tumoren und Ovarien von normaler Größe, entweder nicht involviert oder mit kleinen Tumor - Implantaten auf der Oberfläche.
Histologisch ist auch mittels immunhistochemischer Verfahren kein Unterschied zum papillären Ovarialkarzinom zu finden. CA 125 ist in gleicher Häufigkeit wie bei einem primären Ovarialkarzinom erhöht.

Das Behandlungsregime ist identisch wie beim primären Ovarialkarzinom und besteht im primären Tumordebulking gefolgt von Kombinationschemotherapie.
Keimstrang-Stroma-Tumoren des Ovars
An Keimstang-Stroma-Tumoren des Ovars unterscheidet man
• Fibrom, • Thekazelltumor (Thekom), • Granulosazelltumor (GCT), • Sertoli-Leydig-Zelltumor (Arrhenoblastom), • Hiluszelltumor und • Gynandroblastom
Der Granulosazelltumor ist der häufigste Keimstrang-Stroma-Tumor, wobei man einen adulten und juvenilen Typ unterscheidet.
44 % des juvenilen Types kommen vor dem 10. Lebensjahr und weitere 34 % vor dem 20. Lebensjahr vor, wobei die 5-Jahres-Überlebensrate bei 94,4 % liegt (Young and Scully, 1984).
Eine Abgrenzung gegenüber dem Karzinoid oder einem undifferentierten Karzinom ist manchmal schwierig und folgende Kriterien können hierbei hilfreich sein.

Ca. 5 % aller Granulosazelltumoren verhalten sich maligne und metastasieren. Diese Metastasierung kann schon bei der Primärdiagnose vorhanden sein, so daß für diese Tumoren bei der Erstoperation ein ausgedehntes intra- und retroperitoneales Staging obligat ist. Wegen der möglichen Koinzidenz des Granulosazelltumors mit einem Endometriumkarzinom sollte gleichzeitig die Kürettage durchgeführt werden.
Histologische Kriterien oder Ploidiegehalt sowie Zellproliferationsrate erlauben keinen Rückschluß auf das biologische Potential des untersuchten Tumors (Hitchcock et al., 1989; Chada et al., 1990). Eine weitere Studie fand allerdings einen signifikanten Zusammenhang zwischen Überlebensrate sowie Ploidiegehalt oder S-Phaseindex, wobei jedoch der positive Vorhersagewert für den Ploidiegehalt nur bei 60 %, für den S-Phaseindex bei 67 % lag (Klemi et al., 1990).
Beim metastasierenden Granulosazelltumor kommt eine Kombinationtherapie von Cisplatin, Vinblastin und Bleomycin in Frage, wobei an einer kleinen Fallzahl (n=11) gezeigt werden konnte, daß Patientinnen mit Resttumor von weniger als 2 cm in jedem Fall eine komplette Remission erhielten (Colombo et al., 1986). Bei verbliebenem Tumorrest ist auch eine Strahlentherapie möglich (strahlensensibel).
Beim Granulosazelltumor können noch bis zu 25 Jahre nach Erstdiagnose Rezidive auftreten. Daher haben nur Überlebensstatistik von mindestens 25 Jahren Dauer eine valide Aussagekraft. Tumorgröße sowie prä- oder intraoperative Ruptur sind entscheidende prognostische Faktoren (Gutachten). So liegt die 25-Jahres-Überlebensrate für rupturierte Tumoren bei nur 60 %, für nicht rupturierte bei 83 % (p< 0,0001); bei einer Tumorgröße von weniger als 5 cm überlebten 100 % der Patientinnen, verglichen mit nur 92 % bei Tumorgröße ≥ 5 cm (nicht signifikant) (Bjoerkholm und Silverswaerd, 1991).
Keimzelltumoren
Alle Keimzelltumoren leiten sich von der primordialen Keimzelle ab.
Klassifizierung der Keimzelltumoren des Ovars mit Angabe der jeweiligen Reaktion der Tumormarker AFP und HCG

20 bis 30 % aller benignen und malignen Ovarialtumoren sind Keimzelltumoren. Nur 3 % der Keimzelltumoren sind maligne. Bei Frauen unter 20 Jahren sind 70 % der Ovarialtumoren Keimzelltumoren; davon sind 1/3 bösartig. Als Behandlung ist beim malignen Keimzelltumor die unilaterale Tumorentfernung meist ausreichend und somit eine Erhaltung der Fertilität möglich. Liegt eine Metastasierung vor, so kommt die Chemotherapie in Frage, die in identischer Weise wie bei den Keimstrang-Stroma-Tumoren durchgeführt wird (Cisplatin, Vinblastin, Bleomycin). Eine weitere Möglichkeit stellt das folgende Schema dar:
Diese Tumoren sprechen sehr gut auf Chemotherapie an. Bei der primären Operation sind ein ausgedehntes intra- und retroperitoneales Staging obligat.
Empfehlungen zur Tumornachsorge bei gynäkologischen Malignomen
Nachsorge - Ovarialkarzinom
Allgemein:
Für die Nachsorge gynäkologischer Malignome gelten folgende Empfehlungen zum zeitlichen Abstand der Konsultationen:
Zeitraum 1. Jahr 2. Jahr 3. Jahr 4. Jahr 5. Jahr
Häufigkeit ¼ jährlich ¼ jährlich ¼ jährlich ½ jährlich ½ jährlich
• Untersuchungsabstände sollten risikoadaptiert variiert werden • Grundsätzlich erbringen Tumormarkerbestimmungen und routinemäßige apparative
Untersuchungen keinen prognostischen Vorteil. Sie sind nur symptomorientiert einzusetzen.
Speziell:
• Tumorspezifische Anamnese (Schmerzen, Völlegefühl, Inappetenz oder Zunahme des Bauchumfangs, Gewichtsverlust)
• rectovaginale Untersuchung, Kolposkopie der Scheide mit Essigsäure- und Jodprobe • Sonografie (Aszites, Nierenstau, solid-zystische Tumoren im Becken) • Tumormarker CA 125 (nur falls bei der Primärdiagnose erhöht) • Test auf okkultes Blut im Stuhl jährlich (gastrointestinales Zweitkarzinom)
Mammografie und Mammasonografie jährlich (Mamma-Zweitkarzinom)
(Video "Dermoidzyste" )
(Fallbeschreibung: Keimzelltumor, Ovarial-CA, Trophoblast, Teratom, Rezidiv-Ovarialkarzinom )

Fragen
Kontrazeptiva und Risiko für Ovarialkarzinom
Eine 37jährige Patientin ist besorgt über ihr Risiko, an einem Ovarialkarzinom zu erkranken. Sie hat ein orales Kontrazeptivum im Alter von 25 Jahren über 1 Jahr eingenommen und fragt, ob die Einnahme der Pille ihr Risiko für Ovarialkarzinom erhöht hat.
Antwort
Die Einnahme von oralen Kontrazeptiva vermindert das Risiko für Ovarialkarzinom um ca. 40 %.
Diskussion
Mehrere epidemiologische Studien haben gezeigt, daß die Einnahme von oralen Kontrazeptiva das Risiko, an einem Ovarialkarzinom zu erkranken, deutlich vermindert. Dabei haben Kombinationspräparate einen erhöhten protektiven Effekt, verglichen mit Sequenzpräparaten. Dieser Effekt beginnt bereits 3 Monate nach Einnahmebeginn und steigt während der ersten 5 Jahre leicht an. Das geringste Risiko wird bei Frauen beobachtet, die orale Kontrazeptiva über 10 Jahre eingenommen haben. Dieser Effekt wird u. a. darauf zurückgeführt, daß Ovulationen unterbunden werden. Ovulationen scheinen für die Entstehung des Ovarialkarzinoms von Bedeutung.
Asymptomatische Ovarialzyste
Eine 39jährige Patientin kommt zur gynäkologischen Routineuntersuchung. Sie hatte bisher eine Untersuchung pro Jahr, reguläre Menstruationsblutungen und benutzt ein Diaphragma zur Kontrazeption. Bei der Beckenaustastung zeigt sich ein glatter, asymptomatischer, mobiler Adnextumor von 5 cm Durchmesser, der als Ovarialzyste imponiert. Welche weiteren diagnostischen und ggf. therapeutischen Maßnahmen sind indiziert?
Antwort
Die Bestimmung des Tumormarkers CA 125 sollte durchgeführt werden. Da die angeführten sonographischen Kriterien nicht auf Malignität hindeuten, kann bei normalem CA 125 abgewartet werden. Sollte sich innerhalb von 3 Monaten keine Veränderung ergeben, ist die diagnostische operative Laparoskopie angezeigt.
Diskussion
Die sonographischen Prognosefaktoren Durchmesser <5 cm, rein zystisch, ohne solide Anteile, glatte Begrenzung und fehlende Septierung sprechen für einen gutartigen Prozeß. Zugleich sollten keine Anzeichen für Aszites vorliegen. Liegt zudem der Tumormarker CA 125 im Normbereich, ist ein exspektatives Verhalten für 6 - 12 Wochen möglich. Dann sollte jedoch laparoskopisch abgekärt werden. Es kann zusätzlich eine Doppler-Untersuchung durchgeführt werden. Ein Resistenz-Index von≥ 0,8 ist auch als prognostisch günstig einzustufen. Zeigen CA 125 und Sonographie oder Doppler keinen Anhalt für Malignität, so kann mit Sicherheit davon ausgegangen werden, daß kein malignes Geschehen vorliegt (Sensitivität und negativer Vorhersagewert der Kombination beider Methoden 100 %).

Ovarialtumor in der Schwangerschaft
Eine 24jährige Gravida 1, Para 0 kommt zu ihrer ersten Schwangerenvorsorgeuntersuchung in der 10. Schwangerschaftswoche. Bei der Untersuchung zeigt sich ein 10 cm großer, weicher, zystischer, nicht schmerzhafter Tumor im Bereich der linken Adnexe. Eine Ultraschalluntersuchung zeigt eine unilokuläre, dünnwandige Zyste ohne soliden Anteil.
Wie lautet die Differentialdiagnose und wie würden Sie weiter vorgehen?
Antwort
Es handelt sich hierbei am ehesten um eine Corpus-luteum-Zyste. Differentialdiagnostisch kommen primär ein Zystadenom, ein zystisches Teratom, ein erweichtes Leiomyom oder eine Beckenniere in Frage.
Diskussion
Glattwandige Zysten unter 6 cm Größe sind in der Schwangerschaft fast immer Corpus-luteum-Zysten, die sich nach 14 - 16 Wochen spontan zurückbilden. Neoplasien des Ovars haben eine Inzidenz von 1 auf 1 000 Schwangerschaften, wobei die Malignitätsrate bei 2,4 % liegt. Duch das Uteruswachstum kann es in seltenen Fällen zu einer Stieldrehung kommen. Thekaluteinzysten kommen durch HCG-Überstimulation bei Blasenmole in 25 - 60 % der Fälle vor. Sind sonographische Kriterien und Tumormarker verdächtig, so wird eine invasive Abklärung am besten nach der 16. Schwangerschaftswoche durchgeführt. Die Laparoskopie ist hierbei häufig nicht die Methode der Wahl, da die Zyste hinter der Gebärmutter liegt und schwer zugänglich ist.
Abgrenzung zwischen Borderline-Tumor und invasivem Karzinom
Eine 25jährige Patientin hat einen großen pelvinen Tumor. Bei der Laparotomie zeigt sich eine unilokuläre Zyste mit papillären Projektionen. Im Schnellschnitt erhebt sich die Frage, ob es sich um einen Borderline-Tumor oder ein invasives Karzinom handelt.
Welches ist hierbei für die histologische Abgrenzung das wichtigste Kriterium?
Antwort
Der Nachweis der Stromainvasion durch maligne epitheliale Zellen ist das wichtigste Kriterium bei der histologischen Abgrenzung.
Diskussion
Im Schnellschnitt ist häufig die Abgrenzung zwischen Borderline-Tumor oder invasivem Karzinom nicht möglich. Dies hat auch keine direkten Konsequenzen für den Ablauf und die Ausdehnung der Operation, da bei einer 25jährigen Patientin ein Borderline-Tumor identisch zum invasiven Karzinom operiert und "gestaged" werden sollte. Liegt ein einseitiger Befund vor, so wird das kontralaterale Ovar biopsiert. Es werden zudem multiple Biopsien des Beckenperitoneums entnommen und eine unilaterale pelvine und paraaortale Lymphonodektomie mit Präparation und Resektion der Ovarialgefäße der betroffenen Seite durchgeführt. Eine Netzbiopsie sowie simultane Appendektomie und Douglas-Lavage zur Entnahme einer zytologischen Untersuchung sind ebenso obligat. Bei der histologischen

Untersuchung sind die Parameter mitotische Aktivität und zytologische Atypie für die Differentialdiagnose Borderline-, invasives Karzinom nicht sinnvoll. Die Stromainvasion ist entscheidend für die Diagnose invasiver Karzinome. Für Borderline-Tumoren des Ovars wird eine 5-Jahres-Überlebensrate von 95 %, eine 10-Jahres-Überlebensrate von 90 % angegeben. 20 % der Patientinnen mit Borderline-Tumoren haben schon intraperitoneale oder retroperitoneale Metastasen bei Erstdiagnose und trotzdem eine exzellente Prognose. Wichtig ist, daß bei Aufarbeitung des OP-Präparates pro 1 cm Tumor mindestens ein histologischer Schnitt angefertigt wird, um eine Invasion auszuschließen.
Operatives Vorgehen bei Borderline-Tumoren des Ovars
Bei einer 23jährigen Gravida 0, Para 0 zeigt sich im Bereich des rechten Ovars eine persistierende Zyste von 7 cm Durchmesser. Die Zyste wird exstirpiert, und die Schnellschnittuntersuchung ergibt einen serösen Tumor vom Borderline-Typ. Das andere Ovar sieht makroskopisch normal aus, und auch die Inspektion des gesamten Abdomens zeigt keine Auffälligkeiten. Wie gehen Sie weiter intraoperativ vor?
Antwort
Es werden Spülungen im Bereich des kleinen Beckens und des Abdomens durchgeführt und für die zytologische Untersuchung entnommen. Rechts wird eine komplette Adnexektomie durchgeführt, zudem erfolgt die partielle Omentektomie. Es werden multiple peritoneale Biopsien im Bereich des kleinen Beckens entnommen und eine pelvine und paraaortale Lymphonodektomie rechts durchgeführt.
Diskussion
Wurde der Primäreingriff laparoskopisch durchgeführt, so kann er laparoskopisch weitergeführt werden. Eine Laparotomie ist nicht notwendig, wenn die oben vorgegebenen Operationsschritte komplett durchgeführt werden. Das Risiko für die Mitbeteiligung des anderen Ovars liegt bei 5 - 10 %, so daß eine Biopsie des kontralateralen Ovars angezeigt erscheint. Wird lediglich eine Zystektomie des Borderline-Tumors durchgeführt, so liegt das Risiko für ein Rezidiv zwischen 8 - 40 %. Ein solches Vorgehen erscheint nur dann ratsam, wenn Borderline-Tumoren beidseitig voliegen.
Genetische Belastung für Ovarialkarzinom
Eine 34jährige Patientin kommt zu Ihnen mit der Frage des Risikos für Ovarialkarzinom. Mutter und Schwester sind am Ovarialkarzinom gestorben, und die Patientin ist besorgt über ihr eigenes Risiko. Welche Informationen können Sie ihr geben?
Antwort
Das Risiko für die Entwicklung eines Ovarialkarzinoms liegt für diese Patientin bei ca. 50 %.
Diskussion
Ca. 5 - 10 % aller Ovarialkarzinome sind familliär bedingt. Frauen mit Verwandten 1. Grades mit Ovarialkarzinom besitzen das höchste Risiko. Ebenso zählen das Vorkommen von Mammakarzinom und Colonkarzinom in der Familienanamnese als Risikofaktoren. Lag bei zwei Verwandten 1. Grades (wie in diesem Fall bei Mutter und Schwester) ein

Ovarialkarzinom vor, so liegt das Risiko für die Entwicklung eines Ovarialkarzinoms bei 50 %. Gleichzeitig ist das Risiko für Brust-, Endometrium- und Dickdarmkarzinom erhöht. Als Untersuchungsmethoden gelten die gynäkologische Untersuchung, die Ultraschalluntersuchung und die regelmäßige Bestimmung des CA 125. Ob die Einnahme von Ovulationshemmern beim vererbten Ovarialkarzinom protektiv wirkt, ist nicht geklärt. Beim sporadischen Ovarialkarzinom wird das Risiko nach einjähriger Einnahme von Ovulationshemmern um bis zu 40 % reduziert. Liegt bei zwei Verwandten 1. Grades ein Ovarialkarzinom vor, so wird die prophylaktische Oophorektomie empfohlen. Allerdings bietet diese keinen 100 %igen Schutz, da ein intraperitoneales Karzinom seinen Ausgang auch außerhalb der Ovarien direkt vom Peritoneum nehmen kann.
Diagnostik bei Verdacht auf Ovarialkarzinom
Eine 58jährige Patientin klagt über Appetitmangel und Zunahme des Bauchumfangs. Die körperliche Untersuchung zeigt einen großen irregulären Tumor von 15 cm Durchmesser im Bereich des Beckens und unteren Abdomens. Es besteht auch Verdacht auf Aszites. Welche präoperativen diagnostischen Maßnahmen sind bei dieser Patientin notwendig?
Antwort
Es sollte ein Ultraschall durchgeführt, CA 125 bestimmt und ein Röntgen-Thorax angefertigt werden. Potentiell kann ein Computertomogramm von Abdomen und Becken angefertigt werden, um die Ausdehnung der Erkrankung (vor allem im Oberbauch, im Bereich des großen Netzes und im kleinen Becken) zu beurteilen.
Diskussion
Die Patientin mit den geschilderten Symptomen und Befunden sollte einer invasiven Diagnostik zugeführt werden. Die wichtigste Differentialdiagnose bei Aszites ist die Leberzirrhose: Wird bei einer Patientin mit Aszites aufgrund einer Lebererkrankung eine primäre Laparotomie durchgeführt, so kann dies die Prognose der Patientin aufgrund der Narkose und des großen operativen Eingriffes deutlich verschlechtern. Daher empfiehlt sich, in Zweifelsfällen primär zu laparoskopieren und den Unterbauchtumor bzw. die Peritonealkarzinose laparoskopisch zu sichern. Hiermit kann die unnötige Laparotomie bei Patientinnen mit Lebererkrankung vermieden werden. Die präoperative Durchführung eines Computertomogrammes ist meist unnötig und ohne Konsequenz. Ähnliches gilt für die Durchführung eines Colon-Kontrasteinlaufes. Differentialdiagnostisch muß immer an ein Colonkarzinom gedacht werden. Dies kann jedoch häufig erst intraoperativ entschieden werden. Da vor jeder Operation mit Verdacht auf Ovarialkarzinom eine ausgiebige Darmspülung durchgeführt wird, ist immer eine Operation am Darm (möglichst mit Kontinuitätsresektion) möglich, unabhängig, ob der Primärtumor von Ovar oder Colon ausgeht.
Stadienzuteilung bei Ovarialkarzinom
Bei einer 58jährigen Patientin mit einem großen pelvinen Tumor zeigte eine präoperative Thoraxaufnahme keinen Pleuraerguß. Bei der Laparotomie zeigen sich Aszites und auf beiden Seiten 8 cm große multizystische Ovarialtumoren. Papilläre Tumorknoten zwischen 0,5 und 1,5 cm Durchmesser liegen auf dem pelvinem Peritoneum, Mesenterium des Dünndarms und auf der Leberkapsel. Die paraaortalen Lymphknoten waren makroskopisch nicht vergrößert, zeigen aber mikroskopisch Metastasierung. Der Aszites war negativ für maligne Zellen. Um

welches Ovarialkarzinom-Stadium handelt es sich, welche Therapie schlagen Sie vor und welche Prognose besteht bei der Patientin ?
Antwort
Stadium IIIC, operatives "debulking", kombinierte Chemotherapie, 5-Jahres-Überlebensrate 30 %.
Diskussion
Zusätzlich zum FIGO Stadium IIIC (Metastasierung in die paraaortalen Lymphknoten) sind Grading, Alter, Radikalität der Operation und Ergebnis der second look Laparotomie unabhängige Prognosefaktoren. Standardtherapie bei dieser Patientin wäre eine postoperative Kombinationsbehandlung aus einem platinhaltigem Chemotherapeutikum (Cisplatin oder Carboplatin) mit Cyclophosphamid. Diese Behandlung wird in dreiwöchigem Abstand über sechs Zyklen durchgeführt. Fällt das CA 125 bereits mit dem zweiten Chemotherapiezyklus wieder auf Normalwerte ab (kleiner als 35 IU/ml), ist dies ebenso ein prognostisch günstiger Faktor. Für Patientinnen, bei denen im Rahmen der Erstoperation kein optimales "debulking" möglich war, wird eine Kombinationsbehandlung aus einem platinhaltigen Chemotherapeutikum und Doxitacel empfohlen. Dieses Schema hat eine signifikant höhere Ansprechrate als eine Kombination von Platin und Cyclophosphamid. Bei solchen suboptimal debulkten Patientinnen empfiehlt sich, bereits nach drei Zyklen eine zweite Operation (Laparoskopie oder ggf. Laparotomie) durchzuführen und hierbei, falls notwendig ein sekundäres "debulking" bei noch bestehendem Resttumor durchzuführen ("second effort"). Hiermit kann das rezidivfreie Intervall solcher Patientinnen signifikant verlängert werden.
Erhaltung der Fertilität bei frühem Ovarialkarzinom
Eine 29jährige Gravida 1, Para 1, wurde in der 38. Woche per Kaiserschnitt entbunden. Dabei zeigte sich eine 7 cm große Zyste im Bereich des linken Ovars. Es wurde eine Adnexektomie links durchgeführt. Ein Schnellschnitt zeigte ein seröses Adenokarzinom, Grading 1. Eine abdominale Lavage und Staging-Biopsien waren alle negativ. Das Kind starb am 3. postoperativen Tag wegen schwerer Mißbildungen. Die Patientin möchte weiterhin ihre Fertilität behalten. Wie stufen Sie die Erkrankung ein, welche Prognose hat die Patientin und welche weitere Therapie ist notwendig?
Antwort
Bei der Patientin handelt es ich um ein Ovarialkarzinom Stadium IA, Grading 1 mit einer 5-Jahres-Überlebensrate von mehr als 90 %, wenn keine weitere Therapie mehr erfolgt.
Diskussion
Beim Stadium IA Grading 1 ist die einseitige Adnexektomie ausreichend. Um jedoch die Stadienzuordnung zu validieren, sollte der Lymphknotenstatus pelvin und paraaortal mittels Laparoskopie auf der Seite des betroffenen Ovars in einer weiteren Operation evaluiert werden. Eine engmaschige Nachsorge mit vierteljährlichen gynäkologischen Untersuchungen, Bestimmung von CA 125 und Ultraschall erscheinen indiziert. Zusätzlich sollte nach 6 oder 12 Monaten eine Kontrollaparoskopie durchgeführt werden. Eine weiterführende Behandlung erscheint bei dieser Patientin mit Kinderwunsch nicht notwendig. Bei einer Patientin ohne

Kinderwunsch bzw. in der Postmenopause wäre eine Hysterektomie mit Adnexektomie der kontralateralen Seite sowie Lymphknotensampling empfehlenswert.
Behandlung bei frühem Ovarialkarzinom
Bei einer 47jährigen Patientin mit papillärem serösen Zystadenokarzinom des linken Ovars Stadium IA, Grading 3, wurden das innere Genitale entfernt, eine partielle Omentektomie durchgeführt und multiple Biopsien vom Peritoneum entnommen. Ist eine weitere Therapie notwendig und wenn ja, welche?
Antwort
Bei dieser Patientin besteht eine Rezidivrate von ca. 25 - 50 %, so daß eine systemische oder intraperitoneale Chemotherapie durchgeführt werden sollte. Vorher sollte die laparoskopische pelvine und paraaortale Lymphonodektomie erfolgen.
Diskussion
Beim frühen Ovarialkarzinom unterscheidet man die sogenannten "low risk" von "high risk" Fällen. "Low risk" Fälle sind Stadium IA oder IB und Grading 1 oder 2. "High risk" Fälle sind Stadium IA oder IB mit Grading 3 und Stadium IC sowie Stadium IIA, IIB oder IIC. Patientinnen mit "low risk" frühem Ovarialkarzinom haben eine 5-Jahres-Überlebensrate von 95 %, während bei "high risk" frühem Ovarialkarzinom eine Rezidivrate von bis 50 % besteht, wenn keine adjuvante Therapie durchgeführt wird. Die 5-Jahres-Überlebensrate für das "high risk" frühe Ovarialkarzinom kann durch eine adjuvante Chemotherapie auf 80 % erhöht werden. In Frage kommt systemische Chemotherapie, die intraperitoneale Radiotherapie mit P32 hat sich nicht bewährt. Als systemische Chemotherapie käme am ehesten ein platinhaltiges Schema in einer Kombination von Cis- oder Carboplatin mit Cyclophosphamid in Frage. Hierbei kann diskutiert werden, ob im Gegensatz zur Standardbehandlung statt sechs nur drei Zyklen verabreicht werden. Vor der Chemotherapie sollte der Lymphknotenstatus pelvin und paraaortal evaluiert werden (am besten laparoskopisch).
Beckenrezidiv bei Ovarialkarzinom
Bei einer Patientin mit einem papillären serösen Ovarialkarzinom Stadium III, Grading 3, wurde eine totale abdominale Hysterektomie mit bilateraler Salpingo-Oophorektomie und Omentektomie durchgeführt. Anschließend erfolgten 8 Chemotherapiezyklen, die Cisplatin enthielten. Bei der second look Laparotomie, die eine Dissektion von pelvinen und paraaortalen Lymphknoten einschloß, wurden nur histologisch negative Gewebeproben gewonnen. 18 Monate später zeigt sich bei der Patientin ein asymptomatischer Tumor am Scheidenende von 4 cm Durchmesser. Was ist die wahrscheinlichste Erklärung für diesen Befund und wie gehen Sie weiter diagnostisch und therapeutisch vor?
Antwort
Der Tumor am Scheidenende ist am ehesten auf ein Rezidiv des Ovarialkarzinoms zurückzuführen. Eine Resektion mit intraabdominalem Staging und falls notwendig "debulking", gefolgt von einer second line Chemotherapie, sind indiziert.
Diskussion

Auch nach negativer second look Operation liegt die Rezidivrate zwischen 40 und 50 %, wobei die häufigsten Rezidive im Abstand von 1 bis 2 Jahren nach second look auftreten. Als prognostische Risikofaktoren für ein Rezidiv sind vor allem Stadium, Grading, Radikalität der Erstoperation und Ansprechen der Chemotherapie (anhand der Tumormarker) am aussagekräftigsten. Da ein "sekundäres debulking" den gleichen Effekt wie das primäre "debulking" hat, erscheint bei dieser Patientin die invasive Diagnostik kombiniert mit sekundärem "debulking" indiziert. Als second line Chemotherapie käme bei ihr ein Schema in Frage, welches Docetaxel enthält. Es ist bei einem Rezidiv, wie hier, auch eine Reinduktionstherapie mit Carboplatin möglich.
Keimzelltumor
Ein Chirurg, der gerade ein 14jähriges Mädchen bei Verdacht auf akute Appendizitis operiert, fragt um Ihren Rat. Er fand einen 7 cm großen soliden Tumor im Bereich des rechten Ovars. Das linke Ovar erscheint makroskopisch normal. Im Schnellschnitt zeigte sich ein maligner Keimzelltumor von unklarer Klassifikation. Welche weiteren Schritte soll er durchführen?
Antwort
Intraoperativ sollten die Serummarker Alpha-Fetoprotein, HCG sowie CA 125 abgenommen werden. Als weitere diagnostische Schritte sollte eine peritoneale Lavage zur zytologischen Untersuchung, eine Adnexektomie rechts, eine Inspektion des linken Ovars, eine sorgfältige Inspektion der Abdominalhöhle ggf. mit Peritonealbiopsien, eine partielle Omentektomie und ein Sampling der retroperitonealen Lymphknoten pelvin und paraaortal rechts mit Resektion der ovariellen Gefäße inklusive begleitender Lymphknoten erfolgen.
Diskussion
Bei der Behandlung von Keimzelltumoren genügt die einseitige Adnexektomie mit erweitertem Staging. Eine Adnexektomie der kontralateralen Seite oder Hysterektomie sind primär nicht notwendig. Die Fertilität der meist jungen Patientinnen kann somit erhalten werden. Beim Stadium I ist keine weitere Therapie notwendig. Die Abnahme der Tumormarker Alpha-Fetoprotein und HCG ist hilfreich für die Unterscheidung der verschiedenen Tumoren und auch für die Nachsorge. Das Dysgerminom ist der häufigste maligne Keimzelltumor und macht 30 bis 40 % dieser Veränderungen aus. Nur in 5 bis 10 % der Fälle entwickelt sich aus einem zurückgelassenen kontralateralen Ovar innerhalb von 2 Jahren nach Operation ein weiterer Keimzelltumor. Liegt eine Metastasierung vor, so sollte eine adjuvante Chemotherapie mit Cisplatin, Vinblastin und Bleomycin erfolgen. Dieses Kombinationsschema gilt für alle Keimzelltumoren.
Granulosazelltumor
Bei einer 29jährigen Patientin mit Menometrorrhagien ergibt eine Endometriumbiopsie eine adenomatöse Hyperplasie. Zugleich zeigt die gynäkologische Untersuchung einen 6 cm großen Adnextumor. Der Tumor zeigt vorwiegend solide Anteile im Ultraschall. Eine Laparoskopie bestätigt den Befund im Bereich der linken Adnexe. Es wird eine Adnexektomie durchgeführt und der Tumor komplett entfernt. Das rechte Ovar erscheint unauffällig. Eine abdominale Lavage mit zytologischer Untersuchung und multiplen peritonealen Biopsien werden durchgeführt. Da beim Schnellschnitt ein Granulosazelltumor gefunden wird, erfolgt auch noch ein pelvines und paraaortales Lymphknotensampling. Alle

Biopsien sind negativ. Welche weiteren diagnostischen und therapeutischen Schritte sind notwendig?
Antwort
Da es sich hierbei um ein Stadium IA handelt, reicht die unilaterale Salpingo-Oophorektomie mit intra- und retroperitonealem Staging aus. Die Kürettage sollte die Operation ergänzen.
Diskussion
1 bis 2 % aller Ovarialtumoren sind Grandulosazelltumoren. Bei über der Hälfte dieser Tumoren besteht eine erhöhte Östrogenproduktion, die mit Abnormalitäten des Endometriums einhergehen. Dies kann bis zum Adenokarzinom des Endometriums führen. Beim Stadium IA reicht die einseitige Salpingo-Oophorektomie mit intra- und retroperitonealem Staging aus. Die Rezidivrate liegt trotzdem bei 5 bis 10 %. Entscheidend ist, daß beim Granulosazelltumor Rezidive bis zu 20 Jahre nach Diagnosestellung auftreten können. Bei Rezidiv oder Metastasierung kommt wie beim Keimzelltumor eine Chemotherapie mit Cisplatin, Vinblastin und Bleomycin in Frage.
Literatur
Barnes, MN., Deshane, JS., Rosenfeld, M. et al. (1997). Gene Therapy and Ovarian Cancer: a Review. Obstet. Gynecol. 89, 145-55.
Barnhill, D., Heller, P., Brzozowski, P., Advani, H., Gallup, D., and Park, R. (1985). Epithelial ovarian carcinoma of low malignant potential. Obstet. Gynecol. 65, 53-59.
Barnhill, D.R. and O'Connor, D.M. (1991). Management of ovarian neoplasms of low malignant potential. Oncology Huntingt. 5, 21-26.
Bartel, U., Johannsen, B., and Elling, D. (1989). Zur Wertigkeit von CA 125-Bestimmungen im Serum von Patientinnen mit Ovarialkarzinom. Zentralbl. Gynäkol. 11, 301-309.
Bast, R.C., Jr., Klug, T.L., St John, E., Jenison, E., Niloff, J.M., Lazarus, H., Berkowitz, R.S., Leavitt, T., Griffiths, C.T., Parker, L., Zurawski, V.R., Jr., and Knapp, R.C. (1983). A radioimmunoassay using a monoclonal antibody to monitor the course of epithelial ovarian cancer. N. Engl. J. Med. 309, 883-887.
Baum, R.P., Hrogovic, Z., and Hor, G. (1987). Concentration of CEA, CA 19-9, CA 15-3 and CA 125 in tumor tissue, amnion and cyst fluids, pleural efflusions, and ascites compared to serum levels (meeting abstract). Nucl. Med. 26, 39-40.
Björkholm, E., Silfverswärd, C. (1981) Prognostic factors in granulosa-cell tumors. Gynecol. Oncol. 11, 261-274.
Bloss, J.D., Liao, S.Y., Buller, R.E., Manetta, A., Berman, M.L., McMeekin, S., Bloss, L.P., Disaia, P.J. (1993). Extraovarian peritoneal serous papillary carcinoma: a case-control retrospective comparison to papillary adenocarcinoma of the ovary. Gyn. Oncol. 50: 347-351.
Bostwick, D.G., Tazelaar, H.D., Ballon, S.C., Hendrickson, M.R., and Kempson, R.L. (1986). Ovarian epithelial tumors of borderline malignancy. A clinical and pathologic study of 109 cases. Cancer 58, 2052-2065.

Brinton, L.A. and Hoover, R.N. (1992). Epidemiology of gynecologic cancers. In Principles and practice of gynecologic oncology. W.J. Hoskins, C.A. Perez, and R.C. Young, eds. (Philadelphia: J.B. Lippincott company), pp. 3-26.
Castelli, M., Romano, P., and Atlante, G. (1987). Immunosuppressive acid protein (IAP) and CA 125 assays in detection of human ovarian cancer: preliminary results. Int. J. Biol. Markers 2, 187-190.
CDC and NIH study group (The cancer and steroid hormone study of the centers for disease control and the national institute of child health and human developmemt. N. Engl. J. Med. (1987). 316 (11), 650-655.
Chadha, S., Cornelisse, C.J., Schaberg, A. (1990) Flow cytometric DNA ploidy analysis of ovarian granulosa cell tumors. Gynecol. Oncol. 36, 240-245.
Colombo, N., Sessa, C., Landoni, F., Sartori, E., Pecorelli, S., and Mangioni, C. (1986). Cisplatin, vinblastine, and bleomycin combination chemotherapy in metastatic granulosa cell tumor of the ovary. Obstet. Gynecol. 67, 265-268.
Dalrymple, J.C., Bannatyne, P., Russel, H.J., Solomon, H.J., Iattersall, M.H.N., Atkinson,K., Carter, J., Duval, P., Elliott, P., Friedlander, M., Murray, J., Coppleson, M. (1989). Extraovarian peritoneal serous papillary carcinoma . A clinicopathologic study of 31 cases. Cancer 64:110-115.
Delclos, L. and Smith, J.P. (1975). Ovarian cancer, with special regard to types of radiotherapy. NCI Monograph 42, 129
Dembo, A.J., Bush, R.S., and Beale, F.A. (1979). Improved survival following abdominopelvic irradiation in patients with a completed pelvic operation. Am. J. Obstet. Gynecol. 134, 793-800.
Dembo, A.J., Bush, R.S., and Beale, F.A. (1983). A randomized clinical trial of moving strip versus open field whole abdominal radiation in patients with invasive epithelial cancer of ovary. Int. J. Radiat. Oncol. Biol. Phys. 97
Du Bois, J.B., Joyeux, H., and Solassol, C.L. (1985). Les tumeurs épitheliales de l'ovaire. Résultats thérapeutiques à propos de 164 stades II et III. J. Gynecol. Obstet. Biol. Reprod. 14, 627
Du Bois, www.jenapharm.de/telegyn/t83_1.html. Interview mit Prof. Dr. du Bois, Horst-Schmidt-Kliniken, Wiesbaden
Fioretti, P., Gadducci, A., and Ferdeghini, M. (1986). Combinded evaluation of some tumor associated antigens in the monitoring of integrated surgical and chemotherapeutic treatment of epithelial ovarian cancer. Eur. J. Gynaecol. Oncol. 7, 200-205.
Fioretti, P., Gadducci, M., and Ferdeghinie, A. (1992). The concomitant determination of different serum tumor markers in epithelial ovarian cancer: Relevance for monitoring the response to chemotherapy and follow-up of patients. Gynecol. Oncol. 44, 155-160.
Fleischer, A.C., Rodgers, W.H., Rao, B.K., Kepple, D.M., Worrell, J.A., Williams, L., and Jones, H.W. (1991). Assessment of ovarian tumor vascularity with transvaginal color Doppler sonography [see comments]. J. Ultrasound. Med. 10, 563-568.
Fort, M.G., Pierce, V.K., Saigo, P.E., Hoskins, W.J., and Lewis, J.L. (1989). Evidence for the efficacy of adjuvant therapy in epithelial ovarian tumors of low malignant potential. Gynecol. Oncol. 32, 269-272.
Fromm, G., Gershenson, D., Silva, E. (1990). Papillary serous carcinoma of the peritoneum. Obstet. Gynecol. 75:89-95.
Fuller, D.B., Sause, W.T., and Plenk, H.P. (1987). Analysis of postoperative radiation therapy in stage I through III epithelial ovarian carcinoma. J. Clin. Oncol. 5, 897-905.

Gadducci, A., Ferdeghini, M., and Ceccarini, T. (1990). CA 125, CA 19-9, CA 72-4, CA 195 and TATI in the management of patients with mucinous ovarian malignancies (meeting abstract). J. Tumor Marker Oncol. 5, 221
Gadducci, A., Ferdeghini, M., and Prontera, G. (1992). Ca 126, CA 19-9, CA 73-4, Ca 195 and TATI in the management of patients with epithelial ovarian cancer and benign ovarian masses: Relevance for differential diagnosis. Gynecol. Oncol. 44, 147-154.
Goldberg, N. and Peschel, R.E. (1988). Postoperative abdominopelvic radiation therapy for ovarian cancer. Int. J. Radiat. Oncol. Biol. Phys. 14, 425-429.
Granberg, S., Norstrom, A., and Wikland, M. (1990). Tumors in the lower pelvis as imaged by vaginal sonography. Gynecol. Oncol. 37, 224-229.
Graves, T. (1990). Ondansetron: A new entity in emesis control. Drug Intell. Clin. Pharm. 24, 43-51.
Hacker, N.F., Berek, J.S., Lagasse, L.D., Nieberg, R.K., and Elashoff, R.M. (1983). Primary cytoreductive surgery for epithelial ovarian cancer. Obstet. Gynecol. 61, 413-420.
Halila, H., Lethovitra, P., and Stenman, U.H. (1988). Tumor-associated trypsin inhibitor (TATI) in ovarian cancer. Br. J. Cancer 57, 304-307.
Hata, T., Hata, K., Senoh, D., Makihara, K., Aoki, S., Takamiya, O., and Kitao, M. (1989). Doppler ultrasound assessment of tumor vascularity in gynecologic disorders. J. Ultrasound. Med. 8, 309-314.
Hitchcock, C.L., Norris, H.J., Khalifa, M.A., and Wargotz, E.S. (1989). Flow cytometric analysis of granulosa tumors. Cancer 64, 2127-2132.
Julian, C.G. and Woodruff, J.D. (1972). The biologic behavior of low-grade papillary serous carcinoma of the ovary. Obstet. Gynecol. 40, 860-867.
Kaesemann, H., Caffier, H., and Crombach, F.J. (1986). Monoklonale Antikörper in Diagnostik und Verlaufskontrolle des Ovarialkarzinoms. CA 125 als Tumormarker. Klin. Wochenschr. 64, 781-785.
Kawai, M., Kano, T., Kikkawa, F., Maeda, O., Oguchi, H., and Tomoda, Y. (1992). Transvaginal Doppler ultrasound with color flow imaging in the diagnosis of ovarian cancer. Obstet. Gynecol. 79, 163-167.
Khoo, S.K., Rylatt, D.B., and Parsons, P. (1988). Serial D-Dimer levels in the assessment of tumor mass and clinical outcome in ovarian cancer. Gynecol. Oncol. 29, 188-198.
Killackey, M.A., Davis, A.R. (1993). Papillary serous carcinoma of the peritoneal surface:matched comparison with papillary serous ovarian carcinoma. Gynecol. Oncol. 51:171-174.
Klemi, P.J., Joensuu, H., and Salmi, T. (1990). Prognostic value of flow cytometric DNA content analysis in granulosa cell tumor of the ovary. Cancer 65, 1189-1193.
Kreienberg, R. and Melchert, F. (1985). Neuentwicklungen auf dem Gebiet der Marker zur Diagnostik und Überwachung des Ovarialkarzinoms. Onkologie 8, 253-259.
Kudlacek, S., Schieder, K., Kolbl, H., Neunteufel, W., Nowotny, C., Breitenecker, G., Biegelmayer, G., Vetterlein, M., Furlinger, B., and Micksche, M. (1989). Use of CA 125 monoclonal antibody to monitor patients with ovarian cancer. Gynecol. Oncol. 35, 323-329.
Kurjak, A., Zalud, I., and Alfirevic, Z. (1991). Evaluation of adnexal masses with transvaginal color ultrasound [see comments]. J. Ultrasound. Med. 10, 295-297.
Lele, S.B., Piver, M.J., Matharu, J., Fsukadu, Y. (1988). Peritoneal papilary carcinoma. Gynecol. Oncol 31:315-320.

Mann, W.J., Jr., Wagner, J., Chumas, J., and Chalas, E. (1990). The management of pseudomyxoma peritonei. Cancer 66, 1636-1640.
Mann, W.J., Patsner, R., and Cohen, L. (1988). Preoperative serum CA 125 levels in patients with surgical stage I invasive ovarian adenocarcinoma. Natl. Cancer Inst. 80, 208-209.
Martinez, A., Schray, M.F., and Howes, A.E. (1985). Postoperative radiation therapy for epithelial ovarian cancer: The curative role based on a 24-year experience. J. Clin. Oncol. 3, 901-911.
Mcguckin, M.A., Layton, G.T., Bailey, M.J., Hurst, T., Khoo, S.K., and Ward, B.G. (1990). Evaluation of two new assays for tumor-associated antigens, CASA and OSA, found in the serum of patients with epithelial ovarian carcinoma--comparison with CA125. Gynecol. Oncol. 37, 165-171.
McGuire, W.P., Hoskins, W.J. Brady,M.F., Homesley, H.D., Creasman, W.T., Berman, M.L. Ball, H., Berek, J.S., Woodward, J. (1995). Assessment of dose-intensive therapy in suboptimally debulked ovarian cancer: a Gynecologic Oncology Group study. J. Clin. Oncol. 12:1589-1599.
McGuire, W.P., Hoskins, W.J., Brady, M.F. et al. (1996) Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer. N Engl J Med. 334:1-6
Meden, H. (1996). Ovarialkarzinom. Aktuelle Aspekte zur Diagnostik und Therapie in Klinik und Praxis. AnonymousBerlin-New York: Walter de Gruyter),
Meier, W., Stieber, P., and Fateh-Moghadam, A. (1988). CA 125 Serumwerte und histologischer Befund zum Zeitpunkt der Second look Laparotomie beim Ovarialkarzinom. Geburtsh. u. Frauenheilk. 48, 331-333.
Michael, H., Sutton, G., and Roth, L.M. (1987). Ovarian carcinoma with extracellular mucin production: reassessment of "pseudomyxoma ovarii et peritonei". Int. J. Gynecol. Pathol. 6, 298-312.
NIH consensus conference. (1995) Ovarian cancer. Screening, treatment, and folow-up. NIH Consensus Development Panel on Ovarian Cancer. JAMA 273, 491-497.
Neijt, J.P., Engelholm S.A., Tuxen, M.K., et al. (2000) Exploratory phase III study of paclitaxel and cisplatin versus paclitaxel and carboplatin in advanced ovarian cancer. J. Clin Oncol. 18:3084-92
O'Quinn, A.G. and Hannigan, E.V. (1985). Epithelial ovarian neoplasms of low malignant potential. Gynecol. Oncol. 21, 177-185.
Panici, P.B., Scambia, G., and Baiocchi, G. (1989). Predictive value of multiple tumor marker assays in second look procedures for ovarian cancer. Gynecol. Oncol. 35, 286-289.
Panza, N., Pacilio, G., and Campanalla, L. (1988). Cancer antigen 125, tissue polypeptide antigen, canceroembryonic antigen, and beta-chain human chorionic gonadotropin as serum markers of epithelial ovarian carcinoma. Cancer 61, 76-83.
Piccart, M.J., Bertelsen, K., James, K. et al. (2000) Randomized intergroup trial of cisplatin-paclitaxel versus cisplatin-cyclophosphamide in women with advanced epithelial ovarian cancer: Three-year-results. J Nat Cancer Inst. 92:699-708.
Sainz de la Cuesta, R., Goff, B.A., Fuller, A.F., Jr., Nikrui, N., Eichhorn, J.H., and Rice, L.W. (1994). Prognostic importance of intraoperative rupture of malignant ovarian epithelial neoplasms. Obstet. Gynecol. 84, 1-7.
Scambia, G., Panici-Benedetti, P., and Foti, E. (1990). Serum levels of tumor associated glycoprotein (TAG 72) in patients with gynecological malignancies (meeting abstract). Anticancer Res. 10, 1433-1434.

Schneider, V.L., Schneider, A., Reed, K.L., and Hatch, K.D. (1993). Comparison of Doppler with two-dimensional sonography and CA 125 for prediction of malignancy of pelvic masses. Obstet. Gynecol. 81, 983-988.
Schröck, R., Hafter, R., and Graeff, H. (1985). Die simultane Bestimmung von CA 125 und D-Dimer im Plasma beim Ovarialkarzinom. Onkologie 8, 260-262.
Schröck, R., Hafter, R., and Schmid, L. (1986). Tumorassoziierte Antigene und Fibrinderivate als Reaktionsprodukte des Ovarialkarzinoms. Geburtsh. u. Frauenheilk. 56, 1-10.
Schwartz, P.E., Chambers, S.K., and Chambers, J.T. (1987). Circulating tumor markers in the monitoring of gynecologic malignancies. Cancer 60, 353-361.
Serov, S.F., Scully, R.E., and Sobin, L.H. (1973). Histological typing of ovarian tumors. In International histological classification of tumors 9. WHO, ed. (Geneva,Switzerland: pp. 37-42.
Sevelda, P., Salzer, H., and Dittrich, C. (1987). The diagnostic validity of the tumor marker Ca 125 in ovarian cancer patients. Tumordiagnostik & Therapie 8, 115-120.
Sindelar, W.F., DeLaney, T.F., Tochner, Z., Thomas, G.F., Dachoswki, L.J., Smith, P.D., Friauf, W.S., Cole, J.W., and Glatstein, E. (1991). Technique of photodynamic therapy for disseminated intraperitoneal malignant neoplasms. Phase I study. Arch. Surg. 126, 318-324.
Sugarbaker, P.H., Landy, D., Jaffe, G., and Pascal, R. (1990). Histologic changes induced by intraperitoneal chemotherapy with 5-fluorouracil and mitomycin C in patients with peritoneal carcinomatosis from cystadenocarcinoma of the colon or appendix. Cancer 65, 1495-1501.
Sutton, G.P., Bundy, B.N., Omura, G.A., Yordan, E.L., Beecham, J.B., and Bonfiglio, T. (1991). Stage III ovarian tumors of low malignant potential treated with cisplatin combination therapy (a Gynecologic Oncology Group study). Gynecol. Oncol. 41, 230-233.
Tazelaar, H.D., Bostwick, D.G., Ballon, S.C., Hendrickson, M.R., Kempson, R.L. (1985). Conservative treatment of Borderline ovarian tumors. Obstet. Gynecol. 66, 417-422.
Tholander, B., Tamsen, L., and Stendahl, U. (1985). Monitoring ovarian carcinoma with CA 125, TPA and CEA in serum. A prospective clinical study (meeting abstract). 2rd European conference on clinical oncology and cancer nursing. June 16-20. Stockholm, Sweden
UICC International Union Against Cancer. Hermanek, P., Sobin, L.H. (eds.) (1992). TNM Klassifikation maligner Tumoren.
Vardi, J.R., Tadros, G.H., and Malhotra, C. (1989). Lipid associated sialic acid in plasma in patients with advanced carcinoma of the ovaries. Surg. Gynecol. Obstet. 168, 296-301.
Walton, L., Ellenberg, S.S., Major, F., Jr., Miller, A., Park, R., and Young, R.C. (1987). Results of second-look laparotomy in patients with early-stage ovarian carcinoma. Obstet. Gynecol. 70, 770-773.
Ward, B.G., Mcguckin, M.A., and Ramm, L.E. (1993). The management of ovarian carcinoma is improved by the use of cancer-associated serum antigen and CA 125 assays. Cancer 71, 430-438.
Weiner, Z., Thaler, I., Beck, D., Rottem, S., Deutsch, M., and Brandes, J.M. (1992). Differentiating malignant from benign ovarian tumors with transvaginal color flow imaging [see comments]. Obstet. Gynecol. 79, 159-162.
Weiser, E.B., Burke, T.W., and Heller, P.B. (1988). Determinants of survival of patients with epithelial ovarian carcinoma following whole abdominal irradiation (WAR). Gyneco. Oncol. 201-208.

Yabushita, H., Masuda, T., and Ogawa, A. (1990). Prospective evaluation of serum CA 125 levels in a normal population, Phase I: the specifities of single and serial determinations in testing for ovarian cancer. Gynecol. Oncol. 36, 299-305.
Young, R.C., Walton, L.A., Ellenberg, S.S., Homesley, H.D., Wilbanks, G.D., Decker, D.G., Miller, A., Park, R., and Major, F.J. (1990). Adjuvant therapy in stage I and stage II epithelial ovarian cancer. Results of two prospective randomized trials [see comments]. N. Engl. J. Med. 322, 1021-1027.
Young, R.H. and Scully, R.E. (1984). Ovarian sex cord-stromal tumours: recent advances and current status. Clin. Obstet. Gynaecol. 11, 93-134.




![Maligne biliare Tumoren...häufigste Tumoren des Gastrointestinaltrakts [3]. In Deutschland treten jährlich ungefähr 8.000 mBT auf. Dies entspricht ungefähr 1,7% aller invasiven](https://static.fdokument.com/doc/165x107/5f0d46bc7e708231d4398b25/maligne-biliare-tumoren-hufigste-tumoren-des-gastrointestinaltrakts-3-in.jpg)