Carl Friedrich von Weizsäcker-Zentrum für ... · Bt-Toxin bildet nach Aktivierung Poren in...
Transcript of Carl Friedrich von Weizsäcker-Zentrum für ... · Bt-Toxin bildet nach Aktivierung Poren in...
Biologische Systeme mit
Missbrauchspotenzial
Biologische Grundlagen der Friedensforschung
Carl Friedrich von Weizsäcker-Zentrum für Naturwissenschaft und Friedensforschung Forschungsstelle
Biologische Waffen und Rüstungskontrolle
Dual-Use-Potenzial (Beispiele) Einsatz gentechnischer Verfahren, um:
o eine Übertragbarkeit von Mikroorganismen zu erreichen oder ihre Infektiösität zu erhöhen
o die Virulenz von Mikroorganismen oder Toxinen zu erhöhen
o eine Resistenz von Mikroorganismen gegen therapeutische oder prophylaktische Substanzen zu verstärken oder zu induzieren
o die Umgehung diagnostischer Methoden zu ermöglichen
o die Verbreitungsfähigkeit, Ausbringungsfähigkeit oder „Waffenfähigkeit“ von Mikroorganismen und Toxinen zu erhöhen
o gänzlich neue Pathogene zu generieren oder bereits zurückgedrängte Pathogene wieder zu erschaffen
Quelle: www.rki.de/DE/Content/Forsch/Dual-Use-Risiken/hausverfuegung.html; modifiziert
Dual-Use-Potenzial (Beispiele) In der Vergangenheit kritisch diskutierte Experimente:
o 2001: Herstellung eines rekombinanten Mäusepockenvirus mit unerwarteter Steigerung der Letalität
(Jackson RJ et al.; Expression of mouse interleukin-4 by a recombinant ectromelia virus suppresses cytolytic lymphocyte responses and overcomes genetic resistance to mousepox. J Virol. 2001; 75(3): 1205–10)
o 2002: Biosynthese und biochemische Testung eines Virulenzfaktors des humanen Pockenvirus
(Rosengard AM et al.; Variola virus immune evasion design: Expression of a highly efficient inhibitor of human complement; PNAS. 2002; 99: 8808-13)
o 2002: Chemische Synthese der Erbinformation des Poliovirus und Erzeugung infektiöser Viren in Zellkulturversuchen
(Cello et al.; Chemical synthesis of poliovirus cDNA: generation of infectious virus in the absence of natural template. Science. 2002, 297:1016–18)
o 2005: Wiedererschaffung und Testung des nicht mehr zirkulierenden Influenzavirus von 1918 (Auslöser der „Spanischen Grippe“)
(Tumpey TM et al.; Characterization of the Reconstructed 1918 Spanish Influenza Pandemic Virus. Science. 2005; 310:277-80)
Dual-Use-Potenzial (Beispiele) In der Vergangenheit kritisch diskutierte Experimente:
o 2011: Herstellung eines rekombinanten H5N1 Vogelgrippe-Virus mit künstl. erzeugter aerogener Übertragbarkeit zwischen Säugetieren
(Herfst S et al.; Airborne transmission of influenza A/H5N1 virus between ferrets. Science. 2012; 336:1534–41)
o 2013: Herstellung eines rekombinanten Hundestaupe-Virus (verwandt mit Masern-Virus) mit postuliert höherer Aufnahmewahrscheinlichkeit durch menschliche Zellen
(Bieringer M et al.; Experimental adaptation of wild-type canine distemper virus (CDV) to the human entry receptor CD150. PlosOne. 2013; 8: e57488)
Umgang mit der Dual-Use-Problematik
• Bekanntmachung einschlägiger Verhaltenskodices (z.B. der DFG)
• Bewusstsein für mögliche Dual-Use-Risiken der eigenen Laborarbeit bei den relevanten Akteuren schaffen!
• Aufnahme entsprechender Unterrichtseinheiten in die Curricula (Schule/Universität)
• Fortlaufende Technikfolgenabschätzung und Risikobewertung (bei staatlichen Stellen (ZKBS), aber auch durch zivilgesellschaftliche Akteure)
• Transparenz fördert Vertrauen in wissenschaftliche Arbeit und trägt zum gesamtgesellschaftlichen Dialog bei!
Mögliche Risiken der Gentechnik
• Unkontrollierter Eingriff in die Natur durch (unbeabsichtigte) Vermehrung von GVO (z.B. Verdrängung der Wildtypen durch Überwachsen?!)
• Unbeabsichtigtes Auskreuzen kann den natürlichen Genpool unkontrolliert verändern (Auftreten neuartiger, unerwartet schädlicher GVO?)
• Unbeabsichtigte Schädigung von Mensch und Umwelt durch gentechnisch veränderte Produkte
• Mögliche Konfliktpotenziale innerhalb einer Gesellschaft (z.B. Ablehnung grüner Gentechnik), aber auch zwischen Staaten (z.B. Marktbarrieren, Produkthaftung)
Gliederung
Beispiele für biologische Systeme mit Missbrauchspotenzial: Agro-Gentechnik Molecular Pharming Reproduktives und therapeutisches Klonen Genom-Editierung
Rekombinante Ebola-Vakzine
Phoolcharoen et al., PNAS 108 (51). 2011
http://www.78stepshealth.us/transposable-elements/genetic-engineering-in-plants.html
KanR
Problem: Viele Getreidearten (Ausnahme: Mais) und andere Pflanzenarten lassen sich nicht durch Agrobacterium tumefaciens transformieren.
Abhilfe: biolistische Transformation Prinzip: DNA-beschichtete Gold- oder Wolframpartikel werden mit Hilfe
einer „Gen-Kanone“ in Pflanzenzellen geschossen
Biolistische Transformation
http://passel.unl.edu/Image/siteImages/GeneguncycleLG.jpg http://www.bio-rad.com
Transgene Pflanzen • Stellen gentechnisch veränderte Organismen dar (GVO, gv-
Pflanzen)
• Entstehen durch Übertragung rekombinanten Genmaterials (Zielgen - z.B. herbizidresistentes Enzym - sowie Restriktionsschnittstellen, ggf. Promotor, Antibiotikaresistenz-Gen)
• Technik, Freisetzung, Inverkehrbringen und Risikobewertung werden kontrovers diskutiert
• (Noch) nicht das Ende einer alten Ära (klassische Züchtung), sondern eher Übergang in eine neue Ära (Agro-Gentechnik)
Transgene Pflanzen • 1994: weltweite erste gv-Pflanze (Tomatensorte mit
verminderter Fäulnisneigung) erhält Zulassung für USA
• 1996: gv-Sojabohne (Roundup-Ready Soybeans, Monsanto) erhält Zulassung für EU (Großbritannien)
• Seit 1998 Anbau von gv-Mais (Sorte MON 810, Fa. Monsanto) in der EU (seit 2009 Anbauverbot in D)
• 2010-2013 war gv-Kartoffelpflanze (Sorte Amflora) zugelassen (seit 2011 in EU nicht mehr angebaut)
Transgene Pflanzen • EU: mehrstufiges Zulassungsverfahren einschl. Labor- und
Gewächshausversuchen
• Dann Freilandversuche („Freisetzung“: Anbau zu Testzwecken) auf Versuchsfeldern
• Vermeidung der Auskreuzung rekomb. Erbanlagen: 150 m Abstand zu einem Feld mit konventioneller Landwirtschaft, 300 m zu Ökolandbauflächen
• Vermeidung einer Vermischung auf Anbaufeld: nach Bepflanzung z.B. mit gv-Mais darf im Folgejahr kein wt-Mais angepflanzt werden!
Transgene Pflanzen • Aktuell Anbau von gv-Pflanzensorten in 5 EU-Ländern
(Portugal, Spanien, Tschechien, Slowakei, Rumänien) zulässig
• In Deutschland findet seit 2012 kein Anbau von gv-Pflanzen mehr statt!
• 2015: EU beschließt neue Regeln für Anbau gv-Pflanzen -> jedes Mitgliedsland kann selbst über Zulassung/Verbot entscheiden
Transgene Pflanzen • Antrag auf Zulassung des Inverkehrbringens von gv Lebens-
und Futtermitteln (kommerzieller Anbau, Handel)
• Auch für Import aus Drittstaaten erforderlich
• In der EU z. Zt. 58 zugelassene gv-Pflanzen: Mais, Sojabohnen, Ölraps, Baumwolle, Zuckerrübe
• Alle 10 Jahre muss diese EU-Zulassung neu beantragt werden!
• Berücksichtigung aktueller Stand Forschung + Risikoanalyse
Verzeichnis in EU zugelassener gv-Pflanzen
http://passel.unl.edu/Image/siteImages/GeneguncycleLG.jpg
Transgene Pflanzen • In EU besteht Kennzeichnungspflicht für Lebens- und
Futtermittel, die aus GVO bestehen oder GVO enthalten
• Ausnahmen:
o Lebensmittel mit zufälligen oder techn. unvermeidbaren Spuren von GVO (oder aus GVO hergestelltem Material) bis zu einem Anteil von max. 0,9 %
o Produkte, die von Tieren stammen, die mit gentechnisch veränderten Futtermitteln gefüttert wurden
• Freiwilliges Siegel „Ohne Gentechnik“ für Produkte v. Tieren, die nicht mit gv-Pflanzen gefüttert wurden
http://www.isaaa.org/resources/publications/briefs/49/pptslides/default.asp
International Service for the Acquisition of Agri-biotech Applications (ISAAA) „ISAAA is a not-for-profit international organization that shares the benefits of crop biotechnology“
EU: Portugal, Spanien, Tschechien, Slowakei, Rumänien
http://www.transgen.de/anbau/flaechen_international/531.doku.html
„transGEN wird im Wesentlichen finanziert durch Forum Bio- und Gentechnologie - Verein zur Förderung der gesellschaftlichen Diskussionskultur e.V.“ (Kooperationspartner u.a. BASF, Bayer Crop Science, Dow Agro Science)
73 Mio ha
42 Mio ha
24 Mio ha
0,1 Mio ha
Transgene Pflanzen Einige Beispiele für gv-Pflanzen:
• Schädlingsresistente Maissorte (Bt-Mais MON810) • Herbizidtolerante Sojabohnensorte (Roundup-Ready) • Vitamin A-reiche Reissorte (GoldenRice)
• Trockenstress-toleranter Mais (Drought Gard)
Maissorte MON810 (Bt-Mais) • Problem: Maispflanzen in Monokulturen stark von Befall
durch Larven des Maiszünslers betroffen
• Folgen: Pflanzenstängel geschwächt, Pilzbefall, Absterben befallener Pflanzen, reduzierter Ernteertrag
• Lösung: Schädlingsabwehr durch natürlich vorkommendes Insektengift („Bt-Toxin“) aus Bakterium Bacillus thuringiensis
• Gentechnische Veränderung: Erzeugung rekombinanter Maispflanzen, die modifiziertes Bt-Toxin in den Pflanzenzellen aufweisen -> nach erstem Verzehr stirbt Larve!
Maissorte MON810 (Bt-Mais)
Bravo A et al., BBA. 2004
Schünemann et al., ISRN Microbiology. 2014
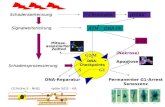
Bt-Toxin bildet nach Aktivierung Poren in Plasma-membran betroffener Darmepithelzellen > Osmotischer Schock führt zum Zelltod > Raupe stellt Fressvorgang ein > Tod durch Verhungern
Bakterien bilden Sporen (Dauerform) und Proteinkristalle bestehend aus Cry-Protein (insektizides Toxin)
Maissorte MON810 (Bt-Mais) • Entwickelt durch Firma Monsanto (USA)
• Seit 1998 kommerzieller Anbau in Europa
• Seit 2009 ist Anbau in Deutschland verboten (ebenso in
Österreich, Ungarn, Griechenland, Frankreich, Luxemburg, Italien und Polen)
• Risikoannahme: Schädigung von Nichtzielorganismen (wie Schmetterlinge, Bienen, Marienkäfer, Köcherfliegenlarven)
• Datenlage nicht eindeutig (EFSA: keine direkte Gefahr für menschliche u. tierische Gesundheit oder die Umwelt)
Roundup-Ready Sojabohne
Unbehandelt: Beikräuter- bewuchs!
Behandelt: Abtötung Beikräuter
Einsatz des Herbizids Roundup zur Vernichtung von Beikräutern
Einsatz von Glyphosat • 1970: Glyphosat gezielt als Herbizid entwickelt (Fa.
Monsanto, USA), 1971 patentiert
• 1974: Glyphosat wird als Totalheribizid Roundup auf den Markt gebracht
• 1996: Einsatz auch in Kombination mit gv-Pflanzen (aktuell sind 85 % der angebauten gv-Pflanzensorten Glyphosat-resistent)
• 2011: ca. 650.000 t weltweit eingesetzt (häufigste Herbizid)
• 2012 in Deutschland ca. 6.000 t auf 39 % der Anbauflächen
eingesetzt; ca. 40 t im Haus- und Kleingartenbereich
EPSP-Synthase (5-Enolpyruvylshikimat- 3-phosphat-synthase)
Glyphosat (N-(Phosphonomethyl)glycin)
Rekombinante EPSP*-Synthase
Herbizid-tolerante gv-Pflanzen: Roundup-Ready Soja
Glyphosat hemmt so die Synthese essentieller Aminosäuren
Vermittelt Herbizid- Toleranz gegen
Glyphosat
X Glyphosat blockiert das Enzym EPSP-Synthase
Einsatz von Glyphosat Bedenken gegen die Anwendung:
• Massiver Einsatz von Glyphosat (= hoher Selektionsdruck)
fördert Entwicklung resistenter Beikräuter
• Glyphosat selbst weist geringe Toxizität gegenüber Nichtzielorganismen auf (wirklich?!)
• Erhöhte Toxizität von Glyphosat-Präparaten durch Zusätze wie z.B. Tallowamin (ein Tensid) -> „Cocktail“-Effekt
Einsatz von Glyphosat Diskutierte Gesundheitsgefahren:
• Glyphosat kann in Nahrungskette verbleiben, gelangt so in
menschlichen und tierischen Organismus
• Glyphosat wirkt möglicherweise krebsauslösend (z. B. Verdachtsfälle in Argentinien)! Schädigt Darmflora?!
• 03/2015: Studie einer WHO-Einrichtung (Internat. Agency for Research on Cancer, IACR) stuft Glyphosat als beim Menschen „wahrscheinlich krebserregend“ ein
• Einstufung aber umstritten (s. Mitteilung des BfR, BRD)
Einsatz von Glyphosat Diskutierte Umweltgefahren:
• Herbizid verbleibt für Tage im Boden und gelangt durch
Auswaschung von den Ackerflächen in Oberflächenwässer
• Schädigung von Wasserorganismen (im Laborversuch nachgewiesen)
• Selektion auf besonders herbizidresistente Beikräuter („Superunkräuter“) wie Amaranthus palmeri
Risiken + Missbrauchspotenziale
• „Agrochemisches Wettrüsten“: kombinierter Herbizideinsatz bzw. Entwicklung besserer Herbizide erforderlich! Neue, passende gv-Pflanzensorten nötig!
• Steigende Abhängigkeit der Landwirte vom Hersteller der gv-Pflanzensorte (z.B. Koppelgeschäft gv-Samen + Herbizid)
• Friedliche Koexistenz möglich zwischen verschiedenen Bewirtschaftungsmodellen (GVO contra Ökolandbau)?!
• Einmal ausgebrachte GVO bzw. rekombinante Erbanlagen nicht mehr aus Natur rückholbar -> unbeabsichtigte Folgen möglich
Risiken + Missbrauchspotenziale Einsatz neuester gentechnischer Verfahren („gene editing“):
• Keine GVO nach GenTG, da keine transgenen Pflanzen!!
(genetische Veränderung von klassischer Züchtung nicht zu unterscheiden, z.B. keine Markergene erforderlich)
• Zielgenau verändertes Genom ergibt Pflanze mit vor-
bestimmten Produkteigenschaften
• Beispiel: „ge“-Raps der Sorte „SU Canola“; 2014 auf den Markt gebracht durch Fa. Cibus (USA); Produktmerkmal: Herbizidtoleranz (Sulfonylharnstoffe)
Gentechnisch veränderte Nutzpflanzen und Tiere:
Von Molecular Farming zu Molecular Pharming
Molecular Farming Einsatz von GVO zur Produktion nachwachsender Rohstoffe, Nahrungs-ergänzungsmittel, Feinchemikalien etc.
Molecular Pharming Einsatz von GVO zur Produktion pharmazeutisch und therapeutisch wirksamer Substanzen wie Antikörper, Enzyme, Impfstoffe etc.
Vorteile Verbesserte Produktqualität durch Auswahl mehrzelliger Organismen wie Pflanzen oder höhere Tiere Schnelle Adapation der Größe von Herden gv-Tiere Anbaufläche gv-Pflanzen
Verband forschender Arzneimittelhersteller (VfA):
„Derzeit sind in Deutschland nach vfa-Recherchen mindestens
176 Arzneimittel mit 134 Wirkstoffen zugelassen, die
gentechnisch hergestellt werden (Stand: 26.03.2015).
Wichtige Anwendungsbereiche sind u.a. Diabetes (Insuline),
Multiple Sklerose und rheumatoide Arthritis
(Immunmodulatoren), Krebserkrankungen (monoklonale
Antikörper), angeborene Stoffwechsel- und
Gerinnungsstörungen (Enzyme, Gerinnungsfaktoren) sowie
Schutzimpfungen (Gebärmutterhalskrebs, Hepatitis B).“
http://www.vfa.de/de/arzneimittel-forschung/datenbanken-zu-arzneimitteln/amzulassungen-gentec.html
Gentechnisch hergestellte Pharmaka
Gentechnisch hergestellte Pharmaka
http://www.bpb.de/gesellschaft/umwelt/bioethik/33747/rote-gentechnik?p=all
Die größten Marktanteile haben: • Erythropoietin („EPO“, Bildung roter Blutkörperchen)
• Insulin (Behandlung des Diabetes mellitus)
• Interferone (z.B. Begleittherapie bei Krebserkrankungen)
• Blutgerinnungsfaktoren (Behandlung der Bluterkrankheit)
Molecular Pharming mit gv-Nutztieren
• 2006: Erstzulassung ATryn (Fa. GTC Biotherpeutics, USA) für Europa
• Gentechnisch veränderte Ziegen liefern über ihre Milch den Blutgerinnungshemmer Antithrombin III
• Anwendung: Prophylaxe von Thromboembolien
Klonen • „Klon“ (gr. für Schössling, Zweig):
Durch ungeschlechtliche Vermehrung erzeugte,
genetisch identische Nachkommenschaft eines Spenders
• Nicht auf Organismen beschränkt, sondern auch für
einzelne Organe, Gewebe und Zellen möglich
• Ziele: „therapeutisches“ o. reproduktives Klonen
Fortpflanzungsklonen
Anwendungen:
• Klonen von Nutztieren und Nutzpflanzen mit idealen Produkteigenschaften
• Klonen von Versuchstieren mit ausgewählten Eigenschaften
• Klonen vom Aussterben bedrohter Arten von Lebewesen
• Klonen von Menschen??? (Verboten in Deutschland und in 40 weiteren Ländern!)
Fortpflanzungsklonen
Methoden:
• Somatischer Zellkerntransfer (SCNT)
• Herstellung induzierter pluripotenter Stammzellen (iPS) für tetraploide Komplementierung o. Keimzell-manipulation
Begriffliche Abgrenzung: Klonierung ist Herstellung identischer Kopien von DNA-Sequenzen!
Somatischer Zellkerntransfer (SCNT) • 1901: Hans Spemann teilt Zellen eines Embryos im Zwei-Zell-
Stadium und erhält zwei vollständig entwickelte Individuen -> frühe Embryonalzellen weisen Potenz auf, sich in einen
neuen Organismus zu entwickeln
• 1924: Spemann schlägt Methode für Zellkerntransfer vor
• 1952: Erstmals erfolgreiche Übertragung von Zellkernen aus Blastozystenzellen auf Eizellen des Leopardfroschs (Rana pipiens)
• 1958: Erste Übertragung von Zellkernen aus adulten Körperzellen des Afrikan. Krallenfroschs (Xenopus laevis)
Transgene Tiere in der Landwirtschaft
Zielstellung: verbesserte Produktmerkmale, neue tierische Produkte
Vorgehen: gezielte Übertragung neuer oder modifizierter Gene in das Genom geeigneter Nutztierarten (von Art zu Art = „Transgen“)
Vorteile: keine Kreuzung oder Hybridisierung erforderlich
Methoden: Rekombinante Retroviren
Pronukleäre DNA-Mikroinjektion
Spermien-vermittelter DNA-Transfer
Rekombinante embryonale Stammzellen
Keimzelltransplantation
Zellkerntransfer zur Klon-Erzeugung („klonieren“)
Fortpflanzungsklonen durch SCNT • 1996: erster Säugetierklon („Klon-Schaf“ Dolly)
• 1997: Mausklone erzeugt (verbesserte Technik)
• 1998 – 2005: Rind, Ziege, Schwein, Katze, Pferd, Büffel,
Hirsch, Hund, Wolf...
• 2007: erster Klon eines Primaten (Rhesusaffe)
Transgene Tiere in der Landwirtschaft
Wikipedia
Klon-Schaf „Dolly“: 05.07.1996 – 14.02.2003 (Lebensalter: <7 Jahre; 12 Jahre erwartbar)
Drei „Mütter“: - Genetische Mutter (= Zellkern einer Körperzelle aus Eutergewebe; Alter: 6 J.) - Eizellspenderin (Eizelle wurde entkernt, dann mit ZK aus #1 supplementiert) - Leihmutter (Eizelle in Gebärmutter eingepflanzt)
•Dolly hatte 3 gesunde Nachkommen •„Vorzeitige“ Alterserscheinungen: Arthritis •Schwere Lungenerkrankung -> eingeschläfert •Von 277 Versuchen war 1 erfolgreich!
Roslin Institute, Schottland
http://science.howstuffworks.com
Forschungsklonen mittels SCNT • Zellkerntransfer von Spenderzellen auf entkernte Eizelle
• In vitro Kultivierung des Embryos (ca. 5 Tage)
• Zerstörung des Embryos und Entnahme embryonaler
Stammzellen (ESZ)
• In Zellkultur Stimulation der Ausdifferenzierung der ESZ in gewünschte Zelltypen
-> Ziel: Ersatz funktionsuntüchtiger Zellen, Gewebe oder Organe durch geklontes, nachgezüchtetes Zellmaterial
Forschungsklonen mittels iPS • Entnahme adulter Zellen (z.B. Hautzellen) des Spenders
• Reprogrammierung der adulten Zellen zu induzierten
pluripotenten Stammzellen (iPS)
• In Zellkultur Stimulation der Ausdifferenzierung dieser iPS in gewünschte Zelltypen
Forschungsklonen mit SCNT • 2007: Gewinnung embryonaler Stammzellen aus Blastozyste
eines geklonten Primaten (Rhesusaffe)
• 2008: erstmals menschliche Embryonen erfolgreich geklont, Gewinnung embryonaler Stammzellen aus zuvor durch SCNT erzeugten Eizellen (ZK stammte aus adulten Hautzellen)
• 2013: Erzeugung embryonaler Stammzellen aus geklonten humanen Embryoblastzellen (Masahito Tachibana, Shoukhrat Mitalipov)
• 2014: Erzeugung von ES-Zellen aus geklonten humanen Embryonen auch älterer Spender (35 u. 75 Jahre alt)
-> Klonen von Menschen zu Fortpflanzungszwecken wird damit technisch immer wahrscheinlicher!
Tetraploide Komplementierung • 2009 im Tierversuch iPS-Zellen in tetraploiden Embryo
eingeführt, Austragen durch Leihmuttertier
• Zellen des tetraploiden Embryos bilden nur extrakorporales Gewebe (z.B. Plazenta)
• Aus den iPS-Zellen reift ein vollständig entwickelter Organismus heran (Klon des iPS-Zell-Spenders)
• Funktioniert z. Zt. nur in Verbindung mit tetraploiden Embryonalzellen
-> Prinzipiell auch mit humanen iPS durchführbar!
Ethische Fragen zum reproduktiven Klonen Zwei Szenarien können diskutiert werden:
(A) Gegenwärtig resultieren Klonexperimente in (i) hohen Verlustraten geklonter Embryonen, (ii) geringer Ausbeute erfolgreich ausgetragener Feten, (iii) oftmals missgebildeten oder vorzeitig erkrankenden Klonen
(B) Zukünftig sei die Erzeugung geklonter Nachkommen genauso sicher und effizient wie Standardmethoden der künstlichen Befruchtung
Ethische Fragen zum reproduktiven Klonen • Für Szenario A ergibt sich eine eindeutige Ablehnung des
reproduktiven Klonens durch verschiedene Interessen-vertreter aus Wissenschaft, Politik, Religion
• Aber: Einschränkung der Forschungsfreiheit wäre bei
Tierversuchen nicht begründbar!
• Forschungen zum Fortpflanzungsklonen beim Menschen werden gegenwärtig abgelehnt (u.a. in D verboten!)
• Zukünftig Änderung „Risiko-Nutzen-Verhältnis“ möglich: Entscheidung noch offen (Gesellschaftliche, politische und
juristische Entscheidungsfindung! Neue Ethikvotum!)
Ethische Fragen zum reproduktiven Klonen Für Szenario (B) werden verschiedene Aspekte zur Bewertung herangezogen:
• Verlust der individuellen Identität? • Genetische Ausstattung bestimmt nur Teil der
gelebten Identität • Situation vergleichbar mit eineiigen Zwillingen
• Stellt der Spender (das „Original“) ein psychosozial belastendes Vorbild für den Klon dar? • Recht auf eigene Lebensführung dürfte nicht durch
Vorliegen eines ident. Genoms eingeschränkt sein • Verlust der Menschenwürde?
• Klone würden nicht als minderwertig anzusehen sein (Sklave, Ersatzorganspender, „Sicherheitskopie“)
Ethische Fragen zum reproduktiven Klonen Für Szenario (B) werden verschiedene Aspekte zur Bewertung herangezogen:
• Verlust der individuellen Identität? • Genetische Ausstattung bestimmt nur Teil der
gelebten Identität • Situation vergleichbar mit eineiigen Zwillingen
• Stellt der Spender (das „Original“) ein psychosozial belastendes Vorbild für den Klon dar? • Recht auf eigene Lebensführung dürfte nicht durch
Vorliegen eines ident. Genoms eingeschränkt sein • Verlust der Menschenwürde?
• Klone würden nicht als minderwertig anzusehen sein (Sklave, Ersatzorganspender, „Sicherheitskopie“)
Der Klon kann selbst nicht in seine Erzeugung einwilligen, trägt aber den Großteil der Risiken.
Stellungnahme Deutscher Ethikrat Gesetzliche Regelungen bereits umfassend, erfordern aber Präzisierung v.a. bezüglich iPS
-> Klare Empfehlung, ein international gültiges Verbot zum Klonen von Menschen zu erwirken!
Genome Editing: CRISPR/Cas9
• Clustered Regularly Interpaced Short Palindromic Repeats
• CRISPR-assoziiertes Protein 9
• Vorkommen: Bakterien und Archaeen
• Aufgabe: vermittelt adaptive Immunität gegen fremde Nukleinsäure (Viren, Plasmide)
Genome Editing: CRISPR/Cas9
Funktionsprinzip
• Bei Erstkontakt werden Bruchstücke fremder Nukleinsäuren an best. Stellen, den CRISPR-Loci, in das Genom der Wirtszelle eingebaut („immunologisches Gedächtnis“)
• Transkription der CRISPR-Loci und nachfolgende Verarbeitung liefert crRNA-Bibliothek
• crRNA-Oligonukleotide weisen komplementäre Basenabfolge spezifisch für best. fremde Nukleinsäuren (NS) auf
• In Zelle patrouillierender Überlebenskomplex enthält einzelne cRNA und vermittelt nach Bindung den Abbau fremder NS
Genome Editing: CRISPR/Cas9
Gentechnische Anwendung
• CRISPR/Cas9-System erlaubt präzises Schneiden von DNA-Doppelsträngen an vausgewählten Sequenzabschnitten
• Weniger komplex in der Anwendung als bisherige gentechn. Verfahren (Zink-Finger-Nukleasen, TALEN)
• Methode zur Gen-Manipulation (nach Schneiden Einbau eines
modifiz. Genabschnitts mittels homologer Rekombination)
• Methode zur Gen-Inaktivierung (Schneiden resultiert in Verlust eines Genabschnitts)
Esvelt et al. eLife 2014;3:e03401
RNA-geleitete Genom-Editierung durch Cas9-Enzym
Gen-Manipulation Gen-Inaktivierung
RNA-Cas9-Komplex gebunden an DNA
Cas9 schneidet DNA-Zielsequenz
Künstl. eingebracht!
Doudna et Charpentier, Science, 2014
Historie von CRISPR-Grundlagenforschung & Methoden zur Genom-Editierung
>380 Publikationen hierzu bereits erschienen!
http://www.nzz.ch/wissenschaft/medizin/ein-neues-werkzeug-beschleunigt-die-forschung-1.18432046
Aktuelle Berichterstattung (Beispiel: Neue Züricher Zeitung, 26. November 2014)
Ethische Implikationen der Genom-Editierung
By David Baltimore ,1 Paul Berg, 2 Michael Botchan ,3,4 Dana Carroll, 5 R. Alta Charo, 6 George Church, 7 Jacob E. Corn, 4 George Q. Daley ,8, 9 Jennifer A. Doudna ,4, 10 * Marsha Fenner ,4 Henry T. Greely, 11 Martin Jinek, 12 G. Steven Martin, 13 Edward Penhoet, 14 Jennifer Puck, 15 Samuel H. Sternberg ,16 Jonathan S. Weissman ,4, 17 Keith R. Yamamoto4,18
Artikel in Science, 3. April 2015
Ethische Implikationen der Genom-Editierung
• Konferenz in Napa (Kalifornien, USA): 01/2015
• Anlass: Beginn einer neuen Ära der Humanbiologie ?!
• Beratung über wissenschaftliche, medizinische, juristische und ethische Tragweite der neuen Techniken zur Manipulation von Genomen
• Empfehlungen zum Umgang mit aktuellen Entwicklungen
-> Ziel: Genom-Editierungstechniken sollen sicher und ethisch
vertretbar in ihrer Anwendung sein!
Napa-Konferenz 2015: Empfehlungen
• Wissenschaftlich fundierte öffentliche Diskussion erforderlich
• Sicherheit und Effizienz der technischen Verfahren müssen gegeben sein, bevor (wenn überhaupt!) die Genom-Editierung humaner Keimzellen für klinische Anwendungen zulässig wäre
• Einrichtung von Foren zum Informationsaustausch und zur Bereitstellung von Lehrmaterialien
• Transparente Forschung -> Risiken und potentieller Nutzen der neuen Techniken soll nachvollziehbar werden
• Zusammenbringen einer global repräsentativen Gruppe von Experten und Interessenvertretern aus Wissenschaft, Politik, Wirtschaft u.a.; ggf. weitere Handlungsempfehlungen/Richtlinien entwickeln
Genome Editing: CRISPR/Cas9
Anwendungsbeispiele für die Erzeugung von GVO mittels CRISPR/Cas9
Doudna et Charpentier, Science, 2014
Genome Editing: CRISPR/Cas9
Doudna et Charpentier, Science, 2014
Anwendungsgebiete für den Einsatz des CRISPR/Cas9-Systems
Missbrauchspotenziale • Gentechnische Verfahren ermöglichen immer tiefere
Eingriffe in verschiedene biologische Systeme
• Gezielte Merkmalsveränderungen unterschiedlicher Arten von Organismen erlaubt die Erringung von Monopolen
• Pflanzen und Tiere als optimierte Produktionsmittel für schädliche biologische Agenzien??
• Genom-Editierung (GE) ermöglicht theoretisch die Schaffung vollständig neuer Lebensformen
-> Ethische Fragen! Internationale Konvention zur Eindämmung der
unkontrollierten Anwendung des Klonens und der GE?!
Fig. 3. Evolution and structure of Cas9. The structure of S. pyogenes Cas9 in the unliganded and RNA-DNA–bound forms.
Doudna et Charpentier, Science, 2014
Fig. 4. CRISPR-Cas9 as a genome engineering tool. (A) Different strategies for introducing blunt double-stranded DNA breaks into genomic loci, which become substrates for endogenous cellular DNA repair machinery that catalyze nonhomologous end joining (NHEJ) or homology-directed repair (HDR).
Doudna et Charpentier, Science, 2014
Glyphosphat blockiert EPSPS-Enzym des Shikimat-Wegs zur Biosynthese essentieller Aminosäuren
Glyphosat (N-(Phosphonomethyl)glycin)
Tetraploide Komplementierung • Differenzierung von iPS-Zellen zu Keimbahnzellen
• Nach Implantation in Keimdrüsen Ausdifferenzierung zu voll
funktionsfähigen Keimzellen (Ei- und Samenzellen)
• Im Tierversuch wurden bereits jeweils lebensfähige Nachkommen mit diesen geklonten Keimzellen erzeugt
• Prinzipiell auch in vitro Fertilisation unter Verwendung dieser geklonten Ei- und Samenzellen möglich
-> Neuer Organismus wäre kein Klon, hätte aber nur ein genetisches Elternteil!
Fortpflanzungsklonen
Embryonen-Schutzgesetz (1990) ... Strafe von bis zu fünf Jahren Gefängnis möglich für den, der „künstlich bewirkt, dass ein menschlicher Embryo mit der gleichen Erbinformation wie ein anderer Embryo, ein Fötus, ein Mensch oder ein Verstorbener entsteht“
Stammzellgesetz (2002) Regelt Einfuhr und Verwendung humaner embryonaler Stammzellen (hES): Verbot von Einfuhr und Verwendung hES außer für besonders gut begründete Forschungszwecke
Resolution UN-Vollversammlung (2005) Unverbindliche Deklaration Empfiehlt Ablehnung des reproduktiven Klonens humaner Embryos und des therapeutischen Klonens mit humanen Zellen