Homburger Dermatologische Fortbildung 2012 · 13 : K01 Topische Therapie eines frühkindlichen...
Transcript of Homburger Dermatologische Fortbildung 2012 · 13 : K01 Topische Therapie eines frühkindlichen...

Universitätsklinikum des Saarlandes
66421 Homburg/Saar Klinik für Dermatologie, Venerologie
und Allergologie
Bi
Homburger Dermatologische Fortbildung
Mittwoch, 10. Oktober 2012
Diese Veranstaltung ist von der Saarländischen Ärztekammer mit 6 Punkten in der Kategorie C zertifiziert.

Liebe Kolleginnen und Kollegen,
im Namen aller Mitarbeiter der Hautklinik lade ich Sie zu unserer schon angekündigten Herbstfortbildung sehr herzlich ein!
Diesmal dürfen wir uns besonders freuen auf den Hauptvortrag von Herrn Prof. Dr. med. Roland Kaufmann, dem Direktor der Hautklinik der Goethe-Universität Frankfurt a. M., zum Thema “Sinnvolle Kombinationen in der operativen und konservativen Therapie von Hautkrebs“.
Gerade bei den epithelialen Tumoren und Präcancerosen haben wir heute zwar viele und immer mehr Alternativen, jedoch ist die sinnvolle Sequenz und Kombination von topisch-medikamentösen Therapien, Kryotherapie, PDT, Operation etc. immer eine Patienten-individuelle und nicht selten schwierige Entscheidung. Die Zahl der problematischen, aktinisch maximal vorgeschädigten, dazu betagten und co-morbiden Patienten mit multiplen Tumoren nimmt dauernd zu. Die Herausforderung ist vor allem die langfristige Therapiestrategie. Anhand vieler Beispiele wird Prof. Kaufmann diese Thematik wie immer brillant und lebendig mit uns bearbeiten. Auch die ganz neuen Entwicklungen kommen zur Sprache, wie etwa die systemischen SMO-Inhibitoren für die Therapie von Problem-Basaliomen – vielleicht schon in naher Zukunft.
Wie immer runden wir den Nachmittag ab mit interessanten Fällen aus den Rubriken „Nützliches“, „Wissenswertes" und „muss man mal gesehen haben“.
Wir freuen uns auf ein Wiedersehen mit Ihnen in Homburg.
Mit freundlichen Grüßen
Ihr
Univ.-Prof. Dr. med. Thomas Vogt
2

INHALTSVERZEICHNIS
Seite
Vorwort 2
Inhaltsverzeichnis 3
LAGEPLAN 4
Tagungsprogramm 5
Raumaufteilungsplan Ambulanz Geb. 36
für PATIENTENVORSTELLUNGEN :
6
P01 (R. 1) Erfolgreiche Systemtherapie eines Morbus Darier mit Alitretinoin (Toctino) nach Acitretinintoleranz
7
P02 (R. 2) Ciclosporin A zur Therapie der Pityriasis rubra pilaris – eine Pathogenese-orientierte und wirksame Alternative zum Retinoid
8
P03 (R. 3) Disseminierte kutane atypische Mykobakteriose bei einem immunkompetenten Landwirt
9
P04 (R. 4) Praecalcaneale congenitale fibrolipomatöse Hamartome (PCFH) – schon mal gesehen?
10
P05 (R. 5) Postmenopausale frontal fibrosierende Alopezie Kossard – lohnt eine Therapie überhaupt?
11
P06 (R. 6) Kongenitale retikuläre ichthyosiforme Erythrodermie (Ichthyosis variegata) – Was hilft solchen Patienten?
12
P07 (R. 7) CD8+ Pagetoide Retikulose (M. Woringer-Kolopp) 13
K01 Topische Therapie eines frühkindlichen Hämangioms mit Propranolol-Gel – eine neue dermatotherapeutische Option?
14
K02 Hypomelanosis Ito: Eine seltene Blaschko-lineäre Störung der Haut mit hoher klinischer Variabilität
15
K03 Isolierte mucosale orale Lues II imitiert bullöses Pemphigoid
16
K04 Darier-artige Keratosen und Grover-artige Bilder unter Vemurafenib – eine weitere Facette der kutanen Nebenwirkungen
17
K05 Eruptive zosteriforme Piloleiomyome im Erwachsenenalter assoziiert mit Uterus myomatosus
18
K06 Neues aus dem OP: erfolgreiche Versorgung großer Defekte mit Integra®
19
Aktuelle Studien unserer Klinik 20
Vorankündigung Dermatologische Fortbildungen 21
Vorankündigung 21. Jahrestagung Arbeitsgemeinschaft Dermatologische Histologie
23
3

Lageplan Klinikum Poliklinik:
Patienten-vorstellung
Hörsaal Dermatologie:
Vortrag
Tagungsort Gebäude 35 (Hörsaal) und Gebäude 36 (Ambulanz) Klinik für Dermatologie, Venerologie, Allergologie Universitätsklinikum des Saarlandes, 66421 Homburg
Tagungsleitung Prof. Dr. med. J. Reichrath Ltd. Oberarzt/Stellv. Klinikdirektor der Klinik für Dermatologie, Venerologie und Allergologie Universitätsklinikum des Saarlandes, Homburg Tel. 06841/16-23832, Fax 06841/16-23830 e-Mail: [email protected]
Mit freundlicher Unterstützung der Firmen Almirall Hermal GmbH (Reinbek) Bristol-Myers Squibb GmbH & Co. KGaA (Königswinter) Galderma Laboratorium GmbH (Düsseldorf) GlaxoSmithKline GmbH & Co. KG (München) Intendis GmbH (Berlin) Leo Pharma GmH (Neu-Isenburg) MSD Sharp & Dohme (Haar) Dr. Theiss Naturwaren GmbH (Homburg/Saar) (Stand bei Drucklegung)
4

Homburger Dermatologische Fortbildung 2012
TAGUNGSPROGRAMM
ab 14:30 Uhr Industrieausstellung und get together 15.00 – 16.00 Uhr Patientenvorstellungen in Geb. 36 (Poliklinik der Hautklinik) 16.15 – 17.00 Uhr Falldiskussion und Kasuistiken
in Geb. 35 (Hörsaal der Hautklinik)
anschließend Hauptvortrag:
„Sinnvolle Kombinationen in der operativen und konservativen
Therapie von Hautkrebs“
Prof. Dr. med. Roland Kaufmann Direktor der Klinik für Dermatologie, Venerologie und Allergologie,
Goethe-Universität Frankfurt a. M.
danach geselliger Imbiss im Kreise der Aussteller
5

Ambulanzplan (Geb. 36) Raum-Nr. entspricht Fallnummer Patientenvorstellungen
5
5
Diagnose: Alopezie Kossard
Referentin: Dr. L. Trémezaygues
Imbiss für Patienten
Diagnose: Praecalcaneale congenitale fibrolipomatöse Hamartome
Referentin: M. Niclou
4 Diagnose:
Kutane atypische Mykobakteriose
Referentin: . Schiefkofer C3
6
Diagnose: Ichthyosis variegata
Referentin: Dr. R. Körner
Diagnose: ityriasis rubra pilaris P
Referentin: E. Janssen
2 10
Diagnose: CD8+ Pagetoide Retikulose (M. Woringer-Kolopp)
Referentin: E. Markeeva
7
Diagnose: M. Darier
Referentin: z Dr. H. Stanis
1
8
Kongressanmeldung
Patientenaufnahme Ambulanz
un
Industrieausstellung
Eingang6

Fall 1 Vorgestellt von: AÄ Dr. med. H. Stanisz und OA PD Dr. med. A. Rösch Überwiesen von: Dr. med. Balzereit Patientin: B. F., männlich, 49 Jahre Diagnose: Erfolgreiche Systemtherapie eines Morbus Darier mit Alitretinoin
(Toctino) nach Acitretinintoleranz Anamnese: Erstmanifestation eines Morbus Darier 1988 im Bereich von Brust und Rücken bei
negativer Familienanamnese. Es erfolgten multiple frustrane lokale Vortherapien mit steroidhaltigen, antiseptischen und keratolytischen Externa. Eine systemische Therapie mit Acitretin musste bei Leuko- und Thrombopenie abgebrochen werden. Aggravation des Hautbefundes jeweils im Sommer.
Hautbefund: Insbesondere am Körperstamm und in den Körperfalten hyperkeratotische,
schmutzig-braun verkrustete Papeln mit großflächiger Konfluenz zu nässenden erosiven Beeten. Streifige, distal gekerbte Nagelveränderungen.
Histologie: Fokale suprabasale Spaltbildung mit akantholytischen Keratinozyten. Reaktive
Proliferation basaler Keratinozyten. Z. T. follikulär pfropfartig aggregierte dyskeratotische Keratinozyten (grains und corps ronds) und aufgelagerte säulenartige Parakeratose.
Therapie: Einleitung einer systemischen Therapie mit Alitretinoin 30mg 1x/d am 30.01.2012.
Darunter sehr gute Stabilisierung des Hautbefundes innerhalb von Wochen bei guter Verträglichkeit. Zusätzlich Lokaltherapie mit Locacorten Vioform Paste und Carbamid+VAS Creme.
Kommentar: Der Morbus Darier (Dyskeratosis follikularis) ist eine dominant vererbte Dermatose
mit einer Prävalenz von 1:50000. Der Erkrankung liegt eine Mutation im ATP2A2 Gen zugrunde, das für die sarkoendoplasmatische Calcium- ATPase 2 (SERCA2) kodiert. SERCA2 transportiert Calcium vom Cytosol ins endoplasmatische Retikulum. Bei Patienten mit Morbus Darier führt die Calciumdefizienz des endoplasmatischen Retikulums dazu, dass bestimmte Membranproteine nicht adäquat prozessiert werden (z. B. Adhäsionsmoleküle). Daraus resultiert die Akantholyse (1). Vitamin-A-Säure-Derivate, insbesondere Acitretin werden bereits seit langem bei kutanen Verhornungsstörungen eingesetzt. Ihr Wirkungs-mechanismus wird über verschiedene nukleäre Retinoidrezeptoren vermittelt. Acitretin und Isotretinoin vermitteln ihre Wirkung am Retinsäurerezeptor (RAR) währen Alitretinoin als Panagonist sowohl RAR als auch RXR (Retinoid-X Rezeptor) aktiviert. Über die Aktivierung der Retinoidrezeptoren beeinflussen Vitamin-A-Säure-Derivate Differenzierung, Proliferation aber auch Entzündungs-aktivität. Die positive Wirkung des Acitretin bei Morbus Darier ist bereits hinreichend bekannt, während es über die Wirksamkeit von Alitretinoin im off-lable-use bisher lediglich einen Fallbericht gibt (2). Der hier präsentierte Kasus spricht für Alitretinoin als mögliche Therapiealternative zu Acitretin insbesondere beim Auftreten von Nebenwirkungen. Als weitere neue Therapieoption bzw. Kombinationstherapie sind bei M. Darier Cyclooxygenase (COX)-2-Inhibitoren zu diskutieren. COX-2-Inhibitoren scheinen die Expression der SERCA2 zu stabilisieren gerade unter UV-B Einfluss (3). Inwiefern ein additiver oder sogar synergistischer Effekt zu Vitamin-A-Säure Derivaten besteht wäre zu untersuchen.
Literatur: 1) M Savgignac, A Edir, M Simon. Darier disease: A disease model of impaired calcium homeostasis BBA 2011; 1111–1117.
2) SE Barnstedt. Erfolgreiche Therapie eines Morbus Darier mit Alitretinoin. Hautarzt 2012. 63: 139-142 3) M Kamija C Nishiyama A Takagi, N Nakano. Cyclooxygenase-2 inhibition restores ultraviolet B- induced
downregulation of ATP2A2/SERCA2 in keratinocytes: possible therapeutic approach of cyclooxygenase-2 inhibition for treatment of Darier disease BJD 2012 166: 1017-1022
7

Fall 2 Vorgestellt von: AÄ E. Janssen und Ltd. OA Prof. Dr. med. J. Reichrath Überwiesen von: Hautarzt Dr. med. V. Schenkelberger, Hautärztin Dr. med. M. Weber-Müller Patienten: Patient 1: W. K., männlich, 46 Jahre;
Patientin 2: B. B.-W., weiblich, 58 Jahre Diagnose: Ciclosporin A zur Therapie der Pityriasis rubra pilaris - eine Pathogenese-
orientierte und wirksame Alternative zum Retinoid Anamnese: Beide Patienten berichteten vom plötzlichen Auftreten von Rötungen im Gesichts-
/Halsbereich gefolgt von juckenden Hautveränderungen am gesamten Integument und palmoplantaren Indurationen.
Hautbefund: Bei beiden Patienten zeigte sich eine rumpfbetonte Suberythrodermie mit
großflächig konfluierenden Plaques und nappes claires. Am Abdomen disseminiert follikuläre Hyperkeratosen. Palmoplantare Hyperkeratosen.
Histologie: Horizontaler und vertikaler Wechsel von Ortho- und zarter Parakeratose bei
suprapapillär gesteigerter Epidermisdicke und deutlichem Stratum granulosum. Weitgestellte Gefäße des oberen Coriums und geringes entzündliches Infiltrat.
Therapie: Unter systemischer Therapie mit Steroiden und Isotretinoin (Patient 1 bis 80mg/d,
Patientin 2 bis 30mg/d) kam es zunächst zu einer Besserung, dann nach etwa vier Wochen zu einer erneuten Exazerbation der Hautveränderungen (s. Hautbefund), weshalb die Isotretinointherapie beendet wurde. Nach Erhöhung der systemischen Methylprednisolontherapie und Einleitung einer Therapie mit Ciclosporin A (je bis 150mg/d) steter Rückgang der Symptome, weshalb die Steroidtherapie kontinuierlich reduziert und schließlich beendet werden konnte. Bei Patient 1 konnte die Ciclosporindosis 3 Jahre nach Therapieeinleitung auf 25mg an 2d/Woche reduziert werden.
Kommentar: Bei beiden Patienten konnte die Diagnose einer Pityriasis rubra pilaris (PRP)
gestellt werden. Bei der PRP handelt es sich um eine mit einer Inzidenz von 1:3500 seltene Erkrankung unbekannter Ätiologie, bei welcher es zum Auftreten von follikulär gebundenen hyperkeratotischen Papeln kommt, welche zu erythematösen Plaques konfluieren. Desweiteren kommt es zum Auftreten palmoplantaren Keratoderme und einer kleieartigen Schuppung der Kopfhaut (1,2). Je nach Verlauf und Alter der Patienten erfolgt eine Einteilung in fünf Unterformen, wobei der klassische adulte Typ mit 55% die häufigste Unterform darstellt (3). Aktuell stellen Retinoide, z. B. Isotretinoin in einer Dosierung von 1mg/kg KG/d, die am häufigsten empfohlene systemische Behandlungsoption dar (4). Leider kommt es häufig zum Therapieversagen (5). Neuere Berichte über eine Assoziation der PRP mit Autoimmunerkrankungen unterstützten die Hypothese einer Immun-pathogenese, an der eine veränderte Immunantwort auf Autoantigene oder bakterielle Antigene beteiligt ist (6). Wenige positive Fallberichte zu MTX, Azathioprin, TNF-Blockern und unsere Fälle sprechen ebenfalls für eine Immunpathogenese der PRP.
Literatur: 1) Albert MR und Mackool (1999): Pityriasis rubra pilaris. Int J Dermatol 38:1-11. 2) Artik S et al. (2004): Pityriasis rubra pilaris. Der Hautarzt 10: 980-983. 3) Griffith WAD (1980): Pityriasis rubra pilaris. Clin Expert Dermatol 5:105-112. 4) Cohen CR, Prystowsky JH (1989): Pityriasis rubra pilaris: a review of diagnosis and treatment. J Am Acad Dermatol
20: 801-807. 5) Artik S et al. (2003): Pityriasis rubra pilaris. Fallberichte und Übersicht der Literatur. Der Hautarzt 9: 858-863. 6) Gregoriou S et al. (2009): Pityriasis rubra pilaris presenting with an abnormal autoimmune profile: two case reports.
J Med Case Rep 3: 123.
8

Fall 3 Vorgestellt von: AÄ Claudia Schiekofer, OÄ PD Dr. med. Claudia Pföhler Überwiesen von: Hautarzt Dr. med. R. Salzmann, St. Wendel Patient: R. K., männlich,52 Jahre Diagnose: Disseminierte kutane atypische Mykobakteriose bei einem immun-
kompetenten Landwirt Anamnese: Im Dezember 2011 stellte sich uns ein 52 jähriger Mann mit seit ca. drei Jahren
zunehmend erosiven Plaques und Knoten verteilt über das gesamte Integument vor. Anfänglich seien die Hautveränderungen lediglich an beiden Tibiakanten aufgetreten. An Vorerkrankungen ist eine Legionellose vor drei Jahren bekannt. Der Patient ist gelernter Landwirt. Alle Lokaltherapien waren sine effectu.
Hautbefund: Im Bereich der linken Schläfe, inguinal rechts und an beiden Unterschenkeln
zeigten sich scharf begrenzte, münzförmige bis ovaläre erythematöse Plaques mit zentraler Kruste.
Histologie: Histologisch war in der Probe aus der rechten Leiste eine plasmazellreiche
suppurative Entzündung zu sehen. Mit den gängigen Methoden (Ziehl-Neelsen, Giemsa, PAS) keine Erregernachweis. Molekularpathologisch (PCR): Mykobakterium avium.
Weitere Befunde: HIV-Serologie: negativ. Röntgen-Thorax in 2 Ebenen: Kein Hinweis auf eine
pulmonale Mykobakteriose. Therapie: Gemäß nationalem Referenzzentrum für Mykobakterien in Borstel Einleitung einer
Dreiertherapie mit Ethambutol 20mg/kg KG (1-0-0), Rifabutin 300 mg (1-0-0) sowie Clarithromycin 500 mg (1-0-1) p. o. eingeleitet. Geplant war eine Therapie über insgesamt ein Jahr. Fünf Tage nach Beginn der Einnahme kam es bei dem Patienten zu einer toxisch bedingten Leuko- und Thrombozytopenie, welche intensivmedizinisch behandelt werden musste. Aus diesem Grund Umstellung auf Monotherapie mit Clarithromycin 500 mg (1-0-1) p. o. Hierunter kam es zu einer zeitgerechten Besserung des Befundes.
Kommentar: Neben den „typischen“ Mykobakterien, die Tuberkulose und Lepra hervorrufen,
gibt des die Gruppe der „atypischen“ Mykobakterien, die ubiqitär in Boden und Gewässern vorkommen und nur gelegentlich Infektionen beim Menschen hervor-rufen [1]. In Europa sind M. marinum („Schwimmbadgranulom“), M. abscessus, M. fortuitum und M. chelonae die Hauptvertreter [2]. Die Inzidenz der Infektionen mit atypischen Mykobakterien ist mit dem Auftreten von AIDS und dem Aufkommen von immunsuppressiven Therapien deutlich angestiegen [1]. Am häufigsten ist die Lunge betroffen, aber auch Haut, Lymphknoten oder Knochen [2]. Wichtig ist, dass auch ein Wirt mit einem intakten Immunsystem betroffen sein kann, wenn der Erreger z. B. durch Verletzungen (z. B. Landwirt) in den Organismus inokuliert wird [1]. Liegt lediglich ein isolierter Hautinfekt vor, so reicht oft eine antibiotische Monotherapie z. B. mit Clarithromycin, tiefere oder disseminierte Infektionen benötigen eine Kombinationstherapie etwa mit Ethambutol, Rifabutin, Clarithromycin für 6 Wo. bis zu 1 Jahr [1,4].
Literatur: 1.) Lee WJ et al. Non-tuberculous mycobacterial infections of the skin: A retrospective study of 29
cases. J Dermatol 2010 Nov; 37(11):965-72 2.) Wagner D, Young LS. Nontuberculous mycobacterial infections: a clinical review. Infection 2004; 32:
257-270 3.) Herzmann C, Esser S, Lange C. Infektionen mit nicht tuberkulösen Mykobakterien bei HIV-infizierten
Patienten. Hautarzt 2011, 62: 272-279 4.) Aubry A, Chosidow O, Caumes E, Robert J, Cambau E. Sixty-three cases of Mycobacterium
marinum infection: clinical features, treatment, and antibiotic susceptibility of causative isolates. Arch Intern Med 2002; 162: 1746-1752
9

Fall 4 Vorgestellt von: AÄ M. Niclou, Prof. Dr. med. T. Vogt Überwiesen von: Hautarzt Dr. med. U. Wilhelmi, Bitburg Patient: E. B., weiblich, 10 Monate Diagnose: Praecalcaneale congenitale fibrolipomatöse Hamartome (PCFH) - Schon mal gesehen? Anamnese: Bereits nach der Geburt fiel im Bereich der linken Ferse ein hautfarbener
symptomloser weicher Knoten auf, einige Wochen später auch auf der Gegenseite. Der Säugling ist ansonsten gesund. Der Vater leidet seit dem 16. Lebensjahr unter dem Auftreten von Lipomen an Armen und Beinen, die Fersen sind nicht betroffen.
Hautbefund: Fersen medial bds.: jeweils ein einzelner, lipomatöser, weich tastbarer,
hautfarbener, nicht druckdolenter, nicht überwärmter Knoten. Sonographisch lassen sich die Knoten nicht von den umgebenden Fettgewebspartien abgrenzen.
Therapie: Derzeit besteht kein weiterer Handlungsbedarf, jedoch empfiehlt sich eine
orthopädische Begleitung des Kindes im Rahmen des Laufenlernens, um mögliche Fehlhaltungen und Fehlbelastungen der Füße oder der unteren Extremitäten zu vermeiden.
Kommentar: Die praecalcanealen congenitalen fibrolipomatösen Hamartome (PCFH) betreffen
ansonsten gesunde Säuglinge. Gelegentlich werden sie bereits bei der Geburt beobachtet, größtenteils fallen diese asymptomatischen Hamartome aber erst im Laufe der ersten Lebensmonate als oft beunruhigende Zufallsbefunde auf. Meist persistieren die Knoten, allerdings fehlen derzeit verlässliche Follow-Up-Untersuchungen (1). Angaben über die Häufigkeit des Auftretens liegen nicht vor, aufgrund der Beschwerdefreiheit der Patienten geht man allerdings von einer relativ hohen Dunkelziffer aus. Die Erstbeschreibung geht auf Elsahy zurück (1977), damals noch unter dem Namen der congenital fibrolipomata. 19 Jahre später berichtete Larreque über 5 weitere Fälle und führte den Begriff der PCFH ein. Bis heute ist die Ätiologie ungeklärt allerdings finden sich in der Literatur immer wieder folgende 2 Erklärungsversuche (2). Zum einen könnte eine frühe fetale Entwicklungsstörung des Fasergewebes der Fußsohle vorliegen. Vorübergehend kommt es beim Feten während der Entwicklung zur physiologischen Hypertrophie der Subkutis, die PCFH könnten so auf einer inkompletten Regression des fetalen Fettgewebes beruhen. Zum anderen wäre eine Herniation von Fettgewebe durch eine möglicherweise defekte Plantarfaszie denkbar. Auch genetische Ursachen mit einem autosomal-dominanten oder einem X-chromosomalen Vererbungsmuster werden diskutiert und durch einige wenige Fälle mit familiärer Häufung bekräftigt, allerdings fehlen Belege und die Mehrheit der bisher beschriebenen Fälle trat sporadisch bei negativer Familienanamnese auf. Hinweise auf assoziierte Fehlbildungen gibt es keine. Im Vordergrund steht die meist besorgten Eltern über die Harmlosigkeit des Befundes aufzuklären und unnötige invasive diagnostische und traumatisierende Maßnahmen zu vermeiden. Die Differentialdiagnose ist allerdings umfassend: juvenile plantare Fibromatose, Hoffmann-Zurhelle-Nävus, benigne symmetrische Lipomatose, piezogene Knötchen u. a. m. (3).
Literatur: 1) Laetsch Semadani B und Mainetti C (2008): Precalcaneal congenital fibrolipomatous hamartomas:
Report of 3 additional cases and discussion of the differential diagnosis. Dermatology 2009. 218: 260-264.
2) Höger P. (2011): Diagnose: Praecalcaneales fibrolipomatöses Hamartom (PCFH). Kinder -und Jugendarzt 42.Jg. Nr.9. 487-488.
3) Yang J.-H. und Park O.-J. (2011): Praecalcaneal congenital fibrolipomatous hamartoma. Ann Dermatol. Vol.23, No. 1: 92-94.
10

Fall 5 Vorgestellt von: AÄ Dr. med. L. Trémezaygues, Prof. Dr. med. T. Vogt Patientin: B. M., weiblich, 68 Jahre Diagnose: Postmenopausale frontal fibrosierende Alopezie Kossard - lohnt eine Therapie überhaupt? Anamnese: Langsam progredienter Haarverlust zunächst am seitlichen und frontalen Capillitium
ab 2007, dann Verlust von Augenbrauen und Wimpern. Keine Besserung des Befundes unter Lokaltherapie mit Kortikosteroiden, kaum Besserung mit systemischen Steroiden.
Hautbefund: Am Capillitium seitlich triangulär und frontal Haarverlust, welcher ophiasisartig auch
den Nacken erfasst. Akzentuierte follikuläre Hyperkeratosen; z. T. auch atrophisch vernarbte, glatt spiegelnde alopezische Areale. Vollständiger Verlust der Augenbrauen und Wimpern sowie Reduktion der Achselhaare.
Histologie: Follikuläre Hyperkeratose mit Hypergranulose und geringe perifollikuläre Fibrose, an
den follikulären Lichen ruber erinnernd. Weitere Befunde: Keine relevanten Vorerkrankungen oder Medikamenteneinnahme. Die dermatolo-
gische Eigen- und Familienanamnese ist leer. Insbesondere ist in der Familie keine Form von Alopezie bekannt. ANA’s, Schliddrüsenhormone und Schilddrüsenauto-antikörper waren normwertig.
Therapie: Systemische Therapie mit Quensyl 200mg/d. Topisch Kortikosteroide Klasse III. Kommentar: Bei der frontal fibrosierenden Alopezie Kossard handelt es sich um einen progressiven
frontotemporalen Haarausfall, der durch eine inflammatorische Destruktion der Haarfollikel bedingt ist. Die Ätiologie der Erkrankung ist bislang unbekannt. Vermutet wird eine zelluläre Autoimmunreaktion gegen basale Follikelkeratinozyten (1). Da diese Form der vernarbenden Alopezie überwiegend bei Frauen in der Postmenopause auftritt, wurde auch ein seltenes follikuläres Involutionsphänomen im Rahmen der postmenopausalen Hormonumstellung angenommen (2). Klinisch zeigt sich eine atrophisierende Alopezie mit Rückgang des frontotemporalen Haaransatzes und Rarefizierung der Augenbrauen. Charakteristisch sind ebenfalls halskrausenartige perifollikuläre Rötungen. Zur Diagnosestellung der Erkrankung trägt, in Zusammen-schau mit der Histologie, auch wesentlich die Dermatoskopie der Kopfhaut bei. Typisch sind ein verminderte Zahl von follikulären Ostiae mit perifollikulärer Schuppung und Erythem und eine Variabilität der Haarschaftdicken (3). Der Verlauf der frontal fibrosierenden Alopezie ist überaus chronisch. Eine spezifische Therapie ist nicht bekannt. Versucht werden topische oder intraläsionale Glukokortikosteroide sowie Lasertherapie. Auch eine systemische Anwendung von Glukokortikosteroiden, Hydroxychloroquin, Ciclosporin A, Azathioprin, Thalidomid, Neotigason und Mycophenolatmofetil wurden für therapieresistente Formen beschrieben. Bis heute fehlt jedoch der Nachweis, dass eine dieser Therapien wirklich hilft. Zielsetzung kann meist nur sein, ein weiteres Fortschreiten der Erkrankung zu verhindern. Von Donovan et al ein mögliches Nachwachsen von Augenbrauen nach intraläsionaler Applikation von Triamcinolon beschrieben (4). Patienten sollten über den Verlauf der Erkrankung aufgeklärt werden und frühzeitige psychologische Hilfestellung und andere Hilfsmaßnahmen (Perücken, temporär befestigte Zweithaarteile o. ä.) angeboten werden.
Literatur: 1)Tremezaygues L, Vogt T, Müller CSL. Frontal fibrosierende Alopezie mit androgenetischem Muster. Eine diagnostische Herausforderung – eine therapeutische Crux. Hautarzt 2012 (63); 411-414. 2)MacDonald A, Clark C, Holmes S. Frontal fibrosing alopecia: a review of 60 cases. J Am Acad Dermatol 2012, in p 3) Mireles-Rocha H, Sánchez-Dueñas LE, Hernández-Torres M. Frontal fibrosing alopecia: dermosopic features. Actas Dermosifiliog. 2012 (103); 167-8. 4)Donovan JC, Samrao A, Ruben BS, Price VH. Eyebrow regrowth in patients with frontal fibrosing alopecia treated with intralesional triamcinolone acetonide. BJ D 2010 (163); 1142-1145.
11

Fall 6 Vorgestellt von: AÄ Dr. med. Rebecca Körner, OÄ Dr. med. Cornelia Müller Überwiesen von: Hautärztin Dr. C. Jonas, Lebach Patient: N. W., 33 Jahre, weiblich Diagnose: Kongenitale retikuläre ichthyosiforme Erythrodermie
(Ichthyosis variegata) – Was hilft solchen Patienten? Anamnese: Seit dem 4. Lebensmonat bestehen Hautveränderungen in Form von
erythematösen, netzförmigen Maculae und Plaques. Begonnen hätten die Hautveränderungen an Fingern und Zehen. Seit dem 11. Lebensmonat Ausbreitung auf das gesamten Integument. Seither Persistenz und schubweise Verschlechterung der Hautveränderungen. Von 1996 bis 1998 Therapie mit Neotigason mit gutem Erfolg. Die Therapie wurde auf Grund von Nebenwirkungen abgebrochen. Aktuell besteht Kinderwunsch, sodass die Patientin eine systemische Therapie ablehnt.
Hautbefund: Am gesamten Integument netzförmige erythematöse Maculae und Plaques mit
variabler Schuppung. Eingestreut Areale klinisch unauffälliger Haut. Massive, samtartige Hyperkeratosen finden sich im Bereich der Kniebeugen, Ellenbogen und Sprunggelenke. Palmoplantar plattenförmige Hyperkeratosen. Weißlich bis gelbliche Verfärbung und Dystrophie aller Nägel. Diffuse Alopezie.
Histologie: Papillomatös aufgefaltete Epidermis mit Hypergranulose und säulenartiger
Hyperparakeratose. Gelegentlich in den säulenförmigen Parakeratosehügeln Hämorrhagien. Vereinzelt an Koilozyten erinnernde Zellen und binukleäre Zellen. Angrenzend dilatierte Gefäße im Papillarkörper.
Therapie: Unter stationären Bedingungen erfolgte im Mai 2012 eine Lokaltherapie mit 0,1%
Triamcinolon in Unguentum leniens im Wechsel mit 10% Kochsalzcreme zur keratolytischen Therapie. Weiterhin initiierten wir eine Bädertherapie mit täglichen Kleopatra-Bädern (2 Tassen Milch und 2 Esslöffel Öl auf eine Badewanne), sowie eine UVB-Schmalspektrum-Lichttherapie. Darunter gute Stabilisierung und Besserung.
Kommentar: Die kongenitale retikuläre ichthyosiforme Erythrodermie oder auch Ichthyosis
variegata zählt zu der Gruppe der kongenitalen Ichthyosen und manifestiert sich wie auch bei unserer Patientin bereits kurz nach der Geburt. Auf Grund des klinischen Bildes mit gesunden Hautarealen zwischen den betroffenen Hautarealen wird die Erkrankung auch als „Konfetti-Ichthyose“ bezeichnet. Ursächlich ist wahrscheinlich eine Mutation im Keratin-10-Gen auf Chromosom 17 [1]. Bei der Konfetti-Ichthyose können sich die gesunden Hautareale im Laufe des Lebens weiter ausdehnen durch mitotische Rekombination [1].
Bei fehlender kausaler Therapie gibt es wenige Möglichkeiten den Hautzustand zu verbessern [2]. Bäder 1-2x tgl. mit Natriumhydrogen-karbonat, mechanische Keratolyse bspw. mit Mikrofasertüchern oder Bimsstein und Lokaltherapie mit keratolytischen Harnstoff-, Kochsalz-, Milchsäure- oder Salicylsäure -haltigen Externa werden empfohlen Wegen der häufigen Anhidrose, ist zudem auf ausreichende Flüssigkeitszufuhr zu achten. [2, 3].
Literatur: 1. Choate KA et al. Mitotic recombination in patients with Ichthyosis causes reversion of dominant
mutation in KRT10. Science 2010; 330(6000): 94-97 2. Küster W. Ichthyosen: Vorschläge für eine verbesserte Therapie. Deutsches Ärzteblatt 2006;
Heft 24: 1684-1689 3. Traupe H, Burgdorf WHC. Treatment of ichthyosis – There is always something we can do! In
memoriam: Wolfgang Küster. J Am Acad Dermatol 2007; 57: 542-7
12

Vorgestellt von: AÄ Evgenia Markeeva, Prof. Dr. med. T. Vogt Fall 7 Überwiesen von: Herrn Dr. med. Dewes Patient: M.P., m., 28 Jahre Diagnose: CD8+ Pagetoide Retikulose (M. Woringer-Kolopp) Anamnese: Der Patient berichtet, dass seit seinem 9. Lebensjahr eine ekzematöse
Hautveränderung im Bereich der linken Fußsohle bestehe. Im Verlauf langsames Wachstum. Weitere Hautveränderungen im Bereich der rechten Fußsohle und axillär rechts seien später dazugekommen. Störend sei ein Brennen mit Blasenbildung (bis zu 5 cm im Durchmesser) an der Fußsohle z. B. nach dem Sport. Alle Lokaltherapien waren stets sine effectu.
Hautbefund: Im Bereich der rechten Fußkante medial ein ca. 5x7 cm messendes Areal mit
Schuppung und kleinen Erosionen, ferner Lichenifikation. Links misst die Hautveränderung ca.5x4 cm. Axillär rechts findet man eine ca. 7 cm durchmessende flächige scharf begrenzte erythematöse Makula.
Histologie: Regelrecht geschichtete Epidermis mit kompakter Orthohyperkeratose. Pagetoides
stark epidermotropes lymphozytäres Infiltrat mit Interfacedermatitis. Zahlreiche Pautrier’sche Mikroabszesse. Immun-phänotypisierung: CD8+, CD45RO+, CD43+, CD30-, CD15-, CD56-. T-Zellrezeptorgen-Rearrangementuntersuchung auf Klonalität steht aus.
Weitere Diagnostik: Mykologie allseits negativ. Lymphknotensonographie, Röntgen-Thorax und
Abdomensonographie unauffällig. Lymphozyten Subpopulation im PB ohne path. Befund.
Therapie: Einleitung einer Creme-PUVA-Therapie. Kommentar: Die Pagetoide Retikulose (PG) stellt eine Sonderform der Mycosis fungoides dar.
Als solitäre Form der Erkrankung wird sie auch als M. Woringer-Kolopp bezeichnet, disseminiert früher als M. Ketron-Goodman. Letztere Kondition wird heutzutage nicht mehr der PG zugerechnet, sondern nach der WHO-EORTC-Klassifikation den aggressiven CD8+ T-Zell-Lymphomen bzw. den kutanen gamma/delta+ T-Zell-Lymphomen oder den extranodalen NK/T-Zell-Lymphomen [1]. Klinisch findet man beim M. Woringer-Kolopp solitäre scharf begrenzte, entzündet wirkende schuppende Plaques, die sehr langsam an Größe zunehmen und bevorzugt an den Extremitäten auftreten. Männer sind häufiger betroffen als Frauen, typischerweise im Erwachsenenalter, jedoch können auch Kinder betroffen sein [2]. Die Dermatoskopie kann diagnostisch helfen: man findet punktförmige und glomeruläre Gefäße, zentral ein homogenes rosiges Bild. In der Peripherie ein weißliches Netzwerk (Negativnetzwerk) wahrscheinlich durch epidermale Akanthose [3]. Histologisch findet man dichtes Infiltrat aus atypischen polymorphen Lymphozyten mit pagetoidem Epidermotropismus [4]. Immunpathologisch zeigen sich mehrere Phänotypen: CD4+/CD8-, CD4-/CD8+ oder CD4-/CD8-. Diese Phänotypen scheinen keine prognostische Bedeutung zu haben. Allgemein ist die Prognose der Erkrankung günstig. Therapeutische Optionen sind Photochemotherapie, Bestrahlung und Exzision. Wegen der unspezifischen Klinik dauert die endgültige Diagnosestellung oft einige Jahre, im Falle unseres Patienten ca. 20 Jahre.
Literatur: 1. Lichte, V., et al., Pagetoid reticulosis (Woringer-Kolopp disease). J Dtsch Dermatol Ges, 2009. 7(4):
p. 353-4. 2. Matsuzaki, Y., et al., Localized pagetoid reticulosis (Woringer-Kolopp disease) in early childhood. J
Am Acad Dermatol, 2009. 61(1): p. 120-3. 3. Suzaki, R., et al., Dermoscopic Features of CD8-Positive Solitary Pagetoid Reticulosis on the Left
Leg. Dermatol Res Pract. 2010. 4. Martin, S.J., et al., CD8+ Pagetoid Reticulosis Presenting as a Solitary Foot Plaque in a Young
Woman. J Clin Aesthet Dermatol. 3(10): p. 46-9.
13

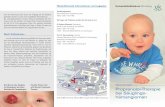
Fall K01 Vorgestellt von: AÄ Dr. med. L. Trémezaygues und OÄ PD Dr. med. C. Pföhler Patientin: S. H., weiblich, 6 Wochen Diagnose: Topische Therapie eines frühkindlichen Hämangioms mit Propranolol- Gel – eine neue dermatotherapeutische Option? Anamnese: Seit der Geburt bestehendes Hämangiom an der Stirn. Nach Angaben der Eltern
sei das initial flache Hämangiom im Laufe der Zeit tumorartig erhabener geworden. Hautbefund: An der Stirn ca. 1,8 cm großer, kissenartig erhabener roter Knoten mit blau-lividem
Randsaum. Sonographisch flaue Vaskularisation; keine high-flow-Anteile. Therapie: Topische Therapie mit 1% Propranolol-Gel okklusiv über Nacht. Kommentar: Hämangiome treten bei 10-12% der Kinder meist kurz nach der Geburt auf; bei
Frühgeborenen bis 22%, Mädchen sind 3-5mal häufiger betroffen. Die Ätiopatho-genese infantiler Hämangiome ist bisher ungeklärt. Derzeitige Hypothesen umfassen somatische Mutationen von Endothel- oder Endothelvorläuferzellen mit Hyperproliferation durch VEGF-Überstimulierbarkeit, Fehldifferenzierungen mesodermaler Zellen sowie die Möglichkeit einer embolischen Verschleppung plazentarer Zellen. Therapeutisch stehen laut AWMF-Leitlinie mehrere Optionen zur Verfügung (1): a) „wait and see“: bei kleinen, kosmetisch und funktionell nicht störenden Hämangiomen, b) Kontaktkryotherapie: für plane, plaqueartige Hämangiome (begrenzte Eindring-tiefe, geringe Schmerzhaftigkeit), c) Lasertherapie: Farbstofflaser oder Blitzlampe für oberflächliche Hämangiome (tiefe Anteile werden nicht erfasst, starke Schmerz-haftigkeit, Lokalanästhesie oder Narkose erforderlich), Nd:YAG Laser (perkutan, interstitiell) für rapide proliferierende und tiefe Hämangiome (Narbenbildung, zwingend Narkose erforderlich), d) operative Resektion bei drohenden Komplika-tionen oder zur Beseitigung von Residuen, e) systemische Glukokortikoide bei aggressiv wachsenden Hämangiomen, z. B. 2,5 mg Prednisolon/kg/Tag über mehrere Wochen. Mittel der Wahl zur Therapie großer oder rasch wachsender infantiler Hämangiome insbesondere in Risikolokalisationen ist seit seiner zufälligen Entdeckung für die Hämangiomtherapie 2008 der Betablocker Propranolol (2). Er soll über eine Vasokonstriktion, eine verminderte Expression von VEGF und eine Apoptose-induktion der Endothelzellen wirken. Die empfohlene Dosis liegt zwischen 1,5-3 mg/Tag. Die Therapie muss langfristig unter engmaschiger Überwachung der Säuglinge durchgeführt werden. Einer deutschen Arbeitsgruppe aus Tübingen gelang es 2012 eine Rückbildung von Hämangiomen unter topischer Therapie mit Timolol 0,5% Gel nachzuweisen (3). Das Gel wurde 1x täglich okklusiv in Finn Chambers appliziert (n=11). Erste Effekte zeigten sich innerhalb der ersten 2 Wochen. Eine Involution von >80% des Hämangioms zeigte sich bei 7/11 Patienten nach 8-30 Wochen. In Anlehnung an diese vielversprechenden Erfolge behandeln wir zurzeit in Zusammenarbeit mit der hiesigen Kinderklinik 3 Säuglinge mit Hämangiomen mit 1% Propranolol Gel. Eine abschließende Bewertung ist aktuell noch nicht möglich.
Literatur: 1) AWMF-Leitlinie “Hämangiome im Säuglings- und Kindesalter” (Stand 13.10.2010, aktuell in Überarbeitung) 2) Léauté-Labrèze C, Dumas de la Roque E, Hubiche T et al. Propranolol for severe haemangiomas of infacy. N Engl J Med 2008; 358: 2649-2651. 3) Moehrle M, Léauté-Labrèze C, Schmidt V, Röcken M, Poets CF, Goelz R. Topical timolol for small
haemangiomas of infancy. Pediatric Dermatology 2012, 1-5.
14

Fall K02 Vorgestellt von: AÄ J. Jungmann und Ltd. OA Prof. Dr. med. J. Reichrath Überwiesen von: Hautarzt Dr. med. T. Lechner, Saarbrücken Patient: L. S., männlich, 2 Jahre Diagnose: Hypomelanosis Ito: Eine seltene Blaschko-lineäre Störung der Haut mit
hoher klinischer Variabilität Anamnese: Im ersten Lebensjahr fiel bei der Routineuntersuchung des Kinderarztes eine in
Wirbeln und Wellen angeordnete streifenförmige Hypopigmentierung der Haut im Bereich des lateralen Rumpfes auf. Sonst altergemäß normal entwickelter Junge. Negative FA.
Hautbefund: In Wirbeln und Wellen verlaufende streifenförmige Hypopigmentierung entlang der
Blaschko-Linien mit Betonung des lateralen Körperstammes. Haarkleid, Dentition, Nägel ohne Anomalien.
Weitere Befunde: Hypospadie, lagerungsbedingte (?) Schädelasymmetrie. Kommentar: Die Hypomelanosis Ito (HI) oder Incontinentia pigmenti achromians ist eine
erstmals 1952 von Ito beschriebene seltene Pigmentierungsstörung (Häufigkeit 1 : 82.000), welche von Geburt an besteht oder sich im ersten Lebensjahr manifestiert (1, 2). In der Kindheit meist zunächst Verstärkung, im Laufe des Lebens dann oft leichte Abnahme der streifigen Hypopigmentierung. Happle unterteilte die HI in zwei Subtypen: Subtyp 1a zeigt enge Streifen wie unser Fall, währenddessen Subtyp 1b sich in breiten Banden darstellt (3). In der Mehrzahl der Fälle ist der Körperstamm unilateral betroffen. Seltener zeigen sich die Hypopigmentierungen im Bereich der Extremitäten oder des Gesichts. Die Handinnenflächen, Fußsohlen und Schleimhäute sind nicht betroffen. Die HI kann mit einer Vielzahl von assoziierten Symptomen einhergehen, wobei die Angaben hinsichtlich der Rate zwischen 33% und 94% schwanken (1,4). Neben den typischen Hautveränderungen sind Alopezien sowie Nagel- und Zahnveränderungen beschrieben. Unter anderem werden Cafe-au-lait Flecken, Cutis mamorata und angiomatöse Nävi beobachtet. Am häufigsten seien neurologische Assoziationen, wobei eine Diskrepanz zwischen neurologischen (94-100%) und dermatologischen Studien (33-60%) besteht, im Sinne von Entwicklungsverzögerung und mentaler Retardierung. 20-30% der Betroffenen haben kranio-faziale Anomalien wie Makrocephalie, orbitaler Hypertelorismus sowie tief sitzende Ohren. Weitere kranio-faziale Anomalien, wie Mikrocephalus oder Brachiocephalus werden in geringeren Raten beobachtet. Daneben auch Differenzen von Arm- und Beinlängen und Kleinwuchs. In mehreren Studien Assoziation der HI mit benignen Tumoren wie Teratomen, Epidermoidzysten und Plexuspapillomen (1,3).
Die Häufigkeit krankhafter Assoziationen wird u. U. neurologischerseits überschätzt, der Dermatologe sollte die Assoziationen zumindest kennen, und zur interdisziplinären Betreuung raten.
Literatur: 1) Pascual-Castroviejo I, Roche C, Martinez-Bermejo A et al: Hypomelanosis of Ito. A study of 76
infantile cases. Brain Dev 1998;20:36-43. 2) Ruggieri M., Pavone L: Topical review: Hypomelanosis of Ito: Clinical Syndrome or just Phenotype?
J. Child Neurol 2000;15:635. 3) Happle R: Mosaicism in human skin. Understanding the patterns and mechanisms. Arch Dermatol
1993;129:1460-1470. 4) Nehal KS, PeBenito R, Orlow SJ: Analysis of 54 cases of hypopigmentation and hyperpigmentation
along the lines of Blaschko. Arch Dermatol. 1996;132(10):1167-70.
15

Fall K03 Vorgestellt von: AÄ Claudia Schiekofer, OÄ PD Dr. med. Claudia Pföhler Überwiesen von: Praktische Ärztin Dr. med. B. Kubin-Siring, Kaiserlautern Patient: D. V., 37 Jahre Diagnose: Isolierte mucosale orale Lues II imitiert bullöses Pemphigoid Anamnese: Im August 2011 stellte sich ein 37 jährige Frau mit seit ca. 2 Jahren bestehenden
Mundschleimhautveränderungen in unserer Hochschulambulanz mit der Diagnose „Herpes“ vor. Ein TPPA-Screen sei unauffällig gewesen. Probebiopsie: unspezifischen Ulkus. Die BP 180 Antikörper waren positiv. Daher stellten wir die Diagnose eines Schleimhautpemphigoids und leiteten eine systemische Therapie mit Dapson ein. Da es auch hierunter zu keiner Befundbesserung kam, wurde die Immunsuppression erweitert bzw. umgestellt auf Methyprednisolon, Azathioprin. Im Rahmen des stationären Aufenthaltes zur Einleitung einer Therapie mit Rituximab erfolgte die erneute Abnahme einer Lues-Serologie. Diese zeigte sich nun deutlich positiv (s. u.)
Hautbefund: Im Bereich der Mundschleimhaut v. a. an der Innenseite von Ober- und Unterlippe,
Zunge und Gaumen zeigten sich multiple Erosionen. Histologie: Primär „unspezifisches Ulcus“. Eine spätere Immunhistochemie an Re-PE mittels
Spirochätenantikörper war schließlich positiv. Weitere Befunde: BP 180: 39 U/ml (positiv > 20 U/ml) TP-PA: reaktiv (1: 163840), VDRL: 1:16, Syphilis-EIA (BEP): positiv Syphilis Western-Blot IgG positiv, Syphilis Western-Blot IgM grenzwertig (evtl.
durch die Immunsuppressive Therapie beeinflusst) Therapie: Nach Erhalt der Syphilis-Serologie wurde die immunsupressive Therapie abgesetzt
und Benzylpenicillin-Benzathin 2,4 Mega i. m. injiziert unter Prophylaxe einer Jarisch Herxheimer Reaktion mit Methylprednisolon 32 mg. Die Injektionen wurden im Abstand von einer Woche zweimal wiederholt. Mittels Lumbalpunktion wurde eine Neurolues ausgeschlossen.
Kommentar: Die Syphilis ist laut RKI aktuell wieder auf dem Vormarsch. Die Syphilis ist der
große Imitator, wie unser Fall erneut belegt [1,2]. Die Beteiligung der Mundschleimhaut tritt typischerweise im Sekundärstadium auf
[3]. Dabei handelt es sich um das erregerreichste Stadium [2]. Typischerweise kommt es dabei zum Auftreten eines Exanthems, Plaques muqeuses und Lymphadenopathie [2]. Der hier aufgezeigte Fall demonstriert hingegen, dass die Lues II nicht zwingend polysymptomatisch sein muss und auch ein isolierter Mundschleimhautbefund – Pemphigus und Pemphigoid nachahmend – vorkommen kann. Bei unserer Patientin kam es wahrscheinlich durch die Lues zu einer falsch-positiven Pemphigoid-Serologie mit Nachweis von Serumantikörpern gegen BP 180.
Literatur: 1.) Compilato D, amato S, Campisi G. Resurgenceof syphilis: a diagnosis based on unusal oral mucosa
leasion. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 108: e45-e49 2.) Plewig G, Landthaler M, Burgdorf WHC, Hertl M, Ruzicka T. Braun-Falco’s Dermatologie,
Venerologie und Allergologie 6. Auflage: 299-323 3.) Leao JC, Gueiros LA, Porter SR. Oral Manifestation of syphilis. Clinics 2006; 61: 161-166
16

Fall K04 Vorgestellt von: AÄ Dr. med. Rebecca Körner, Prof. Dr. med. Th. Vogt Überwiesen von: Facharzt für Allgemeinmedizin Dr. S. Niederländer, Schwalbach Patient: W. L., 56 Jahre, männlich Diagnose: Darier-artige Keratosen unter Vemurafenib – eine weitere Facette der kutanen
Nebenwirkungen Anamnese: Wir stellen einen Pat. mit metastasierendem malignen Melanom vor, Mutations-
status BRAF V600E positiv. Es wurde daher ab Mai 2012 eine Therapie mit Vemurafenib (Zelboraf ®) 240 mg 4-0-4 eingeleitet. Ein Staging im Juli 2012 zeigte eine complete remission. Jedoch entwickelte der Patient diverse Hautveränderungen.
Hautbefund: Bei der klinischen Untersuchung zeigten sich im Bereich der Fußsohlen und der
Handinnenflächen gelbliche teils schwielenartig verhärtete, teils abschuppende Areale. Dermatitis solaris - Bild im Bereich des Gesichtes. Am oberen Rücken auch mehrere raue, leicht schuppende, hautfarbene bis bräunliche Plaques.
Histologie: Rücken: Fokal suprabasale Spaltbildung mit akantholytischen Keratinozyten.
Reaktive Proliferation basaler Keratinozyten. Zum Teil follikulär pfropfartig aggregiert zahlreiche dyskeratotische Keratinozyten (grains und corps ronds) und säulenartige Parakeratose, vereinbar mit Morbus Darier.
Therapie: Lokaltherapie mit Steroid- und Isotretinoin-haltigen Externa. Kommentar: Vemurafenib zeigt bei BRAF V600E mutierten Melanomen hohe Ansprechraten [1].
Neben kardialen und okkulären Nebenwirkungen sind auch zahlreiche kutane beschrieben [2, 3]: Spinozelluläre Karzinome, Keratoakanthome, warzige Dyskeratome: Interessanterweise auch Eruptionen, welche histologisch an „akantholytische“ Dermatosen erinnern [2, 3]. Unser Patient entwickelte zahlreiche schuppende bis hyperkeratotische Plaques und Maculae am Rücken. Histologisch zeigte sich ein Bild, das einem Morbus Darier entspricht. Ätiologisch kommen hier evtl. zusätzliche RAS-Mutationen in Keratinozyten zum Tragen. Solche Zellen zeigen unter BRAF Hemmung eine starke CRAF-Aktivierung [5]. Auch ist bekannt, dass RAS-mutierte Zellen eine erniedrigte SERCA2-Expression zeigen, jenes Enzyms, das bei Morbus Darier vermindert ist. Die paradoxe Aktivierung von CRAF mindert die SERCA2-Funktion weiter [3, 5].
Für den Kliniker erscheint es wichtig, Darier- und auch Grover-artige Exantheme unter Vemurafenib zu kennen, da diese keine eigenständigen Erkrankungen darstellen, sondern eine Facette der möglichen kutanen Nebenwirkungen der Vemurafenib-Therapie.
Literatur: 1. Chapman PB et al. Improved survival with Vemurafenib in melanoma with BRAF V600E mutation.
NEJM 2011; 364: 2507-16 2. Huang V, Hepper D, Anadkat M, Cornelius L. Cutaneous toxic effects associated with Vemurafenib
and Inhibition of the BRAF pathway. Arch Dermatol 2012, Vol 148, No 5: 628-633 3. Chu EY, Wanat KA, Miller CJ et al. Diverse cutaneous side effects associated with BRAF inhibitor
therapy: A clinicopathologic study. J Am Acad Dermatol, in press; doi:10.1016/j.jaad.2012.04.008 4. Belloni B, Schönewolf N, Rozati S, Goldinger SM, Dummer R. Cutaneous drug eruptions associated
with the use of new oncological drugs. Chem Immunol Allergy 2012; Vol 97: 191-202 5. Heidron SJ et al. Kinase-dead BRAF and oncogenic RAS cooperate to drive tumor progression
through CRAF. Cell 2010; 22; 140: 209-21
17

Vorgestellt von: AÄ Dr. med. M. Schmidt-Bachmann, OA PD Dr. med. A. Rösch Überwiesen von: Hautärztin Dr. med. A. Kalt Patientin: J. V., weiblich, 53 Jahre, Diagnose: Eruptive zosteriforme Piloleiomyome im Erwachsenenalter assoziiert mit
Uterus myomatosus Anamnese: Bei der Patientin entwickelten sich gruppierte Knötchen über einen Zeitraum von
2 Jahren. Subjektiv besteht nur geringer Juckreiz. Bemerkenswert ist ein Z. n. Myomektomie bei Uterus myomatosus. Die Familienanamnese ist unauffällig.
Hautbefund: Thorakolumbal rechts zeigten sich multiple, zosteriform gruppierte ca. 5-10 mm
messende hautfarbene bis rot-braune, weiche Nodi. Histologie: Im Korium Faszikel mit α-SMA, Caldesmon und Desmin-positiven, spindeligen
Zellen mit zigarettenförmigen Nuclei. Eine zuvor mit Ki67 erfassbare erhöhte Proliferationsaktivität der Tumorzellen konnte in einer Re-Biopsie nicht bestätigt werden.
Labor: VZV-Serologie IgG positiv, IgA, IgM negativ. Tumormarker normwertig, außer NSE:
erhöht mit 61,9 µg/l. Therapie: Aufgrund des stationären Verlaufs besteht derzeit bei der Patientin kein Wunsch
zu einer Therapie und u. E. kein medizinisch begründeter Zwang, dennoch werden Befundkontrollen zunächst 3-monatig empfohlen.
Kommentar: Kutane Piloleiomyome treten oft multipel in einer segmentalen, streifigen oder
blaschkolineären Verteilung auf, gern an den Streckseiten der unteren Extremität bei jüngeren Frauen. Bei einem Teil dieser Pat. beobachtet man einen autosomal dominanten Erbgang. Eine rein zosteriforme Verteilung multipler Leiomyome ist selten. Charakteristisch sind oft brennende, einschießende Schmerzen z. B. bei Berührung. Während bei Schmerzsymptomen eine symptomatische Therapie mit Analgetika, Antidepressiva, Antiepeleptika oder Kalziumkanalblocker im Vordergrund steht, ist bei einzelnen Leiomyomen eine Exzision die Therapie der Wahl. Bei multiplen Leiomyomen sind Kryotherapie, Elektrokoagulation oder die Laserablation (z. B. CO2 Laser) weitere Therapiemöglichkeiten zur Behandlung. Die Piloleiomyome neigen allerdings häufig zu Rezidiven. Neuere Untersuchungen zeigten, dass molekulargenetisch eine Mutation des Fumarat Hydratase (FH) Gens zugrunde liegt, eingebunden in den mitochondrialen Krebs Zyklus (1). Neben den Hautveränderungen besteht durch die Mutation der FH eine Assoziation zu Myomen der Gebärmutter (MCUL-Syndrom), sowie zu Nierenzellkarzinomen (HLRCC Syndrom) (2, 3). Bei Auftreten von Leiomyomen empfiehlt sich daher eine humangenetische Untersuchung, sowie ein Neoplasieausschluss. Wichtig ist auch, dass Leiomyosarkome so gut wie nie aus Leiomyomen hervorgehen, jedoch sind einzelne Fälle dokumentiert (4), daher der Rat zur Beobachtung bei aktuellem Therapieverzicht.
Literatur: 1) Badeloe S, Van Geel M, Van Steensel M, Bastida J, Ferrando J, Steijlen P, Frank J, Poblete-Guitierrez P (2006)
Diffuse and segmental variants of cutaneous leiomyomatosis: novel mutations in the fumarate hydratase gene and review of the literature. Experimental Dermatology 15: 735-741 2) Reed WB, Walker R, Horowitz R. Cutaneous leiomyomata with uterine leiomyomata. Acta Derm Venereol. 1973;53:409–16 3) Launonen V, Vierimaa O, Kiuru M, Isola J, Roth S, Pukkala E, et al. Inherited susceptibility to uterine leiomyomas and renal cell cancer. Proc Natl Acad Sci USA. 2001;98:3387–92 4) Utikal J, Haus G, Poenitz N, Koenen W, Back W, Dippel E, Gratchev A, Goerdt S. Cutaneus leiomyosarcoma with mixoid alteration arising in a setting of multiple cutaneus smooth muscle neoplasms. In: Journal of Cutaneus Pathology 2006: 33 (Suppl.2): 20-23
Fall K05
18

Vorgestellt von: OÄ Dr. med. C. Müller Thema: Neues aus dem OP: erfolgreiche Versorgung großer Defekte mit Integra® Hintergrund: Was haben eine beiderseitig auftretende Arteriitis temporalis, eine ausgedehnte
anogenitale Akne inversa und ein Merkelzell-Karzinom gemeinsam? Nach suffizienter chirurgischer Sanierung können ausgedehnte und tiefe Haut- und Weichteildefekte vorliegen, welche einer der individuellen Patientensituation angepassten Therapie bedürfen. Die Integraversorgung soll hier an einigen Fällen verdeutlicht werden. Patientin 1: 48-jährige Patientin mit ausgedehnter anogenitaler Akne inversa. Patient 2: 94-jähriger Patient mit entdifferenziertem Plattenepithelkarzinom des hochparietalen Kapillitiums. Diverse Therapieversuche (u. a. intraläsionale Injektion von Methotrexat und Radiatio) führten zu keiner Kuration des Tumors. Patient 3: 75- jähriger multimorbider Patient mit einer beiderseitigen Arteriitis temporalis Horton im Vollbild mit ausgedehnten, fast den gesamten Skalp umfassenden Nekrosen.
Therapie: Patientin 1: Zunächst radikale en-bloc-Resektion aller betroffenen Areale inguinal,
am Mons pubis und anogenital. Im Anschluss Wundgrundkonditionierung durch aufwändige Vakuumverbände. Nach einer deutlich beschleunigten Wundgranulation Defektdeckung mittels gemeshter Spalthauttransplantation über mehreren Lagen Integra® Single Layer (IDRT-SL). Nach weiteren 5 Tagen Vakuumversiegelung waren ca. 60% des Transplantates vital eingeheilt. Patient 2: Nach umfangreicher Vorbereitung des Patienten wurde in einem einzigen operativen Eingriff in Intubationsnarkose der Tumor einschließlich adäquaten Sicherheitsabstands bis auf die Kalotte unter Mitnahme der Galea aponeutorica exzidiert. Nach ausgiebiger Blutstillung wurden insgesamt 5 Lagen IDRT-SL in den Defekt eingebracht und der Defekt bis auf das umliegende Hautniveau aufgefüllt. Hierauf konnte dann im selben Eingriff ein gemeshtes Spalthauttransplantat aufgebracht und mittels Vakuum-Versiegelung fixiert werden. Nach sieben Tagen konnte der Patient mit einem komplett vitalen Transplantat in die ambulante Weiterbetreuung entlassen werden. Patient 3: Zunächst erfolgte mittels Temporalarterienbiopsie die Diagnosesicherung einer Arteriitis temporalis Horton sowie die Einleitung einer immunsuppressiven Therapie mit Prednisolon in adäquater Dosierung. Begleitend erfolgte nach initialer antiseptischer Lokaltherapie das chirurgische Debridement und Entfernen aller nekrotischen Areale. Daraus resultierte eine Wundfläche mit freiliegender Kalotte von der Größe zweier Handteller. Anschließend wurde auf den gesamten Defekt je eine Lage Integra® Bilayer aufgebracht und es folgte eine dreiwöchige Konditionierungsphase zur Einheilung des Dermisersatzes. Schließlich wurden nach Desilikonisierung gemeshte Spalthauttransplantate aufgebracht, welche trotz deutlich eingeschränkter Durchblutung der Kopfschwarte bei Verschluss beider Aa. temporalis komplett einheilten.
Fazit: In der Versorgung großer Defekte nach tumorchirurgischen Eingriffen sowie der
Behandlung ausgedehnter Verbrennungsnarben mit Narbenstrikturen hat sich die Methode des permanenten Dermisersatzes durch verschiedene Materialien seit vielen Jahren durchgesetzt. In der klassischen Dermatochirurgie ist diese Methode jedoch noch kein etabliertes Standardtherapieverfahren. Wir stellen drei Patienten vor, bei denen die Therapie dreier pathogenetisch unterschiedlicher Erkrankungen der Defektverschluss mittels eines permanenten Dermisersatzes (Integra®) erfolgreich durchgeführt wurde.
Literatur: 1) Burke JF, Yannas IV, Quinby WC, Jr. et al. Successful use of a physiologically acceptable artificial skin in the
treatment of extensive burn injury. Ann Surg 1981; 194: 413-28. 2) Chalmers RL, Smock E, Geh JL. Experience of Integra((R)) in cancer reconstructive surgery. J Plast Reconstr
Aesthet Surg 2010; 63: 2081-90. 3) Shores JT, Gabriel A, Gupta S. Skin substitutes and alternatives: a review. Adv Skin Wound Care 2007; 20: 493-
508 4) Müller CSL; Schiekofer C, Körner R, Vogt T. Improved patient-centered care with effective use of Integra® in
dermatologic reconstructive surgery. Manuscript submitted.
Fall K06
19

Aktuelle Studien unserer Klinik
Malignes Melanom, palliative Therapie
MEK115306-Studie A Phase III, randomized, double-blinded study comparing the combination of the BRAF inhibitor, dabrafenib and the MEK inhibitor, trametinib to dabrafenib and placebo as first-line therapy in subjects with unresectable (Stage IIIC) or metastatic (Stage IV) BRAF V600E/K mutation-positive cutaneous melanoma
Status: rekrutierend
PRAME-Studie An open, dose-escalation Phase I/II study to assess the safety, immunogenicity and clinical activity of recPRAME + AS15 Antigen-Specific Cancer Immunotherapeutic as first-line treatment of patients with PRAME-positive metastatic melanoma
Status: rekrutierend
Weitere Informationen: www.clinicaltrials.gov: NCT01149343
CHEMOSENS-Studie Individualisierte Kombinationstherapie nach ex-vivo Chemosensitivitätsprofil versus DTIC-Monochemotherapie als first-line Behandlung des fernmetastasierten Melanoms (AJCC Stadium IV)
Status: rekrutierend
Weitere Informationen: www.clinicaltrials.gov: NCT 00779714
Malignes Melanom, operative Therapie
SENTINEL-Studie Kontrollierte und prospektiv randomisierte Therapie-studie zum Vergleich einer radikalen Lymph-adenektomie versus Beobachtung bei Patienten mit malignem Melanom > 1,0 mm Tumordicke und positiver Wächter-Lymph-knotenbiopsie
Status: rekrutierend
Weitere Informationen: http://www.ado-homepage.de/index.php?ID=91
Handekzem
PASSION-Studie Nicht-interventionelle Beobachtungsstudie. Alitretinoin bei chronischem Handekzem
Status: rekrutierend
BEACH-Studie Nicht-interventionelle Beobachtungsstudie. Imlan vs. Imlan plus Creme bei Handekzem
Status: rekrutierend
Ansprechpartner: Onkologische Ambulanz der Klinik
OA PD Dr. med. Alexander Rösch Tel.: 06841/16-23568
Poliklinik OÄ PD Dr. med. Claudia Pföhler Tel.: 06841/16-23839
20

Homburger Dermatologische Fortbildung -
Gäste sind herzlich willkommen! Die Veranstaltungen finden jeweils von 16:00 Uhr s.t. bis ca. 17:30 Uhr in unserem Hörsaal in Gebäude 35 statt. Vorgesehene Fortbildungspunkte: 2 Punkte je Veranstaltung - Die Zertifizierung ist beantragt.
14.11.2012
Diaklinik: Diagnosen und Differenzialdiagnosen dermatologischer Erkrankungen zur Diskussion
OÄ Dr. med. C. Müller und ärztliches Kollegium der Klinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum des Saarlandes
21.11.2012
Die neue S3-Leitlinie „Malignes Melanom“
OA Priv.-Doz. Dr. med. A. Rösch, Klinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum des Saarlandes
28.11.2012
Psoriasisarthritis
Priv.-Doz. Dr. med. G. Assmann, I. Medizinische Klinik, Universitätsklinikum des Saarlandes
12.12.2012
Hautkrankheiten und Depression
Prof. Dr. med. V. Köllner, Fachklinik für Psychosomatische Medizin und Medizinische Fakultät der Universität des Saarlandes
09.01.2012
Pharmakotherapie in der Dermatologie: aktueller Journal-Club
Prof. Dr. med. J. Reichrath und ärztliches Kollegium der Klinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum des Saarlandes
16.01.2013
Topische Therapie: Galenik und riskante Inhaltsstoffe
OÄ Priv.-Doz. Dr. med. C. Pföhler, Klinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum des Saarlandes
21

23.01.2012
Die Rolle von IL17 bei Psoriasis
Dr. Julia Weber-Arden, Medical Scientific Liason Manager, Novartis Pharma GmbH
06.02.2013
Next-Generation-Sequencing: Was bringt das 1000-Dollar Genom für die klinische Medizin?
Prof. Dr. med. Wolfram Henn, Institut für Humangenetik, Universitätsklinikum des Saarlandes
20.02.2013
Schmerztherapie – ein Update
OA Dr. med. P. Bialas, Leiter der Schmerzambulanz, Klinik für Anästhesiologie, Intensivmedizin und Schmerztherapie, Universitätsklinikum des Saarlandes und Medizinische Fakultät des Saarlandes
06.03.2013
Labordiagnostik in der Dermatologie: vom Gram-Präparat zum Tissue-Micro-Array
Anne Kerber, Klinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum des Saarlandes
13.03.2013
Diaklinik: Diagnosen und Differenzialdiagnosen dermatologischer Erkrankungen zur Diskussion
OÄ Dr. med. C. Müller und ärztliches Kollegium der Klinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum des Saarlandes
20.03.2013
Pharmakotherapie in der Dermatologie: aktueller Journal-Club
Prof. Reichrath und ärztliches Kollegium der Klinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum des Saarlandes
24.04.2013
Viren und Hautkrebs
Univ.-Prof. Dr. med. S. Smola, Direktorin Institut für Virologie, Institut für Infektionsmedizin Universitätsklinikum des Saarlandes
22

23

Universitätsklinikum des Saarlandes
Klinik für Dermatologie, Allergologie und Venerologie D-66421 Homburg Direktor: Univ.-Prof. Dr. med. Th. Vogt
Ltd. Oberarzt/ Stv. Klinikdirektor
Prof. Dr. med. Jörg Reichrath
Klinikdirektor
Univ.-Prof. Dr. med. Thomas Vogt
Unser Ärzteteam stellt sich vor:
Dr. med. Cornelia S. L. Müller
Oberärzte
Priv.-Doz. Dr. med. Claudia Pföhler
Priv.-Doz. Dr. med. Alexander Rösch
Assistenzärzte
Dr. med. Léa Trémezaygues
Karin Braunert Dr. med. Michael Diefenbacher
Dr. med.Luisa Hinterberger
Eva Janssen Janina JungmannEvgenia Markeeva
Claudia Schiekofer Dr. med. Rebecca Schmaltz
Dr. med. Sigrid Psaier
Dr. med. Hedwig Stanisz
Mylène Niclou Dr. med. MareikeSchmidt-Bachmann