Organische Chemie - uni-marburg.de · Übung 3.0: Alkane und Alkene 1. Zeichnen sie alle...
Transcript of Organische Chemie - uni-marburg.de · Übung 3.0: Alkane und Alkene 1. Zeichnen sie alle...

Dr. Sabrina Höbenreich SoSe 2019 Philipps-Universität Marburg Veranstaltungsnummer: LV-20-107-006
Experimentalchemie
für Mediziner, Zahnmediziner und Biologen (LA)
Teil 2: Organische Chemie
https://www.uni-marburg.de/de/fb15/studium/lehrexport/praktikum-humanmedizin-zahnheilkunde-biologie_l3

Übung 3.0: Alkane und Alkene1. Zeichnen sie alle Konstitutionsisomere in der Skeletformelschreibweise von Butan, Buten und Butin.
2. Warum läßt sich kein Butinisomer aus der Struktur des 2-Methylpropans (iso-Butans) ableiten?
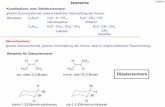
3. Sortieren Sie die Carbokationen (2-6) nach Ihrer Stabilität. Beginnen Sie mit dem am wenig stabilsten.
4. Geben Sie für folgende Umsetzungen mit einem Äquivalent Brom das Hauptprodukt an.

2
Fazit der Woche 3: Struktur Eigenschaften der Alkane
Radikalische Reaktionen: Bindungsstärke und Regioselektivität: a) a)
b) b)
c)
Hyperkonjugation
Bindungsspaltung benötigt Energie (Licht od. Wärme)
Stabilität von C-Radikalen und Carbokationen:
Bindungsstärke und Substitutionsgrad:
Additionsreaktionen an Alkene
vs.

Fazit der Woche 3: Eigenschaften der Alkene
Additionsreaktionen an Alkene Struktur und Nomenklatur der Alkene:
Stabilität von Alkenen: Resonanzstabilisierung von Kationen und Radikalen:
abhängig von Konfiguration
abhängig von Substitution

4 5. Alkene
5. Alkene: Mehrfach ungesättigte Kohlenwasserstoffe Konjugierte und nicht konjugierte π-Systeme: Konjugierte und nicht konjugierte Polyene in der Natur:
konjugierte Diene unkonjugiertes Dien
konjugierte π-Bindungen sind stabiler im Vergleich zu ihren unkonjugierten Analoga
Grund: Resonanzstabilisierung

5 6. Alkine
6. Alkine: Definition und Eigenschaften Definition:
Alkine (selten Acetylene) sind chemische Verbindungen aus der Gruppe der aliphatischen Kohlenwasserstoffe,
die an beliebiger Position mindestens eine Kohlenstoff-Kohlenstoff-Dreifachbindung im Molekül besitzen
und sich über die Summenformel CnH2n–2 beschreiben lassen.
Name: Valenzstrichformel: Summenformel: Skelettformel: Smp./Sdp. [C°]
Ethin C2H2 – 83.8 (Sublimation)
Propin C3H4 −102.7/–23.2
But-1-in C4H6 −125.7/ 8.1
But-2-in C4H6 −32.2/27

6
6. Alkine: Definition und Eigenschaften Definition:
Alkine (selten Acetylene) sind chemische Verbindungen aus der Gruppe der aliphatischen Kohlenwasserstoffe,
die an beliebiger Position mindestens eine Kohlenstoff-Kohlenstoff-Dreifachbindung im Molekül besitzen
und sich über die Summenformel CnH2n–2 beschreiben lassen.
6. Alkine
Nomenklatur: Suffix = -in (Verbindungsklasse der Alkine)
Stammname: leitet sich vom Namen das Alkans mit gleicher Anzahl an C-Atomen ab
bei verzweigten Alkinen wird die längste Kette gewählt, die die
Dreifachbindung enthält
Alkine haben eine höhere Priorität als Alkene
Beispiel:
Position der Dreifachbindung: Positionszahl wird zwischen Stammnamen und Suffix umgeben von
Bindestrichen angegeben (z.B. But-2-in)

7
6. Alkine: Definition und Eigenschaften Definition:
Alkine (selten Acetylene) sind chemische Verbindungen aus der Gruppe der aliphatischen Kohlenwasserstoffe,
die an beliebiger Position mindestens eine Kohlenstoff-Kohlenstoff-Dreifachbindung im Molekül besitzen
und sich über die Summenformel CnH2n–2 beschreiben lassen.
6. Alkine
Struktureigenschaften: Reaktivität:
elektrostatische Potenzialkarte des Ethins
• terminale (endständige) Alkine sind schwach sauer (pKs = 25)
• terminale Alkine bilden mit Metallionen Acetylide (M+ –C≡C–R; M = Ag,
Cu etc.), die in trockenem Zustand explosiv sein können
• Alkine können analog zu den Alkenen Additions- und Polymerisationsreaktionen eingehen

Der Benzolring:
8
7. Aromaten: Definition und das Konzept der Aromatizität Definition:
Aromaten (auch Arene) sind chemische Verbindungen aus der Gruppe der cyclisch konjugierten Kohlen-
wasserstoffe, deren Gesamtzahl an π-Elektronen durch den Ausdruck (4n+2) darstellbar ist, wobei n jede
ganze Zahl inklusive Null sein kann.
7. Aromatische Kohlenwasserstoffe
mesomere Grenzstrukturen des Benzols
≡ ≡
• cyclische Struktur
• 6 identische C–H Einheiten
• sp2-hybridisierte C-Atome
• C–C Bindungslängen 139 pm
• delokaliserte π-Elektronen
• Mesomerie

Der Benzolring: Elektronische Eigenschaften: Weitere Vertreter:
9
7. Aromaten: Definition und das Konzept der Aromatizität Definition:
Aromaten (auch Arene) sind chemische Verbindungen aus der Gruppe der cyclisch konjugierten Kohlen-
wasserstoffe, deren Gesamtzahl an π-Elektronen durch den Ausdruck (4n+2) darstellbar ist, wobei n jede
ganze Zahl inklusive Null sein kann.
7. Aromatische Kohlenwasserstoffe
mesomere Grenzstrukturen des Benzols
elektrostatische Potenzialkarte des Benzols
• cyclische Struktur
• 6 identische C–H Einheiten
• sp2-hybridisierte C-Atome
• C–C Bindungslängen 139 pm
• delokaliserte π-Elektronen
≡ ≡

10
7. Aromaten: Wichtige Vertreter Einfach substituierte Aromaten:
Mehrfach substituierte Aromaten:
7. Aromatische Kohlenwasserstoffe
2 zusätzliche π-Elektronen in der CO2H Einheit!
Relative Position eines Zweitsubstituenten zu einem anderen Subst. wird durch die Angabe ortho, meta, para ge- kennzeichnet!

11
7. Aromaten: Wichtige Vertreter Mehrfach substituierte Aromaten:
Heteroaromaten:
7. Aromatische Kohlenwasserstoffe

Aufgabe 1:
Benennen Sie die folgenden Aromaten:
12
Übung 3.1: Nomenklatur der Aromaten
7. Aromatische Kohlenwasserstoffe

Vergleich der Hydrierungswärmen von Cyclohexen, Cyclohexa-1,3-dien und „Cyclohexa-1,3,5-trien“:
13
7. Aromaten: Definition und das Konzept der Aromatizität Definition:
Aromaten (auch Arene) sind chemische Verbindungen aus der Gruppe der cyclisch konjugierten Kohlen-
wasserstoffe, deren Gesamtzahl an π-Elektronen durch den Ausdruck (4n+2) darstellbar ist, wobei n jede
ganze Zahl inklusive Null sein kann.
7. Aromatische Kohlenwasserstoffe
(berechnet 239 kJ/mol)

14
7. Aromaten: Reaktivitätsunterschiede zu Alkenen
Cyclohexen
7. Aromatische Kohlenwasserstoffe
• welcher Reaktionstyp?
• welche relative Konfiguration?
• welcher Reaktionstyp?
Epoxidierung
Dibromierung
Epoxid

15
7. Aromaten: Reaktivitätsunterschiede zu Alkenen
Cyclohexen Benzol:
7. Aromatische Kohlenwasserstoffe
• welcher Reaktionstyp?
• welche relative Konfiguration?
• welcher Reaktionstyp?
keine Reaktion!
keine Reaktion! Epoxidierung
Dibromierung
Epoxid

16
7. Aromaten: Reaktivitätsunterschiede zu Alkenen
Cyclohexen Benzol:
7. Aromatische Kohlenwasserstoffe
• welcher Reaktionstyp?
• welche relative Konfiguration?
• welcher Reaktionstyp?
keine Reaktion!
keine Reaktion!
Fazit: Im Vergleich zu einfachen Alkenen ist
Benzol reaktionsträge gegenüber Elektrophilen!
Epoxidierung
Dibromierung
Epoxid

17
7. Aromaten: Reaktivitätsunterschiede zu Alkenen
Cyclohexen Benzol:
7. Aromatische Kohlenwasserstoffe
• welcher Reaktionstyp?
• welche relative Konfiguration?
• welcher Reaktionstyp? AlCl3 = Aluminiumtrichlorid
(Katalysator)
Beobachtung: In Gegenwart eines geeigneten
Katalysators reagiert Benzol mit aktivierten Elektrophilen!
• welcher Reaktionstyp?
Epoxidierung
Dibromierung
Epoxid
Brombenzol

18
7. Aromaten: Mechanistische Unterschiede zu Alkenen
Cyclohexen
7. Aromatische Kohlenwasserstoffe
s*(C–Br)-Orbital
• welche Konformation?
• Grund für Präferenz der Konformation?
• Verbindungsname ?

19
7. Aromaten: Mechanistische Unterschiede zu Alkenen
Cyclohexen Benzol:
7. Aromatische Kohlenwasserstoffe
s*(C–Br)-Orbital
elektrophile Aktivierung von
Br2 durch AlCl3
AlCl3 fungiert als Lewis-Säure-Katalysator
• welche Konformation?
• Grund für Präferenz der Konformation?
• Verbindungsname ?
s-Komplex (Summe aller Grenzstrukturen)
s-Komplex ist nicht aromatisch!
Benzol (aromatisch)
Brombenzol (aromatisch)

20
7. Aromaten: Mechanistische Unterschiede zu Alkenen
7. Aromatische Kohlenwasserstoffe
Allgemeines Reaktionsprofil der elektrophilen aromatischen Substitution (SEAr)
• E⊕ = Elektrophil (z.B. Br2/AlCl3)
• DG⧧ = Aktivierungsenergie
• DG = Freie Energie
• ÜZ = Übergangszustand
• Triebkraft ist die Rückgewinnung der
Aromatizität
• Die Energiebarriere vom Ausgangsstoff zur Zwischenstufe (Intermediat) ist am größten, folglich ist dieser Schritt der langsamste (geschwindigkeits-bestimmend)
• Übergangszustand ≠ Zwischenstufe!!!
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg
DG
ÜZ1
ÜZ2
Fazit: Aromaten reagieren mit
Elektrophilen vorzugsweise über
Substitutionsreaktionen statt über
Additionsreaktionen.

Mechanismus
21
7. Aromaten: Nitrierungen und Sulfonierungen
7. Aromatische Kohlenwasserstoffe
Nitrierung von Benzol
Nitrobenzol

22
7. Aromaten: Nitrierungen und Sulfonierungen
7. Aromatische Kohlenwasserstoffe
Sulfonierung von Benzol
Benzolsulfonsäure
Mechanismus

Aufgabe:
1. Durch die Reaktion von tert-Butylchlorid (tBuCl) und Aluminiumtrichlorid (AlCl3) wird ein kationisches
Intermediat (Carbokation) erzeugt, das mit Benzol reagieren kann. Wie sieht dieses Kation aus? Bitte
schlagen Sie anhand Ihrer Kenntnisse über die elektrophile Bromierung und Nitrierung von Benzol einen
Mechanismus vor, nach welchem Benzol mit dem entsprechenden Carbokation zu einem neuen Produkt
reagiert.
2. Bitte sagen Sie das Produkt der unten aufgeführten Reaktion vorher. Nehmen Sie dazu an, dass der Reaktionsmechanismus ähnlich zu dem ist, den Sie in der Aufgabe 1 formuliert haben.
23
Übung 3.2: SEAr Reaktionen mit Kohlenstoffelektrophilen
7. Aromatische Kohlenwasserstoffe

24
7. Aromaten: Elektrophile Substitution an Phenol und Toluol
7. Aromatische Kohlenwasserstoffe
Bromierung von Phenol
Grund:
mesomere Grenzstrukturen
kein Katalysator nötig!
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg

25
7. Aromaten: Elektrophile Substitution an Phenol und Toluol
7. Aromatische Kohlenwasserstoffe
Bromierung von Phenol
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg

26
7. Aromaten: Elektrophile Substitution an Phenol und Toluol
7. Aromatische Kohlenwasserstoffe
Bromierung von Toluol
Grund:
ortho-Angriff
para-Angriff
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg

27
7. Aromaten: SEAr an elektronenarmen Aromaten
7. Aromatische Kohlenwasserstoffe
Nitrierung von Trifluortoluol:
Grund:
meta-Angriff vermeidet Lokalisierung der positiven Ladung in Nachbarschaft zur CF3 Gruppe
para-Angriff ungünstig
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg

28
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Fazit: ortho-Angriff: para-Angriff
D = +M Substituent
besonders begünstigend
besonders begünstigend
D = +M Substituent

29
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Fazit: meta-Angriff:
D = +M Substituent
keine Beteiligung des +M Substituenten
(Angriff in m-Position weniger günstig als in o- oder p-Position im Falle von +M Substituenten)

30
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Fazit: ortho-Angriff: para-Angriff
D‘ = +I Substituent
relativ begünstigend
relativ begünstigend
D‘ = +I Substituent

31
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Fazit: meta-Angriff:
D‘ = +I Substituent
keine Beteiligung des +I Substituenten
(Angriff in m-Position weniger günstig als in o- oder p-Position im Falle von +I Substituenten)

32
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Fazit: ortho-Angriff: para-Angriff
A‘ = –I Substituent
relativ ungünstig
relativ ungünstig
A‘ = –I Substituent

33
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Fazit: meta-Angriff:
A‘ = –I Substituent
keine Beteiligung des –I Substituenten
(Angriff in m-Position weniger ungünstig als in o- oder p-Position im Falle von –I Substituenten)

34
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Fazit: ortho-Angriff: para-Angriff
A+ = –M Substituent
äußerst ungünstig
äußerst ungünstig
A+ = –M Substituent

Fazit: meta-Angriff:
35
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
A+ = –M Substituent
keine Beteiligung des –M Substituenten
(Angriff in m-Position deutlich weniger ungünstig als in o- oder p-Position im Falle von –M Substituenten)

36
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Fazit: Elektronische Effekte Beispiel Aktivierung Dirigiert nach elektronenschiebend -NR2, -OR stark aktivierend nur ortho/para durch Konjugation (+M) (freie Elektronenpaare)
elektronenschiebend Alkyl aktivierend meist ortho/para durch Induktion (+I) weniger meta elektronenziehend -CF3, -NR3 desaktivierend nur meta durch Induktion (–I) elektronenziehend -CN, -NO2, SO3 stark desaktivierend nur meta durch Konjugation (–M)

Dirigierender Effekt der Halogene (am Beispiel von Cl): ortho-Angriff: para-Angriff
37
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Hal = –I/+M Substituent
etwas begünstigend
etwas begünstigend
Hal = –I/+M Substituent

Hal = –I/+M Substituent
38
7. Aromaten: Zusammenfassung der dirigierenden Effekte
7. Aromatische Kohlenwasserstoffe
Dirigierender Effekt der Halogene (am Beispiel von Cl): meta-Angriff:
keine Beteiligung des +M Anteils des Halogensubstituenten
(Angriff in m-Position weniger günstig als in o- oder p-Position im Falle von –I/+M Substituenten)
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin
Heidelberg
X = Halogen