Simon Walter - OPUS 4 · Reaktionstechnische Untersuchungen an Supported-Ionic-Liquid-Phase (SILP)...
Transcript of Simon Walter - OPUS 4 · Reaktionstechnische Untersuchungen an Supported-Ionic-Liquid-Phase (SILP)...

Reaktionstechnische Untersuchungen an Supported-Ionic-Liquid-
Phase (SILP) Katalysatoren zur Hydroformylierung von Buten und
Verfahrensaspekte zur Umsetzung von n-Butan zu Aldehyden
Der Technischen Fakultät der
Friedrich-Alexander-Universität Erlangen-Nürnberg
zur Erlangung des Grades
Doktor-Ingenieur
vorgelegt von
Diplom-Ingenieur
Simon Walter
aus Fürth

Als Dissertation genehmigt von der Technischen Fakultät der Friedrich-Alexander
Universität Erlangen-Nürnberg.
Tag der mündlichen Prüfung: 19.03.2015
Vorsitzender des Promotionsorgans: Prof. Dr. habil. Marion Merklein
Gutachter: Prof. Dr. Peter Wasserscheid
Prof. Dr. Andreas Jess


Für
meinen Sohn
&
meine Tochter


Danksagung
Mein Dank geht an alle am Lehrstuhl für Chemische Reaktionstechnik. Die Zeit mit
euch hat mir sehr viel Freude bereitet.
Mein größter Dank geht an Prof. Dr. Peter Wasserscheid für die herausfordernde
Aufgabenstellung und Betreuung dieser Arbeit. Deine herausstechenden Eigenschaften
immer das Positive zu sehen und zu motivieren, haben mich menschlich und fachlich
sehr viel weiter gebracht. Danke auch für die Möglichkeiten, die einem Doktoranden
bezüglich finanzieller und sachlicher Mittel am Lehrstuhl zur Verfügung stehen. Dass
ein Lehrstuhl jegliche Konferenzbesuche und ein jährliches Skiseminar ermöglichen
kann, ist bei weitem nicht selbstverständlich. Das Korrekturlesen dieser Arbeit im
Familienurlaub ist auch keine Selbstverständlichkeit. Danke!
Dr. Marco Haumann danke ich für die vielen fachlichen Diskussionsrunden und die
Gespräche nebenbei. Deine wertvollen Tipps auf allen Fachgebieten der
Reaktionstechnik vom Maschinenbau bis zur metallorganischen Komplexkatalyse
waren immer sehr hilfreich. Nur den Ausflug nach Süd-Korea hättest du dir sparen
können.
Bedanken möchte ich mich auch bei allen Partner, die im Rahmen des BMBF-Projektes
mitgewirkt haben. Herrn Dr. Oliver Scherr danke für ich Betreuung des Projektes im
Auftrag des BMBF. Bei Herrn Prof. Dr. Robert Franke möchte ich dafür bedanken, dass
er dieses Projekt möglich machte und für sein eingebrachtes fachliches Wissen. Dr.
Hanna Hahn von Evonik Industries AG danke ich für zahlreichen Diskussion, die
Koordination des Projektes und das schnelle Durchbringen von Patenten. Dr. Katrin M.
Dyballa von Evonik Industries AG danke ich für die Synthese und Bereitstellung der
Liganden. Simon Kokolakis und Michael Friedrich von der TU Darmstadt danke ich für
die fachlichen Diskussionen und wünsche Ihnen alles Gute für die Zukunft. Die
Zusammenarbeit mit euch hat mir viel Freude gemacht.
Dr. W. Hieringer danke ich für die Diskussionen über den katalytischen Mechanismus
zur Hydroformylierung von Olefinen und die DFT-Rechnungen. Diese haben einen
großen Einblick in die Komplexität des Mechanismus geliefert.
Dank auch an alle Gruppenleiter und Doktoranden am Lehrstuhl. Das produktive
Arbeitsklima und die zahlreichen Diskussionen bei einer oder mehreren Tasse(n) Kaffee

haben mir und hoffentlich euch auch sehr weiter geholfen. Besonders herausheben will
ich Willi, Matthias, Steffi, Vale, Andi, Nike, René, Peter und Grobi. Danke.
Ebenso gilt mein Dank den Bachelor- und Masterstudenten, die ich bei ihrer
Abschlussarbeit betreuen durfte. Armin Stürzenhofecker, Dominik Hertweck, Marion
Schülein und Michael Thomann. Marion und Michael wünsche ich viel Erfolg bei ihrer
Promotion.
Für die Hilfe bei der Planung und dem Aufbau der Versuchsanlage sowie wie bei allen
weiteren großen und kleineren Hardwareproblemen gilt mein Dank den
Werkstattmitarbeitern Michael Schmacks, Achim Mannke, Julian Karl, Sascha Jeschke,
Alexander Busch und Dipl.-Ing. (FH) Hendryk Partsch. Ohne euch würde der Lehrstuhl
nicht so gut funktionieren.
Dem Prüfungskomitee mit Prof. Dr. K.-E. Wirth, Prof. Dr. A. Jess und Prof. Dr. J.
Libuda danke ich, dass sie sich die Zeit genommen haben, dieses Dokument zu lesen
und das Rigorosum abzunehmen.
Zutiefst möchte ich bei meinen Eltern für das Ermöglichen und die Unterstützung für
das Studium bedanken. Ihr seid die besten.
Der allergrößte Dank gebührt meiner Frau Katharina. Dafür, dass sie mir unseren Sohn
Elias und unsere Tochter Louisa geschenkt hat und für das Verständnis abends und auch
am Wochenende mal nicht für die Familie da zu sein. Danke.

Publikationen
Teile dieser Arbeit wurden bereits in den folgenden Fachzeitschriften, Patenten oder als
Konferenzbeiträge veröffentlicht:
Fachzeitschriften:
Schönweiz, A.; Debuschewitz, J.; Walter, S.; Wölfel, R.; Hahn, H.; Dyballa, K.
M.; Franke, R.; Haumann, M.; Wasserscheid, P.; Ligand-Modified Rhodium
Catalysts on Porous Silica in the Continuous Gas-Phase Hydroformylation of
Short-Chain Alkenes–Catalytic Reaction in Liquid-Supported Aldol Products;
ChemCatChem (2013), 5 (10), 2955 – 2963.
Walter, S.; Haumann, M.; Hahn, H.; Franke, R.; Wasserscheid, P.; n-Butane
Carbonylation to n-Pentanal Using a Cascade Reaction of Dehydrogenation and
SILP-Catalyzed Hydroformylation; AIChE J. (2014), accepted manuscript.
Patente:
Dyballa, K. M.; Franke, R.; Hahn, H.; Becker, M.; Schönweiz, A.; Walter, S.;
Wölfel, R.; Haumann, M.; Wasserscheid, P.; Kaftan, A.; Laurin, M.; Libuda, J.;
Immobilized catalytically active composition for hydroformylation of olefin-
containing mixtures. WO2014/170392 (A1), WO2014/160075 (A1), 2014.
Walter, S. Haumann, M., Wasserscheid, P., Hahn, H., Quandt, T.; Franke, R.;
Verfahren zur Herstellung von Aldehyden aus Alkanen und Synthesegas, DE
102014203960.6, 2014.
Konferenzbeiträge:
Walter, S.; Wölfel, R.; Haumann, M.; Hahn, H.; Dyballa, K. M.; Franke, R.;
Wasserscheid, P.; Hydroformylierung verdünnter technischer C4-Ströme mit
Supported Ionic Liquid Phase (SILP)-Katalysatoren, ProcessNet Jahrestagung,
2012, Karslruhe.
Walter, S.; Haumann, M.; Hahn, H.; Franke, R.; Wasserscheid, P.; Advances with
Supported Ionic Liquid Phase (SILP) materials for gas-phase hydroformylation
of technical C4 feedstock, 47. Jahrestreffen Deutscher Katalytiker, 2014, Weimar


Inhaltsverzeichnis
Abkürzungs- und Symbolverzeichnis .......................................................................... xiv
1 Einleitung ................................................................................................................ 1
2 Industrielle Entwicklung der Hydroformylierung .................................................. 4
2.1 Katalysatoren für die Hydroformylierung .......................................................... 4
2.1.1 Metalle ........................................................................................................ 4
2.1.2 Liganden in der Hydroformylierung .......................................................... 6
2.2 Mechanismus der Rhodium-katalysierten Hydroformylierung von Olefinen .. 11
2.3 Hydroformylierung von C4 – Alkenen – Wirtschaftliche Hintergründe und
Verfahren .................................................................................................................. 14
2.3.1 Rohstoffquellen für C4 – Alkene .............................................................. 14
2.3.2 Synthesegas .............................................................................................. 14
2.3.3 Dehydrierung von Alkanen ...................................................................... 15
2.4 Industrielle Verfahrenskonzepte für die Hydroformylierung ........................... 21
3 Immobilisierung homogener Katalysatorkomplexe.............................................. 23
3.1 Fluid-Fluid Mehrphasenkatalyse ...................................................................... 24
3.2 Heterogenisierung homogener Katalysatorkomplexe – Supported Homogeneous
Catalysts .................................................................................................................... 27
3.3 Analogie zwischen heterogener und homogener Katalyse in der Supported
Liquid Phase (SLP) - Katalyse .................................................................................. 30
3.4 Supported Ionic Liquid Phase (SILP) – Katalyse ............................................. 34
3.5 Zusammenfassung und Bewertung der Immobilisierungstechniken ................ 38
3.6 Stand der SILP-katalysierten Hydroformylierung und Aufgabenstellung ....... 40
4 Versuchsaufbauten, Materialien und Methoden ................................................... 42
4.1 Allgemeine Arbeitstechniken ........................................................................... 42
4.2 Verwendete Stoffe ............................................................................................ 42
4.2.1 Gase .......................................................................................................... 42
4.2.2 Komplexe und Katalysatoren ................................................................... 43
4.2.3 Ionische Flüssigkeiten .............................................................................. 44

4.2.4 Diphoshpit-Liganden ................................................................................ 45
4.2.5 Träger ........................................................................................................ 46
4.2.6 Additive .................................................................................................... 47
4.2.7 Präparation der SILP-Katalysatoren ......................................................... 47
4.3 Konzeption und Auslegung der Versuchsanlage .............................................. 48
4.4 Analytische Verfahren: Gaschromatographie ................................................... 53
5 Vorgehensweise und Überblick über den Ergebnisteil ......................................... 57
6 Theoretische Überlegungen zur SILP-Katalyse ................................................... 58
6.1 Theoretisches Modell zur Beschreibung von Transport und Reaktion in SILP-
Katalysatoren ............................................................................................................ 58
6.2 Modell zur Charakterisierung der SILP-katalysierten Hydroformylierung ..... 68
7 Optimierung des SILP-Katalysatorsystems .......................................................... 77
7.1 Vermessung des literaturbekannten-SILP-Katalysator-Systems ...................... 77
7.2 Precursorvariation und Einfluss der Komplexierungskinetik ........................... 80
7.3 Variation der ionischen Flüssigkeit .................................................................. 87
7.4 Einsatz industriell relevanter Träger ................................................................. 90
8 Kinetische Untersuchungen .................................................................................. 96
8.1 Durchführung der kinetischen Messungen ....................................................... 96
8.2 Analyse der Messdaten ..................................................................................... 97
8.2.1 Potenzansätze ............................................................................................ 99
8.2.2 Hyperbolische Ansätze ........................................................................... 102
8.3 Bestimmung der Temperaturabhängigkeit auf das Reaktionsnetzwerk ......... 110
8.3.1 Zusammenfassende Betrachtung der Temperaturabhängigkeit ............. 114
8.4 Validierung des kinetischen Modelles im Strömungsrohrreaktor .................. 116
8.5 Zusammenfassung und Bewertung der Kinetikstudien .................................. 120
9 Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal ......................... 122
9.1 Einfluss der Produktzusammensetzung der Dehydrierungsreaktion auf die
Ausbeute an n-Pentanal ........................................................................................... 125

9.2 Hydroformylierung eines dehydrierten n-Butan-Stromes mit dem Rh-
Biphephos-Komplex ............................................................................................... 131
9.3 Ergebnisse der Kaskadenreaktion aus heterogen-katalysierter Dehydrierung und
SILP-katalysierter Hydroformylierung ................................................................... 134
10 Zusammenfassung und Ausblick ........................................................................ 136
Abstract ....................................................................................................................... 139
Anhang ............................................................................................................................. I
I Literaturverzeichnis ............................................................................................ II
II Abbildungsverzeichnis ..............................................................................XXXIII
III Tabellenverzeichnis ......................................................................................... XL
IV Daten zur GC-Analytik ................................................................................. XLII
V Weitere Analysemethoden ........................................................................... XLIV
VI Auswertung der Messdaten ........................................................................... XLV
VII Herleitung des Thiele-Moduls ................................................................... XLVII
VIII 31P-NMR-Studien zur Komplexierung von Rh-Präkursoren mit dem Ligand
Benzpinakol .............................................................................................................. LI
IX Dynamische Differenzkalorimetrie von Komponenten des SILP-Katalysators
LII
X Untersuchungen zur Reaktion von n-Pentanal mit der ionischen Flüssigkeit
[EMIM][NTf2] ........................................................................................................ LIII
XI Charakterisierung der SiO2 – basierten Träger ............................................... LIV
XI.I Herleitung einer modifizierten Ergun-Gleichung zur Bestimmung des
Druckverlustes .................................................................................................... LIV
XI.II Messung des Druckverlustes einer Trägerschüttung .............................. LVI
XII Partialdruckvariationen an dem Rh-BzP-SILP-Katalysator ......................... LVII
XIII Hyperbolische Modellansätze .......................................................................... LX
XIV Umsatz- und Selektivitätsverläufe in Abhängigkeit der Reaktionstemperatur
LXIII
XV Parameter der Sensitivitätsanalyse ................................................................ LXV
XVI Kaskadenreaktion inklusive Regenerierung ....................................... LXXXVIII


Abkürzungs- und Symbolverzeichnis
Abkürzung Bedeutung
acac Acetylacetonat
ARXPS Angle-Resolved X-Ray Photoelectron Spectroscopy
BIPHEPHOS (6,6´-[(3,3´-di-tert-butyl-5,5´-dimethoxy-1,1´-biphenyl-2,2-
diyl)bis(oxy)]bis(dibenzo[d,f][1,3,2]-dioxaphosphepin))
BISBI 2,2´-bis((diphenylphosphin)methyl)-1,1´biphenyl
BzP Benzpinakol - 2,2´-((3,3´-di-tert-butyl-5,5´-dimethoxybiphenyl-
2,2´-diyl)bis(oxy)bis(4,4,5,5-tetraphenyl-1,3,2-dioxaphospholan)
CB&I Chicago Bridge and Iron Company
Cr Chrom
DAE Differential-algebraische Gleichung
DIPHOS 1,2-bis(diphenylphosphino)ethan
EFC Electronic Flow Control
F Filterelement
FID Flammenionisationsdetektor
FTIR Fourier-Transformations-Infrarotspektrometer
Gew-% Gewichtsprozent
GC Gaschromatograph
HASPO Hetero-atom substituted phosphine oxides
HPLC High Performance Liquid Chromatography
IL Ionische Flüssigkeit

LC Level Controller
MFC Mass Flow Controller
MAS-NMR Magic angle Spinning - Nuclear Magnetic Resonance
[MMIM][NTf2] 1,3-Dimethyl-imidazolium bis(trifluoromethylsulfonyl)imid
NC Normally Closed
NMR Nuclear Magnetic Resonance
NO Normally Open
[OMIM][NTF2] 1-Methyl-3-octylimidazolium bis(trifluoromethylsulfonyl)imid
PI Pressure Indicator
PIC Pressure Indicator Controller
PR Pressure Regulator
Pt Platin
PVD Physical Vapor Deposition
R Rückschlagarmatur
Rh Rhodium
SABIC Saudi Arabic Basic Industries Coporation
SAP Supported Aqueous Phase
SHOP Shell-Higher-Olefin-Process
SILP Supported Ionic Liquid Phase
SLP Supported Liquid Phase
SV Sicherheitsventil
TI Temperature Indicator

TIC Temperature Indicator Controller
UCC Union Carbide Coporation
V Ventil
WLD Wärmeleitfähigkeitsdetektor
Lateinische Buchstaben
Symbol Dimension Bedeutung
a m-1 spezifische Phasengrenzfläche
Ai % Ausbeute an einem Reaktionsprodukt P
c mol l-1 Konzentration
D m2 s-1 Diffusionskoeffizient
Deff m2 s-1 effektiver Diffusionskoeffizient
Di,IL m2 s-1 Diffusionskoeffizient der Komponenten i in der ionische
Flüssigkeit
d m Durchmesser
dP m Partikel-(Teilchen)durchmesser
dR m Reaktordurchmesser
E - Edukt
H12 - Henry-Koeffizient
k verschieden Reaktionsgeschwindigkeitskonstante
keff verschieden effektive Reaktionsgeschwindigkeitskonstante

l/b Molares Verhältnis von linearen zu verzweigten
Aldehyden
L - Ligand, nur im Zusammenhang mit Summenformel
L m charakteristische Länge
Le m Mittlere Porenlänge
M - Metall
P - Produkt
p bar oder Pa Gesamtdruck
pi bar oder Pa Partialdruck der Komponente i
pkrit bar oder Pa Kritischer Druck
ri mol m-3 s-1 Reaktionsgeschwindigkeit für die Komponente i
reff mol m-3 s-1 Effektive Reaktionsgeschwindigkeit für die Komponente
i
reff,V(R) mol m-3 s-1 Effektive Reaktionsgeschwindigkeit bezogen auf die
Volumeneinheit des Reaktionsraumes
VK m3 Volumen einer Kugel
Griechische Buchstaben:
Symbol Dimension Bedeutung
α - Porenfüllgrad
δ m Schichtdicke
ε - Porosität des Partikels
ε´ - Porosität der Schüttung

μ Pa s dynamische Viskosität
η - Katalysatorwirkungsgrad, Porennutzungsgrad
ηP - SILP-Katalysatorwirkungsgrad
Φ - Thiele-Modul
ΦSILP - SILP-Modul
Indizes tiefgestellt:
eff effektiv
Ges Gesamt
i Platzhalter für eine allgemeine Komponente
IL Bezogen auf die ionische Flüssigkeit
P Pellet
0 Größe (Konzentration, Volumen, Temperatur,…) zu Beginn der Reaktion
(t = 0)



Einleitung 1
1 Einleitung
„Alles Wissen und alle Vermehrung unseres Wissens endet nicht mit einem
Schlusspunkt, sondern mit einem Fragezeichen.“
Hermann Hesse
Die Produkte der Hydroformylierung sind aus dem täglichen Leben nicht mehr
wegzudenken. Aldehyde, Alkohole, Polyole, Carbonsäuren, Ester und Amine werden
beispielsweise zur Herstellung von hochwertigen Beschichtungen, Schmierstoffen,
kosmetischen Produkten, pharmazeutischen Produkten, Aromen- und Duftstoffen,
Druckfarben, sowie Kunststoffen verwendet. Zu den marktrelevanten Produkten, die
durch die Hydroformylierung linearer Olefine synthetisiert werden, zählen
Weichmacher auf Phthalatbasis. Diese finden hauptsächlich Anwendung in
Polyvinylchlorid – PVC. Bis zum Ende der neunziger Jahre hatten niedermolekulare
Weichmacher mit 3 – 6 Kohlenstoffatomen in der Hauptkette den größten Marktanteil
in Europa (siehe Abbildung 1).[1] Di(2-ethylhexyl)phthalat DEHP, auch bekannt als
Dioctylphthalat (DOP), ist das am häufigsten verwendete Phthalat für Weichmacher in
PVC.[2] Es ist der Phthalatester des Alkohols 2-Ethylhexanol, der normalerweise über
die Dimerisierung von Butyraldehyd aus Propylen hergestellt wird. Aufgrund der nicht
kovalenten Verankerung des Weichmachers in PVC und der Exposition in die Umwelt,
gab es wiederholt Bedenken hinsichtlich der potenziell gesundheitsgefährdenden
Auswirkungen.[3] Menschen nehmen Weichmacher über die Luft oder die Nahrung auf.
Fast bei jedem Menschen lassen sich Phthalate oder deren Metabolite im Blut und Urin
nachweisen.[4-6]
Trotz des breiten Anwendungsfeldes des Weichmachers DEHP tendierte der
europäische Markt in den letzten zehn Jahren zu hochmolekularen Phthalaten (7 – 13
Kohlenstoffatome in der Hauptkette), die gemäß der REACH-Verordnung keine
Gefahreneinstufung erfordern. Ein wichtiger Vertreter der hochmolekularen Phthalate
ist Di(2-propylheptyl)phthalat DPHP. Ausgang der Synthese ist die Hydroformylierung
von 1-Buten zu n-Pentanal.
Sich schnell ändernde Märkte und zunehmende Konkurrenz sind Herausforderungen der
chemischen Industrie, speziell in Westeuropa.[7] Steigende Rohstoffpreise und knappe
Ressourcen erfordern stetig Innovationen in effizientere Synthesen und Verfahren.
Innovationen sind Garant für mehr Effizienz. Der Verband der Chemischen Industrie

2 Einleitung
e.V. – VCI nennt drei Technologien für mehr Effizienz: Biotechnologie,
Nanotechnologie und Katalyse-Verfahren.[8]
Abbildung 1: Anteil Phthalat-basierter Weichmacher am europäischen Markt. HMW = Phthalate mit
hohem Molekulargewicht ( 7 – 13 C-Atome in der Hauptkette), LMW = Phthalate mit niedrigem
Molekulargewicht (3 – 6 C-Atome in der Hauptkette).[1]
Katalyse ist eine Schlüsseltechnologie des 21. Jahrhunderts, denn effiziente
Katalysatoren sind der Dreh- und Angelpunkt für die gezielte und kostengünstige
Herstellung von Chemikalien und Pharmaprodukten. Aber auch in Zukunftsbereichen
wie Energiegewinnung und –speicherung oder Umweltschutz spielen sie eine zentrale
Rolle. Die Entwicklung effizienter Katalysatoren ist jedoch immer noch eine große
Herausforderung. Ihre Leistungsfähigkeit, die sich an Aktivität und Selektivität für
bestimmte Produkte, aber auch an der Langzeitstabilität misst, hängt entscheidend von
den strukturellen Gegebenheiten auf der Nanometerskala ab. Darüber hinaus spielen
Stoff- und Wärmetransporteigenschaften der Gesamtstruktur eine wichtige Rolle. Wie
in Abbildung 2 dargestellt, müssen ineinander greifende Transport- und
Reaktionsprozesse über mehrere Größenskalen optimiert werden (Reaktor > Pellet >
Korn > Pore > aktives Zentrum).
Die Supported Ionic Phase (SILP)-Katalyse stellt bis heute eine der
vielversprechendsten Techniken zur Heterogenisierung homogener
Edelmetallkomplexe dar und kombiniert somit die Vorteile der homogenen und
heterogen Katalyse. Für die Hydroformylierung von kurzkettigen Olefinen wurden im
Labormaßstab schon beachtliche Aktivitäten und Standzeiten erzielt. Trotz des
fortgeschrittenen Entwicklungsstadiums der SILP-Katalyse sind viele Fragestellungen
0%
10%
20%
30%
40%
50%
60%
70%
80%
90%
100%
1982 1988 1993 1998 2003 2008 2011est.
HMW
LMW
Andere

Einleitung 3
bezüglich des Zusammenwirkens der Komponenten, des Reaktionsnetzwerkes und der
Makrokinetik noch offen.
Abbildung 2: Die Entwicklung eines Katalysators ist die Optimierung eines Problems auf mehreren
Größenskalen.
Das Ziel der vorliegenden Arbeit ist, mit reaktionstechnischen Methoden wichtige
Erkenntnisse über die Supported Ionic Liquid Phase (SILP) – Katalyse am Beispiel der
Hydroformylierung von C4-Olefinen zu erhalten. Dies umfasst ein theoretisches Modell
zur Beschreibung der Transportvorgänge als Funktion der Kinetik in einem SILP-
Katalysator und ein Modell zur Charakterisierung der Funktionsweise des SILP-
Katalysators unter Prozessbedingungen. Auf der Materialseite werden einzelne
Parameter des SILP-Katalysators systematisch untersucht, um ein besseres Verständnis
der Wirkungsweise zu erlangen und um das System für technische Einsatzgemische zu
optimieren. Für die Optimierung der Prozessbedingungen wird ein kinetisches Modell
entwickelt, welches das Reaktionsnetzwerk von Olefinen und Synthesegas an
homogenen Rhodiumkatalysatoren berücksichtigt und eine Simulation des
Reaktionsgeschehens zulässt. Letztendlich soll mit den daraus resultierenden
Erkenntnissen ein Verfahren entwickelt werden, das es ermöglicht, n-Butan über eine
Kaskadenreaktion aus Dehydrierung und Hydroformylierung direkt in Aldehyde
umzusetzen.
SubstratProdukt
10110-110-9
[m]10-7 10-5 10-3

4 Industrielle Entwicklung der Hydroformylierung
2 Industrielle Entwicklung der Hydroformylierung
Die Hydroformylierung ist eine technisch bedeutende Reaktion, die die Addition von
Synthesegas, einer Mischung aus Kohlenstoffmonoxid und Wasserstoff, an die
Doppelbindung von Olefinen in Anwesenheit eines Katalysators unter Bildung von
Aldehyden umfasst.[9-12]
Abbildung 3: Reaktionsschema der Hydroformylierung von Olefinen.
Im Fall der Hydroformylierung von 1-Buten können als Oxoprodukte der lineare
Aldehyd n-Pentanal oder der verzweigte Aldehyd 2-Methylbutanal (sec-Pentanal)
entstehen.
2.1 Katalysatoren für die Hydroformylierung
Homogene Katalysatorkomplexe für die Hydroformylierung bestehen üblicherweise aus
einem Übergangsmetallatom (M), das Metallcarbonylhydride ausbilden kann, und
einem oder mehreren Liganden (L).[13] Eine allgemeine Struktur ist in Abbildung 4
dargestellt:
HxMy(CO)zLn
Abbildung 4: Allgemeine Struktur eines homogenen Katalysatorkomplexes für die Hydroformylierung.
Für den Fall, dass der Ligand (L) ebenfalls eine Carbonylverbindung ist, wird von
unmodifizierten Katalysatoren gesprochen. Modifizierte Katalysatoren liegen vor, falls
Ligand (L) eine andere organische Verbindung ist.
2.1.1 Metalle
Kobalt- und Rhodium-basierte Katalysatoren spielen in der Forschung und in der
industriellen Anwendung die größte Rolle. Alternative Metalle wie Ruthenium, Iridium,
Palladium, Platin oder Eisen sind deutlich weniger aktiv in der Hydroformylierung.[14]

Industrielle Entwicklung der Hydroformylierung 5
Unmodifizierte Cobalt-Katalysatoren (z.B. HCo(CO)4) waren die Basis für die erste und
zweite Generation von Oxo-Prozessen und werden heutzutage noch in der
Hydroformylierung von längerkettigen Olefinen eingesetzt.[15-16] Die harschen
Reaktionsbedingungen der Co-Katalysatoren bei Temperaturen von 150 – 180 °C und
Druckbereichen von 200 – 250 bar haben den Weg für die Rh-katalysierte
Hydroformylierung bereitet.[17-18] Unmodifizierte Rhodiumkomplexe schienen anfangs
weniger aktiv in der Hydroformylierung zu sein, da die Ausbildung des
Rhodiumhydridkomplexes einen hohen Druck an Wasserstoff benötigt.[19] Nach
Ausbildung der aktiven Spezies HRh(CO)4 zeigten sich die Rhodiumkomplexe als
deutlich aktiver und selektiver unter milderen Bedingungen als Kobalt-basierte
Komplexe.[20]
Tabelle 1: Kennzahlen verschiedener Oxoverfahren nach Hibbel et al.[18]
Katalysatormetall Kobalt Rhodium
Variante unmodifiziert modifiziert modifiziert modifiziert
Ligand Phosphin
(Phoban)
Phosphin
(TPP)
Phosphin
( TPPTS)
Katalysatorspezies HCo(CO)4 HCo(CO)3L HRh(CO)L3 HRh(CO)L3
Phasen 1 1 1 2
Temperatur / °C 150 – 180 160 – 200 60 – 120 50 – 130
Druck / bar 200 – 300 50 – 150 1 – 30 12 – 50
Kat-Konzentration /
%
0,1 – 1,0 0,2 – 0,8 0,01 – 0,1 0,001 – 0,1
Raum-Zeit-Ausbeute
/ LHSV
0,5 – 2,0 0,1 – 0,2 0,1 – 0,2 > 0,2
Produkte Aldehyde Alkohole Aldehyde Aldehyde
l/b-Verhältnis ~80 : 20 88 : 12 92 : 8 > 95 : 5
Nebenprodukte viele viele wenige wenige
Katalysatorkreislauf aufwendig einfach einfach besonders
einfach

6 Industrielle Entwicklung der Hydroformylierung
Im Jahre 1968 entdeckten unabhängig voneinander Arbeitsgruppen von Shell und um
Wilkinson den Einsatz von Phosphan-modifizierten Katalysatoren in der
Hydroformylierung.[21-22] Die Arbeitsgruppe von Shell versetzte eine Co2(CO)8-Lösung
mit Phosphanliganden, die bei Drücken von 30 – 35 bar und Temperaturen um 150 –
200 °C zu aktiven Hydroformylierungskatalysatoren führten. Wilkinson et al. konnten
spektroskopisch nachweisen, dass Hydridocarbonyltris(triphenylphosphan)rhodium(I) -
HRh(CO)(PPh3)3 die Isomerisierung, Hydrierung und Hydroformylierung von Olefinen
unter Synthesegas katalysiert. Ligand-modifizierte Kobalt- oder Rhodiumkatalysatoren
sind heute Stand der Technik, sowohl in einphasigen als auch in zweiphasigen
Prozessen. Tabelle 1 stellt die Kennzahlen verschiedener Oxo-Verfahren auf Basis des
Katalysatormetalls zusammen. Der Einfluss des Liganden auf Aktivität und Selektivität
unter gegebenen Reaktionsbedingungen wird im folgenden Abschnitt näher
beschrieben.
2.1.2 Liganden in der Hydroformylierung
Phosphor-Liganden werden heutzutage unabhängig vom eingesetzten Metall,
hauptsächlich in der industriellen Hydroformylierung genutzt.[23, 11] Neben Phosphor
wurden weitere metallkoordinierende Elemente, wie Stickstoff, Arsen, Antimon oder
Bismut, für die Synthese von Liganden verwendet. Diese erwiesen sich jedoch als
weniger aktiv im Vergleich zu Phosphor-basierten Liganden, die sich in
Monophosphane/phosphine, Diphosphane/phosphine, Phosphinite, Phosphonite,
Monophosphite und Diphosphite einteilen lassen. (Di-)Phosphane und (Di-)Phosphite
stellen die wichtigste Ligandenklasse innerhalb der Gruppe dar. Der bedeutendste
Vertreter der Phosphin-Liganden ist Triphenylphosphin PPh3. Triphenylphosphin wurde
erstmals 1963 von Vaska et al. synthetisiert, aber die Gruppe um Wilkinson entdeckte,
dass der Ligand aktiv in der Hydroformylierung ist.[24-25]
Phosphin-Liganden können die Oxidationsstufe des Metalls stabilisieren und aufgrund
ihrer elektronischen und sterischen Eigenschaften an die Aktivität des jeweiligen
Metalls angepasst werden.[26] Zweizähnige Liganden haben gegenüber einzähnigen
Liganden den Vorteil, dass sie terminale Olefine primär zum linearen Aldehyd
umsetzen. Sanger berichtete als einer der ersten von dem Einsatz von Diphosphinen in
der Hydroformylierung.[27] Zu den wichtigsten Vertretern der Diphosphin-Liganden
zählen 2,2´-Bis((diphenylphosphin)methyl)-1,1´-biphenyl (BISBI), 1,2-
Bis(diphenylphosphin)ethan (DIPHOS)-Derivate und Liganden mit Xanthen-Struktur

Industrielle Entwicklung der Hydroformylierung 7
oder Xanthen-verwandter Struktur.[28-33, 15] In der Hydroformylierung von 1-Okten
wurden bei 80 °C und 10 bar Synthesegasdruck linear to branched (l/b)-Verhältnisse
von 53,5 für Xantphos und 80,5 für BISBI erhalten.[34] Ein wichtiger Parameter zur
Beschreibung der Beziehung zwischen Aktivität und Regioselektivität für Diphosphin-
Liganden ist das Konzept des „Bisswinkels“ von Casey und Whiteker.[35] Der Parameter
ist aus Kraftfeldrechnungen abgeleitet und beschreibt den Winkel zwischen den
Phosphoratomen des Liganden und dem Metallatom. Näherungsweise konnte ermittelt
werden, dass ein größerer Bisswinkel zu einem größeren l/b-Verhältnis führt.
Ausnahmen dieser Regel könnten durch elektronische Effekte verursacht werden. Sie
stehen im Zusammenhang mit der Hybridisierung des Metalls. Größere Bisswinkel
fördern die Dissoziation von CO aus der fünffach koordinierten Spezies (18 ve) zu der
vierfach-koordinierten Spezies (16 ve) (siehe auch 2.2). Aus demselben Grund kann die
Isomerisierung begünstigt werden, da es zur Konkurrenz zwischen der CO-Insertion und
der β-Wasserstoff Eliminierung kommt.
Im Vergleich zu Phosphin-Liganden sollen Phosphit-Liganden aufgrund der
elektronenziehenden Substituenten am Phosphoratom die CO-Dissoziation begünstigen
und folglich zu einer Steigerung der Reaktionsgeschwindigkeit beitragen.[36-37] Ein
weiterer Vorteil von Phosphit-Liganden liegt in der einfacheren Präparation gegenüber
Phosphin-Liganden und einer besseren Stabilität gegen schwefelhaltige Stoffe und
Oxidationsmittel. Hingegen reagieren Phosphit-Liganden sensitiv auf Hydrolyse oder
mit Halogenverbindungen nach der Arbuzow-Reaktion. In Patentschriften der Union
Carbide Corporation – UCC sind zahlreiche Monophosphit-Liganden und darauf
aufbauend Diphosphit-Liganden für die Hydroformylierung offen gelegt worden.[38-39]
Diphosphit-Liganden sollen die Sensitivität gegen Hydrolyse im Vergleich zu
Monophosphiten deutlich vermindern und selektiver in der Reaktion zum linearen
Aldehyd sein. Der Diphenyl-Diphosphit-Ligand BIPHEPHOS (6,6´-[(3,3´-Di-tert-
butyl-5,5´-dimethoxy-1,1´-biphenyl-2,2´-diyl)bis(oxy)]bis(dibenzo[d,f][1,3,2]-
dioxaphosphepin)) ist einer der bekanntesten Vertreter dieser Ligandengruppe und
bildet bis heute das Grundgerüst für eine Vielzahl von sterisch anspruchsvollen
Diphosphit-Liganden (siehe Abbildung 5).[40-46]
Billig et al. erreichten in der Hydroformylierung von Propen mit Rh/BIPHEPHOS bei
74 °C und einem Gesamtdruck von 5,65 bar ein l/b-Verhältnis von 52,8. Cuny et al.
zeigten, dass sich mit dem Rh-BIPHEPHOS-Komplex terminale Olefine mit Keton-,
Ester-, Säure-, Amid-, Alkohol- oder Nitrilgruppen zu Dicarbonylen bei 60 °C und 4,82
bar Gesamtdruck mit hoher Regioselektivität umsetzen ließen.[47]

8 Industrielle Entwicklung der Hydroformylierung
Abbildung 5: BIPHEPHOS (6,6´-[(3,3´-Di-tert-butyl-5,5´-dimethoxy-1,1´-biphenyl-2,2´-
diyl)bis(oxy)]bis(dibenzo[d,f][1,3,2]-dioxaphosphepin)).
Moasser et al. untersuchten die Hydroformylierung von 1-Octen mit Rh/BIPHEPHOS
mittels in-situ 1H und 31P NMR-Messungen unter 20 bar Synthesegasdruck und 60
°C.[48] Sie konnten vier Rh-Spezies in Abhängigkeit des Synthesegasdruckes feststellen.
Ohne Synthesegas konnte ausschließlich die Rh(BIPHEPHOS)(acac)-Spezies unter
Verwendung von (Acetylacetonat)dicarbonylrhodium(I) Rh(acac)(CO)2 als Vorstufe
(engl.: Precursor) gefunden werden. Beaufschlagung des NMR-Röhrchens mit
Synthesegas führte zu der Rh(BIPHEPHOS)(CO)2H – Spezies, die in zeitaufgelösten
NMR-Messungen zuerst die Isomerisierung von 1-Octen und anschließend die Bildung
von Aldehyden katalysierte. Durch die wahrscheinlich auftretende Hydroformylierung
interner Octene resultiert ein deutlich kleineres l/b-Verhältnis von 15 im Vergleich zu
den Ergebnissen der UCC. Mit fortschreitender Reaktion und damit sinkendem
Synthesegasdruck wurden zwei Rhodium-Dimer-Spezies detektiert, die als inaktiv
interpretiert wurden. Es konnte aber gezeigt werden, dass diese Spezies auf mangelnden
Wasserstoff zurückzuführen sind und diese Reaktion durch die Zugabe von Wasserstoff
reversibel ist. Behr et al. und Vogl et al. nutzten die Fähigkeit des Rh/BIPHEPHOS-
Komplexes unter Synthesegas Alkene zu isomerisieren zur Umsetzung von internen
Alkenen zu linearen Aldehyden.[49-50] Bei 125 °C und 20 bar Synthesegasdruck konnte
trans-4-Octen mit einer Ausbeute von 88 % zu n-Nonanal umgesetzt werden. Vogl et
al. erreichten eine Ausbeute von 86 % an linearem Aldehyd in der Tandemreaktion aus
Isomerisierung und Hydroformylierung von 2-Penten bei 100 °C und 30 bar
Synthesegasdruck. Das l/b-Verhältnis lag bei 99 % und als Nebenprodukt wurde n-
Pentan detektiert. Es sei noch erwähnt, dass Rhodium-Katalysatoren mit Diphosphin-
Liganden ebenfalls aktiv für die Isomerisierung/Hydroformylierung sind.[32]

Industrielle Entwicklung der Hydroformylierung 9
Die Stabilität und die erzielten hohen Regioselektivitäten in der Hydroformylierung
haben zu zahlreichen weiteren Modifikationen von Diphosphit-Liganden geführt.
Beispiele für Diphosphit-Liganden sind in Abbildung 6 dargestellt.
1[51] 2[51]
3[52]
4[53]
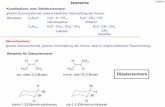
Abbildung 6: Auswahl zweizähniger Diphoshpit-Liganden.
2,2´-((3,3´-Di-tert-butyl-5,5´-dimethoxybiphenyl-2,2´-diyl)bis(oxy)bis(4,4,5,5-
tetraphenyl-1,3,2-dioxaphospholan) ist ein Ligand mit zwei 1,1,2,2-Tetraphenyl-1,2-
ethandiol (Benzopinakol-BzP)-Gruppen (Struktur 1 in Abbildung 6). Mit diesem
Liganden wurden sehr hohe n:iso-Selektivitäten von 99,2 % für 1-Octen in der
Hydroformylierung bei 20 bar Synthesegasdruck erhalten.[51] Mittels NMR- und FTIR-
Untersuchungen konnte die Rhodium-Hydrid-Spezies [HRh(CO)2(BzP)] mit Präferenz

10 Industrielle Entwicklung der Hydroformylierung
zu äquatorial-äquatorial (engl.: ee) Koordination des Diphophosphit-Liganden und dem
Hydrid in axialer Position festgestellt werden.
Abbildung 7: Bildung des ee-[HRh(CO)2(BzP)]-Komplexes[51]
Phosphit-Liganden zeigen eine geringe Anfälligkeit gegen Oxidation im Vergleich zu
Phosphin-Liganden, reagieren dafür aber mit Wasser zu „Hetero-atom-substituted-
phosphine-oxides“ (HASPOs).[54-55] Billig et al. untersuchten die thermische Stabilität
von Phosphit-Liganden gelöst in Aldehyd.[38] Durch Verknüpfung der Arylgruppen mit
Linkern konnte die Stabilität der Liganden verbessert werden. In dem postulierten
Abbaumechanismus der Liganden durch Hydrolyse reagieren diese mit dem Aldehyd
und Wasser weiter und bilden Hydroxyalkylphosphonate. Die Bildung der Phosphonate
führt wiederum zur weiteren Zersetzung der Liganden in einem autokatalytischen
Mechanismus.[56] Tricas et al. kamen bei Untersuchungen zum Abbau von
Monophosphit Liganden zu ähnlichen Ergebnissen.[57] Die Art des Linkers zwischen
den Arylgruppen zeigte keinen Einfluss auf die Stabilität des Liganden. Nach 48
Stunden in einer Lösung aus Aceton und Dichlormethan mit 10-fachen molaren
Überschuss Wasser zu Ligand waren die Liganden vollständig oder mindestens zu 50 %
zersetzt.
Abbildung 8:Abbau von Phosphit-Liganden durch Hydrolyse zu pentavalenten „Hetero-atom
substituted phosphine oxides“ (HASPOs) und trivalenten Phosphorspezies.[58]

Industrielle Entwicklung der Hydroformylierung 11
Phosphit-Liganden, die nach dem Schema in Abbildung 8 zu HASPOs abgebaut werden,
stehen im Gleichgeweicht mit der Phosphorspezies. Diese können mit dem
Edelmetallzentrum einen aktiven Komplex für die Hydroformylierung bilden.[58]
In dem US Patent 4,567,306 der Davy McKee Corporation (heute: Johnson Matthey) ist
eine Methode zur Stabilisierung von Phosphit-Liganden durch Zugabe von tertiären
Aminen in die Reaktionslösung beschrieben.[59] Die Amine sollen den autokatalytischen
Abbau der Liganden unterbinden, indem sie mit den aziden Phosphorspezies
Ammoniumsalze bilden. Nachteilig ist, dass Amine die unerwünschte
Aldolkondensation katalysieren und somit zur Bildung des Nebenproduktes Wasser, das
für den Abbau der Liganden hauptsächlich verantwortlich ist, beitragen. Epoxide sollen
laut US Patent 5,364,950 der UCC mit den Phosphonaten Phosphorigsäureester bzw.
Phosphite bilden und dadurch die autokatalystische Zersetzung der Liganden
stoppen.[60] Ein anderer Ansatz verwendet Ionentauscher zur Steuerung der Azidität und
zur Entfernung von Abbauprodukten des Liganden.[38, 56] Die Reaktionslösung wird in
dem beschriebenen Verfahren über ein schwach basisches Granulat zur Abtrennung der
sauren Komponenten geleitet.
2.2 Mechanismus der Rhodium-katalysierten Hydroformylierung von Olefinen
Die Arbeitsgruppe um Wilkinson entdeckte im Jahr 1968, dass
Hydridocarbonyltris(triphenylphosphan)rhodium(I) [HRh(CO)(PPh3)3] aktiv in der
Hydroformylierung von Alkenen ist.[25, 21] In kinetischen Studien bestimmte die Gruppe
den Einfluss des Substrates, des Metall zu Ligand Verhältnisses und der
Reaktionsgleichgewichte zwischen monomeren und dimeren Rh-Spezies. Auf
Grundlage dieser Daten postulierten Wilkinson et al. einen Reaktionsmechanismus, der
bis heute anerkannt ist.
In Abbildung 9 ist der Reaktionsmechanismus für die Isomerisierung, Hydrierung und
Hydroformylierung von 1-Buten mit einem zweizähnigen Phosphor-Rhodium-Komplex
dargestellt. Ausgehend von dem Precursor Dicarbonyl(acetylacetonat)rhodium(I)
Rh(acac)(CO)2 (A*) bildet sich mit dem Ligand und Synthesegas unter Abspaltung von
Acetylaceton (Hacac) die Hydriddicarbonyl(Ligand)rhodium (I) – Spezies (A) aus. Der
koordinativ gesättigte Präkatalysator (A) geht durch CO-Abspaltung in den katalytisch
aktiven Rhodium(I) – Komplex (16 ve) (B) über. Anlagerung des Olefins (B → C) durch
π-Komplexbildung resultiert in einem koordinativ gesättigten Rh(I)-Komplex (18 ve).

12 Industrielle Entwicklung der Hydroformylierung
Gefolgt von der Insertion des Olefins in die Rh-H Bindung wird ein n-Alkylrhodium(I)-
Komplex (16 ve) (D) erhalten. Mit der Anlagerung von CO an Komplex (D) entsteht ein
Alkyldicarbonylrhodium(I)–Komplex (E). Durch Insertion eines CO Moleküls resultiert
eine Acylrhodium(I)-Spezies (F), die unter Anlagerung eines weiteren CO-Moleküls im
Gleichgewicht mit dem koordinativ gesättigten Acyldicarbonylrhodium(I)-Komplex
(F*) ist. Die oxidative Addition von Wasserstoff (F → G) führt zu einem elektronisch
und koordinativ gesättigten Rh(III)-Komplex.
Abbildung 9: Postulierter Mechanismus für die Isomerisierung, Hydrierung und Hydroformylierung von
1-Buten, modifiziert nach Kiedorf et al.[61]

Industrielle Entwicklung der Hydroformylierung 13
Im letzten Schritt wird der Aldehyd in einer reduktiven C-H-Eliminierung unter
Rückbildung des aktiven, ungesättigten Rhodium(I)-Komplexes abgespalten. Die
Regioselektivität zum linearen Aldehyd wird in dem konkurrierenden Schritt von der
Insertion des Olefins unter Bildung des n-Alkykomplexes (C → D) oder unter Bildung
des iso-Alkylkomplexes (C → D*) bestimmt. Dieser ist wiederum maßgeblich von den
elektronischen und sterischen Eigenschaften des Liganden abhängig. Die Bildung des
iso-Alkylkomplexes gefolgt von der CO-Anlagerung/Insertion und oxidativen Addition
würde in der Bildung eines verzweigten Aldehyds resultieren.
Eine oxidative Addition von Wasserstoff an den n- oder iso-Alkylrhodiumkomplex (D,
D*, I) in Konkurrenz zu der CO-Insertion führt ebenfalls zu einem koordinativ
gesättigten Rhodium(III)komplex. Die anschließende reduktive Eliminierung bildet den
aktiven Katalysatorkomplex (B) unter Abspaltung eines Alkans zurück. Den kürzesten
Reaktionsmechanismus stellt die Isomerisierung des Olefins da. Durch β-H-
Eliminierung des iso-Alkylrhodium(I)-Komplexes (D*, I) wird das interne Alken
erhalten. Die Schritte zur Isomerisierung sind reversibel und finden folglich in beide
Richtungen statt. Die Isomerisierung wird neben der Kinetik und den Eigenschaften des
Liganden von dem thermodynamischen Gleichgewicht der Alkenisomere beeinflusst.
Abbildung 10: Gleichgewicht zwischen ee und ea Koordination des Diphosphit-Liganden (BzP) an
Rhodium.
In NMR und FTIR-Untersuchungen stellten van Leeuwen und Gladfelter fest, dass der
aktive Komplex (B) für zweizähnige Liganden eine trigonal bipyramidale Struktur
favorisiert.[48, 41] Diese kann wiederum in zwei isomeren Strukturen vorliegen, mit dem
Diphosphit-Ligand in äquatorial-äquatorial (ee) oder äquatorial-apikal (ea) Orientierung

14 Industrielle Entwicklung der Hydroformylierung
(siehe Abbildung 10). Selent et al. konnten für den BzP-Liganden eine Präferenz für die
bisäquatoriale Struktur spektroskopisch nachweisen und mittels DFT-Rechnungen
festigen. Generell lässt sich aus den Untersuchungen ableiten, dass die Bildung des
linearen Aldehyds von der bisäquatorialen Konfiguration des Katalysatorkomplexes (B)
bevorzugt wird.[62-63]
2.3 Hydroformylierung von C4 – Alkenen – Wirtschaftliche Hintergründe und
Verfahren
2.3.1 Rohstoffquellen für C4 – Alkene
1-Buten ist ein wichtiger Rohstoff als Comonomer in der Produktion von Polyethylen
oder für die Synthese von Weichmachern für Polyvinylchlorid. Butene werden nahezu
ausschließlich über das katalytische Cracken von Vakuumgasöl und mittleren
Destillaten aus der Erdöl-Raffinierung oder über das Steamcracken von Naphtha
produziert.[64-65] Hierbei kann die Ausbeute zu Ethen bei Cracking Prozessen durch
veränderte Prozessbedingungen gesteigert werden, jedoch nicht die Ausbeute zu Buten.
In thermischen Raffinierprozessen (Visbreaking oder thermisches Cracken) fallen
Butene nur als Nebenprodukt an. Die Oligomerisierung von Ethen (SHOP – Shell
Higher Olefin Process) liefert eine Verteilung von alpha-Olefinen mit 4 – 20
Kohlenstoffatomen.[66] 10 Gew % der Produktphase enthalten 1-Buten, das in sehr hoher
Reinheit aus dem Strom isoliert werden kann. Der Alphabutol Prozess der IFP-SABIC
ist speziell auf die selektive Dimerisierung von Ethen zu 1-Buten ausgelegt, das
hauptsächlich Anwendung als Comonomer findet.[67] Die Abtrennung von C3+-Alkanen
aus Erdgas, speziell aus der zunehmenden Förderung von Schiefergas mittels Fracking,
oder auch aus der Rohölförderung, hat zu einer steigenden Verfügbarkeit von n-Butan
geführt.[68-70] Zusammen mit der gestiegenen Nachfrage nach Propen und Buten
gegenüber Ethen hat sich daraus ein steigendes Interesse nach Prozessen zur
katalytischen Dehydrierung von Butan zur Produktion von 1-Buten ergeben (siehe
anschließendes Kapitel)
2.3.2 Synthesegas
Synthesegas wird als eine Mischung aus Kohlenmonoxid und Wasserstoff definiert. Aus
Schweröl, Gasöl, Kohle oder Biomasse wird Synthesegas über partielle Oxidation bzw.

Industrielle Entwicklung der Hydroformylierung 15
Vergasung hergestellt. Erdgas oder leichte Kohlenwasserstoffe werden durch
Dampfreformierung zu Synthesegas umgesetzt.[71-72] Das molare Verhältnis von
Kohlenstoffmonoxid und Wasserstoff ist nach der partiellen Oxidation von Schweröl
nahezu eins, mit geringen Anteilen an Kohlenstoffdioxid, Methan, Stickstoff, Argon und
Schwefelwasserstoff. Schwefelwasserstoff ist vorhanden, da eine vollständige
Abtrennung der Schwefelverbindungen, z.B. über Wäscher, aus ökonomischen und
technischen Gesichtspunkten nicht möglich ist. Aus Erdgas wird ein molarer
Überschuss an Wasserstoff gegenüber Kohlenstoffmonoxid erhalten. Als Nebenprodukt
fällt in geringen Mengen Kohlenstoffdioxid an. Für ein stöchiometrisches Verhältnis
von Wasserstoff und Kohlenstoffmonoxid in einer anschließenden Hydroformylierung
ist eine Reduzierung des Wasserstoffgehaltes durch eine Druckwechseladsorption nötig.
Alternative Prozesse zur Generierung von Synthesegas basieren auf der reversiblen
Wassergas-Shift-Reaktion mit Überschuss an H2 zu CO2. Tominaga et al. und Haukka
et al. benutzten Ruthenium-Katalysatoren für die Tandem Wassergas-Shift-
Reaktion/Hydroformylierung von CO2, H2 und 1-Hexen zu Aldehyden und
Alkoholen.[73-75] Die direkte Hydrierung der Olefine konnte durch die Immobilisierung
der Ru-Komplexe in einer Mischung aus den ionischen Flüssigkeiten [BMIM]Cl und
[BMIM][NTf2] drastisch reduziert werden.
2.3.3 Dehydrierung von Alkanen
Die katalytische Dehydrierung von C1-C10 Alkanen ist heutzutage eine wichtige
industrielle Route, um selektiv Olefine herzustellen. Speziell die überproportional
steigende Nachfrage nach Propen und Buten gegenüber Ethen führte zu einer
Intensivierung dieser Technologie. Ein Großteil von Propen und Buten wird jedoch nach
wie vor durch das Steamcracking und das Fluid Catalytic Cracking (FCC) gewonnen.
Die Dehydrierung von Alkanen stellt eine Gleichgewichtsreaktion dar. Das
Gleichgewicht wird bei hohen Temperaturen und Drücken < 1 bar zunehmend auf die
Produktseite verschoben (siehe Abbildung 11).
Katalytische Dehydrierung von Alkanen wird bereits seit den 30-iger Jahren des letzten
Jahrhunderts durchgeführt. Leuna in Deutschland und UOP (Universal Oil Products) in
den USA zusammen mit ICI in England haben unabhängig voneinander die Technik
kommerzialisiert. Beide Verfahren verwendeten einen Chrom/Aluminiumoxid-
Katalysator. Bis heute sind Chromoxid auf Aluminiumoxid und Platin/Zinn auf
Aluminiumoxid die industriell am meisten verwendeten Katalysatoren zur katalytischen

16 Industrielle Entwicklung der Hydroformylierung
Dehydrierung von C1-C10 Alkanen. Beide Metalle unterscheiden sich nicht wesentlich
in der Aktivität, aber in der Selektivität, der Stabilität, der Regenerierbarkeit und dem
Preis.[76]
Abbildung 11: Gleichgewichtsumsatz von n-Butan als Funktion der Temperatur und des Druckes,
Simulation mit Aspen Plus 7.2.
Die Aktivität der Chrom-Dehydrierungskatalysatoren kann durch Zugabe von
Alkalimetallen als Dotierungsmittel gesteigert werden. Cäsium, Kalium und Rubidium
haben sich als effiziente Promotoren herausgestellt.[77] Kalium steigert die Aktivität
indem es die Cr6+-Spezies in Cr3+ oder Cr2+-Spezies überführt, die hauptsächlich als
aktive Zentren ausgemacht wurden. Des Weiteren wurde nachgewiesen, dass Kalium
als Dotierungsmittel die Azidität der Trägeroberfläche und der Chromcluster herabsetzt.
Entscheidend für eine Steigerung der Aktivität durch Promotoren ist das richtige
Verhältnis von Chrom zu Kalium. Ein zu großer Kaliumanteil kann als Katalysatorgift
wirken.
ZrO2 und AlOx haben das größte Potential als Trägermaterialien für kommerzielle
Chrom-Katalysatoren.[78-83] Weckhuysen postulierte einen Mechanismus für die
katalytische Dehydrierung von Alkanen an Cr/Al2O3 (siehe Abbildung 12).[80] Das
0 ,1
0 ,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
0,0
0,2
0,4
0,6
0,8
1,0
200
3 0 0
4 0 0
5 0 0
6 0 0
7 0 0
Gle
ich
ge
wic
hts
um
sa
tz /
-
Temper
atur / °
CDruck / bar
0,000
0,1238
0,2475
0,3712
0,4950
0,6188
0,7425
0,8663
0,9900

Industrielle Entwicklung der Hydroformylierung 17
Alkan koordiniert an ein Cr3+-Zentrum, das isoliert oder als Cluster vorliegen kann. Im
zweiten Schritt wird eine C-H-Bindung gebrochen, es entsteht eine O-H-Bindung und
eine Cr-C-Bindung. Durch den Übergang eines Wasserstoffatomes des C2-
Kohlenstoffatoms auf das Cr-Zentrum wird das Alken abgespalten. Im letzten Schritt
wird die Oberfläche des Katalysators durch Abspaltung von H2 regeneriert.
Abbildung 12: Postulierter katalytischer Mechanismus der Alkan-Dehydrierung an Cr/Al2O3-
Katalysatoren nach Weckhuysen.[80]
Platin/Zinn-Katalysatoren werden ebenfalls mit Alkalimetallen modifiziert.[84-86] Zinn
soll die Aktivität, die Selektivität und damit auch die Stabilität der Katalysatoren
verbessern. Es reduziert die Azidität des Trägermaterials und interagiert mit den
Orbitalen des Platins und trägt somit zur Verminderung der Koksbildung bei. Abhängig
von dem Verhältnis von Pt/Sn und der Reduktionstemperatur können sich Legierungen
auf der Oberfläche des Trägers bilden.[87-88] Ein Vorteil von Pt/Sn-Katalysatoren ist, dass
sie fähig zur Strukturisomerie (i-C4 n C4) sein können. Der Effekt der Promotoren ist
auch bei Platin/Zinn-Katalysatoren nicht genau erklärt. Nachgewiesen wurde, dass sie
ebenfalls die Azidität der Trägeroberfläche beeinflussen und somit zur
Selektivitätssteigerung beitragen können. Als Trägermaterialien für den technischen
Einsatz werden AlOx, ZnAl2O3 und MgAl2O4 verwendet. Diese Träger werden
aufgrund der geringen Azidität und guten Stabilität unter thermischen Belastungen
verwendet. In den letzten Jahren wurde auch von Zeolithen oder Zeolith-ähnlichen
Trägern berichtet.[89-91] Abbildung 13 zeigt mögliche Reaktionspfade in der
Dehydrierung leichter Kohlenwasserstoffe an Platinzentren und aziden
Oberflächengruppen des Trägers.[92] Es wird vermutet, dass die unerwünschten
Oligomerisierungs- und Polymerisierungsreaktionen nur durch die aziden
Oberflächengruppen katalysiert werden.
Sowohl Chrom- als auch Platin-Katalysatoren haben gemeinsam, dass sie aufgrund von
Koksbildung deaktivieren. Chrom-Katalysatoren sind zwischen einigen Minuten und

18 Industrielle Entwicklung der Hydroformylierung
Abbildung 13: Reaktionsnetzwerk der Dehydrierung von Alkanen an Platin und aziden Zentren.[92-93]
einigen Stunden aktiv, Platin-Katalysatoren einige Stunden bis Tage. Folglich müssen
die Katalysatoren periodisch regeneriert werden. Die Regeneration erfolgt meistens mit
Luft und/oder Dampf, um die Kohlenstoffablagerungen abzubrennen. Durch die
hydrothermalen Bedingungen sollten die Katalysatoren nicht verändert werden.
Während der Regeneration neigt Platin zum Sintern bei hohen Temperaturen. In
manchen Fällen ist eine Reduzierung des Metalls vor dem Kontakt mit
Kohlenwasserstoffen oder eine Restrukturierung der Metallcluster mit Chloriden nötig.
Die Reduktion kann auch in-situ durch frei werdenden Wasserstoff während der
Dehydrierung stattfinden.
Es existieren fünf kommerzielle Verfahren, die sich hinsichtlich
Temperaturmanagement, eingesetztem Katalysator und Katalysatorregenerierung
unterscheiden. Eine detaillierte Beschreibung der einzelnen Verfahren ist auf Basis der
Patentschriften schwierig. Es werden daher ausschließlich literaturbekannte Aspekte der
Verfahren erläutert, die in der wissenschaftlichen Literatur diskutiert werden. Ein
Überblick ist in Tabelle 2 dargestellt.
- CATOFIN (Houdry Technology), CB&I, (früher ABB Lummus)
- OLEFLEX, UOP
- Steam-Active Reforming (STAR), Thyssen-Krupp Uhde (früher Phillips)
- Propane Dehydrogenation Technology (PDH), Linde-BASF-Statoil
- Fluidized Bed Dehydrogenation (FBD), Snamprogetti-Yarsintez
Das CATOFIN Verfahren setzt auf parallel angeordnete Festbettreaktoren. Es beruht
auf dem von Houdry entwickelten CATADIENE Prozess zur Produktion von
Butadien.[94-95] Die Reaktoren werden alternierend in einem Zyklus betrieben. Der
Zyklus besteht aus der Beaufschlagung des Reaktors mit Reaktionsgas, Spülen des

Industrielle Entwicklung der Hydroformylierung 19
Reaktors und Regenerierung des Katalysators mit Luft. Das Reaktionsgas wird vor dem
Eintritt in den Reaktor auf Reaktionstemperatur vorgeheizt, da die Reaktoren adiabat
betrieben werden und sich aufgrund der endothermen Reaktion abkühlen. Die
Temperatur im Reaktor wird durch die freiwerdende Wärme bei der Regenerierung
erzeugt. Der Chrom/Aluminiumoxid-Katalysator wird von der Clariant AG (früher Süd-
Chemie AG) produziert. Im Jahre 2000 existierten acht Catofin Anlagen zur Produktion
von Isobuten und zwei Anlagen zur Produktion von Propen weltweit.[92, 96]
Das OLEFLEX Verfahren besteht aus in Reihe geschalteten Rohrreaktoren, die adiabat
betrieben werden. Der Platin/Zinn auf Aluminiumoxid-Katalysator passiert parallel mit
dem Reaktionsgas die Reaktoren. Der Katalysator wird in einer Regenerationseinheit
aufgefangen und kontinuierlich dem Prozess erneut zugeführt. Das Reaktionsgas wird
vor dem Eintritt und zwischen den Reaktoren durch Gasbrenner auf
Reaktionstemperatur erhitzt. Laut UOP existieren neun Anlagen für die Produktion von
Propen nach dem OLEFLEX Verfahren.[97]
In dem STAR-Verfahren von Thyssen-Krupp Uhde werden die Festbettreaktoren aktiv
mit Brenner analog dem Steam-Reforming beheizt. Das Verfahren beruht auf der
oxidativen Dehydrierung. Die Reaktoren werden normalerweise mit einem Druck von
0,5 MPa betrieben. Der Partialdruck der Kohlenwasserstoffe wird mit Dampf und/oder
Luft reduziert. Der erhöhte Druck ist prozessbedingt und wirkt sich positiv auf die
anschließende Aufreinigung und folglich die Energiebilanz der Anlage aus. Reaktion
und Regeneration erfolgen in einem Zyklus. Daher werden meist mehrere Reaktoren
parallel eingesetzt. Der Katalysator ist ein Platin/Zinn auf Magnesium/Zink dotiertem
Aluminat.[98-99]
Das Reaktorkonzept des PDH Verfahrens besteht aus parallel angeordneten
Festbettreaktoren, die mit Brenner befeuert werden. Die Regeneration des Katalysators
erfolgt zyklisch mit einer Mischung aus Dampf und Luft. Der Katalysator ist vom Typ
Chrom/Aluminia. Es wird angenommen, dass mittlerweile Platin Katalysatoren in dem
Prozess eingesetzt werden.[100]
Die FBD Technik ist angelehnt an das Fluid Catalytic Cracking (FCC).[101] Das System
besteht aus einem Wirbelschichtreaktor und einem Regenerator. Die Wirbelschicht wird
üblicherweise als blasenbildende Wirbelschicht betrieben, um die Verweilzeitverteilung
der Edukte so klein wie möglich zu halten und trotzdem einen guten Wärmeübergang

20 Industrielle Entwicklung der Hydroformylierung
Tabelle 2: Industrielle Prozesse zur katalytischen Alkan-Dehydrierung.[102-104, 93]
CATOFIN UOP Oleflex STAR FBD Linde
Lizenzgeber Clariant AG /
ABB Lummus
UOP Inc. Uhde Snamprogetti/
Yarsintez
Linde
(BASF)
Reaktor Festbettreaktor,
adiabat
Wanderbett-
reaktor,
adiabat
Festbett-
reaktor
Wirbelschicht-
reaktor
Festbett-
reaktor,
isotherm
Betrieb zyklisch kontinuierlich zyklisch kontinuierlich zyklisch
Substrat C3 oder C4 C3 oder C4 C3 oder C4 C3 oder C4 C3 oder C4
Katalysator CrOx/Al2O3 mit
Alkalimetall
Pt/Sn/Al2O3
mit
Alkalimetall
Pt/Sn auf
ZnAl2O3/
CaAl2O3
CrOx/Al2O3 mit
Alkalimetall
CrOx/Al2O3
Wärme-
eintrag
Wärme wird
während
Regenerierung
des Katalysators
erzeugt
Gas-
vorheizung
Aktiver
Wärme-
eintrag mit
Brennern
Wärme wird
während
Regenerierung
des Katalysators
erzeugt
Aktiver
Wärme-
eintrag mit
Brennern
T / °C 590 – 650 550 – 620 550 – 600 550 – 600 -
p / bar 0,3 – 0,5 2 – 5 5 – 6 1,1 – 1,5 >1
Zykluszeit 15 – 30 min - 8 Stunden - 9 Stunden
Umsatz / % C3: 48 – 65
C4: 60 - 65
C3: 25
C4: 35
C3: 40 C3: 40
C4: 50
C3: 30
Selektivität
an Olefin /
%
C3: 82 – 87
C4: 93
C3: 89 – 91
C4: 91 - 93
C3: 89 C3: 89
C4: 91
C3: 90
zu erzeugen. Einbauten im Reaktor können zusätzlich die Fluidisierung bzw.
Rückvermischung bewusst stören. Der Cr/Al-Katalysator zirkuliert kontinuierlich im
Gegenstrom zwischen Reaktor und Regenerator. Die Reaktionswärme (> 650 °C) wird
durch die Wärmekapazität des heißen Katalysators erzeugt.[105-106]

Industrielle Entwicklung der Hydroformylierung 21
2.4 Industrielle Verfahrenskonzepte für die Hydroformylierung
Nach der Entdeckung der Hydroformylierung, auch als Oxosynthese oder Roelen-
Reaktion bezeichnet, im Jahre 1938, begannen sofort die Bemühungen der industriellen
Umsetzung. Im Jahre 2013 feierte die Hydroformylierung 75-jähriges Jubiläum und zu
diesem Anlass sind zahlreiche Artikel über die industrielle Entwicklung der Reaktion
erschienen.[11-12, 18]Daher soll auf die Entwicklung an dieser Stelle nicht weiter
eingegangen werden. In Tabelle 3 ist ein Überblick über industrielle Oxo-Verfahren
inklusive der wichtigsten Kennzahlen gegeben.
Ohne Zweifel ist das Ruhrchemie/Rhône-Poulenc-Verfahren ein Meilenstein in der
Entwicklung der industriellen Hydroformylierung. Das Lösen des
Katalysatorkomplexes in mit Edukten und Produkten nicht mischbaren Wasser führte
zu einer effizienteren Rezyklierung und damit besseren Ausnutzung der Rhodium-
Ligand-Spezies. Nachteilig an diesem Verfahren ist das begrenzte Spektrum an
einsetzbaren kurzkettigen Olefinen. Die Löslichkeit der Olefine in der wässerigen
Katalysatorphase nimmt mit zunehmender Kettenlänge ab, wodurch sich die
Reaktionsgeschwindigkeit reduziert (siehe Abbildung 14). Dieser Effekt kann nur
bedingt durch intensives Rühren kompensiert werden, sodass eine wirtschaftliche
Durchführung des Prozesses für > C4 nicht gewährleistet werden kann.
Die Immobilisierung des homogenen Katalysatorkomplexes ist bis heute eine der
größten Herausforderungen der industriellen Hydroformylierung. Im anschließenden
Kapitel werden einige innovative Immobilisierungskonzepte vorgestellt.
Abbildung 14: Löslichkeit von Alkenen und Aldehyden in Wasser[107]
Aldehyd
Olefin
Aldehyde
Aldehyde
Lö
slic
hk
eit
/ m
ol%

22 Industrielle Entwicklung der Hydroformylierung
Tabelle 3: Überblick industrieller Oxo-Verfahren.[108, 16, 109, 12] R
uh
rch
em
ie /
Rh
ôn
e-P
ou
len
c -
Pro
zess
HR
h(C
O)(
PR
3) 3
C3,
C4 b
edin
gt
40
– 5
0
11
0 –
140
Ald
ehy
de
95
: 5
wen
ig
Zw
eip
has
iges
Rea
kti
on
smed
ium
,
Kat
aly
sato
rph
ase
pra
kti
sch
u
nlö
slic
h
mit
Edu
kt/
Pro
duk
tphas
e
Mit
sub
ish
i
Ch
emic
al
Co
rpo
rati
on
-
Pro
zess
HR
h(C
O) 4
Inte
rne
C8
Ald
ehy
de
Zug
abe
von
T
PP
und
des
till
ativ
e
Ab
tren
nung
Un
ion
Ca
rbid
e
Co
rpo
rati
on
(U
CC
)
HR
h(C
O)(
PP
h3) 3
C2 –
C4
15
- 3
0
85
- 1
20
Ald
ehy
de
92
: 8
wen
ig
„Gas
re
cycl
e p
roce
ss“
–
Kat
aly
sato
r v
erble
ibt
im
Rea
kto
r,
Ald
ehyde
wer
den
mit
S
yn
thes
egas
au
s dem
Rea
kto
r g
estr
ippt.
„L
iqu
id
recy
cle
pro
cess
“ –
Kat
aly
sato
r v
erble
ibt
im
Ho
chsi
eder
, d
esti
llat
ive
Au
frei
nig
ung
Sh
ell
- P
roze
ss
Co
(CO
) 3(P
R3) 2
ku
rz-
un
d
lan
gk
etti
g
50
– 1
00
16
0 -
200
Alk
oh
ole
88
: 1
2
~ 1
5 %
Alk
an
Des
till
atio
n,
Kat
aly
sato
rko
mp
lex
ver
ble
ibt
mit
d
en
Ho
chsi
eder
n
im
Su
mp
f der
Kolo
nn
e
Ex
xo
n -
Pro
zess
HC
o(C
O) 4
lan
gk
etti
g
20
0 –
300
11
0 –
180
Ald
ehy
de
80
: 2
0
wen
ig,
Alk
an <
3 %
Ph
asen
tren
nu
ng
du
rch
Was
chen
mit
N
a 2C
O3.
Rück
-
gew
inn
ung
vo
n
HC
o(C
O) 4
m
it
H2S
O4
BA
SF
-
Pro
zess
HC
o(C
O)
C3
20
0 –
300
11
0 –
180
Ald
ehy
de
80
: 2
0
wen
ig,
Alk
an
< 3
%
Üb
erfü
hre
n d
urc
h
par
tiel
le
Ox
idat
ion
und
Ess
igsä
ure
in C
o-
Sal
ze
Ru
hrc
hem
ie
- P
roze
ss
HC
o(C
O) 4
C3
20
0 –
300
11
0 –
180
Ald
ehy
de
80
: 2
0
wen
ig,
Alk
an
< 3
%
Au
sflä
llen
v
on
Co
-Sch
lam
m
Pro
zess
Ka
taly
sato
rsp
ezie
s
Alk
en
Dru
ck /
ba
r
Tem
per
atu
r /
°C
Pro
du
kte
n/i
so-V
erh
ält
nis
Neb
enp
rod
uk
te
Ka
taly
sato
r-
rezy
kli
eru
ng

Immobilisierung homogener Katalysatorkomplexe 23
3 Immobilisierung homogener Katalysatorkomplexe
Die mitunter harschen Bedingungen, die bei der destillativen Aufreinigung des
Katalysatorkomplexes in industriellen Verfahren auftreten, führen zu einer teilweisen
Zersetzung der Rhodium-Ligand-Struktur, wodurch eine Zufuhr von frischem Rhodium
und Ligand in industrielle Prozesse notwendig ist. Die Abtrennung von Produkt und
Katalysator sowie die Rezyklierung des Katalysators ist eine der größten
Herausforderungen der homogenen Katalyse.[110] Eine Verbesserung der Rhodium-
Rezyklierung für die Hydroformylierung hat das Lösen des Katalysatorkomplexes in
einem mit der organischen Phase schlecht löslichem Medium, z.B. Wasser, gebracht.
Das „einfache“ Abtrennen der Katalysatorspezies von der Edukt/Produkt-Phase ohne
ein zusätzliches Trennverfahren wird allgemein als Immobilisierung bezeichnet.
Immobilisierungskonzepte zielen darauf ab, die katalytisch aktive Spezies in einer
anderen Phase als die Edukte/Produkte zu halten. Die Phasen können entweder in zwei
nicht oder nur schlecht löslichen Fluiden oder in unterschiedlichen Aggregatszuständen
vorliegen, wobei die Phasen unter Reaktionsbedingungen nicht zwangsläufig
zweiphasig, beispielsweise bei thermomorphen Systemen, vorliegen müssen. Eine
Klassifizierung von Immobilisierungstechniken ist in Abbildung 15 dargestellt.
Abbildung 15: Immobilisierungskonzepte für homogene Katalysatoren
Immobilisieurngskonzepte homogener Katalysatoren
Fluid-Fluid Mehrphasensysteme
Flüssig-Flüssig Mehrphasensysteme
zweiphasig organsich / organisch
zweiphasig wässrig / organisch
zweiphasig ionische
Flüssigkeit / organisch
Mizellare Systeme
Phasenwechsel
überkritisches CO2, Δp
Fluorierte Lösungsmittel,
ΔT
Thermomorphe Systeme, ΔT
Heterogenisierung
kovalente Verknüpfung
Metall - Träger Wechselwirkung
Ligand - Träger Bindung
Physisorption
Supported Liquid Phase - SLP
Supported Aqueous Phase -
SAP
Supported Membrane Phase
(SMP)
Supported Fluorous Phase
(SFP)
Supported Ionic Liquid Phase -
SILP
Elektrostatische Wechselwirkung
Ionenpaar-wechselwirkung

24 Immobilisierung homogener Katalysatorkomplexe
3.1 Fluid-Fluid Mehrphasenkatalyse
Fluid-Fluid-Phasensysteme bestehen aus zwei Phasen, wobei eine Phase den
Katalysator immobilisiert und die zweite Phase die Edukte/Produkte enthält. Die Phasen
können entweder flüssig/flüssig oder durch eine Druck- bzw. Temperaturänderung in
unterschiedlichen Phasen vorliegen. Für Flüssig-Flüssig-Zweiphasensysteme muss der
Katalysatorkomplex speziell auf das Lösungsmittel abgestimmt werden, das im Idealfall
mit den Produkten eine Mischungslücke aufweist. Hingegen sollten die Edukte eine gute
Löslichkeit in dem Lösungsmittel aufweisen. Für den Fall einer geringen Löslichkeit
der Edukte in dem Lösungsmittel beeinflussen zunehmend Massentransporteffekte die
Reaktionsgeschwindigkeit.[107] Die bekannteste Anwendung der Flüssig-Flüssig-
Zweiphasensysteme ist die Hydroformylierung von Propen nach dem
Ruhrchemie/Rhône-Poulenc-Verfahren. Der Einsatz eines wasserlöslichen Metall-
Ligand-Komplexes führte zu einer einfacheren und ökonomischeren Rückgewinnung
und Rezyklierung des Katalysatorkomplexes im Vergleich zu den einphasigen Oxo-
Verfahren.[111-113] Die Gruppe um Cole-Hamilton erreichte durch die Zugabe von 1-
Octyl-3-methylimidazoliumbromid [OMIM]Br als Additiv in der wässrigen
Zweiphasen-Hydroformylierung eine Steigerung der Löslichkeit von 1-Octen in der
Katalysatorphase und folglich eine Steigerung der Reaktionsrate.[114] Renken et al.
fügten der wässrigen, zweiphasigen Hydroformylierung amphiphile Mittel zu, damit die
wässrige und organische Phase mizellare Systeme ausbilden.[115] Aufgrund der Größe
der Mizellen von 10 – 100 nm ist die Stoffaustauschfläche gegenüber einem mechanisch
dispergiertem System drastisch erhöht und die Reaktionsrate konnte von 12 molAlken
molRh-1 h-1 auf 1003 molAlken molRh
-1 h-1 für 1-Decen gesteigert werden. Riisager et al.
untersuchten die Hydroformylierung von 1-Octen mit Rhodium-TPPTS unter Zugabe
von Cetyltrimethylammoniumbromid (CTAB).[116] Der Umsatz bezüglich des Alkens
konnte durch geringe Mengen an CATB gesteigert werden. Bei hohen Konzentrationen
bildeten sich liposome Strukturen von TPPTS und CTAB aus, die eine Verringerung der
Aktivität und der Selektivität zur Folge hatten.
Der Shell-Higher-Olefin-Process (SHOP) zur Ethenoligomerisierung ist ein
industrielles Beispiel für die organisch-organisch-Zweiphasenkatalyse. Der
Nickelkatalysatorkomplex ist in einem polaren Lösungsmittel, beispielsweise
Butandiol, gelöst, das mit entstehenden linearen Alpha-Olefinen eine Mischungslücke
aufweist.[117-118] Der Einsatz von ionischen Flüssigkeiten als Reaktionsmedium in der
Zweiphasenkatalyse wurde für die Rhodium-katalysierte Hydroformylierung von
langkettigen Olefinen untersucht.[119-120] Mit modifizierten Liganden konnten exzellente

Immobilisierung homogener Katalysatorkomplexe 25
Aktivitäten von 680 h-1 und l/b-Verhältnisse von 20,9 in Hexafluorophosphat-basierten
ionischen Flüssigkeiten erzielt werden. Ionische Flüssigkeiten bieten u.a. den Vorteil,
dass die speziellen Löslichkeitseigenschaften auf den Übergangsmetallkomplex und die
Edukte abgestimmt werden können.[121] Favre et al. konnten zeigen, dass Phosphit-
Liganden, die in wässrigen Zweiphasensystemen nicht stabil sind, in ionischen
Flüssigkeiten für die Rhodium-katalysierte Hydroformylierung eingesetzt und
Leaching-Effekte minimiert werden können.[122] Aufgrund des sehr geringen
Dampfdruckes der ionischen Flüssigkeiten ist eine destillative Aufreinigung der
Produktmischung bei gegebener Stabilität des Katalysators möglich. Der Einsatz von
ionischen Flüssigkeiten in der Katalyse ist in Artikeln von Wasserscheid[123], Welton[124-
126], Pârvulescu[127], Haumann[128] und Olivier-Bourbigou[129] beschrieben. Die Nickel
katalysierte Olefinoligomerisierung nach dem „Difasol“ –Verfahren war der erste
Übergangsmetall-katalysierte Prozess, der zweiphasig mit einer ionischen Flüssigkeit
industriell durchgeführt wurde.[130]
In der Zweiphasenkatalyse hat die Phasengrenzfläche immer einen entscheidenden
Einfluss auf den Stofftransport und damit oft auf die Reaktionsrate. Die
Phasengrenzfläche wird u.a. durch die Viskosität der Medien oder den Energieeintrag
in Form von Rühren beeinflusst. Die Löslichkeit der Edukte in der Katalysatorphase
setzt oft die wirtschaftlichen Grenzen der Zweiphasenkatalyse. Mit
temperaturgesteuerten Lösungsmittelsystemen ist es möglich, die Reaktion in einer
Phase durchzuführen. Das Gemisch aus Lösungsmittel, Katalysator und Edukt muss
hierbei eine stark temperaturabhängige Mischungslücke besitzen. Horváth et al.
beschrieb im Jahre 1994 die zweiphasige Katalyse mit fluorierten Lösungsmittel für die
Hydroformylierung langkettiger Olefine.[131] Zwischen Temperaturen von 60°C und 120
°C mischen sich die fluorierte und die organische Phase. Durch Abkühlen wird erneut
ein zweiphasiges Gemisch erhalten. Als Ligand wurde in den Arbeiten von Horváth eine
fluorierte Phosphinspezies P[CH2CH2(CF2)5CF3] eingesetzt. Foster et al. untersuchten
die Hydroformylierung von 1-Octen in Perfluoromethylcyclohexan mit fluorhaltigen
Triarylphophit- oder Triarylphosphin-Liganden.[132] Im Vergleich zu dem System von
Horváth konnte die Aktivität vervierfacht und das l/b Verhältnis von 4,5 auf 6,3
gesteigert werden. Grundlegende Details zur fluorierten Zweiphasenkatalyse sind in den
Artikeln von Pozzi[133] und Tzschucke[134] aufgeführt. Die Gruppe um Behr nutzte ein
System aus üblicherweise drei Lösungsmitteln, die aus einem polaren und einem
unpolaren Lösungsmittel sowie einem Lösungsmittelvermittler bestehen.[135] Die
Mischungslücke des Dreikomponentensystems ist temperaturabhängig, wobei

26 Immobilisierung homogener Katalysatorkomplexe
idealerweise bei Reaktionstemperatur ein einphasiges Medium vorliegt. Das polare
Lösungsmittel enthält den Katalysator und das unpolare Lösungsmittel dient als
Extraktionsmittel für die Produkte. Am Beispiel der isomerisierenden
Hydroformylierung von 4-Octen konnten in dem thermomorphen System
Propylencarbonat/iso-Dodecan/N-methyl-2-pyrrolidon Umsätze von 99 % und
Selektivitäten an n-Nonanal von 81 % erreicht werden.[136] Der Rhodium-Austrag war
in diesem System <0,1 %. Für das thermomorphe System Polycarbonat/n-Dodecan/p-
Xylen betrug der Rhodium-Verlust dagegen 47 %.[137]
Überkritische Fluide besitzen gas- und flüssigkeitsähnliche Eigenschaften.[138-139] Die
Dichte ist vergleichbar mit der Dichte von Flüssigkeiten und der binäre
Diffusionskoeffizient weist ähnliche Werte wie in gasförmigen Medien auf.
Überkritische Medien lösen sowohl feste (z.B. homogene Übergangsmetallkomplexe)
als auch flüssige Komponenten. Überkritisches Kohlenstoffdioxid (scCO2) ist das am
meisten verwendete Fluid. Der kritische Punkt wird bereits bei einer Temperatur von
Tkrit = 31,1°C und einem Druck von pkrit = 73,8 bar erreicht. Zudem ist CO2 nicht toxisch,
nicht entflammbar und sicher handhabbar. In der Hydroformylierung von 1-Octen mit
unmodifizierten, Phosphin- oder Phosphit-modifizierten Rhodium-Systemen konnten
Koch und Leitner vergleichbare Aktivitäten mit Systemen in organischen Lösungsmittel
erreichen.[140] Die Trennung von Katalysator und Produkt erfolgt durch Veränderung
von Druck und Temperatur, sodass die Aldehyde aus dem überkritischen Medium
extrahiert werden. Die Löslichkeit des Katalysatorkomplexes in überkritischem CO2 in
Abhängigkeit von Druck und Temperatur hat einen entscheidenden Einfluss auf das
Leaching in die organische Phase während der Extraktion. Cole-Hamilton et al.
untersuchten die Hydroformylierung in einem Zweiphasen-System aus überkritischem
Kohlenstoffdioxid und ionischer Flüssigkeit.[141-142] Überkritisches CO2 löst die
organischen Komponenten, fördert deren Diffusion in die Katalysatorphase aus
Metallkomplex und ionischer Flüssigkeit und kann gleichzeitig als Extraktionsmittel für
die Produkte wirken. Aufgrund des Dichteunterschiedes beider Phasen und der in-situ
Extraktion ergibt sich die Möglichkeit einer kontinuierlichen Fahrweise für die
Hydroformylierung von langkettigen Olefinen.
Bei Fluid-Fluid-Mehrphasensystemen bringt eine sehr gute Abtrennung von
Edukt/Produkt und Katalysator oft den Nachteil mit sich, dass aufgrund von
Stofftransportlimitierungen die Anwendbarkeit auf einige wenige Stoffsysteme
beschränkt bleibt. Zusätzlich muss das Design des Liganden auf das Reaktionsmedium

Immobilisierung homogener Katalysatorkomplexe 27
abgestimmt werden. Die Heterogenisierung homogener Übergangsmetallkomplexe
bietet demgegenüber Vorteile, die im nächsten Kapitel näher erläutert werden.
3.2 Heterogenisierung homogener Katalysatorkomplexe – Supported
Homogeneous Catalysts
Die Zweiphasenkatalyse war ein Meilenstein in der Reaktionsführung homogener
Katalysatoren. Eine logische Weiterführung des Gedankens homogene Katalysatoren
effizienter zu nutzen, ist die Kombination der Vorteile der homogenen und heterogenen
Katalyse. Die Immobilisierung homogener Katalysatoren auf Feststoffen ermöglicht
deren Einsatz in Festbettreaktoren oder Suspensions-Reaktoren. Diese auf den ersten
Blick einfache Lösung bringt jedoch einige praktische Herausforderungen mit sich:
- Metall-Leaching vom Support;
- Reduzierte Aktivität und Selektivität des immobilisierten Katalysators gegenüber
dem homogene Katalysator;
- Probleme mit der mechanischen und thermischen Stabilität;
- Support verhält sich nicht inert.
In der Literatur existieren zahlreiche Ansätze zur Immobilisierung von homogenen
Katalysatoren.[143-147, 107] Homogene Katalysatorkomplexe können in eine
Polymermatrix eingeschlossen werden, über ionische oder kovalente Bindungen mit
dem Support verankert werden, über Wasserstoffbrückenbindungen mit dem Träger
verknüpft werden oder in einem dünnen physisorbierten Film eines Fluides gelöst auf
dem Träger vorliegen. All diese Möglichkeiten haben ihre Vor- und Nachteile.
Katalysator-Leaching stellt außer bei der ionischen oder kovalenten Verankerung von
Katalysator und Träger das größte Problem dar. Für eine kovalente Verknüpfung muss
der Ligand speziell hergestellt werden und Leaching wird nur bei hinreichend starker
Verknüpfung vermieden. Für eine ionische Verknüpfung muss der Katalysatorkomplex
ebenfalls eine Ladung tragen, jedoch kann die Stabilität durch Gegenionen beeinflusst
werden, die bei Reaktionen mit eventueller Salzbildung entstehen. Bei Verknüpfung
über Wasserstoffbrückenbindungen steht der Ligand in Konkurrenz zu den Edukten,
Produkten und Lösungsmitteln.
Supported Liquid Phase (SLP) Katalysatoren basieren auf der Physisorption eines
Lösungsmittels auf der Oberfläche eines porösen Trägers. In dem Lösungsmittel ist ein
homogener Katalysatorkomplex gelöst. Acres et al. berichteten im Jahre 1966 erstmals

28 Immobilisierung homogener Katalysatorkomplexe
über diese Form der Katalyse.[148] Rhodiumtrichlorid gelöst in Ethylenglykol wurde auf
Silica immobilisiert und in der Isomerisierung von Olefinen in der Gasphase eingesetzt.
Rony testete erstmals Rh-SLP-Katalysatoren in der Gasphasen-Hydroformylierung von
Propen.[149] In reaktionstechnischen Studien konnte Rony zeigen, dass bei SLP-
Katalysatoren ein Optimum in der Beladung an Lösungsmittel hinsichtlich
Stofftransport existiert. Der Vorteil von SLP-Katalysatoren liegt in der großen
Austauschfläche, die sich durch die Benetzung eines porösen Trägermaterials ergibt. In
Gasphasenreaktionen ist der Einsatz von homogenen Katalysatoren ohne weitere
Modifikationen möglich. Das Lösungsmittel sollte einen geringen Dampfdruck
aufweisen und den oft hydrophoben Katalysatorkomplex möglichst gut lösen. Hieraus
ergibt sich gleichzeitig das größte Problem der SLP-Katalysatoren. Der Dampfdruck
organischer Lösungsmittel ist immer ungleich null, daher verdampft dieses über die Zeit
und dem homogenen Katalysatorkomplex wird das Reaktionsmedium entzogen.
Beckmann und Keil konnten durch einen regelmäßigen Wechsel der Anströmrichtung
des Festbettes und zwei Adsorberschüttungen vor und nach der SLP-
Katalysatorschüttung die Verdampfungsrate des Lösungsmittels reduzieren und somit
die Stabilität des SLP-Katalysators verbessern.[150]
Davis und Hanson verknüpften die wässrige Zweiphasenkatalyse und die Supported
Liquid Phase – Katalyse zur Supported Aqueous Phase (SAP) – Katalyse.[151] Der
hydrophile Katalysatorkomplex ist in Wasser gelöst, das einen hydrophilen Träger
benetzt. Nach Hanson sind SAP – Katalysatoren in der Gas- und Flüssigphase
einsetzbar. In der Flüssigphase muss die Voraussetzung einer Mischungslücke zwischen
Wasser und Edukt/Produkt vorhanden sein, analog der Zweiphasenkatalyse. In der
Hydroformylierung von Propen mit SAP-Katalysatoren vermuteten Riisager et al., dass
der Katalysatorkomplex an dem Träger haftet, da kein Wasser nach den Versuchen auf
dem Träger mehr vorlag.[152] Von Mehnert et al.[153-154] und Riisager et al.[155] wurden
unabhängig voneinander ionische Flüssigkeiten als Reaktionsmedium auf porösen
Trägern immobilisiert. Aufgrund des extrem niedrigen Dampfdruckes von ionischen
Flüssigkeiten unter Reaktionsbedingungen von homogen katalysierten Reaktionen,
bleibt das Lösungsmittel für den Komplex intakt.[156-157] Ein weiterer Vorteil, der sich
aus dem Einsatz von ionischen Flüssigkeiten ergibt, ist, dass der Ligand nicht speziell
auf das Lösungsmittel abgestimmt werden muss, sondern die ionische Flüssigkeit kann
entsprechend dem Liganden ausgewählt werden.

Immobilisierung homogener Katalysatorkomplexe 29
Katalysatoren und ionische Flüssigkeiten können in verschiedenen Kombinationen mit
dem Träger/Supportmaterial vorliegen. Die wichtigsten sind in Abbildung 16
dargestellt.[158]
Typ 1a
Typ 1b
Typ 2
Typ 3
Abbildung 16: Kombinationsmöglichkeiten von Katalysator / ionischer Flüssigkeit / Support. K =
homogener Katalysatorkomplex, IL = ionische Flüssigkeit.[158]
Typ 1 a und b beschreiben Supported Ionic Phase (SILP) Katalysatoren, die im nächsten
Kapitel noch näher beschrieben werden. Die ionische Flüssigkeit kann durch
physikalische Wechselwirkungen oder durch eine chemische Bindung an den Träger
koordinieren. Der Katalysatorkomplex ist jeweils in der IL gelöst. Die kovalente
Verknüpfung von Fragmenten der ionischen Flüssigkeit mit dem Träger ist in Typ 2
dargestellt.[159] Über einen Ionenaustausch wird das Anion der IL mit einer anionischen
katalytischen Spezies substituiert.[160-161] Das Kation kann in diesem Zusammenhang
auch als Ligand bezeichnet werden. In der Literatur wird für diese Klasse häufig der
Begriff Supported Ionic Liquid Catalyst (SILC) verwendet. Typ 3 beschreibt die
sogenannte Solid Catalyst with Ionic Liquid Layer (SCILL) Katalyse.[162-164] In diesem
Fall wird ein klassischer heterogener Katalysator mit einer ionischen Flüssigkeit
Trägeroberfläche
K
IL IL
IL
IL
IL K
Trägeroberfläche
K
IL IL
IL
IL
IL K
Trägeroberfläche
IL IL IL
K
Trägeroberfläche
K
ILIL
IL
ILIL
K
ILILIL

30 Immobilisierung homogener Katalysatorkomplexe
beschichtet und dadurch modifiziert. SCILL-Katalysatoren haben sich als sehr effizient
in der selektiven Hydrierung von 1,3-Butadien zu 1-Buten erwiesen.[165] Der Einfluss
der ionischen Flüssigkeit wird einem Ligand-Effekt am Metallcluster zugeschrieben.[166]
Die IL nimmt direkt Einfluss auf die Ladungsverteilung des Metallclusters und damit
auch auf die Wechselwirkung von Substrat und Metall.
In der Literatur lassen sich noch weitere Differenzierungen und Ableitungen von IL
funktionalisierten Oberflächen finden: Supported Ionic Liquid nano Particles
(SILnPs)[167], Ionic Liquid Crystalline – SILP (ILC-SILP)[168], Supported Ionic Liquid
like Phase (SILLP)[169], Polymer Supported Ionic Liquid (PSIL)[170-171] und Supported
Ionic Liquid Membrane (SILM)[172-173].
3.3 Analogie zwischen heterogener und homogener Katalyse in der Supported
Liquid Phase (SLP) - Katalyse
Der Einsatz von geträgerten Katalysatoren (Supported Catalysts) ist in der Industrie seit
Jahrzehnten weit verbreitet. Es gibt nur einige wenige Reaktionen, die an reinen
Edelmetallkatalysatoren stattfinden, beispielsweise die Ammoniakoxidation an Platin-
Rhodium-Netzen. Bereits Thiele erkannte im Jahre 1939, dass eine Beziehung zwischen
der katalytischen Aktivität und dem Durchmesser des Trägerpellets besteht. [174] Aus der
Überlegung heraus, dass die Größe des Pellets nicht unendlich vergrößert werden kann
ohne letztlich einen Punkt zu erreichen, an dem die Produkte im Inneren des Korns
schneller entstehen als diese durch Diffusion aus dem Träger ausgetragen werden
können, ist das berühmte „Thiele-Modul“ entstanden. Für eine Reaktion erster Ordnung
ist das Thiele-Modul nachstehend definiert:[174-175]
𝑇ℎ𝑖𝑒𝑙𝑒 − 𝑀𝑜𝑑𝑢𝑙 𝜙 = 𝐿√𝑘𝐴 𝐴𝑖𝑛𝑡,𝑉
𝐷 (3-1)
mit L = lineares Maß zur Charakterisierung der Größe des Partikels in m, k =
Reaktionsgeschwindigkeitskonstante bezogen auf die äußere Katalysatoroberfläche in m3 m-2 s-1, D =
Diffusionskoeffizient in m2 s-1, Aint,V = interne Oberfläche bezogen auf Feststoffvolumen in m2 m-3.
Das Modell, das Thiele für die Herleitung seines Moduls verwendete, ist in Abbildung
17 dargestellt. Es zeigt den Ausschnitt eines Katalysators mit einer durchgehenden Pore,
die von beiden Seiten von einem Fluid umgeben ist.

Immobilisierung homogener Katalysatorkomplexe 31
Abbildung 17: Darstellung eines Ausschnittes eines Katalysators nach Thiele. x = Ortkoordinate, y =
Konzentration des Eduktes i, ys = Konzentration des Eduktes i an der Schale des Partikels, y0 =
Konzentration des Eduktes i im Zentrum des Partikels.[174]
Zur Herleitung wird eine infinitesimal kleine Querschnittsfläche in der Pore mit der
Dicke dx betrachtet. Die Konzentration des Reaktanden nimmt zum Zentrum der Pore
ab. Unter der Annahme stationärer Bedingungen ist der Anteil an Reaktanden, der durch
Diffusion durch die äußere Grenze des Definitionsbereiches in die Pore strömt, größer
als der Anteil, der vom Zentrum nach außen durch die Grenzschicht diffundiert. Die
Differenz der Reaktanden wird durch die Reaktion an der Wand des Porenabschnittes
verursacht. Durch die Lösung dieses Ansatzes in Abhängigkeit der Geometrie des
Partikels lässt sich das Verhältnis der Reaktionsgeschwindigkeit, die für eine bestimmte
Partikelgröße beobachtet wird, zu der Reaktionsgeschwindigkeit angeben, die möglich
wäre, falls die Konzentration der Reaktanden im Inneren des Korns gleich der
Konzentration außerhalb des Partikels wäre. Die Lösung dieses Ansatzes beschreibt das
Verhältnis von beobachteter Reaktionsgeschwindigkeit zu maximaler
Reaktionsgeschwindigkeit als Funktion des Thiele-Moduls. Die Abbildung ist
hinreichend aus Lehrbüchern und Vorlesungen bekannt und wird daher nicht weiter
erläutert.[175] Eine mathematische Herleitung des Thiele Moduls ist im Anhang gegeben
(siehe Kapitel VII).
Hougen und Watson behaupteten, dass das Thiele-Modul generell für poröse
Katalysatoren gültig ist und der Term unter der Wurzel nur von der Temperatur
abhängig ist, sobald die Parameter des Moduls empirisch für den Betriebsbereich
ermittelt worden sind.[176] [177] Wheeler zeigte im Jahre 1951, dass die Selektivität eines
porösen, heterogenen Katalysators nicht ausschließlich von der Auswahl und
Zusammensetzung des Katalysators abhängt, sondern auch von der Größe und der

32 Immobilisierung homogener Katalysatorkomplexe
Struktur des Katalysatorpellets.[178] Er betrachtete eine Pore als einen mikroskopischen
Strömungsrohrreaktor. Für den Fall, dass die Diffusion langsamer als die Reaktion ist,
werden kinetische Größen, Reaktionsordnung, Aktivität und Selektivität, abhängig von
der Poren- und Pelletgröße. Im Falle einer Parallelreaktion wird die langsamere
Reaktion mit zunehmender Partikelgröße oder steigender Temperatur im
diffusionslimitierten Bereich (Thiele Modul > 10) relativ betrachtet begünstigt. Der
Einfluss der Geometrie des Partikels auf den Wirkungsgrad wurde von Aris
untersucht.[179] Es zeigt sich, dass der Wirkungsgrad am Beispiel einer Platte, eines
Zylinder oder einer Kugel unabhängig von der Form ist. Diffusion in porösen Medien
ist bis heute ein großer Bestandteil der Forschung. Evans, Watson und Mason stellten
1961 das „Dusty-Gas“ – Modell vor.[180] [181] In diesem Modell wird die Porenwand als
gleichmäßig im Raum verteilte Anordnung von großen, fixen Molekülen („Dust“)
betrachtet, entlang derer die Gasmoleküle diffundieren müssen. Dadurch können die
„dust“ Partikel formal als große Gasmoleküle betrachtet werden und
Multikomponentensysteme von kombinierter molekularer und Knudsen-Diffusion
modelliert werden. Die gleichzeitige Betrachtung von internen Konzentrations- und
Temperaturgradienten für endotherme und exotherme Reaktionen wurden von Weisz
und Hicks analysiert.[182] Für exotherme Reaktionen konnten Sie einen Wirkungsrad
größer eins feststellen. Dieses Verhalten wurde dadurch erklärt, dass bei einem
genügend hohen Temperaturanstieg im Inneren des Korns der Effekt einer gestiegenen
Reaktionsgeschwindigkeitskonstanten gegenüber dem Effekt der Abnahme der
Reaktandenkonzentration auf die Reaktionsgeschwindigkeit überwiegt.[183] Mit dem
von Weisz hergeleiteten Kriterium war es möglich, mit messbaren Größen zu beurteilen,
ob die Aktivierungsenergie dem Arrheniusgesetz folgt.[184] 17 Jahre nach der
Veröffentlichung von Thiele bestimmte Bischoff die Gültigkeit des Thiele-Moduls für
verschiedene Reaktionsordnungen, indem er ein allgemeines Thiele-Modul in
Abhängigkeit der Reaktionsordnung herleitete.[185] Im Bereich kleiner Thiele-Module
können sich für Reaktionsordnungen von 0,5 bis 3 Abweichungen von 15 % im
Wirkungsgrad ergeben. Astarita stellte eine Analogie zwischen Gas-Flüssig-Systemen
und Fluid-Feststoff-Systemen für die Überlagerung von Stofftransport und chemischer
Reaktion auf.[186] Für fünf Reaktionsregime von langsamen bis momentanen Reaktionen
konnte in Anlehnung an das Zweifilmmodell von Lewis und Whitman ein Wirkungsgrad
abgeleitet werden.[187]
Die theoretischen Beziehungen von Diffusion und Reaktionskinetik sowohl für Gas-
Flüssig-Systeme als auch für Fluid-Feststoff-Systeme wurden von Rony in einem Model

Immobilisierung homogener Katalysatorkomplexe 33
zur Beschreibung von Supported Liquid Phase (SLP) Katalysatoren verwendet.[188]
Rony betrachtet in seinem Modell eine einzelne Pore mit einer mittleren Länge l (siehe
Abbildung 18). Zwei Grenzfälle sind dem Modell zugrunde gelegt: (1) Eine kleine
Menge an Flüssigkeit ist homogen als dünner Film an der Porenwand verteilt und (2)
die komplette Pore ist mit Flüssigkeit gefüllt. Die Hauptvariable stellt die reduzierte
Länge der mit Flüssigkeit gefüllten Pore dar.
Abbildung 18: Ideale Makropore eines Supported Liquid Phase (SLP) - Katalysators nach Rony.[188]
Das Ergebnis ist ein Wirkungsgrad in Analogie zu Thiele, der die
Reaktionsgeschwindigkeit in der Pore ins Verhältnis zu der intrinsischen
Reaktionsgeschwindigkeit setzt. Die effizienteste Form eines SLP-Katalysators liegt
laut Rony vor, wenn im Porennetzwerk nur dünne Filme oder Mikrotröpfchen des
Lösungsmittels vorliegen. Für Flüssigkeitsbeladungen zwischen 30 % und 60 %,
bezogen auf das Porenvolumen, findet ein Fluten der Poren statt und folglich wird die
Diffusion der Reaktanden behindert. Am Beispiel der Hydroformylierung von Propen
mit Bis(triphenylphosphin)rhodium gelöst in Benzylbutylphthalat auf Silica zeigte sich,
dass die gemessene Daten mit dem Modell korrelieren.[149] Der maximale Umsatz von
Propen wurde für einen SLP-Katalysator mit einer Flüssigkeitsbeladung von 50 %
erreicht. Rinker stellte einen Ansatz auf, der es ermöglichte, nicht-ideale poröse Träger
abzubilden.[189] Sein Modell beruht zunächst auf der experimentellen Bestimmung von
Parametern, die den Stoffmengenstrom aufgrund von Diffusion in einer mit Flüssigkeit
gefüllten Pore charakterisieren.[190] Die Daten wurden mittels einer Wicke-Kallenbach-
Diffusionszelle unabhängig von der Reaktion untersucht. Mit Hilfe des „Dusty-Gas“-
Modells konnte so ein Zusammenhang zwischen dem Stoffstrom in der Pore und der
Flüssigkeitsbeladung auf dem Träger hergestellt werden. Der Stoffstrom ist in einer
leeren Pore am größten und nimmt mit zunehmender Beladung exponentiell ab. Folglich
konnte durch Lösen der Bilanzgleichungen für ein kugelförmiges SLP-Katalysatorpellet

34 Immobilisierung homogener Katalysatorkomplexe
ein modifiziertes Thiele Modul aufgestellt werden, das den Stofftransportes in der Pore
und über die Gas/Flüssig-Phasengrenzfläche berücksichtigt. Das Modul ist wie folgt
definiert.[191]
𝜙𝑃 = 𝐿 (𝑞 𝜃0 𝐻𝐴 𝑘𝐴𝐷𝐴𝑒
)
12
(3-2)
Modifiziertes Thiele-Modul für Supported Liquid Phase (SLP) Katalysatoren nach Rinker. L =
charakteristische Länge des Pellets in m, q = Flüssigkeitsbeladung des Trägers, 0 = Porosität des
Trägers in m3 m-3, HA = Gas/Flüssig Verteilungskoeffizient der Komponente A in mol m-3 mol-1 m3, kA
= Reaktionsgeschwindigkeitskonstante für Reaktion 1.Ordnung in s-1, DAe = effektiver
Diffusionskoeffizient von A in einer mit Flüssigkeit gefüllten Pore in m2 s-1.[191]
Die Gültigkeit des Modells wurde anhand der Hydrierung von Ethen mit einem Rh-SLP-
Katalysator und der Isomerisierung von Quadricyclan mit Co-SLP-Katalysatoren
gezeigt.[192] Das Lösungsmittel für den Rhodiumkomplex war Dioctylphthalat und für
den Cobaltkomplex 1-Chlornaphthalin. Für die Ethen-Hydrierung konnte ein Maximum
in der Reaktionsgeschwindigkeit für Beladungen zwischen 45 % und 55 % gemessen
und berechnet werden. Für die Isomerisierung ergab sich das Maximum in der
Reaktionsgeschwindigkeit bei vollständiger Beladung des Trägers mit Flüssigkeit.
Begründet wurde dieser Wert mit der hohen Löslichkeit von Quadricyclan in
Dioctylphthalat. Der Vorteil der SLP-Katalyse liegt laut Rinker bei Systemen, die eine
große Mischungslücke zwischen Edukt und Lösungsmittels aufweisen, damit der Effekt
der kurzen Diffusionswege zum Tragen kommt.
3.4 Supported Ionic Liquid Phase (SILP) – Katalyse
In Kapitel 3.2 wurde bereits die Supported Ionic Liquid Phase (SILP) - Katalyse erwähnt
und deren Entwicklung aus der Supported Liquid Phase (SLP) bzw. der Supported
Aqueous Phase (SAP) – Katalyse dargestellt. Ein SILP-Katalysator besteht aus einem
katalytisch aktiven Metallkomplex, einer ionischen Flüssigkeit und einem
Trägermaterial. Der Katalysatorkomplex ist in der ionischen Flüssigkeit gelöst und diese
liegt im Idealfall als dünner Film an den Porenwänden des Trägers immobilisiert vor.
Makroskopisch wird ein heterogener Katalysator erhalten, dessen Aktivität und
Selektivität analog zur homogenen Katalyse bei vergleichbaren Reaktionsbedingungen
sind.

Immobilisierung homogener Katalysatorkomplexe 35
Abbildung 19: Konzept der Supported Ionic Liquid Phase (SILP) Katalyse.[193]
Supported Ionic Liquid Phase (SILP) – Katalysatoren werden seit über einem Jahrzehnt
erforscht. Arbeiten auf diesem Feld sind in Review-Artikeln von Fehrmann[193], van
Doorslaer[158], Hagiwara[194] und Selvam[195], sowie in zahlreichen Veröffentlichungen
zur Olefin-Hydroformylierung[196-199], -Metathese[200], -Dimerisierung[201-202], Wasser-
Gas Shift Reaktion[203], Absorption/Adsorption[204-205], asymmetrischen Hydrierung[206-
207] und Hydroaminomethylierung[208] detailliert beschrieben. Auf die einzelnen
Reaktionen soll hier nicht weiter eingegangen werden. Vielmehr sollen im Folgenden
literaturbekannte Erkenntnisse der letzten Jahre zum Verständnis der SILP-Katalyse
diskutiert werden. Ein zentrales Thema, dass die SLP-, SAP- und SILP-Katalyse immer
begleitet hat, ist die Verteilung bzw. das Benetzungsverhalten des Lösungsmittels im
Porennetzwerk. Cremer et al. konnten mittels Quantitative Angle-Resolved X-ray
Photoelectron Spectroscopy (ARXPS) zeigen, dass die ionischen Flüssigkeiten
[MMIM][NTf2] und [OMIM][NTf2] auf einer Au(111)-Oberfläche durch physikalische
Gasphasenabscheidung (PVD – Physical Vapor Deposition) bis zu einer Schichtdicke
von 9 nm Lage für Lage anwachsen.[209-210] Im Gegensatz zu einem metallischen
Trägermaterial neigt die IL [EMIM][NTf2] auf unbehandelten Glas-Substraten nach
Ausbildung einer benetzenden Schicht zur Tropfenbildung.[211]
Die Gruppe von Arai konnte ein ähnliches Benetzungsverhalten bereits für SLP-
Katalysatoren feststellen.[212] Die Dispersion von Wasser und Ethylenglycol auf Silica
wurde mittels der Adsorption von Zimtaldehyd bestimmt. Während Wasser dazu neigt,
Inseln auf dem Träger auszubilden, die bei hohen Wasserbeladungen koagulieren,
Träger Pore
Ionische Flüssigkeit
Substrat Produkt

36 Immobilisierung homogener Katalysatorkomplexe
breitet sich Ethylenglycol als kontinuierlicher Film auf dem Träger aus. Lemus et al.
charakterisierten verschiedene Träger aus den Materialien Aktivkohle, TiO2, SiO2 und
Al2O3 in Abhängigkeit der Beladung an ionischer Flüssigkeit [OMIM][PF6].[213] Mittels
Elementaranalyse konnte für alle Träger eine direkte Proportionalität zwischen der
Einwaage und der Beladung an ionischer Flüssigkeit bestimmt werden. Stickstoff- und
Quecksilber –Adsorptionsmessungen zeigten ein Fluten der Poren mit zunehmender
Beladung in der Reihenfolgen Mikroporen → Mesoporen → Makroporen. Ha,
Fehrmann und Riisager stellten fest, dass sich die Oberfläche um 82 % und das
Porenvolumen um 75 % von einem mit 50 Vol% an ionischer Flüssigkeit beladenen
Silica 100-Träger reduzierte.[214] Hingegen verkleinerte sich der mittlere
Porendurchmesser nur von 7,8 nm auf 7,4 nm. Die Autoren schließen daraus eine
irreguläre Verteilung und Schichtdicke der IL in den Poren. Haumann et al. konnten
mittels BET-Analyse und Festkörper NMR-Messungen (MAS-NMR) feststellen, dass
die IL [EMIM][NTf2] zuerst die Mikroporen eines Silica 100 Trägers flutete und
anschließend einen Film ausbildete, der bei einer Beladung von 10 Vol% den Träger
vollständig bedeckt.[215] Ein Anstieg der Beladung auf 20 Vol % bzw. 40 Vol % führte
zur Ausbildung von mehreren Lagen an IL, die wahrscheinlich als Inseln in den Poren
vorlagen. Für eine Beladung von 57, 2 Vol% wurde eine theoretische Schichtdicke von
1,66 nm berechnet.
Ein ebenso oft diskutierter Aspekt ist, wie bzw. wo der Katalysator in einem SLP-
System vorliegt. Horváth untersuchte im Jahre 1990 die Hydroformylierung mit
Supported Aqueous Phase (SAP) – Katalysatoren mit Rh-TPPTS als
Übergangsmetallkomplex und vermutete, dass die Komplexe eher einen heterogenen als
einen homogenen Charakter zeigten.[216] Nach Abbruch der Reaktion konnte durch
Elementaranalyse festgestellt werden, dass sich nur der Anteil von Wasser auf dem
Pellet reduziert hatte. Da der Katalysator vor Abbruch der Reaktion noch aktiv war, aber
der Restanteil an Wasser rechnerisch nicht ausreichte, um eine flüssige Katalysatorphase
zu bilden, vermutete Hovárth, dass die hydratisierten Sulfonatgruppen des
wasserlöslichen Phosphinliganden über Wasserstoffbrückenbindungen mit dem Träger
wechselwirkten (siehe Abbildung 20).

Immobilisierung homogener Katalysatorkomplexe 37
Abbildung 20: Vermutete Immobilisierung von TPPTS auf der hydrophilen Oberfläche eines Trägers
über Wasserstoffbrückenbindungen mit den hydratisierten Sulfonatgruppen nach Hovárth.[216]
31P-NMR Spin-Gitter-Relaxations-Zeit (T1)-Messungen von Hanson et al. aus dem
Jahre 1994 bestätigten hingegen die Anwesenheit einer flüssigen Phase in der SAP-
katalysierten Hydroformylierung mit Rh-TPPTS.[217] Riisager et al. untersuchten die
Hydroformylierung von Propen in der Gasphase mit SAP-Katalysatoren.[152] Die
Variation des Sättigungsgrades des Substratstromes mit Wasser im Bereich von yH2O =
0 bis yH2O = 0,6 zeigte, dass das l/b-Verhältnis (l/b ≈ 1) unabhängig von dem Anteil an
Wasser im Feedstrom war, die Aktivität hingegen ein Maximum bei yH2O = 0,1 hatte.
Riisager et al. vermuteten daher, dass der Katalysatorkomplex, wie bereits von Hovárth
postuliert, einen heterogenen Charakter aufwies. Die eingeschränkte Mobilität des
Katalysatorkomplexes könnte das reduzierte l/b-Verhältnis von 4 → 1 im Vergleich zu
wässrigen Zweiphasenkatalyse mit gleichem Rh-Ligand-System erklären. Die Gruppe
von Bell kommt zu ähnlichen Erkenntnissen für die Supported Ionic Liquid (SILP)-
Katalyse.[218] In der Hydroformylierung von Propen mit dem SILP System, bestehend
aus Rh-Sulfoxantphos (Rh-SX), [BMIM][OctSO4] und Silica, konnte die Gruppe mittels
in-situ FTIR und 31P-MAS-NMR nachweisen, dass der aktive Komplex HRh(CO)2SX
über Wechselwirkungen der Sulfonatgruppen des Liganden mit den Silanolgruppen des
Trägers stabilisiert wird (siehe Abbildung 21).

38 Immobilisierung homogener Katalysatorkomplexe
Abbildung 21: Mögliche Wechselwirkungen von Sulfoxantphos (A, B) und [BMIM][OctSO4] (C) mit
der Oberfläche eines Silica-Trägers nach Shylesh et al.[218]
Ihre These bestärken die Autoren damit, dass eine Imprägnierung des Träger in der
Reihenfolge IL, Präkursor und Ligand einen weniger aktiven Katalysator ergibt, da die
IL mit den Silanolgruppen interagiert und somit die Koordinationsstellen für den
Liganden inhibiert. Eine thermische Behandlung des Träger bei Temperaturen > 100 °C
führt zu einer reduzierten Anzahl an Silanolgruppen und gleichzeitig einer gesteigerten
Azidität der verbleibenden Gruppen. Daraus resultiert, dass eine größere Anzahl an
Liganden über die Phosphoratome mit dem Träger interagiert und folglich keinen
aktiven Komplex mit dem Rhodium ausbilden kann. Der SILP-Katalysator mit der IL
[BMIM][HSO4] zeigte eine geringere Aktivität als ein Katalysator mit der IL
[BMIM][OctSO4]. Die stärkere Wechselwirkung des Anions [HSO4]- mit den
Silanolgruppen könnte aufgrund der höheren Azidität der konjugierten Brønsted-Säure
die Anlagerung des Liganden blockieren.
3.5 Zusammenfassung und Bewertung der Immobilisierungstechniken
Der Vergleich der verschiedenen Immobilisierungstechniken zeigt, dass das globale
Konzept zwar sehr einfach die Umsetzung im Detail aber sehr komplex ist. Alle
Techniken konnten das Problem des Katalysator-Leachings nicht vollständig
verhindern. Im Fall der Zweiphasenkatalyse ist eine genaue Abstimmung des
Stoffsystems und des Reaktionsnetzwerkes mit den Reaktionsbedingungen nötig. Eine

Immobilisierung homogener Katalysatorkomplexe 39
effiziente Immobilisierung des Katalysators im Reaktionsmedium ist oft nur mit einer
Modifikation des Liganden und einer notwendig großen Mischungslücke zwischen dem
Lösungsmittel und der Produktphase möglich. Hinzu kommt, dass die Edukte ebenfalls
eine geringe Löslichkeit in dem Reaktionsmedium aufweisen und somit der
Stofftransport zum entscheidenden Einfluss auf die Aktivität wird. Für die wässrige
Zweiphasenkatalyse nach dem Ruhrchemie/Rhône-Poulenc-Verfahren ist die
Löslichkeit des Produkts in Wasser größer als die der Edukte (siehe Abbildung 14). Der
aus wirtschaftlichen Gründen beschränkte Einsatz auf das Substrat Propen zeigt sehr
deutlich, dass eine detailliertere Bewertung des ganzen Systems für eine industrielle
Umsetzung unvermeidlich ist.
Die Heterogenisierung homogener Katalysatorkomplexe stellt die ideale Verknüpfung
der Vorteile von homogener und heterogener Katalyse dar. Der SLP-, SAP- und SILP-
Katalyse stehen jedoch noch einige Herausforderungen im Weg. Zum einen das
Verständnis, wie Katalysator und Lösungsmittel im Porennetzwerk vorliegen und zum
zweiten das Upscaling zur Herstellung dieser Katalysatorklasse und der Handhabung
eines makroskopisch heterogenen Katalysators mit zum Teil luft- und
feuchtigkeitssensitiven Komponenten. Der erste Punkt wurde bereits im vorherigen
Kapitel diskutiert und die Ergebnisse dieser Arbeit werden noch zu einem weiteren
Verständnis beitragen. Zum zweiten Punkt beschreiben Werner at al. zusammen mit der
Clariant AG (früher Süd-Chemie AG) ein Beschichtungsverfahren mittels Spraycoater,
das die Herstellung von SILP- und SCILL-Katalysatoren im Tonnenmaßstab erlaubt.[219]
Das Trägermaterial wird durch eine aufwärtsgerichtete Anströmung mit einem Gas in
einen fluidisierten Zustand gebracht. Die ionische Flüssigkeit und der
Katalysatorkomplex, die in einem Lösungsmittel gelöst vorliegen, werden auf das
Trägermaterial gesprüht. Über die Verdampfungsrate des Lösungsmittels kann indirekt
Einfluss auf die Verteilung von IL und Katalysatorkomplex genommen werden. Die
Wacker Chemie AG, zusammen mit Fehrmann und Riisager, beschreiben in einem
Patent ein Verfahren zur Befüllung eines Reaktors mit einem SILP-Katalysator für die
Hydroformylierung, der einen luft- und feuchtigkeitssensitiven Liganden enthält.[220]
Zur Beurteilung des Forschungsaufwandes zur Immobilisierung des homogenen
Katalysatorkomplexes sollte ein kritischer Blick auf die Kostenaufschlüsselung für das
Produkt n-Butanal nach dem Low-Pressure-Oxo-Verfahren der Union Carbide
Corporation geworfen werden.

40 Immobilisierung homogener Katalysatorkomplexe
Tabelle 4: Kostenstruktur der Produktion von n-Butanal nach dem LPO-Verfahren[109]
Posten Anteil in %
Rohstoffe
Propen 59
Synthesegas 17
Katalysator / Chemikalien 2
Betriebsmittel 4
Nebenprodukte (Wertprodukt) -10
Fixkosten 9
Investitionskosten 19
Mehr als 75 % der Kosten sind den Rohstoffen zugeordnet, wobei nur 2 % auf den
Katalysator entfallen. Auf den ersten Blick scheint das größte Einsparpotential für die
Hydroformylierung bei der Substitution der Rohstoffe zu liegen. Auf lange Sicht ist
hierbei jedoch kein Preisrückgang aufgrund der Rohstoffsituation zu erwarten, sodass
das Einsparpotential eher gering einzuschätzen ist. Unter Berücksichtigung der
produzierten Mengen an Aldehyden von 7,88 ·106 t a-1 weltweit, Stand im Jahr 2000,
erscheinen die Kosten für Katalysator und Chemikalien nicht trivial.[109] Ein effizientes
Immobilisierungskonzept kombiniert mit einem einfachen Verfahren ist daher nicht nur
aus ökologischen und ressourcenschonenden, sondern auch aus ökonomischen
Gesichtspunkten sinnvoll. Unter dem Kostenaspekt sollte aber nicht nur die
Immobilisierungstechnik betrachtet werden. Erst das Verfahren, das aus der
eingesetzten Immobilisierungstechnik resultiert, muss sich hinsichtlich Apparate,
Energieaufwand und Betriebskosten gegen bestehende Verfahren durchsetzen.
3.6 Stand der SILP-katalysierten Hydroformylierung und Aufgabenstellung
Die aktuelle Forschung an Supported Ionic Liquid Phase (SILP) – Katalyse hat am
Beispiel der Hydroformylierung gezeigt, dass ein technisches C4-Gemisch mit einem
sensitiven Rhodium-Ligand-System über 800 Stunden Reaktionszeit stabil in einem
Rohrreaktor betrieben werden kann. Dieses System dient gleichzeitig als Referenz für
diese Arbeit.

Immobilisierung homogener Katalysatorkomplexe 41
Abbildung 22: Umsatz und n/iso-Selektivität der Hydroformylierung eines technischen C4-Stromes
(Raffinat I) mit einem Rh-Benzpinakol-SILP-Katalysator, T = 100 °C, pges = 10 bar, pRaffinat I = 2 bar, pH2
= pCO = 4 bar,Vges = 29,2 ml min-1, mSILP = 3 g, wRh = 0,2 Gew-%, L : Rh = 10 : 1, BTPS : L = 4 : 1,
[EMIM][NTf2], α = 10 Vol-%.[198]
Trotz des fortgeschrittenen Stadiums der Entwicklung von SILP-katalysierten
Hydroformylierungsreaktionen im Labormaßstab sind einige Fragestellungen noch zu
klären, aus denen sich die Ziele dieser Arbeit ergeben:
- Vertieftes Verständnis der SILP-Katalyse an sich und der Einfluss der
wesentlichen Einflussfaktoren von SILP-Katalysatorsystemen.
- Optimierung von SILP-Katalysatoren für die Hydroformylierung technischer
Einsatzgemische.
- Verständnis der Prozesse, die zur Deaktivierung des Katalysators führen.
- Nutzung von n-Butan als Rohstoff für die Synthese von n-Pentanal über eine
Kaskadenreaktion aus heterogen-katalysierter Dehydrierung und SILP-
katalysierter Hydroformylierung.

42 Versuchsaufbauten, Materialien und Methoden
4 Versuchsaufbauten, Materialien und Methoden
4.1 Allgemeine Arbeitstechniken
Alle luft- und feuchtigkeitsempfindlichen Substanzen wurden in einer inerten
Atmosphäre unter Argon (Linde AG, 4.6) gelagert. Die Katalysatorpräparationen
wurden in einer Glove-Box durchgeführt. Schlenk-Technik wurde für Arbeiten
außerhalb der Glove-Box verwendet. Hygroskopische Substanzen wurden vor dem
Einsatz unter Hochvakuum für mindestens 24 Stunden getrocknet.
4.2 Verwendete Stoffe
4.2.1 Gase
Die Hydroformylierung wurde in dieser Arbeit ausschließlich in der Gasphase
durchgeführt. Synthesegas wurde als Mischung von Kohlenstoffmonoxid (Linde AG,
3.7) und Wasserstoff (Linde AG, 5.0) bereitgestellt. 1-Buten (Linde AG, 2.5) diente als
Modellsubstrat. Raffinat III wurde als Beispiel für ein technisches Gemisch eingesetzt.
Bei Raffinat III handelt es sich um einen aufbereiteten C4-Schnitt, der durch
Steamcracking aus Naphtha gewonnen wird. Raffinat III enthält nur noch Spuren an Iso-
Buten und 1,3-Butadien. Mehrere Raffinat III-Chargen wurden von Evonik Industries
AG im Rahmen dieser Arbeit zur Verfügung gestellt.
Tabelle 5: Molare Zusammensetzung der Raffinat III –Chargen.
Anteila in mol % Raffinat III
Charge 1
Raffinat III
Charge 2
Raffinat III
Charge 3
Iso-Butan 0,13 0,06 0,18
n-Butan 25,62 19,10 25,09
Trans-2-Buten 25,96 33,10 25,3
1-Buten 32,29 27,00 31,5
Iso-Buten 0,06 0,04 0,11
Cis-2-Buten 14,92 17,06 14,22
Iso-Pentan 1,02 3,64 3,6
aZusammensetzung wurde mittels Gaschromatographie bestimmt

Versuchsaufbauten, Materialien und Methoden 43
Raffinat III wurde direkt der Produktionseinheit entnommen, daher schwankte die
Zusammensetzung der einzelnen Chargen, wie in Tabelle 5 aufgeführt. Iso-Pentan
wurde dem Gemisch nachträglich beigefügt und diente als interner Standard für die
Gaschromatographie (GC) - Analytik. n-Butan (Linde AG, 2.5) wurde ausschließlich
für die Dehydrierung eingesetzt. Synthetische Luft mit einem Anteil von 20 Vol-%
Sauerstoff wurde zur Regenerierung des heterogenen Katalysators verwendet. Zur
Inertisierung der Versuchsanlage wurde Helium (Linde AG, 4.6) verwendet.
4.2.2 Komplexe und Katalysatoren
Die Komplexe und Katalysatoren, die für die Synthese von SILP-Katalysatoren
eingesetzt wurden, sind in Tabelle 6 aufgeführt. Die Rhodium-basierten Komplexe
waren kommerziell erhältlich.
Tabelle 6: Übersicht über die eingesetzten Präkursoren und homogenen Katalysatoren.
Komplex Abkürzung Molekulargewicht CAS-Nummer
g mol-1
(Acetylacetonat)dicarbonylrho
dium(I) Rh(CO)2(acac) 258,03 14874-82-9
(Acetylacetonat)(1,5-
cyclooctadien)rhodium(I) Rh(acac)(COD) 310,19 12245-39-5
Tris(triphenylphosphin)rohdiu
m(I)chlorid RhCl(PPh3)3 925,22 14694-95-2
Rhodium(III)chlorid RhCl3 209,26 10049-07-7
Für die Alkan-Dehydrierung wurde ein heterogener Katalysator von Evonik Industries
AG eingesetzt. Die Daten in Tabelle 7 sind dem Datenblatt entnommen.
Tabelle 7: Zusammensetzung des Chrom/Aluminiumoxid – Katalysators der Evonik Industries AG.[221]
Material Abkürzung Anteil Molekulargewicht CAS-Nummer
Gew % g mol-1
Aluminiumoxid Al2O3 86 101,96 1344-28-1
Chrom(V)-verbindungen — 3 — —
Dichromtrioxid Cr2O3 7 151,99 1308-38-9
Kaliumcarbonat K2CO3 4 138,32 584-08-7

44 Versuchsaufbauten, Materialien und Methoden
4.2.3 Ionische Flüssigkeiten
Die SILP-Systeme für die Hydroformylierung enthielten die in Tabelle 8 aufgeführten
ionischen Flüssigkeiten. Die ionischen Flüssigkeiten [EMIM][NTf2] und
[BMIM][NTf2] wurden von Merck KGaA bezogen. Die mit Benzylgruppen
substituierten ionischen Flüssigkeiten sowie [OMIM][NTf2] wurden am Lehrstuhl für
Chemische Reaktionstechnik von Dipl.-Chem. Valentin Wagner synthetisiert.
Tabelle 8: Stoffdaten der eingesetzten ionischen Flüssigkeiten.
Ionische Flüssigkeit Abkürzung Molare
Masse /
Dichte1
/
Viskosität1
/
Viskosität2
/
g mol-1 g cm-3 mPa s mPa s
1-Ethyl-3-methylimidazolium
bis(trifluoromethylsulfonyl)imid
[EMIM]
[NTf2] 391,31 1,530 30,63 6,96
1-Butyl-3-methylimidazolium
bis(trifluoromethylsulfonyl)imid
[BMIM]
[NTf2] 419,36 1,40 32,46 7,15
1-Methyl-3-octylimidazolium
bis(trifluoromethylsulfonyl)imid
[OMIM]
[NTf2] 475,47 1,37 38,5 7,34
1-Benzyl-3-methylimidazolium
bis(trifluoromethylsulfonyl)imid
[BzMIM]
[NTf2] 453,38 1,493 124,76 7,16
1-Benzyl-3-ethylimidazolium
bis(trifluoromethylsulfonyl)imid
[BzEIM]
[NTf2] 467,41 1,453 91,64 6,65
1-Benzyl-3-butylimidazolium
bis(trifluoromethylsulfonyl)imid
[BzBIM]
[NTf2] 495,46 1,396 139,63 7,44
1,3-Dibenzylimidazolium
bis(trifluoromethylsulfonyl)imid
[BzBzIM]
[NTf2] 529,48 fest 8,43
1 bei 25°C 2 bei 100°C

Versuchsaufbauten, Materialien und Methoden 45
4.2.4 Diphosphit-Liganden
In dieser Arbeit wurde der Diphosphit-Ligand 2,2´-(3,3´-Di-tert-butyl-5,5´-
dimethoxybiphenyl-2,2´-diyl)bis(oxy)bis/4,4,5,5-tetraphenyl-1,3,2-dioxaphospholan)
verwendet.
Abbildung 23: Diphosphit-Ligand 2,2´-(3,3´-Di-tert-butyl-5,5´-dimethoxybiphenyl-2,2´-
diyl)bis(oxy)bis/4,4,5,5-tetraphenyl-1,3,2-dioxaphospholan), (BzP).
Der Ligand wurde von Evonik Industries AG nach Literaturvorschriften synthetisiert
und bereitgestellt.[222] [51] Im Folgenden wird der Ligand aufgrund seiner Substruktur als
Benzpinakol (BzP) bezeichnet.
Der Ligand (6,6´-[(3,3´-Di-tert-butyl-5,5´-dimethoxy-1,1´-biphenyl-2,2´-
diyl)bis(oxy)]bis(dibenzo[d,f][1,3,2]-dioxaphosphepin)) wurde von Sigma Aldrich
bezogen. CAS-Nummer: 121627-17-6.
Abbildung 24: BIPHEPHOS (6,6´-[(3,3´-Di-tert-butyl-5,5´-dimethoxy-1,1´-biphenyl-2,2´-
diyl)bis(oxy)]bis(dibenzo[d,f][1,3,2]-dioxaphosphepin)).

46 Versuchsaufbauten, Materialien und Methoden
4.2.5 Träger
Das Trägermaterial für die SILP-Katalysatoren war standardmäßig Silica Gel 100 mit
einer Partikelgröße von 0,063 – 0,2 mm von Merck KGaA. Zwei technische SiO2-
basierte Extrudate wurden von Evonik Industries AG zur Verfügung gestellt: Ein
granulierter Träger mit der Bezeichnung „Siliperl“, der eine Partikelgröße von 1,0 mm
bis 2,0 mm aufweist und ein stäbchenförmiger Träger mit einem Durchmesser von 1,6
mm und variabler Länge. Die SiO2-Träger werden vor der Verwendung unter Stickstoff
(Linde AG, 5.0) mit dem folgenden Temperaturprogramm kalziniert: Der Träger wird
von Raumtemperatur auf 150 °C mit einer Heizrampe von 2 °C min-1 aufgeheizt und
anschließend zwei Stunden konstant bei 150 °C gehalten. In einer zweiten Heizphase
wird der Träger mit einer Heizrampe von 2,5 °C min-1 auf 600 °C erhitzt. Für weitere
12 Stunden wird die Temperatur konstant bei 600 °C gehalten, um eine fast vollständige
Decarboxylierung der Oberfläche zu gewährleisten. Die aktive Abkühlphase auf 50 °C
unter Stickstoff wird mit einer Rampe von 5 °C min-1 durchgeführt, um eine
Recarboxylierung des hygroskopischen Materials zu verhindern. Anschließend wird der
Träger für 24 Stunden evakuiert und in der Glove-Box bis zur Verwendung gelagert.
Tabelle 9: Morphologische Eigenschaften der Silica-Träger
Träger-
bezeichnung
Träger-
material
Behandlung Partikelgröße Ober-
flächea
nach
BET
Poren-
volumenb
Mittlere
Poren-
weite
mm m2 g-1 cm3 g-1 nm
Silica 100 SiO2 Kalzinierung 0,063 – 0,2 361 1,02 10,5
Silica 100 SiO2 Kalzinierung
Ultraschall 0,063 – 0,2 356 1,00 10,4
SiO2 - Siliperl SiO2 — 1,0 – 2,0 305 0,78 10,5
SiO2 - Siliperl SiO2 Kalzinierung 1,0 – 2,0 340 0,85 9,0
SiO2 - Siliperl SiO2 Kalzinierung
Ultraschall 1,0 – 2,0 333 0,84 8,9
SiO2 - Aerolyst SiO2 — d = 1,6
(Stäbchen) 169 0,96 22,1
SiO2 – Aerolyst SiO2 Kalzinierung d = 1,6
(Stäbchen) 178 0,99 22,5
SiO2 - Aerolyst SiO2 Kalzinierung
Ultraschall
d = 1,6
(Stäbchen) 134 0,78 22,5
abestimmt durch BET Adsorptionsisotherme, bBJH kumulatives Porenvolumen

Versuchsaufbauten, Materialien und Methoden 47
Die morphologischen Eigenschaften der Träger wurden mittels Stickstoff-
Gasadsorption gemessen. Die Daten in Tabelle 9 wurden mit dem Gerät „Quantachrome
Quadrasorb SI“ bestimmt. Die Silica-Träger wurden vor und nach der thermischen
Behandlung vermessen. Zusätzlich wurde der Einfluss von Ultraschall auf das Gefüge
der Poren untersucht.
4.2.6 Additive
SILP-Katalysatoren mit dem Benzpinakol-Ligand wurden gemäß der Literatur mit
einem Stabilisator präpariert.[198] Bei dem Stabilisator handelt es sich um das sterisch
gehinderte Diamin Bis(2,2,6,6-tetramethyl-4-piperidyl)sebacat (CAS-Nummer: 52829-
07-9).
Abbildung 25: Struktur des Stabilisators Bis(2,2,6,6-tetramethyl-4-piperidyl)sebacat.
4.2.7 Präparation der SILP-Katalysatoren
Die Präparation der SILP-Materialien erfolgte durch Versetzen der porösen
Trägermaterialien mit einer Lösung aus Katalysatorkomplex, ionischer Flüssigkeit und
Stabilisator. Zur Lösung der Komponenten hatte sich Dichlormethan (Merck KGaA,
getrocknet, max. 0,004 % H2O) als geeignetes Lösungsmittel herausgestellt. Durch
Einengen der Lösung am Rotationsverdampfer und die wirkenden Kapillar-, Adhäsions-
und Kohäsionskräfte kommt es zum Abscheiden der Komponenten in dem
Porennetzwerk des Trägers.[223] Nachdem das Lösungsmittel entfernt ist, liegt der SILP-
Katalysator als rieselfähiges Pulver vor. Um eine Zersetzung des Katalysators zu
vermeiden, werden die Einwaagen der einzelnen Komponenten ausschließlich in der
Glove-Box durchgeführt.

48 Versuchsaufbauten, Materialien und Methoden
4.3 Konzeption und Auslegung der Versuchsanlage
Zur Durchführung einer kontinuierlichen Kaskadenreaktion wurde eine Versuchsanlage
konzeptioniert und aufgebaut. Die Gesamtanlage setzt sich aus dem Reaktionsteil, der
Steuerung und der online Analytik zusammen. Der Reaktionsteil gliedert sich in drei
Sektionen. Einen Teil für die katalytische Alkandehydrierung, einen Teil für die
Kondensation und Sammlung eines Alkan/Alken-Gemisches und einen Teil für die
SILP-katalysierte Hydroformylierung. Ein Fließbild der Anlage ist in Abbildung 26
dargestellt. Beide Reaktorstränge können sowohl in Reihe geschaltet als auch
unabhängig voneinander betrieben werden.
Die Dosierung der gasförmigen Komponenten für die Alkandehydrierung erfolgt über
vier Massendurchflussregler (Mass Flow Controller – MFC) der Firma Bronkhorst
High-Tech B.V. Neben dem Reaktionsgas n-Butan kann Helium zum Spülen des
Reaktors und zur Partialdruckvariation eingesetzt werden. Synthetische Luft und
Wasserstoff werden zur in-situ Regenerierung des heterogenen Katalysators verwendet.
Um eine gleichzeitige Förderung von Wasserstoff und synthetischer Luft in den Reaktor
zu vermeiden, ist ein Dreiwegehahn installiert, der nur für eines der beiden Gase offen
steht. Zusätzlich werden zwei pneumatische Ventile über ein elektropneumatisches
Wegeventil manuell angesteuert, das ebenfalls ein gleichzeitiges Ausströmen beider
Gase unterbindet.
Der Dehydrierungsreaktor besteht aus einer hochwarmfesten Nickel-Chrom-Eisen-
Legierung (2.4816, Alloy 600). Der Festbettreaktor hat eine Länge von 650 mm, einen
Innendurchmesser von 10 mm und eine Wandstärke von 7,5 mm. Der Reaktor ist bis zu
einer Temperatur von 850 °C bei Atmosphärendruck vom TÜV-Süd zugelassen. Die
Katalysatorschüttung liegt auf einem Bett aus Glaswolle. Die Glaswolle liegt wiederum
auf einer gesinterten Metallfritte aus dem Werkstoff 1.4571 auf, die passgenau 50 mm
vor dem Reaktorausgang eingesetzt ist. Die Fritte besitzt eine mittlere Porenweite von
6 µm. Zusätzlich ist in der Schüttung ein Thermoelement Pt-100 eingebracht. 2/3 der
Länge des Reaktors sind als Vorheizstrecke ausgelegt, um das Reaktionsgas auf
Temperaturen bis zu 850 °C vor der Katalysatorschüttung aufzuheizen. Der Rohrreaktor
verfügt über einen Heizmantel mit drei Heizzonen, die unabhängig voneinander geregelt
werden können. Die Anschlüsse für den Reaktor bestehen aus dem Werkstoff 1.4571.
Aufgrund der Elastizitätsgrenze Rp0,2 der Anschlüsse und der Temperaturstabilität von
1.4571 werden die unteren 50 mm der Rohrreaktors nicht aktiv beheizt.

Versuchsaufbauten, Materialien und Methoden 49
Die kohlenwasserstoffhaltigen Substrate werden dem Hydroformylierungsteil flüssig
über eine HPLC-Pumpe (Knauer Smartline 100) zudosiert. Die High-Performance-
Liquid-Chromatography (HPLC) - Pumpe ist mit federgestützten Kugelventilen
ausgerüstet, um eine bessere Förderkonstanz zu gewährleisten. Synthesegas wird über
einen MFC für Kohlenstoffmonoxid und Wasserstoff bereitgestellt. Helium kann über
einen MFC oder über ein Nadelventil in die Anlage gegeben werden. Helium dient zum
Spülen, zum Prüfen auf Leckagen oder zum Verdünnen der Reaktionsmischung. Der
Vorheizer erhitzt das flüssige Olefingemisch knapp unterhalb der Siedetemperatur bei
Betriebsdruck. Im Mischer werden die Kohlenwasserstoffe durch Reduzierung des
Partialdruckes mit Synthesegas in die Gasphase überführt.
Der Hydroformylierungsreaktor ist aus dem Werkstoff 1.4571 gefertigt. Der Reaktor ist
bei 50 bar Druck bis zu einer Temperatur von 450 °C zugelassen. Die Länge des
Reaktors beträgt 500 mm, der Innendurchmesser 10 mm und die Wandstärke 5 mm. Die
SILP-Katalysatorschüttung liegt auf einer Fritte mit 6 µm mittlere Porenweite auf. Ein
Thermoelement ist in die Schüttung eingebracht. Ein zweites Thermoelement (TI I-2.10)
ist 50 mm über der Fritte in die Wandung des Reaktors eingefasst. Die Regelung der
Einzonenheizung erfolgt über das Thermoelement in der Wandung.
Die Kondensationsbehälter haben jeweils ein Volumen von 0,6 Litern. Die Steuerung
der pneumatischen Ventile ist darauf ausgelegt, dass die Behälter im Wechsel befüllt
und entleert werden können. Schwinggabelsonden am Kopf und am Boden der Behälter
stellen sicher, dass Kondensat vorliegt und verhindern ein Volllaufen bzw. ein
vollständiges Entleeren der Behälter. Digitale Drucksensoren sind in die Notabschaltung
integriert. Die pneumatischen Ventile, die digitalen Druckaufnehmer und die
Füllstandsensoren werden über eine Steuerung des Typs „LOGO!“ der Siemens AG
gesteuert. Die Kühlung der Behälter erfolgt mit einem luftgekühlten Kryostat „MPC-
K6s“ der Firma Peter Huber Kältemaschinebau GmbH, der bis -25 °C mit einer
Glysantin/Wasser-Mischung betrieben werden kann. Der Kryostat hat eine
Kälteleistung von 0,05 kW bei -20 °C. Für eine Verbesserung des Wärmeübergangs und
eine Vergrößerung der Austauschfläche sind Hohlzylinder aus Edelstahl als regellose
Schüttung in die Behälter eingebracht. Die Hohlzylinder haben eine Länge von 15 mm
und einen Durchmesser von 10 mm. Um ein Fehlsignal der Schwinggabelsonden durch
die Füllkörper zu vermeiden, sind diese mit einem stabilen Drahtgitter umgeben.

50 Versuchsaufbauten, Materialien und Methoden
Abbildung 26: Fließbild der Kaskadenversuchsanlage nach DIN 19227.

Versuchsaufbauten, Materialien und Methoden 51
Rohrleitungen und Behälter sind aus Edelstahl 1.4571 und die Ventilkörper aus
Edelstahl 1.4401 gefertigt. Die Ventile enthalten Packungen entweder aus dem
Werkstoff Polytetrafluorethylen (PTFE, Tmax = 232 °C) oder aus dem thermoplastischen
Kunststoff Polyetherketon (PEEK, Tmax = 315 °C). Die Rohrleitungen werden über
anliegende Heizbänder der Firma Horst GmbH temperiert. Die Isolation der Leitungen
wird mit einem Band aus Glaswolle bewerkstelligt.
Die Analyse der Gasströme beider Reaktorstränge erfolgt alternierend oder seriell.
Hierzu wurde ein 4-Port SD (Selector, Dead-End) Ventil von Valco Instruments Co. Inc.
über eine Relaissteuerung an die Schnittstelle des Gaschromatographen angeschlossen.
Somit ist die Ansteuerung des Ventils in die Software der Gaschromatographen
implementiert. Die Gaszusammensetzung wird mit einem Gaschromatographen „GC
450“ von Bruker Corporation bestimmt (siehe 4.4).
Die gesamte Anlage ist mit Sicherheitseinrichtungen ausgestattet, die einen sicheren und
kontinuierlichen Betrieb über mehrere Tage ohne Anwesenheit eines Betreibers
gewährleisten. Die Regler überwachen Druck und Temperatur und versetzen die Anlage
im Fall von Überdruck, Übertemperatur oder Ausfall einer Heizschnur in einen sicheren
Zustand.
Für die kinetischen Messungen der SILP-katalysierten Hydroformylierung wird der
Rohrreaktor durch einen Mikroreaktor ersetzt. Der Mikroreaktor hat eine Länge von 80
mm und einen Innendurchmesser von 4,6 mm. Die Katalysatorschüttung wird auf einer
integrierten Fritte mit 10 μm durchschnittlicher Porenweite fixiert. Um isotherme
Bedingungen zu gewährleisten wurden Aluminiumblöcke passgenau zwischen Reaktor
und Heizmantel angefertigt. Die Regelung des Heizmantels erfolgte über ein
Thermoelement, das direkt über der Katalysatorschüttung angebracht war. Loekman
konnte mit pulverförmigen Partikeln keinen messbaren Druckverlust bei kompletter
Füllung des Reaktors feststellen.[224] Temperatur- und Druckgradienten, die nicht auf die
Reaktion zurückzuführen sind, werden somit minimiert.
Axiale Dispersionseinflüsse können in Rohrreaktoren vernachlässigt werden, wenn die
Bodensteinzahl größer als 100 ist.[225] Die Bodensteinzahl für ein gasdurchströmtes
Festbett kann unter Verwendung der Peclet-Zahl anhand folgender Gleichungen
abgeschätzt werden.[226]

52 Versuchsaufbauten, Materialien und Methoden
𝐵𝑜 = 𝑢0 𝐿
𝐷𝑎𝑥> 100 (4-1)
𝐷𝑎𝑥 = 𝑢0 𝑑𝑃𝑃𝑒𝑎𝑥
(4-2)
1
𝑃𝑒𝑎𝑥= (
0,73 𝜀
𝑅𝑒 𝑆𝑐+
0,45
1 +7,3 𝜀𝑅𝑒 𝑆𝑐
) (4-3)
𝑅𝑒 = 𝑢0 𝑑𝑃 𝜌
𝜇 (4-4)
𝑆𝑐 = 𝜇
𝜌 𝐷12 (4-5)
Diffusionskoeffizienten von Fluiden in Gasen besitzen Werte zwischen 10-6 < D12 < 10-
4 m2 s-1. Für das Dreistoffsystem aus 1-Buten, Kohlenstoffmonoxid und Wasserstoff
werden nach der Methode von Fuller binäre Diffusionskoeffizienten (D12, D13, D23) aus
Kombinationen der jeweiligen Stoffe abgeschätzt:[227]
𝐷12 = 0,00143 (
𝑇𝐾)1,75
[(𝑀1
𝑔 𝑚𝑜𝑙−1)−1
+ (𝑀2
𝑔 𝑚𝑜𝑙−1)−1
]
0,5
𝑝𝑏𝑎𝑟
√2 [(∑Δ𝑉1)13⁄ + (∑Δ𝑉2)
13⁄ ]2 𝑖𝑛 𝑐𝑚2 𝑠−1
(4-6)
Dabei ist ΔV das sogenannte Diffusionsvolumen, das mit tabellierten Gruppenbeiträgen
ermittelt werden kann. Für 1-Buten ist der Wert ΔV,1-Buten =82,08, für CO ΔV,CO = 18 und
für Wasserstoff ΔV,H2 = 6,12.
Mit folgenden Randbedingungen und den gegebenen Dimensionen des Reaktors
DH2/CO in m2 s-1 1,18 · 10-5 ρ in kg m-3 2,81
DH2/1-Buten in m2 s-1 6,05 · 10-6 μ in Pa s 1,24 · 10-5
DCO/1-Buten in m2 s-1 1,52 · 10-6 V𝑔𝑒𝑠 in ml min-1 25
dP in mm 0,2 – 0,063 ε* 0,32
*siehe Kapitel 7.4.
folgt aus einer Worst-Case-Abschätzung eine Bodensteinzahl von mindestens 690.

Versuchsaufbauten, Materialien und Methoden 53
4.4 Analytische Verfahren: Gaschromatographie
Die Analyse der Reaktionsgase erfolgte mit einem Gaschromatographen“ GC450“ der
Firma Bruker Corporation. Der Gaschromatograph (GC) war mit einem
Wärmeleitfähigkeitsdetektor (WLD) und zwei Flammenionisationsdetektoren (FID)
ausgestattet (s. Abbildung 27)
Abbildung 27: Ausstattung des verwendeten Gaschromatographen
Die Aufgabe der Proben auf die Trennsäulen geschieht gleichzeitig über zwei
pneumatische Einspritzventile mit 250 µl Probenschleifen. Argon wird als Trägergas
Sample Loop 250 μL
V-1
1
2
3
4
5
6
Sample Loop 250 μL
V-2
1
2
3
4
5
6
V-3
1
2
3
F
4
FIDMan FC
middle
FIDMan FC
rear
TCDMan FC
front
Sample IN Sample OUT
EFC-24frontArgon 1041
front
EFC-21middleArgon
1177 /Ultimetalmiddle
Split vent
PR-10-100 PSIArgon
C1 – C4 channel Pentanal, Pentanolchannel
H2, CO, C1 channelTCD Make-up
TCD Reference
EFC-24 RearArgon
Hayesep Q 80/100 Mesh0.5m x 1/16´´ x 1.0MM Ultimetal
B10098
CP-Wax 52 CB25m x 0.53mm, df = 2μm
CP7658
Restek MicropackedShincarbon column
CP913624
Deactivated Fused silica10m x 0.32mm
CP735732
HP-AL/S50m x 0.535mm x 15.00 μm
Backflush vent
NV-1 V-4

54 Versuchsaufbauten, Materialien und Methoden
verwendet. Wasserstoff, Kohlenstoffmonoxid und Helium werden durch eine WLD-
Analyse quantifiziert. Über den EFC-24-Front (Electronic Flow Control) und PR-1
(Pressure Regulator) wird der Säulendruck und die Trägergasgeschwindigkeit auf den
Säulen geregelt. Der eingestellte Säulendruck beträgt für den EFC-24 3,45 bar für eine
Minute und 2,41 bar für die restliche Dauer der Messung. Der PR-1 ist konstant auf 3,17
bar eingestellt. Eine Hayesep Q80/100 (0,5 m x 1/16´´ x 1,0 mm) Säule trennt die
Permanentgase von den kohlenwasserstoffhaltigen Stoffen. Eine Trennsäule von dem
Typ Shincarbon Micropacked trennt letztlich Wasserstoff, Kohlenmonoxid und Helium
auf. Nachdem die Permanentgase die Hayesep-Säule passiert haben, regelt der Druck
des ECF-24-Front auf 2,41 bar herunter und Ventil V-4 öffnet elektronisch. Das
Rückspülen der Kohlenwasserstoffe ist nötig, um eine Deaktivierung der Shincarbon-
Trennsäule zu verhindern. Mit dem Nadelventil NV-1 kann der Fluss ins Abgas geregelt
und gleichzeitig der Druck auf den Säulen gewährleistet werden.
Die kohlenwasserstoffhaltigen Stoffe werden mit zwei Flammenionisationsdetektoren
analysiert. Das Splitverhältnis von Trägergas zu Probenvolumen liegt konstant bei 20 :
1. Ein kleineres Splitverhältnis würde ein Tailing und ineinander überlaufende Peaks
mit sich führen. Für EFC-21 wird ein konstanter Fluss von 2,5 ml min-1 und für EFC-
24-Rear ein konstanter Überdruck von 0,31 bar eingestellt. Mit einer CP-Wax (25 m x
0,53 mm x 2 µm) Trennsäule werden zuerst Alkane und Alkene von Aldehyden,
Alkoholen und Aldolprodukten getrennt. Alkane und Alkene werden auf die HP-Plot-S
(50 m x 0,53 mm x 15 µm) Trennsäule geleitet und Aldehyde, Alkohole und
Aldolprodukte werden auf der Deactivated Fused Silica (10 m x 0,32 mm) weiter
aufgetrennt. Plot-Aluminiumoxid-Säulen besitzen eine hohe Auflösung für
Kohlenwasserstoffisomere, können aber durch Moleküle mit funktionellen Gruppe
deaktiviert werden.
Mit der folgenden GC-Methode kann eine vollständige Trennung der Komponenten
erreicht werden. Die Anfangstemperatur von 55 °C wird für 4 Minuten gehalten.
Anschließend folgt eine lineare Aufheizphase mit 4,5 °C min-1 auf 100 °C. 100 °C wird
für 12 Minuten konstant gehalten. Die letzte Aufheizphase mit 10 °C min-1 auf 130 °C
dient zur Entfernung hochsiedender Verbindungen bzw. zur Verkürzung derer
Retentionszeit. Die Säulen werden für 6 Minuten konstant bei 130 °C belassen. Die
Gesamtdauer der Methode beträgt 35 Minuten. Die Temperatur der Einhausung des
Wärmeleitfähigkeitsdetektors beträgt 220 °C und die des Filamentes 350 °C. Die zwei
Flammenionisationsdetektoren sind auf 250°C beheizt.

Versuchsaufbauten, Materialien und Methoden 55
Ein Beispielchromatogramm aus einem Versuch zur Hydroformylierung von Raffinat
III ist in Abbildung 28 dargestellt:
Abbildung 28: Chromatogramme einer Messung zur Hydroformylierung von Raffinat III.
Iso
bu
tan
Bu
tan
t-2
-Bu
ten
1-B
ute
n
c-2
-Bu
ten
Iso
bu
ten
Iso
pe
nta
n
2-M
eth
ybu
tan
al
n-P
en
tan
al
2-P
rop
yl-2
-he
pte
nal

56 Versuchsaufbauten, Materialien und Methoden
Weitere Analytische Verfahren, die im Rahmen dieser Arbeit verwendet wurden, sind
im Anhang in Kapitel V gegeben.

Vorgehensweise und Überblick über den Ergebnisteil 57
5 Vorgehensweise und Überblick über den Ergebnisteil
Die Resultate in dieser Arbeit wurden in enger Zusammenarbeit mit dem
Industriepartner Evonik Industries AG und den Projektpartner des BMBF Projektes
„HY-SILP“ (Entwicklung von neuartigen, ressourcenschonenden Technologien unter
Einsatz von Supported Ionic Liquid Phase (SILP) Katalysatoren) erzielt. Die gewonnen
Erkenntnisse aus den kontinuierlichen Anlagenversuchen werden zeigen, dass das
Konzept der SILP-Katalyse für die Hydroformylierungsreaktion von der bisherigen
Modellvorstellung abweicht.[196] Um die Interpretation der Ergebnisse verständlicher zu
gestalten, befasst sich der erste Themenkomplex mit einer reaktionstechnischen
Beschreibung der SILP-Katalyse und einer Weiterentwicklung des SILP-Modells.
Der zweite Abschnitt des Ergebnisteils dieser Arbeit behandelt die materialtechnische
Optimierung des SILP-Katalysators und dessen Einsatz unter Prozessbedingungen. Die
Entwicklung des Katalysators ist ein evolutionärer Prozess. Das soll bedeuten, dass bei
der Planung einer Versuchsreihe immer die Erkenntnisse der vorangegangen
Experimente in den nachfolgenden Versuch eingeflossen sind. Diese dynamische
Methode der Katalysatorentwicklung und Optimierung wird durch die Reviews von
Dautzenberg[228], Buzzi-Ferraris[229] und Moulijn[230] beschrieben.
Im dritten Abschnitt wird ein kinetisches Modell abgeleitet, um das Reaktionsnetzwerk
mathematisch beschreiben zu können. Die kinetischen Modelle sollen zum einen zur
Entwicklung eines grundlegenden Verständnisses der katalytischen Vorgänge des
Reaktionsnetzwerkes beitragen und zum anderen zur Optimierung der
Prozessbedingungen.
Das letzte Abschnitt zeigt das Potential der SILP-Katalyse in der Hydroformylierung
mit komplexen technisch und wirtschaftlich relevanten Gemischen. Neben dem Einsatz
eines technisch etablierten Gemisches steht die Entwicklung eines Verfahrens im
Vordergrund, das n-Butan als Rohstoff für die Aldehydsynthese verwerten soll.

58 Theoretische Überlegungen zur SILP-Katalyse
6 Theoretische Überlegungen zur SILP-Katalyse
6.1 Theoretisches Modell zur Beschreibung von Transport und Reaktion in
SILP-Katalysatoren
In Kapitel 3.3 wurden bereits einige reaktionstechnische Ansätze zur Beschreibung von
Supported Liquid Phase (SLP) - Katalysatoren beschrieben. Ein SILP-Katalysator stellt
wie ein SLP-Katalysator makroskopisch einen heterogenen Katalysator und
mikroskopisch einen homogenen Katalysator dar. Die gasförmigen Komponenten
müssen durch eine mit ionischer Flüssigkeit verengte Pore diffundieren, sich in die
Flüssigkeit einlösen und letztlich an einem homogenen Katalysator reagieren. In diesem
Kapitel wird ein Model vorgestellt, das den Stofftransport einer gasförmigen
Komponente und die Reaktion in einem SILP-Katalysator beschreibt. Das Model ist an
das Modul von Thiele und das Zweifilmmodel nach Lewis und Whitman angelehnt.[187,
174]
Die Aktivität eines SILP-Katalysators wird nicht nur durch die Art des homogenen
Edelmetallkomplexen beeinflusst; die Verteilung der Komplexe und der ionischen
Flüssigkeit spielt ebenfalls eine Rolle. Des Weiteren haben die Porenradienverteilung,
das Benetzungsverhalten der ionischen Flüssigkeit, der Anteil der IL im Porennetzwerk,
die Löslichkeit der Substrate und Produkte in der IL, die Wechselwirkungen von
Edelmetallkomplex und Träger bzw. Komplex und IL und im weitesten Sinne
wahrscheinlich auch die Präparation des SILP-Katalysators einen Einfluss auf die
Aktivität. Untersuchungen zu den Wechselwirkungen der ionischen Flüssigkeit
[BMIM][NTf2] mit einer idealen planaren Oberfläche eines Alumina-Trägers zeigten
eine kontinuierliche Filmbildung im Nanometerbereich.[231-232] Haumann et al. konnten
mittels Festkörper-NMR-Messungen zeigen, dass sich für Beladungen unter 10 Vol.-%
Inseln an ionischer Flüssigkeit auf realen Porenwänden ausbilden.[215] Mit höherer
Beladung wurde kein Signal für freie Silanolgruppen an der Oberfläche des Trägers
detektiert. Daraus lässt sich schließen, dass sich ein monomolekularer Film auf der
Oberfläche des Trägers bildet, aber nicht, ob ein kontinuierliches homogenes
Anwachsen des Films stattfindet. An der Phasengrenzfläche Gas/IL konnte
nachgewiesen werden, dass die Ausrichtung der Alkylkette am Kation der IL die
Struktur der Phasengrenzfläche und somit die Löslichkeit und den Phasenübergang
beeinflussen.[233] Das Zusammenspiel all dieser Effekte ist jedoch sehr kompliziert und

Theoretische Überlegungen zur SILP-Katalyse 59
bis heute nicht im Detail geklärt. Daher werden folgende Annahmen für das Modell
getroffen:
- Das Fluid ist gasförmig oder flüssig, keine Mischung aus zwei Phasen.
- Das Katalysatorpellet ist isotherm, Temperatureffekte werden nicht
berücksichtigt.
- Der Träger wird als inert betrachtet und Diffusion der reagierenden Gase und
Produkte findet nur in der Pore statt.
- Die Poren sind untereinander verbunden.
- Filmdiffusion durch die äußere Grenzschicht des Pellets ist im Vergleich zur
Diffusion in der Pore sehr schnell.
- Stofftransport findet ausschließlich aufgrund von Diffusion statt.
- Die Reaktion ist erster Ordnung und die Rückreaktion wird nicht berücksichtigt.
In Abbildung 29 ist eine Veranschaulichung des Models geben. Den Bilanzraum bildet
ein poröses, kugelförmiges SILP-Katalysatorpellet. Es werden der Stofftransport in
einer mit ionischer Flüssigkeit gefüllten Pore und der Stofftransport über die Gas/IL
Phasengrenzfläche mit anschließender Reaktion beschrieben.
Abbildung 29: Veranschaulichung des Bilanzraumes und der Stofftransportvorgänge in einem SILP-
Katalysator
R
x + dx
x dx
ci(x)
Pore
IL-Film
SILP-Pellet
TrägerILGas
ci(x)
ci,gl ci,IL

60 Theoretische Überlegungen zur SILP-Katalyse
In einer ersten Näherung kann angenommen werden, dass kein Konzentrationsgradient
im IL-Film vorliegt. Diese Annahme ist für kleine Beladungen, bei denen die Filmdicke
im Nanometerbereich liegt, sicherlich zutreffend. Ionische Flüssigkeiten besitzen im
Vergleich zu organischen Lösungsmitteln eine zwei- bis dreimal höhere Viskosität.[234-
235] Eine höhere Viskosität resultiert in einem kleineren Diffusionskoeffizienten in der
flüssigen Phase. Für Kohlenstoffdioxid, das eine mit organischen Lösungsmitteln
vergleichbar hohe Löslichkeit in ILs besitzt, ist der Diffusionskoeffizient in
[EMIM][NTf2] im Vergleich zu Toluol um das zehnfache reduziert.[236-237] In dem
Model werden daher drei Fälle unterschieden (siehe Tabelle 10):
Fall I: Reaktion und Stofftransport laufen simultan im IL-Film ab.
Fall II: Die Reaktion ist im Vergleich zum Stofftransport langsam
Fall III: Stofftransport ist wesentlich schneller als die Reaktion aufgrund des
dünnen IL-Films.
Tabelle 10: Konzentrationsverlauf im IL-Film in Abhängigkeit von Stofftransport und Reaktion nach
Lewis und Whitman[187]
Fall I Fall II Fall III
Stofftransport und
Reaktion laufen simultan
im IL-Film ab
Stofftransport und
Reaktion sind getrennt
voneinander
Stofftransport und
Reaktion sind komplett
unabhängig, IL-Film ist
immer gesättigt
Ausgangsformel bildet die allgemeine Stoffbilanz eines Stoffes i, die um einen Term
zur Beschreibung des Phasenübergangs Gas/IL erweitert wurde:
TrägerILGasCi
ci(x)
ci,gl
ci,IL
TrägerILGasCi
ci(x)
ci,gl ci,IL
TrägerILGasCi
ci(x)
ci,gl
ci,IL

Theoretische Überlegungen zur SILP-Katalyse 61
𝜕𝑐𝑖𝜕𝑡= −𝑑𝑖𝑣 (𝑐𝑖 �� ) + 𝑑𝑖𝑣 (𝐷𝑖 𝑔𝑟𝑎𝑑 𝑐𝑖) + 𝑅𝑖 ± 𝑎 𝛽𝑖 (𝑐𝑖 − 𝑐𝑖,𝑔𝑙) (6-1)
In den Annahmen wird Strömung aufgrund von Konvektion bereits ausgeschlossen.
Daraus resultiert, dass die Geschwindigkeit (u = 0) ist. Der Dispersionskoeffizient Di in
der Gasphase ist ortsunabhängig und wird im Folgenden als effektiver
Diffusionskoeffizient Deff bezeichnet. Unter Berücksichtigung nur einer Raumrichtung
resultiert:
𝜕𝑐𝑖𝜕𝑡= 𝐷𝑒𝑓𝑓 𝑑
𝑑𝑐
𝑑𝑥+ 𝑅𝑖 + 𝑎𝛽𝑖(𝑐𝑖, − 𝑐𝑖,𝑔𝑙) (6-2)
Für ein kugelförmiges Pellet vom Radius R ergibt sich die Stoffbilanz für eine
volumenbeständige und irreversible Reaktion unter den eingangs formulierten
Annahmen aus der allgemeinen Stoffbilanz für einphasige Reaktionssysteme. Mit
𝜕𝑐𝑖 𝜕𝑡⁄ = 0 (stationäre Verhältnisse) und 𝑅𝑖 = 𝜈𝑖𝑗𝑟𝑗 = −1𝑘𝑐𝑖,𝐼𝐿 lautet die Stoffbilanz:
𝐷𝑒𝑓𝑓 (𝑑2𝑐𝑖𝑑𝑥2
+2
𝑥
𝑑𝑐𝑖𝑑𝑥) − (−𝑘𝑐𝑖,𝐼𝐿 ± 𝑎 𝛽𝑖(𝑐𝑖,𝐼𝐿 − 𝑐𝑖,𝑔𝑙)) = 0 (6-3)
Der effektive Diffusionskoeffizient der gasförmigen Komponente in der leeren Pore
wird über folgende Beziehung beschrieben.
𝐷𝑒𝑓𝑓0 =
𝐷𝑖,𝑔 𝜖0
𝜏0 / m2 s-1 (6-4)
Aus Gl. (6-4) ist ersichtlich, dass der effektive Diffusionskoeffizient von der Porosität
und Tortuosität des Trägers abhängt. Beide Faktoren werden in einem SILP-Katalysator
zusätzlich durch die Beladung α an ionischer Flüssigkeit beeinflusst. Bei der Beladung
α handelt es sich um eine volumenbezogene Größe. Daher kann folgende Beziehung für
die Porosität angegeben werden:
𝜀 = 𝜀𝑃 (1 − 𝛼) (6-5)
Die Tortuosität ist ein Konzept, dass das Verhältnis von mittlerer Porenlänge (Le) zu der
Länge (L) beschreibt, entlang derer der Diffusionstrom definiert ist.[238]
𝜏 = 𝐿𝑒 𝐿⁄ (6-6)

62 Theoretische Überlegungen zur SILP-Katalyse
In der Literatur existieren zahlreiche Korrelationen, die einen Zusammenhang zwischen
der Porosität und der Tortuosität herstellen.[239-241] Folgender Zusammenhang erweist
sich als besonders zutreffend.
𝜏 = 1 − 𝑝 ln 𝜀 (6-7)
Der Parameter p stellt hier einen Anpassungsparameter dar, der durch physikalische
Effekte, wie beispielsweise die Hygroskopizität des Trägers, modifiziert wird.[242] In
diesem Modell soll ebenfalls diese Beziehung zur Beschreibung des effektiven
Diffusionskoeffizienten einfließen. Der Parameter p beschreibt in diesem Modell die
Homogenität der IL-Filmbildung:
𝜏 = 1 − 𝑝 ln 𝜀0(1 − 𝛼),
mit p =1 (ideale Filmbildung), p → 0 (Inselbildung bzw. Fluten der Poren
und Filmbildung)
(6-8)
Unter Berücksichtigung von Gl.(6-5) und Gl.(6-8) hängt der effektive
Diffusionskoeffizient von der Beladung α wie folgt ab:
𝐷𝑒𝑓𝑓 = 𝐷𝑖,𝑔 𝜀
0 (1−𝛼)
1−𝑝 ln 𝜖𝑃 (1−𝛼) / m2 s-1 (6-9)
Durch Einführen der Beziehungen:
𝐻12 = 𝑐𝑖 𝑐𝑖,𝑔𝑙 > 1⁄ , mit 𝐻12 = Henry-Koeffizient / , (6-10)
Einführen dimensionsloser Größen:
𝑦 = 𝑥 𝑅⁄ , (6-11)
𝑓 = 𝑐𝑖 𝑐𝑖,𝑆⁄ (6-12)
erhält man aus Gl. (6-3)
2
𝑦
𝑑𝑓
𝑑𝑦+𝑑2𝑓
𝑑𝑦2− 𝜙𝑆𝐼𝐿𝑃𝑓 = 0 (6-13)
wobei 𝜙𝑆𝐼𝐿𝑃 eine dimensionslose Kennzahl für ein kugelförmiges SILP-Partikel
darstellt, die Stofftransport in der Pore, über die Gas/IL Phasengrenzfläche und in der

Theoretische Überlegungen zur SILP-Katalyse 63
IL zur Reaktion ins Verhältnis setzt. In Abhängigkeit der betrachteten
Konzentrationsprofile in dem IL-Film konnten folgende Moduli 𝜙𝑆𝐼𝐿𝑃 abgeleitet
werden:
Tabelle 11: Modifizierte Thiele-Moduli für ein kugelförmiges SILP-Katalysatorpellet in Abhängigkeit
des Stofftransportes im IL-Film.
Fall I Fall II Fall III
𝜙𝑆𝐼𝐿𝑃,𝐼 = 𝑅√√𝑘 𝐷𝑖
𝐼𝐿 𝑎
𝐷𝑒𝑓𝑓 𝐻12
𝜙𝑆𝐼𝐿𝑃,𝐼𝐼 = 𝑅√2 𝑘 𝛽𝑖 𝑎
𝐷𝑒𝑓𝑓 𝐻12(𝑘 + 𝛽𝑖 𝑎) 𝜙𝑆𝐼𝐿𝑃,𝐼𝐼𝐼 = 𝑅√
𝑘
𝐷𝑒𝑓𝑓 𝐻12
(6-14) (6-15) (6-16)
Für die Stoffaustauschfläche wird folgende Beziehung aus einer geometrischen
Abhängigkeit für eine ideale zylindrische Pore definiert:
𝑎 = 𝑎0 √1 − 𝛼 (6-17)
Mit den Randbedingungen
(𝐼) 𝑦 = 1 ⟹ 𝑓 = 1 (6-18)
(𝐼𝐼) 𝑦 = 0 ⟹ 𝑑𝑓
𝑑𝑦= 0 (Symmetriebedingung) (6-19)
folgt folgende Lösung aus Gl. (6-13):
𝑓 =1
𝑦 (𝑒𝜙𝑆𝐼𝐿𝑃𝑌 − 𝑒−𝜙𝑆𝐼𝐿𝑃𝑌)
(𝑒𝜙𝑆𝐼𝐿𝑃 − 𝑒−𝜙𝑆𝐼𝐿𝑃)=1
𝑦 sinh(𝜙𝑆𝐼𝐿𝑃𝑌)
sinh(𝜙𝑆𝐼𝐿𝑃) (6-20)
Resubstitution von Gl. (6-20) liefert das Verhältnis der Konzentration ci zu der
Konzentration an der Pelletoberfläche ci,S in Abhängigkeit des Ortes x:
𝑐𝑖
𝑐𝑖,𝑆=𝑅
𝑥 sinh(𝜙𝑆𝐼𝐿𝑃
𝑥
𝑅)
sinh(ϕ𝑆𝐼𝐿𝑃) (6-21)

64 Theoretische Überlegungen zur SILP-Katalyse
Mit Hilfe von Gl. (6-21) kann eine auf das Reaktionsvolumen VR bezogene effektive
Reaktionsgeschwindigkeit reff definiert werden. Aus dem Verhältnis von effektiver zur
intrinsischen Reaktionsgeschwindigkeit ergibt sich der Katalysator- oder
Porennutzungsgrad eines SILP-Pellets:
𝜂 =(𝑟𝑒𝑓𝑓)𝑉𝑅𝑟𝑖𝑛𝑡𝑟
(6-22)
𝑟𝑒𝑓𝑓,𝑉𝑅 =1
𝑉𝑘 ∫ 𝑟(𝑥)4𝜋𝑥2𝑑𝑥𝑅
0 (6-23)
𝑟(𝑥) = 𝑘𝑉𝐼𝐿 ∙ 𝑐𝑖 (6-24)
𝑉𝐾 =4
3𝜋𝑅3 (6-25)
⟹ 𝜂𝑃 =𝑟𝑒𝑓𝑓
𝑟=
3
ϕ𝑆𝐼𝐿𝑃 (
1
tanh(ϕ𝑆𝐼𝐿𝑃)−
1
ϕ𝑆𝐼𝐿𝑃) (6-26)
Analog zur Interpretation des Thiele Moduls führen Werte < 3 für die SILP-Moduli zu
einem Wirkungsgrad nahe 100 %. Im Folgenden sollen die Moduli anhand einer
Modellreaktion A → B diskutiert werden. Der Einfluss eines einzelnen Parameters in
den Moduli ist immer in Relation zu den anderen Parametern zu betrachten und nicht
als absolut.
Abbildung 30 stellt den Porennutzungsgrad als Funktion der erhaltenen modifizierten
Thiele-Moduli gegen die Beladung mit ionischer Flüssigkeit dar. Für Fall III, in dem
kein Konzentrationsgradient im IL-Film vorliegt, wird der höchste Porenwirkungsgrad
erzielt. Für Fall I zeigt sich der kleinste Wirkungsgrad in Abhängigkeit der Beladung.
In den Verläufen spiegeln sich die getroffenen Annahmen der jeweiligen Fälle wieder.
Ein starker Abfall der Konzentration im IL-Film hat einen erhöhten Stoffmengenstrom
im Film zur Folge. Aus der Annahme resultiert, dass die Reaktion in der Flüssigphase
schneller erfolgt als der Stoffmengenstrom in den Film. Der verlangsamte Stofftransport
über die Gas/IL–Phasengrenzfläche im Verhältnis zur Reaktion führt unter
Berücksichtigung des effektiven Diffusionskoeffizienten zu einer schlechteren
Ausnutzung des SILP-Katalysatorpellets. Für eine Erhöhung des Wirkungsgrads müsste
der effektive Diffusionskoeffizient durch die Wahl eines anderen Trägers bzw.
Porengefüges vergrößert oder die Löslichkeit der Edukte in der ionischen Flüssigkeit
drastisch erhöht werden.

Theoretische Überlegungen zur SILP-Katalyse 65
Abbildung 30: Wirkungsgrad eines SILP-Katalysators gegen die Beladung an ionischer Flüssigkeit in
Abhängigkeit der betrachteten Fälle des modifizierten Thiele-Moduls, R = 0,01 m, k = 1 s-1, Deff = 1 •
10-5 m2 s-1, Di,IL = 1 • 10-10 m2 s-1, ε= 0,6, H12 = 50.
Der Einfluss der Löslichkeit, ausgedrückt durch den Henry-Koeffizient, und der
Porosität des Trägers ist für den Fall III in Abbildung 31 dargestellt.
a) b)
Abbildung 31: Der Wirkungsgrad eines SILP-Katalysatorpellets gegen die Beladung an ionischer
Flüssigkeit in Abhängigkeit des Henry-Koeffizienten (a) und der Porosität (b) des Trägers unter
Bedingungen für das SILP Modul Typ III ϕSILP,III.
0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
0,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
P / -
/ -
SILP,I
SILP,II
SILP,III
0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,00,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
P / -
/ -
eP = const.
H12
0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,00,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
P / -
/ -
H12
= const.
eP

66 Theoretische Überlegungen zur SILP-Katalyse
Grundsätzlich zeigt sich, dass der Katalysatorwirkungsgrad mit zunehmender Beladung
abnimmt. Dieses Verhalten ist mit dem sinkenden effektiven Diffusionskoeffizienten in
der sich verengenden Pore verbunden. Der Grenzfall α = 1 und α = 0 ist in diesem Modell
nicht berücksichtigt. Es kann in einigen Fällen theoretisch möglich sein mit einer
Beladung von α = 1 einen höheren Wirkungsgrad als mit einer Beladung α < 1 zu
erzielen. Allerdings ist dieser Fall technisch schwer umzusetzen und wird in diesem
Rahmen nicht weiter diskutiert.
Abbildung 31(a) zeigt den Wirkungsgrad in Abhängigkeit der Beladung α für das SILP-
Modul ϕSILP,III. Der Henry-Koeffizient variiert im Bereich H12 = 1 – 1000. Der Henry-
Koeffizient stellt eine IL-spezifische Größe dar. Mit abnehmenden Werten für den
Henry-Koeffizienten steigt die Löslichkeit des Substrates in der ionischen Flüssigkeit.
Folglich reduziert sich der Katalysatorwirkungsgrad mit zunehmender Löslichkeit der
Substrate, bei entsprechend kleinem effektiven Diffusionskoeffizienten. In Abbildung
31(b) ist der Einfluss der Porosität für Werte zwischen 0,1 und 0,9 dargestellt. Mit
zunehmenden Porenvolumen sinkt der Katalysatorwirkungsgrad. Allerdings erhöht sich
mit der Porosität ebenfalls die Stoffaustauschfläche, die eine schnelle Umsetzung
begünstigt. Es sollte beachtet werden, dass die absolute Menge an ionischer Flüssigkeit
zu unterschiedlichen Filmdicken in Abhängigkeit der Porosität führt. Daraus können
letztendlich ähnliche Wirkungsgrade erreicht werden. Die optimale Porosität eines
Trägers für die SILP-Katalyse wird somit von vielen Faktoren beeinflusst.
Beispielsweise können für eine stark exotherme und schnell ablaufende Reaktion eine
kleine Porosität und eine hohe Beladung zu einer verbesserten Abfuhr der Wärme aus
dem Katalysatorbett führen.
Für den Fall, dass der Stofftransport über die Gas/IL-Phasengrenzfläche und eine
schnelle Reaktion simultan ablaufen, wird das SILP-Modul ϕSILP,I erhalten. In
Abbildung 32 ist der Wirkungsgrad gegen die Beladung an ionischer Flüssigkeit in
Abhängigkeit der Stoffaustauschfläche für das SILP-Modul ϕSILP,I dargestellt.

Theoretische Überlegungen zur SILP-Katalyse 67
Abbildung 32: Der Wirkungsgrad eines SILP-Katalysatorpellets gegen die Beladung an ionischer
Flüssigkeit in Abhängigkeit der Stoffaustauschflächen des Trägers unter Bedingungen für ϕSILP,I.
Im Falle eines Konzentrationsgradienten im IL-Film ist die Stoffaustauschfläche von
entscheidender Bedeutung für die Ausnutzung des Pellets. Für den Henry-Koeffizient
wird ein konstanter Wert von H12 = 10 in Abbildung 32 festgelegt. Die spezifische
Stoffaustauschfläche wird im Bereich von 102 m-1 bis 1010 m-1 variiert. Weiterhin wird
angenommen, dass der IL-Film homogen über den Querschnitt einer zylindrischen Pore
mit der Beladung anwächst. Eine große Stoffaustauschfläche begünstigt eine schnelle
Umsetzung der Reaktanden. Für den Fall, dass ein teurer Katalysatorkomplex eingesetzt
wird, führt eine zu große Austauschfläche zu einem schlechten Wirkungsgrad und
letztendlich zu einer unökonomischen Ausnutzung des Katalysators. Im Bereich von
Literaturwerten für den Diffusionskoeffizienten Di,IL von Gasen, wie beispielsweise
Wasserstoff, Kohlenstoffdioxid, Ethen oder Propen, in ionischen Flüssigkeiten zeigen
diese einen vernachlässigbaren Einfluss auf den Wirkungsgrad in Abhängigkeit der
Beladung.[237, 243]
Fall II betrachtet Stofftransport und Reaktion getrennt voneinander, sodass neben dem
Henry- und dem Diffusionskoeffizienten auch die formale „Grenzschichtdicke“ δ in das
Modell einfließen. Der Einfluss des Stoffübergangskoeffizienten auf den Wirkungsrad
ist sehr gering und wird daher nicht näher beschrieben.
0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
0,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
P / -
/ -
eP, H
12, D
L
i= const
a

68 Theoretische Überlegungen zur SILP-Katalyse
Alle drei Fälle zeigen, dass die Löslichkeit der Substrate und der effektive
Diffusionskoeffizient den größten Einfluss auf den Wirkungsgrad haben. Eine
Verbesserung der Diffusion in der Pore lässt sich entweder durch die Morphologie des
Trägers oder durch eine Erhöhung des Diffusionskoeffizienten, beispielsweise durch
einer Temperaturerhöhung bewirkt, bewerkstelligen.[182] Die Modelle zeigen aber auch,
dass eine Erhöhung der Löslichkeit zu einer Steigerung der Reaktionsgeschwindigkeit
führt, aber nicht zwangsläufig zu einer besseren Ausnutzung des Pellets.
Zusammenfassend kann festgehalten werden, dass das Potential der SILP-Katalyse bei
Systemen mit geringer Löslichkeit für die Edukte liegt. Für unerwünschte
Folgereaktionen kann dies von Vorteil sein.[123] Die Möglichkeit, einen homogenen
Katalysatorkomplex in einer spezifischen ionischen Flüssigkeit zu lösen und zu
stabilisieren, kann ebenfalls den vordergründigen Nachteil einer schlechten Löslichkeit
der Substrate mittels eines SILP-System kompensieren.
Das hier gezeigte Modell beschreibt einen idealen SILP-Katalysator. Bis heute ist noch
nicht ganz geklärt, wie die ionische Flüssigkeit und der Metallkomplex in dem
Porennetzwerk vorliegen, beziehungsweise wie der Stofftransport durch die Verteilung
der fluiden Phase beeinflusst wird. Rony stellte bereits 1968 fest, dass sein Modell zur
Beschreibung der Supported Liquid Phase (SLP) – Katalyse für eine einzelne Pore
ausreichend ist, aber nicht für die Abbildung der Vorgänge eines SLP-Katalysators, da
die Verteilung der Flüssigkeit in dem dreidimensionalen Makro- und
Mikroporennetzwerk sehr komplex ist.[188] Im Laufe dieser Arbeit hat sich gezeigt, dass
die SILP-Katalyse speziell am Beispiel der Hydroformylierung weit von der idealen
Vorstellung abweicht.
Im nachfolgenden Kapitel sollen die unterschiedlichen Einflussfaktoren auf die SILP-
Katalyse am Beispiel der Hydroformylierung erläutert werden.
6.2 Modell zur Charakterisierung der SILP-katalysierten Hydroformylierung
In diesem Kapitel soll ein Modell zur Beschreibung der Vorgänge in der Supported Ionic
Liquid (SILP) - Katalyse am Beispiel der Hydroformylierung von Buten vorgestellt
werden. Das Modell beruht auf den Erkenntnissen aller in dieser Arbeit vorgestellten
Ergebnisse und trägt entscheidend zum dem Verständnis und zur Interpretation
derselben bei. Das SILP-Konzept beruht auf der Physisorption von ionischer Flüssigkeit
auf einem Träger und einem darin gelöstem Edelmetallkomplex. Wie bereits in Kapitel

Theoretische Überlegungen zur SILP-Katalyse 69
3.4 diskutiert, weicht die Realität stark von der Modellvorstellung der Supported Liquid
Phase (SLP) – Katalyse ab. Aufbauend auf den literaturbekannten Erkenntnissen ist in
Abbildung 33 die Verteilung bzw. Anordnung von Katalysatorkomplex, Ligand und
ionischer Flüssigkeit in einer Modelpore dargestellt. Die Einteilung der Porengrößen
nach Mikro-, Meso- und Makroporen ist gemäß der IUPAC-Norm.[244-245] Nach
Riisager[214] und Haumann[215] erfolgt in den Mikroporen des Trägers ein Fluten mit
ionischer Flüssigkeit. Cremer et al. zeigten, dass sich auf einer Glasoberfläche nach der
Ausbildung einer monomolekularen Schicht an ionischer Flüssigkeit zunächst Inseln
bilden.[210] Die Verteilung und Anordnung von Ligand, Katalysatorkomplex und
ionischer Flüssigkeit wird durch deren chemische und physikalische Eigenschaften
beeinflusst sowie durch die Morphologie und die Oberflächenbeschaffenheit des
Trägers. Neben den Wechselwirkungen zwischen Katalysatorkomplex, Ligand und
ionischer Flüssigkeit konkurrieren diese um Adsorptionsplätze auf der Oberfläche des
Trägers. Durch die Benetzung einer Trägeroberfläche mit einer Flüssigkeit wird die
Oberfläche der Flüssigkeit vergrößert. Dem wirkt die Oberflächenspannung der
Flüssigkeit entgegen. Eine Verkleinerung der Flüssigkeitsoberfläche kann nur dann
eintreten, wenn die Flüssigkeit in die Poren steigt und diese flutet. Dies wird solange
geschehen, bis die Adhäsionskraft mit der Oberflächenspannung im Gleichgewicht ist.
Die Adhäsionsstärke wird durch die Oberflächengruppen des Trägers beeinflusst. Die
Oberfläche von Silica ist mit Silanolgruppen besetzt. Die Silanolgruppen können
thermisch bei 600 – 800 °C durch Kondensation in Siloxane umgewandelt werden.[246]
Zusätzlich nehmen das Lösungsmittel, das zur Präparation des SILP-Katalysators
verwendet wurde, und die eingestellte Verdampfungsrate Einfluss auf die Verteilung
der Komponenten.
Abbildung 33: Schematische Darstellung einer möglichen Verteilung von Katalysatorkomplex, Ligand
und ionischer Flüssigkeit in einer Modelpore nach der Präparation eines SILP-Katalysators.
Rh-Ligand-Komplex
Meso
Makro
Mikro
„freier“ Ligand ionische Flüssigkeit

70 Theoretische Überlegungen zur SILP-Katalyse
Aus diesen Überlegungen lassen sich vier verschiedene Konstellationen von
Katalysatorkomplex, Ligand und ionischer Flüssigkeit nach dem Entfernen des
Lösungsmittels ableiten. Diese Fälle sind in Abbildung 34 schematisch verdeutlicht.
Abbildung 34: Mögliche Konstellationen von Katalysatorkomplex, Ligand und ionischer Flüssigkeit auf
einer kalzinierten Silica-Oberfläche.
Der Ligand und der Katalysatorkomplex können entweder gelöst in der ionischen
Flüssigkeit (a), physisorbiert auf der Oberfläche des Trägers (b), physisorbiert auf der
Oberfläche in Konkurrenz zu der IL (c) oder auf einer monomolekularen Schicht aus IL
(d) vorliegen.
Aus Abbildung 34 ergibt sich nun folgende Fragestellung: In welcher Konformation ist
der Edelmetallkomplex aktiv? Horváth[216], Fehrmann[152] und Bell[218] gehen von einer
physisorbierten Katalysatorspezies in der SLP- und SILP-Katalyse am Beispiel der
Hydroformylierung aus. Der Ligand koordiniert jeweils mit den Sulfonatgruppen an die
Silanolgruppen des Trägers. Der in dieser Arbeit eingesetzte Ligand besitzt keine
sulfonierten Gruppen und die SILP-Katalysatoren sind trotzdem aktiv. Zudem wird der
Träger vor dem Einsatz bei einer Temperatur von 600 °C kalziniert, dies hat eine
─+
─
+ ++
──
─
+ ++ +
+
─ ─
─
─
+
─
+
─
+
─
+
─+
─
+
─
a) b)
c) d)
Rh-Ligand-Komplex Ligand + ─ Ionische Flüssigkeit
+
─

Theoretische Überlegungen zur SILP-Katalyse 71
reduzierte Anzahl an Silanolgruppen zur Folge und resultiert nach Bell in einer
reduzierten Aktivität für den SILP-Katalysator. Der Katalysatorkomplex müsste
folglich in anderen Formationen im Porennetzwerk des Trägers vorliegen.
Ein in dieser Arbeit entwickeltes Modell liefert einen Ansatz zum Verständnis der SILP-
Katalyse für die Hydroformylierung. Bevor das Modell im Detail erklärt wird, sollte
zuerst ein Blick auf das Reaktionsnetzwerk der Hydroformylierung gelegt werden (siehe
Abbildung 35). Neben der Hydroformylierung von 1-Buten und 2-Buten treten, wie
bereits in Abbildung 9 dargestellt, die Hydrierung von Buten zu n-Butan, sowie die
Isomerisierung der Butene auf. All diese Reaktionen werden durch den aktiven
Übergangsmetallkomplex katalysiert. Aldehyde können durch Anwesenheit einer Säure
oder Base aldolisieren. Die Aldoladdition von zwei Molekülen n-Pentanal ergibt 3-
Hydroxy-2-propylheptanal. Gefolgt von der thermodynamisch begünstigten
Kondensationsreaktion wird 2-Propyl-2-heptenal erhalten. Des Weiteren ist eine
Aldolreaktion des verzweigten und linearen Aldehydes möglich, sowie eine
Oligomerisierung/Polymerisierung der Produkte durch konsekutiv Aldoladditionen/ -
kondensationen. Die Folgereaktion der Aldehyde kann in diesem System durch mehrere
Komponenten katalysiert werden: Ionische Flüssigkeit, Stabilisator, Träger und/oder
Abbauprodukte des Liganden.
Abbildung 35: Reaktionsnetzwerk der Hydroformylierung von 1-Buten, Rhodium-katalysierte
Reaktionen sind grau hinterlegt.

72 Theoretische Überlegungen zur SILP-Katalyse
Die Siedetemperaturen für n-Pentanal und 2-Propyl-2-heptenal liegen bei 103 °C bzw.
bei 244,3 °C unter Standarddruck von 1,01325 bar.[247-248] In dieser Arbeit werden als
Standardreaktionsbedingungen 100 °C und 10 bar Absolutdruck gewählt. Folglich ist es
theoretisch möglich, unter bestimmten Bedingungen den Sättigungsdampfdruck pSat des
jeweiligen Produktes zu erreichen. Das hätte zur Konsequenz, dass Moleküle aus der
Gasphase kondensieren. Die kondensierte Phase steht mit der Gasphase im
Gleichgewicht. In den Poren tritt Kondensation von Molekülen aus der Gasphase bereits
bei Drücken unter dem Sättigungsdampfdruck auf. Dieser Effekt wird als
Kapillarkondensation bezeichnet und ist auf eine häufigere Anzahl an
Wechselwirkungen zwischen den Molekülen mit der Porenwand als mit sich selbst
zurückzuführen.[249]
Für die SILP-katalysierte Hydroformylierung bedeutet dies, dass während der Reaktion
auch Hochsieder eine flüssige Phase in dem Porennetzwerk des Trägers ausbilden
können. In Abbildung 36 ist das Anfahrverhalten eines SILP-Katalysators bis zum
Erreichen eines stationären Zustandes dargestellt. In der Startphase können sowohl die
ionische Flüssigkeit als auch der Stabilisator, der unter Reaktionsbedingungen flüssig
vorliegt, als Lösungsmittel für den Katalysator dienen (siehe Kapitel IX).
Abbildung 36: Bildung eines flüssigen Reaktionsmediums aus Produkt und Folgeprodukt im
Porennetzwerk in der Anfahrphase am Beispiel der SILP-katalysierten Hydroformylierung von 1-Buten.
Die Edukte diffundieren in das Porennetzwerk und reagieren an einem in IL gelöstem
aktiven Zentrum zu den Produkten. Ein Teil der gebildeten Produkte diffundiert aus dem
Rh-Ligand-Komplex
Meso
Makro
Mikro
„freier“ Ligand
ionische Flüssigkeit
Edukte Produkte Edukte Produkte
(Folge-)Produkt / IL – Phase

Theoretische Überlegungen zur SILP-Katalyse 73
Porennetzwerk und ein Teil verbleibt im Porennetzwerk und bildet eine zusätzliche
flüssige Phase aus. Diese kann mit der ionischen Flüssigkeit mischbar sein oder eine
Mischungslücke aufweisen und folglich ein zweiphasiges Reaktionsmedium in den
Poren ausbilden. Das Porennetzwerk reichert sich solange mit flüssigem Produkt an, bis
die produzierte Menge an Aldehyd und Aldolprodukt im Gleichgewicht mit der durch
Verdampfung in die Gasphase übergehenden Menge an Produkten ist. Sobald dieser
Punkt erreicht ist, kann von stationären Bedingungen ausgegangen werden. In-situ wird
somit ein Lösungsmittel für den Katalysatorkomplex und den Ligand gebildet.
Katalysatorkomplex und Ligand, die zu Beginn physisorbiert auf der Oberfläche des
Trägers vorliegen, werden durch die Ausbildung einer flüssigen Phase gelöst und sind
aktiv für die Reaktion.
Abbildung 37: Einfluss des Partialdruckes eines Hochsieders auf den Porenfüllgrad durch kondensiertes
Produkt.
Der Porenfüllgrad, der sich unter Reaktionsbedingungen in dem Porennetzwerk des
Trägers ausbildet, wird von mehreren Parametern beeinflusst. Die entscheidende Größe
ist der Partialdruck des Hochsieders in der Gasphase. Je näher der Partialdruck des
Hochsieders an dem Sättigungsdampfdruck liegt, desto größer ist der Porenfüllgrad in
dem kapillaren System. Wird der Sättigungsdampfdruck erreicht, führt das zu einem
kompletten Fluten des Porennetzwerkes und zum Leaching der aktiven Komponente aus
den Poren des SILP-Katalysators. Für Einstoffsysteme kann das Verhalten der
Kapillarkondensation anhand der Kelvin-Gleichung für zylindrische Poren beschrieben
werden:[250]
Rh-Ligand-Komplex
Meso
Makro
Mikro
„freier“ Ligand
ionische Flüssigkeit (Folge-)Produkt / IL – Phase
pP,Vap <<<< pP,Sat pP,Vap << pP,Sat pP,Vap ≤ pP,Sat

74 Theoretische Überlegungen zur SILP-Katalyse
𝑙𝑛𝑝𝑣
𝑝𝑆𝑎𝑡= 𝛾 𝑉𝑀
𝑟 𝑅 𝑇 (6-27)
mit pv = Dampdruck über der gekrümmten Oberfläche, pSat = Sättigungsdampfdruck, γ =
Grenzflächenspannung, VM = molare Volumen der Flüssigkeit, r = Krümmungsradius, R = allgemeine
Gaskonstante, T = Temperatur
Die Kelvin-Gleichung verknüpft den Dampfdruck einer Flüssigkeit mit der Krümmung
der Gas-Flüssig-Phasengrenzfläche. Der Krümmungsradius ist wiederum abhängig von
der Porengeometrie bzw. dem Porenradius für eine ideale zylindrische Pore und dem
Benetzungsverhalten der Flüssigkeit. Diese Beziehung wird über die Young´sche
Gleichung dargestellt. Für die SILP-Katalyse bleibt festzuhalten, dass kleine
Porendurchmesser die Ausbildung einer flüssigen Phase begünstigen. Im vorliegenden
Fall wäre es nicht korrekt, von einer Porenkondensation zu sprechen. Das Produkt
diffundiert nicht von der Gasphase in das Porennetzwerk und kondensiert, sondern das
Produkt entsteht in dem Lösungsmittel in den Poren und geht anschließend über einen
Phasenwechsel in die Gasphase über. Der Phasenübergang wird durch die
Zustandsvariablen Druck, Temperatur und chemische Zusammensetzung beeinflusst.
Diese nehmen Einfluss auf die Kinetik der Reaktion und den Stoffmengentransport in
dem SILP-Katalysator. Aufgrund der Dynamik des Systems variieren Parameter wie
Diffusionskoeffizienten, Verteilungskoeffizienten oder Stoffaustauschfläche durch
veränderte Prozessbedingungen. In dem bisherigen Modell wird davon ausgegangen,
dass die ionische Flüssigkeit mit dem Hochsieder eine komplette Mischbarkeit aufweist.
Ist dies nicht der Fall, muss die Frage geklärt werden, in welcher der beiden Phasen der
Katalysatorkomplex vorliegt und wie beide Phasen in dem Porennetzwerk vorliegen.
Das vorgestellte Modell ist sehr speziell auf die Erklärung der Vorgänge in der SILP-
katalysierten Hydroformylierung abgestimmt. Dieses Modell ist auf alle Reaktionen mit
SILP-Katalysatoren übertragbar, an denen eine hochsiedende Komponente als Edukt
oder Produkt teilnimmt. Über Reinstoffdaten sollte im Vorfeld eine Abschätzung über
die Prozessbedingungen für einen stabilen Betrieb eines SILP-Katalysators getroffen
werden. Das folgende Strukturanalysediagramm dient als Richtlinie für die Auswahl der
Komponenten eines SILP-Katalysators und dessen Betriebsweise.
Der Einfluss der einzelnen Komponenten eines SILP-Katalysators und der Einfluss der
Reaktionsbedingungen werden in den nächsten Kapiteln mit experimentellen
Ergebnissen dargestellt.

Theoretische Überlegungen zur SILP-Katalyse 75

76 Theoretische Überlegungen zur SILP-Katalyse
Abbildung 38: Entscheidungsdiagramm zur optimalen Betriebsweise eines SILP-Katalysators in einer
Gasphasen-Reaktion.

Optimierung des SILP-Katalysatorsystems 77
7 Optimierung des SILP-Katalysatorsystems
Die Optimierung des SILP-Katalysators konzentriert sich auf die Materialentwicklung
und auf reaktionskinetische Ansätze. Die Materialentwicklung hat das Ziel, die Stabilität
und die Aktivität für den Einsatz mit technischen Gemischen zu verbessern und einen
besseren Einblick in die Wirkungsweise der einzelnen Komponenten zu erhalten. In der
Literatur werden oft nur der Umsatz bezüglich des Olefins und das l/b-Verhältnis
betrachtet. Die Selektivität zu den Nebenprodukten spielt ebenso eine wichtige Rolle,
da sie letztlich die Produktivität beeinflusst und somit einen ökonomischen Faktor
darstellt. Durch Messungen im Plug-Flow-Strömungsrohrreaktor wird das
Reaktionsnetzwerk der Umsetzung von Alkenen mit Synthesegas reaktionskinetisch
studiert. Sowohl die Ergebnisse der Materialvariation als auch die kinetischen Ansätze
werden mit dem im vorherigen Kapitel vorgestellten Modell interpretiert.
7.1 Vermessung des literaturbekannten-SILP-Katalysator-Systems
Ausgangspunkt dieser Arbeit sind die Ergebnisse von Jakuttis et al., die mit einem SILP-
Katalysator eine Stabilität von über 800 Stunden in der Hydroformylierung von Raffinat
I erreichten.[198] Der Umsatz bezüglich der Alkene betrug ungefähr 25 % über die
betrachtete Reaktionszeit. Die n:iso-Selektivität war mit 99 % außerordentlich hoch. Die
Zusammensetzung des SILP-Katalysators und die eingestellten Reaktionsbedingungen
sind in Tabelle 12 zusammengefasst.
In dieser Arbeit werden hauptsächlich SILP-Katalysatoren mit dem Benzpinakol-
basierten Liganden untersucht. Jakuttis et al. testeten SILP-Katalysatoren mit dem
Benzpinakol-Ligand bereits mit Raffinat I unter den Bedingungen in Tabelle 12. Diese
Reaktionsbedingungen dienen gleichzeitig als Referenz für diese Arbeit. In Abbildung
39 ist der Umsatz und die Selektivität gegen die Reaktionszeit mit Raffinat III als
Substrat aufgetragen. Raffinat III eignet sich aufgrund der Zusammensetzung als
Modellsubstrat für ein Gemisch von dehydriertem n-Butan (siehe Kapitel 4.2).

78 Optimierung des SILP-Katalysatorsystems
Tabelle 12: Zusammensetzung des SILP-Katalysators und getestete Reaktionsbedingungen nach
Jakuttis et al.[198]
SILP-Parameter Reaktionsbedingungen nach Jakuttis et al.
Precursor Rh(acac)(CO)2 Absolutdruck in bar 10
Ligand Benzpinakol Temperatur in °C 100
Ionische Flüssigkeit [EMIM][NTf2] Gesamtvolumenstrom in ml
min-1
29,2
Träger Silica 100 (kalz.),
0,0063 – 0,2 mm
Partialdruck Raffinat 1 in bar 2
Stabilisator Bis(2,2,6,6-
tetramethyl-4-
piperidyl)sebacat
Partialdruck
Kohlenstoffmonoxid in bar
4
wRh in Gew-% 0,2 Partialdruck Wasserstoff in bar 4
Beladung an IL 0,1 Anteil linearer Alkene im
Raffinat I in mol-%
41,7
Ligand : Rhodium 10 : 1
Stabilisator : Ligand 4 : 1
Einsetzte Masse an
SILP-Katalysator in g
3
In den Versuchen mit Raffinat III zeigt sich, dass SILP-Katalysatoren mit dem Rh-BzP-
Komplex ausschließlich 1-Buten verwerten bzw., dass durch die Isomerisierung von 1-
Buten mehr 2-Buten gebildet wird als durch die Hydroformylierung von 2-Buten zu 2-
Methylbutanal verbraucht wird. Das entsprechende Verhalten für dieses
Katalysatorsystems wird bereits in der Patentschrift „Verfahren zur Abtrennung von 1-
Buten aus C4-haltigem Kohlenwasserstoffströmen durch Hydroformylierung“
dokumentiert.[251] Daher ist auf der linken y-Achse in Abbildung 39 nur der Umsatz
bezüglich 1-Buten dargestellt. Nach einer Anfahrphase von 15 Stunden erreicht der
Umsatz von 1-Buten einen stabilen Wert von 48 %. Dies entspricht einer Turn-Over-
Frequency (TOF) von 410 h-1. Der Molenanteil von 1-Buten im Raffinat III (Charge 3)
beträgt 31,5 mol-%.

Optimierung des SILP-Katalysatorsystems 79
Abbildung 39: Umsatz und Selektivität gegen die Reaktionszeit für den Standard SILP-Katalysator mit
Raffinat-III. Anzahl an Datenpunkten reduziert.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 30 ml min -1; pRaff-III,3 = 2 bar; pH2 = 4 bar; pCO = 4 bar;
mSILP-Kat = 3 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh = 0,2
Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten, S2-Propyl-2-heptenal.
Auf der rechten y-Achse sind die Selektivitäten zu den Produkten n-Pentanal, n-Butan,
trans-2-Buten, cis-2-Buten und dem Aldolprodukt 2-Methyl-2-heptenal, sowie die
n:iso-Selektivität aufgetragen. Die n:iso-Selektivität beträgt über den gesamten
Versuchsverlauf über 99 %. Die Selektivität zum linearen Aldehyd liegt bei 80 %. Von
den Nebenprodukten zeigt cis-2-Buten die höchste Selektivität mit 8 %. Laut dem
thermodynamischen Gleichgewicht der Butene müsste der Anteil von trans-2-Buten
über dem Anteil von cis-2-Buten bei 100 °C liegen. Die Selektivität an trans-2-Buten
beträgt aber lediglich 2 -3 %. Dieses Verhalten zusammen mit der hohen n:iso-
Selektivität von 99 %, spiegelt den sterischen Anspruch des Liganden wieder. n-Butan,
das durch Hydrierung von 1-Buten oder 2-Buten gebildet werden kann, wird mit einer
Selektivität von 6-7 % gebildet. Als Folgeprodukt konnte das
Aldolkondensationsprodukt 2-Propyl-2-heptenal detektiert werden. Durch die
Verwendung eines internen Standards im Raffinat III war es möglich, die Massenbilanz
zu 99 % zu schließen. Der Messfehler aufgrund nicht detektierter Hochsieder im
Gaschromatographen sollte sich somit auf < 1% belaufen. Das Ergebnis zeigt, dass das
0 20 40 60 80 100 120
0
10
20
30
40
50
60
70
80
90
100
X1-B
ute
n, R
aff
III /
%
Zeit / h
0
5
10
60
70
80
90
100
Si /
%

80 Optimierung des SILP-Katalysatorsystems
Reaktionsnetzwerk der Hydroformylierung mit dem Rh-BzP-SILP-Katalysator
komplexer ist als bisher angenommen.
Die Aldolreaktion könnte entweder durch azide Oberflächengruppen des Trägers, durch
den basischen Charakter des Stabilisators oder durch die ionische Flüssigkeit katalysiert
werden. Watanabe et al. berichten von der lösungsmittelfreien Aldolkondensation von
C4 – C10 – Aldehyden mit der Aminosäure Lysin bei Raumtemperatur.[252] Es wird
vermutet, dass die Aminogruppe essentiell für die Umsetzung der Reaktion ist. Sharma
et al.[253] und Arnold et al.[254] stellen fest, dass die Aldolkondensation unter
Anwesenheit von Lithiumperchlorat durch Triethylamin katalysiert wird. Ohne
Triethylamin tritt keine Aldolreaktion bei 120 °C auf. Hamaya et al. untersuchten die
Aldolkondensation von n-Decanal in der ionischen Flüssigkeit 1-Butyl-3-
methylimidazolium hexafluorophosphat [BMIM][PF6] mit N-Methylaminopropyl-
Gruppen funktionalisiertem FSM-16 Silica als Katalysator.[255] Ohne Anwesenheit des
Katalysators konnte keine Reaktion des Aldehyds bei 80 °C in der IL festgestellt
werden. Mit nicht-funktionalisiertem Silica wird n-Decanal komplett umgesetzt. Die
Ausbeute zum Produkt 2-Octyl-2-dodecenal beträgt lediglich 19 %. Mit dem Amino-
funktionalisierten Silica liegt die Ausbeute bei 83 %. Wang et al. stellen fest, dass die
Aldolreaktion alleine durch die Temperatur als treibende Kraft stattfindet, ohne dass ein
Katalysator oder Lösungsmittel eingesetzt wurde.[256] Weiterhin wäre es möglich, dass
die Aldolreaktion durch Abbauprodukte des Phosphitliganden katalysiert wird. Wie
bereits in Kapitel 2.1.2 erwähnt, werden Phosphitliganden durch Hydrolyse zersetzt. Es
können sich trivalente Phosphorsäureester bilden. Diese können wiederrum katalytisch
auf die Aldolreaktion wirken.[58] Die Vielzahl von Promotoren für die Aldolbildung
machen es schwer die unerwünschte Folgereaktion gänzlich zu unterdrücken.
7.2 Precursorvariation und Einfluss der Komplexierungskinetik
Hinsichtlich der aktiven Spezies für die Hydroformylierung ist sich die Literatur relativ
einig. Die Ausbildung der aktiven Spezies ist von dem eingesetzten Präkursor und dem
Ligand abhängig. In dem folgenden Abschnitt wird der Einfluss des Präkursors auf die
Aktivität und Selektivität des SILP-Katalysators untersucht. Neben dem standardmäßig
für die SILP-katalysierte Hydroformylierung eingesetzten
(Acteylacetonat)dicarbonylrhodium(I) Rh(acac)(CO)2, wurde (Acetylacetonat)(1,5-
cyclooctadien)rhodium(I) Rh(acac)(COD) und Chlorotris(triphenylphosphin)
rhodium(I) RhCl(PPh3)3 verwendet. Die Präparation der SILP-Katalysatoren verläuft

Optimierung des SILP-Katalysatorsystems 81
für alle eingesetzten Präkursoren analog der Vorschrift aus Kapitel 4.2.7. Für alle
Experimente wird 1-Buten als Substrat verwendet. Synthesegas wird stöchiometrisch
im 4-fachen Überschuss zu 1-Buten dosiert. In Abbildung 40 ist der Umsatz- und
Selektivitätsverlauf mit dem Standardkatalysator für 1-Buten dargestellt.
Abbildung 40: Einfluss des Präkursors Rh(acac)(CO)2 auf Umsatz und Selektivität in der SILP-
katalysierten Hydroformylierung von 1-Buten.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 30 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 4 bar;
mSILP-Kat = 3,0 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh = 0,2
Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten, S2-Propyl-2-heptenal.
Der Umsatz an 1-Buten liegt zwischen 12 – 14 %. Das entspricht unter den eingestellten
Reaktionsbedingungen einer TOF von 400 h-1 und einer Produktivität an linearem
Aldehyd von 320 gn-Pentanal kg-1SILP
h-1. Die Selektivität zu n-Pentanal ist mit 72 - 75 %
um mindestens 5 Prozentpunkte geringer als mit Raffinat III als Substrat. Hingegen ist
die Selektivität zu den 2-Butenen erhöht. Durch den Einsatz von reinem 1-Buten ist der
Gradient zum Erreichen des thermodynamischen Gleichgewichtes der C4-Alkene größer
als mit Raffinat III. Die Selektivität bezüglich n-Butan von 7 % ist vergleichbar mit dem
Einsatz des technischen Gemisches. Die Selektivität zu 2-Propyl-2-heptenal beträgt 2 –
3 %.
0 5 10 15 20 25
0
5
10
15
20
25
30
35
40
45
50
X1-B
ute
n /
%
Zeit / h
0
10
20
30
40
50
60
70
80
90
100
Si /
%

82 Optimierung des SILP-Katalysatorsystems
In Abbildung 41 ist der Umsatz- und Selektivitätsverlauf eines SILP-Katalysators mit
dem Präkursor (Acetylacetonat)(1,5-cycloocatdien)rhodium(I) Rh(acac)(COD)
dargestellt.
Abbildung 41: Einfluss des Präkursors Rh(acac)(COD) auf Umsatz und Selektivität in der SILP-
katalysierten Hydroformylierung von 1-Buten.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 30 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 4 bar;
mSILP-Kat = 3,0 g; Rh(acac)(COD); BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh =
0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten, S2-Propyl-2-heptenal.
Der Umsatz an 1-Buten erreicht nach drei Stunden sein Maximum von 57 % und fällt
anschließend kontinuierlich ab. Die Selektivität zu n-Pentanal ist mit 53 % um 20
Prozentpunkte niedriger als mit einem SILP-Katalysator, der mit Rh(acac)(CO)2 als
Präkursor präpariert wurde. Im Gegenzug sind in der Anfangsphase die Selektivitäten
zu den Nebenprodukten cis- und trans-2-Buten, sowie n-Butan erhöht. Nach 30 Stunden
stellen sich ein konstanter Umsatz von 25 % und konstante Selektivitäten zu den
Produkten ein. Der erhöhte Umsatz und die verringerte Selektivität zum Aldehyd im
Vergleich zu dem Rh(acac)(CO)2-SILP könnte mit einer langsameren Komplexierung
des Liganden (BzP) mit dem Präkursor Rh(acac)(COD) verbunden sein. Preetz et al.
beobachteten am Beispiel der Rhodium-katalysierten asymmetrischen Hydrierung
prochiraler Olefine, dass Präkursoren mit Diolefin-Liganden eine Aktivierungsphase
zeigten.[257] Die Aktivierungsphase wurde durch die langsame Hydrierung von
0 5 10 15 20 25 30 35 40 45
0
5
10
15
20
25
30
35
40
45
50
55
60
65
X1-B
ute
n /
%
Zeit / h
0
10
20
30
40
50
60
70
80
90
100
Si /
%

Optimierung des SILP-Katalysatorsystems 83
Cyclooctadien begründet und kinetisch validiert. Für die Ausbildung unmodifizierter
Rhodium-Katalysatorkomplexe, die aktiv für die Hydroformylierung sind, sind die
Partialdrücke an CO und H2 zu gering.[258-259] Ein aktiver, unmodifizierter
Edelmetallkomplex würde sich zudem in einer veränderten n:iso-Selektivität
niederschlagen. Der Einfluss der Komplexierungskinetik wird für den Präkursor
Rh(acac)(COD) detaillierter im anschließenden Kapitel untersucht.
Im Zusammenhang mit dem Wilkinson-Katalysator wird untersucht, ob die Liganden
des Wilkinson-Katalysators durch den Benzpinakol-Liganden verdrängt werden. Das
Ergebnis ist in Abbildung 42 dargestellt. Aus Vorversuchen ist bekannt, dass ein SILP-
Katalysator, der mit RhCl(PPh3)3 und IL imprägniert wurde, nicht aktiv für die
Hydroformylierung unter den gewählten Reaktionsbedingungen ist.
Abbildung 42: Einfluss des Präkursors RhCl(PPh3)3 auf Umsatz und Selektivität in der SILP-
katalysierten Hydroformylierung von 1-Buten. Anzahl an Datenpunkten reduziert.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 30 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 4 bar;
mSILP-Kat = 3,0 g; RhCl(PPh3)3; BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh = 0,2
Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten, S2-Propyl-2-heptenal.
Beim Einsatz des Wilkinson-Katalysators als Präkursor fällt besonders die lange
Deaktivierungsphase über 100 Stunden auf. Zu Beginn liegt der Umsatz an 1-Buten bei
52 % und erreicht nach 105 Stunden ein konstantes Niveau von 17 %. Die sinkende
0 20 40 60 80 100 120
0
5
10
15
20
25
30
35
40
45
50
55
60
65
X1-B
ute
n /
%
Zeit / h
0
10
20
30
40
50
60
70
80
90
100
Si /
%

84 Optimierung des SILP-Katalysatorsystems
Aktivität des Katalysators könnte durch die stetige Konkurrenz der Liganden
Triphenylphoshpin und Benzpinakol um das Edelmetall verursacht werden. Die
konstant hohe n:iso-Selektivität deutet daraufhin, dass nur der Rh-Benzpinakol-
Komplex aktiv für die Hydroformylierung ist. Ein Austausch der Liganden scheint somit
möglich und zugunsten des Diphosphitliganden stattzufinden. In Versuchen ohne
Benzpinakol ist der Wilkinson-Katalysator unter den gewählten Reaktionsbedingungen
sehr aktiv für die Hydrierung und Isomerisierung. 1-Buten wird vollständig zu 2-Buten
und n-Butan umgesetzt. Die Selektivität zu n-Pentanal liegt mit maximal 69 % zwischen
den SILP-Katalysatoren, die mit den Präkursoren Rh(acac)(CO)2 bzw. Rh(acac)(COD)
und dem Benzpinakol-Ligand präpariert worden sind.
Die Komplexierung der Präkursoren mit dem Ligand Benzpinakol hat einen großen
Einfluss auf das Reaktionsnetzwerk und die Stabilität der SILP-Katalysatoren. Die
n:iso-Selektivität ist bei allen eingesetzten Rh-Präkursoren mit diesem Ligand über 99
%. Daraus lässt sich folgern, dass die Hydroformylierung ausschließlich durch den Rh-
Benzpinakol-Komplex katalysiert wird. Unter stationären Bedingungen zeigt der SILP-
Katalysator mit Rh(acac)(COD) den höchsten Umsatz an 1-Buten mit 25 % und die
höchste Produktivität an linearem Aldehyd von 510 gn-Pentanal kg-1SILP h-1. Die Selektivität
ist mit 73 % zum linearen Aldehyd bei dem SILP-Katalysator mit dem Präkursor
Rh(acac)(CO)2 am größten. Der Unterschied im Komplexierungsverhalten zwischen
den Präkursoren Rh(acac)(CO)2 und Rh(acac)(COD) mit dem Liganden könnte während
der Präparation zu einer unterschiedlichen Verteilung der aktiven Zentren im
Porennetzwerk führen. Ein Präkursor kann aufgrund der geringeren Größe tiefer in das
Porennetzwerk eindringen als ein organometallischer Komplex. Nach der
Modellmodelvorstellung in Kapitel 6.2 müssten aufgrund des Fluten der Poren mit
Produkt/Folgeprodukt daher mehr Zentren in Lösung gehen und aktiv für die Reaktion
sein. Der Einsatz eines Halogenid-haltigen Präkursor-Salzes wie beim Wilkinson-
Katalysator ist aufgrund von Korrosionsproblemen oder unerwünschten
Nebenreaktionen des Liganden mit dem Halogenid nicht geeignet für den Dauerbetrieb.
Einfluss der Komplexierungskinetik
Im Folgenden soll der Einfluss der Kinetik der Komplexierung des Liganden
Benzpinakol und der Vorstufe (Acetylacetonat)(cyclooctadien)rhodium (I)
Rh(acac)(COD) untersucht werden. In Abbildung 43 und Abbildung 44 ist der Umsatz-
und Selektivitätsverlauf des SILP-Katalysators dargestellt. Beide SILP-Katalysatoren
sind einer Herstellungscharge entnommen. Der einzige Unterschied zwischen den

Optimierung des SILP-Katalysatorsystems 85
Katalysatoren liegt in der Lagerungsdauer unter Argon. Der SILP-Katalysator, dessen
Verlauf in Abbildung 43 beschrieben ist, wird direkt nach der Präparation in den Reaktor
eingesetzt während der in Abbildung 44 getestete Katalysator zehn Tage unter
Schutzgas lagerte.
Abbildung 43: Einfluss der Komplexierungskinetik von Rh(acac)(COD) und Benzpinakol auf Umsatz
und Selektivität in der SILP-katalysierten Hydroformylierung von 1-Buten direkt nach der Synthese
des SILP-Katalysators. Anzahl an Datenpunkten reduziert
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 25 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 4 bar;
mSILP-Kat = 0,5 g; Rh(acac)(COD); BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh =
0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten, S2-Propyl-2-heptenal.
Aus Abbildung 43 ist zu erkennen, dass der SILP-Katalysator, der direkt nach der
Präparation in der Reaktion getestet wird, über 120 Stunden kontinuierlich deaktiviert.
Im Gegenzug steigt die Selektivität an n-Pentanal auf 75 % an, bis stationäre
Bedingungen erreicht sind. In der Anfangsphase sind die Selektivitäten für cis-2-Buten
und n-Butan erhöht. Interessanterweise wird die Selektivität von trans-2-Buten in der
Deaktivierungsphase nicht beeinflusst. Dieses Verhalten lässt sich auf die
Komplexierung zwischen dem Präkursor Rh(acac)(COD) und dem Liganden
Benzpinakol zurückführen. Sowohl Acetylacetonat als auch 1,5-Cyclooctadien sind
zweizähnige Liganden und schützen das Edelmetall vor unerwünschten Reaktionen oder
Clusterbildung. Eine Substitution kann nur durch ein geeignetes polares Lösungsmittel
0 20 40 60 80 100 120 140 160 180 200 220
0
5
10
15
20
25
30
35
40
45
50
X1-B
ute
n /
%
Zeit / h
0
10
20
30
40
50
60
70
80
90
100
Si /
%

86 Optimierung des SILP-Katalysatorsystems
oder durch Hydrierung der zweizähnigen Liganden in einem Lösungsmittel stattfinden.
Die Tatsache, dass die Komplexierung unter Synthesegas über 120 Stunden benötigt,
könnte auf die Kinetik der Hydrierung von COD oder auf eine langsame Ausbildung
einer Flüssigphase aufgrund der niedrigen Selektivität an Hochsiedern im
Porennetzwerk zurückzuführen sein. Mittels 31P-NMR Untersuchungen konnte gezeigt
werden, dass in der Flüssigphase mit dem Präkursor Rh(acac)(CO)2 sofort nach Zugabe
die Carbonylgruppen durch den Liganden verdrängt werden, hingegen bei dem
Präkursor Rh(acac)(COD) die Komplexierung sehr langsam verläuft (siehe Kapitel
VIII).
Aus Abbildung 44 ist zu erkennen, dass der gleiche SILP-Katalysator, der 10 Tage unter
Schutzgas lagerte, eine wesentlich kürzere Aktivierungsphase von 5 Stunden zeigt.
Abbildung 44: Einfluss der Komplexierungskinetik von Rh(acac)(COD) und Benzpinakol auf Umsatz
und Selektivität in der SILP-katalysierten Hydroformylierung von 1-Buten 10 Tage nach der Synthese
des SILP-Katalysators.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 25 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 4 bar;
mSILP-Kat = 0,5 g; Rh(acac)(COD); BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh =
0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten, S2-Propyl-2-heptenal.
Der Umsatz an 1-Buten ist im stationären Zustand um 6 Prozentpunkte höher als bei
dem Versuch zuvor und wird sehr schnell erreicht. Die TOF erreicht einen Wert von
1940 h-1. Die Selektivität an n-Pentanal befindet sich bei 68 %. Dieses Ergebnis zeigt,
0 5 10 15 20 25 30 35 40 45 50 55
0
5
10
15
20
25
30
35
40
45
50
X1-B
ute
n /
%
Zeit / h
0
10
20
30
40
50
60
70
80
90
100
Si /
%

Optimierung des SILP-Katalysatorsystems 87
dass eine Komplexierung von Rh(acac)(COD) mit dem Benzpinakol-Ligand ohne
Anwesenheit von Wasserstoff möglich ist und dass trotz der geringen Menge an
ionischer Flüssigkeit auf dem Träger eine gewisse Mobilität der Komponenten im
Porennetzwerk vorhanden ist. Unter gleichen Reaktionsbedingungen zeigt ein SILP-
Katalysator mit dem Präkursor Rh(acac)(CO)2 einen Umsatz von 6% an 1-Buten und
eine TOF von 710 h-1. Wahrscheinlich weist ein Präkursor, im Vergleich zu einem
sterisch anspruchsvollen Metall-Ligand-Komplex, eine andere Verteilung im
Porennetzwerk auf. Ein Präkursor wird eher in die Mikroporen eindringen als ein
metallorganischer Komplex, der einen kinematischen Durchmesser von annähernd 3 nm
aufweist. Die Verteilung des unkomplexierten Edelmetalls könnte zu mehr aktiven
Zentren in Lösung im Verlauf der Reaktion führen. Denn laut Theorie sollte der aktive
Komplex für den Katalysezyklus unabhängig von der Vorstufe des Edelmetalls sein.
Weiterhin könnten kinetische Effekte eine bessere Aktivität des SILP-Katalysators mit
Rh(acac)(COD) Präkursor bedingen. Das Verhältnis von Rhodium zu Ligand in Lösung
hat einen entscheidenden Einfluss auf die Reaktionsgeschwindigkeit. Im Jahre 1980
stellten d´Oro et al. bereits fest, dass mit zunehmenden Verhältnis von
Triphenylphosphin zu Rhodium die Aktivität abnimmt.[15] Kinetische Messungen
ergeben, dass Triphenylphosphin mit einer negativen Ordnung von -0,7 in den Ansatz
eingeht. Dieser kinetische Effekt könnte ebenfalls aufgrund der Imprägnierung in
Abhängigkeit der Katalysatorvorstufe die gemessene Aktivität beeinflussen. Kinetische
Untersuchungen in Kapitel 8.4 werden diesen Effekt für den Rh-Benzpinakol-Komplex
ebenfalls bestätigen.
7.3 Variation der ionischen Flüssigkeit
Ionische Flüssigkeiten sind laut Theorie und Praxis eine ideale Stoffgruppe zur
Immobilisierung homogener Metallkomplexe auf einem porösen Trägermaterial, da sie
unter technischen Reaktionsbedingungen keinen messbaren Dampfdruck aufweisen.
Die ionische Flüssigkeit sollte eine gute Löslichkeit für den Katalysatorkomplex und die
Substrate aufweisen. Im Zusammenhang mit dem in Kapitel 6.2 vorgestellten Modell
stellt sich der Einfluss der ionischen Flüssigkeit etwas komplexer dar. Um den Einfluss
der IL genauer zu untersuchen, werden SILP-Katalysatoren mit verschieden ionischen
Flüssigkeiten getestet. ILs mit Bis(trifluoromethylsulfonyl)imid [NTf2]- - Anionen sind
nach Jakuttis am stabilsten mit Phosphitsystemen in der SILP-Hydroformylierung.[260]
Die Kationen haben die Struktur 1-R1-3-methylimidazolium [R1MIM]+ und 1-Benzyl-

88 Optimierung des SILP-Katalysatorsystems
3-R1-imidazolium [BzR1IM]+. R1 steht für eine Alkylgruppe der Kettenlängen C1 – C8.
Im Vorfeld des IL-Screenings wird die Löslichkeit des Präkursors Rh(acac)(CO)2, des
Liganden Benzpinakol und des Katalysatorkomplexes in der jeweiligen ionischen
Flüssigkeit, n-Pentanal und 2-Propy-2-heptenal, sowie in Mischungen aus IL und
(Folge-)Produkt untersucht. Die Ergebnisse zeigen, dass der Präkursor, der Ligand und
der Katalysatorkomplex sich gut in dem Aldehyd und in dem Aldolprodukt einlösen. In
allen ionischen Flüssigkeiten ist der Katalysatorkomplex nicht vollständig gelöst und
Feststoffe werden beobachtet. Die ionischen Flüssigkeiten zeigen zudem eine
vollständige Mischbarkeit mit n-Pentanal. Eine Reaktion von n-Pentanal mit dem
Carbenkohlenstoffatom der IL [EMIM][NTf2] kann mittels 1H-NMR-Messungen
ausgeschlossen werden (siehe Anhang X).[261] Die Aktivtäten und die Selektivität an n-
Pentanal sind in Tabelle 13 für die C4-Substrate 1-Buten und Raffinat III
zusammengefasst.
Tabelle 13: Vergleich von Aktivität, Umsatz und Selektivität von SILP-Katalysatoren in Abhängigkeit
der immobilisierten ionischen Flüssigkeit.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 30 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 4 bar;
mSILP-Kat = 0,5 g; Rh(acac)(CO)2; BzP; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh = 0,2 Gew-%; L : Rh
= 10 : 1; St : L = 4 : 1.
Ionische Flüssigkeit C4 – Substrat TOF X1-Buten Sn-Pentanal
h-1 % %
[EMIM][NTf2] 1-Buten 400 13 73
[BMIM][NTf2] 1-Buten 474 15 71
[OMIM][NTf2] 1-Buten 566 18 68
[EMIM][NTf2] Raff III, Charge 1 405 43 75
[BzMIM][NTf2] Raff III, Charge 1 343 39 77
[BzEIM][NTf2] Raff III, Charge 1 225 23 79
[BzBIM][NTf2] Raff III, Charge 1 152 17 81
[BzBzIM][NTf2] Raff III, Charge 1 235 25 79
In der Hydroformylierung von 1-Buten beeinflusst die ionische Flüssigkeit die Aktivität
der SILP-Katalysatoren. Mit zunehmender Alkylkette am Kation steigt die Aktivität um
den Faktor 1,4 an. Die Selektivität an linearem Aldehyd sinkt leicht von 73 % auf 68 %.

Optimierung des SILP-Katalysatorsystems 89
Für die Benzyl-substituierten ILs in der Hydroformylierung von Raffinat III ergibt sich
ein gegenteiliger Effekt. Der Einsatz der ionischen Flüssigkeit [BzMIM][NTf2] ergibt
einen aktiveren SILP-Katalysator als die IL [BzBIM][NTf2]. Auch mit Raffinat III ist
ein Zusammenhang zwischen der Selektivität und der Aktivität zu erkennen. Ein
größerer Umsatz resultiert in einer schlechteren Selektivität. Ein höherer Umsatz führt
zu einem größeren axialen Konzentrationsgradient in der Katalysatorschüttung. Durch
die auftretenden Reaktionen verschieben sich die Verhältnisse der Partialdrücke über
die Schüttung, dies wirkt sich auf die Reaktionsgeschwindigkeiten der einzelnen
Produkte und folglich auf die Selektivität aus (siehe Kapitel 8.4).
Trotz der schlechten Löslichkeit des Katalysatorkomplexes in der ionischen Flüssigkeit
ist deren Einfluss deutlich messbar. Auf welche Weise beeinflusst die ionische
Flüssigkeit die Aktivität der SILP-Katalysatoren, wenn die Reaktion in einer Mischung
aus Aldehyd, Aldolprodukt und IL stattfindet? Unter Berücksichtigung des Modells aus
Kapitel 6.2 ist es schwierig, den Einfluss der ionischen Flüssigkeit auf einen Parameter
zu reduzieren, da das System dynamisch auf äußere Einflüsse reagiert. Es muss
festgestellt werden, ob sich das Produkt und die ionische Flüssigkeit in jedem Verhältnis
mischen lassen. Für n-Pentanal ist dies der Fall. Wenn keine Mischungslücke vorliegt,
spielt der Porenfüllgrad unter Reaktionsbedingungen eine entscheidende Rolle. Das
Verhältnis von IL und Aldehyd/Aldolprodukt beeinflusst die Löslichkeit der Substrate
und deren Diffusionskoeffizienten in der Mischung und indirekt den
Diffusionskoeffizienten in der Gasphase durch das reduzierte Gasvolumen. In
Abbildung 45 ist der Einfluss der ionischen Flüssigkeit auf die Verdampfungsrate (a)
und die Siedepunktskurve (b) für eine Mischung aus n-Pentanal und IL dargestellt. Zur
Bestimmung der Verdampfungsrate wird die IL und n-Pentanal im Massenverhältnis 1
: 1 gemischt und in der TG-Apparatur bei konstant 60 °C und unter 15 ml min-1
Stickstoff vermessen. Reiner Aldehyd verdampft unter diesen Bedingungen sehr
schnell. Mit zunehmender Alkylkettenlängen am Kation der IL wird die
Verdampfungsrate an Aldehyd reduziert, obwohl das molare Verhältnis für das
Stoffsystem [EMIM][NTf2] / n-Pentanal aufgrund des Molekulargewichts der IL am
größten ist. Der gleiche Trend zeigt sich in einer Modellierung mittels der PC-SAFT-
Gleichung in einem T,x-Diagramm.[262] Dieses Verhalten könnte auf die verstärkten
Van-der-Waals-Kräfte zwischen dem Aldehyd und der Alkylkette der IL
zurückzuführen sein.

90 Optimierung des SILP-Katalysatorsystems
a)
b)
Abbildung 45: a) Vergleich von TG-Messungen von der Verdampfung von n-Pentanal und n-Pentanal
gelöst in ionischer Flüssigkeit bei 60 °C und 15 ml min-1 Stickstoff. b) Berechnung eines T,x-Diagramms
n-Pentanal / ionische Flüssigkeit mittels PC-SAFT Gleichung. (Mingquan Xie, M. Sc., Arbeitsgruppe
Prof. Dr. H.J. Freund, CRT Uni-Erlangen-Nürnberg).
n-Pentanal, n-Pentanal / [EMIM][NTf2] n-Pentanal / [BMIM][NTf2], n-Pentanal /
[OMIM][NTf2].
Für die SILP-Katalyse nach dem neuen Modell bedeutet dies, dass durch die Art der
ionischen Flüssigkeit der Porenfüllgrad unter Reaktionsbedingungen beeinflusst wird.
Dies kann unter Berücksichtigung der Ergebnisse in Abbildung 45 einerseits zu einer
größeren Anzahl an aktiven Zentren in Lösung führen oder den Stofftransport zum
Positiven oder zum Negativen beeinflussen. Da der Diffusionskoeffizient Di,l umgekehrt
proportional zur Viskosität des Lösungsmittels ist, wäre ein hohes Verhältnis an
Produkt/IL für den Diffusionskoeffizienten vorteilhaft.
7.4 Einsatz industriell relevanter Träger
Silica Gel 100 mit einer Körnung von 0,063 – 0,200 mm stellt einen effektiven Träger
in der SILP-katalysierten Hydroformylierung dar.[260] Für den technischen Einsatz ist
dieser Träger gänzlich ungeeignet, wie Druckverlustmessungen zeigen. In Abbildung
46 ist der Druckverlust pro Länge Festkörperschüttung gegen die
Leerrohrgeschwindigkeit für Silica 100 dargestellt.
0 1 2 3 4 5 60,70
0,75
0,80
0,85
0,90
0,95
1,00
mi(t
) / m
0
Zeit / h
T = 60 °C, N2
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
375
380
385
390
395
400
Tem
pe
ratu
r / K
xIL / -
PC-SAFT

Optimierung des SILP-Katalysatorsystems 91
Abbildung 46: Druckverlust pro Länge Festkörperschüttung gegen die Leerrohrgeschwindigkeit für
Silica 100, dP = 0,063 – 0,200 mm, Fluid Helium, Raumtemperatur. (Messaufbau und –durchführung
siehe Anhang XI)
Die Werte sind Mittelwerte aus Druckverlustmessungen bei verschiedenen
Schütthöhen. Die berechneten Werte beruhen auf der Ergun-Gleichung zur Abschätzung
des Druckabfalles.[263] Die Ergun-Gleichung berücksichtigt nur Vollmaterialpartikel.
Untersuchungen zeigen jedoch, dass Strömungsungleichverteilungen durch die
Porosität ε des Trägers nur einen marginalen Unterschied bei der Berechnung des
Druckverlustes nach Ergun ergeben.[264-265] Da die Porosität ε´ der Schüttung nicht
bekannt ist, wird die Ergun-Gleichung so modifiziert, dass der Parameter ε´ zur
Anpassung der errechneten Werte an die gemessenen Werte dient (Herleitung siehe
XI.I). Nach der Methode der kleinsten Quadrate ergibt sich eine Porosität von ε´ = 0,32
für die Silica 100 – Schüttung. Die ermittelte Bettporosität entspricht einer zufälligen
Packung runder Partikel.[266]
Als technische Träger werden SiO2-basierte Träger mit den Handelsnamen „Siliperl“
und „Aerolyst“ getestet. Der Träger „Siliperl“ ist ein Granulat mit einer
Partikelgrößenverteilung von 1,0 – 2,0 mm. „Aerolyst“ ist ein Extrudat von amorphem
SiO2, das durch Flammenhydrolyse hergestellt wird. Die Extrudate sind stäbchenförmig
und haben einen Durchmesser von 1,6 mm bei variabler Länge bis 2 mm. Die Träger
wurden von Evonik Industries AG bereitgestellt. Für beide technische Träger ist der
0,00 0,05 0,10 0,15 0,20 0,25 0,30
0
1000
2000
3000
4000
5000
6000
p
L-1 /
mb
ar
m-1
Leerrohrgeschwindigkeit / m s-1
gemessen
berechnet

92 Optimierung des SILP-Katalysatorsystems
messbare Druckverlust < 10 mbar unter den gemessenen Volumenströmen. Die
technischen Träger wurden nicht unter Rühren nass imprägniert, da durch die
mechanische Belastung der Abrieb zu Verlusten an Trägermaterial und folglich auch an
Edelmetall geführt hätte. Daher wurde Ultraschall zur Unterstützung der Imprägnierung
eingesetzt, um eine homogene Verteilung der Komponenten auf dem Träger zu
bewirken.
In Abbildung 47 ist der Umsatz- und Selektivitätsverlauf eines SILP-Katalysators mit
dem Träger „Siliperl“ bei sinkendem Gesamtvolumenstrom von 30 ml min-1 auf 15 ml
min-1 mit ΔV = 5 ml min-1 abgebildet.
Abbildung 47: Stabilitätsuntersuchungen eines SILP-Katalysators präpariert mit dem technischen
Träger SiO2 Siliperl.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 15 - 30 ml min -1; pRaff-III,2 = 2 bar; pH2 = 4 bar; pCO = 4
bar; mSILP-Kat = 3 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; SiO2 - Siliperl (kalz.); α = 0,1;
wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten.
Der Umsatz an 1-Buten steigt mit sinkenden Volumenstrom von 35 % auf 60 % an. Das
Katalysatorsystem reagiert sofort auf die Änderung der Verweilzeit. Für einen SILP-
Katalysator mit Silica 100 als Trägermaterial ist der Umsatz im Vergleich acht
Prozentpunkte größer. „Siliperl“ ist anhand der morphologischen Daten, wie
Porenvolumen und spezifischen Oberfläche, dem Silica 100 sehr ähnlich (Silica 100:
0 5 10 15 20 25 30 35 40 45 50 55 60 65
0
10
20
30
40
50
60
70
80
90
100
X1-B
ute
n, R
aff
III /
%
Zeit / h
0
10
20
30
40
50
60
70
80
90
100
Si /
%

Optimierung des SILP-Katalysatorsystems 93
356 m2 g-1, dPore = 10,4 nm; Siliperl: 333 m2 g-1, dPore = 8,9 nm). Die Größe der Partikel
stellt jedoch den signifikantesten Unterschied zwischen diesen Trägern dar. Durch die
Anordnung der Katalysatorpartikel ergeben sich an der Reaktorwand Kanäle, die dem
Gas einen geringeren Strömungswiderstand entgegensetzen, wodurch höhere
Strömungsgeschwindigkeiten in Randnähe auftreten. Die daraus resultierenden
Inhomogenität in den Strömungsgeschwindigkeitsprofilen kann zu starken
Unterschieden der Reaktorleistung über den Querschnitt führen.[267] Das führt
letztendlich zu einer sinkenden Wahrscheinlichkeit für die Gase in die Poren des Trägers
zu diffundieren. Laut Dautzenberg und Perego et al. sollte das Verhältnis von
Reaktordurchmesser zum Partikeldurchmesser mindestens 10 betragen, damit der
Einfluss des Strömungsprofil auf die Reaktorleistung möglichst gering ausfällt.[228, 268]
Diese Bedingung ist mit dem Trägermaterial „Siliperl“ (dP = 1,0 – 2,0 mm) nicht
gegeben, da der Durchmesser des Reaktors 10 mm beträgt. Eine Änderung der
Verweilzeit beeinflusst die Selektivitäten nicht signifikant. Die n-Pentanal-Selektivität
sinkt von 78 auf 72 %. Dies dürfte eher kinetischen Gründen aufgrund des axialen
Konzentrationsgradienten bei höheren Umsätzen geschuldet sein. In Kapitel 8.4 wird
unter Berücksichtigung der Kinetik die Abhängigkeit der Partialdrücke auf das
Reaktionsnetzwerk dargestellt.
In Abbildung 48 ist ein Langzeitversuch über 450 Stunden für einen SILP-Katalysator
auf dem technischen Träger „Aerolyst“ dargestellt. Die Verweilzeit wurde über 80
Stunden schrittweise erhöht, analog dem Versuch in Abbildung 47. Der
Gesamtvolumenstrom von 15 ml min-1 wurde über die restliche Versuchslaufzeit
konstant gehalten. Die Lücken in den Verläufen sind auf Ausfälle der online GC-
Analytik zurückzuführen.
Durch die Reduzierung des Gesamtvolumenstroms in den ersten 80 Stunden erhöht sich
der Umsatz an 1-Buten von 26 % auf 44 %. Aufgrund der regellosen Schüttung der
stäbchenförmigen Partikel treten Kurzschlussströmungen in dem Laborreaktor verstärkt
auf. Daher ist der Umsatz im Vergleich zu den SILP-Katalysatoren mit den vorher
getesteten SiO2-Trägern niedriger. Über den restlichen Versuchsverlauf ist eine
kontinuierliche Deaktivierung bis auf einen Umsatz von 22 % 1-Buten zu beobachten.
Unter Betrachtung der Ergebnisse von Jakuttis et al. ist die Deaktivierung vordergründig
auf den Einfluss des Trägers zurückzuführen, da unter vergleichbaren
Reaktionsbedingungen über 800 Stunden keine Deaktivierung festgestellt wurde.[198]

94 Optimierung des SILP-Katalysatorsystems
Abbildung 48: Stabilitätsuntersuchungen eines SILP-Katalysators präpariert mit dem technischen
Träger SiO2 Aerolyst. Anzahl an Datenpunkten reduziert.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 15 - 30 ml min -1; pRaff-III,2 = 2 bar; pH2 = 4 bar; pCO = 4
bar; mSILP-Kat = 3 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; SiO2 - Aerolyst (kalz.); α = 0,1;
wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten.
Jakuttis et al. setzen Silica 100 als Trägermaterial ein, das auch standardmäßig in dieser
Arbeit verwendet wird. Da beide Träger vor der Präparation des SILP-Katalysators unter
gleichen Bedingungen kalziniert wurden, ist eine Deaktivierung aufgrund von
Oberflächengruppen des Trägers unwahrscheinlich. Die massenbezogene spezifische
Oberfläche des Trägers „Aerolyst“ ist um das 2,7-fache kleiner als die Oberfläche des
Trägers Silica 100. Die Porenweite des „Aerolyst“-Trägers beträgt durchschnittlich 22
nm. Damit sind die Kapillarkräften geringer und der Porenfüllgrad durch Akkumulation
von Produkt ist reduziert im Vergleich zu den 10 nm Poren des Trägers Silica 100.
Daraus resultieren lokal höhere Konzentrationen an Katalysator, Ligand, ionischer
Flüssigkeit und Stabilisator. Zusammen mit dem höheren Umsatz bei verlängerter
Verweilzeit wird dadurch die Bildung von Hochsiedern begünstigt, die letztendlich zur
Deaktivierung des SILP-Katalysators führen. Die Aldolprodukte können sich negativ
auf den Stofftransport auswirken, da eine Oligomerisierung der Aldehyde durch die
Anreicherung im Porennetzwerk nicht ausgeschlossen werden kann. Zum anderen führt
die Aldolkondensation zur Bildung von Wasser und dieses führt wiederum durch
Hydrolyse zur Zersetzung des Diphosphitliganden in sogenannte sekundäre
0 50 100 150 200 250 300 350 400 450 500
0
10
20
30
40
50
60
70
80
90
100
X1-B
ute
n, R
aff
III /
%
Zeit / h
0
2
4
6
8
10
12
14
40
50
60
70
80
90
100
Si /
%

Optimierung des SILP-Katalysatorsystems 95
Phosphinoxide.[58] Fragmente des zersetzten Liganden scheinen eine geringere Affinität
zum dem Edelmetall zu besitzen, sowohl die n-Pentanal-Selektivität (annährend 80 %)
und die n:iso-Selektivität in der Deaktivierungsphase nicht beeinflusst werden. Ebenso
wäre eine Inaktivierung des aktiven Zentrums durch Abbauprodukte des Liganden
denkbar, da diese ebenfalls mit dem Rhodium einen Komplex bilden könnten.
Zusammenfassend kann festgestellt werden, dass eine Imprägnierung technischer
Träger mittels Nassimprägnierung durch Ultraschall möglich ist und SILP-
Katalysatoren mit technisch relevanten Trägern aktiv in der
Gasphasenhydroformylierung von Raffinat III sind. Ein SILP-Katalysator basierend auf
dem technischen Träger „Aeroylst“ ist nicht langzeitstabil unter den gewählten
Reaktionsbedingungen. Die Folgereaktionen der Aldehyde zusammen mit der
Akkumulation im Porennetzwerk stellen das größte Problem für die Langzeitstabilität
der SILP-Katalysatoren mit Phosphit-Liganden dar.

96 Kinetische Untersuchungen
8 Kinetische Untersuchungen
8.1 Durchführung der kinetischen Messungen
Für die kinetischen Messungen wird der Strömungsrohrreaktor mit einem
Innendurchmesser von 4,6 mm verwendet (siehe Kapitel 4.3). Durch Anpassen der
Verweilzeit werden die Umsätze an 1-Buten kleiner 10 % gehalten. Dadurch werden
etwaige Verfälschungen der Kinetik aufgrund von Temperatureffekten oder zu großen
axialen Konzentrationsgradienten vermieden. Zudem kann in erste Näherung
angenommen werden, dass der Porenfüllgrad, der sich unter Reaktionsbedingungen
aufgrund der Akkumulation der Produkte ergibt, vernachlässigt werden kann. Im
stationären Zustand ist somit auch die Veränderung von aktiven Katalysatorzentren in
erster Näherung konstant. Für die Auswertung der kinetischen Daten werden mindestens
zehn Datenpunkte zu jedem Betriebspunkt unter stationären Bedingungen
aufgenommen. Die kinetische Modellierung bezieht sich ausschließlich auf die durch
den Rhodium-Komplex katalysierten Reaktionen.
In der Literatur existieren zahlreiche Artikel, in denen der Zusammenhang zwischen der
Ligandstruktur, der Komplexierung, der räumlichen Anordnung, der katalytisch aktiven
Spezies und der Regioselektivität beschrieben wird.[269-272, 53] Eine Verknüpfung dieser
Daten zur Entwicklung kinetischer Ansätze besteht nur in Ansätzen. Ein
mechanistisches Verständnis ist für die Entwicklung eines kinetischen Ansatzes jedoch
essentiell. Unter Berücksichtigung des Katalysezyklus für die Hydroformylierung gibt
es theoretische und mechanistische Ansätze in einphasigen und zweiphasigen Systemen
in der Literatur.[273-281] Für die SILP-Katalyse am Beispiel der Hydroformylierung sind
kinetische Modelle der Arbeitsgruppen um Wasserscheid und Bell vorhanden.[282-283, 199]
Diese Arbeiten fokusieren primär auf der Zielreaktion, der Hydroformylierung, und auf
die Steigerung der n:iso-Selektivität. Nebenreaktionen werden nur unvollkommen oder
nicht in der Kinetik berücksichtigt. Bis heute gibt es sehr wenige Ansätze, die das
gesamte Netzwerk an Reaktionen von Olefinen und Synthesegas unter
Reaktionsbedingungen für die Hydroformylierung in Abhängigkeit des Liganden
beschreiben.[284, 61] Aus diesem Grund soll in diesem Kapitel ein kinetischer Ansatz unter
Berücksichtigung des Reaktionsnetzwerkes entwickelt werden, mit dem Ziel, die
Reaktionsbedingungen und letztlich die Ausbeute an linearem Aldehyd zu optimieren.

Kinetische Untersuchungen 97
Kinetische Modellierung von homogen katalysierten Reaktionen basieren auf zwei
Modellansätzen: Auf empirischen Modellgleichungen und Gleichungen, die auf einen
katalytischen Mechanismus aufbauen und eine genau definierte katalytisch aktive
Spezies berücksichtigen.[268] Zur Beschreibung der Kinetik werden Potenzansätze
verwendet, da diese oftmals leichter zu handhaben und ausreichend sind, um das
Prozessverhalten zu simulieren. Hyperbolische Ansätze, wie sie verstärkt auch für
homogen-katalysierte Reaktionen zum Einsatz kommen, geben ein umfassenderes Bild
auf den katalytischen Mechanismus und deren Teilschritte ab.[285] Allerdings müssen
quantenchemische Kenntnisse über den Zyklus vorhanden sein, um fundierte Aussagen
treffen zu können. Ein weiteres generelles Problem für die Entwicklung mechanistischer
Ansätze ist die Bewertung der Vielzahl der zu bestimmenden und oft verknüpften
Parameter. Körkel stellt zur Parameterschätzung bei nichtlinearen Differential-
Algebraischen-Gleichungs-(DAE)-Modellen fest, dass eine steigende Anzahl an
Parametern bei der Modellvalidierung von experimentellen Daten dazu neigt, größere
Konfidenzintervalle zu erhalten.[286]
8.2 Analyse der Messdaten
Bevor ein kinetisches Modell aufgestellt werden kann, sollte eine möglichst genaue
Analyse der Messdaten erfolgen. Da die Änderung der Zusammensetzung bei kleinen
Umsätzen im Reaktor gering ist, kann auch die Temperatur im Reaktor als konstant
angesehen werden. Es wird praktisch eine Stoffmengenänderungsgeschwindigkeit Ri
gemessen, welche der mittleren Zusammensetzung und Temperatur zugeordnet werden
kann.
��𝑖 = ��𝑖 − ��𝑖,0𝑚𝑆𝐼𝐿𝑃−𝐾𝑎𝑡
=∑𝜐𝑖𝑗𝑟𝑗𝑗
(8-1)
In den folgenden Abbildungen sind die gemessenen Stoffmengenänderungs-
geschwindigkeiten in Abhängigkeit der jeweiligen Eduktkonzentrationen bei einer
Reaktionstemperatur von 100 °C aufgetragen. Die Rohdaten sind in Kapitel XII
dargestellt. Die Messungen wurden bei einer GHSV von 91000 mGas3N mSILP-Kat
-3 h-1 bzw.
einer WHSV von 2,3 h-1 durchgeführt. Unter den gemessenen Reaktionsbedingungen ist
die n:iso-Selektivität > 99 %. Ein Einfluss der Reaktionsbedingungen auf die
Regioselektivität kann ausgeschlossen werden und wird nicht in der Kinetik
berücksichtigt. Die Löslichkeit der Edukte ist in Flüssigphasenreaktionen ein wichtiger

98 Kinetische Untersuchungen
Parameter, da die Konzentrationen bzw. die Konzentrationsverhältnisse in der Gasphase
unterschiedlich zur Flüssigphase sind. Nach der neuen Modellvorstellung ist das
Lösungsmittel aus Produkten und IL ein sehr dynamischer Parameter und nur
unzureichend modellierbar. In erster Näherung kann der Einfluss des Porenfüllgrades
unter Reaktionsbedingungen bei kleinen Umsätzen vernachlässigt werden. Der Einfluss
der Edukte auf die Kinetik bezieht sich daher vereinfachend nur auf deren
Konzentrationen in der Gasphase.
Abbildung 49 a) zeigt die Abhängigkeit der Bildungsgeschwindigkeiten zu den
jeweiligen Produkten als Funktion des Partialdruckes an Wasserstoff. Mit steigendem
Wasserstoffpartialdruck steigen die Stoffmengenänderungsgeschwindigkeiten bzw. der
Umsatz an 1-Buten an. Der Einfluss des Partialdruckes an Kohlenstoffmonoxid auf die
Reaktionsrate in der Gasphase zeigt, dass diese auf die Bildung von n-Pentanal keinen
signifikanten Einfluss hat. Dem entgegen sinken die
Stoffmengenänderungsgeschwindigkeiten für die Nebenprodukte stark mit
zunehmenden Partialdruck an Kohlenstoffmonoxid. Die Abspaltung von
Kohlenstoffmonoxid aus dem Präkatalysator (Spezies 2 in Abbildung 9) führt zu dem
katalytisch aktiven Rhodium(I)-Komplex (16 ve). Dieses Gleichgewicht wird durch den
Partialdruck an CO beeinflusst. Mit steigender Konzentration liegt das Gleichgewicht
mehr auf Seite der 18 ve-Spezies, daraus resultiert eine sinkende globale
Stoffmengenänderungsgeschwindigkeit. Ein steigender Partialdruck an CO führt zu
einer wahrscheinlicheren Insertion von CO in den Rh-Alkylkomplex und somit zu einer
Steigerung der Bildungsrate für n-Pentanal gegenüber den Nebenprodukten. Ein
steigender Partialdruck an 1-Buten führt zu einer Steigerung der Bildungsrate aller
aufgeführten Produkte.
Zusammenfassend kann festgestellt werden, dass die Stoffmengenänderungs-
geschwindigkeiten und damit die Selektivität durch die Edukte 1-Buten, H2 und CO
beeinflusst werden. Mit Blick auf den postulierten Katalysezyklus in Kapitel 2.2 lassen
sich die gemessenen Abhängigkeiten deuten. Die Ausbildung des
Alkyldicarbonylrhodium-Komplexes (E), der für eine hohe Selektivität zum Aldehyd
nötig ist, wird durch einen hohen CO-Partialdruck begünstigt. Die Ausbildung eines iso-
Alkylrhodium-Komplexes führt zu den Butenisomeren oder dem verzweigten Aldehyd.
Eine CO-Insertion in diesen Komplex wird aber auch unter hohen Isomerisierungsraten
nicht beobachtet, da unter den gemessen Versuchsbedingungen die n:iso-Selektivität >
99 % ist. Dieses Verhalten ist auf den sterischen Anspruch des Liganden zurückzuführen
und nicht auf die Kinetik der Reaktion.^

Kinetische Untersuchungen 99
a)
b)
c)
Abbildung 49: Variation der Eduktzusammensetzung am Rh-BzP-SILP-Katalysator im Strömungsrohr.
a) Variation des Wasserstoff-Partialdruckes, b) Variation des Kohlenstoffmonoxid-Partialdruckes, c)
Variation des Partialdruckes an 1-Buten.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 25 ml min -1; p1-Buten = 0,5 - 2 bar; pH2 = 1 - 4 bar; pCO =
2 - 4 bar; pHe = 0,5 – 3 bar; mSILP-Kat = 0,5 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica
100 (kalz.); α = 0,1; wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
n-Pentanal, n-Butan, trans-2-Buten, cis-2-Buten.
8.2.1 Potenzansätze
Potenzansätze bieten eine einfache Möglichkeit, um das Reaktionsgeschehen zu
beschreiben. Im Folgenden soll geklärt werden, ob die SILP-katalysierte
Hydroformylierung von 1-Buten durch Potenzansätze beschrieben werden kann. Die
Analyse der Messdaten erfolgt nach der Differentialmethode. Es ergibt sich folgender
formaler Zusammenhang der Reaktionsgeschwindigkeit zu dem jeweiligen Produkt in
Abhängigkeit der Edukte:
1x105
2x105
3x105
4x105
0,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
Ri /
mm
ol kg
-1 s
-1
pH
2
/ Pa2,0x10
52,5x10
53,0x10
53,5x10
54,0x10
50,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
Ri /
mm
ol kg
-1 s
-1
pCO
/ Pa
5,0x104
1,0x105
1,5x105
2,0x105
0,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
Ri /
mm
ol kg
-1 s
-1
p1-Buten
/ Pa

100 Kinetische Untersuchungen
𝑅𝑖 = 𝑟𝑖 = 𝑘𝑖 𝑝𝐻2𝑛 𝑝𝐶𝑂
𝑚 𝑝1−𝐵𝑢𝑡𝑒𝑛𝑞
𝑖𝑛 𝑚𝑚𝑜𝑙
𝑘𝑔 𝑠 (8-2)
mit i=n-Pentanal, n-Butan, cis-2-Buten, trans-2-Buten
𝑘𝑖 = 𝑘𝑖,𝐻2 ∙ 𝑘𝑖,𝐶𝑂 ∙ 𝑘𝑖,1−𝐵𝑢𝑡𝑒𝑛 (8-3)
In Abbildung 50 a)-d) ist die logarithmierte Stoffmengenänderungsgeschwindigkeit
gegen den logarithmierten Partialdruck des jeweiligen Eduktes aufgetragen. Die
Reaktionsordnung entspricht der Steigung und die Geschwindigkeitskonstante dem y-
Achsenabschnitt.
a)
b)
c)
Abbildung 50: Doppelt-logarithmische Darstellung der Konzentrationsabhängigkeit am Rh-BzP-SILP-
Katalysator zur Bestimmung der Reaktionsordnungen nach der Differentialmethode. a) Variation des
Wasserstoff-Partialdruckes, b) Variation des Kohlenstoffmonoxid-Partialdruckes, c) Variation des
Partialdruckes an 1-Buten.
n-Pentanal, n-Butan, trans-2-Buten, cis-2-Buten.
Es ergeben sich folgende Parameter für die Potenzansätze:
11,4 11,6 11,8 12,0 12,2 12,4 12,6 12,8 13,0-3,0
-2,5
-2,0
-1,5
-1,0
-0,5
0,0
0,5
ln(R
i) / -
ln(pH
2
) / -
12,2 12,3 12,4 12,5 12,6 12,7 12,8 12,9 13,0
-2,0
-1,5
-1,0
-0,5
0,0
0,5
ln
(Ri)
/ -
ln(pCO
) / -
10,8 11,0 11,2 11,4 11,6 11,8 12,0 12,2 12,4
-3,5
-3,0
-2,5
-2,0
-1,5
-1,0
-0,5
0,0
0,5
ln(R
i) / -
ln(p1-Buten
) / -

Kinetische Untersuchungen 101
Tabelle 14: Ergebnisse der Parameterbestimmung nach dem Potenzmodell
Ri / mmol kg-1
s-1
ki / mmol kg-1
s-1 Pa-(n+m+q)
pH2n / Pa pCO
m / Pa p1-Butenq
/ Pa
n-Pentanal 2,24 · 10-4 n = 0,21 m = -0,15 q = 0,65
n-Butan 2,1 · 101 n = 0,63 m = -1,86 q = 0,92
trans-2-Buten 3,27 · 101 n = 0,51 m = -1,97 q = 1,09
cis-2-Buten 1,25 · 102 n = 0,48 m = -1,95 q = 1,07
Die Geschwindigkeitskonstanten, die die Proportionalität zwischen der
Bildungsgeschwindigkeit und der Konzentration der Edukte herstellen, weisen für die
Isomerisierungsreaktion die größten Werte auf. Eine Änderung der Konzentration hat
somit einen größeren Einfluss auf die Isomerisierungsgeschwindigkeit. Die Tatsache,
dass die gemessenen Bildungsraten aus Abbildung 49 für n-Pentanal größer sind als für
2-Buten hängt mit dem Reaktionspartner Kohlenstoffmonoxid zusammen. Die
Reaktionsordnungen für CO haben für die Nebenreaktionen Werte von -1,97 – -1,86.
Wie bereits im vorherigen Kapitel diskutiert, beeinflusst der CO-Partialdruck die
Ausbildung des aktiven 16-ve-Komplexes und die Gleichgewichte der Teilschritte rund
um die Alkylrhodium-Spezies. Für Wasserstoff wird eine Reaktionsordnung von 0,21
für die Hydroformylierungsreaktion bestimmt. Die Konzentration an Wasserstoff hat
somit einen untergeordneten Einfluss auf die Kinetik der Hydroformylierung im
Vergleich zur Konzentration an 1-Buten, das mit einer Ordnung von 0,65 in den
Potenzansatz eingeht. Die positive Abhängigkeit der Hydrierungsreaktion vom
Wasserstoffpartialdruck lässt sich mit der Stöchiometrie der Reaktion und dem
Katalysezyklus erklären. Der Einfluss auf die Isomerisierungsreaktion kann dagegen
nicht mit dem Zyklus aus Abbildung 9 erklärt werden. Denn laut diesem Zyklus wird
Wasserstoff nur für die irreversible Ausbildung der aktiven Spezies benötigt. Die
bestimmten Ordnungen bezüglich 1-Buten zeigen, dass der Partialdruck an 1-Buten
einen größeren Einfluss auf die Bildungsraten der Nebenreaktion hat als auf die Rate
der Hydroformylierung.
Es kann festgehalten werden, dass die ermittelten Potenzansätze die Ergebnisse und
Interpretationen aus dem vorangegangenen Kapitel wiedergeben. Die Größenordnungen

102 Kinetische Untersuchungen
der Reaktionsordnungen lassen Rückschlusse auf das Reaktionsnetzwerk zu. Die
Modellierung des Reaktionsnetzwerkes mit den erhaltenen
Stoffmengenänderungsgeschwindigkeiten zeigt, dass sich nahezu alle Werte in einem
Fehlerbereiche von ± 10 % anpassen lassen. Die bisherigen standardmäßig eingestellten
Partialdrücke von p1-Buten = 2 bar, pH2 = 4 bar und pCO = 4 bar stellen offensichtlich nicht
das Optimum hinsichtlich Aktivität und Selektivität dar.
a) n-Pentanal
b) n-Butan
c) trans-2-Buten
d) cis-2-Buten
Abbildung 51: Ergebnisse der Modellierung des Reaktionsnetzwerkes der Hydroformylierung von 1-
Buten am Rh-BzP-SILP-Katalysator bei 100 °C und 10 bar Gesamtdruck.
8.2.2 Hyperbolische Ansätze
Obwohl die Potenzansätze das Reaktionsnetzwerk in dem untersuchten Messbereich gut
beschreiben, geben sie nur ein unvollständiges Bild der Teilschritte der Katalyse wieder.
0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,40,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
- 10 %
Ri,b
ere
ch
ne
t / m
mol kg
-1 s
-1
Ri,gemessen
/ mmol kg-1 s
-1
+ 10 %
0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,40,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
Ri,b
ere
ch
ne
t / m
mol kg
-1 s
-1
Ri,gemessen
/ mmol kg-1 s
-1
+ 10 %
- 10 %
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,70,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
Ri,b
ere
ch
ne
t / m
mol kg
-1 s
-1
Ri,gemessen
/ mmol kg-1 s
-1
+ 10 %
- 10 %
0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,40,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
Ri,b
ere
ch
ne
t / m
mol kg
-1 s
-1
Ri,gemessen
/ mmol kg-1 s
-1
- 10 %
+ 10 %

Kinetische Untersuchungen 103
Hyperbolische Ansätze, die in der heterogenen Katalyse zur Mechanismusaufklärung
verwendet werden, liefern ein detaillierteres Bild über die einzelnen Teilschritte des
Katalysezyklus.[285] Die Bestimmung hyperbolischer Geschwindigkeitsgesetzte basiert
auf dem Katalysezyklus aus Kapitel 2.2. Die 16-ve Spezies (B) bildet die freie
Koordinationsstelle Θ0 in Analogie zur heterogenen Katalyse. Daraus ergeben sich die
folgenden Reaktionsgeschwindigkeiten bezüglich der Produkte und der jeweiligen
Teilschritte.
Hydroformylierung zu n-Pentanal:
𝑟1 = 𝑘1 ∙ 𝜃𝐴 − 𝑘−1 ∙ 𝑝𝐶𝑂 ∙ 𝜃0 𝑚𝑖𝑡 𝜃0 = 𝜃𝐵 (8-4)
𝑟2 = 𝑘2 ∙ 𝑝1−𝐵𝑢𝑡𝑒𝑛 𝜃0 − 𝑘−2 ∙ 𝜃𝐶 (8-5)
𝑟3 = 𝑘3 ∙ 𝜃𝐶 − 𝑘−3 ∙ 𝜃𝐷 (8-6)
𝑟4 = 𝑘4 ∙ 𝑝𝐶𝑂 ∙ 𝜃𝐷 − 𝑘−4 ∙ 𝜃𝐸 (8-7)
𝑟5 = 𝑘5 ∙ 𝜃𝐸 − 𝑘−5 ∙ 𝜃𝐹 (8-8)
𝑟6 = 𝑘6 ∙ 𝑝𝐻2 ∙ 𝜃𝐹 − 𝑘−6 ∙ 𝜃𝐺 (8-9)
𝑟7 = 𝑘7 ∙ 𝜃𝐺 (8-10)
Hydrierung zu n-Butan:
𝑟1 = 𝑘1 ∙ 𝜃𝐴 − 𝑘−1 ∙ 𝑝𝐶𝑂 ∙ 𝜃0 𝑚𝑖𝑡 𝜃0 = 𝜃𝐵 (8-11)
𝑟2 = 𝑘2 ∙ 𝑝1−𝐵𝑢𝑡𝑒𝑛 𝜃0 − 𝑘−2 ∙ 𝜃𝐶 (8-12)
𝑟3 = 𝑘3 ∙ 𝜃𝐶 − 𝑘−3 ∙ 𝜃𝐷 (8-13)
𝑟8 = 𝑘8 ∙ 𝑝𝐻2 ∙ 𝜃𝐷 − 𝑘−8 ∙ 𝜃𝐻 (8-14)
𝑟9 = 𝑘9 ∙ 𝜃𝐻 (8-15)

104 Kinetische Untersuchungen
Isomerisierung zu trans-2-Buten bzw. cis-2-Buten:
Für die Isomerisierung wird angenommen, dass diese nach einem Metallhydrid-
Insertions-Eliminations-Mechanismus abläuft und nicht über einen π-Allyl-
Metallhydrid-Mechanismus.
𝑟1 = 𝑘1 ∙ 𝜃𝐴 − 𝑘−1 ∙ 𝑝𝐶𝑂 ∙ 𝜃0 𝑚𝑖𝑡 𝜃0 = 𝜃𝐵 (8-16)
𝑟2 = 𝑘2 ∙ 𝑝1−𝐵𝑢𝑡𝑒𝑛 𝜃0 − 𝑘−2 ∙ 𝜃𝐶 (8-17)
𝑟10 = 𝑘10 ∙ 𝜃𝐶 − 𝑘−10 ∙ 𝜃𝐼 (8-18)
𝑟11 = 𝑘11 ∙ 𝜃𝐼 − 𝑘−11 ∙ 𝜃𝐽 (8-19)
𝑟12 = 𝑘12 ∙ 𝜃𝑗 − 𝑘−12 ∙ 𝑝2−𝐵𝑢𝑡𝑒𝑛 ∙ 𝜃0 (8-20)
Wird nun ein kinetisches Modell aus diesen Gleichungen abgeleitet, ist zunächst der
sogenannte geschwindigkeitsbestimmende Schritt (eng: RDS – rate determining step)
unbekannt. Die Reaktionsgeschwindigkeiten werden unter der Annahme aufgestellt,
dass jeder Teilschritt im Katalysezyklus der geschwindigkeitsbestimmende Schritt sein
könnte. Alle abgeleiteten Ansätze sind im Anhang in Kapitel XIII dargestellt. Für die
Formulierung der Reaktionsgeschwindigkeitsansätze soll folgende Bedingung gelten:
𝜃0 + ∑𝜃𝑖
𝑛
𝑖=1
= 1 (8-21)
Die Bestimmung der Reaktionsgeschwindigkeitskonstanten und der
Gleichgewichtskonstanten wird mittels einer nicht-linearen Regressionsanalyse
durchgeführt. Der Reaktionsgeschwindigkeitsansatz, der durch die Parametrisierung die
geringste Abweichung von den experimentell ermittelten Reaktionsgeschwindigkeiten
zeigte, wurde als geschwindigkeitsbestimmender Schritt postuliert. Für die
Hydroformylierung von 1-Buten zu n-Pentanal wird für dieses System die Insertion des
Olefins in die Rh-H-Bindung (Reaktionsschritt r3 in Abbildung 12) zu dem n-
Alkylrhodium(I)-Komplex als RDS abgleitet (8-22).
𝑟3 =𝑘3 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
(8-22)

Kinetische Untersuchungen 105
Für die Hydrierung wird das beste Modell basierend auf dem Reaktionsschritt 8, der
oxidativen Addition von Wasserstoff, abgeleitet.
𝑟8 =𝑘8 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
(8-23)
Für die Isomerisierung zu trans-2-Buten und cis-2-Buten stellt sich ebenfalls die
Insertion des Olefins (Reaktionsschritt 10) zum dem iso-Alkylrhodium(I)-Komplex als
RDS heraus.
𝑟10 =𝑘10 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
(8-24)
Die Paramater der Regressionsanalyse sind in Tabelle 15 aufgelistet. Abbildung 52
vergleicht die gemessenen und berechneten Kurven entsprechend den gebildeten
Produkten ausgehend von 1-Buten und Synthesegas.
Tabelle 15: Parameteranalyse für das hyperbolische Modell nach dem Katalysezyklus basierend auf der
Rhodium(I)-Spezies.
r3, n-Pentanal r8, n-Butan
k3 / mmol kg-1 s-1 Pa-1 2,01 k8 / mmol kg-1 s-1 Pa-2 0,57
K1 / - 3,80 K1 / - 2,6 ·10-3
K2 / - 0,94 K2 / - 5,0 ·10-3
K3 / - 0,14
r10, trans-2-Buten r10, cis-2-Buten
k10 / mmol kg-1 s-1 Pa-1 2660,0 k10 / mmol kg-1 s-1 Pa-1 7945,0
K1 / - 1,1 · 10-4 K1 / - 1,1 · 10-4
K2 / - 0,91 K2 / -
0,91

106 Kinetische Untersuchungen
n-Pentanal:
n-Butan:
trans-2-Buten:
cis-2-Buten:
Abbildung 52: Modellierung des Reaktionsnetzwerkes mit hyperbolischen Ansätzen basierend auf dem
postulierten Rh(I)-Katalysezyklus. 1-Buten, CO, H2, berechnet.
Die Abhängigkeit der Hydroformylierung von 1-Buten zu n-Pentanal kann in einem
Fehlerbereich von ± 20 % wiedergegeben werden. Die Abhängigkeit des
Wasserstoffpartialdruckes ist in r3 nicht enthalten. Die formalkinetischen Ansätze
zeigten bereits, dass die Ordnung bezüglich Wasserstoff annährend null ist und somit
die Konzentration in der Gasphase keinen signifikanten Einfluss auf die
Reaktionsgeschwindigkeit der Hydroformylierung hat. Für Rhodium-Komplexe mit
zweizähnigen Liganden wird laut Literatur oft die Koordination oder die Insertion des
Olefins als RDS für die Hydroformylierung beschrieben.[41, 62] Hanna et al. stellten,
aufbauend auf kinetischen Daten für die Hydroformylierung von Propen mit Rh-
Xanthphos, ebenfalls die Olefininsertion als RDS fest und gelangen zu dem gleichen
abgeleiteten Ansatz wie in Formel (8-22) postuliert.[199] Für die Hydrierung von 1-Buten
0 1x105
2x105
3x105
4x105
0,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
r i / m
mol kg
-1 s
-1
pi / Pa
0 1x105
2x105
3x105
4x105
0,0
0,2
0,4
0,6
0,8
1,0
r i / m
mol kg
-1 s
-1
pi / Pa
0 1x105
2x105
3x105
4x105
0,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
r i / m
mol kg
-1 s
-1
pi / Pa
0 1x105
2x105
3x105
4x105
0,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
r i / m
mol kg
-1 s
-1
pi / Pa

Kinetische Untersuchungen 107
zu n-Butan wird die Abhängigkeit bezüglich der Partialdrücke von 1-Buten und
Wasserstoff gut abgebildet. Die Abhängigkeit des CO-Partialdruckes kann hingegen mit
den hyperbolischen Ansätzen nicht wiedergegeben werden. Das gleiche Verhalten
bezüglich des CO-Partialdruckes wird für die Isomerisierungsreaktion beobachtet.
Zusätzlich fehlt in dem Reaktionsgeschwindigkeitsansatz r10 die Abhängigkeit des
Wasserstoffpartialdruckes, obwohl eindeutig dessen Einfluss auf die Bildung von cis-
und trans-2-Buten gemessen wird. Die numerische Ermittlung der Parameter aus
Tabelle 15 sollte für die Gleichgewichtskonstanten K1 und K2 unabhängig von der
Reaktion gleiche Werte liefern, da diese Teilschritte in allen Gleichungen berücksichtigt
werden. Die Werte überschneiden sich nur für die Isomerisierung zu den internen
Alkenen. Dass für die Nebenreaktionen die Abhängigkeit des CO-Partialdruckes nicht
abgebildet werden kann, legt die Vermutung nahe, dass die Nebenreaktionen durch
einen anderen Mechanismus katalysiert werden.
In Abbildung 53 ist ein Katalysezyklus für die Hydrierung und Isomerisierung von 1-
Buten dargestellt. Grundlage für den postulierten Zyklus bildet die Hydrierung von
Alkenen mit dem Wilkinson-Katalysator.[287-288] Ein Überblick über Mechanismen zur
Alken-Hydrierung/Isomerisierung mit Komplexen vom Typ R2P(CH2)2M(CO)L ist in
einer Arbeit aus der Gruppe um Bergman dargestellt.[289] Es sei an dieser Stelle
festzuhalten, dass der postulierte Mechanismus keinen Anspruch auf Richtigkeit auf
quantenchemischer Basis legt. Dieser soll lediglich als Erklärungs- und Modellansatz
zur kinetischen Modellierung dienen, um das komplexe Reaktionsnetzwerk von 1-Buten
und Synthesegas mit Rhodium-Komplexen zu beschreiben.
Der Mechanismus basiert auf einer Rhodium(I)-Spezies. Das Anion kann theoretisch in
dem SILP-System die ionische Flüssigkeit, eine deprotonierte Silanolgruppe des
Trägers oder der Stabilisator sein. Weiterhin könnten protische oder aprotisch-polare
Lösungsmittel die Rolle des Anions einnehmen. Die Dissoziation von CO überführt den
Komplex von der 18 ve in die 16 ve Spezies (B). Wasserstoff addiert dann oxidativ an
die 16 ve-Spezies. Die Oxidationsstufe ändert sich von I auf III. Damit das Olefin an
den gesättigten Komplex koordinieren kann, muss CO dissoziieren. Nach der Insertion
des Olefins (U → V) folgt die Anlagerung von CO und anschließend die reduktive
Eliminierung unter Abspaltung des Alkans. Die β-H-Eliminierung aus dem
Alkylrhodium(III)-komplex (V) kann zur Umlagerung der Doppelbindung und folglich
zur Eliminierung des internen Olefins führen.

108 Kinetische Untersuchungen
Abbildung 53: Postulierter Katalysezyklus für die Hydrierung und Isomerisierung von 1-Buten
basierend auf einer Rh(I)-Spezies.
Auf Basis des postulierten Mechanismus für die Hydrierung und Isomerisierung von 1-
Buten erfolgt die Ableitung der hyperbolischen Reaktionsgeschwindigkeitsansätze. Das
beste Modell konnte unter Festlegung der Olefininsertion (r16) als RDS sowohl für die
Hydrierung zu n-Butan als auch für die Isomerisierung zu cis- & trans-2-Buten
abgeleitet werden.
𝑟16 =𝑘16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1𝑝𝐶𝑂 + 𝑝𝐶𝑂2 + 𝐾13𝐾1 𝑝𝐶𝑂𝑝𝐻2 + 𝐾14𝐾13𝐾1 𝑝𝐻2 +
𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
(8-25)

Kinetische Untersuchungen 109
Die Daten der Parameteranalyse und der Vergleich der gemessenen und berechneten
Daten sind in Tabelle 16 und Abbildung 54 für die Produkte n-Butan, trans- und cis-2-
Buten gegeben.
Tabelle 16: Parameteranalyse für das hyperbolische Modell für die Nebenreaktionen Hydrierung und
Isomerisierung nach dem Katalysezyklus basierend auf der Rhodium(III)-Spezies.
n-Butan trans-2-Buten cis-2-Buten
k16 /
mmol kg-1 s-1 Pa-2 7,84 5,05 13,67
K1 / - 6,7 · 10-3
K13 / -
4,8 · 10-3
K14 / - 258,03
K15 / - 6,57
Aus den Abbildungen ist zu erkennen, dass durch den Reaktionsgeschwindigkeits-
ansatz r16 (Formel (8-25)) die Bildungsraten in Abhängigkeit der Partialdrücke von 1-
Buten, Wasserstoff und Kohlenstoffmonoxid sehr gut wiedergegeben werden können.
Auf Basis des postulierten Zyklus in Abbildung 53 ist es möglich, den limitierenden
bzw. koordinierenden Einfluss des Partialdruckes an Kohlenstoffmonoxid zu
modellieren. Die numerische Parameteranalyse liefert, unabhängig von der
Nebenreaktion, die gleichen Gleichgewichtskonstanten. Die Bildungsraten
unterscheiden sich nur in dem Wert der Reaktionsgeschwindigkeitskonstanten. Für cis-
2-Buten wird die größte Geschwindigkeitskonstante ermittelt. Auf eine Interpretation
der Werte der Gleichgewichtskonstanten soll in diesem Zusammenhang verzichtet
werden, da nur quantenchemische Methoden einen detaillierteren Einblick in die
einzelnen Reaktionsschritte des Katalysezyklus liefern können. Zusammenfassend
bleibt festzuhalten, dass die abgeleiteten hyperbolischen Ansätze die Rhodium-
katalysierten Reaktionen von 1-Buten und Synthesegas gut beschreiben und
wiedergeben.

110 Kinetische Untersuchungen
n-Butan:
trans-2-Buten:
cis-2-Buten:
Abbildung 54: Modellierung der Nebenreaktionen (Hydrierung, Isomerisierung) mit hyperbolischen
Ansätzen nach einem postulierten Katalysezyklus basierend auf einer Rh(III)-Spezies. 1-Buten,
CO, H2, berechnet.
8.3 Bestimmung der Temperaturabhängigkeit auf das Reaktionsnetzwerk
Die Reaktionstemperatur ist eine der wichtigsten Variablen. Durch entsprechende Wahl
der Temperatur kann nicht nur die Gesamtaktivität beeinflusst werden, sondern auch die
Selektivität zum Zielprodukt. Im Fall der SILP-katalysierten Hydroformylierung wird
durch die Temperatur der sich einstellende Porenfüllgrad und die Löslichkeit des
Komplexes in der Mischung aus ionischen Flüssigkeit und (Folge-)Produkt unter
Reaktionsbedingungen beeinflusst. Die Messungen zur Bestimmung der
Aktivierungsenergien bezüglich der einzelnen Produkte werden mit einer steigenden
Temperaturrampe von 70 °C bis 130 °C und einer abfallenden Temperaturrampe von
120 ° bis 60 °C mit Δ T = 10 K durchgeführt. Abbildung 55 zeigt die
Stoffmengenänderungsgeschwindigkeiten für die Produkte n-Pentanal, n-Butan, trans-
0 1x105
2x105
3x105
4x105
0,0
0,2
0,4
0,6
0,8
1,0
r i / m
mol kg
-1 s
-1
pi / Pa
0 1x105
2x105
3x105
4x105
0,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
r i / m
mol kg
-1 s
-1
pi / Pa
0 1x105
2x105
3x105
4x105
0,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6r i /
mm
ol kg
-1 s
-1
pi / Pa

Kinetische Untersuchungen 111
2-Buten und cis-2-Buten in Abhängigkeit der Reaktionstemperatur unter konstanter
Verweilzeit im Reaktor. Das Verhältnis der Partialdrücke 1-Buten : CO : H2 ist konstant
bei 2 bar: 4 bar : 4 bar. Die Reaktionsverläufe zu den jeweiligen Versuchen sind in
Kapitel XIV dargestellt. Zur Bestimmung der Stoffmengenänderungsgeschwindigkeiten
in Abhängigkeit von der Temperatur werden ausschließlich Werte unter stationären
Bedingungen ausgewählt.
Steigende Temperaturrampe Sinkende Temperaturrampe
Abbildung 55: Abhängigkeit der Reaktionstemperatur auf die Reaktionsgeschwindigkeiten am Rh-BzP-
SILP-Katalysator. Temperaturbereich 60 – 130°C mit ΔT = 10 K.
Rh-BzP-SILP ; pabs = 10 bar; T = 60 - 130 °C; VGes= 25 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 4
bar; mSILP-Kat = 0,5 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh
= 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
n-Pentanal, n-Butan, trans-2-Buten, cis-2-Buten.
Die Stoffmengenänderungsgeschwindigkeiten nehmen für alle Produkte mit steigender
Reaktionstemperatur zu. Bei der Messung mit steigender Temperaturrampe konnte
keine Aktivität unter 70 °C Reaktionstemperatur festgestellt werden. Hingegen zeigt
sich, dass der SILP-Katalysator bei 60 °C noch aktiv, wenn der Katalysator unter hohen
Temperaturen angefahren wurde.
Die Temperaturabhängigkeit ist über die Arrheniusabhängigkeit der
Geschwindigkeitskonstanten definiert.
𝑘𝑖 = 𝑘0,𝑗 𝑒𝐸𝐴,𝑗𝑅 𝑇 (8-26)
Darin bildet ko,j den präexponentiellen Faktor bzw. Stoßfaktor und EA,j die
Aktivierungsenergie für die jeweilige Reaktionsgeschwindigkeit. Die Bedeutung und
70 80 90 100 110 120 1300
2
4
6
8
10
Ri /
mm
ol kg
-1 s
-1
T / °C
60 70 80 90 100 110 1200
2
4
6
8
Ri /
mm
ol kg
-1 s
-1
T / °C

112 Kinetische Untersuchungen
Interpretation des präexponentiellen Faktors wird speziell im Fall der heterogenen
Katalyse schon lange diskutiert.[290] Da nicht mit Sicherheit festgelegt werden kann, dass
die Reaktionsordnungen für den gesamten Temperaturbereich gültig sind, wird die
Aktivierungsenergie direkt aus den Bildungsgeschwindigkeiten bestimmt. Um eine
Größenordnung für die Temperaturabhängigkeit der Bildungsreaktion zu erhalten, kann
durch die Auftragung der logarithmierten Reaktionsgeschwindigkeit gegen die
reziproke Temperatur die Aktivierungsenergie aus der Steigung der sich ergebenden
Geraden abgelesen werden (Abbildung 56 a) – d)).
ln 𝑟𝑖 = ln 𝑘𝑖 −𝐸𝐴𝑅 𝑇
+ 𝑛 ln 𝑝𝐻2 +𝑚 ln 𝑝𝐶𝑂 + 𝑞 ln 𝑝1−𝐵𝑢𝑡𝑒𝑛 (8-27)
a) n-Pentanal
b) n-Butan
c) trans-2-Buten
d) cis-2-Buten
Abbildung 56: Vergleich der Temperaturabhängigkeit der Bildungsreaktionen am Rh-BzP-SILP-
Katalysator. T = 70 – 130 °C, steigende Temperaturrampe.
0,0024 0,0025 0,0026 0,0027 0,0028 0,0029-1,5
-1,0
-0,5
0,0
0,5
1,0
1,5
2,0
2,5
3,0
EA = 80,2 kJ mol
-1
EA = 50,3 kJ mol
-1
ln R
i / -
1/T / K-1
140 130 120 110 100 90 80 70
Temperatur / °C
0,0024 0,0025 0,0026 0,0027 0,0028 0,0029-3,5
-3,0
-2,5
-2,0
-1,5
-1,0
-0,5
0,0
0,5
1,0
EA = 83,9 kJ mol
-1
EA = 37,4 kJ mol
-1
ln R
i / -
1/T / K-1
140 130 120 110 100 90 80 70
Temperatur / °C
0,0024 0,0025 0,0026 0,0027 0,0028 0,0029
-4
-3
-2
-1
0
1
EA = 49,4 kJ mol
-1
EA = 109,2 kJ mol
-1
ln R
i / -
1/T / K-1
140 130 120 110 100 90 80 70
Temperatur / °C
0,0024 0,0025 0,0026 0,0027 0,0028 0,0029-4
-3
-2
-1
0
1
EA = 65,3 kJ mol
-1
EA = 104,5 kJ mol
-1
ln R
i / -
1/T / K-1
140 130 120 110 100 90 80 70
Temperatur / °C

Kinetische Untersuchungen 113
Für alle Produkte wird keine einheitliche Aktivierungsenergie über den gemessenen
Temperaturbereich festgestellt. Für das Produkt n-Pentanal ergibt sich für Temperaturen
bis 100 °C eine Aktivierungsenergie von 80 kJ mol-1 und über Temperaturen von 100
°C ein Wert von 50 kJ mol-1. Die Werte der gemessenen Aktivierungsenergien liegen
im Bereich literaturbekannter Werte für die Hydroformylierung von 1-Buten. In der
SILP-katalysierten Hydroformylierung mit Rh-Sulfoxanthphos wird eine
Aktivierungsenergie von 64,1 kJ mol-1 zwischen 80 – 110 °C im gradientenfreien
Kreisgasreaktor bestimmt.[283] Salmi et al. stellten in der Flüssigphase eine
Aktivierungsenergie von 75,5 kJ mol-1 bei 100 °C mit HRhCO(TPP3)3 als Katalysator
fest.[291] Für die Nebenprodukte n-Butan, trans-2-Buten und cis-2-Buten lässt sich
ebenfalls im Temperaturbereich zwischen 95 °C und 105 °C eine Änderung der
Aktivierungsenergie beobachten. Die Aktivierungsenergien sind, entgegen dem Produkt
n-Pentanal, im oberen Temperaturbereich größer. Eine Änderung der scheinbaren
Aktivierungsenergie aufgrund von Stofftransportphänomenen ist daher
unwahrscheinlich. Hanna et al. beobachten in der SILP-katalysierten
Hydroformylierung von Propen mit Rh-Sulfoxanthphos für die Bildung des Aldehyds
ebenfalls eine erniedrigte Aktivierungsenergie zwischen 110 °C und 140 °C. [199]
Untersuchungen mit kleineren Partikeln zeigen, dass die Änderung der
Aktivierungsenergie nicht auf Stofftransportlimitierungen zurückzuführen ist, sondern
mit einer Änderung des geschwindigkeitsbestimmenden Schrittes bei höheren
Temperaturen von der Olefin-Insertion zur oxidative Addition verbunden ist.
Die Messung mit sinkender Temperaturrampe ergibt das gleiche Verhalten bezüglich
der Aktivierungsenergien. Die gemessenen Aktivierungsenergien sind
interessanterweise konstant um den Faktor 1,32 ± 0,08 kleiner als im Versuch mit
steigender Temperaturrampe.
Dies könnte auf die Berechnung der Stoffmengenänderungsgeschwindigkeit
zurückführen sein. Im Nenner von Formel (8-1) geht die Masse des SILP-Katalysators
ein und damit die Annahme, dass alle Rhodiumzentren an der Reaktion teilnehmen.
Faktisch sind nach der Modellverstellung aus Kapitel 6.2 nur die gelösten Rh-Zentren
aktiv für die Reaktion. Wenn der SILP-Katalysator bei 120 °C Reaktionstemperatur
angefahren wird, bildet sich durch die höhere Aktivität des SILP-Katalysators und damit
einhergehend höherem Partialdruck des Produktes in der Gasphase mehr Lösungsmittel
in den Poren des Trägers aus. Somit steigt die Wahrscheinlichkeit, dass die Anzahl an
gelösten Katalysatorkomplexen zunimmt. Durch die schrittweise Reduzierung der
Temperatur und die wirkenden Kapillarkräfte verbleiben die Rh-Zentren in Lösung.

114 Kinetische Untersuchungen
Daraus ergibt sich, dass Änderungen in der Reaktionstemperatur zum einem zu
kleineren Gradienten auf die Stoffmengenänderungsgeschwindigkeit führen und zu
kleineren scheinbaren Aktivierungsenergien.
a) n-Pentanal
b) n-Butan
c) trans-2-Buten
d) cis-2-Buten
Abbildung 57: Vergleich der Temperaturabhängigkeit der Bildungsreaktionen am Rh-BzP-SILP-
Katalysator. T = 120 – 60 °C, sinkende Temperaturrampe.
8.3.1 Zusammenfassende Betrachtung der Temperaturabhängigkeit
Die bestimmten Aktivierungsenergien zeigen, dass es ein Optimum hinsichtlich
Aktivität und Selektivität zum linearen Aldehyd in Abhängigkeit der
Reaktionstemperatur gibt. In Abbildung 58 ist der Einfluss einer Temperaturerhöhung
von 10 K auf die Reaktionsgeschwindigkeitskonstanten für die jeweiligen Produkte
simuliert. Der Sprung in den Grafiken folgt aus den Schnittpunkten der Geraden in
0,0025 0,0026 0,0027 0,0028 0,0029 0,0030-1,0
-0,5
0,0
0,5
1,0
1,5
2,0
2,5
3,0
EA = 65,7 kJ mol
-1
EA = 37 kJ mol
-1
ln R
i / -
1/T / K-1
120 110 100 90 80 70 60Temperatur / °C
0,0025 0,0026 0,0027 0,0028 0,0029 0,0030-3,0
-2,5
-2,0
-1,5
-1,0
-0,5
0,0
EA = 64,6 kJ mol
-1
EA = 26,5 kJ mol
-1
ln R
i / -
1/T / K-1
120 110 100 90 80 70 60
Temperatur / °C
0,0025 0,0026 0,0027 0,0028 0,0029 0,0030-5,0
-4,5
-4,0
-3,5
-3,0
-2,5
-2,0
-1,5
-1,0
-0,5
0,0
EA = 81,6 kJ mol
-1
EA = 38,4 kJ mol
-1
ln R
i / -
1/T / K-1
120 110 100 90 80 70 60
Temperatur / °C
0,0025 0,0026 0,0027 0,0028 0,0029 0,0030-4,0
-3,5
-3,0
-2,5
-2,0
-1,5
-1,0
-0,5
0,0
0,5
1,0
EA = 77,8 kJ mol
-1
EA = 50,3 kJ mol
-1
ln R
i / -
1/T / K-1
120 110 100 90 80 70 60
Temperatur / °C

Kinetische Untersuchungen 115
Abbildung 56 und Abbildung 57. Beispielsweise führt eine Temperaturerhöhung von 60
°C auf 70 °C zu einer Verdopplung der Geschwindigkeitskonstante in der
Reaktionsgeschwindigkeit von cis-2-Buten (Abbildung 58, links).
Steigende Temperaturrampe Sinkende Temperaturrampe
Abbildung 58: Einfluss einer Temperaturerhöhung von 10 K auf die Erhöhung der
Reaktionsgeschwindigkeitskonstanten. Verhältnis der Geschwindigkeitskonstanten (k2/k1) gegen die
Temperatur T1, mit T2 = T1 + 10 K.
n-Pentanal, n-Butan, cis-2-Buten, trans-2-Buten.
Aus Abbildung 58 a) und b) ist zu erkennen, dass es für jedes Produkt zwei Bereiche
gibt, in denen sich Temperaturerhöhungen unterschiedlich stark auf die
Geschwindigkeitskonstante auswirken. Wie bereits diskutiert, könnte in dem
Temperaturbereich zwischen 90 und 100 °C eine Verschiebung des
geschwindigkeitsbestimmenden Schrittes in dem katalytischen Mechanismus die
Erklärung für die Änderung der Aktivierungsenergien sein. Die Nebenprodukte zeigen
gegenüber dem Produkt n-Pentanal ein reziprokes Verhalten bezüglich der Werte der
bestimmten Aktivierungsenergien. Dies führt dazu, dass Temperaturänderungen im
unteren Temperaturbereich einen größeren Einfluss auf die Geschwindigkeitskonstante
für n-Pentanal zeigen als dies im oberen Temperaturbereich der Fall ist. Hinsichtlich der
Selektivität zum Wunschprodukt sollte die Reaktion bei zwischen 90 °C und 100 °C
durchgeführt werden (siehe Abbildung 78 und Abbildung 79 in Kapitel XIV). Zumal
unter nicht-isothermen Bedingungen über 100 °C Temperaturgradienten einen
überproportionalen Einfluss auf die Geschwindigkeitskonstanten der Nebenprodukte
zeigen, als dies für das Produkt n-Pentanal der Fall ist. Dieses Verhalten würde sich
zusätzlich negativ auf die Aldehyd-Selektivität auswirken. Hinsichtlich der
Produktivität an n-Pentanal ist eine Steigerung um den Faktor 2,5 möglich wenn die
50 60 70 80 90 100 110 120 130 1401,00
1,25
1,50
1,75
2,00
2,25
2,50
2,75
3,00
k2/k
1 [T
2 =
T1 +
10K
]
T1 / °C
50 60 70 80 90 100 110 120 130 1401,00
1,25
1,50
1,75
2,00
2,25
2,50
k2/k
1 [T
2 =
T1 +
10K
]
T1 / °C

116 Kinetische Untersuchungen
Reaktion bei 120 °C anstelle von 90 °C durchgeführt wird. Dies ist allerdings mit einer
Einbuße von 20 Prozentpunkten auf die Selektivität an linearem Aldehyd verbunden.
8.4 Validierung des kinetischen Modelles im Strömungsrohrreaktor
Das in Kapitel 8.2 abgeleitete hyperbolische Modell wird im Folgenden zur
Beschreibung des Reaktionsfortschrittes und -netzwerkes im Strömungsrohreaktor
eingesetzt. Eine Simulation in Aspen mit dem RPlug-Modell soll zunächst das Ergebnis
aus Abbildung 40 mit Hilfe der Gleichungen (8-22) und (8-25) und der Geometrie der
Katalysatorschüttung validieren. Die Parameter der Simulation sind in Tabelle 17
gegeben.
Tabelle 17: Standardversuchsbedingungen im Strömungsrohr am Rh-BzP-SILP-Katalysator.
mSILP 3 g ε´ 0,32*
V0 30 ml min-1 p1-Buten 2 bar
TR 100 °C pH2 4 bar
pabs 10 bar pCO 4 bar *Porosität der SILP-Schüttung nach der Druckverlustmessung aus Kapitel 7.4.
Die Simulation liefert folgendes Ergebnis unter Berücksichtigung der hyperbolischen
Ansätze:
Tabelle 18: Ergebnis der Simulation basierend auf den hyperbolischen Ansätzen.
X1-Buten 14,3 % Sn-Pentanal 69,0 %
XH2 5,6 % Sn-Butan 9,6 %
XCO 4,9 % Scis-2-Buten 15,7 %
Prod. 330 gn-PentanalkgSILP-1 h-1 Strans-2-Buten 5,7 %
Die Werte der Simulation zeigen, dass das Ergebnis aus Abbildung 40 mit einer
Fehlertoleranz von ± 10 % wiedergegeben werden kann. Die gemessene Produktivität
beträgt 290 gn-PentanalkgSILP-1 h-1 entgegen 330 gn-PentanalkgSILP
-1 h-1 nach der Simulation in
Aspen.
Eine Sensitivitätsanalyse bewertet die Empfindlichkeit der Eingangskonzentrationen
der Edukte und der Verweilzeit auf das Reaktionsnetzwerk. Die Molenströme von 1-

Kinetische Untersuchungen 117
Buten, CO und H2 werden im Bereich von 0,05 – 0,5 mol h-1 mit Δn=0,05 mol h-1
gegeneinander bei 10 bar Absolutdruck und 100 °C Reaktionstemperatur variiert.
Daraus ergeben sich 103 theoretische Betriebspunkte für die SILP-katalysierte
Hydroformylierung im Laborströmungsrohrreaktor. Das Ergebnis der
Sensitivitätsanalyse ist im Anhang in Kapitel XV detailliert aufgelistet. Abbildung 59
zeigt den Einfluss der Eingangszusammensetzung auf den Umsatz an 1-Buten (a) bzw.
auf die Produktivität (b) als Funktion der Selektivität von n-Pentanal.
a)
b)
Abbildung 59: Sensitivitätsanalyse der Eingangsmolenströme (hyperbolische Modell, Strömungsrohr),
a) Umsatz an 1-Buten als Funktion der n-Pentanal-Selektivität, b) Produktivität von n-Pentanal als
Funktion der n-Pentanal-Selektivität. Offene Punkte werden zur Validierung im Experiment
herangezogen (siehe Tabelle 19).
Abbildung 59 a) zeigt, dass hohe Selektivitäten zum linearen Aldehyd nur bei Umsätzen
< 20 % bezüglich 1-Buten unter den gewählten Betriebsbedingungen möglich sind. Aus
Abbildung 59 b) ist erkennbar, dass die höchste Produktivität von 606
gn-PentanalkgSILP-1 h-1 bei einer Selektivität zum n-Pentanal von 8,56 % erreicht wird. Eine
hohe Selektivität zum linearen Aldehyd ist somit mit Einbußen hinsichtlich Umsatz und
Produktivität verbunden. Die Simulation bestätigt den koordinierenden Effekt von
Kohlenstoffmonoxid auf das Reaktionsnetzwerk, speziell auf die Bildungsrate der
Nebenprodukte. Große axiale Konzentrationsgradienten in der Katalysatorschüttung,
damit verbunden hohe Umsätze, resultieren in einer verstärkten Bildung der
Nebenprodukte. Dieses Resultat wird anhand von vier Betriebspunkten in einem
Experiment validiert. In Tabelle 19 sind vier Betriebspunkte und die Ergebnisse aus der
Simulation dargestellt:
0 10 20 30 40 50 60 70 80 90 1000
10
20
30
40
50
60
70
80
90
100
111
X1
-Bu
ten / %
Sn-Pentanal
/ %
1 2
4
3
0 10 20 30 40 50 60 70 80 90 1000,0
0,1
0,2
0,3
0,4
0,5
0,6
Pro
d. / kg
n-P
enta
nal kg
-1 SIL
P h
-1
Sn-Pentanal
/ %
1
2
3
4

118 Kinetische Untersuchungen
- Betriebspunkt 1 beschreibt die bereits vorgestellten Ergebnisse unter
Standardreaktionsbedingungen am Rh-BzP-SILP-Katalysator.
- Betriebspunkt 2 stellt einen Punkt mit maximaler Selektivität zum linearen
Aldehyd dar.
- Betriebspunkt 3 soll die maximale Produktivität in dem gewählten
Parameterfenster wiedergeben.
- Betriebspunkt 4 stellt das maximale Produkt aus Selektivität und Produktivität
dar.
Tabelle 19: Betriebspunkte und Ergebnisse der Simulation zur Validierung des hyperbolischen Modells.
n1-Buten
/ mol h-1
p1-Buten /
bar 0,116 2 0,05 1 0,50 4,76 0,35 3,89
nCO
/mol h-1
pCO
/ bar 0,232 4 0,40 8 0,05 0,48 0,50 5,56
nH2
/mol h-1
pH2
/ bar 0,232 4 0,05 1 0,50 4,76 0,05 0,55
V0 in ml min-1 30 25,9 54,3 46,5
X1-Buten / % 14,3 14,16 49,29 6,04
Sn-Pentanal / % 69,0 90,05 8,56 72,95
Sn-Butan / % 9,6 0,90 29,51 1,28
Strans-2-Buten / % 5,7 2,44 16,69 6,95
Scis-2-Buten / % 15,7 6,61 45,24 18,82
Prod. /
gn-PentanalkgSILP-1 h-1
330 183 606 443
In Abbildung 60 ist der Umsatz- und Selektivitätsverlauf im Experiment unter den
gewählten Betriebspunkten aus Tabelle 19 gegen die Reaktionszeit dargestellt.
Folgereaktionen der Aldehyde werden in diesem Modell nicht berücksichtigt.

Kinetische Untersuchungen 119
Abbildung 60: Validierung des hyperbolischen Modelles. Umsatz und Selektivität gegen die
Reaktionszeit am Standard SILP-Katalysator unter vier ausgewählten Betriebspunkten aus der
Simulation.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; mSILP-Kat = 3,0 g; Rh(acac)(COD); BzP; [EMIM][NTf2];
Stabilisator; Silica 100 (kalz.); α = 0,1; wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn-Butan, Strans-2-Buten, Scis-2-Buten.
In Abbildung 60 ist zu erkennen, dass die simulierten Betriebspunkte, und im
Experiment wiedergegeben werden können. Lediglich unter den Bedingungen für den
Betriebspunkt konnte kein stabiler Zustand erreicht werden. Der gemessene Umsatz
liegt zum Ende des Betriebsfensters 18 Prozentpunkte unter dem berechneten Wert. Die
Selektivitäten stimmen mit der Simulation überein. Der Umsatzrückgang könnte auf die
Reduzierung des Porenfüllgrades und somit auf Entzug des Lösungsmittels für den
Katalysatorkomplex zurückzuführen sein. Aufgrund der geringen Selektivität zum
linearen Aldehyd von 8 – 9 % ist dessen Partialdruck in der Gasphase erniedrigt. Dies
führt zu einem großen Gradienten für den Phasenübergang von der flüssigen Phase in
die Gasphase und folglich zu einem kleinen Porenfüllgrad nach dem Modell aus Kapitel
6.2. Eine anschließende Änderung der Betriebsparameter auf die Standardbedingungen
zeigt eine Aktivierungsphase, die sich mit der Ausbildung einer flüssigen Phase und
damit dem Lösen des Edelmetallkomplexes korrelieren lässt. Da zumal die Löslichkeit
des Komplexes in der ionischen Flüssigkeit sehr gering ist. Tabelle 20 stellt die
berechnete und gemessene Produktivität für das Produkt n-Pentanal unter den vier
untersuchten Betriebsparametern zusammen. Es zeigt sich, dass die Werte der
0 20 40 60 80 100 120
0
10
20
30
40
50
X1-B
ute
n /
%
Zeit / h
1 2 4 1 13
0
20
40
60
80
100
Si /
%

120 Kinetische Untersuchungen
gemessenen Produktivität immer unter den Werten der berechneten Produktivität liegen.
Dies ist darauf zurückzuführen, dass der Umsatz und die Selektivität im Experiment
immer niedriger sind als in der Simulation berechnet. Die Abweichungen betragen unter
stationären Bedingungen max. 15,3 %. Unter den Bedingungen für den Betriebspunkt
ist die Abweichung mit 20,8 % am größten.
Tabelle 20: Vergleich der gemessenen und berechneten Produktivität für das Produkt n-Pentanal.
Produktivität / gn-PentanalkgSILP-1 h-1 max. Fehler / %
berechnet gemessen
330 280 – 340 15,2
183 155 – 170 15,3
606 480 – 530 20,8
443 390 – 420 12,0
8.5 Zusammenfassung und Bewertung der Kinetikstudien
Im vorliegenden Kapitel wurde das Verhalten des SILP-Katalysators mit dem Rhodium-
Benzpinakol-Komplex kinetisch im differentiell betriebenen Strömungsrohrreaktor
untersucht. Trotz der Komplexität der Vorgänge in den Poren eines SILP-Katalysators
konnte auf Basis dieser Messungen zwei kinetische Modelle entwickelt werden: Ein
formalkinetischer Ansatz basierend auf Potenzansätzen und ein hyperbolisches Modell
basierend auf postulierten Katalysezyklen. Beide Ansätze geben das Reaktionsnetzwerk
in dem untersuchten Bereich wieder und können zur Beschreibung des
Reaktionsnetzwerkes herangezogen werden. Das hyperbolische Modell bietet
gegenüber den Potenzansätzen Einblick in die Teilschritte des Katalysezyklus. Die
Annahmen, die in diesem Modell stecken, können nur mit quantenchemischen
Methoden verifiziert werden. Quantenchemische Rechnungen könnten zusammen mit
kinetischer Modellierung ein tiefgreifenderes Verständnis in das Reaktionsnetzwerk von
Olefinen mit Synthesegas an Übergangsmetallkomplexen liefern.
Die Werte der scheinbaren Aktivierungsenergie deuten zum einen auf eine
Verschiebung des geschwindigkeitsbestimmenden Schrittes in Abhängigkeit von der

Kinetische Untersuchungen 121
Temperatur hin und zum anderen bestätigen sie das Modell aus Kapitel 6.2. Der
Porenfüllgrad, der sich unter den gewählten Betriebsparametern vermutlich aufgrund
der begrenzten Löslichkeit des Katalysatorkomplexes in der ionischen Flüssigkeit
einstellt, nimmt großen Einfluss auf die Aktivität und Stabilität des SILP-Katalysators.
Die Ergebnisse der Simulation des Reaktionsnetzwerkes basierend auf den
hyperbolischen Ansätzen und den bestimmten Aktivierungsenergien zeigen, dass die
maximale Produktivität nicht mit einem hohen Umsatz an 1-Buten und hoher
Selektivität an n-Pentanal verbunden ist. Unter Berücksichtigung der Langzeitstabilität
wären damit Betriebsbedingungen möglich, die eine kurze Verweilzeit der Aldehyde in
der Katalysatorschüttung gewährleisten und somit eine Zersetzung des Diphosphit-
Liganden durch frei werdendes Wasser, das aufgrund der Aldolkondensation der
Aldehyde entsteht, vermeiden. Die Übertragung der Ergebnisse der Simulation auf den
Laborströmungsrohrreaktor gelingt. Die molaren Verhältnisse der gebildeten Produkte
werden in Experiment bestätigt. Allerdings weichen die Absolutwerte aus dem
Experiment etwas von der Simulation ab. Es resultiert eine 12 – 21 % kleinere
Produktivität an linearem Aldehyd im Experiment als im Modell vorrausberechnt.

122 Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal
9 Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal
Die in den letzten Jahren kontinuierlich gestiegene Nachfrage nach hochmolekularen
Phthalaten führt zu einer erhöhten Umsetzung von Olefinen ≥ C4 durch
Hydroformylierung. Zusammen mit den veränderten Rohstoffgegebenheiten durch neue
Fördermethoden, speziell dem Fracking, ergeben sich neue Rohstoffe für die Synthese
von Aldehyden.[292-293] Erdgas kann bis zu 20 Gew-% an C3- und C4 -
Kohlenwasserstoffe enthalten. Diese werden durch Kondensation von Methan
abgetrennt und für Koch-/Heizzwecke, Kältemittel oder als Kraftstoff verwendet. Für
den Einsatz in der Synthese ist eine C-H-Aktivierung nötig. Eine Methode dafür wäre
die heterogen-katalysierte Dehydrierung zur Umsetzung von Alkanen zu Alkenen. Wie
bereits in Kapitel 2.3.3 erwähnt, handelt es sich bei der Dehydrierung von Alkanen um
eine stark endotherme Reaktion. Hohe Umsätze sind nur bei ausreichend hoher
Temperatur oder durch das kontinuierliche Entfernen eines Produktes aus dem
Reaktionsgas möglich. Daraus folgt, dass der Produktstrom einen erheblichen Teil an
nicht umgesetzten Alkanen enthält. Für anschließende Reaktionen ist eine Aufreinigung
des engsiedenden Gemisches Butan/Buten aus reaktionstechnischen und
wirtschaftlichen Gesichtspunkten nötig.[294] Bei einer homogen-katalysierten Reaktion
in der Flüssigphase würden die Konkurrenzlöslichkeit der Alkane/Alkene in dem
Lösungsmittel und die langen Diffusionswege in dem Lösungsmittel zu keinem
konkurrenzfähigen Verfahren führen. Dagegen bietet die SILP-Katalyse enorme
Vorteile. Durch den Einsatz eines SILP-Katalysators in Festbettreaktoren sind die
Diffusionswege kurz und die Konkurrenzlöslichkeit spielt eine untergeordnete Rolle.
SILP-Systeme zeigten insbesondere bei der Verwendung von Eduktströmen mit hohem
Anteil an inerten Alkanen eine hohe Leistungsfähigkeit. Dieses Potential zeigen bereits
Haumann et al. in der Hydroformylierung eines C4-Gemisches mit einem Anteil von 30
Vol-% an Alkenen auf.[197] Die Kombination aus heterogen-katalysierter Alkan-
Dehydrierung und SILP-katalysierter Hydroformylierung bietet somit eine elegante
Möglichkeit, um Alkane direkt in Aldehyde ohne eine zusätzliche Aufreinigung
umzusetzen. Abbildung 61 zeigt ein entsprechendes Verfahren zur Realisierung dieser
Kaskadenreaktion.
Die Anlage setzt sich im Wesentlichen aus drei Teilen zusammen: Einem
Hochtemperatur-Rohrreaktor für die Dehydrierung, einem gekühlten
Zwischenlagergefäß und einem Rohrreaktor für die Hydroformylierung. Eine
detaillierte Beschreibung der Anlage ist in Kapitel 4.3 gegeben.

Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal 123
Abbildung 61: Vereinfachtes Verfahrensfließbild der Reaktionskaskade aus heterogen katalysierter n-
Butan-Dehydrierung und SILP-katalysierter Hydroformylierung.
Die größte Herausforderung der direkten Kopplung beider Reaktionen stellt der
Druckunterschied dar. Die Dehydrierung wird bei Atmosphärendruck und die SILP-
katalysierte Hydroformylierung idealerweise zwischen 10 – 30 bar durchgeführt. Der
Einsatz eines Verdichters für den Produktstrom der Dehydrierung ist aus technischen
und sicherheitstechnischen Gründen nicht möglich. Ein entsprechender Betriebsdruck >
10 bar ist aufgrund des Eingangsdruck und des Saugvolumenstromes und der daraus
resultierenden Förderleistung mit kommerziell erhältlichen Laborverdichtern nicht
realisierbar. Hinzu kommt, dass die meisten Laborverdichter nicht die ATEX
(ATmospheres EXplosibles) – Bedingungen erfüllen, die aufgrund der explosiven
Atmosphäre aus Wasserstoff und Kohlenwasserstoffen erforderlich ist. Da Flüssigkeiten
nahezu inkompressibel sind, kann die Druckstufe mittels einer Pumpe überwunden
werden. Hierfür wird der Produktstrom in einem Zwischenlagergefäß mittels eines
Krysostaten bei -25 °C auskondensiert. Das verflüssigte Gemisch kann dadurch bei
beliebigem Volumenstrom gegen Druck gefördert werden. Das Kondensationsgefäß ist
gegen Atmosphäre offen. Dadurch können Wasserstoff und leichtere
Kohlenwasserstoffe, die durch Crackreaktionen entstehen, entweichen. Im Folgenden
soll der Einfluss der Reaktionstemperatur der Dehydrierung auf die Zusammensetzung
des Produktstromes und das Gas/Flüssig-Gleichgewicht im Zwischenlagergefäß unter
Gleichgewichtsbedingungen simuliert werden.
Die Grundlage für die Simulation der Produktzusammensetzung bildet das
thermodynamische Gleichgewicht der C4-Kohlenwasserstoffe bzw. die V-L-L-
Gleichgewichte bei einem Absolutdruck von 1,01325 bar, die sich unabhängig von der

124 Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal
Abbildung 62: Gleichgewichtszusammensetzung
und anteiliger Molenstrom der Gasphase nach
dem Zwischenlagergefäß bei -20 °C. n-Butan,
1-Buten, cis-2-Buten, trans-2-Buten,
Wasserstoff, ��𝑖 / ��𝐺𝑒𝑠
Abbildung 63: Gleichgewichtszusammensetzung
und anteiliger Molenstrom der
auskondensierten Phase nach dem
Zwischenlagergefäß bei -20 °C. n-Butan, 1-
Buten, cis-2-Buten, trans-2-Buten,
Wasserstoff, ��𝑖 / ��𝐺𝑒𝑠
Abbildung 64: Gleichgewichtszusammensetzung des Produktstromes in mol-% der Dehydrierung in
Abhängigkeit der Reaktionstemperatur und 1,01325 Absolutdruck. Keine Nebenreaktionen
berücksichtigt.
n-Butan, 1-Buten, cis-2-Buten, trans-2-Buten, Wasserstoff.
300 350 400 450 500 5500,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
xi,G
as / -
Reaktionstemperatur Dehydrierung / °C
0
10
20
30
40
50
60
70
80
90
100
ni /
nG
es / %
300 350 400 450 500 5500,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
xi,F
lüssig / -
Reaktionstemperatur Dehydrierung / °C
0
10
20
30
40
50
60
70
80
90
100
ni /
nG
es / %
200 300 400 500 600 7000,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
xi,G
GW
im
Pro
du
kts
tro
m / -
Reaktionstemperatur Dehydrierung / °C

Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal 125
Verweilzeit in dem Zwischenlagergefäß einstellen. Die Zusammensetzung des
Produktstromes der Dehydrierung wird aufgrund des thermodynamischen
Gleichgewichtes maßgeblich durch die Temperatur beeinflusst. Mit steigender
Temperatur steigt die Umsetzung an n-Butan. Die Zusammensetzung, speziell der
entstandene Wasserstoff, beeinflusst das Gas-Flüssig-Gleichgewicht in dem
Zwischenlagergefäß. In Abbildung 62 und Abbildung 63 sind die Zusammensetzungen
der Gas- und Flüssigphasen in Abhängigkeit der Reaktionstemperatur der Dehydrierung
im thermodynamischen Gleichgewicht dargestellt und die daraus resultierenden
anteiligen Molenströme. Die Gasphase setzt sich konstant aus 55 mol-% Wasserstoff
zusammen. n-Butan bildet die Hauptkomponenten der C4-Kohlenwasserstoffe, die in die
Gasphase übergehen. Mit steigender Reaktionstemperatur nimmt der Anteil des Alkanes
ab und die Anteile der Alkene nehmen zu. Aufgrund des höheren Partialdruckes an
Wasserstoff bei höheren Reaktionstemperaturen verschiebt sich das Gleichgewicht der
Kohlenwasserstoffe zunehmend in die Gasphase, erkennbar anhand des prozentualen
Molenstromes. Die Zusammensetzungen und die Molenströme verhalten sich für die
Flüssigphase analog. Aus den Grafiken ist zu erkennen, dass sich mit der gegebenen
Kühlleistung und unter der Annahme einer Gleichgewichtszusammensetzung eine
optimale Reaktionstemperatur für die Dehydrierung im Bereich von 450 - 550 °C ergibt.
Im folgenden Kapitel wird der Einfluss der Reaktionstemperatur der katalytischen
Dehydrierung von n-Butan auf die Ausbeute an Aldehyd in der anschließenden SILP-
katalysierten Hydroformylierung näher untersucht.
9.1 Einfluss der Produktzusammensetzung der Dehydrierungsreaktion auf die
Ausbeute an n-Pentanal
Aufbauend auf den Ergebnissen der SILP-katalysierten Hydroformylierung und den
Ergebnissen der Gleichgewichtssimulation soll im Folgenden der Einfluss der
Reaktionsbedingungen der Dehydrierung und der Hydroformylierung auf die Stabilität
des Prozesses und die Ausbeute an linearem Aldehyd untersucht werden. In Abbildung
65 ist die katalytische Dehydrierung von n-Butan bei 450 °C Reaktionstemperatur und
Atmosphärendruck an dem Cr/AlOx-Katalysator dargestellt. Das entstandene C4-
Produktgemisch wird im Tank kondensiert. Mittels eines Füllstandsensors kann
sichergestellt werden, dass verflüssigte Kohlenwasserstoffe vorliegen. Sobald eine
entsprechende Füllstandhöhe in dem Zwischenlagergefäß erreicht wird, wird die

126 Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal
Hydroformylierung zugeschaltet. Die Norm-Volumenströme an C4-
Kohlenwasserstoffen werden in beiden Reaktionen auf 43 mlN min-1 eingestellt.
Abbildung 65: Dehydrierung von n-Butan bei TR = 450 °C, Umsatz und Selektivität in Abhängigkeit
des Reaktionsverlaufes am heterogenen Cr/AlOx-Katalysator.
T = 450 °C, pn-butane = 1 bar, VGes= 43.4 mlN min-1, mCr/AlOx = 10 g, wCr = 10 Gew-%.
Xn-Butan, S1-Buten, Strans-2-Buten, Scis-2-Buten.
In Abbildung 65 ist der Umsatz an n-Butan und die Selektivität der entstandenen Butene
bei 450 °C Reaktionstemperatur aufgeführt. In der Anfangsphase beträgt der Umsatz an
n-Butan 11 %. Dies entspricht annährend dem thermodynamischen
Gleichgewichtsumsatz bei der entsprechenden Temperatur. Eine Behandlung des
Katalysators unter reduzierenden Bedingungen hat keinen Einfluss auf die anfängliche
Aktivität. Nach 20 Stunden unter Reaktionsgas setzt eine kontinuierliche Deaktivierung
des Katalysators ein. Am Ende der Versuchslaufzeit, nach 140 Stunden, zeigt der
Katalysator noch einen Umsatz von 4 %. Die Deaktivierung des heterogenen
Katalysators ist hauptsächlich auf Koksablagerungen durch Polymerisierungsreaktionen
der Alkene zurückzuführen. Daraus resultiert eine formale Reduktion der aktiven
Zentren durch Belegung mit Kohlenstoff. Basierend auf kinetischen Modellierungen zur
Deaktivierung von Cr2O3/Al2O3 Katalysatoren vermuten Pena et al.[295] und Gascón et
al.[296], dass die Koksbildung in einem simultanen Monolayer-Multilayer Mechanismus
stattfindet. Sowohl azide Oberflächengruppen als auch der Metallcluster selbst tragen
0 20 40 60 80 100 120 140 160
0
10
20
30
40
50
X
n-B
uta
n / %
Zeit / h
0
10
20
30
40
50
Si /
%

Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal 127
zur Bildung von Kohlenstoffablagerung bei. Die Selektivität zu den Butenen ist in den
ersten Stunden des Versuchs leicht reduziert. Dies ist vor allem auf die Bildung
kurzkettiger Alkane und Alkene durch Crackingreaktionen zurückzuführen. Mit
einsetzender Deaktivierung des Katalysators ist die Selektivität der Butene konstant bei
94 % über den restlichen Versuchsverlauf. Gemäß dem thermodynamischen
Gleichgewicht der Butene bei 450 °C wird trans-2-Buten bevorzugt gebildet.
Wie bereits erwähnt, wurde der Produktstrom der Dehydrierung kondensiert und mittels
einer HPLC-Pumpe gegen 10 bar der Hydroformylierung zudosiert. In Abbildung 66 ist
der Umsatz an 1-Buten und die Selektivität an n-Pentanal und 2-Propyl-2-heptenal
dargestellt. Der Volumenstrom des dehydrierten C4-Produktstromes wird konstant bei
43 mlN min-1 gehalten. Das molare Verhältnis von Synthesegas zu C4-Gemsich wurde
durch Anpassen der Volumenströme von 2 : 1 auf 1 : 2 reduziert. In den vorangegangen
Experimenten mit dem Rh-BzP-Komplex konnte gezeigt werden, dass durch diesen
Komplex ausschließlich 1-Buten umgesetzt wird. Die Nebenreaktionen sind in
folgender Abbildung nicht aufgeführt, da aufgrund eines fehlenden internen Standards
darüber keine Aussagen getroffen werden konnten.
In Abbildung 66 ist zu erkennen, dass der Umsatz an 1-Buten mit sinkendem Verhältnis
von Synthesegas zu C4-Gemsich von 60 % auf 93 % ansteigt. Zwei Effekte können
diesem Verhalten zugeschrieben werden. Durch Anpassen der Volumenströme an das
molare Verhältnis verlängert sich die Verweilzeit und folglich steigt der Umsatz. Der
andere Effekt hängt mit der Kinetik der Reaktion zusammen. Aus Kapitel 8.2.1 ist
bekannt, dass der Partialdruck des Alkenes einen positiven Einfluss auf die
Reaktionsgeschwindigkeit der Hydroformylierung hat. Folglich führt eine Steigerung
des Partialdruckes ebenfalls zu einer Steigerung des Umsatzes. Die Selektivitäten zu n-
Pentanal und dem Folgeprodukt werden nicht durch die veränderten Partialdrücke
beeinflusst. Die Selektivität von n-Pentanal liegt konstant bei 96 % und für 2-Propyl-2-
heptenal zwischen 2 – 4 %. Der Molenanteil von 1-Buten in dem dehydriertem Gemisch
beträgt zwischen 1-2 mol-%. Somit werden mehr als 98 mol-% inerte Komponenten
durch den Reaktor geschleust. Trotz dieser geringen Konzentration des Reaktanden
kann dieser fast vollständig umgesetzt werden. Die resultierende Produktivität beträgt
35 – 60 gn-Pentanal kgSILP-Kat-1 h-1. In der Hydroformylierung von Raffinat III, mit einem
1-Buten Anteil von 30 mol-%, beträgt die Produktivität 290 – 320 gn-Pentanal kgSILP-Kat-1
h-1 unter vergleichbaren Reaktionsbedingungen.

128 Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal
Abbildung 66: Direkte Umsetzung eines dehydrierten n-Butan-Gemisches zu Aldehyden. Umsatz und
Selektivität gegen den Reaktionsverlauf bei variablen C4 : Synthesegas – Verhältnis.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 64,9 – 129,9 mlN min -1; pRaff-III,1 = 3,33 – 6,66 bar; pH2
= 1,67 – 3,33 bar; pCO = 1,67 – 3,33bar; mSILP-Kat = 3 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator;
Silica 100; α = 0,1; wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, S2-Propyl-2-heptenal.
Zur Steigerung der Ausbeute an Aldehyd wird in dem folgenden Kaskadenversuch die
Dehydrierung bei 500 °C Reaktionstemperatur durchgeführt. Aus Abbildung 64 und
Abbildung 63 ist zu erkennen, dass die Steigerung der Temperatur zu einem erhöhten
Molenanteil von 1-Buten in der kondensierten Phase führt. Im Vergleich zu den
vorherigen Bedingungen der Hydroformylierung wurde das Molenverhältnis von
Synthesegas zu C4-Komponenten konstant bei 1 : 2 belassen. In Abbildung 67 ist die
Dehydrierung von n-Butan und in Abbildung 68 die anschließende Hydroformylierung
dargestellt.
0 20 40 60 80 100 120 140 160
0
20
40
60
80
100
X1-B
ute
n / %
Zeit / h
Syngas : C4-Feed
2 : 1 1 : 1 1 : 2
De
hyd
rie
run
g,
Fü
llen
de
s V
orl
ag
eta
nks
0
20
40
60
80
100
Si /
%

Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal 129
Abbildung 67: Dehydrierung von n-Butan bei TR = 500 °C, Umsatz und Selektivität in Abhängigkeit
des Reaktionsverlaufes am heterogenen Cr/AlOx-Katalysator.
T = 500 °C, pn-butane = 1 bar, VGes= 43.4 mlN min-1, mCr/AlOx = 10 g, wCr = 10 Gew-%.
Xn-Butan, S1-Buten, Strans-2-Buten, Scis-2-Buten.
Der Cr/AlOx-Katalysator zeigt zu Beginn einen Umsatz von annährend 18 % n-Butan
und deaktiviert schneller über den restlichen Versuchsverlauf. Die Selektivität der
Butene erreicht nach 20 Stunden ein Maximum von 88 %. Im Vergleich zu dem Versuch
bei 450 °C Reaktionstemperatur ist die Selektivität um 5 Prozentpunkte erniedrigt.
Nebenprodukte sind Methan, Ethan, Ethen, Propan und Propen.
In der Hydroformylierung stellt sich nach einer kurzen Anlaufphase ein konstanter
Umsatz von 90 % 1-Buten ein. Die Selektivitäten an n-Pentanal und 2-Propyl-2-heptenal
sind bei 96 - 97 & bzw. 2-3 %. Aufgrund des höheren 1-Buten Anteils im Eduktstrom
der Hydroformylierung resultiert eine Produktivität von 87 gn-Pentanal kgSILP-Kat-1 h-1.
0 20 40 60 80 100 120
0
10
20
30
40
50
Xn
-Buta
n / %
Zeit / h
0
10
20
30
40
50
Si /
%

130 Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal
Abbildung 68: Direkte Umsetzung eines dehydrierten n-Butan-Gemisches zu Aldehyden. Umsatz und
Selektivität gegen den Reaktionsverlauf bei konstantem molaren Verhältnis von C4 : Synthesegas von 2
: 1.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 64,9 mlN min -1; pRaff-III,1 = 6,66 bar; pH2 = 1,67 bar; pCO
= 1,67 bar; mSILP-Kat = 3 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica 100; α = 0,1; wRh =
0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, S2-Propyl-2-heptenal.
Zusätzlich zu C5-Aldehyden werden Spuren kurzkettiger Aldehyde, speziell Propanal
und n-Butanal, detektiert. Ethen und Propen werden durch Crackreaktionen in der
Dehydrierung gebildet. Diese lösen sich in dem kondensierten C4-Gemsich und werden
der Hydroformylierung zudosiert. Nach Van Rooy et al. steigt die Aktivität mit
geringerem sterischen Anspruch des Liganden und des Substrates.[297] Somit kann
erwartet werden, dass die Hydroformylierung von Ethen gegenüber Propen und Buten
kinetisch begünstigt wird. Unter den gewählten Reaktionsbedingungen waren die
Produktivität an Propanal und n-Butanal geringer als die Produktivität von iso-Pentanal.
Dessen Selektivität beträgt wiederum weniger als 1% in der Hydroformylierung von 1-
Buten.
Eine weitere Steigerung der Reaktionstemperatur auf 550 °C führt zu keiner
Verbesserung der Ausbeute an linearem Aldehyd (siehe Kapitel XVI). Die
Deaktivierung des heterogenen Katalysators schreitet schneller voran und die
Selektivität der Nebenprodukte übersteigt die Selektivität der Butene. Dies wirkt sich
0 20 40 60 80 100 120
0
20
40
60
80
100
X1-B
ute
n / %
Zeit / h
0
20
40
60
80
100
Si /
%
De
hyd
rie
run
g,
Fü
llen
de
s V
orl
ag
eta
nks

Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal 131
auf das Produktspektrum der Hydroformylierung aus und würde eine aufwendige
Reinigung des Produktgemisches nach sich ziehen. Zusätzlich werden durch die
Nebenprodukte die Partialdrücke der C4-Komponenten erniedrigt. Dies hat zur Folge,
dass die Gas-Flüssig-Gleichgewichte zunehmend auf die Gas-Seite verschoben werden
bzw. der Taupunkt der jeweiligen Komponenten zu niedrigeren Temperaturen
verschoben wird. Folglich ist es nicht möglich, bei den gegebenen Temperaturen das
Gemisch zu verflüssigen und gegen Druck zu dosieren.
Der Benzpinakol-Ligand zählt bezüglich der n:iso-Selektivität zu den besten Liganden.
In Betrachtung der Kaskadenreaktion aus heterogen-katalysierter Dehydrierung und
SILP-katalysierter Hydroformylierung ist der Ligand nicht optimal, da dieser nur
endständige Alkene verwertet. Diese sind unter den Bedingungen der Dehydrierung
thermodynamisch nicht favorisiert. Für den Liganden vom Typ Biphephos ist dagegen
bekannt, dass dieses System aktiv in der isomerisierenden Hydroformylierung ist.[50] Im
folgenden Kapitel wird der Hydroformylierungsschritt der Sequenz mit dem Rh-
Biphephos-Komplex untersucht.
9.2 Hydroformylierung eines dehydrierten n-Butan-Stromes mit dem Rh-
Biphephos-Komplex
Der Rhodium-Benzpinakol-Komplex ist sehr effizient in der Abtrennung von 1-Buten
aus Kohlenwasserstoffströmen durch Hydroformylierung. In der Anwendung, der in
dieser Arbeit vorgestellten Kaskadenreaktion aus Dehydrierung und
Hydroformylierung, führt die hohe Selektivität des Liganden für die Umsetzung
terminaler Alkene allerdings zu einer ineffizienten Verwertung der internen Alkene.
Rhodium-Biphephos-Komplexe (Rh-BP) haben dagegen die Eigenschaft, interne
Alkene zu terminalen Alkenen zu isomerisieren und anschließend zu linearen
Aldehyden zu hydroformylieren. Die Ergebnisse der Hydroformylierung eines
dehydrierten n-Butan-Stroms mit Rh-BP sind in Abbildung 69 dargestellt. Die
Dehydrierung wird unter analogen Bedingungen zu dem Versuch in Abbildung 65
durchgeführt. Der Reaktionsverlauf bezüglich Umsatz und Selektivität ist
reproduzierbar.

132 Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal
Abbildung 69: Einfluss des Liganden auf die Verwertung der Butene eines dehydrierten n-Butan-
Stromes. Umsatz und Selektivität gegen den Reaktionsverlauf bei variablen C4 : Synthesegas –
Verhältnis.
Rh-BP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 64,9 – 129,9 mlN min -1; pRaff-III,1 = 3,33 – 6,66 bar; pH2
= 1,67 – 3,33 bar; pCO = 1,67 – 3,33bar; mSILP-Kat = 3 g; Rh(acac)(CO)2; BP; [EMIM][NTf2]; Stabilisator;
Silica 100; α = 0,1; wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
In Abbildung 69 ist auf der linken y-Achse der Umsatz an 1-Buten und der Umsatz
bezogen auf alle Alkene dargestellt. Die rechte y-Achse zeigt die Selektivität an n-
Pentanal und 2-Propyl-2-heptenal. Die Unterbrechungen im Reaktionsverlauf sind auf
Gasblasen im Pumpenkopf zurückzuführen und damit auf ein Einbrechen der
Förderleistung der HPLC-Pumpe. Zu Beginn der Hydroformylierung wird das
Synthesegas : C4 – Verhältnis bei 1 : 1 eingestellt. In der Aktivierungsphase ist der
Umsatz an 1-Buten bei 10 % und steigt kontinuierlich an. Nach 190 Stunden beträgt der
Umsatz an 1-Buten 77 %. Der Umsatz bezogen auf alle Alkene liegt bei 10 %. In
Abbildung 70 ist das Stoffmengenverhältnis gegen die Versuchslaufzeit aufgetragen.
Das molare Verhältnis von trans-2-Buten zu cis-2-Buten bleibt bis 190 Stunden
Reaktionszeit nahezu konstant. Die Verhältnisse der 2-Butene bezogen auf 1-Buten
steigen von 2 auf über 20 an. Es kann daher davon ausgegangen werden, dass primär 1-
Buten zu Aldehyd umgesetzt wird. Die Selektivität an n-Pentanal beträgt 97 % unter
diesen Versuchsbedingungen. Eine Reduzierung der Partialdrücke von Wasserstoff und
Kohlenstoffmonoxid resultiert in einer kleinen Steigerung des Umsatzes auf 93 % nach
215 Stunden Versuchslaufzeit.
0 20 40 60 80 100 120 140 160 180 200 220 240
0
20
40
60
80
100
Xi /
%
Zeit / h
De
hyd
rie
run
g,
Fü
llen
de
s V
orla
ge
tan
ks
0
20
40
60
80
100
TR = 393.15 K
Si /
%TR = 373.15 K
1 : 2Syngas : C4-Feed = 1:1

Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal 133
Abbildung 70: Änderung der Stoffmengenverhältnisse der Butene über den Reaktionsverlauf der
Hydroformylierung mit Rh-Biphephos.
Rh-BP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 64,9 – 129,9 mlN min -1; pRaff-III,1 = 3,33 – 6,66 bar; pH2
= 1,67 – 3,33 bar; pCO = 1,67 – 3,33bar; mSILP-Kat = 3 g; Rh(acac)(CO)2; BP; [EMIM][NTf2]; Stabilisator;
Silica 100; α = 0,1; wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
trans-2-Buten / cis-2-Buten, trans-2-Buten / 1-Buten, cis-2-Buten / 1-Buten.
Eine Erhöhung der Reaktionstemperatur von 100 °C auf 120 °C führt zu einem stärkeren
Anstieg des Gesamtumsatzes der Alkene im Vergleich zu dem Umsatz an 1-Buten. Die
Stoffmengenverhältnisse von trans-2-Buten und cis-2-Buten bezogen auf 1-Buten
reduzieren sich, wobei die n:iso-Selektivität unverändert bleibt. Daraus lässt sich
folgern, dass unter diesen Reaktionsbedingungen eine Umsetzung interner Alkene zu
linearen Aldehyden stattfindet. Aus dem trans/cis-2-Buten-Verhältnis lässt sich
ableiten, dass cis-2-Buten bevorzugt umgesetzt wird. Die Selektivität zu n-Pentanal
verringert sich um 2 Prozentpunkte auf 95 %. Eine vermehrte Bildung des
Folgeproduktes kann unter 120 °C Reaktionstemperatur nicht festgestellt werden. Durch
die effizientere Ausnutzung der Alkene kann eine maximale Produktivität von 120
gn-Pentanal kgSILP-Kat-1 h-1 erreicht werden.
0 50 100 150 200 250
0
5
10
15
20
25
Syngas : C4-Feedstock = 1 : 1 1 : 2
Sto
ffm
en
ge
nve
rhä
ltn
is /
mo
l m
ol-1
Zeit / h
100°C 120°C

134 Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal
9.3 Ergebnisse der Kaskadenreaktion aus heterogen-katalysierter
Dehydrierung und SILP-katalysierter Hydroformylierung
Die Ergebnisse in Kapitel 9 zeigen, dass es möglich ist, eine Kaskadenreaktion aus
heterogen katalysierter n-Butan Dehydrierung und SILP-katalysierter
Hydroformylierung über einen Zeitraum von 200 Stunden im Labor stabil zu betreiben.
Die direkte zweistufige Umsetzung von n-Butan zu n-Pentanal stellt ein
vielversprechendes Verfahren dar, das auf alternative Rohstoffquellen zurückgreift. Die
Vorteile der SILP-Katalyse werden in diesem Verfahren sehr deutlich. Die Tatsache,
dass SILP-Katalysatoren sehr effizient in der Umsetzung hochverdünnter Ströme sind,
ermöglicht die direkte Umsetzung ohne eine Aufreinigung des Produktstromes nach der
Dehydrierung. Tabelle 21 fasst die Ergebnisse der Kaskadenreaktion zusammen.
Tabelle 21: Vergleich der Produktivität an n-Pentanal in Abhängigkeit der Prozessbedingungen der
Kaskadenreaktion und des Einsatzstoffes.
Prozessbedingungen Katalysatorkomplex Produktivität
Dehydrierung
n-Butan
Hydroformylierung gn-Pentanal kgSILP-Kat
-1 h-1
450 °C, atm 100 °C, 10 bar Rh-Benzpinakol 35 – 60
450 °C, atm 100 °C, 10 bar Rh-Biphephos 20 – 120
550 °C, atm 100 °C, 10 bar Rh-Benzpinakol 87
Hydroformylierung Raffinat III bei
100 °C und 10 bar Rh-Benzpinakol 290 – 320
Für die Umsetzung der Zwischenstufe stehen grundsätzlich zwei Optionen zur
Verfügung: Das Produktgemisch der Dehydrierung kann gasförmig oder flüssig dosiert
werden. Die gasförmige Förderung mittels eines Kompressors würde alle entstandenen
Komponenten, die sich bei der Dehydrierung von Alkanen bilden, der
Hydroformylierung zuführen. Wasserstoff würde faktisch in der
Bruttoreaktionsgleichung nicht auftauchen. Unter kinetischen und reaktionstechnischen
Aspekten wäre es möglich, ohne eine zusätzliche Wasserstoffzufuhr in der
Hydroformylierung mit dem Rh-Benzpinakol auszukommen (siehe Kapitel 8.4).

Verfahren zur direkten Umsetzung von n-Butan zu n-Pentanal 135
Nachteilig wäre das Produktspektrum, das sich durch die Hydroformylierung und
Isomerisierung der kurz- und langkettigen Alkene ergeben würde. Die Selektivität des
heterogenen Katalysators für die Dehydrierung beeinflusst damit maßgeblich den sich
ergebenden Trennaufwand nach der Hydroformylierung.
Eine Kondensation der C4-Komponenten bei entsprechender Temperatur bietet
dementgegen den Vorteil, dass leichte Kohlenwasserstoffe zum Großteil im
Kondensator abgetrennt werden. Nachteilig ist, dass der entstandene Wasserstoff im
Kondensator ebenfalls abgetrennt wird und somit separat der Hydroformylierung
zugeführt werden muss. Der Wassersstoff aus dem Kondensator könnte durch eine
Membran aufgereinigt und anschließend der Hydroformylierung wieder verdichtet
zugeführt werden.[298]
Unter Berücksichtigung der bisher erzielten Ergebnisse stellen die Kondensierung des
Produktstromes der Dehydrierung und dessen Förderung mittels Pumpe einen Vorteil
für die Selektivität zu n-Pentanal gegenüber der gasförmigen Förderung mittels
Kompressor dar. Die Auswahl der Prozessvariante wird letztlich durch mehrere
Faktoren, beispielsweise Standort, energetischer Wirkungsgrad und
Rohstoffverfügbarkeit beeinflusst. Eine Verbesserung des heterogenen
Dehydrierkatalysators hinsichtlich Selektivität und Stabilität bei höheren Temperaturen
würde die Produktivität an n-Pentanal sicherlich sehr positiv beeinflussen.

136 Zusammenfassung und Ausblick
10 Zusammenfassung und Ausblick
Seit mehr als 50 Jahren wird an der Immobilisierung homogener Katalysatoren auf
porösen Trägermaterialien geforscht. Im Zusammenhang mit dieser Katalysatorklasse
stand immer die Frage über die Natur der aktiven Spezies im Raum. Diese Arbeit befasst
sich mit reaktionstechnischen Untersuchungen der Supported Ionic Liquid Phase (SILP)
– Katalyse für die Hydroformylierung von 1-Buten und liefert einen möglichen
Erklärungsansatz über die Wirkungsweise dieser Systeme in Gasphasenreaktionen.
Der erste Teil dieser Arbeit widmet sich einer intensiven reaktionstechnischen
Durchdringung der SILP-Katalyse, um effizienter zu qualitativen Aussagen über die
Wirkungsweise der Komponenten zu kommen. Dazu wurde ein Modell für die SILP-
Katalyse entwickelt, dass eine Verbindung zwischen der Kinetik der Reaktion und dem
Stofftransport in einem SILP-Katalysator herstellt. Das Modell erlaubt die
mathematische Beschreibung des Konzentrationsprofiles einer Komponente über den
Radius eines Partikels in Abhängigkeit einer dimensionslosen Kennzahl, dem SILP-
Modul ΦSILP. Abhängig von dem Konzentrationsprofil der Substrate in dem Film aus
ionischer Flüssigkeit wurden drei SILP-Moduli abgeleitet. Die drei Moduli erlauben
einen Rückschluss auf die zu verbessernden Parameter hinsichtlich Prozessbedingungen
und Materialentwicklung. Eine Validierung des Modelles anhand einer Modellreaktion,
beispielsweise einer Hydrierungs- oder Isomerisierungsreaktion, steht noch aus.
Ein zweites Modell, das in dieser Arbeit entwickelt wurde, liefert einen Ansatz zu
Erklärung der Aktivität von SILP-Katalysatoren mit geringen Beladungen an ionischer
Flüssigkeit, speziell für die Hydroformylierung von kurzkettigen Olefinen in der
Gasphase. Die Entwicklung von SLP-, SAP- und SILP-Katalysatoren war immer von
der Frage begleitet, wie der homogene Katalysatorkomplex auf dem Träger vorliegt,
nachdem das Lösungsmittel vom Träger verdampft war. In der Literatur wird eine
physisorbierte, aktive Katalysatorspezies postuliert. In dem vorgestellten Modell wird
dagegen davon ausgegangen, dass sich hochsiedende Produkte in dem Porennetzwerk
anreichern und mit der ionischen Flüssigkeit eine flüssige Phase für den
Katalysatorkomplex ausbilden. Entscheidend für die Aktivität des SILP-Katalysators
sind das Löslichkeitsverhalten der hochsiedenden Komponente mit der ionischen
Flüssigkeit und die Löslichkeit des Katalysatorkomplexes in der Mischung. Das Modell
zeigt klar die Grenzen der SILP-Katalyse am Beispiel der Hydroformylierung auf.
Sobald der Sättigungsdampfdruck des Hochsieders erreicht wird, kommt es zum
vollständigen Fluten des Porennetzwerkes. Dies führt zum Austrag der aktiven

Zusammenfassung und Ausblick 137
Komponenten mit einem flüssigen Produktstrom und folglich zur Deaktivierung des
SILP-Katalysators.
Die Versuche zur Variation der Komponenten eines SILP-Katalysators zeigen, dass die
Wahl des Präkursors Einfluss auf die Komplexierung mit dem Ligand Benzpinakol und
die Verteilung der aktiven Komponenten auf dem Trägermaterial des SILP-Katalysators
hat. Dies spiegelt sich auch in der Aktivität des SILP-Katalysators wieder. Ionische
Flüssigkeiten mit Benzyl-Substituenten am Kation erzielen keine Verbesserung
gegenüber der standardmäßig eingesetzten IL [EMIM][NTf2]. Die Übertragung des
Systems auf technische Träger ist durchführbar. Eine Langzeitstabilität über 500
Stunden konnte allerdings mit dem technischen Träger im Gegensatz zu Silica 100 nicht
gewährleistet werden.
Zur Beschreibung der SILP-katalysierten Hydroformylierung von 1-Buten wurden zwei
kinetische Modelle entwickelt. Mit Potenzansätzen lässt sich das Netzwerk der
Rhodium-katalysierten Reaktionen von 1-Buten und Synthesegas gut wiedergegeben.
Die bestimmten Reaktionsordnungen lassen ein Rückschluss auf den katalytischen
Mechanismus zu. Ein detaillierter Einblick in die Teilschritte des Katalysezyklus ist
darüber hinaus mit einem hyperbolischen Modell möglich. Um die Nebenreaktionen
abbilden zu können, wird ein Katalysezyklus für die Hydrierung und Isomerisierung
unter Synthesegas aufbauend auf Literaturdaten angenommen. Beide Modelle dienen
zur Beschreibung der Stoffmengenänderungsgeschwindigkeiten an einem Rhodium-
Benzpinakol-SILP-Katalysator. Aus der Simulation der kinetischen Parameter geht
hervor, dass die Feedzusammensetzung einen entscheidenden Einfluss auf die Aktivität
und Selektivität zum Aldehyd hat. Kohlenstoffmonoxid kann in diesem
Reaktionsnetzwerk eine steuernde Funktion zugeschrieben werden. Unter diesen
Aspekten bildet eine stöchiometrische Dosierung von Wasserstoff und
Kohlenstoffmonoxid mit dem in dieser Arbeit verwendeten Katalysatorsystem nicht das
Optimum.
Die Entwicklung eines Verfahrens zur Umsetzung von Alkanen zu Aldehyden stellt
schließlich ein innovatives Konzept dar, dass auf alternative Rohstoffquellen zur
Synthese einer Basischemikalie zugreift. Einen hochverdünnten Feedstrom effizient
umsetzen zu können, ist die hervorstechende Eigenschaft eines SILP-Katalysators
gegenüber industriell etablierten Verfahren zur Hydroformylierung. Von Vorteil sind
die kurzen Diffusionswege in einem SILP-Katalysatorpellet im Vergleich zu
Flüssigphasenprozessen. Weiterhin begünstigt die kurze Verweilzeit der Produkte in

138 Zusammenfassung und Ausblick
den Poren des Trägers die Lebensdauer des SILP-Katalysators, da aufgrund des
geringen Partialdruckes der Produkte ein hinreichend hoher Gradient für den
Phasenübergang (flüssig → gas) gegeben ist. Die Bildungsrate für die Folgereaktion der
Aldehyde wird verlangsamt und folglich auch die Bildung von Wasser, das zur
Deaktivierung des Phosphit-Liganden beitragen würde.
Diese Arbeit trägt entscheidend zum Verständnis von geträgerten homogenen
Katalysatoren und zum Verständnis des Reaktionsnetzwerkes der Hydroformylierung
von 1-Buten bei. Nach wie vor bieten SILP-Katalysatoren ein enormes Potential für
Reaktionen in der Gasphase. Im Vorfeld sollte jedoch eine detaillierte Abstimmung der
Komponenten eines SILP-Katalysators und der physikalischen Parameter der Substrate
erfolgen. Aufbauend auf den Ergebnissen und den daraus gewonnenen Erkenntnissen
dieser Arbeit sollten zukünftige Entwicklungen zur Heterogenisierung homogener
Edelmetallkomplexe effizienter und schneller zum Erfolg führen können.

Zusammenfassung und Ausblick 139
Abstract
For more than 50 years, the immobilization of homogeneous catalyst complexes is still
a topic in research. Within this research field, there was always the question about the
nature of the active species in the porous network of the support. This work concerns
with the characterization of supported ionic liquid phase (SILP) catalysts by reaction
engineering aspects and provide an explanation of the operating principles of these class
of catalysts.
The first part of this work addresses an intensive reaction engineering description of the
SILP catalysis to get more qualitative statements about the impact of the components.
On this, a model for the SILP catalysis was derived that gives a correlation between the
reaction kinetics and the mass transport insight the catalyst pellet. The model allows the
mathematical description of the concentration profile over the pellet in dependency of a
dimensionless number, the SILP-modul ΦSILP. Three different SILP-modules were
derived depending on the concentration profile of the substrate in the ionic liquid film.
With the help of the modules it is possible to check which parameter should be
optimized. A validation of the modules by means of a test reaction remains to be done.
A second model provides an explanation for the activity of SILP-catalysts with low
content of solvent for the hydroformylation reactions of short olefins. The nature of the
homogeneous catalyst on supported liquid phase (SLP) catalysts is still a topic in
research. In literature, a physisorbed active species of the homogeneous complex is
commonly postulated for SLP-catalysts because of the continuous evaporation of the
solvent under reaction conditions. The current model claims that high boiling products
are cumulating in the porous network of the support and build up an additional solvent
with the ionic liquid. The solubility of the high boiling products and the ionic liquid
plays a crucial role for the solubility of the catalyst complex and for mass transport
aspects. The saturation pressure of the high boiling products limits the operation in gas
phase applications because the active components could leach out at corresponding
reaction conditions.
The appointed precursor for a SILP catalyst showed an appreciable influence on the
activity and selectivity of the reaction. The complexation of the precursor and the ligand
as well as the distribution of the different complexes causes these behaviors. The nature
of the ionic liquid showed less impact on the activity of the SILP-catalyst. Long-term
stability tests with technical support materials for SILP-catalysts pointed out the

140 Zusammenfassung und Ausblick
feasibility with these supports but a long-term stability could not be verified over 500
hours time on stream.
Two kinetic models were derived that describe the reaction network of 1-butene with
synthesis gas under reaction conditions applied for hydroformylation. Power law
equations are suitable to model the global reactions of hydroformylation, hydrogenation,
and isomerization. The determined reaction orders are giving a first insight in the
catalytic mechanisms. Hyperbolic reaction rates were developed for a more precise
description of the catalytic proceedings. The modeling of the reaction network suggests
that for the hydrogenation and isomerization reaction another catalytic cycle occurs
under the reaction conditions for hydroformylation. Based on the hyperbolic reaction
rate equations, a simulation of the process parameters demonstrated that the feed
composition has large influence on the activity, productivity and selectivity of the
reaction.
The last part deals with the development of a process that utilizes cheap and abundant
n-butane to synthesis aldehydes. The process consists of a heterogeneously catalyzed
dehydrogenation and SILP-catalyzed hydroformylation reaction. SILP-catalysts are
quite efficient in converting highly diluted feedstocks. This positive feature makes
SILP-catalysts with fixed-bed applications superior over established industrial processes
for hydroformylation. Therefore, it is possible to convert alkanes into aldehydes in a
two-step process avoiding any purification step between. Additionally, the low
concentrations of the substrates in the feedstock for hydroformylation reduces the
deactivating of SILP-catalysts by flooding the porous network with high boiling
products.
The presented results in this work contribute to the understanding of immobilized
homogeneous catalysts on porous supports and the reaction network of 1-butene with
synthesis gas on Rh-complexes. SILP-catalysts still have a tremendous potential to
transfer homogenous catalyzed reactions into fixed-bed applications. Based on the
represented results in this thesis, the future development of SILP-catalysts should be
more efficient.

Anhang

II Literaturverzeichnis
I Literaturverzeichnis
[1] http://www.plasticisers.org/ (aufgerufen, Juni 17, 2014).
[2] http://www.dehp-facts.com/ (aufgerufen, Juni 17, 2014).
[3] Umweltbundesamt, 'Phthalate - Die nützlichen Weichmacher mit den unerwünschten
Eigenschaften', 2007.
[4] H. M. Koch, H. Drexler, J. Angerer, 'Internal exposure of nursery-school children and
their parents and teachers to di(2-ethylhexyl)phthalate (DEHP)', Int. J. Hyg. Envir. Heal.
2004, 207, 15-22.
[5] H. Koch, H. Bolt, R. Preuss, J. Angerer, 'New metabolites of di(2-ethylhexyl)phthalate
(DEHP) in human urine and serum after single oral doses of deuterium-labelled DEHP',
Arch Toxicol 2005, 79, 367-376.
[6] R. Preuss, H. M. Koch, J. Angerer, 'Biological monitoring of the five major metabolites
of di-(2-ethylhexyl)phthalate (DEHP) in human urine using column-switching liquid
chromatography–tandem mass spectrometry', J. Chromatogr. B 2005, 816, 269-280.
[7] Verband der Chemsichen Industrie e.V. - VCI, 'Die deutsche chemische Industrie 2030',
VCI-Prognos-Studie 2012.
[8] Verband der Chemsichen Industrie e.V. - VCI, 'Factbook 05 - Die Formel für
Ressourceneffizienz', 2012.
[9] K.-D. Wiese, D. Obst, in Catalytic Carbonylation Reactions, Vol. 18 (Ed.: M. Beller),
Springer Berlin Heidelberg, 2006, pp. 1-33.
[10] C. D. Frohning, C. W. Kohlpaintner, H.-W. Bohnen, in Applied Homogeneous Catalysis
with Organometallic Compounds, Wiley-VCH Verlag GmbH, 2008, pp. 29-194.
[11] R. Franke, D. Selent, A. Börner, 'Applied Hydroformylation', Chem. Rev. 2012, 112,
5675-5732.

Literaturverzeichnis III
[12] G. Frey, G. Dämbkes, 75 Jahre Oxo-Synthese, Klartext-Verlag, Essen, 2013.
[13] M. Beller, B. Cornils, C. D. Frohning, C. W. Kohlpaintner, 'Progress in
hydroformylation and carbonylation', J. Mol. Catal. A-Chem 1995, 104, 17-85.
[14] J. Pospech, I. Fleischer, R. Franke, S. Buchholz, M. Beller, 'Alternative Metals for
Homogeneous Catalyzed Hydroformylation Reactions', Angew. Chem., Int. Ed. 2013,
52, 2852-2872.
[15] P. W. N. M. Van Leeuwen, C. Claver, Rhodium Catalyzed Hydroformylation, Vol. 22,
Kluwer Academic Publishers, Dodrecht, 2000.
[16] H.-W. Bohnen, B. Cornils, in Advances in Catalysis, Vol. Volume 47, Academic Press,
2002, pp. 1-64.
[17] G. Dümbgen, D. Neubauer, 'Großtechnische Herstellung von Oxo-Alkoholen aus
Propylen in der BASF', Chem. Ing. Tech. 1969, 41, 974-980.
[18] J. Hibbel, E. Wiebus, B. Cornils, '75 Jahre Hydroformylierung – Oxoreaktoren und
Oxoanlagen der Ruhrchemie AG und der Oxea GmbH von 1938 bis 2013', Chem. Ing.
Tech. 2013, 85, 1853-1871.
[19] J. L. Vidal, W. E. Walker, 'Rhodium carbonyl cluster chemistry under high pressure of
carbon monoxide and hydrogen. 3. Synthesis, characterization, and reactivity of
HRh(CO)4', Inorg. Chem. 1981, 20, 249-254.
[20] G. Liu, R. Volken, M. Garland, 'Unmodified Rhodium-Catalyzed Hydroformylation of
Alkenes Using Tetrarhodium Dodecacarbonyl. The Infrared Characterization of 15
Acyl Rhodium Tetracarbonyl Intermediates†', Organometallics 1999, 18, 3429-3436.
[21] D. Evans, G. Yagupsky, G. Wilkinson, 'The reaction of
hydridocarbonyltris(triphenylphosphine)rhodium with carbon monoxide, and of the
reaction products, hydridodicarbonylbis(triphenylphosphine)rhodium and dimeric
species, with hydrogen', J. Chem. Soc. A. 1968, 2660-2665.

IV Literaturverzeichnis
[22] L. H. Slaugh, R. D. Mullineaux, 'Novel Hydroformylation catalysts', J. Organomet.
Chem. 1968, 13, 469-477.
[23] J. T. Carlock, 'A comparative study of triphenylamine, triphenylphosphine,
triphenylarsine, triphenylantimony and triphenylbismuth as ligands in the rhodium-catal
yzed hydroformylation of 1-dodecene', Tetrahedron 1984, 40, 185-187.
[24] S. S. Bath, L. Vaska, 'Five-Coordinate Hydrido-Carbonyl Complexes of Rhodium and
Iridium and their Analogy with CoH(CO)4', J. Am. Chem. Soc. 1963, 85, 3500-3501.
[25] D. Evans, J. A. Osborn, G. Wilkinson, 'Hydroformylation of alkenes by use of rhodium
complex catalysts', J. Chem. Soc. A. 1968, 3133-3142.
[26] L. Damoense, M. Datt, M. Green, C. Steenkamp, 'Recent advances in high-pressure
infrared and NMR techniques for the determination of catalytically active species in
rhodium- and cobalt-catalysed hydroformylation reactions', Coordin. Chem. Rev. 2004,
248, 2393-2407.
[27] A. R. Sanger, 'Hydroformylation of 1-hexene catalysed by complexes of rhodium(I)
with DI- or tritertiary phosphines', J. Mol. Catal. 1978, 3, 221-226.
[28] T. J. Devon, G. W. Phillips, T. A. Puckette, J. L. Stavinoha, J. J. Vanderbilt, U.S. Patent
4694109 (1987), Texas Eastman.
[29] C. P. Casey, G. T. Whiteker, M. G. Melville, L. M. Petrovich, J. A. Gavney, D. R.
Powell, 'Diphosphines with natural bite angles near 120.degree. increase selectivity for
n-aldehyde formation in rhodium-catalyzed hydroformylation', J. Am. Chem. Soc. 1992,
114, 5535-5543.
[30] C. P. Casey, L. M. Petrovich, '(Chelating diphosphine)rhodium-Catalyzed
Deuterioformylation of 1-Hexene: Control of Regiochemistry by the Kinetic Ratio of
Alkylrhodium Species Formed by Hydride Addition to Complexed Alkene', J. Am.
Chem. Soc. 1995, 117, 6007-6014.

Literaturverzeichnis V
[31] C. P. Casey, E. L. Paulsen, E. W. Beuttenmueller, B. R. Proft, B. A. Matter, D. R.
Powell, 'Electronically Dissymmetric DIPHOS Derivatives Give Higher n:i
Regioselectivity in Rhodium-Catalyzed Hydroformylation Than Either of Their
Symmetric Counterparts', J. Am. Chem. Soc. 1998, 121, 63-70.
[32] L. A. van der Veen, P. C. J. Kamer, P. W. N. M. van Leeuwen, 'Hydroformylation of
Internal Olefins to Linear Aldehydes with Novel Rhodium Catalysts', Angew. Chem.,
Int. Ed. 1999, 38, 336-338.
[33] L. A. van der Veen, P. H. Keeven, G. C. Schoemaker, J. N. H. Reek, P. C. J. Kamer, P.
W. N. M. van Leeuwen, M. Lutz, A. L. Spek, 'Origin of the Bite Angle Effect on
Rhodium Diphosphine Catalyzed Hydroformylation', Organometallics 2000, 19, 872-
883.
[34] M. Kranenburg, Y. E. M. van der Burgt, P. C. J. Kamer, P. W. N. M. van Leeuwen, K.
Goubitz, J. Fraanje, 'New Diphosphine Ligands Based on Heterocyclic Aromatics
Inducing Very High Regioselectivity in Rhodium-Catalyzed Hydroformylation: Effect
of the Bite Angle', Organometallics 1995, 14, 3081-3089.
[35] C. P. Casey, G. T. Whiteker, 'The Natural Bite Angle of Chelating Diphosphines', Isr.
J. Chem. 1990, 30, 299-304.
[36] J. D. Unruh, J. R. Christenson, 'A study of the mechanism of rhodium/phosphine-
catalyzed hydroformylation: use of 1,1′-bis(diarylphosphino)ferrocene ligands', J. Mol.
Catal. 1982, 14, 19-34.
[37] L. A. van der Veen, M. D. K. Boele, F. R. Bregman, P. C. J. Kamer, P. W. N. M. van
Leeuwen, K. Goubitz, J. Fraanje, H. Schenk, C. Bo, 'Electronic Effect on Rhodium
Diphosphine Catalyzed Hydroformylation: The Bite Angle Effect Reconsidered', J. Am.
Chem. Soc. 1998, 120, 11616-11626.
[38] E. Billig, A. G. Abatjoglou, D. R. Bryant, R. E. Murray, J. M. Maher, U.S. Patent
4599206 (1986), UCC.

VI Literaturverzeichnis
[39] E. Billig, A. G. Abatjoglou, D. R. Bryant, U.S. Patent 4668651 (1987), UCC.
[40] E. Billig, A. G. Abatjoglou, D. R. Bryant, U.S Patent 4769498 (1987), UCC.
[41] A. van Rooy, P. C. J. Kamer, P. W. N. M. van Leeuwen, K. Goubitz, J. Fraanje, N.
Veldman, A. L. Spek, 'Bulky Diphosphite-Modified Rhodium Catalysts:
Hydroformylation and Characterization', Organometallics 1996, 15, 835-847.
[42] C. B. Dieleman, P. C. J. Kamer, J. N. H. Reek, P. W. N. M. van Leeuwen, 'Xantphite:
A New Family of Ligands for Catalysis. Applications in the Hydroformylation of
Alkenes', Helv. Chim. Acta 2001, 84, 3269-3280.
[43] C. Kunze, D. Selent, I. Neda, M. Freytag, P. G. Jones, R. Schmutzler, W. Baumann, A.
Börner, 'Calix[4]arene-based Bis-phosphonites, Bis-phosphites, and Bis-O-acyl-
phosphites as Ligands in the Rhodium(I)-catalyzed Hydroformylation of 1-Octene', Z.
Anorg. Allg. Chem. 2002, 628, 779-787.
[44] D. Sémeril, C. Jeunesse, D. Matt, L. Toupet, 'Regioselectivity with Hemispherical
Chelators: Increasing the Catalytic Efficiency of Complexes of Diphosphanes with
Large Bite Angles', Angew, Chem. 2006, 118, 5942-5946.
[45] D. Selent, W. Baumann, K.-D. Wiese, A. Borner, 'Diastereoisomeric bisphosphite
ligands in the hydroformylation of octenes: rhodium catalysis and HP-NMR
investigations', Chem. Commun. 2008, 6203-6205.
[46] D. Sémeril, D. Matt, L. Toupet, 'Highly Regioselective Hydroformylation with
Hemispherical Chelators', Chem.-Eur. J. 2008, 14, 7144-7155.
[47] G. D. Cuny, S. L. Buchwald, 'Practical, high-yield, regioselective, rhodium-catalyzed
hydroformylation of functionalized .alpha.-olefins', J. Am. Chem. Soc. 1993, 115, 2066-
2068.

Literaturverzeichnis VII
[48] B. Moasser, W. L. Gladfelter, D. C. Roe, 'Mechanistic Aspects of a Highly
Regioselective Catalytic Alkene Hydroformylation using a Rhodium Chelating
Bis(phosphite) Complex', Organometallics 1995, 14, 3832-3838.
[49] A. Behr, D. Obst, C. Schulte, T. Schosser, 'Highly selective tandem isomerization–
hydroformylation reaction of trans-4-octene to n-nonanal with rhodium-BIPHEPHOS
catalysis', J. Mol. Catal. A-Chem 2003, 206, 179-184.
[50] C. Vogl, E. Paetzold, C. Fischer, U. Kragl, 'Highly selective hydroformylation of
internal and terminal olefins to terminal aldehydes using a rhodium-BIPHEPHOS-
catalyst system', J. Mol. Catal. A-Chem 2005, 232, 41-44.
[51] D. Selent, R. Franke, C. Kubis, A. Spannenberg, W. Baumann, B. Kreidler, A. Börner,
'A New Diphosphite Promoting Highly Regioselective Rhodium-Catalyzed
Hydroformylation', Organometallics 2011, 30, 4509-4514.
[52] I. Piras, R. Jennerjahn, R. Jackstell, W. Baumann, A. Spannenberg, R. Franke, K.-D.
Wiese, M. Beller, 'Synthesis of novel rhodium phosphite catalysts for efficient and
selective isomerization–hydroformylation reactions', J. Organomet. Chem. 2010, 695,
479-486.
[53] I. S. Mikhel, N. V. Dubrovina, I. A. Shuklov, W. Baumann, D. Selent, H. Jiao, A.
Christiansen, R. Franke, A. Börner, 'Synthesis, complexation behavior and application
of a new diphosphite ligand in rhodium-catalyzed hydroformylation', J. Organomet.
Chem. 2011, 696, 3050-3057.
[54] J. Svara, N. Weferling, T. Hofmann, in Ullmann's Encyclopedia of Industrial Chemistry,
Wiley-VCH Verlag GmbH & Co. KGaA, 2000.
[55] P. W. N. M. van Leeuwen, J. C. Chadwick, in Homogeneous Catalysts, Wiley-VCH
Verlag GmbH & Co. KGaA, 2011, pp. 1-49.
[56] E. Billig, A. G. Abatjoglou, D. R. Bryant, R. E. Murray, J. M. Maher, U.S. Patent
4717775 (1988), UCC.

VIII Literaturverzeichnis
[57] H. Tricas, O. Diebolt, P. W. N. M. van Leeuwen, 'Bulky monophosphite ligands for
ethene hydroformylation', J. Catal. 2013, 298, 198-205.
[58] A. Christiansen, D. Selent, A. Spannenberg, M. Köckerling, H. Reinke, W. Baumann,
H. Jiao, R. Franke, A. Börner, 'Heteroatom-Substituted Secondary Phosphine Oxides
(HASPOs) as Decomposition Products and Preligands in Rhodium-Catalysed
Hydroformylation', Chem.-Eur. J. 2011, 17, 2120-2129.
[59] A. J. Dennis, G. E. Harrison, J. P. Wyber, U.S. Patent 4567306 (1986), Davy McKee
Corporation.
[60] J. E. Babin, J. M. Maher, E. Billig, U.S. Patent 5364950 (1994), UCC.
[61] G. Kiedorf, D. M. Hoang, A. Müller, A. Jörke, J. Markert, H. Arellano-Garcia, A.
Seidel-Morgenstern, C. Hamel, 'Kinetics of 1-dodecene hydroformylation in a
thermomorphic solvent system using a rhodium-biphephos catalyst', Chem. Eng. Sci.
2013.
[62] J. J. Carbó, F. Maseras, C. Bo, P. W. N. M. van Leeuwen, 'Unraveling the Origin of
Regioselectivity in Rhodium Diphosphine Catalyzed Hydroformylation. A DFT
QM/MM Study', J. Am. Chem. Soc. 2001, 123, 7630-7637.
[63] R. Lazzaroni, R. Settambolo, G. Alagona, C. Ghio, 'Investigation of alkyl metal
intermediate formation in the rhodium-catalyzed hydroformylation: Experimental and
theoretical approaches', Coordin. Chem. Rev. 2010, 254, 696-706.
[64] F. Obenaus, W. Droste, J. Neumeister, in Ullmann's Encyclopedia of Industrial
Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 2000.
[65] K. Weissermel, H.-J. Arpe, in Industrial Organic Chemistry, Wiley-VCH Verlag
GmbH, 2007.
[66] E. Greiner, R. Gubler, Y. Inoguchi, Linear Alpha Olefins, Chemical Economics
Handbook CEH - Marketing Research Report, SRI International, 2004.

Literaturverzeichnis IX
[67] F. A. Al-Sherehy, in Studies in Surface Science and Catalysis, Vol. Volume 100 (Eds.:
J. B. M. Absi-Halabi, A. Stanislaus), Elsevier, 1996, pp. 515-523.
[68] R. W. Baker, K. Lokhandwala, 'Natural Gas Processing with Membranes: An
Overview', Ind. Eng. Chem. Res. 2008, 47, 2109-2121.
[69] U. Lubenau, Hecker, S. Wohlrab, 'Silikatschichten auf porösen keramischen Trägern -
Membranen für die Aufbereitung von Erdgas und Erdölbegleitgas', DBI - GTI
Geotechnologisches Institut 2009.
[70] K. Neubauer, R. Dragomirova, M. Stöhr, R. Mothes, U. Lubenau, D. Paschek, S.
Wohlrab, 'Combination of membrane separation and gas condensation for advanced
natural gas conditioning', J. Membrane Sci. 2014, 453, 100-107.
[71] M. Appl, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag
GmbH & Co. KGaA, 2000.
[72] H. Hiller, R. Reimert, H.-M. Stönner, in Ullmann's Encyclopedia of Industrial
Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 2000.
[73] K.-i. Tominaga, Y. Sasaki, 'Ruthenium-catalyzed one-pot hydroformylation of alkenes
using carbon dioxide as a reactant', J. Mol. Catal. A-Chem 2004, 220, 159-165.
[74] K.-i. Tominaga, 'An environmentally friendly hydroformylation using carbon dioxide
as a reactant catalyzed by immobilized Ru-complex in ionic liquids', Catal. Today 2006,
115, 70-72.
[75] M.-L. Kontkanen, L. Oresmaa, M. A. Moreno, J. Jänis, E. Laurila, M. Haukka, 'One-
dimensional metal atom chain [Ru(CO)4]n as a catalyst precursor—Hydroformylation
of 1-hexene using carbon dioxide as a reactant', Appl. Catal., A 2009, 365, 130-134.
[76] D. Sanfilippo, I. Miracca, 'Dehydrogenation of paraffins: synergies between catalyst
design and reactor engineering', Catal. Today 2006, 111, 133-139.

X Literaturverzeichnis
[77] F. Cavani, M. Koutyrev, F. Trifirò, A. Bartolini, D. Ghisletti, R. Iezzi, A. Santucci, G.
Del Piero, 'Chemical and Physical Characterization of Alumina-Supported Chromia-
Based Catalysts and Their Activity in Dehydrogenation of Isobutane', J. Catal. 1996,
158, 236-250.
[78] M. A. Vuurman, I. E. Wachs, D. J. Stufkens, A. Oskam, 'Characterization of chromium
oxide supported on Al2O3, ZrO2, TiO2, and SiO2 under dehydrated conditions', J. Mol.
Catal. 1993, 80, 209-227.
[79] B. M. Weckhuysen, I. E. Wachs, R. A. Schoonheydt, 'Surface Chemistry and
Spectroscopy of Chromium in Inorganic Oxides', Chem. Rev. 1996, 96, 3327-3350.
[80] B. M. Weckhuysen, R. A. Schoonheydt, 'Alkane dehydrogenation over supported
chromium oxide catalysts', Catal. Today 1999, 51, 223-232.
[81] A. Hakuli, A. Kytökivi, A. O. I. Krause, 'Dehydrogenation of i-butane on CrOx/Al2O3
catalysts prepared by ALE and impregnation techniques', Appl. Catal., A 2000, 190,
219-232.
[82] M. Cherian, M. S. Rao, W.-T. Yang, J.-M. Jehng, A. M. Hirt, G. Deo, 'Oxidative
dehydrogenation of propane over Cr2O3/Al2O3 and Cr2O3 catalysts: effects of loading,
precursor and surface area', Appl. Catal., A 2002, 233, 21-33.
[83] R. L. Puurunen, B. M. Weckhuysen, 'Spectroscopic Study on the Irreversible
Deactivation of Chromia/Alumina Dehydrogenation Catalysts', J. Catal. 2002, 210,
418-430.
[84] J. C. Bricker, D.-Y. Jan, J. M. Foresman, US 4914075 UOP Inc.
[85] S. Miguel, A. Castro, O. Scelza, J. Soria, 'Effect of the addition of alkali metals on the
metallic phase of Pt/Al2O3 catalysts', Catal Lett 1995, 32, 281-291.

Literaturverzeichnis XI
[86] O. A. Bariås, A. Holmen, E. A. Blekkan, 'Propane Dehydrogenation over Supported Pt
and Pt–Sn Catalysts: Catalyst Preparation, Characterization, and Activity
Measurements', J. Catal. 1996, 158, 1-12.
[87] R. D. Cortright, J. M. Hill, J. A. Dumesic, 'Selective dehydrogenation of isobutane over
supported Pt/Sn catalysts', Catal. Today 2000, 55, 213-223.
[88] M.-H. Lee, B. M. Nagaraja, K. Y. Lee, K.-D. Jung, 'Dehydrogenation of alkane to light
olefin over PtSn/θ-Al2O3 catalyst: Effects of Sn loading', Catal. Today 2013.
[89] Y. Zhang, Y. Zhou, A. Qiu, Y. Wang, Y. Xu, P. Wu, 'Propane dehydrogenation on
PtSn/ZSM-5 catalyst: Effect of tin as a promoter', Catal. Commun. 2006, 7, 860-866.
[90] Z. Nawaz, W. Fei, 'Pt−Sn-Based SAPO-34 Supported Novel Catalyst for n-Butane
Dehydrogenation', Ind. Eng. Chem. Res. 2009, 48, 7442-7447.
[91] B. Yilmaz, U. Müller, 'Catalytic Applications of Zeolites in Chemical Industry', Top.
Catal. 2009, 52, 888-895.
[92] M. M. Bhasin, J. H. McCain, B. V. Vora, T. Imai, P. R. Pujadó, 'Dehydrogenation and
oxydehydrogenation of paraffins to olefins', Appl. Catal., A 2001, 221, 397-419.
[93] K. J. Caspary, H. Gehrke, M. Heinritz-Adrian, M. Schwefer, in Handbook of
Heterogeneous Catalysis, Wiley-VCH Verlag GmbH & Co. KGaA, 2008.
[94] GB 778821 (1957), Houdry Process Corp.
[95] R. M. Shirk, R. G. Carig, A. W. Hoge, GB 794089 (1958), Houdry Process Corp.
[96] http://www.cbi.com/images/uploads/tech_sheets/CatofinDehyrogenation-12.pdf,
aufgerufen, Jan. 22, 2014.
[97] http://www.uop.com/?document=uop-olefin-production-solutions-
brochure&download=1, aufgerufen, Jan. 22, 2014.

XII Literaturverzeichnis
[98] http://www.thyssenkrupp-industrial-
solutions.com/fileadmin/documents/brochures/uhde_brochures_pdf_en_12.pdf,
aufgerufen, Jan. 22, 2014.
[99] D. Sanfilippo, P. N. Rylander, in Ullmann's Encyclopedia of Industrial Chemistry,
Wiley-VCH Verlag GmbH & Co. KGaA, 2000.
[100] H. Zimmermann, F. Versluis, US 5378350 (1995), Linde AG, Engelhard De Meern B.V.
[101] D. Sanfilippo, F. Buonomo, G. Fusco, I. Miracca, G. R.Kotelnikov, in Studies in Surface
Science and Catalysis, Vol. Volume 119 (Eds.: D. S. F. F. A. V. A. Parmaliana, A. F),
Elsevier, 1998, pp. 919-924.
[102] M. P. Atkins, G. R. Evans, 'Catalytic Dehydrogenation - A Review of current Processes
and Innovations', Erdöl Erdgas Kohle 1995, 111, 271 - 274.
[103] H. Bölt, H. Zimmermann, 'Dehydrogenation Process for Propane and Isobutane', Erdöl
Erdgas Kohle 1995, 111, 90 - 93.
[104] S. Airaksinen, Dissertation - Chromium oxide catalysts in the deyhdrogeantion of
alkanes, Helsinki University of Technology 2005.
[105] R. Iezzi, A. Bartolini, US 5633421 (1997), Eniricerche SPA, Snamprogetti SPA.
[106] E. C. Luckenbach, F. A. Zenz, G. Papa, A. Bartolini, US 5656243 (1997), Snamprogetti
SPA.
[107] D. J. Cole-Hamilton, R. P. Tooze, Catalyst Separation, Recovery and Recyling,
Springer, 2006.
[108] E. Wiebus, B. Cornils, 'Die großtechnische Oxosynthese mit immobilisiertem
Katalysator', Chem. Ing. Tech. 1994, 66, 916-923.
[109] C. Kohlpaintner, in Encyclopedia of Catalysis, John Wiley & Sons, Inc., 2002.

Literaturverzeichnis XIII
[110] B. Cornils, W. A. Herrmann, I. T. Horváth, W. Leitner, S. Mecking, H. Olivier-
Bourbigou, D. Vogt, in Multiphase Homogeneous Catalysis, Wiley-VCH Verlag
GmbH, 2008.
[111] B. Cornils, E. G. Kuntz, 'Introducing TPPTS and related ligands for industrial biphasic
processes', J. Organomet. Chem. 1995, 502, 177-186.
[112] B. Cornils, 'Bulk and fine chemicals via aqueous biphasic catalysis', J. Mol. Catal. A-
Chem 1999, 143, 1-10.
[113] C. W. Kohlpaintner, R. W. Fischer, B. Cornils, 'Aqueous biphasic catalysis:
Ruhrchemie/Rhône-Poulenc oxo process', Appl. Catal., A 2001, 221, 219-225.
[114] S. L. Desset, S. W. Reader, D. J. Cole-Hamilton, 'Aqueous-biphasic hydroformylation
of alkenes promoted by "weak" surfactants', Green Chem. 2009, 11, 630-637.
[115] F. Van Vyve, A. Renken, 'Hydroformylation in reverse micellar systems', Catal. Today
1999, 48, 237-243.
[116] A. Riisager, B. E. Hanson, 'CTAB micelles and the hydroformylation of octene with
rhodium/TPPTS catalysts: Evidence for the interaction of TPPTS with micelle surfaces',
J. Mol. Catal. A-Chem 2002, 189, 195-202.
[117] R. F. Mason, M. Valley, US 3686352 (1971), Shell Oil Company.
[118] E. F. Lutz, 'Shell higher olefins process', J. Chem. Educ. 1986, 63, 202.
[119] C. C. Brasse, U. Englert, A. Salzer, H. Waffenschmidt, P. Wasserscheid, 'Ionic
Phosphine Ligands with Cobaltocenium Backbone: Novel Ligands for the Highly
Selective, Biphasic, Rhodium-Catalyzed Hydroformylation of 1-Octene in Ionic
Liquids†', Organometallics 2000, 19, 3818-3823.
[120] P. Wasserscheid, H. Waffenschmidt, P. Machnitzki, K. W. Kottsieper, O. Stelzer,
'Cationic phosphine ligands with phenylguanidinium modified xanthene moieties-a

XIV Literaturverzeichnis
successful concept for highly regioselective, biphasic hydroformylation of oct-1-ene in
hexafluorophosphate ionic liquids', Chem. Commun. 2001, 451-452.
[121] M. Earle, P. Wasserscheid, P. Schulz, H. Olivier-Bourbigou, F. Favre, M. Vaultier, A.
Kirschning, V. Singh, A. Riisager, R. Fehrmann, S. Kuhlmann, in Ionic Liquids in
Synthesis, Wiley-VCH Verlag GmbH & Co. KGaA, 2008, pp. 265-568.
[122] F. Favre, H. Olivier-Bourbigou, D. Commereuc, L. Saussine, 'Hydroformylation of 1-
hexene with rhodium in non-aqueous ionic liquids : how to design the solvent and the
ligand to the reaction', Chem. Commun. 2001, 1360-1361.
[123] P. Wasserscheid, W. Keim, 'Ionic Liquids—New “Solutions” for Transition Metal
Catalysis', Angew. Chem., Int. Ed. 2000, 39, 3772-3789.
[124] T. Welton, 'Room-Temperature Ionic Liquids. Solvents for Synthesis and Catalysis',
Chem. Rev. 1999, 99, 2071-2084.
[125] T. Welton, 'Ionic liquids in catalysis', Coordin. Chem. Rev. 2004, 248, 2459-2477.
[126] J. P. Hallett, T. Welton, 'Room-Temperature Ionic Liquids: Solvents for Synthesis and
Catalysis. 2', Chem. Rev. 2011, 111, 3508-3576.
[127] V. I. Pârvulescu, C. Hardacre, 'Catalysis in Ionic Liquids', Chem. Rev. 2007, 107, 2615-
2665.
[128] M. Haumann, A. Riisager, 'Hydroformylation in Room Temperature Ionic Liquids
(RTILs): Catalyst and Process Developments', Chem. Rev. 2008, 108, 1474-1497.
[129] H. Olivier-Bourbigou, L. Magna, D. Morvan, 'Ionic liquids and catalysis: Recent
progress from knowledge to applications', Appl. Catal., A 2010, 373, 1-56.
[130] H. Olivier-Bourbigou, F. Favre, A. Forestière, F. Hugues, in Handbook of Green
Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 2010.

Literaturverzeichnis XV
[131] I. T. Horváth, J. Rábai, 'Facile Catalyst Separation Without Water: Fluorous Biphase
Hydroformylation of Olefins', Science 1994, 266, 72-75.
[132] D. F. Foster, D. Gudmunsen, D. J. Adams, A. M. Stuart, E. G. Hope, D. J. Cole-
Hamilton, G. P. Schwarz, P. Pogorzelec, 'Hydroformylation in perfluorinated solvents;
improved selectivity, catalyst retention and product separation', Tetrahedron 2002, 58,
3901-3910.
[133] G. Pozzi, I. Shepperson, 'Fluorous chiral ligands for novel catalytic systems', Coordin.
Chem. Rev. 2003, 242, 115-124.
[134] C. C. Tzschucke, C. Markert, W. Bannwarth, S. Roller, A. Hebel, R. Haag, 'Modern
Separation Techniques for the Efficient Workup in Organic Synthesis', Angew. Chem.,
Int. Ed. 2002, 41, 3964-4000.
[135] A. Behr, G. Henze, L. Johnen, C. Awungacha, 'Advances in thermomorphic
liquid/liquid recycling of homogeneous transition metal catalysts', J. Mol. Catal. A-
Chem 2008, 285, 20-28.
[136] A. Behr, G. Henze, D. Obst, B. Turkowski, 'Selection process of new solvents in
temperature-dependent multi-component solvent systems and its application in
isomerising hydroformylation', Green Chem. 2005, 7, 645-649.
[137] A. Behr, D. Obst, B. Turkowski, 'Isomerizing hydroformylation of trans-4-octene to n-
nonanal in multiphase systems: acceleration effect of propylene carbonate', J. Mol.
Catal. A-Chem 2005, 226, 215-219.
[138] P. G. Jessop, T. Ikariya, R. Noyori, 'Homogeneous Catalysis in Supercritical Fluids',
Chem. Rev. 1999, 99, 475-494.
[139] W. Leitner, 'Supercritical Carbon Dioxide as a Green Reaction Medium for Catalysis',
Accounts Chem. Res. 2002, 35, 746-756.

XVI Literaturverzeichnis
[140] D. Koch, W. Leitner, 'Rhodium-Catalyzed Hydroformylation in Supercritical Carbon
Dioxide', J. Am. Chem. Soc. 1998, 120, 13398-13404.
[141] P. B. Webb, T. E. Kunene, D. J. Cole-Hamilton, 'Continuous flow homogeneous
hydroformylation of alkenes using supercritical fluids', Green Chem. 2005, 7, 373-379.
[142] T. E. Kunene, P. B. Webb, D. J. Cole-Hamilton, 'Highly selective hydroformylation of
long-chain alkenes in a supercritical fluid ionic liquid biphasic system', Green Chem.
2011, 13, 1476-1481.
[143] T. Jongsma, M. Fossen, G. Challa, P. W. N. M. van Leeuwen, 'Fine tuning of bulky-
phosphite modified rhodium catalysts by binding them to copolymers', J. Mol. Catal.
1993, 83, 17-35.
[144] T. Jongsma, H. van Aert, M. Fossen, G. Challa, P. W. N. M. van Leeuwen, 'Stable silica-
grafted polymer-bound bulky-phosphite modified rhodium hydroformylation catalysts',
J. Mol. Catal. 1993, 83, 37-50.
[145] R. Augustine, S. Tanielyan, S. Anderson, H. Yang, 'A new technique for anchoring
homogeneous catalysts', Chem. Commun. 1999, 1257-1258.
[146] E. Lindner, T. Schneller, F. Auer, H. A. Mayer, 'Chemistry in Interphases—A New
Approach to Organometallic Syntheses and Catalysis', Angew. Chem., Int. Ed. 1999, 38,
2154-2174.
[147] N. E. Leadbeater, M. Marco, 'Preparation of Polymer-Supported Ligands and Metal
Complexes for Use in Catalysis', Chem. Rev. 2002, 102, 3217-3274.
[148] G. J. K. Acres, G. C. Bond, B. J. Cooper, J. A. Dawson, 'The use of supported solutions
of rhodium trichloride for homogeneous catalysis', J. Catal. 1966, 6, 139-141.
[149] P. R. Rony, 'Diffusion kinetics within supported liquid-phase catalysts', J. Catal. 1969,
14, 142-147.

Literaturverzeichnis XVII
[150] A. Beckmann, F. J. Keil, 'Increasing yield and operating time of SLP-catalyst processes
by flow reversal and instationary operation', Chem. Eng. Sci. 2003, 58, 841-847.
[151] J. P. Arhancet, M. E. Davis, J. S. Merola, B. E. Hanson, 'Hydroformlyation by aqueous-
phase catalysis: a new class of heterogeneous catalysts', Nature 1989, 339, 454 - 455
[152] A. Riisager, K. M. Eriksen, J. Hjortkjær, R. Fehrmann, 'Propene hydroformylation by
supported aqueous-phase Rh-NORBOS catalysts', J. Mol. Catal. A-Chem 2003, 193,
259-272.
[153] C. P. Mehnert, R. A. Cook, N. C. Dispenziere, M. Afeworki, 'Supported Ionic Liquid
Catalysis − A New Concept for Homogeneous Hydroformylation Catalysis', J. Am.
Chem. Soc. 2002, 124, 12932-12933.
[154] C. P. Mehnert, E. J. Mozeleski, R. A. Cook, 'Supported ionic liquid catalysis
investigated for hydrogenation reactions', Chem. Commun. 2002, 3010-3011.
[155] A. Riisager, P. Wasserscheid, R. van Hal, R. Fehrmann, 'Continuous fixed-bed gas-
phase hydroformylation using supported ionic liquid-phase (SILP) Rh catalysts', J.
Catal. 2003, 219, 452-455.
[156] P. Wasserscheid, 'Volatile times for ionic liquids', Nature 2006, 439, 831-834.
[157] J. P. Armstrong, C. Hurst, R. G. Jones, P. Licence, K. R. J. Lovelock, C. J. Satterley, I.
J. Villar-Garcia, 'Vapourisation of ionic liquids', Phys. Chem. Chem. Phys. 2007, 9, 982-
990.
[158] C. Van Doorslaer, J. Wahlen, P. Mertens, K. Binnemans, D. De Vos, 'Immobilization
of molecular catalysts in supported ionic liquid phases', Dalton Trans. 2010, 39, 8377-
8390.
[159] M. H. Valkenberg, C. deCastro, W. F. Holderich, 'Immobilisation of ionic liquids on
solid supports', Green Chem. 2002, 4, 88-93.

XVIII Literaturverzeichnis
[160] C. Zhong, T. Sasaki, M. Tada, Y. Iwasawa, 'Ni ion-containing ionic liquid salt and Ni
ion-containing immobilized ionic liquid on silica: Application to Suzuki cross-coupling
reactions between chloroarenes and arylboronic acids', J. Catal. 2006, 242, 357-364.
[161] W. Chen, Y. Zhang, L. Zhu, J. Lan, R. Xie, J. You, 'A Concept of Supported Amino
Acid Ionic Liquids and Their Application in Metal Scavenging and Heterogeneous
Catalysis', J. Am. Chem. Soc. 2007, 129, 13879-13886.
[162] Y. Gu, C. Ogawa, J. Kobayashi, Y. Mori, S. Kobayashi, 'A Heterogeneous Silica-
Supported Scandium/Ionic Liquid Catalyst System for Organic Reactions in Water',
Angew. Chem., Int. Ed. 2006, 45, 7217-7220.
[163] A. Jess, W. Korth, B. Etzold, WO 2007124896 (2007), Sued Chemie AG, Jess, A.,
Korth, W., Etzold, B.
[164] U. Kernchen, B. Etzold, W. Korth, A. Jess, 'Solid Catalyst with Ionic Liquid Layer
(SCILL) – A New Concept to Improve Selectivity Illustrated by Hydrogenation of
Cyclooctadiene', Chem. Eng. Technol. 2007, 30, 985-994.
[165] T. Mangartz, W. Korth, C. Kern, A. Jess, 'Selective hydrogenation of 1,3-butadiene
from crude C4 cracker stream with a solid catalyst with ionic liquid layer (SCILL) -
DSC and solubility study', DGMK Tagungsbericht 2013, 2, 243-248.
[166] M. Sobota, M. Happel, M. Amende, N. Paape, P. Wasserscheid, M. Laurin, J. Libuda,
'Ligand Effects in SCILL Model Systems: Site-Specific Interactions with Pt and Pd
Nanoparticles', Adv. Mater. 2011, 23, 2617-2621.
[167] K. B. Sidhpuria, A. L. Daniel-da-Silva, T. Trindade, J. A. P. Coutinho, 'Supported ionic
liquid silica nanoparticles (SILnPs) as an efficient and recyclable heterogeneous catalyst
for the dehydration of fructose to 5-hydroxymethylfurfural', Green Chem. 2011, 13,
340-349.
[168] F. T. U. Kohler, B. Morain, A. Weiß, M. Laurin, J. Libuda, V. Wagner, B. U. Melcher,
X. Wang, K. Meyer, P. Wasserscheid, 'Surface-Functionalized Ionic Liquid Crystal–

Literaturverzeichnis XIX
Supported Ionic Liquid Phase Materials: Ionic Liquid Crystals in Mesopores',
ChemPhysChem 2011, 12, 3539-3546.
[169] P. Lozano, E. Garcia-Verdugo, N. Karbass, K. Montague, T. De Diego, M. I. Burguete,
S. V. Luis, 'Supported Ionic Liquid-Like Phases (SILLPs) for enzymatic processes:
Continuous KR and DKR in SILLP-scCO2 systems', Green Chem. 2010, 12, 1803-
1810.
[170] D. W. Kim, D. Y. Chi, 'Polymer-Supported Ionic Liquids: Imidazolium Salts as
Catalysts for Nucleophilic Substitution Reactions Including Fluorinations', Angew.
Chem., Int. Ed. 2004, 43, 483-485.
[171] J. Sun, W. Cheng, W. Fan, Y. Wang, Z. Meng, S. Zhang, 'Reusable and efficient
polymer-supported task-specific ionic liquid catalyst for cycloaddition of epoxide with
CO2', Catal. Today 2009, 148, 361-367.
[172] F. J. Hernández-Fernández, A. P. de los Ríos, F. Tomás-Alonso, J. M. Palacios, G.
Víllora, 'Preparation of supported ionic liquid membranes: Influence of the ionic liquid
immobilization method on their operational stability', J. Membrane Sci. 2009, 341, 172-
177.
[173] L. A. Neves, J. G. Crespo, I. M. Coelhoso, 'Gas permeation studies in supported ionic
liquid membranes', J. Membrane Sci. 2010, 357, 160-170.
[174] E. W. Thiele, 'Relation between Catalytic Activity and Size of Particle', Ind. Eng. Chem.
1939, 31, 916 - 920.
[175] A. Jess, P. Wasserscheid, Chemical Technology, Wiley-VCH, Weinheim, 2013.
[176] O. A. Hougen, K. M. Watson, 'General Principles', Ind. Eng. Chem. 1943, 35, 529-541.
[177] O. A. Hougen, K. M. Watson, Chemical Process Principles: Kinetics and Catalysis,
Wiley, 1947.

XX Literaturverzeichnis
[178] A. Wheeler, in Advances in Catalysis, Vol. Volume 3 (Eds.: V. I. K. E. K. R. P. H. E.
W.G. Frankenburg, H. S. Taylor), Academic Press, 1951, pp. 249-327.
[179] R. Aris, 'On shape factors for irregular particles—I: The steady state problem. Diffusion
and reaction', Chem. Eng. Sci. 1957, 6, 262-268.
[180] R. B. Evans, G. M. Watson, E. A. Mason, 'Gaseous Diffusion in Porous Media at
Uniform Pressure', J. Chem. Phys. 1961, 35, 2076-2083.
[181] E. A. Mason, A. P. Malinauskas, R. B. Evans, 'Flow and Diffusion of Gases in Porous
Media', J. Chem. Phys. 1967, 46, 3199-3216.
[182] P. B. Weisz, J. S. Hicks, 'The behaviour of porous catalyst particles in view of internal
mass and heat diffusion effects', Chem. Eng. Sci. 1962, 17, 265-275.
[183] G. Emig, H. Hofmann, 'Reaktionstechnik', Chem. Ing. Tech. 1975, 47, 1012-1016.
[184] P. B. Weisz, 'Diffusivity of porous particles. I. Measurements and significance for
internal reaction velocities', Z. Phys. Chem. (Muenchen, Ger.) 1957, 11, 1-15.
[185] K. B. Bischoff, 'Effectiveness factors for general reaction rate forms', AIChE J. 1965,
11, 351-355.
[186] G. Astarita, 'REGIMES OF MASS TRANSFER WITH CHEMICAL REACTION', Ind.
Eng. Chem. 1966, 58, 18-26.
[187] W. K. Lewis, W. G. Whitman, 'Principles of Gas Absorption', Ind. Eng. Chem. 1924,
16, 1215-1220.
[188] P. R. Rony, 'Supported liquid-phase catalysts', Chem. Eng. Sci. 1968, 23, 1021-1034.
[189] R. Abed, R. G. Rinker, 'Diffusion-limited reaction in supported liquid-phase catalysis',
J. Catal. 1973, 31, 119-126.

Literaturverzeichnis XXI
[190] R. Datta, W. Savage, R. G. Rinker, 'Supported liquid-phase catalysis: II. Experimental
evaluation of the flux model for liquid-loaded porous media', J. Catal. 1985, 95, 193-
201.
[191] R. Datta, R. G. Rinker, 'Supported liquid-phase catalysis: I. A theoretical model for
transport and reaction', J. Catal. 1985, 95, 181-192.
[192] R. Datta, J. Rydant, R. G. Rinker, 'Supported liquid-phase catalysis: III. Experimental
evaluation of the diffusion-reaction model', J. Catal. 1985, 95, 202-208.
[193] R. Fehrmann, A. Riisager, M. Haumann, Supported Ionic Liquids: Fundamentals and
Applications, Wiley-VCH, 2014.
[194] H. Hagiwara, 'Development of Noncovalent Supported Ionic Liquid Phase Catalyst
(SILPC) for Liquid-Phase Reaction as a Benign and Sustainable Protocol to Immobilize
Homogeneous Catalyst', Synlett 2012, 23, 837-850.
[195] T. Selvam, A. Machoke, W. Schwieger, 'Supported ionic liquids on non-porous and
porous inorganic materials—A topical review', Appl. Catal., A 2012, 445–446, 92-101.
[196] M. Haumann, K. Dentler, J. Joni, A. Riisager, P. Wasserscheid, 'Continuous Gas-Phase
Hydroformylation of 1-Butene using Supported Ionic Liquid Phase (SILP) Catalysts',
Adv. Synth. Catal. 2007, 349, 425-431.
[197] M. Haumann, M. Jakuttis, R. Franke, A. Schönweiz, P. Wasserscheid, 'Continuous Gas-
Phase Hydroformylation of a Highly Diluted Technical C4 Feed using Supported Ionic
Liquid Phase Catalysts', ChemCatChem 2011, 3, 1822-1827.
[198] M. Jakuttis, A. Schönweiz, S. Werner, R. Franke, K.-D. Wiese, M. Haumann, P.
Wasserscheid, 'Rhodium–Phosphite SILP Catalysis for the Highly Selective
Hydroformylation of Mixed C4 Feedstocks', Angew. Chem., Int. Ed. 2011, 50, 4492-
4495.

XXII Literaturverzeichnis
[199] D. G. Hanna, S. Shylesh, S. Werner, A. T. Bell, 'The kinetics of gas-phase propene
hydroformylation over a supported ionic liquid-phase (SILP) rhodium catalyst', J. Catal.
2012, 292, 166-172.
[200] J. Scholz, S. Loekman, N. Szesni, W. Hieringer, A. Görling, M. Haumann, P.
Wasserscheid, 'Ethene-Induced Temporary Inhibition of Grubbs Metathesis Catalysts',
Adv. Synth. Catal. 2011, 353, 2701-2707.
[201] F. T. U. Kohler, K. Gartner, V. Hager, M. Haumann, M. Sternberg, X. Wang, N. Szesni,
K. Meyer, P. Wasserscheid, 'Dimerization of ethene in a fluidized bed reactor using Ni-
based Supported Ionic Liquid Phase (SILP) catalysts', Catal. Sci. and Technol. 2014, 4,
936-947.
[202] J. Scholz, V. Hager, X. Wang, F. T. U. Kohler, M. Sternberg, M. Haumann, N. Szesni,
K. Meyer, P. Wasserscheid, 'Ethylene to 2-Butene in a Continuous Gas Phase Reaction
using SILP-Type Cationic Nickel Catalysts', ChemCatChem 2014, 6, 162-169.
[203] S. Werner, N. Szesni, M. Kaiser, R. W. Fischer, M. Haumann, P. Wasserscheid, 'Ultra-
Low-Temperature Water–Gas Shift Catalysis using Supported Ionic Liquid Phase
(SILP) Materials*', ChemCatChem 2010, 2, 1399-1402.
[204] H. Kolding, R. Fehrmann, A. Riisager, 'CO2 Capture technologies: Current status and
new directions using supported ionic liquid phase (SILP) absorbers', Sci. China Chem.
2012, 55, 1648-1656.
[205] H. Klefer, D. Roth, I. Eckle, C. Schrage, B. Böhringer, M. Haumann, P. Wasserscheid,
'Kontinuierliche Gasreinigung mit SILP-Materialien
Continuous Purification of Gases Using SILP Materials', Chem. Ing. Tech. 2014, 86, 92-96.
[206] U. Hintermair, G. Franciò, W. Leitner, 'A Fully Integrated Continuous-Flow System for
Asymmetric Catalysis: Enantioselective Hydrogenation with Supported Ionic Liquid
Phase Catalysts Using Supercritical CO2 as the Mobile Phase', Chem.-Eur. J. 2013, 19,
4538-4547.

Literaturverzeichnis XXIII
[207] M. J. Schneider, M. Haumann, P. Wasserscheid, 'Asymmetric hydrogenation of methyl
pyruvate in the continuous gas phase using Supported Ionic Liquid Phase (SILP)
catalysis', J. Mol. Catal. A-Chem 2013, 376, 103-110.
[208] M. J. Schneider, M. Lijewski, R. Woelfel, M. Haumann, P. Wasserscheid, 'Continuous
Gas-Phase Hydroaminomethylation using Supported Ionic Liquid Phase Catalysts',
Angew. Chem., Int. Ed. 2013, 52, 6996-6999.
[209] T. Cremer, M. Stark, A. Deyko, H. P. Steinrück, F. Maier, 'Liquid/Solid Interface of
Ultrathin Ionic Liquid Films: [C1C1Im][Tf2N] and [C8C1Im][Tf2N] on Au(111)',
Langmuir 2011, 27, 3662-3671.
[210] T. Cremer, Doktorarbeit thesis, University Erlangen-Nürnberg 2012.
[211] T. Cremer, M. Killian, J. M. Gottfried, N. Paape, P. Wasserscheid, F. Maier, H.-P.
Steinrück, 'Physical Vapor Deposition of [EMIM][Tf2N]: A New Approach to the
Modification of Surface Properties with Ultrathin Ionic Liquid Films', ChemPhysChem
2008, 9, 2185-2190.
[212] S.-i. Fujita, Y. Sano, B. M. Bhanage, M. Arai, 'A comparative study of supported
aqueous- and ethylene glycol-phase catalysts in stilbene hydrogenation: Influence of the
different modes of dispersion of supported liquids', Appl. Catal., A 2006, 314, 89-93.
[213] A. V. Perdikaki, O. C. Vangeli, G. N. Karanikolos, K. L. Stefanopoulos, K. G. Beltsios,
P. Alexandridis, N. K. Kanellopoulos, G. E. Romanos, 'Ionic Liquid-Modified Porous
Materials for Gas Separation and Heterogeneous Catalysis', J. Phys. Chem. C. 2012,
116, 16398-16411.
[214] H. N. T. Ha, D. T. Duc, T. V. Dao, M. T. Le, A. Riisager, R. Fehrmann, 'Characterization
and parametrical study of Rh-TPPTS supported ionic liquid phase (SILP) catalysts for
ethylene hydroformylation', Catal. Commun. 2012, 25, 136-141.
[215] M. Haumann, A. Schönweiz, H. Breitzke, G. Buntkowsky, S. Werner, N. Szesni, 'Solid-
State NMR Investigations of Supported Ionic Liquid Phase Water-Gas Shift Catalysts:

XXIV Literaturverzeichnis
Ionic Liquid Film Distribution vs. Catalyst Performance', Chem. Eng. Technol. 2012,
35, 1421-1426.
[216] I. Horváth, 'Hydroformylation of olefins with the water soluble HRh(CO)[P(m-
C6H4SO3Na)3]3 in supported aqueous-phase. Is it really aqueous?', Catal Lett 1990, 6,
43-48.
[217] B. B. Bunn, T. Bartik, B. Bartik, W. R. Bebout, T. E. Glass, B. E. Hanson, 'Phosphorus-
31 NMR spin lattice relaxation times as an indirect probe of adsorbed water in supported
aqueous phase catalysts', J. Mol. Catal. 1994, 94, 157-161.
[218] S. Shylesh, D. Hanna, S. Werner, A. T. Bell, 'Factors Influencing the Activity,
Selectivity, and Stability of Rh-Based Supported Ionic Liquid Phase (SILP) Catalysts
for Hydroformylation of Propene', ACS Catalysis 2012, 2, 487-493.
[219] S. Werner, N. Szesni, M. Kaiser, M. Haumann, P. Wasserscheid, 'A Scalable
Preparation Method for SILP and SCILL Ionic Liquid Thin-Film Materials', Chem. Eng.
Technol. 2012, 35, 1962-1967.
[220] A. Zipp, C. Rüdinger, R. Fehrmann, C. W. Hanning, A. Riisager, WO 2013124175
(2013), Wacker Chemie AG.
[221] Evonik Industries AG, 'Sicherheitsdatenblatt Katalysator H 94082', 2008.
[222] A. P. Börner, D. D. Hess, B. D. Kreidler, D. D. Selent, K. D. D. Wiese, DE
102006058682, US 2010036143 (2008), Evonik Oxeno GmbH.
[223] J. Villadsen, H. Livejerg, 'Supported Liquid-Phase Catalysts', Cataly. Rev. 1978, 17,
203-272.
[224] S. Loekman, Dissertation, FAU Erlangen 2011.
[225] G. Emig, E. Klemm, in Technische Chemie, Springer Berlin Heidelberg, 2005, pp. 209-
234.

Literaturverzeichnis XXV
[226] M. Kraume, in Transportvorgänge in der Verfahrenstechnik, Springer Berlin
Heidelberg, 2012, pp. 247-274.
[227] M. Kleiber, R. Joh, in VDI-Wärmeatlas, Springer Berlin Heidelberg, 2013, pp. 137-174.
[228] F. M. Dautzenberg, Ten Guidelines for Catalyst testing, Vol. 411, ACS Publications,
1989.
[229] G. Buzzi-Ferraris, 'Planning of experiments and kinetic analysis', Catal. Today 1999,
52, 125-132.
[230] J. A. Moulijn, J. Pérez-Ramırez, R. J. Berger, G. Hamminga, G. Mul, F. Kapteijn, 'High-
throughput experimentation in catalyst testing and in kinetic studies for heterogeneous
catalysis', Catal. Today 2003, 81, 457-471.
[231] M. Sobota, I. Nikiforidis, W. Hieringer, N. Paape, M. Happel, H.-P. Steinrück, A.
Görling, P. Wasserscheid, M. Laurin, J. r. Libuda, 'Toward Ionic-Liquid-Based Model
Catalysis: Growth, Orientation, Conformation, and Interaction Mechanism of the
[Tf2N]− Anion in [BMIM][Tf2N] Thin Films on a Well-Ordered Alumina Surface',
Langmuir 2010, 26, 7199-7207.
[232] H.-P. Steinruck, 'Recent developments in the study of ionic liquid interfaces using X-
ray photoelectron spectroscopy and potential future directions', Phys. Chem. Chem.
Phys. 2012, 14, 5010-5029.
[233] K. R. J. Lovelock, 'Influence of the ionic liquid/gas surface on ionic liquid chemistry',
Phys. Chem. Chem. Phys. 2012, 14, 5071-5089.
[234] R. Seddon Kenneth, A. Stark, M.-J. Torres, in Clean Solvents, Vol. 819, American
Chemical Society, 2002, pp. 34-49.
[235] D. Morgan, L. Ferguson, P. Scovazzo, 'Diffusivities of Gases in Room-Temperature
Ionic Liquids: Data and Correlations Obtained Using a Lag-Time Technique', Ind. Eng.
Chem. Res. 2005, 44, 4815-4823.

XXVI Literaturverzeichnis
[236] W. J. McManamey, J. M. Woollen, 'The diffusivity of carbon dioxide in some organic
liquids at 25° and 50°C', AIChE J. 1973, 19, 667-669.
[237] D. Camper, P. Scovazzo, C. Koval, R. Noble, 'Gas Solubilities in Room-Temperature
Ionic Liquids', Ind. Eng. Chem. Res. 2004, 43, 3049-3054.
[238] N. Epstein, 'On tortuosity and the tortuosity factor in flow and diffusion through porous
media', Chem. Eng. Sci. 1989, 44, 777-779.
[239] J. Comiti, M. Renaud, 'A new model for determining mean structure parameters of fixed
beds from pressure drop measurements: application to beds packed with
parallelepipedal particles', Chem. Eng. Sci. 1989, 44, 1539-1545.
[240] A. Koponen, M. Kataja, J. Timonen, 'Tortuous flow in porous media', Phys. Rev. E
1996, 54, 406-410.
[241] M. Barrande, R. Bouchet, R. Denoyel, 'Tortuosity of Porous Particles', Anal. Chem.
2007, 79, 9115-9121.
[242] Z. Sun, X. Tang, G. Cheng, 'Numerical simulation for tortuosity of porous media',
Mircopor. Mesopor. Mat. 2013, 173, 37-42.
[243] J.-P. Mikkola, J. Wärnå, P. Virtanen, T. Salmi, 'Effect of Internal Diffusion in Supported
Ionic Liquid Catalysts: Interaction with Kinetics', Ind. Eng. Chem. Res. 2006, 46, 3932-
3940.
[244] J. Rouquerol, D. Avnir, C. W. Fairbridge, D. H. Everett, J. M. Haynes, N. Pernicone, J.
D. F. Ramsay, K. S. W. Sing, K. K. Unger, 'Recommendations for the characterization
of porous solids', Pure & Appl. Chem. 1994, 66, 1739-1758.
[245] B. Zdravkov, J. Čermák, M. Šefara, J. Janků, 'Pore classification in the characterization
of porous materials: A perspective', cent.eur.j.chem. 2007, 5, 385-395.

Literaturverzeichnis XXVII
[246] O. W. Flörke, H. A. Graetsch, F. Brunk, L. Benda, S. Paschen, H. E. Bergna, W. O.
Roberts, W. A. Welsh, C. Libanati, M. Ettlinger, D. Kerner, M. Maier, W. Meon, R.
Schmoll, H. Gies, D. Schiffmann, in Ullmann's Encyclopedia of Industrial Chemistry,
Wiley-VCH Verlag GmbH & Co. KGaA, 2000.
[247] http://www.chemspider.com/Chemical-Structure.4905309.html (aufgerufen, Apr 14,
2014).
[248] http://www.chemspider.com/Chemical-Structure.7772.html (aufgerufen, Apr. 15,
2014).
[249] M. Stieß, in Mechanische Verfahrenstechnik - Partikeltechnologie 1, Springer Berlin
Heidelberg, 2009, pp. 105-160.
[250] L. R. Fisher, J. N. Israelachvili, 'Direct experimental verification of the Kelvin equation
for capillary condensation', Nature 1979, 277, 548 - 549.
[251] B. Kreidler, K. D. Wiese, D. Hess, D. Selent, A. Börner, DE 102008002188 (A1)
(2008), Evonik Oxeno GmbH.
[252] Y. Watanabe, K. Sawada, M. Hayashi, 'A green method for the self-aldol condensation
of aldehydes using lysine', Green Chem. 2010, 12, 384-386.
[253] L. K. Sharma, K. B. Kim, G. I. Elliott, 'A selective solvent-free self-condensation of
carbonyl compounds utilizing microwave irradiation', Green Chem. 2011, 13, 1546-
1549.
[254] A. Arnold, M. Markert, R. Mahrwald, 'Amine-Catalyzed Aldol Condensation in the
Presence of Lithium Perchlorate', J. Synth. Org. Chem. 2006, 2006, 1099-1102.
[255] J. Hamaya, T. Suzuki, T. Hoshi, K.-i. Shimizu, Y. Kitayama, H. Hagiwara, 'Sustainable
Self-Aldol Condensation of Unmodified Aldehyde: A Combination of Ionic Liquid and
Heterogeneous Secondary-Amine Grafted on Silica', Synlett 2003, 2003, 0873-0875.

XXVIII Literaturverzeichnis
[256] Z. Wang, C. Zhang, C. Zhang, Y.-S. Zheng, J. Xiao, 'Solvent- and Catalyst-Free Direct
Aldol Reactions', Chinese. J. Chem. 2011, 29, 2689-2694.
[257] A. Preetz, H.-J. Drexler, C. Fischer, Z. Dai, A. Börner, W. Baumann, A. Spannenberg,
R. Thede, D. Heller, 'Rhodium-Complex-Catalyzed Asymmetric Hydrogenation:
Transformation of Precatalysts into Active Species', Chem.-Eur. J. 2008, 14, 1445-
1451.
[258] M. Garland, P. Pino, 'Kinetics of the formation and hydrogenolysis of acylrhodium
tetracarbonyl', Organometallics 1991, 10, 1693-1704.
[259] J. Feng, M. Garland, 'Unmodified Homogeneous Rhodium-Catalyzed
Hydroformylation of Styrene. The Detailed Kinetics of the Regioselective Synthesis',
Organometallics 1999, 18, 417-427.
[260] M. Jakuttis, Dissertation, Friedrich-Alexander Universität Erlangen-Nürnberg
(Erlangen), 2012.
[261] I. Chiarotto, M. Feroci, M. Orsini, M. M. M. Feeney, A. Inesi, 'Study on the Reactivity
of Aldehydes in Electrolyzed Ionic Liquids: Benzoin Condensation – Volatile Organic
Compounds (VOCs) vs. Room Temperature Ionic Liquids (RTILs)', Adv. Synth. Catal.
2010, 352, 3287-3292.
[262] M. Xie, H. J. Freund, 'Modellierung der Stoffsystems n-Pentanal und ionischer
Flüssigkeit mittles PC-SAFT Gleichung', Lehrstuhl f. Chemische Reaktionstechnik -
Universität Erlangen-Nürnberg 2014.
[263] S. Ergun, 'Fluid flow through packed columns', Chem. Eng. Prog. 1952, 48, 89 - 94.
[264] R. H. Perry, Chemical Engineers´ Handbook, McGraw-Hill Book Company, New York,
1991.
[265] O. Bey, G. Eigenberger, 'Fluid flow through catalyst filled tubes', Chem. Eng. Sci. 1997,
52, 1365-1376.

Literaturverzeichnis XXIX
[266] M. Baerns, A. Behr, A. Brehm, J. Gmehling, H. Hofmann, U. Onken, A. Renken,
Technische Chemie, Wiley-VCH, Weinheim, 2006.
[267] J. J. Lerou, G. F. Froment, 'Velocity, temperature and conversion profiles in fixed bed
catalytic reactors', Chem. Eng. Sci. 1977, 32, 853-861.
[268] C. Perego, S. Peratello, 'Experimental methods in catalytic kinetics', Catal. Today 1999,
52, 133-145.
[269] C. Bianchini, H. M. Lee, A. Meli, F. Vizza, 'In Situ High-Pressure 31P{1H} NMR
Studies of the Hydroformylation of 1-Hexene by RhH(CO)(PPh3)3', Organometallics
2000, 19, 849-853.
[270] M. Caporali, P. Frediani, A. Salvini, G. Laurenczy, 'In situ high pressure FT-IR
spectroscopy on alkene hydroformylation catalysed by RhH(CO)(PPh3)3 and
Co2(CO)8', Inorg. Chim. Acta 2004, 357, 4537-4543.
[271] E. Zuidema, E. Daura-Oller, J. J. Carbó, C. Bo, P. W. N. M. van Leeuwen, 'Electronic
Ligand Effects on the Regioselectivity of the Rhodium−Diphosphine-Catalyzed
Hydroformylation of Propene', Organometallics 2007, 26, 2234-2242.
[272] D. Sémeril, D. Matt, L. Toupet, W. Oberhauser, C. Bianchini, 'High-Pressure
Investigations under CO/H2 of Rhodium Complexes Containing Hemispherical
Diphosphites', Chem.-Eur. J. 2010, 16, 13843-13849.
[273] S. S. Divekar, B. M. Bhanage, R. M. Deshpande, R. V. Gholap, R. V. Chaudhari,
'Selectivity in hydroformylation of 1-decene by homogeneous catalysis', J. Mol. Catal.
1994, 91, L1-L6.
[274] P. Purwanto, H. Delmas, 'Gas-liquid-liquid reaction engineering: hydroformylation of
1-octene using a water soluble rhodium complex catalyst', Catal. Today 1995, 24, 135-
140.

XXX Literaturverzeichnis
[275] R. M. Deshpande, Purwanto, H. Delmas, R. V. Chaudhari, 'Kinetics of
Hydroformylation of 1-Octene Using [Rh(COD)Cl]2−TPPTS Complex Catalyst in a
Two-Phase System in the Presence of a Cosolvent', Ind. Eng. Chem. Res. 1996, 35,
3927-3933.
[276] R. M. Deshpande, Purwanto, H. Delmas, R. V. Chaudhari, 'Effect of pH on rate and
selectivity behavior in biphasic hydroformylation of 1-octene', J. Mol. Catal. A-Chem
1997, 126, 133-140.
[277] M. Haumann, H. Koch, P. Hugo, R. Schomäcker, 'Hydroformylation of 1-dodecene
using Rh-TPPTS in a microemulsion', Appl. Catal., A 2002, 225, 239-249.
[278] D. Y. Murzin, A. Bernas, T. Salmi, 'Kinetic modelling of regioselectivity in alkenes
hydroformylation over rhodium', J. Mol. Catal. A-Chem 2010, 315, 148-154.
[279] M. S. Shaharun, B. K. Dutta, H. Mukhtar, S. Maitra, 'Hydroformylation of 1-octene
using rhodium–phosphite catalyst in a thermomorphic solvent system', Chem. Eng. Sci.
2010, 65, 273-281.
[280] R. M. Deshpande, A. A. Kelkar, A. Sharma, C. Julcour-Lebigue, H. Delmas, 'Kinetics
of hydroformylation of 1-octene in ionic liquid-organic biphasic media using rhodium
sulfoxantphos catalyst', Chem. Eng. Sci. 2011, 66, 1631-1639.
[281] D. Y. Murzin, A. Bernas, T. Salmi, 'Mechanistic model for kinetics of propene
hydroformylation with Rh catalyst', AIChE J. 2012, 58, 2192-2201.
[282] A. Riisager, R. Fehrmann, M. Haumann, B. S. K. Gorle, P. Wasserscheid, 'Stability and
Kinetic Studies of Supported Ionic Liquid Phase Catalysts for Hydroformylation of
Propene', Ind. Eng. Chem. Res. 2005, 44, 9853-9859.
[283] M. Haumann, M. Jakuttis, S. Werner, P. Wasserscheid, 'Supported ionic liquid phase
(SILP) catalyzed hydroformylation of 1-butene in a gradient-free loop reactor', J. Catal.
2009, 263, 321-327.

Literaturverzeichnis XXXI
[284] A. C. J. Koeken, L. J. P. van den Broeke, B.-J. Deelman, J. T. F. Keurentjes, 'Full kinetic
description of 1-octene hydroformylation in a supercritical medium', J. Mol. Catal. A-
Chem 2011, 346, 1-11.
[285] R. V. Chaudhari, A. Seayad, S. Jayasree, 'Kinetic modeling of homogeneous catalytic
processes', Catal. Today 2001, 66, 371-380.
[286] S. Körkel, Dissertation, Ruprecht-Karls-Universität Heidelberg (Heidelberg), 2002.
[287] J. Halpern, T. Okamoto, A. Zakhariev, 'Mechanism of the
chlorotris(triphenylphosphine) rhodium(I)-catalyzed hydrogenation of alkenes. The
reaction of chlorodihydridotris(triphenyl-phosphine)rhodium(III) with cyclohexene', J.
Mol. Catal. 1977, 2, 65-68.
[288] C. Elschenbroich, in Organometallchemie, Vieweg+Teubner, 2008, pp. 593-681.
[289] M. J. Hostetler, M. D. Butts, R. G. Bergman, 'Scope and mechanism of alkene
hydrogenation/isomerization catalyzed by complexes of the type R2E(CH2)2M(CO)(L)
(R = Cp, Me, Ph; E = phosphorus, tantalum; M = rhodium, iridium; L = CO, PPh3)', J.
Am. Chem. Soc. 1993, 115, 2743-2752.
[290] G. C. Bond, M. A. Keane, H. Kral, J. A. Lercher, 'Compensation Phenomena in
Heterogeneous Catalysis: General Principles and a Possible Explanation', Cataly. Rev.
2000, 42, 323-383.
[291] T. Salmi, J. Ahlkvist, A. Bernas, J. Wärnå, P. Mäki-Arvela, C. Still, J. Lehtonen, D. Y.
Murzin, 'Hydroformylation of 1-Butene on Rh Catalyst', Ind. Eng. Chem. Res. 2008, 48,
1325-1331.
[292] J. N. Armor, 'Emerging importance of shale gas to both the energy & chemicals
landscape', J. Energ. Chem. 2013, 22, 21-26.
[293] S. Majhi, P. Mohanty, H. Wang, K. K. Pant, 'Direct conversion of natural gas to higher
hydrocarbons: A review', J. Energ. Chem. 2013, 22, 543-554.

XXXII Literaturverzeichnis
[294] J. Gmehling, U. Onken, W. Arlt, 'Vapor-Liquid Equilibrium Data Collection, Dechema
Data Series', I, Part 6a.
[295] J. A. Pena, A. Monzon, J. Santamaria, 'Deactivation by Coke of a Cr2O3/Al2O3
Catalyst During Butene Dehydrogenation', J. Catal. 1993, 142, 59-69.
[296] J. Gascón, C. Téllez, J. Herguido, M. Menéndez, 'Propane dehydrogenation over a
Cr2O3/Al2O3 catalyst: transient kinetic modeling of propene and coke formation', Appl.
Catal., A 2003, 248, 105-116.
[297] A. Van Rooy, J. N. H. de Bruijn, K. F. Roobeek, P. C. J. Kamer, P. W. N. M. Van
Leeuwen, 'Rhodium-catalysed hydroformylation of branched 1-alkenes; bulky
phosphite vs. triphenylphosphine as modifying ligand', J. Organomet. Chem. 1996, 507,
69-73.
[298] R. Dittmeyer, Dissertation, FAU Erlangen-Nürnberg 1994.

Abbildungsverzeichnis XXXIII
II Abbildungsverzeichnis
Abbildung 1: Anteil Phthalat-basierter Weichmacher am europäischen Markt. HMW =
Phthalate mit hohem Molekulargewicht ( 7 – 13 C-Atome in der Hauptkette), LMW =
Phthalate mit niedrigem Molekulargewicht (3 – 6 C-Atome in der Hauptkette).[1] ....... 2
Abbildung 2: Die Entwicklung eines Katalysators ist die Optimierung eines Problems
auf mehreren Größenskalen. ........................................................................................... 3
Abbildung 3: Reaktionsschema der Hydroformylierung von Olefinen. ......................... 4
Abbildung 4: Allgemeine Struktur eines homogenen Katalysatorkomplexes für die
Hydroformylierung. ........................................................................................................ 4
Abbildung 5: BIPHEPHOS (6,6´-[(3,3´-Di-tert-butyl-5,5´-dimethoxy-1,1´-biphenyl-
2,2´-diyl)bis(oxy)]bis(dibenzo[d,f][1,3,2]-dioxaphosphepin)). ...................................... 8
Abbildung 6: Auswahl zweizähniger Diphoshpit-Liganden. ......................................... 9
Abbildung 7: Bildung des ee-[HRh(CO)2(BzP)]-Komplexes[51] .................................. 10
Abbildung 8:Abbau von Phosphit-Liganden durch Hydrolyse zu pentavalenten „Hetero-
atom substituted phosphine oxides“ (HASPOs) und trivalenten Phosphorspezies.[58] . 10
Abbildung 9: Postulierter Mechanismus für die Isomerisierung, Hydrierung und
Hydroformylierung von 1-Buten, modifiziert nach Kiedorf et al.[61] ........................... 12
Abbildung 10: Gleichgewicht zwischen ee und ea Koordination des Diphosphit-
Liganden (BzP) an Rhodium. ....................................................................................... 13
Abbildung 11: Gleichgewichtsumsatz von n-Butan als Funktion der Temperatur und des
Druckes, Simulation mit Aspen Plus 7.2. ..................................................................... 16
Abbildung 12: Postulierter katalytischer Mechanismus der Alkan-Dehydrierung an
Cr/Al2O3- Katalysatoren nach Weckhuysen.[80] ............................................................ 17
Abbildung 13: Reaktionsnetzwerk der Dehydrierung von Alkanen an Platin und aziden
Zentren.[92-93] ................................................................................................................. 18
Abbildung 14: Löslichkeit von Alkenen und Aldehyden in Wasser[107] ...................... 21
Abbildung 15: Immobilisierungskonzepte für homogene Katalysatoren ..................... 23
Abbildung 16: Kombinationsmöglichkeiten von Katalysator / ionischer Flüssigkeit /
Support. K = homogener Katalysatorkomplex, IL = ionische Flüssigkeit.[158] ............ 29

XXXIV Abbildungsverzeichnis
Abbildung 17: Darstellung eines Ausschnittes eines Katalysators nach Thiele. x =
Ortkoordinate, y = Konzentration des Eduktes i, ys = Konzentration des Eduktes i an der
Schale des Partikels, y0 = Konzentration des Eduktes i im Zentrum des Partikels.[174] 31
Abbildung 18: Ideale Makropore eines Supported Liquid Phase (SLP) - Katalysators
nach Rony.[188] ............................................................................................................... 33
Abbildung 19: Konzept der Supported Ionic Liquid Phase (SILP) Katalyse.[193] ........ 35
Abbildung 20: Vermutete Immobilisierung von TPPTS auf der hydrophilen Oberfläche
eines Trägers über Wasserstoffbrückenbindungen mit den hydratisierten
Sulfonatgruppen nach Hovárth.[216] .............................................................................. 37
Abbildung 21: Mögliche Wechselwirkungen von Sulfoxantphos (A, B) und
[BMIM][OctSO4] (C) mit der Oberfläche eines Silica-Trägers nach Shylesh et al.[218]
....................................................................................................................................... 38
Abbildung 22: Umsatz und n/iso-Selektivität der Hydroformylierung eines technischen
C4-Stromes (Raffinat I) mit einem Rh-Benzpinakol-SILP-Katalysator, T = 100 °C, pges
= 10 bar, pRaffinat I = 2 bar, pH2 = pCO = 4 bar,Vges = 29,2 ml min-1, mSILP = 3 g, wRh = 0,2
Gew-%, L : Rh = 10 : 1, BTPS : L = 4 : 1, [EMIM][NTf2], α = 10 Vol-%.[198] ........... 41
Abbildung 23: Diphosphit-Ligand 2,2´-(3,3´-Di-tert-butyl-5,5´-dimethoxybiphenyl-
2,2´-diyl)bis(oxy)bis/4,4,5,5-tetraphenyl-1,3,2-dioxaphospholan), (BzP). .................. 45
Abbildung 24: BIPHEPHOS (6,6´-[(3,3´-Di-tert-butyl-5,5´-dimethoxy-1,1´-biphenyl-
2,2´-diyl)bis(oxy)]bis(dibenzo[d,f][1,3,2]-dioxaphosphepin)). .................................... 45
Abbildung 25: Struktur des Stabilisators Bis(2,2,6,6-tetramethyl-4-piperidyl)sebacat.
....................................................................................................................................... 47
Abbildung 26: Fließbild der Kaskadenversuchsanlage nach DIN 19227. .................... 50
Abbildung 27: Ausstattung des verwendeten Gaschromatographen ............................ 53
Abbildung 28: Chromatogramme einer Messung zur Hydroformylierung von Raffinat
III. .................................................................................................................................. 55
Abbildung 29: Veranschaulichung des Bilanzraumes und der Stofftransportvorgänge in
einem SILP-Katalysator ................................................................................................ 59
Abbildung 30: Wirkungsgrad eines SILP-Katalysators gegen die Beladung an ionischer
Flüssigkeit in Abhängigkeit der betrachteten Fälle des modifizierten Thiele-Moduls, R
= 0,01 m, k = 1 s-1, Deff = 1 • 10-5 m2 s-1, Di,IL = 1 • 10-10 m2 s-1, ε= 0,6, H12 = 50. ...... 65

Abbildungsverzeichnis XXXV
Abbildung 31: Der Wirkungsgrad eines SILP-Katalysatorpellets gegen die Beladung an
ionischer Flüssigkeit in Abhängigkeit des Henry-Koeffizienten (a) und der Porosität (b)
des Trägers unter Bedingungen für das SILP Modul Typ III ϕSILP,III. .......................... 65
Abbildung 32: Der Wirkungsgrad eines SILP-Katalysatorpellets gegen die Beladung an
ionischer Flüssigkeit in Abhängigkeit der Stoffaustauschflächen des Trägers unter
Bedingungen für ϕSILP,I. ................................................................................................. 67
Abbildung 33: Schematische Darstellung einer möglichen Verteilung von
Katalysatorkomplex, Ligand und ionischer Flüssigkeit in einer Modelpore nach der
Präparation eines SILP-Katalysators. ........................................................................... 69
Abbildung 34: Mögliche Konstellationen von Katalysatorkomplex, Ligand und
ionischer Flüssigkeit auf einer kalzinierten Silica-Oberfläche. .................................... 70
Abbildung 35: Reaktionsnetzwerk der Hydroformylierung von 1-Buten, Rhodium-
katalysierte Reaktionen sind grau hinterlegt. ................................................................ 71
Abbildung 36: Bildung eines flüssigen Reaktionsmediums aus Produkt und
Folgeprodukt im Porennetzwerk in der Anfahrphase am Beispiel der SILP-katalysierten
Hydroformylierung von 1-Buten. ................................................................................. 72
Abbildung 37: Einfluss des Partialdruckes eines Hochsieders auf den Porenfüllgrad
durch kondensiertes Produkt. ........................................................................................ 73
Abbildung 38: Entscheidungsdiagramm zur optimalen Betriebsweise eines SILP-
Katalysators in einer Gasphasen-Reaktion. .................................................................. 76
Abbildung 39: Umsatz und Selektivität gegen die Reaktionszeit für den Standard SILP-
Katalysator mit Raffinat-III. Anzahl an Datenpunkten reduziert. ................................ 79
Abbildung 40: Einfluss des Präkursors Rh(acac)(CO)2 auf Umsatz und Selektivität in
der SILP-katalysierten Hydroformylierung von 1-Buten. ............................................ 81
Abbildung 41: Einfluss des Präkursors Rh(acac)(COD) auf Umsatz und Selektivität in
der SILP-katalysierten Hydroformylierung von 1-Buten. ............................................ 82
Abbildung 42: Einfluss des Präkursors RhCl(PPh3)3 auf Umsatz und Selektivität in der
SILP-katalysierten Hydroformylierung von 1-Buten. Anzahl an Datenpunkten reduziert.
....................................................................................................................................... 83
Abbildung 43: Einfluss der Komplexierungskinetik von Rh(acac)(COD) und
Benzpinakol auf Umsatz und Selektivität in der SILP-katalysierten Hydroformylierung

XXXVI Abbildungsverzeichnis
von 1-Buten direkt nach der Synthese des SILP-Katalysators. Anzahl an
Datenpunkten reduziert ................................................................................................. 85
Abbildung 44: Einfluss der Komplexierungskinetik von Rh(acac)(COD) und
Benzpinakol auf Umsatz und Selektivität in der SILP-katalysierten Hydroformylierung
von 1-Buten 10 Tage nach der Synthese des SILP-Katalysators. ........................... 86
Abbildung 45: a) Vergleich von TG-Messungen von der Verdampfung von n-Pentanal
und n-Pentanal gelöst in ionischer Flüssigkeit bei 60 °C und 15 ml min-1 Stickstoff. b)
Berechnung eines T,x-Diagramms n-Pentanal / ionische Flüssigkeit mittels PC-SAFT
Gleichung. (Mingquan Xie, M. Sc., Arbeitsgruppe Prof. Dr. H.J. Freund, CRT Uni-
Erlangen-Nürnberg). ..................................................................................................... 90
Abbildung 46: Druckverlust pro Länge Festkörperschüttung gegen die
Leerrohrgeschwindigkeit für Silica 100, dP = 0,063 – 0,200 mm, Fluid Helium,
Raumtemperatur. (Messaufbau und –durchführung siehe Anhang XI) ........................ 91
Abbildung 47: Stabilitätsuntersuchungen eines SILP-Katalysators präpariert mit dem
technischen Träger SiO2 Siliperl. ................................................................................. 92
Abbildung 48: Stabilitätsuntersuchungen eines SILP-Katalysators präpariert mit dem
technischen Träger SiO2 Aerolyst. Anzahl an Datenpunkten reduziert. ...................... 94
Abbildung 49: Variation der Eduktzusammensetzung am Rh-BzP-SILP-Katalysator im
Strömungsrohr. a) Variation des Wasserstoff-Partialdruckes, b) Variation des
Kohlenstoffmonoxid-Partialdruckes, c) Variation des Partialdruckes an 1-Buten. ...... 99
Abbildung 50: Doppelt-logarithmische Darstellung der Konzentrationsabhängigkeit am
Rh-BzP-SILP-Katalysator zur Bestimmung der Reaktionsordnungen nach der
Differentialmethode. a) Variation des Wasserstoff-Partialdruckes, b) Variation des
Kohlenstoffmonoxid-Partialdruckes, c) Variation des Partialdruckes an 1-Buten. .... 100
Abbildung 51: Ergebnisse der Modellierung des Reaktionsnetzwerkes der
Hydroformylierung von 1-Buten am Rh-BzP-SILP-Katalysator bei 100 °C und 10 bar
Gesamtdruck. .............................................................................................................. 102
Abbildung 52: Modellierung des Reaktionsnetzwerkes mit hyperbolischen Ansätzen
basierend auf dem postulierten Rh(I)-Katalysezyklus. 1-Buten, CO, H2,
berechnet. .................................................................................................................... 106
Abbildung 53: Postulierter Katalysezyklus für die Hydrierung und Isomerisierung von
1-Buten basierend auf einer Rh(I)-Spezies. ................................................................ 108

Abbildungsverzeichnis XXXVII
Abbildung 54: Modellierung der Nebenreaktionen (Hydrierung, Isomerisierung) mit
hyperbolischen Ansätzen nach einem postulierten Katalysezyklus basierend auf einer
Rh(III)-Spezies. 1-Buten, CO, H2, berechnet. .......................................... 110
Abbildung 55: Abhängigkeit der Reaktionstemperatur auf die
Reaktionsgeschwindigkeiten am Rh-BzP-SILP-Katalysator. Temperaturbereich 60 –
130°C mit ΔT = 10 K. ................................................................................................. 111
Abbildung 56: Vergleich der Temperaturabhängigkeit der Bildungsreaktionen am Rh-
BzP-SILP-Katalysator. T = 70 – 130 °C, steigende Temperaturrampe. ..................... 112
Abbildung 57: Vergleich der Temperaturabhängigkeit der Bildungsreaktionen am Rh-
BzP-SILP-Katalysator. T = 120 – 60 °C, sinkende Temperaturrampe. ..................... 114
Abbildung 58: Einfluss einer Temperaturerhöhung von 10 K auf die Erhöhung der
Reaktionsgeschwindigkeitskonstanten. Verhältnis der Geschwindigkeitskonstanten
(k2/k1) gegen die Temperatur T1, mit T2 = T1 + 10 K. ............................................... 115
Abbildung 59: Sensitivitätsanalyse der Eingangsmolenströme (hyperbolische Modell,
Strömungsrohr), a) Umsatz an 1-Buten als Funktion der n-Pentanal-Selektivität, b)
Produktivität von n-Pentanal als Funktion der n-Pentanal-Selektivität. Offene Punkte
werden zur Validierung im Experiment herangezogen (siehe Tabelle 19). ............... 117
Abbildung 60: Validierung des hyperbolischen Modelles. Umsatz und Selektivität
gegen die Reaktionszeit am Standard SILP-Katalysator unter vier ausgewählten
Betriebspunkten aus der Simulation. .......................................................................... 119
Abbildung 61: Vereinfachtes Verfahrensfließbild der Reaktionskaskade aus heterogen
katalysierter n-Butan-Dehydrierung und SILP-katalysierter Hydroformylierung. .... 123
Abbildung 62: Gleichgewichtszusammensetzung und anteiliger Molenstrom der
Gasphase nach dem Zwischenlagergefäß bei -20 °C. n-Butan, 1-Buten, cis-2-
Buten, trans-2-Buten, Wasserstoff, 𝑛𝑖 / 𝑛𝐺𝑒𝑠 ............................................. 124
Abbildung 63: Gleichgewichtszusammensetzung und anteiliger Molenstrom der
auskondensierten Phase nach dem Zwischenlagergefäß bei -20 °C. n-Butan, 1-
Buten, cis-2-Buten, trans-2-Buten, Wasserstoff, 𝑛𝑖 / 𝑛𝐺𝑒𝑠 ................... 124
Abbildung 64: Gleichgewichtszusammensetzung des Produktstromes in mol-% der
Dehydrierung in Abhängigkeit der Reaktionstemperatur und 1,01325 Absolutdruck.
Keine Nebenreaktionen berücksichtigt. ...................................................................... 124

XXXVIII Abbildungsverzeichnis
Abbildung 65: Dehydrierung von n-Butan bei TR = 450 °C, Umsatz und Selektivität in
Abhängigkeit des Reaktionsverlaufes am heterogenen Cr/AlOx-Katalysator. .......... 126
Abbildung 66: Direkte Umsetzung eines dehydrierten n-Butan-Gemisches zu
Aldehyden. Umsatz und Selektivität gegen den Reaktionsverlauf bei variablen C4 :
Synthesegas – Verhältnis. ........................................................................................... 128
Abbildung 67: Dehydrierung von n-Butan bei TR = 500 °C, Umsatz und Selektivität in
Abhängigkeit des Reaktionsverlaufes am heterogenen Cr/AlOx-Katalysator. .......... 129
Abbildung 68: Direkte Umsetzung eines dehydrierten n-Butan-Gemisches zu
Aldehyden. Umsatz und Selektivität gegen den Reaktionsverlauf bei konstantem
molaren Verhältnis von C4 : Synthesegas von 2 : 1. ................................................... 130
Abbildung 69: Einfluss des Liganden auf die Verwertung der Butene eines dehydrierten
n-Butan-Stromes. Umsatz und Selektivität gegen den Reaktionsverlauf bei variablen C4
: Synthesegas – Verhältnis. ......................................................................................... 132
Abbildung 70: Änderung der Stoffmengenverhältnisse der Butene über den
Reaktionsverlauf der Hydroformylierung mit Rh-Biphephos. ................................... 133
Abbildung 71: 31P-NMR Untersuchungen zur Komplexierung des Liganden
Benzpinakol mit den Präkursoren Rh(acac)(CO)2, Rh(acac)(COD), RhCl(PPh3)3 in
Abhängigkeit der Rhodium-Ligand-Verhältnisses. ...................................................... LI
Abbildung 72: DSC Kurve des eingesetzten Stabilisators Bis(2,2,6,6-tetramethyl-4-
piperidyl)sebacat. ......................................................................................................... LII
Abbildung 73: 1H-NMR (399 MHz, DMSO) einer Mischung aus n-Pentanal und
[EMIM][NTf2] in DMSO im molaren Verhältnis 1 : 1. Probe wurde vor der Messung
für 5 Stunden auf 100 °C temperiert. .......................................................................... LIII
Abbildung 74: Versuchsaufbau der Apparatur zur Druckverlustmessung von
Schüttkörpern. ............................................................................................................. LVI
Abbildung 75: Variation des H2-Partialdruckes am Rh-BzP-SILP-Katalysator im
Strömungsrohr. .......................................................................................................... LVII
Abbildung 76: Variation des CO-Partialdruckes am Rh-BzP-SILP-Katalysator im
Strömungsrohr. ......................................................................................................... LVIII
Abbildung 77: Variation des 1-Buten-Partialdruckes am Rh-BzP-SILP-Katalysator im
Strömungsrohr. ............................................................................................................ LIX

Abbildungsverzeichnis XXXIX
Abbildung 78: Variation Reaktionstemperatur am Rh-BzP-SILP-Katalysator im
Strömungsrohr. Steigende Temperaturrampe von 70 – 130 °C mit ΔT = 10 K. ..... LXIII
Abbildung 79: Variation Reaktionstemperatur am Rh-BzP-SILP-Katalysator im
Strömungsrohr. Abnehmende Temperaturrampe von 120 – 60 °C mit ΔT = 10 K. LXIV
Abbildung 80: Langzeittest der Dehydrierung von n-Butan bei TR = 500 °C mit
zwischenzeitlicher Regenerierung/Reduzierung des heterogenen Katalysators.
Umsatz und Selektivität in Abhängigkeit des Reaktionsverlaufes am heterogenen
Cr/AlOx-Katakysator. ..................................................................................... LXXXVIII

XL Tabellenverzeichnis
III Tabellenverzeichnis
Tabelle 1: Kennzahlen verschiedener Oxoverfahren nach Hibbel et al.[18] .................... 5
Tabelle 2: Industrielle Prozesse zur katalytischen Alkan-Dehydrierung.[102-104, 93] ...... 20
Tabelle 3: Überblick industrieller Oxo-Verfahren.[108, 16, 109, 12] .................................... 22
Tabelle 4: Kostenstruktur der Produktion von n-Butanal nach dem LPO-Verfahren[109]
....................................................................................................................................... 40
Tabelle 5: Molare Zusammensetzung der Raffinat III –Chargen. ................................ 42
Tabelle 6: Übersicht über die eingesetzten Präkursoren und homogenen Katalysatoren.
....................................................................................................................................... 43
Tabelle 7: Zusammensetzung des Chrom/Aluminiumoxid – Katalysators der Evonik
Industries AG.[221] ......................................................................................................... 43
Tabelle 8: Stoffdaten der eingesetzten ionischen Flüssigkeiten. .................................. 44
Tabelle 9: Morphologische Eigenschaften der Silica-Träger ....................................... 46
Tabelle 10: Konzentrationsverlauf im IL-Film in Abhängigkeit von Stofftransport und
Reaktion nach Lewis und Whitman[187] ........................................................................ 60
Tabelle 11: Modifizierte Thiele-Moduli für ein kugelförmiges SILP-Katalysatorpellet
in Abhängigkeit des Stofftransportes im IL-Film. ........................................................ 63
Tabelle 12: Zusammensetzung des SILP-Katalysators und getestete
Reaktionsbedingungen nach Jakuttis et al.[198] .............................................................. 78
Tabelle 13: Vergleich von Aktivität, Umsatz und Selektivität von SILP-Katalysatoren
in Abhängigkeit der immobilisierten ionischen Flüssigkeit. ........................................ 88
Tabelle 14: Ergebnisse der Parameterbestimmung nach dem Potenzmodell ............. 101
Tabelle 15: Parameteranalyse für das hyperbolische Modell nach dem Katalysezyklus
basierend auf der Rhodium(I)-Spezies. ...................................................................... 105
Tabelle 16: Parameteranalyse für das hyperbolische Modell für die Nebenreaktionen
Hydrierung und Isomerisierung nach dem Katalysezyklus basierend auf der
Rhodium(III)-Spezies. ................................................................................................ 109
Tabelle 17: Standardversuchsbedingungen im Strömungsrohr am Rh-BzP-SILP-
Katalysator. ................................................................................................................. 116
Tabelle 18: Ergebnis der Simulation basierend auf den hyperbolischen Ansätzen. ... 116

Tabellenverzeichnis XLI
Tabelle 19: Betriebspunkte und Ergebnisse der Simulation zur Validierung des
hyperbolischen Modells. ............................................................................................. 118
Tabelle 20: Vergleich der gemessenen und berechneten Produktivität für das Produkt n-
Pentanal. ...................................................................................................................... 120
Tabelle 21: Vergleich der Produktivität an n-Pentanal in Abhängigkeit der
Prozessbedingungen der Kaskadenreaktion und des Einsatzstoffes. .......................... 134
Tabelle 22: WLD-Linie ............................................................................................. XLII
Tabelle 23: FID-Linie: Alkane und Alkene .............................................................. XLII
Tabelle 24: FID-Linie: Aldehyde, Alkohole, Aldolprodukte .................................. XLIII

XLII Daten zur GC-Analytik
IV Daten zur GC-Analytik
Die Retentionszeiten und Kalibierfaktoren (Relative Molar Response-RMR – Wert)
sind in den Tabellen 22 - 24dargestellt:
Tabelle 22: WLD-Linie
Stoff Retentionszeit / min RMR – Wert / -
He 0,87 0,94
H2 0,95 1,00
CO 2,38 11,34
Tabelle 23: FID-Linie: Alkane und Alkene
Stoff Retentionszeit / min RMR – Wert / -
iso-Butan 15,22 1,01
n-Butan 16,15 1,00
trans-2-Buten 20,97 0,99
1-Buten 21,43 1,00
iso-Buten 22,52 1,00
cis-2-Buten 24,28 1,02
iso-Pentan 26,73 1,09
1,3-Butadien 27,40 1,03

Daten zur GC-Analytik XLIII
Tabelle 24: FID-Linie: Aldehyde, Alkohole, Aldolprodukte
Stoff Retentionszeit / min RMR – Wert / -
sec-Pentanal, 2-Methylbutanal 8,21 1,41
n-Pentanal 9,96 1,40
2-Pentanol 17,37 1,43
1-Pentanol 19,54 1,43
3-Methyl-2-heptenal, 33,00 1,54

XLIV Weitere Analysemethoden
V Weitere Analysemethoden
Kernspinresonanzspektroskopie:
Die homogenen Rhodium-Phosphit-Komplexe wurden mittels
Kernspinresonanzspektroskopie (NMR) untersucht. Die Spektren wurden mit einem
Jeol ECX-400 aufgenommen und ausgewertet.
Optische Emissionsspektroskopie mit induktiv gekoppeltem Plasma:
Die optische Emissionsspektroskopie mit induktiv gekoppeltem Plasma (ICP-AES) zur
Bestimmung des Rhodiumgehaltes der SILP-Katalysatoren wurde von Dr. Nicola
Taccardi (CRT) an einem Spectro Ciros Vision durchgeführt. Vor der Analyse wurden
die SILP-Katalysatoren in einer Lösung aus HCl, H2SO4 und HF komplett aufgelöst.
Thermogravimetrische Messungen:
Thermogravimetrische Analysen wurden mit dem Gerät SETYSY Evolution der Firma
Setaram Instrumentation durchgeführt.
Karl-Fischer Coulometrie:
Die quantitative Bestimmung des Wassergehaltes von ionischen Flüssigkeiten erfolgte
nach dem Karl-Fischer-Verfahren. Der Karl-Fischer-Titrator KF Coulometer 576 von
Metrohm GmbH & Co. KG wurde verwendet. Nachweisgrenze 10 µg – 200 mg
Absolutwasser.
Dynamische Differenzkalorimetrie:
Für die thermischen Analysen der zur Messung der aufgenommen oder abgegebenen
Wärmemenge wurde das Gerät DSC 204 F1 der Firma Netzsch-Gerätebau GmbH
verwendet.

Auswertung der Messdaten XLV
VI Auswertung der Messdaten
Die Stoff- und Wärmebilanzen des gewählten Reaktors ergeben sich aus dessen
Operationsweise. Speziell für die Bestimmung der kinetischen Daten gelten folgende
Voraussetzungen:
Die Auswertung der Messdaten des Gaschromatographen erfolgte über die
Flächensignale.
Für reines 1-Buten erfolgte die Bestimmung der Kenngrößen über die integralen
Flächensignale, die über die die Kalibrierfaktoren ins Verhältnis gesetzt werden
Umsatz :
𝑋𝑖 =
∑𝐴𝑗𝜅𝑗
𝑗
∑𝐴𝑗𝜅𝑗
𝑗 +𝐴𝑖𝜅𝑖
∙ 100 % ( 𝑗 ≠ 𝑖) (VI-1)
Ausbeute :
𝑌𝑗 =
𝐴𝑗𝜅𝑗
∑𝐴𝑗𝜅𝑗
𝑗 +𝐴𝑖𝜅𝑖
∙ 100 % (VI-2)
Selektivität :
𝑆𝑗 = 𝑋𝑖𝑌𝑗 ∙ 100 % (VI-3)
Für die Analyse des technischen Substrates Raffinat III über das integrale
Flächenverhältnis von Substrat zu internem Standard (IS). Das integrale
Flächenverhältnis Ai/AIS ist proportional zum Stoffmengenverhältnis ni/nIS :
Umsatz :

XLVI Auswertung der Messdaten
𝑋𝑖 =
𝐴𝑖,0𝐴𝐼𝑆
−𝐴𝑖𝐴𝐼𝑆
𝐴𝑖,0𝐴𝐼𝑆
∙ 100 %, 𝑋𝑖 =∑𝐴𝑖,0𝐴𝐼𝑆
− ∑𝐴𝑖𝐴𝐼𝑆𝑖𝑖
∑𝐴𝑖,0𝐴𝐼𝑆
𝑖
∙ 100 % (VI-4)
Ausbeute :
𝑌𝑗 =
𝐴𝑗𝐴𝐼𝑆
−𝐴𝑗,0𝐴𝐼𝑆
𝐴𝑖,0𝐴𝐼𝑆
∙ 100 %, 𝑌𝑗 =
𝐴𝑗𝐴𝐼𝑆
−𝐴𝑗,0𝐴𝐼𝑆
∑𝐴𝑖,0𝐴𝐼𝑆𝑖
∙ 100 % (VI-5)
Selektivität :
𝑆𝑗 = 𝑋𝑖𝑌𝑗 ∙ 100 % (VI-6)
Turn-Over-Frequency - TOF :
𝑇𝑂𝐹 = ��𝑖 𝑋𝑖𝑛𝑅ℎ
𝑖𝑛 ℎ−1 ∙ (VI-7)
Produktivität :
𝑃𝑟𝑜𝑑.= ��𝑖 𝑌𝑗
𝑚𝑆𝐼𝐿𝑃−𝐾𝑎𝑡 𝑖𝑛 𝑘𝑔𝑗 𝑘𝑔𝑆𝐼𝐿𝑃−𝐾𝑎𝑡
−1 ℎ−1 ∙ (VI-8)

Herleitung des Thiele-Moduls XLVII
VII Herleitung des Thiele-Moduls
Annahmen für den Thiele Ansatz:
- Fluid ist entweder ein Gas oder eine Flüssigkeit, keine Mischung aus beiden
Aggregatszuständen
- Temperatur ist über das gesamte Partikel gleichmäßig, isotherm
- Äußere Oberfläche des Partikels geht nicht in die Betrachtung mit ein
- Diffusion durch die äußere Grenzschicht ist vergleichsweise schnell zu
Diffusion im Inneren,
- Poren sind miteinander verknüpft
- Diffusion findet ausschließlich in den Poren statt und nicht durch den
Feststoff des Katalysators
- Die Reaktion findet ausschließlich an den Porenwänden statt
- Alle Poren besitzen die gleiche Geometrie
- Keine Konvektion im Katalysatorpartikel, Stofftransport findet ausschließlich
durch Diffusion oder durch Volumenänderung aufgrund der Reaktion statt
- Eine Rückreaktion wird im Ansatz der Reaktionsgeschwindigkeit
vernachlässigt
- Im Zentrum der Pore existiert keine Strömung durch Diffusion
Kontinuitätsgleichung:
𝜕𝑐𝑖𝜕𝑡= −𝑑𝑖𝑣 (𝑐𝑖 �� ) + 𝑑𝑖𝑣 (𝐷𝑖 𝑔𝑟𝑎𝑑 𝑐𝑖) + 𝜈𝑖𝑣𝑣 (1 +
�� 𝑐𝑖𝑐𝑖,𝑤
)
Nabla – Operator: �� =𝜕
𝜕𝑥𝑒 𝑥 +
𝜕
𝜕𝑦𝑒 𝑦 +
𝜕
𝜕𝑧𝑒 𝑧
Laplace – Operator: Δ = �� ∇ =𝜕2
𝜕𝑥2+
𝜕2
𝜕𝑦2+
𝜕2
𝜕𝑧2
Skalares Feld: G �� ∙ 𝐺 =𝜕𝐺
𝜕𝑥𝑒 𝑥 +
𝜕𝐺
𝜕𝑦𝑒 𝑦 +
𝜕𝐺
𝜕𝑧𝑒 𝑧 𝑔𝑟𝑎𝑑 𝐺
Vektorfeld 𝐺 �� ∙ 𝐺 =𝜕𝐺𝑥
𝜕𝑥+𝜕𝐺𝑦
𝜕𝑦+𝜕𝐺𝑧
𝜕𝑧 𝑑𝑖𝑣 𝐺
𝜕𝑐𝑖𝜕𝑡= 𝑑𝑖𝑣(𝐷𝑖𝑔𝑟𝑎𝑑 𝑐𝑖) + 𝑅𝑖 = 0

XLVIII Herleitung des Thiele-Moduls
1.Dim: 𝐷𝑖𝑑𝑑𝑐
𝑑𝑥+ 𝑅𝑖 = 0 → bei Thiele 𝐷𝑖 ortsunabhängig
𝜕𝑐𝑖
𝜕𝑡= 𝐷𝑒𝑑
𝑑𝑐
𝑑𝑥+ 𝑅𝑖
𝜕𝑐𝑖
𝜕𝑡= 𝐷𝑒 𝑑
𝑑𝑐
𝑑𝑥+ 𝑘 ∙ 𝑐𝑖 = 0
Für Kugelkoordinaten:
4𝜋(𝑥 + 𝑑𝑥)2𝐷𝑒 𝑑𝑐
𝑑𝑥|𝑥+𝑑𝑥
− 4𝜋𝑥2𝐷𝑒𝑑𝑐
𝑑𝑥|𝑥= 4𝜋𝑥2𝑑𝑥𝑘𝑐𝑖
Taylor-Reihe:
4𝜋(𝑥 + 𝑑𝑥)2𝐷𝑒 (𝑑𝑐
𝑑𝑥|𝑥+𝑑2𝑐
𝑑𝑥2|𝑥∙ 𝑑𝑥) − 4𝜋𝑥2𝐷𝑒
𝑑𝑐
𝑑𝑥|𝑥= 4𝜋𝑥2𝑑𝑥𝑘𝑐𝑖
⟹ 𝐷𝑒 (2
𝑥 𝑑𝑐
𝑑𝑥+𝑑2𝑐
𝑑𝑥2) = 𝑘𝑐𝑖
2
𝑥 𝑑𝑐𝑖
𝑑𝑥+𝑑2𝑐𝑖
𝑑𝑥2=
𝑘∙𝑐𝑖
𝐷𝑒
Einführung dimensionsloser Größen:
𝑓 =𝑐
𝑐𝑏; 𝑦′ =
𝑥
𝑅
𝑑𝑐
𝑑𝑥= 𝑐𝑏
𝑑𝑓
𝑅𝑑𝑦 ;
𝑑2𝑐
𝑑𝑥2= 𝑐𝑏
𝑑2𝑓
𝑅2𝑑𝑦2
2
𝑅2 𝑐𝑏
𝑦 𝑑𝑓
𝑑𝑦+
𝑐𝑏
𝑅2 𝑑2𝑓
𝑑𝑦2=
𝑘∙𝑐𝑏∙𝑓
𝐷𝑒
2
𝑦 𝑑𝑓
𝑑𝑦+𝑑2𝑓
𝑑𝑦2= 𝑅2
𝑘
𝐷𝑒⏟𝜙2
∙ 𝑓
Randbedingungen zur Lösung der Differentialgleichung:
𝑦 = 1 ⇒ 𝑓 = 1
𝑦 = 0 ⇒ 𝑑𝑓
𝑑𝑦= 0 𝑆𝑦𝑚𝑚𝑒𝑡𝑟𝑖𝑒𝑏𝑒𝑑.
⟹ 𝑓 =1
𝑦 (𝑒𝜙𝑦−𝑒−𝜙𝑦)
(𝑒𝜙−𝑒−𝜙)=
1
𝑦 sinh(𝜙𝑦)
sinh(𝜙)

Herleitung des Thiele-Moduls XLIX
Mit 𝜙 = 𝑅√𝑘
𝐷𝑒
Definition des Wirkungsgrades:
𝜂 =(𝑟𝑒𝑓𝑓)𝑉𝑅
𝑟𝑖𝑛𝑡𝑟
𝑓 =1
𝑦 sinh(𝜙𝑦)
sinh(𝜙)=
1
𝑦 (𝑒𝜙𝑦−𝑒−𝜙𝑦)
(𝑒𝜙−𝑒−𝜙)
𝑟𝑒𝑓𝑓 =1
𝑉𝑘 ∫ 𝑟(𝑥)4𝜋𝑥2𝑑𝑥𝑅
0
𝑟(𝑥) = 𝑘𝑉𝐼𝐿 ∙ 𝑐𝑖
𝑉𝐾 =4
3𝜋𝑅3
𝑓 =1
𝑦 sinh(𝜙𝑦)
sinh(𝜙) 𝑓 =
𝑐
𝑐𝑏 𝑦 =
𝑥
𝑅
𝑐
𝑐𝑏=
𝑅
𝑥 sinh(𝜙
𝑥
𝑅)
sinh(𝜙)
𝑟𝑒𝑓𝑓 =1
𝑉𝑘 ∫ 𝑘 ∙ 𝑐𝑖𝑅
0∙ 4𝜋𝑥2𝑑𝑥
𝑟𝑒𝑓𝑓 =1
𝑉𝑘 ∫ 𝑘 ∙ 𝑐𝑏 ∙𝑅
0
𝑅
𝑥 sinh(𝜙
𝑥
𝑅)
sinh(𝜙)∙ 4𝜋𝑥2𝑑𝑥
𝑟𝑒𝑓𝑓 =1
4
3𝜋𝑅3 ∫ 𝑘 ∙ 𝑐𝑏 ∙𝑅
0
𝑅
𝑥 sinh(𝜙
𝑥
𝑅)
sinh(𝜙)∙ 4𝜋𝑥2𝑑𝑥
𝑟𝑒𝑓𝑓 = 3 ∙ 𝑘 ∙ 𝑐𝑏 ∫𝑅
𝑥 sinh(𝜙
𝑥
𝑅)
sinh(𝜙) (𝑥2
𝑅2) 𝑑 (
𝑥
𝑅)
𝑅
0
⟹ 𝑟𝑒𝑓𝑓 =3
𝜙 (
1
tanh(𝜙)−
1
𝜙) ∙ 𝑘 ∙ 𝑐𝑏 𝑠𝑖𝑒ℎ𝑒 𝑍𝑤𝑖𝑠𝑐ℎ𝑒𝑛𝑟𝑒𝑐ℎ𝑛𝑢𝑛𝑔
⟹ 𝜼 =𝒓𝒆𝒇𝒇
𝒓=
𝟑
𝝓 (
𝟏
𝐭𝐚𝐧𝐡(𝝓)−
𝟏
𝝓)

L Herleitung des Thiele-Moduls
Zwischenrechnung:
𝑟𝑒𝑓𝑓 =1
𝑉𝑘 ∫ 𝑟(𝑥)4𝜋𝑥2𝑑𝑥𝑅
0 mit 𝑟(𝑥) = 𝑘 ∙ 𝑐
𝑐
𝑐𝑏=
sinh(𝜙 𝑥
𝑅)
(𝑥
𝑅) sinh𝜙
⟹ 𝑟𝑒𝑓𝑓 =1
4
3𝜋𝑅3 ∫ 𝑘 ∙ 𝑐𝑏 ∙𝑅
0 sinh(𝜙
𝑥
𝑅)
(𝑥
𝑅) sinh𝜙
∙ 4𝜋𝑥2𝑑𝑥
𝑟𝑒𝑓𝑓 = 3 ∙ 𝑘 ∙ 𝑐𝑏 ∫ sinh(𝜙
𝑥
𝑅)
(𝑥
𝑅) sinh𝜙
(𝑥
𝑅)2 𝑑 (
𝑥
𝑅)
𝑅
0
𝑟𝑒𝑓𝑓 = ∫sinh(𝜙
𝑥
𝑅)
sinh𝜙⏟ 𝑣´
𝑅
0 (𝑥
𝑅)⏟𝑢
𝑑 (𝑥
𝑅)
Partielle Integration:
∫𝑢 ∙ 𝑣′𝑑𝑥 = 𝑢 ∙ 𝑣 − ∫𝑢′ ∙ 𝑣𝑑𝑥
𝑢 (𝑥
𝑅) =
𝑥
𝑅 ⇒ 𝑢′ = 1
𝑣′ =sinh(𝜙
𝑥
𝑅)
sinh𝜙 ⇒ 𝑣 = ∫
sinh(𝜙 𝑥
𝑅)
sinh𝜙𝑑 (
𝑥
𝑅)
Nebenrechnung:
∫sinh(𝜙 𝑥
𝑅) 𝑑 (
𝑥
𝑅) = ∫
𝑒𝜙𝑥𝑅 − 𝑒−𝜙
𝑥𝑅
2 𝑑 (
𝑥
𝑅)
1
2 1
𝜙 𝑒𝜙
𝑥𝑅 −
1
2 1
𝜙 𝑒−𝜙
𝑥𝑅 =
1
𝜙cosh ( 𝜙
𝑥
𝑅)
___________________________
⇒ 𝑣 = 1
𝜙 cosh (𝜙
𝑥𝑅)
sinh𝜙

31P-NMR-Studien zur Komplexierung von Rh-
Präkursoren mit dem Ligand Benzpinakol
LI
VIII 31P-NMR-Studien zur Komplexierung von Rh-Präkursoren mit dem
Ligand Benzpinakol
Rh(acac)(CO)2
Rh(acac)(COD)
RhCl(PPh3)3
31P NMR (161 MHz, CDCl3): δ (ppm) =
145.4 (freier Ligand), 146.6 (Rh-P-
Kopplung), 148.5 (Rh-P-Kopplung)
Abbildung 71: 31P-NMR Untersuchungen zur Komplexierung des Liganden Benzpinakol mit den
Präkursoren Rh(acac)(CO)2, Rh(acac)(COD), RhCl(PPh3)3 in Abhängigkeit der Rhodium-Ligand-
Verhältnisses.
154
152
150
148
146
144
142
140
L : Rh = 10 : 1
L : Rh = 5 : 1
31P / ppm
L : Rh = 1 : 1
154
152
150
148
146
144
142
140
L : Rh = 10 : 1
L : Rh = 5 : 1
31P / ppm
L : Rh = 1 : 1
154
152
150
148
146
144
142
140
L : Rh = 10 : 1
L : Rh = 1 : 1
L : Rh = 5 : 1
31P / ppm

LII Dynamische Differenzkalorimetrie von Komponenten
des SILP-Katalysators
IX Dynamische Differenzkalorimetrie von Komponenten des SILP-
Katalysators
Abbildung 72: DSC Kurve des eingesetzten Stabilisators Bis(2,2,6,6-tetramethyl-4-piperidyl)sebacat.
20 40 60 80 100 120 140
-3,0
-2,5
-2,0
-1,5
-1,0
-0,5
0,0
0,5
DS
C /
mW
mg
-1
T / °C

Untersuchungen zur Reaktion von n-Pentanal mit der
ionischen Flüssigkeit [EMIM][NTf2]
LIII
X Untersuchungen zur Reaktion von n-Pentanal mit der ionischen Flüssigkeit
[EMIM][NTf2]
Abbildung 73: 1H-NMR (399 MHz, DMSO) einer Mischung aus n-Pentanal und [EMIM][NTf2] in
DMSO im molaren Verhältnis 1 : 1. Probe wurde vor der Messung für 5 Stunden auf 100 °C temperiert.
12 10 8 6 4 2 0
-0,5
0,0
0,5
1,0
1,5
2,0
2,5
3,0
3,5
1H
/ ppm

LIV Charakterisierung der SiO2 – basierten Träger
XI Charakterisierung der SiO2 – basierten Träger
XI.I Herleitung einer modifizierten Ergun-Gleichung zur Bestimmung des
Druckverlustes
42
3
min
23
2
10Re31
75,11
150
p
Bereichrturbulente
p
Bereicharerla
p
fürgültigd
w
d
w
L
p
e
e
e
e
2
21 wCwCL
p
150.200
11123
2
11 bzwkd
kCmitp
e
e
75,1
112322
k
dkC
pe
e
2
21 wCwCdz
dp
2
2
12
1
1
021
11p
pw
p
pC
p
pwC
dz
dp
p
pwCpwCdz
dp
k
11
2
102111
pk
dz
dp 1
dzkdpp
p
p
1
2
Lkpp 2
2
2
12
1
2
1
LkppbzwLkpp 2.2 2
12
2
1
2
2

Charakterisierung der SiO2 – basierten Träger LV
21 pppmit
LLkppp :|22
11
L
Lkpp
L
p 22
11
1
2
112111 pwCpwCk
2
1
2
1211
A
V
TRn
VpCp
A
VC
Rohr
22
1211
A
V
TRn
mpCp
A
VC
Rohr
22
1
211A
V
TR
MpCp
A
VC Medium
Rohr
2
1211
TRA
pVTRMCp
A
VC Medium
Rohr
2
1
32123
2
1
1111
TRA
pVTRM
dkp
A
V
dkk Medium
pRohrp
e
e
e
e
L
LTRA
pVTRM
dkp
A
V
dkpp
L
pMedium
pRohrp
2
1
32123
2
1
2
11
11112
e
e
e
e
mit
p1 = Druck vor der Schüttung
p2 = Druck nach der Schüttung

LVI Charakterisierung der SiO2 – basierten Träger
XI.II Messung des Druckverlustes einer Trägerschüttung
Abbildung 74: Versuchsaufbau der Apparatur zur Druckverlustmessung von Schüttkörpern.

Partialdruckvariationen an dem Rh-BzP-SILP-
Katalysator
LVII
XII Partialdruckvariationen an dem Rh-BzP-SILP-Katalysator
Ausbeute an n-Pentanal, n-Butan, trans- & cis-2-Buten gegen die Zeit als Funktion des
H2-Partialdruckes:
Abbildung 75: Variation des H2-Partialdruckes am Rh-BzP-SILP-Katalysator im Strömungsrohr.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 25 ml min -1; p1-Buten = 2 bar; pH2 = 1 - 4 bar; pCO = 4
bar; pHe = 1 - 4 bar; mSILP-Kat = 0,5 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.);
α = 0,1; wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
Yn-Pentanal, Yn-Butan, Ytrans-2-Buten, Ycis-2-Buten.
0 5 10 15 20 25 300,0
0,5
1,0
1,5
2,0
2,5
pH
2=
1 b
ar
pH
2=
2 b
ar
pH
2=
3 b
ar
Y / %
Zeit / h
pH
2=
4 b
ar

LVIII Partialdruckvariationen an dem Rh-BzP-SILP-
Katalysator
Ausbeute an n-Pentanal, n-Butan, trans- & cis-2-Buten gegen die Zeit als Funktion des
CO-Partialdruckes:
Abbildung 76: Variation des CO-Partialdruckes am Rh-BzP-SILP-Katalysator im Strömungsrohr.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 25 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 2 - 4
bar; pHe = 2 - 4 bar; mSILP-Kat = 0,5 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.);
α = 0,1; wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
Yn-Pentanal, Yn-Butan, Ytrans-2-Buten, Ycis-2-Buten.
0 5 10 15 20 25 30 35 40 450,0
0,5
1,0
1,5
2,0
2,5
3,0
3,5
pCO
= 2,5 bar
pC
O=
2 b
ar
pC
O=
3 b
ar
pCO
= 4 barY / %
Zeit / h

Partialdruckvariationen an dem Rh-BzP-SILP-
Katalysator
LIX
Ausbeute an n-Pentanal, n-Butan, trans- & cis-2-Buten gegen die Zeit als Funktion des
1-Buten-Partialdruckes:
Abbildung 77: Variation des 1-Buten-Partialdruckes am Rh-BzP-SILP-Katalysator im Strömungsrohr.
Rh-BzP-SILP ; pabs = 10 bar; T = 100 °C; VGes= 25 ml min -1; p1-Buten = 0,5 - 2 bar; pH2 = 4 bar; pCO = 4
bar; pHe = 0,5 - 2 bar; mSILP-Kat = 0,5 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica 100
(kalz.); α = 0,1; wRh = 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
Yn-Pentanal, Yn-Butan, Ytrans-2-Buten, Ycis-2-Buten.
0 5 10 15 20 25 30 35 40 450,0
0,5
1,0
1,5
2,0
2,5
3,0
3,5
4,0
4,5
p1-Buten
= 0,5 bar
p1-B
ute
n=
1 b
ar
p1-B
ute
n=
1,5
bar
p1-Buten
= 2 bar
Y / %
Zeit / h

LX Hyperbolische Modellansätze
XIII Hyperbolische Modellansätze
Reaktionsgeschwindigkeitsansätze für die Hydroformylierung nach dem Mechanismus
in Abbildung 9:
𝑟2 =𝑘2 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝐾1 + 𝑝𝐶𝑂
(10-9)
𝑟3 =𝑘3 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
(10-10)
𝑟4 =𝑘4 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
(10-11)
𝑟5 =𝑘5𝐾4 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾4𝐾3𝐾2𝐾1𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂
(10-12)
𝑟6 =𝑘6𝐾5𝐾4 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂𝑝𝐻2
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 +𝐾4𝐾3𝐾2𝐾1𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂 + 𝐾5𝐾4𝐾3𝐾2𝐾1𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂
(10-13)
𝑟7 =𝑘7𝐾6𝐾5𝐾4 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂𝑝𝐻2
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾4𝐾3𝐾2𝐾1𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂 +
𝐾5𝐾4𝐾3𝐾2𝐾1𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂 + 𝐾6𝐾5𝐾4 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐶𝑂𝑝𝐻2
(10-14)
Reaktionsgeschwindigkeitsansätze für die Hydrierung nach dem Mechanismus in
Abbildung 9:
𝑟2 =𝑘2 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝐾1 + 𝑝𝐶𝑂
(10-15)
𝑟3 =𝑘3 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
(10-16)
𝑟8 =𝑘8 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
(10-17)

Hyperbolische Modellansätze LXI
𝑟9 =𝑘9𝐾8 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾3𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾8𝐾3𝐾2𝐾1𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
(10-18)
Reaktionsgeschwindigkeitsansätze für die Isomerisierung nach dem Mechanismus in
Abbildung 9:
𝑟2 =𝑘2 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝐾1 + 𝑝𝐶𝑂
(10-19)
𝑟10 =𝑘10 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
(10-20)
𝑟11 =𝑘11 𝐾10𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾10𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
(10-21)
𝑟12 =𝑘12𝐾11 𝐾10𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛
𝐾1 + 𝑝𝐶𝑂 + 𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾10𝐾2𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛 + 𝐾11𝐾10𝐾2𝐾1𝑝𝐴𝑙𝑘𝑒𝑛
(10-22)
Reaktionsgeschwindigkeitsansätze für die Hydrierung nach dem Mechanismus in
Abbildung 53:
𝑟15 =𝑘15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1𝑝𝐶𝑂 + 𝑝𝐶𝑂2 + 𝐾13𝐾1 𝑝𝐶𝑂𝑝𝐻2 + 𝐾14𝐾13𝐾1 𝑝𝐻2
(10-23)
𝑟16 =𝑘16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1𝑝𝐶𝑂 + 𝑝𝐶𝑂2 + 𝐾13𝐾1 𝑝𝐶𝑂𝑝𝐻2 + 𝐾14𝐾13𝐾1 𝑝𝐻2 + 𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
(10-24)
𝑟17 =𝑘17𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2𝑝𝐶𝑂
𝐾1𝑝𝐶𝑂 + 𝑝𝐶𝑂2 + 𝐾13𝐾1 𝑝𝐶𝑂𝑝𝐻2 + 𝐾14𝐾13𝐾1 𝑝𝐻2 +
𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2 + 𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
(10-25)
𝑟18 =𝑘18𝐾17𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2𝑝𝐶𝑂
𝐾1𝑝𝐶𝑂 + 𝑝𝐶𝑂2 + 𝐾13𝐾1 𝑝𝐶𝑂𝑝𝐻2 + 𝐾14𝐾13𝐾1 𝑝𝐻2 + 𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2 +
𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2 + 𝐾17𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2𝑝𝐶𝑂
(10-26)

LXII Hyperbolische Modellansätze
Reaktionsgeschwindigkeitsansätze für die Isomerisierung nach dem Mechanismus in
Abbildung 53:
𝑟15 =𝑘15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1𝑝𝐶𝑂 + 𝑝𝐶𝑂2 + 𝐾13𝐾1 𝑝𝐶𝑂𝑝𝐻2 + 𝐾14𝐾13𝐾1 𝑝𝐻2
(10-27)
𝑟16 =𝑘16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1𝑝𝐶𝑂 + 𝑝𝐶𝑂2 + 𝐾13𝐾1 𝑝𝐶𝑂𝑝𝐻2 + 𝐾14𝐾13𝐾1 𝑝𝐻2 +
𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
(10-28)
𝑟19 =𝑘19𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1𝑝𝐶𝑂 + 𝑝𝐶𝑂2 + 𝐾13𝐾1 𝑝𝐶𝑂𝑝𝐻2 + 𝐾14𝐾13𝐾1 𝑝𝐻2 +
𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2 + 𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
(10-29)
𝑟20 =𝑘20𝐾19𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
𝐾1𝑝𝐶𝑂 + 𝑝𝐶𝑂2 +𝐾13𝐾1 𝑝𝐶𝑂𝑝𝐻2 + 𝐾14𝐾13𝐾1 𝑝𝐻2 + 𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2 +
𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2 + 𝐾19𝐾16𝐾15𝐾14𝐾13 𝐾1 𝑝𝐴𝑙𝑘𝑒𝑛𝑝𝐻2
(10-30)

Umsatz- und Selektivitätsverläufe in Abhängigkeit der
Reaktionstemperatur
LXIII
XIV Umsatz- und Selektivitätsverläufe in Abhängigkeit der
Reaktionstemperatur
Abbildung 78: Variation Reaktionstemperatur am Rh-BzP-SILP-Katalysator im Strömungsrohr.
Steigende Temperaturrampe von 70 – 130 °C mit ΔT = 10 K.
Rh-BzP-SILP ; pabs = 10 bar; T = 70 - 130 °C; VGes= 25 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 4
bar; mSILP-Kat = 0,5 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh
= 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten, S2-Propyl-2-heptenal.
0 20 40 60 80 100 120
0
5
10
15
20
25
30
35
X1-B
ute
n /
%
Zeit / h
0
10
20
30
40
50
60
70
80
90
100
Si /
%

LXIV Umsatz- und Selektivitätsverläufe in Abhängigkeit der
Reaktionstemperatur
Abbildung 79: Variation Reaktionstemperatur am Rh-BzP-SILP-Katalysator im Strömungsrohr.
Abnehmende Temperaturrampe von 120 – 60 °C mit ΔT = 10 K.
Rh-BzP-SILP ; pabs = 10 bar; T = 60 - 120 °C; VGes= 25 ml min -1; p1-Buten = 2 bar; pH2 = 4 bar; pCO = 4
bar; mSILP-Kat = 0,5 g; Rh(acac)(CO)2; BzP; [EMIM][NTf2]; Stabilisator; Silica 100 (kalz.); α = 0,1; wRh
= 0,2 Gew-%; L : Rh = 10 : 1; St : L = 4 : 1.
X1-Buten, Sn-Pentanal, Sn/iso, Sn-Butan, Strans-2-Buten, Scis-2-Buten, S2-Propyl-2-heptenal.
0 20 40 60 80 100 120
0
5
10
15
20
25
30
35
X1-B
ute
n /
%
Zeit / h
0
10
20
30
40
50
60
70
80
90
100
Si /
%

Parameter der Sensitivitätsanalyse LXV
XV Parameter der Sensitivitätsanalyse
t
n1
-Buten
,0
nC
O,0
nH
2,0
n1
-Buten
,aus
nn
-Pen
tanal,au
s
nn
-Butan
,aus
ncis-2
-Bu
ten,au
s
ntran
s-2-B
uten
,aus
mn
-Pen
tanal,au
s
Nr. mol h-1 mol h-1 mol h-1 mol h-1 mol h-1 mol h-1 mol h-1 mol h-1 kg s-1
1 0,05 0,05 0,05 1,98E-02 0,01603 3,41E-03 7,84E-03 2,89E-03 3,84E-07
2 0,05 0,05 0,10 1,52E-02 0,01553 6,52E-03 9,29E-03 3,43E-03 3,72E-07
3 0,05 0,05 0,15 1,19E-02 0,01503 8,90E-03 1,04E-02 3,83E-03 3,60E-07
4 0,05 0,05 0,20 9,32E-03 0,01453 1,08E-02 1,13E-02 4,15E-03 3,48E-07
5 0,05 0,05 0,25 7,37E-03 0,01404 1,23E-02 1,19E-02 4,40E-03 3,36E-07
6 0,05 0,05 0,30 5,87E-03 0,01357 1,35E-02 1,25E-02 4,60E-03 3,25E-07
7 0,05 0,05 0,35 4,71E-03 0,01312 1,45E-02 1,29E-02 4,77E-03 3,14E-07
8 0,05 0,05 0,40 3,79E-03 0,01268 1,53E-02 1,33E-02 4,91E-03 3,03E-07
9 0,05 0,05 0,45 3,07E-03 0,01227 1,60E-02 1,36E-02 5,02E-03 2,93E-07
10 0,05 0,05 0,50 2,50E-03 0,01187 1,66E-02 1,39E-02 5,12E-03 2,84E-07
11 0,05 0,10 0,05 0,03211 0,01318 9,15E-04 2,77E-03 1,02E-03 3,15E-07
12 0,05 0,10 0,10 0,03042 0,01305 1,90E-03 3,39E-03 1,25E-03 3,12E-07
13 0,05 0,10 0,15 0,02885 0,01292 2,82E-03 3,96E-03 1,46E-03 3,09E-07
14 0,05 0,10 0,20 0,02739 0,01279 3,67E-03 4,49E-03 1,66E-03 3,06E-07
15 0,05 0,10 0,25 0,02603 0,01266 4,48E-03 4,99E-03 1,84E-03 3,03E-07
16 0,05 0,10 0,30 0,02476 0,01254 5,23E-03 5,46E-03 2,01E-03 3,00E-07
17 0,05 0,10 0,35 0,02357 0,01242 5,94E-03 5,90E-03 2,18E-03 2,97E-07
18 0,05 0,10 0,40 0,02246 0,0123 6,60E-03 6,31E-03 2,33E-03 2,94E-07
19 0,05 0,10 0,45 0,02141 0,01218 7,23E-03 6,70E-03 2,47E-03 2,91E-07
20 0,05 0,10 0,50 0,02043 0,01206 7,83E-03 7,07E-03 2,61E-03 2,89E-07
21 0,05 0,15 0,05 0,03627 1,12E-02 4,19E-04 1,58E-03 5,82E-04 2,67E-07
22 0,05 0,15 0,10 0,03547 1,11E-02 8,75E-04 1,88E-03 6,92E-04 2,65E-07
23 0,05 0,15 0,15 0,03469 1,10E-02 1,32E-03 2,16E-03 7,98E-04 2,64E-07
24 0,05 0,15 0,20 0,03393 1,10E-02 1,75E-03 2,45E-03 9,02E-04 2,63E-07
25 0,05 0,15 0,25 0,0332 0,01092 2,16E-03 2,72E-03 1,00E-03 2,61E-07
26 0,05 0,15 0,30 0,03249 0,01086 2,57E-03 2,98E-03 1,10E-03 2,60E-07
27 0,05 0,15 0,35 0,0318 0,01081 2,96E-03 3,24E-03 1,19E-03 2,59E-07
28 0,05 0,15 0,40 0,03114 0,01075 3,34E-03 3,49E-03 1,29E-03 2,57E-07
29 0,05 0,15 0,45 0,03049 0,0107 3,71E-03 3,73E-03 1,38E-03 2,56E-07
30 0,05 0,15 0,50 0,02986 0,01064 4,07E-03 3,97E-03 1,46E-03 2,55E-07
31 0,05 0,20 0,05 0,0386 9,68E-03 2,41E-04 1,08E-03 3,99E-04 2,32E-07
32 0,05 0,20 0,10 0,03813 9,65E-03 5,02E-04 1,26E-03 4,64E-04 2,31E-07
33 0,05 0,20 0,15 0,03767 9,61E-03 7,59E-04 1,43E-03 5,27E-04 2,30E-07
34 0,05 0,20 0,20 0,03722 9,58E-03 1,01E-03 1,60E-03 5,89E-04 2,29E-07
35 0,05 0,20 0,25 0,03678 9,55E-03 1,26E-03 1,76E-03 6,50E-04 2,29E-07
36 0,05 0,20 0,30 0,03634 9,52E-03 1,50E-03 1,93E-03 7,10E-04 2,28E-07
37 0,05 0,20 0,35 0,03591 9,49E-03 1,74E-03 2,09E-03 7,69E-04 2,27E-07

LXVI Parameter der Sensitivitätsanalyse
38 0,05 0,20 0,40 0,03549 9,46E-03 1,98E-03 2,24E-03 8,28E-04 2,26E-07
39 0,05 0,20 0,45 0,03508 9,43E-03 2,21E-03 2,40E-03 8,85E-04 2,26E-07
40 0,05 0,20 0,50 0,03467 9,40E-03 2,44E-03 2,55E-03 9,41E-04 2,25E-07
41 0,05 0,25 0,05 4,02E-02 8,56E-03 1,57E-04 8,19E-04 3,02E-04 2,05E-07
42 0,05 0,25 0,10 3,99E-02 8,54E-03 3,26E-04 9,33E-04 3,44E-04 2,04E-07
43 0,05 0,25 0,15 0,03955 8,52E-03 4,94E-04 1,05E-03 3,86E-04 2,04E-07
44 0,05 0,25 0,20 0,03925 8,50E-03 6,60E-04 1,16E-03 4,27E-04 2,03E-07
45 0,05 0,25 0,25 0,03896 8,48E-03 8,23E-04 1,27E-03 4,68E-04 2,03E-07
46 0,05 0,25 0,30 0,03867 8,46E-03 9,85E-04 1,38E-03 5,08E-04 2,02E-07
47 0,05 0,25 0,35 0,03838 8,44E-03 1,15E-03 1,49E-03 5,48E-04 2,02E-07
48 0,05 0,25 0,40 0,03809 8,43E-03 1,30E-03 1,59E-03 5,88E-04 2,02E-07
49 0,05 0,25 0,45 0,03781 8,41E-03 1,46E-03 1,70E-03 6,27E-04 2,01E-07
50 0,05 0,25 0,50 0,03753 8,39E-03 1,62E-03 1,80E-03 6,65E-04 2,01E-07
51 0,05 0,30 0,05 4,13E-02 7,68E-03 1,11E-04 6,56E-04 2,42E-04 1,84E-07
52 0,05 0,30 0,10 4,11E-02 7,67E-03 2,29E-04 7,37E-04 2,72E-04 1,83E-07
53 0,05 0,30 0,15 4,09E-02 7,65E-03 3,47E-04 8,17E-04 3,01E-04 1,83E-07
54 0,05 0,30 0,20 4,07E-02 7,64E-03 4,64E-04 8,96E-04 3,31E-04 1,83E-07
55 0,05 0,30 0,25 4,05E-02 7,63E-03 5,80E-04 9,75E-04 3,60E-04 1,83E-07
56 0,05 0,30 0,30 0,04025 7,62E-03 6,95E-04 1,05E-03 3,89E-04 1,82E-07
57 0,05 0,30 0,35 0,04004 7,60E-03 8,09E-04 1,13E-03 4,17E-04 1,82E-07
58 0,05 0,30 0,40 0,03983 7,59E-03 9,22E-04 1,21E-03 4,46E-04 1,82E-07
59 0,05 0,30 0,45 0,03963 7,58E-03 1,03E-03 1,28E-03 4,74E-04 1,81E-07
60 0,05 0,30 0,50 0,03943 7,57E-03 1,15E-03 1,36E-03 5,02E-04 1,81E-07
61 0,05 0,35 0,05 4,22E-02 6,97E-03 8,22E-05 5,47E-04 2,02E-04 1,67E-07
62 0,05 0,35 0,10 4,20E-02 6,96E-03 1,70E-04 6,07E-04 2,24E-04 1,66E-07
63 0,05 0,35 0,15 4,19E-02 6,95E-03 2,57E-04 6,67E-04 2,46E-04 1,66E-07
64 0,05 0,35 0,20 4,17E-02 6,94E-03 3,44E-04 7,26E-04 2,68E-04 1,66E-07
65 0,05 0,35 0,25 4,16E-02 6,93E-03 4,31E-04 7,85E-04 2,89E-04 1,66E-07
66 0,05 0,35 0,30 4,14E-02 6,92E-03 5,16E-04 8,43E-04 3,11E-04 1,66E-07
67 0,05 0,35 0,35 4,13E-02 6,91E-03 6,02E-04 9,01E-04 3,33E-04 1,65E-07
68 0,05 0,35 0,40 4,11E-02 6,91E-03 6,87E-04 9,59E-04 3,54E-04 1,65E-07
69 0,05 0,35 0,45 0,04094 6,90E-03 7,71E-04 1,02E-03 3,75E-04 1,65E-07
70 0,05 0,35 0,50 0,04079 6,89E-03 8,55E-04 1,07E-03 3,96E-04 1,65E-07
71 0,05 0,40 0,05 4,29E-02 6,38E-03 6,36E-05 4,69E-04 1,73E-04 1,53E-07
72 0,05 0,40 0,10 4,28E-02 6,37E-03 1,31E-04 5,15E-04 1,90E-04 1,52E-07
73 0,05 0,40 0,15 4,27E-02 6,37E-03 1,99E-04 5,61E-04 2,07E-04 1,52E-07
74 0,05 0,40 0,20 4,25E-02 6,36E-03 2,66E-04 6,07E-04 2,24E-04 1,52E-07
75 0,05 0,40 0,25 4,24E-02 6,35E-03 3,32E-04 6,52E-04 2,41E-04 1,52E-07
76 0,05 0,40 0,30 4,23E-02 6,35E-03 3,99E-04 6,98E-04 2,57E-04 1,52E-07
77 0,05 0,40 0,35 4,22E-02 6,34E-03 4,65E-04 7,43E-04 2,74E-04 1,52E-07
78 0,05 0,40 0,40 4,21E-02 6,33E-03 5,31E-04 7,88E-04 2,91E-04 1,52E-07
79 0,05 0,40 0,45 4,19E-02 6,33E-03 5,96E-04 8,33E-04 3,07E-04 1,51E-07
80 0,05 0,40 0,50 4,18E-02 6,32E-03 6,62E-04 8,78E-04 3,24E-04 1,51E-07
81 0,05 0,45 0,05 4,35E-02 5,88E-03 5,07E-05 4,10E-04 1,51E-04 1,41E-07
82 0,05 0,45 0,10 4,34E-02 5,88E-03 1,04E-04 4,46E-04 1,65E-04 1,41E-07

Parameter der Sensitivitätsanalyse LXVII
83 0,05 0,45 0,15 4,33E-02 5,87E-03 1,58E-04 4,83E-04 1,78E-04 1,41E-07
84 0,05 0,45 0,20 4,32E-02 5,87E-03 2,11E-04 5,20E-04 1,92E-04 1,40E-07
85 0,05 0,45 0,25 4,31E-02 5,86E-03 2,64E-04 5,56E-04 2,05E-04 1,40E-07
86 0,05 0,45 0,30 4,30E-02 5,86E-03 3,17E-04 5,92E-04 2,19E-04 1,40E-07
87 0,05 0,45 0,35 4,29E-02 5,85E-03 3,70E-04 6,29E-04 2,32E-04 1,40E-07
88 0,05 0,45 0,40 4,28E-02 5,85E-03 4,23E-04 6,65E-04 2,45E-04 1,40E-07
89 0,05 0,45 0,45 4,27E-02 5,84E-03 4,75E-04 7,01E-04 2,58E-04 1,40E-07
90 0,05 0,45 0,50 4,26E-02 5,84E-03 5,27E-04 7,36E-04 2,72E-04 1,40E-07
91 0,05 0,50 0,05 4,40E-02 5,46E-03 4,14E-05 3,64E-04 1,34E-04 1,31E-07
92 0,05 0,50 0,10 4,39E-02 5,46E-03 8,51E-05 3,94E-04 1,45E-04 1,31E-07
93 0,05 0,50 0,15 4,38E-02 5,45E-03 1,29E-04 4,24E-04 1,56E-04 1,30E-07
94 0,05 0,50 0,20 4,38E-02 5,45E-03 1,72E-04 4,53E-04 1,67E-04 1,30E-07
95 0,05 0,50 0,25 4,37E-02 5,44E-03 2,15E-04 4,83E-04 1,78E-04 1,30E-07
96 0,05 0,50 0,30 4,36E-02 5,44E-03 2,58E-04 5,13E-04 1,89E-04 1,30E-07
97 0,05 0,50 0,35 4,35E-02 5,44E-03 3,01E-04 5,42E-04 2,00E-04 1,30E-07
98 0,05 0,50 0,40 4,34E-02 5,43E-03 3,44E-04 5,72E-04 2,11E-04 1,30E-07
99 0,05 0,50 0,45 4,34E-02 5,43E-03 3,87E-04 6,01E-04 2,22E-04 1,30E-07
100 0,05 0,50 0,50 4,33E-02 5,43E-03 4,30E-04 6,31E-04 2,33E-04 1,30E-07
101 0,10 0,05 0,05 0,04376 0,01867 6,68E-03 2,26E-02 8,32E-03 4,47E-07
102 0,10 0,05 0,10 0,03563 0,01842 1,29E-02 2,41E-02 8,90E-03 4,41E-07
103 0,10 0,05 0,15 0,02947 0,01818 1,76E-02 2,54E-02 9,37E-03 4,35E-07
104 0,10 0,05 0,20 0,02464 0,01795 2,12E-02 2,64E-02 9,75E-03 4,29E-07
105 0,10 0,05 0,25 0,02076 0,01772 2,42E-02 2,73E-02 1,01E-02 4,24E-07
106 0,10 0,05 0,30 0,01759 0,01749 2,66E-02 2,80E-02 1,03E-02 4,19E-07
107 0,10 0,05 0,35 0,01497 0,01727 2,86E-02 2,86E-02 1,06E-02 4,13E-07
108 0,10 0,05 0,40 0,01279 0,01705 3,03E-02 2,91E-02 1,08E-02 4,08E-07
109 0,10 0,05 0,45 0,01095 0,01682 3,18E-02 2,96E-02 1,09E-02 4,03E-07
110 0,10 0,05 0,50 0,0094 0,01661 3,30E-02 2,99E-02 1,11E-02 3,97E-07
111 0,10 0,10 0,05 0,07128 0,01668 1,86E-03 7,44E-03 2,74E-03 3,99E-07
112 0,10 0,10 0,10 0,06776 0,01658 3,91E-03 8,58E-03 3,17E-03 3,97E-07
113 0,10 0,10 0,15 0,06454 0,01649 5,79E-03 9,63E-03 3,55E-03 3,95E-07
114 0,10 0,10 0,20 0,06159 0,0164 7,51E-03 1,06E-02 3,91E-03 3,92E-07
115 0,10 0,10 0,25 0,05887 0,01632 9,09E-03 1,15E-02 4,24E-03 3,90E-07
116 0,10 0,10 0,30 0,05636 0,01623 1,06E-02 1,23E-02 4,54E-03 3,88E-07
117 0,10 0,10 0,35 0,05402 0,01615 1,19E-02 1,31E-02 4,83E-03 3,86E-07
118 0,10 0,10 0,40 0,05184 0,01607 1,32E-02 1,38E-02 5,09E-03 3,84E-07
119 0,10 0,10 0,45 0,04981 0,01599 1,44E-02 1,45E-02 5,34E-03 3,83E-07
120 0,10 0,10 0,50 0,0479 0,01591 1,55E-02 1,51E-02 5,58E-03 3,81E-07
121 0,10 0,15 0,05 0,07871 0,01498 8,43E-04 3,99E-03 1,47E-03 3,58E-07
122 0,10 0,15 0,10 0,077 0,01493 1,80E-03 4,58E-03 1,69E-03 3,57E-07
123 0,10 0,15 0,15 0,07536 0,01488 2,71E-03 5,15E-03 1,90E-03 3,56E-07
124 0,10 0,15 0,20 0,07378 0,01483 3,59E-03 5,70E-03 2,10E-03 3,55E-07
125 0,10 0,15 0,25 0,07227 0,01479 4,43E-03 6,22E-03 2,29E-03 3,54E-07
126 0,10 0,15 0,30 0,07081 0,01474 5,24E-03 6,73E-03 2,48E-03 3,53E-07
127 0,10 0,15 0,35 0,06941 0,01469 6,02E-03 7,21E-03 2,66E-03 3,52E-07

LXVIII Parameter der Sensitivitätsanalyse
128 0,10 0,15 0,40 0,06806 0,01465 6,77E-03 7,68E-03 2,83E-03 3,51E-07
129 0,10 0,15 0,45 0,06676 0,01461 7,50E-03 8,14E-03 3,00E-03 3,49E-07
130 0,10 0,15 0,50 0,0655 0,01456 8,20E-03 8,57E-03 3,16E-03 3,48E-07
131 0,10 0,20 0,05 0,08232 1,36E-02 4,81E-04 2,63E-03 9,70E-04 3,25E-07
132 0,10 0,20 0,10 0,08133 0,01357 1,02E-03 2,98E-03 1,10E-03 3,25E-07
133 0,10 0,20 0,15 0,08036 0,01354 1,56E-03 3,32E-03 1,23E-03 3,24E-07
134 0,10 0,20 0,20 0,07941 0,01351 2,07E-03 3,66E-03 1,35E-03 3,23E-07
135 0,10 0,20 0,25 0,07848 0,01348 2,58E-03 3,99E-03 1,47E-03 3,22E-07
136 0,10 0,20 0,30 0,07758 0,01345 3,08E-03 4,31E-03 1,59E-03 3,22E-07
137 0,10 0,20 0,35 0,07669 0,01342 3,56E-03 4,62E-03 1,70E-03 3,21E-07
138 0,10 0,20 0,40 0,07583 0,01339 4,03E-03 4,93E-03 1,82E-03 3,20E-07
139 0,10 0,20 0,45 0,07498 0,01336 4,49E-03 5,23E-03 1,93E-03 3,20E-07
140 0,10 0,20 0,50 0,07416 0,01334 4,95E-03 5,52E-03 2,04E-03 3,19E-07
141 0,10 0,25 0,05 0,08459 1,25E-02 3,11E-04 1,93E-03 7,12E-04 2,98E-07
142 0,10 0,25 0,10 0,08394 1,24E-02 6,62E-04 2,16E-03 7,98E-04 2,98E-07
143 0,10 0,25 0,15 0,08331 1,24E-02 1,01E-03 2,39E-03 8,81E-04 2,97E-07
144 0,10 0,25 0,20 0,08268 1,24E-02 1,35E-03 2,61E-03 9,64E-04 2,97E-07
145 0,10 0,25 0,25 0,08206 0,01238 1,68E-03 2,83E-03 1,05E-03 2,96E-07
146 0,10 0,25 0,30 0,08146 0,01236 2,01E-03 3,05E-03 1,13E-03 2,96E-07
147 0,10 0,25 0,35 0,08086 0,01234 2,33E-03 3,27E-03 1,21E-03 2,95E-07
148 0,10 0,25 0,40 0,08027 0,01232 2,65E-03 3,48E-03 1,28E-03 2,95E-07
149 0,10 0,25 0,45 0,07969 0,0123 2,97E-03 3,69E-03 1,36E-03 2,94E-07
150 0,10 0,25 0,50 0,07911 0,01228 3,28E-03 3,89E-03 1,44E-03 2,94E-07
151 0,10 0,30 0,05 0,08621 1,15E-02 2,18E-04 1,51E-03 5,59E-04 2,75E-07
152 0,10 0,30 0,10 0,08576 1,15E-02 4,63E-04 1,68E-03 6,19E-04 2,75E-07
153 0,10 0,30 0,15 0,08531 1,15E-02 7,04E-04 1,84E-03 6,78E-04 2,74E-07
154 0,10 0,30 0,20 0,08487 1,15E-02 9,43E-04 2,00E-03 7,37E-04 2,74E-07
155 0,10 0,30 0,25 0,08443 1,14E-02 1,18E-03 2,16E-03 7,96E-04 2,74E-07
156 0,10 0,30 0,30 0,084 1,14E-02 1,41E-03 2,31E-03 8,53E-04 2,73E-07
157 0,10 0,30 0,35 0,08357 1,14E-02 1,64E-03 2,47E-03 9,10E-04 2,73E-07
158 0,10 0,30 0,40 0,08314 1,14E-02 1,87E-03 2,62E-03 9,67E-04 2,73E-07
159 0,10 0,30 0,45 0,08272 0,01138 2,10E-03 2,77E-03 1,02E-03 2,72E-07
160 0,10 0,30 0,50 0,08231 0,01137 2,33E-03 2,92E-03 1,08E-03 2,72E-07
161 0,10 0,35 0,05 0,08746 1,07E-02 1,62E-04 1,24E-03 4,58E-04 2,55E-07
162 0,10 0,35 0,10 0,08713 1,07E-02 3,42E-04 1,36E-03 5,03E-04 2,55E-07
163 0,10 0,35 0,15 0,0868 1,07E-02 5,20E-04 1,48E-03 5,47E-04 2,55E-07
164 0,10 0,35 0,20 0,08647 1,06E-02 6,97E-04 1,60E-03 5,91E-04 2,55E-07
165 0,10 0,35 0,25 0,08614 1,06E-02 8,73E-04 1,72E-03 6,35E-04 2,54E-07
166 0,10 0,35 0,30 0,08582 1,06E-02 1,05E-03 1,84E-03 6,78E-04 2,54E-07
167 0,10 0,35 0,35 0,08549 1,06E-02 1,22E-03 1,95E-03 7,21E-04 2,54E-07
168 0,10 0,35 0,40 0,08517 1,06E-02 1,39E-03 2,07E-03 7,63E-04 2,54E-07
169 0,10 0,35 0,45 0,08486 1,06E-02 1,56E-03 2,18E-03 8,06E-04 2,53E-07
170 0,10 0,35 0,50 0,08454 1,06E-02 1,73E-03 2,30E-03 8,48E-04 2,53E-07
171 0,10 0,40 0,05 0,08847 9,97E-03 1,25E-04 1,05E-03 3,87E-04 2,38E-07
172 0,10 0,40 0,10 0,08822 9,96E-03 2,63E-04 1,14E-03 4,22E-04 2,38E-07

Parameter der Sensitivitätsanalyse LXIX
173 0,10 0,40 0,15 0,08796 9,95E-03 4,00E-04 1,24E-03 4,56E-04 2,38E-07
174 0,10 0,40 0,20 0,0877 9,94E-03 5,37E-04 1,33E-03 4,90E-04 2,38E-07
175 0,10 0,40 0,25 0,08745 9,93E-03 6,72E-04 1,42E-03 5,24E-04 2,38E-07
176 0,10 0,40 0,30 0,0872 9,93E-03 8,07E-04 1,51E-03 5,57E-04 2,37E-07
177 0,10 0,40 0,35 0,08695 9,92E-03 9,41E-04 1,60E-03 5,91E-04 2,37E-07
178 0,10 0,40 0,40 0,0867 9,91E-03 1,07E-03 1,69E-03 6,24E-04 2,37E-07
179 0,10 0,40 0,45 0,08645 9,90E-03 1,21E-03 1,78E-03 6,57E-04 2,37E-07
180 0,10 0,40 0,50 0,08621 9,90E-03 1,34E-03 1,87E-03 6,90E-04 2,37E-07
181 0,10 0,45 0,05 8,93E-02 9,35E-03 9,96E-05 9,07E-04 3,35E-04 2,24E-07
182 0,10 0,45 0,10 8,91E-02 9,34E-03 2,09E-04 9,82E-04 3,62E-04 2,23E-07
183 0,10 0,45 0,15 0,0889 9,33E-03 3,18E-04 1,06E-03 3,89E-04 2,23E-07
184 0,10 0,45 0,20 0,0887 9,33E-03 4,26E-04 1,13E-03 4,17E-04 2,23E-07
185 0,10 0,45 0,25 0,0885 9,32E-03 5,34E-04 1,20E-03 4,44E-04 2,23E-07
186 0,10 0,45 0,30 0,0883 9,32E-03 6,41E-04 1,28E-03 4,70E-04 2,23E-07
187 0,10 0,45 0,35 0,0881 9,31E-03 7,48E-04 1,35E-03 4,97E-04 2,23E-07
188 0,10 0,45 0,40 0,0879 9,30E-03 8,54E-04 1,42E-03 5,24E-04 2,23E-07
189 0,10 0,45 0,45 0,0877 9,30E-03 9,60E-04 1,49E-03 5,50E-04 2,22E-07
190 0,10 0,45 0,50 0,0875 9,29E-03 1,06E-03 1,56E-03 5,77E-04 2,22E-07
191 0,10 0,50 0,05 9,00E-02 8,80E-03 8,12E-05 7,98E-04 2,95E-04 2,11E-07
192 0,10 0,50 0,10 8,99E-02 8,80E-03 1,70E-04 8,59E-04 3,17E-04 2,10E-07
193 0,10 0,50 0,15 8,97E-02 8,79E-03 2,58E-04 9,19E-04 3,39E-04 2,10E-07
194 0,10 0,50 0,20 8,95E-02 8,79E-03 3,46E-04 9,79E-04 3,61E-04 2,10E-07
195 0,10 0,50 0,25 0,08936 8,78E-03 4,34E-04 1,04E-03 3,83E-04 2,10E-07
196 0,10 0,50 0,30 0,0892 8,78E-03 5,21E-04 1,10E-03 4,05E-04 2,10E-07
197 0,10 0,50 0,35 0,08903 8,77E-03 6,08E-04 1,16E-03 4,27E-04 2,10E-07
198 0,10 0,50 0,40 0,08887 8,77E-03 6,95E-04 1,22E-03 4,49E-04 2,10E-07
199 0,10 0,50 0,45 0,08871 8,76E-03 7,81E-04 1,28E-03 4,71E-04 2,10E-07
200 0,10 0,50 0,50 0,08855 8,76E-03 8,67E-04 1,33E-03 4,92E-04 2,10E-07
201 0,15 0,05 0,05 0,06344 0,01959 9,28E-03 4,21E-02 1,56E-02 4,69E-07
202 0,15 0,05 0,10 0,05475 0,01947 1,80E-02 4,22E-02 1,56E-02 4,66E-07
203 0,15 0,05 0,15 0,04802 0,01935 2,44E-02 4,25E-02 1,57E-02 4,63E-07
204 0,15 0,05 0,20 0,04264 0,01924 2,94E-02 4,29E-02 1,58E-02 4,60E-07
205 0,15 0,05 0,25 0,0382 0,01914 3,34E-02 4,33E-02 1,60E-02 4,58E-07
206 0,15 0,05 0,30 0,03449 0,01905 3,67E-02 4,37E-02 1,61E-02 4,56E-07
207 0,15 0,05 0,35 0,03132 0,01896 3,95E-02 4,40E-02 1,62E-02 4,54E-07
208 0,15 0,05 0,40 0,02859 0,01888 4,19E-02 4,43E-02 1,64E-02 4,52E-07
209 0,15 0,05 0,45 0,0262 0,0188 4,39E-02 4,46E-02 1,65E-02 4,50E-07
210 0,15 0,05 0,50 0,0241 0,01872 4,57E-02 4,49E-02 1,66E-02 4,48E-07
211 0,15 0,10 0,05 0,11029 0,01815 2,75E-03 1,37E-02 5,07E-03 4,34E-07
212 0,15 0,10 0,10 0,10532 0,01808 5,81E-03 1,52E-02 5,60E-03 4,33E-07
213 0,15 0,10 0,15 0,10085 0,01802 8,54E-03 1,65E-02 6,09E-03 4,31E-07
214 0,15 0,10 0,20 0,09681 0,01796 1,10E-02 1,77E-02 6,53E-03 4,30E-07
215 0,15 0,10 0,25 0,09312 0,0179 1,33E-02 1,88E-02 6,93E-03 4,28E-07
216 0,15 0,10 0,30 0,08974 0,01785 1,53E-02 1,98E-02 7,30E-03 4,27E-07
217 0,15 0,10 0,35 0,08663 0,01779 1,72E-02 2,07E-02 7,65E-03 4,26E-07

LXX Parameter der Sensitivitätsanalyse
218 0,15 0,10 0,40 0,08375 0,01774 1,89E-02 2,16E-02 7,97E-03 4,24E-07
219 0,15 0,10 0,45 0,08107 0,01769 2,06E-02 2,24E-02 8,27E-03 4,23E-07
220 0,15 0,10 0,50 0,07858 0,01764 2,21E-02 2,32E-02 8,55E-03 4,22E-07
221 0,15 0,15 0,05 0,12214 0,0168 1,26E-03 7,16E-03 2,64E-03 4,02E-07
222 0,15 0,15 0,10 0,11959 0,01676 2,70E-03 8,00E-03 2,95E-03 4,01E-07
223 0,15 0,15 0,15 0,11717 0,01672 4,07E-03 8,79E-03 3,24E-03 4,00E-07
224 0,15 0,15 0,20 0,11487 0,01668 5,37E-03 9,55E-03 3,52E-03 3,99E-07
225 0,15 0,15 0,25 0,11267 0,01665 6,61E-03 1,03E-02 3,79E-03 3,98E-07
226 0,15 0,15 0,30 0,11058 0,01661 7,80E-03 1,10E-02 4,05E-03 3,97E-07
227 0,15 0,15 0,35 0,10858 0,01658 8,92E-03 1,16E-02 4,29E-03 3,97E-07
228 0,15 0,15 0,40 0,10667 0,01654 1,00E-02 1,23E-02 4,52E-03 3,96E-07
229 0,15 0,15 0,45 0,10484 0,01651 1,10E-02 1,29E-02 4,75E-03 3,95E-07
230 0,15 0,15 0,50 0,10308 0,01648 1,20E-02 1,35E-02 4,96E-03 3,94E-07
231 0,15 0,20 0,05 0,12735 0,01563 7,16E-04 4,61E-03 1,70E-03 3,74E-07
232 0,15 0,20 0,10 0,12585 0,0156 1,54E-03 5,12E-03 1,89E-03 3,73E-07
233 0,15 0,20 0,15 0,12439 0,01557 2,35E-03 5,62E-03 2,07E-03 3,73E-07
234 0,15 0,20 0,20 0,12297 0,01555 3,13E-03 6,10E-03 2,25E-03 3,72E-07
235 0,15 0,20 0,25 0,1216 0,01552 3,88E-03 6,57E-03 2,42E-03 3,71E-07
236 0,15 0,20 0,30 0,12026 0,0155 4,62E-03 7,03E-03 2,59E-03 3,71E-07
237 0,15 0,20 0,35 0,11896 0,01548 5,33E-03 7,48E-03 2,76E-03 3,70E-07
238 0,15 0,20 0,40 0,11769 0,01545 6,03E-03 7,91E-03 2,92E-03 3,70E-07
239 0,15 0,20 0,45 0,11646 0,01543 6,70E-03 8,33E-03 3,07E-03 3,69E-07
240 0,15 0,20 0,50 0,11526 0,01541 7,36E-03 8,74E-03 3,23E-03 3,69E-07
241 0,15 0,25 0,05 0,13039 0,01461 4,63E-04 3,32E-03 1,22E-03 3,49E-07
242 0,15 0,25 0,10 0,1294 0,01459 9,96E-04 3,66E-03 1,35E-03 3,49E-07
243 0,15 0,25 0,15 0,12844 0,01457 1,52E-03 4,00E-03 1,47E-03 3,49E-07
244 0,15 0,25 0,20 0,12749 0,01455 2,03E-03 4,33E-03 1,60E-03 3,48E-07
245 0,15 0,25 0,25 0,12657 0,01453 2,53E-03 4,65E-03 1,72E-03 3,48E-07
246 0,15 0,25 0,30 0,12566 0,01452 3,03E-03 4,97E-03 1,83E-03 3,47E-07
247 0,15 0,25 0,35 0,12476 0,0145 3,51E-03 5,28E-03 1,95E-03 3,47E-07
248 0,15 0,25 0,40 0,12389 0,01448 3,99E-03 5,58E-03 2,06E-03 3,47E-07
249 0,15 0,25 0,45 0,12302 0,01447 4,45E-03 5,88E-03 2,17E-03 3,46E-07
250 0,15 0,25 0,50 0,12218 0,01445 4,91E-03 6,18E-03 2,28E-03 3,46E-07
251 0,15 0,30 0,05 0,13245 1,37E-02 3,24E-04 2,56E-03 9,46E-04 3,28E-07
252 0,15 0,30 0,10 0,13176 0,0137 6,96E-04 2,81E-03 1,04E-03 3,28E-07
253 0,15 0,30 0,15 0,13108 0,01369 1,06E-03 3,05E-03 1,12E-03 3,27E-07
254 0,15 0,30 0,20 0,13041 0,01367 1,42E-03 3,28E-03 1,21E-03 3,27E-07
255 0,15 0,30 0,25 0,12974 0,01366 1,78E-03 3,52E-03 1,30E-03 3,27E-07
256 0,15 0,30 0,30 0,12909 0,01365 2,13E-03 3,75E-03 1,38E-03 3,27E-07
257 0,15 0,30 0,35 0,12844 0,01363 2,48E-03 3,98E-03 1,47E-03 3,26E-07
258 0,15 0,30 0,40 0,12781 0,01362 2,82E-03 4,20E-03 1,55E-03 3,26E-07
259 0,15 0,30 0,45 0,12718 0,01361 3,16E-03 4,42E-03 1,63E-03 3,26E-07
260 0,15 0,30 0,50 0,12656 0,0136 3,49E-03 4,64E-03 1,71E-03 3,25E-07
261 0,15 0,35 0,05 0,13399 1,29E-02 2,40E-04 2,08E-03 7,66E-04 3,09E-07
262 0,15 0,35 0,10 0,13348 1,29E-02 5,14E-04 2,26E-03 8,33E-04 3,09E-07

Parameter der Sensitivitätsanalyse LXXI
263 0,15 0,35 0,15 0,13298 1,29E-02 7,84E-04 2,44E-03 8,99E-04 3,09E-07
264 0,15 0,35 0,20 0,13247 1,29E-02 1,05E-03 2,61E-03 9,64E-04 3,09E-07
265 0,15 0,35 0,25 0,13198 0,01288 1,32E-03 2,79E-03 1,03E-03 3,08E-07
266 0,15 0,35 0,30 0,13149 0,01287 1,58E-03 2,96E-03 1,09E-03 3,08E-07
267 0,15 0,35 0,35 0,131 0,01286 1,84E-03 3,14E-03 1,16E-03 3,08E-07
268 0,15 0,35 0,40 0,13052 0,01286 2,10E-03 3,31E-03 1,22E-03 3,08E-07
269 0,15 0,35 0,45 0,13004 0,01285 2,35E-03 3,48E-03 1,28E-03 3,07E-07
270 0,15 0,35 0,50 0,12957 0,01284 2,60E-03 3,64E-03 1,34E-03 3,07E-07
271 0,15 0,40 0,05 0,13521 1,22E-02 1,85E-04 1,74E-03 6,41E-04 2,92E-07
272 0,15 0,40 0,10 0,13482 1,22E-02 3,95E-04 1,88E-03 6,93E-04 2,92E-07
273 0,15 0,40 0,15 0,13443 1,22E-02 6,03E-04 2,02E-03 7,44E-04 2,92E-07
274 0,15 0,40 0,20 0,13404 1,22E-02 8,09E-04 2,15E-03 7,95E-04 2,92E-07
275 0,15 0,40 0,25 0,13366 1,22E-02 1,01E-03 2,29E-03 8,45E-04 2,92E-07
276 0,15 0,40 0,30 0,13328 1,22E-02 1,22E-03 2,43E-03 8,95E-04 2,92E-07
277 0,15 0,40 0,35 0,1329 1,22E-02 1,42E-03 2,56E-03 9,45E-04 2,91E-07
278 0,15 0,40 0,40 0,13252 1,22E-02 1,62E-03 2,70E-03 9,94E-04 2,91E-07
279 0,15 0,40 0,45 0,13215 0,01216 1,82E-03 2,83E-03 1,04E-03 2,91E-07
280 0,15 0,40 0,50 0,13178 0,01215 2,01E-03 2,96E-03 1,09E-03 2,91E-07
281 0,15 0,45 0,05 0,13622 1,16E-02 1,47E-04 1,49E-03 5,50E-04 2,77E-07
282 0,15 0,45 0,10 0,1359 1,16E-02 3,13E-04 1,60E-03 5,91E-04 2,77E-07
283 0,15 0,45 0,15 0,13559 1,16E-02 4,78E-04 1,71E-03 6,31E-04 2,77E-07
284 0,15 0,45 0,20 0,13529 1,16E-02 6,42E-04 1,82E-03 6,72E-04 2,77E-07
285 0,15 0,45 0,25 0,13498 1,16E-02 8,04E-04 1,93E-03 7,12E-04 2,77E-07
286 0,15 0,45 0,30 0,13468 1,16E-02 9,66E-04 2,04E-03 7,53E-04 2,77E-07
287 0,15 0,45 0,35 0,13437 1,16E-02 1,13E-03 2,15E-03 7,93E-04 2,77E-07
288 0,15 0,45 0,40 0,13407 1,16E-02 1,29E-03 2,26E-03 8,32E-04 2,76E-07
289 0,15 0,45 0,45 0,13377 1,16E-02 1,45E-03 2,36E-03 8,72E-04 2,76E-07
290 0,15 0,45 0,50 0,13348 1,15E-02 1,60E-03 2,47E-03 9,11E-04 2,76E-07
291 0,15 0,50 0,05 0,13707 1,10E-02 1,20E-04 1,30E-03 4,80E-04 2,64E-07
292 0,15 0,50 0,10 0,13681 1,10E-02 2,54E-04 1,39E-03 5,14E-04 2,64E-07
293 0,15 0,50 0,15 0,13656 1,10E-02 3,88E-04 1,48E-03 5,47E-04 2,64E-07
294 0,15 0,50 0,20 0,13631 1,10E-02 5,21E-04 1,57E-03 5,80E-04 2,64E-07
295 0,15 0,50 0,25 0,13606 1,10E-02 6,54E-04 1,66E-03 6,13E-04 2,63E-07
296 0,15 0,50 0,30 0,13581 1,10E-02 7,85E-04 1,75E-03 6,46E-04 2,63E-07
297 0,15 0,50 0,35 0,13556 1,10E-02 9,17E-04 1,84E-03 6,79E-04 2,63E-07
298 0,15 0,50 0,40 0,13532 1,10E-02 1,05E-03 1,93E-03 7,11E-04 2,63E-07
299 0,15 0,50 0,45 0,13507 1,10E-02 1,18E-03 2,02E-03 7,44E-04 2,63E-07
300 0,15 0,50 0,50 0,13483 1,10E-02 1,31E-03 2,10E-03 7,76E-04 2,63E-07
301 0,20 0,05 0,05 0,07877 0,02005 1,14E-02 6,56E-02 2,42E-02 4,80E-07
302 0,20 0,05 0,10 0,07193 0,01999 2,20E-02 6,29E-02 2,32E-02 4,78E-07
303 0,20 0,05 0,15 0,06649 0,01994 2,98E-02 6,12E-02 2,26E-02 4,77E-07
304 0,20 0,05 0,20 0,06209 0,01989 3,58E-02 6,01E-02 2,22E-02 4,76E-07
305 0,20 0,05 0,25 0,05846 0,01985 4,05E-02 5,93E-02 2,19E-02 4,75E-07
306 0,20 0,05 0,30 0,05541 0,01982 4,43E-02 5,88E-02 2,17E-02 4,74E-07
307 0,20 0,05 0,35 0,05279 0,01979 4,75E-02 5,84E-02 2,15E-02 4,73E-07

LXXII Parameter der Sensitivitätsanalyse
308 0,20 0,05 0,40 0,05053 0,01976 5,02E-02 5,81E-02 2,14E-02 4,73E-07
309 0,20 0,05 0,45 0,04855 0,01973 5,24E-02 5,79E-02 2,14E-02 4,72E-07
310 0,20 0,05 0,50 0,0468 0,01971 5,44E-02 5,78E-02 2,13E-02 4,72E-07
311 0,20 0,10 0,05 0,14795 0,01894 3,59E-03 2,16E-02 7,95E-03 4,53E-07
312 0,20 0,10 0,10 0,14199 0,0189 7,56E-03 2,31E-02 8,50E-03 4,52E-07
313 0,20 0,10 0,15 0,13671 0,01885 1,11E-02 2,44E-02 9,00E-03 4,51E-07
314 0,20 0,10 0,20 0,13197 0,01881 1,42E-02 2,56E-02 9,44E-03 4,50E-07
315 0,20 0,10 0,25 0,1277 0,01877 1,70E-02 2,67E-02 9,85E-03 4,49E-07
316 0,20 0,10 0,30 0,12382 0,01873 1,95E-02 2,77E-02 1,02E-02 4,48E-07
317 0,20 0,10 0,35 0,12028 0,0187 2,18E-02 2,87E-02 1,06E-02 4,47E-07
318 0,20 0,10 0,40 0,11702 0,01867 2,39E-02 2,95E-02 1,09E-02 4,47E-07
319 0,20 0,10 0,45 0,11402 0,01863 2,58E-02 3,03E-02 1,12E-02 4,46E-07
320 0,20 0,10 0,50 0,11123 0,0186 2,76E-02 3,11E-02 1,15E-02 4,45E-07
321 0,20 0,15 0,05 0,16536 0,01784 1,66E-03 1,11E-02 4,08E-03 4,27E-07
322 0,20 0,15 0,10 0,16208 0,01781 3,58E-03 1,21E-02 4,45E-03 4,26E-07
323 0,20 0,15 0,15 0,159 0,01778 5,38E-03 1,30E-02 4,81E-03 4,25E-07
324 0,20 0,15 0,20 0,15609 0,01775 7,08E-03 1,39E-02 5,14E-03 4,25E-07
325 0,20 0,15 0,25 0,15334 0,01772 8,68E-03 1,48E-02 5,46E-03 4,24E-07
326 0,20 0,15 0,30 0,15074 0,0177 1,02E-02 1,56E-02 5,76E-03 4,23E-07
327 0,20 0,15 0,35 0,14827 0,01767 1,16E-02 1,64E-02 6,04E-03 4,23E-07
328 0,20 0,15 0,40 0,14592 0,01765 1,30E-02 1,71E-02 6,32E-03 4,22E-07
329 0,20 0,15 0,45 0,14368 0,01762 1,43E-02 1,78E-02 6,58E-03 4,22E-07
330 0,20 0,15 0,50 0,14155 0,0176 1,55E-02 1,85E-02 6,83E-03 4,21E-07
331 0,20 0,20 0,05 0,17262 0,01685 9,48E-04 7,00E-03 2,58E-03 4,03E-07
332 0,20 0,20 0,10 0,17064 0,01683 2,06E-03 7,65E-03 2,82E-03 4,03E-07
333 0,20 0,20 0,15 0,16873 0,01681 3,12E-03 8,28E-03 3,06E-03 4,02E-07
334 0,20 0,20 0,20 0,16689 0,01678 4,15E-03 8,89E-03 3,28E-03 4,02E-07
335 0,20 0,20 0,25 0,16511 0,01676 5,14E-03 9,48E-03 3,50E-03 4,01E-07
336 0,20 0,20 0,30 0,16339 0,01674 6,10E-03 1,01E-02 3,71E-03 4,01E-07
337 0,20 0,20 0,35 0,16172 0,01672 7,03E-03 1,06E-02 3,91E-03 4,00E-07
338 0,20 0,20 0,40 0,16011 0,01671 7,93E-03 1,11E-02 4,11E-03 4,00E-07
339 0,20 0,20 0,45 0,15855 0,01669 8,81E-03 1,17E-02 4,30E-03 3,99E-07
340 0,20 0,20 0,50 0,15703 0,01667 9,65E-03 1,22E-02 4,49E-03 3,99E-07
341 0,20 0,25 0,05 0,17662 0,01595 6,12E-04 4,98E-03 1,84E-03 3,82E-07
342 0,20 0,25 0,10 0,17531 0,01594 1,33E-03 5,42E-03 2,00E-03 3,81E-07
343 0,20 0,25 0,15 0,17404 0,01592 2,03E-03 5,85E-03 2,16E-03 3,81E-07
344 0,20 0,25 0,20 0,17279 0,01591 2,71E-03 6,28E-03 2,32E-03 3,81E-07
345 0,20 0,25 0,25 0,17157 0,01589 3,37E-03 6,69E-03 2,47E-03 3,80E-07
346 0,20 0,25 0,30 0,17038 0,01588 4,03E-03 7,10E-03 2,62E-03 3,80E-07
347 0,20 0,25 0,35 0,16921 0,01586 4,66E-03 7,50E-03 2,77E-03 3,80E-07
348 0,20 0,25 0,40 0,16807 0,01585 5,29E-03 7,88E-03 2,91E-03 3,79E-07
349 0,20 0,25 0,45 0,16696 0,01583 5,90E-03 8,26E-03 3,05E-03 3,79E-07
350 0,20 0,25 0,50 0,16587 0,01582 6,49E-03 8,64E-03 3,19E-03 3,79E-07
351 0,20 0,30 0,05 0,17922 0,01515 4,29E-04 3,80E-03 1,40E-03 3,62E-07
352 0,20 0,30 0,10 0,17829 0,01514 9,27E-04 4,12E-03 1,52E-03 3,62E-07

Parameter der Sensitivitätsanalyse LXXIII
353 0,20 0,30 0,15 0,17739 0,01513 1,42E-03 4,43E-03 1,64E-03 3,62E-07
354 0,20 0,30 0,20 0,17649 0,01512 1,90E-03 4,74E-03 1,75E-03 3,62E-07
355 0,20 0,30 0,25 0,17561 0,0151 2,37E-03 5,05E-03 1,86E-03 3,61E-07
356 0,20 0,30 0,30 0,17475 0,01509 2,84E-03 5,34E-03 1,97E-03 3,61E-07
357 0,20 0,30 0,35 0,1739 0,01508 3,30E-03 5,64E-03 2,08E-03 3,61E-07
358 0,20 0,30 0,40 0,17306 0,01507 3,75E-03 5,93E-03 2,19E-03 3,61E-07
359 0,20 0,30 0,45 0,17224 0,01506 4,20E-03 6,21E-03 2,29E-03 3,60E-07
360 0,20 0,30 0,50 0,17143 0,01505 4,64E-03 6,49E-03 2,40E-03 3,60E-07
361 0,20 0,35 0,05 0,18108 0,01442 3,17E-04 3,05E-03 1,12E-03 3,45E-07
362 0,20 0,35 0,10 0,1804 0,01442 6,84E-04 3,29E-03 1,21E-03 3,45E-07
363 0,20 0,35 0,15 0,17972 0,01441 1,05E-03 3,52E-03 1,30E-03 3,45E-07
364 0,20 0,35 0,20 0,17906 0,0144 1,41E-03 3,76E-03 1,39E-03 3,44E-07
365 0,20 0,35 0,25 0,1784 0,01439 1,76E-03 3,99E-03 1,47E-03 3,44E-07
366 0,20 0,35 0,30 0,17774 0,01438 2,11E-03 4,21E-03 1,55E-03 3,44E-07
367 0,20 0,35 0,35 0,1771 0,01437 2,45E-03 4,44E-03 1,64E-03 3,44E-07
368 0,20 0,35 0,40 0,17646 0,01436 2,80E-03 4,66E-03 1,72E-03 3,44E-07
369 0,20 0,35 0,45 0,17583 0,01435 3,13E-03 4,88E-03 1,80E-03 3,43E-07
370 0,20 0,35 0,50 0,17521 0,01434 3,47E-03 5,10E-03 1,88E-03 3,43E-07
371 0,20 0,40 0,05 0,18253 1,38E-02 2,44E-04 2,53E-03 9,34E-04 3,29E-07
372 0,20 0,40 0,10 0,182 0,01376 5,26E-04 2,72E-03 1,00E-03 3,29E-07
373 0,20 0,40 0,15 0,18148 0,01375 8,05E-04 2,90E-03 1,07E-03 3,29E-07
374 0,20 0,40 0,20 0,18096 0,01374 1,08E-03 3,08E-03 1,14E-03 3,29E-07
375 0,20 0,40 0,25 0,18044 0,01374 1,35E-03 3,26E-03 1,20E-03 3,29E-07
376 0,20 0,40 0,30 0,17994 0,01373 1,63E-03 3,44E-03 1,27E-03 3,28E-07
377 0,20 0,40 0,35 0,17943 0,01372 1,89E-03 3,62E-03 1,33E-03 3,28E-07
378 0,20 0,40 0,40 0,17893 0,01371 2,16E-03 3,79E-03 1,40E-03 3,28E-07
379 0,20 0,40 0,45 0,17844 0,01371 2,42E-03 3,97E-03 1,46E-03 3,28E-07
380 0,20 0,40 0,50 0,17795 0,0137 2,69E-03 4,14E-03 1,53E-03 3,28E-07
381 0,20 0,45 0,05 0,18369 1,32E-02 1,94E-04 2,16E-03 7,95E-04 3,15E-07
382 0,20 0,45 0,10 0,18327 1,32E-02 4,17E-04 2,30E-03 8,50E-04 3,15E-07
383 0,20 0,45 0,15 0,18286 1,32E-02 6,38E-04 2,45E-03 9,04E-04 3,15E-07
384 0,20 0,45 0,20 0,18244 1,32E-02 8,57E-04 2,60E-03 9,57E-04 3,15E-07
385 0,20 0,45 0,25 0,18203 0,01314 1,07E-03 2,74E-03 1,01E-03 3,14E-07
386 0,20 0,45 0,30 0,18163 0,01313 1,29E-03 2,88E-03 1,06E-03 3,14E-07
387 0,20 0,45 0,35 0,18122 0,01313 1,51E-03 3,03E-03 1,12E-03 3,14E-07
388 0,20 0,45 0,40 0,18082 0,01312 1,72E-03 3,17E-03 1,17E-03 3,14E-07
389 0,20 0,45 0,45 0,18043 0,01312 1,93E-03 3,31E-03 1,22E-03 3,14E-07
390 0,20 0,45 0,50 0,18003 0,01311 2,14E-03 3,45E-03 1,27E-03 3,14E-07
391 0,20 0,50 0,05 0,18466 1,26E-02 1,58E-04 1,87E-03 6,91E-04 3,02E-07
392 0,20 0,50 0,10 0,18432 1,26E-02 3,39E-04 1,99E-03 7,35E-04 3,02E-07
393 0,20 0,50 0,15 0,18398 1,26E-02 5,18E-04 2,11E-03 7,79E-04 3,02E-07
394 0,20 0,50 0,20 0,18365 1,26E-02 6,96E-04 2,23E-03 8,23E-04 3,01E-07
395 0,20 0,50 0,25 0,18331 1,26E-02 8,73E-04 2,35E-03 8,67E-04 3,01E-07
396 0,20 0,50 0,30 0,18298 1,26E-02 1,05E-03 2,47E-03 9,10E-04 3,01E-07
397 0,20 0,50 0,35 0,18265 1,26E-02 1,22E-03 2,58E-03 9,54E-04 3,01E-07

LXXIV Parameter der Sensitivitätsanalyse
398 0,20 0,50 0,40 0,18232 1,26E-02 1,40E-03 2,70E-03 9,96E-04 3,01E-07
399 0,20 0,50 0,45 0,182 0,01258 1,57E-03 2,82E-03 1,04E-03 3,01E-07
400 0,20 0,50 0,50 0,18167 0,01257 1,74E-03 2,93E-03 1,08E-03 3,01E-07
401 0,25 0,05 0,05 0,0903 0,02033 1,31E-02 9,23E-02 3,40E-02 4,86E-07
402 0,25 0,05 0,10 0,08712 0,02031 2,54E-02 8,56E-02 3,16E-02 4,86E-07
403 0,25 0,05 0,15 0,08454 0,02029 3,42E-02 8,11E-02 2,99E-02 4,86E-07
404 0,25 0,05 0,20 0,08244 0,02028 4,08E-02 7,78E-02 2,87E-02 4,85E-07
405 0,25 0,05 0,25 0,08072 0,02027 4,60E-02 7,53E-02 2,78E-02 4,85E-07
406 0,25 0,05 0,30 0,07928 0,02026 5,00E-02 7,34E-02 2,71E-02 4,85E-07
407 0,25 0,05 0,35 0,07807 0,02025 5,33E-02 7,19E-02 2,65E-02 4,85E-07
408 0,25 0,05 0,40 0,07703 0,02025 5,61E-02 7,06E-02 2,61E-02 4,84E-07
409 0,25 0,05 0,45 0,07614 0,02024 5,84E-02 6,96E-02 2,57E-02 4,84E-07
410 0,25 0,05 0,50 0,07536 0,02024 6,03E-02 6,87E-02 2,54E-02 4,84E-07
411 0,25 0,10 0,05 0,18402 0,01944 4,38E-03 3,08E-02 1,14E-02 4,65E-07
412 0,25 0,10 0,10 0,17753 0,01941 9,19E-03 3,21E-02 1,18E-02 4,64E-07
413 0,25 0,10 0,15 0,17185 0,01938 1,34E-02 3,32E-02 1,22E-02 4,64E-07
414 0,25 0,10 0,20 0,16681 0,01935 1,70E-02 3,42E-02 1,26E-02 4,63E-07
415 0,25 0,10 0,25 0,16229 0,01932 2,03E-02 3,51E-02 1,30E-02 4,62E-07
416 0,25 0,10 0,30 0,15823 0,01929 2,32E-02 3,60E-02 1,33E-02 4,62E-07
417 0,25 0,10 0,35 0,15456 0,01927 2,58E-02 3,68E-02 1,36E-02 4,61E-07
418 0,25 0,10 0,40 0,1512 0,01925 2,82E-02 3,75E-02 1,38E-02 4,61E-07
419 0,25 0,10 0,45 0,14813 0,01923 3,04E-02 3,82E-02 1,41E-02 4,60E-07
420 0,25 0,10 0,50 0,1453 0,01921 3,24E-02 3,88E-02 1,43E-02 4,60E-07
421 0,25 0,15 0,05 0,20799 0,01852 2,05E-03 1,57E-02 5,78E-03 4,43E-07
422 0,25 0,15 0,10 0,20411 0,01849 4,42E-03 1,68E-02 6,19E-03 4,43E-07
423 0,25 0,15 0,15 0,20049 0,01847 6,63E-03 1,78E-02 6,58E-03 4,42E-07
424 0,25 0,15 0,20 0,19711 0,01845 8,69E-03 1,88E-02 6,94E-03 4,41E-07
425 0,25 0,15 0,25 0,19393 0,01843 1,06E-02 1,97E-02 7,28E-03 4,41E-07
426 0,25 0,15 0,30 0,19094 0,0184 1,24E-02 2,06E-02 7,60E-03 4,40E-07
427 0,25 0,15 0,35 0,18813 0,01838 1,41E-02 2,14E-02 7,91E-03 4,40E-07
428 0,25 0,15 0,40 0,18546 0,01836 1,57E-02 2,22E-02 8,20E-03 4,39E-07
429 0,25 0,15 0,45 0,18294 0,01835 1,73E-02 2,30E-02 8,47E-03 4,39E-07
430 0,25 0,15 0,50 0,18054 0,01833 1,87E-02 2,37E-02 8,74E-03 4,39E-07
431 0,25 0,20 0,05 0,21774 0,01766 1,18E-03 9,80E-03 3,62E-03 4,23E-07
432 0,25 0,20 0,10 0,21533 0,01764 2,56E-03 1,06E-02 3,90E-03 4,22E-07
433 0,25 0,20 0,15 0,21302 0,01763 3,88E-03 1,13E-02 4,17E-03 4,22E-07
434 0,25 0,20 0,20 0,2108 0,01761 5,15E-03 1,20E-02 4,43E-03 4,21E-07
435 0,25 0,20 0,25 0,20867 0,01759 6,37E-03 1,27E-02 4,68E-03 4,21E-07
436 0,25 0,20 0,30 0,20661 0,01757 7,54E-03 1,34E-02 4,92E-03 4,20E-07
437 0,25 0,20 0,35 0,20464 0,01756 8,66E-03 1,40E-02 5,16E-03 4,20E-07
438 0,25 0,20 0,40 0,20273 0,01754 9,75E-03 1,46E-02 5,38E-03 4,20E-07
439 0,25 0,20 0,45 0,20089 0,01753 1,08E-02 1,52E-02 5,60E-03 4,19E-07
440 0,25 0,20 0,50 0,19911 0,01751 1,18E-02 1,58E-02 5,81E-03 4,19E-07
441 0,25 0,25 0,05 0,22292 0,01688 7,60E-04 6,90E-03 2,54E-03 4,04E-07
442 0,25 0,25 0,10 0,22131 0,01686 1,66E-03 7,43E-03 2,74E-03 4,03E-07

Parameter der Sensitivitätsanalyse LXXV
443 0,25 0,25 0,15 0,21974 0,01685 2,53E-03 7,95E-03 2,93E-03 4,03E-07
444 0,25 0,25 0,20 0,21821 0,01683 3,37E-03 8,46E-03 3,12E-03 4,03E-07
445 0,25 0,25 0,25 0,21673 0,01682 4,20E-03 8,95E-03 3,30E-03 4,02E-07
446 0,25 0,25 0,30 0,21528 0,01681 5,00E-03 9,43E-03 3,48E-03 4,02E-07
447 0,25 0,25 0,35 0,21387 0,0168 5,78E-03 9,90E-03 3,65E-03 4,02E-07
448 0,25 0,25 0,40 0,21249 0,01678 6,54E-03 1,04E-02 3,82E-03 4,02E-07
449 0,25 0,25 0,45 0,21115 0,01677 7,29E-03 1,08E-02 3,99E-03 4,01E-07
450 0,25 0,25 0,50 0,20984 0,01676 8,01E-03 1,12E-02 4,15E-03 4,01E-07
451 0,25 0,30 0,05 0,22616 0,01615 5,32E-04 5,22E-03 1,93E-03 3,86E-07
452 0,25 0,30 0,10 0,22502 0,01614 1,16E-03 5,61E-03 2,07E-03 3,86E-07
453 0,25 0,30 0,15 0,22389 0,01613 1,77E-03 5,99E-03 2,21E-03 3,86E-07
454 0,25 0,30 0,20 0,22279 0,01612 2,37E-03 6,37E-03 2,35E-03 3,86E-07
455 0,25 0,30 0,25 0,22171 0,01611 2,96E-03 6,73E-03 2,48E-03 3,85E-07
456 0,25 0,30 0,30 0,22065 0,0161 3,54E-03 7,09E-03 2,62E-03 3,85E-07
457 0,25 0,30 0,35 0,2196 0,01609 4,11E-03 7,45E-03 2,75E-03 3,85E-07
458 0,25 0,30 0,40 0,21858 0,01608 4,67E-03 7,80E-03 2,88E-03 3,85E-07
459 0,25 0,30 0,45 0,21757 0,01607 5,22E-03 8,14E-03 3,00E-03 3,85E-07
460 0,25 0,30 0,50 0,21659 0,01606 5,75E-03 8,47E-03 3,13E-03 3,84E-07
461 0,25 0,35 0,05 0,22842 0,01549 3,93E-04 4,16E-03 1,53E-03 3,71E-07
462 0,25 0,35 0,10 0,22757 0,01548 8,54E-04 4,45E-03 1,64E-03 3,70E-07
463 0,25 0,35 0,15 0,22673 0,01547 1,31E-03 4,74E-03 1,75E-03 3,70E-07
464 0,25 0,35 0,20 0,2259 0,01547 1,76E-03 5,02E-03 1,85E-03 3,70E-07
465 0,25 0,35 0,25 0,22508 0,01546 2,20E-03 5,31E-03 1,96E-03 3,70E-07
466 0,25 0,35 0,30 0,22428 0,01545 2,63E-03 5,58E-03 2,06E-03 3,70E-07
467 0,25 0,35 0,35 0,22348 0,01544 3,06E-03 5,86E-03 2,16E-03 3,69E-07
468 0,25 0,35 0,40 0,2227 0,01543 3,48E-03 6,13E-03 2,26E-03 3,69E-07
469 0,25 0,35 0,45 0,22192 0,01543 3,90E-03 6,39E-03 2,36E-03 3,69E-07
470 0,25 0,35 0,50 0,22116 0,01542 4,31E-03 6,66E-03 2,46E-03 3,69E-07
471 0,25 0,40 0,05 0,23012 0,01488 3,03E-04 3,43E-03 1,26E-03 3,56E-07
472 0,25 0,40 0,10 0,22946 0,01487 6,56E-04 3,66E-03 1,35E-03 3,56E-07
473 0,25 0,40 0,15 0,22881 0,01487 1,01E-03 3,88E-03 1,43E-03 3,56E-07
474 0,25 0,40 0,20 0,22817 0,01486 1,35E-03 4,11E-03 1,51E-03 3,56E-07
475 0,25 0,40 0,25 0,22753 0,01485 1,69E-03 4,33E-03 1,60E-03 3,55E-07
476 0,25 0,40 0,30 0,2269 0,01485 2,03E-03 4,55E-03 1,68E-03 3,55E-07
477 0,25 0,40 0,35 0,22627 0,01484 2,37E-03 4,76E-03 1,76E-03 3,55E-07
478 0,25 0,40 0,40 0,22566 0,01483 2,70E-03 4,98E-03 1,84E-03 3,55E-07
479 0,25 0,40 0,45 0,22504 0,01483 3,02E-03 5,19E-03 1,91E-03 3,55E-07
480 0,25 0,40 0,50 0,22444 0,01482 3,35E-03 5,40E-03 1,99E-03 3,55E-07
481 0,25 0,45 0,05 0,23147 0,01432 2,41E-04 2,90E-03 1,07E-03 3,43E-07
482 0,25 0,45 0,10 0,23094 0,01431 5,20E-04 3,09E-03 1,14E-03 3,42E-07
483 0,25 0,45 0,15 0,23042 0,01431 7,97E-04 3,27E-03 1,21E-03 3,42E-07
484 0,25 0,45 0,20 0,22991 0,0143 1,07E-03 3,45E-03 1,27E-03 3,42E-07
485 0,25 0,45 0,25 0,2294 0,01429 1,34E-03 3,63E-03 1,34E-03 3,42E-07
486 0,25 0,45 0,30 0,22889 0,01429 1,61E-03 3,80E-03 1,40E-03 3,42E-07
487 0,25 0,45 0,35 0,22839 0,01428 1,88E-03 3,98E-03 1,47E-03 3,42E-07

LXXVI Parameter der Sensitivitätsanalyse
488 0,25 0,45 0,40 0,22789 0,01428 2,15E-03 4,15E-03 1,53E-03 3,42E-07
489 0,25 0,45 0,45 0,2274 0,01427 2,41E-03 4,32E-03 1,59E-03 3,41E-07
490 0,25 0,45 0,50 0,22691 0,01427 2,67E-03 4,49E-03 1,66E-03 3,41E-07
491 0,25 0,50 0,05 0,23257 1,38E-02 1,96E-04 2,51E-03 9,26E-04 3,30E-07
492 0,25 0,50 0,10 0,23215 1,38E-02 4,22E-04 2,66E-03 9,81E-04 3,30E-07
493 0,25 0,50 0,15 0,23172 0,01379 6,47E-04 2,81E-03 1,04E-03 3,30E-07
494 0,25 0,50 0,20 0,2313 0,01378 8,71E-04 2,96E-03 1,09E-03 3,30E-07
495 0,25 0,50 0,25 0,23089 0,01378 1,09E-03 3,10E-03 1,14E-03 3,30E-07
496 0,25 0,50 0,30 0,23047 0,01377 1,31E-03 3,25E-03 1,20E-03 3,30E-07
497 0,25 0,50 0,35 0,23006 0,01377 1,53E-03 3,39E-03 1,25E-03 3,29E-07
498 0,25 0,50 0,40 0,22965 0,01376 1,75E-03 3,53E-03 1,30E-03 3,29E-07
499 0,25 0,50 0,45 0,22924 0,01376 1,96E-03 3,68E-03 1,36E-03 3,29E-07
500 0,25 0,50 0,50 0,22884 0,01375 2,18E-03 3,82E-03 1,41E-03 3,29E-07
501 0,30 0,05 0,05 0,09859 0,02051 1,45E-02 1,22E-01 4,49E-02 4,91E-07
502 0,30 0,05 0,10 0,10046 0,02052 2,82E-02 1,10E-01 4,07E-02 4,91E-07
503 0,30 0,05 0,15 0,10202 0,02053 3,79E-02 1,02E-01 3,76E-02 4,91E-07
504 0,30 0,05 0,20 0,10331 0,02053 4,50E-02 9,59E-02 3,54E-02 4,91E-07
505 0,30 0,05 0,25 0,10438 0,02054 5,03E-02 9,12E-02 3,36E-02 4,91E-07
506 0,30 0,05 0,30 0,10527 0,02054 5,44E-02 8,75E-02 3,23E-02 4,92E-07
507 0,30 0,05 0,35 0,10601 0,02055 5,77E-02 8,46E-02 3,12E-02 4,92E-07
508 0,30 0,05 0,40 0,10663 0,02055 6,04E-02 8,22E-02 3,03E-02 4,92E-07
509 0,30 0,05 0,45 0,10716 0,02055 6,26E-02 8,02E-02 2,96E-02 4,92E-07
510 0,30 0,05 0,50 0,10763 0,02055 6,44E-02 7,85E-02 2,90E-02 4,92E-07
511 0,30 0,10 0,05 0,21847 0,01978 5,12E-03 4,14E-02 1,53E-02 4,73E-07
512 0,30 0,10 0,10 0,21191 0,01976 1,07E-02 4,21E-02 1,55E-02 4,73E-07
513 0,30 0,10 0,15 0,20622 0,01974 1,55E-02 4,28E-02 1,58E-02 4,72E-07
514 0,30 0,10 0,20 0,20122 0,01971 1,96E-02 4,34E-02 1,60E-02 4,72E-07
515 0,30 0,10 0,25 0,1968 0,0197 2,33E-02 4,40E-02 1,62E-02 4,71E-07
516 0,30 0,10 0,30 0,19284 0,01968 2,65E-02 4,46E-02 1,64E-02 4,71E-07
517 0,30 0,10 0,35 0,18927 0,01966 2,93E-02 4,51E-02 1,66E-02 4,70E-07
518 0,30 0,10 0,40 0,18605 0,01965 3,19E-02 4,56E-02 1,68E-02 4,70E-07
519 0,30 0,10 0,45 0,18311 0,01963 3,43E-02 4,60E-02 1,70E-02 4,70E-07
520 0,30 0,10 0,50 0,18043 0,01962 3,64E-02 4,64E-02 1,71E-02 4,69E-07
521 0,30 0,15 0,05 0,24992 0,01899 2,43E-03 2,09E-02 7,72E-03 4,54E-07
522 0,30 0,15 0,10 0,24556 0,01897 5,24E-03 2,21E-02 8,15E-03 4,54E-07
523 0,30 0,15 0,15 0,24154 0,01895 7,83E-03 2,31E-02 8,54E-03 4,53E-07
524 0,30 0,15 0,20 0,2378 0,01893 1,02E-02 2,41E-02 8,90E-03 4,53E-07
525 0,30 0,15 0,25 0,23432 0,01892 1,25E-02 2,51E-02 9,25E-03 4,53E-07
526 0,30 0,15 0,30 0,23106 0,0189 1,45E-02 2,59E-02 9,57E-03 4,52E-07
527 0,30 0,15 0,35 0,22801 0,01888 1,65E-02 2,68E-02 9,87E-03 4,52E-07
528 0,30 0,15 0,40 0,22514 0,01887 1,83E-02 2,75E-02 1,02E-02 4,51E-07
529 0,30 0,15 0,45 0,22244 0,01885 2,00E-02 2,83E-02 1,04E-02 4,51E-07
530 0,30 0,15 0,50 0,21989 0,01884 2,16E-02 2,90E-02 1,07E-02 4,51E-07
531 0,30 0,20 0,05 0,26256 0,01824 1,40E-03 1,30E-02 4,80E-03 4,36E-07
532 0,30 0,20 0,10 0,25976 0,01823 3,05E-03 1,39E-02 5,11E-03 4,36E-07

Parameter der Sensitivitätsanalyse LXXVII
533 0,30 0,20 0,15 0,2571 0,01821 4,62E-03 1,47E-02 5,41E-03 4,36E-07
534 0,30 0,20 0,20 0,25455 0,0182 6,11E-03 1,54E-02 5,70E-03 4,35E-07
535 0,30 0,20 0,25 0,25212 0,01818 7,54E-03 1,62E-02 5,97E-03 4,35E-07
536 0,30 0,20 0,30 0,24979 0,01817 8,91E-03 1,69E-02 6,23E-03 4,35E-07
537 0,30 0,20 0,35 0,24755 0,01815 1,02E-02 1,76E-02 6,49E-03 4,34E-07
538 0,30 0,20 0,40 0,2454 0,01814 1,15E-02 1,82E-02 6,73E-03 4,34E-07
539 0,30 0,20 0,45 0,24334 0,01813 1,27E-02 1,89E-02 6,96E-03 4,34E-07
540 0,30 0,20 0,50 0,24135 0,01812 1,39E-02 1,95E-02 7,19E-03 4,33E-07
541 0,30 0,25 0,05 0,26912 0,01754 9,06E-04 9,08E-03 3,35E-03 4,20E-07
542 0,30 0,25 0,10 0,26722 0,01753 1,98E-03 9,69E-03 3,58E-03 4,19E-07
543 0,30 0,25 0,15 0,26539 0,01752 3,02E-03 1,03E-02 3,79E-03 4,19E-07
544 0,30 0,25 0,20 0,2636 0,01751 4,02E-03 1,09E-02 4,01E-03 4,19E-07
545 0,30 0,25 0,25 0,26187 0,01749 5,00E-03 1,14E-02 4,21E-03 4,19E-07
546 0,30 0,25 0,30 0,26019 0,01748 5,95E-03 1,20E-02 4,41E-03 4,18E-07
547 0,30 0,25 0,35 0,25856 0,01747 6,87E-03 1,25E-02 4,61E-03 4,18E-07
548 0,30 0,25 0,40 0,25698 0,01746 7,76E-03 1,30E-02 4,80E-03 4,18E-07
549 0,30 0,25 0,45 0,25543 0,01745 8,63E-03 1,35E-02 4,98E-03 4,18E-07
550 0,30 0,25 0,50 0,25393 0,01744 9,48E-03 1,40E-02 5,16E-03 4,17E-07
551 0,30 0,30 0,05 0,27313 0,01689 6,34E-04 6,83E-03 2,52E-03 4,04E-07
552 0,30 0,30 0,10 0,27177 0,01688 1,39E-03 7,28E-03 2,69E-03 4,04E-07
553 0,30 0,30 0,15 0,27044 0,01687 2,12E-03 7,72E-03 2,85E-03 4,04E-07
554 0,30 0,30 0,20 0,26914 0,01686 2,84E-03 8,15E-03 3,01E-03 4,03E-07
555 0,30 0,30 0,25 0,26786 0,01685 3,54E-03 8,58E-03 3,16E-03 4,03E-07
556 0,30 0,30 0,30 0,26662 0,01685 4,23E-03 8,99E-03 3,32E-03 4,03E-07
557 0,30 0,30 0,35 0,2654 0,01684 4,90E-03 9,40E-03 3,47E-03 4,03E-07
558 0,30 0,30 0,40 0,2642 0,01683 5,56E-03 9,80E-03 3,61E-03 4,03E-07
559 0,30 0,30 0,45 0,26303 0,01682 6,21E-03 1,02E-02 3,76E-03 4,02E-07
560 0,30 0,30 0,50 0,26188 0,01681 6,84E-03 1,06E-02 3,90E-03 4,02E-07
561 0,30 0,35 0,05 0,27585 0,01629 4,69E-04 5,40E-03 1,99E-03 3,90E-07
562 0,30 0,35 0,10 0,27483 0,01628 1,02E-03 5,74E-03 2,12E-03 3,89E-07
563 0,30 0,35 0,15 0,27383 0,01627 1,57E-03 6,08E-03 2,24E-03 3,89E-07
564 0,30 0,35 0,20 0,27285 0,01626 2,10E-03 6,42E-03 2,37E-03 3,89E-07
565 0,30 0,35 0,25 0,27188 0,01626 2,63E-03 6,74E-03 2,49E-03 3,89E-07
566 0,30 0,35 0,30 0,27093 0,01625 3,15E-03 7,07E-03 2,61E-03 3,89E-07
567 0,30 0,35 0,35 0,26999 0,01624 3,66E-03 7,38E-03 2,72E-03 3,89E-07
568 0,30 0,35 0,40 0,26907 0,01623 4,16E-03 7,70E-03 2,84E-03 3,88E-07
569 0,30 0,35 0,45 0,26816 0,01623 4,66E-03 8,01E-03 2,95E-03 3,88E-07
570 0,30 0,35 0,50 0,26726 0,01622 5,14E-03 8,31E-03 3,07E-03 3,88E-07
571 0,30 0,40 0,05 0,27785 0,01572 3,61E-04 4,43E-03 1,63E-03 3,76E-07
572 0,30 0,40 0,10 0,27706 0,01572 7,86E-04 4,70E-03 1,73E-03 3,76E-07
573 0,30 0,40 0,15 0,27629 0,01571 1,21E-03 4,97E-03 1,83E-03 3,76E-07
574 0,30 0,40 0,20 0,27552 0,0157 1,62E-03 5,23E-03 1,93E-03 3,76E-07
575 0,30 0,40 0,25 0,27476 0,0157 2,03E-03 5,49E-03 2,02E-03 3,76E-07
576 0,30 0,40 0,30 0,27401 0,01569 2,43E-03 5,75E-03 2,12E-03 3,75E-07
577 0,30 0,40 0,35 0,27327 0,01569 2,83E-03 6,00E-03 2,21E-03 3,75E-07

LXXVIII Parameter der Sensitivitätsanalyse
578 0,30 0,40 0,40 0,27254 0,01568 3,23E-03 6,25E-03 2,31E-03 3,75E-07
579 0,30 0,40 0,45 0,27182 0,01567 3,62E-03 6,50E-03 2,40E-03 3,75E-07
580 0,30 0,40 0,50 0,2711 0,01567 4,00E-03 6,74E-03 2,49E-03 3,75E-07
581 0,30 0,45 0,05 0,27941 0,0152 2,87E-04 3,73E-03 1,38E-03 3,64E-07
582 0,30 0,45 0,10 0,27878 0,01519 6,23E-04 3,95E-03 1,46E-03 3,64E-07
583 0,30 0,45 0,15 0,27816 0,01519 9,56E-04 4,16E-03 1,54E-03 3,63E-07
584 0,30 0,45 0,20 0,27754 0,01518 1,29E-03 4,38E-03 1,61E-03 3,63E-07
585 0,30 0,45 0,25 0,27693 0,01518 1,61E-03 4,59E-03 1,69E-03 3,63E-07
586 0,30 0,45 0,30 0,27633 0,01517 1,93E-03 4,80E-03 1,77E-03 3,63E-07
587 0,30 0,45 0,35 0,27573 0,01517 2,25E-03 5,00E-03 1,85E-03 3,63E-07
588 0,30 0,45 0,40 0,27514 0,01516 2,57E-03 5,21E-03 1,92E-03 3,63E-07
589 0,30 0,45 0,45 0,27456 0,01516 2,88E-03 5,41E-03 2,00E-03 3,63E-07
590 0,30 0,45 0,50 0,27398 0,01515 3,20E-03 5,61E-03 2,07E-03 3,63E-07
591 0,30 0,50 0,05 0,28066 0,01471 2,33E-04 3,21E-03 1,19E-03 3,52E-07
592 0,30 0,50 0,10 0,28015 0,0147 5,06E-04 3,39E-03 1,25E-03 3,52E-07
593 0,30 0,50 0,15 0,27964 0,0147 7,76E-04 3,57E-03 1,32E-03 3,52E-07
594 0,30 0,50 0,20 0,27914 0,01469 1,04E-03 3,74E-03 1,38E-03 3,52E-07
595 0,30 0,50 0,25 0,27864 0,01469 1,31E-03 3,92E-03 1,44E-03 3,51E-07
596 0,30 0,50 0,30 0,27815 0,01468 1,57E-03 4,09E-03 1,51E-03 3,51E-07
597 0,30 0,50 0,35 0,27766 0,01468 1,84E-03 4,26E-03 1,57E-03 3,51E-07
598 0,30 0,50 0,40 0,27717 0,01468 2,10E-03 4,43E-03 1,63E-03 3,51E-07
599 0,30 0,50 0,45 0,27669 0,01467 2,35E-03 4,59E-03 1,70E-03 3,51E-07
600 0,30 0,50 0,50 0,27621 0,01467 2,61E-03 4,76E-03 1,76E-03 3,51E-07
601 0,35 0,05 0,05 0,10415 0,02064 1,57E-02 1,53E-01 5,65E-02 4,94E-07
602 0,35 0,05 0,10 0,11209 0,02067 3,05E-02 1,36E-01 5,03E-02 4,95E-07
603 0,35 0,05 0,15 0,1189 0,0207 4,09E-02 1,24E-01 4,57E-02 4,95E-07
604 0,35 0,05 0,20 0,12451 0,02071 4,83E-02 1,14E-01 4,22E-02 4,96E-07
605 0,35 0,05 0,25 0,12905 0,02073 5,38E-02 1,07E-01 3,95E-02 4,96E-07
606 0,35 0,05 0,30 0,13276 0,02074 5,79E-02 1,01E-01 3,74E-02 4,96E-07
607 0,35 0,05 0,35 0,13581 0,02074 6,11E-02 9,67E-02 3,57E-02 4,96E-07
608 0,35 0,05 0,40 0,13833 0,02075 6,36E-02 9,30E-02 3,43E-02 4,96E-07
609 0,35 0,05 0,45 0,14045 0,02076 6,57E-02 9,00E-02 3,32E-02 4,97E-07
610 0,35 0,05 0,50 0,14226 0,02076 6,74E-02 8,74E-02 3,22E-02 4,97E-07
611 0,35 0,10 0,05 0,25133 0,02003 5,81E-03 5,32E-02 1,96E-02 4,79E-07
612 0,35 0,10 0,10 0,24515 0,02001 1,21E-02 5,31E-02 1,96E-02 4,79E-07
613 0,35 0,10 0,15 0,23983 0,02 1,74E-02 5,32E-02 1,96E-02 4,78E-07
614 0,35 0,10 0,20 0,2352 0,01998 2,20E-02 5,32E-02 1,96E-02 4,78E-07
615 0,35 0,10 0,25 0,23113 0,01997 2,59E-02 5,33E-02 1,97E-02 4,78E-07
616 0,35 0,10 0,30 0,22753 0,01996 2,94E-02 5,34E-02 1,97E-02 4,78E-07
617 0,35 0,10 0,35 0,22431 0,01995 3,25E-02 5,35E-02 1,98E-02 4,77E-07
618 0,35 0,10 0,40 0,22141 0,01994 3,52E-02 5,37E-02 1,98E-02 4,77E-07
619 0,35 0,10 0,45 0,2188 0,01993 3,76E-02 5,38E-02 1,98E-02 4,77E-07
620 0,35 0,10 0,50 0,2164 0,01992 3,99E-02 5,39E-02 1,99E-02 4,77E-07
621 0,35 0,15 0,05 0,29107 0,01934 2,80E-03 2,69E-02 9,92E-03 4,63E-07
622 0,35 0,15 0,10 0,28638 0,01932 6,02E-03 2,80E-02 1,03E-02 4,62E-07

Parameter der Sensitivitätsanalyse LXXIX
623 0,35 0,15 0,15 0,28208 0,01931 8,97E-03 2,90E-02 1,07E-02 4,62E-07
624 0,35 0,15 0,20 0,27812 0,01929 1,17E-02 2,99E-02 1,10E-02 4,62E-07
625 0,35 0,15 0,25 0,27445 0,01928 1,42E-02 3,08E-02 1,13E-02 4,61E-07
626 0,35 0,15 0,30 0,27104 0,01927 1,65E-02 3,16E-02 1,16E-02 4,61E-07
627 0,35 0,15 0,35 0,26786 0,01925 1,86E-02 3,23E-02 1,19E-02 4,61E-07
628 0,35 0,15 0,40 0,26489 0,01924 2,06E-02 3,30E-02 1,22E-02 4,60E-07
629 0,35 0,15 0,45 0,2621 0,01923 2,25E-02 3,37E-02 1,24E-02 4,60E-07
630 0,35 0,15 0,50 0,25948 0,01922 2,43E-02 3,44E-02 1,27E-02 4,60E-07
631 0,35 0,20 0,05 0,30698 0,01868 1,62E-03 1,66E-02 6,12E-03 4,47E-07
632 0,35 0,20 0,10 0,30386 0,01866 3,53E-03 1,75E-02 6,46E-03 4,46E-07
633 0,35 0,20 0,15 0,30089 0,01865 5,33E-03 1,84E-02 6,77E-03 4,46E-07
634 0,35 0,20 0,20 0,29807 0,01864 7,05E-03 1,92E-02 7,07E-03 4,46E-07
635 0,35 0,20 0,25 0,29539 0,01862 8,68E-03 2,00E-02 7,36E-03 4,46E-07
636 0,35 0,20 0,30 0,29283 0,01861 1,02E-02 2,07E-02 7,63E-03 4,45E-07
637 0,35 0,20 0,35 0,29039 0,0186 1,17E-02 2,14E-02 7,89E-03 4,45E-07
638 0,35 0,20 0,40 0,28805 0,01859 1,31E-02 2,21E-02 8,15E-03 4,45E-07
639 0,35 0,20 0,45 0,28582 0,01858 1,45E-02 2,27E-02 8,39E-03 4,45E-07
640 0,35 0,20 0,50 0,28367 0,01857 1,58E-02 2,34E-02 8,62E-03 4,44E-07
641 0,35 0,25 0,05 0,31513 0,01805 1,05E-03 1,15E-02 4,25E-03 4,32E-07
642 0,35 0,25 0,10 0,31297 0,01804 2,30E-03 1,22E-02 4,50E-03 4,32E-07
643 0,35 0,25 0,15 0,31089 0,01803 3,50E-03 1,29E-02 4,74E-03 4,31E-07
644 0,35 0,25 0,20 0,30888 0,01802 4,66E-03 1,35E-02 4,97E-03 4,31E-07
645 0,35 0,25 0,25 0,30693 0,01801 5,79E-03 1,41E-02 5,20E-03 4,31E-07
646 0,35 0,25 0,30 0,30504 0,018 6,87E-03 1,47E-02 5,41E-03 4,31E-07
647 0,35 0,25 0,35 0,30322 0,01799 7,92E-03 1,53E-02 5,62E-03 4,30E-07
648 0,35 0,25 0,40 0,30145 0,01798 8,94E-03 1,58E-02 5,83E-03 4,30E-07
649 0,35 0,25 0,45 0,29974 0,01797 9,93E-03 1,63E-02 6,03E-03 4,30E-07
650 0,35 0,25 0,50 0,29807 0,01796 1,09E-02 1,69E-02 6,22E-03 4,30E-07
651 0,35 0,30 0,05 0,32002 0,01746 7,35E-04 8,61E-03 3,18E-03 4,18E-07
652 0,35 0,30 0,10 0,31846 0,01745 1,61E-03 9,12E-03 3,36E-03 4,17E-07
653 0,35 0,30 0,15 0,31693 0,01744 2,46E-03 9,62E-03 3,55E-03 4,17E-07
654 0,35 0,30 0,20 0,31545 0,01743 3,30E-03 1,01E-02 3,73E-03 4,17E-07
655 0,35 0,30 0,25 0,314 0,01742 4,11E-03 1,06E-02 3,90E-03 4,17E-07
656 0,35 0,30 0,30 0,31258 0,01742 4,90E-03 1,10E-02 4,07E-03 4,17E-07
657 0,35 0,30 0,35 0,3112 0,01741 5,68E-03 1,15E-02 4,24E-03 4,16E-07
658 0,35 0,30 0,40 0,30985 0,0174 6,43E-03 1,19E-02 4,40E-03 4,16E-07
659 0,35 0,30 0,45 0,30853 0,01739 7,17E-03 1,24E-02 4,56E-03 4,16E-07
660 0,35 0,30 0,50 0,30724 0,01738 7,89E-03 1,28E-02 4,71E-03 4,16E-07
661 0,35 0,35 0,05 0,32328 0,0169 5,44E-04 6,78E-03 2,50E-03 4,04E-07
662 0,35 0,35 0,10 0,3221 0,0169 1,19E-03 7,17E-03 2,64E-03 4,04E-07
663 0,35 0,35 0,15 0,32095 0,01689 1,82E-03 7,55E-03 2,79E-03 4,04E-07
664 0,35 0,35 0,20 0,31982 0,01688 2,45E-03 7,93E-03 2,92E-03 4,04E-07
665 0,35 0,35 0,25 0,31871 0,01687 3,06E-03 8,30E-03 3,06E-03 4,04E-07
666 0,35 0,35 0,30 0,31762 0,01687 3,66E-03 8,66E-03 3,20E-03 4,04E-07
667 0,35 0,35 0,35 0,31654 0,01686 4,25E-03 9,02E-03 3,33E-03 4,03E-07

LXXX Parameter der Sensitivitätsanalyse
668 0,35 0,35 0,40 0,31549 0,01686 4,83E-03 9,37E-03 3,46E-03 4,03E-07
669 0,35 0,35 0,45 0,31445 0,01685 5,40E-03 9,72E-03 3,58E-03 4,03E-07
670 0,35 0,35 0,50 0,31344 0,01684 5,96E-03 1,01E-02 3,71E-03 4,03E-07
671 0,35 0,40 0,05 0,32563 0,01638 4,19E-04 5,53E-03 2,04E-03 3,92E-07
672 0,35 0,40 0,10 0,32471 0,01638 9,15E-04 5,84E-03 2,15E-03 3,92E-07
673 0,35 0,40 0,15 0,32381 0,01637 1,40E-03 6,15E-03 2,27E-03 3,92E-07
674 0,35 0,40 0,20 0,32293 0,01636 1,89E-03 6,44E-03 2,38E-03 3,92E-07
675 0,35 0,40 0,25 0,32205 0,01636 2,36E-03 6,74E-03 2,49E-03 3,91E-07
676 0,35 0,40 0,30 0,32119 0,01635 2,83E-03 7,03E-03 2,59E-03 3,91E-07
677 0,35 0,40 0,35 0,32034 0,01635 3,29E-03 7,32E-03 2,70E-03 3,91E-07
678 0,35 0,40 0,40 0,3195 0,01634 3,75E-03 7,60E-03 2,80E-03 3,91E-07
679 0,35 0,40 0,45 0,31867 0,01634 4,20E-03 7,88E-03 2,91E-03 3,91E-07
680 0,35 0,40 0,50 0,31786 0,01633 4,64E-03 8,16E-03 3,01E-03 3,91E-07
681 0,35 0,45 0,05 0,32742 0,01589 3,32E-04 4,64E-03 1,71E-03 3,80E-07
682 0,35 0,45 0,10 0,32669 0,01589 7,25E-04 4,89E-03 1,80E-03 3,80E-07
683 0,35 0,45 0,15 0,32597 0,01588 1,11E-03 5,14E-03 1,90E-03 3,80E-07
684 0,35 0,45 0,20 0,32526 0,01588 1,50E-03 5,38E-03 1,99E-03 3,80E-07
685 0,35 0,45 0,25 0,32455 0,01587 1,88E-03 5,62E-03 2,07E-03 3,80E-07
686 0,35 0,45 0,30 0,32386 0,01587 2,25E-03 5,86E-03 2,16E-03 3,80E-07
687 0,35 0,45 0,35 0,32317 0,01586 2,62E-03 6,10E-03 2,25E-03 3,80E-07
688 0,35 0,45 0,40 0,32249 0,01586 2,99E-03 6,33E-03 2,33E-03 3,79E-07
689 0,35 0,45 0,45 0,32181 0,01585 3,35E-03 6,56E-03 2,42E-03 3,79E-07
690 0,35 0,45 0,50 0,32115 0,01585 3,71E-03 6,79E-03 2,50E-03 3,79E-07
691 0,35 0,50 0,05 0,32885 0,01543 2,71E-04 3,98E-03 1,47E-03 3,69E-07
692 0,35 0,50 0,10 0,32825 0,01543 5,89E-04 4,19E-03 1,54E-03 3,69E-07
693 0,35 0,50 0,15 0,32766 0,01542 9,05E-04 4,39E-03 1,62E-03 3,69E-07
694 0,35 0,50 0,20 0,32708 0,01542 1,22E-03 4,59E-03 1,69E-03 3,69E-07
695 0,35 0,50 0,25 0,3265 0,01542 1,53E-03 4,79E-03 1,77E-03 3,69E-07
696 0,35 0,50 0,30 0,32593 0,01541 1,83E-03 4,99E-03 1,84E-03 3,69E-07
697 0,35 0,50 0,35 0,32536 0,01541 2,14E-03 5,18E-03 1,91E-03 3,69E-07
698 0,35 0,50 0,40 0,3248 0,0154 2,44E-03 5,38E-03 1,98E-03 3,69E-07
699 0,35 0,50 0,45 0,32424 0,0154 2,74E-03 5,57E-03 2,05E-03 3,68E-07
700 0,35 0,50 0,50 0,32369 0,01539 3,03E-03 5,76E-03 2,12E-03 3,68E-07
701 0,40 0,05 0,05 0,10741 0,02073 1,67E-02 1,86E-01 6,88E-02 4,96E-07
702 0,40 0,05 0,10 0,12216 0,02079 3,26E-02 1,64E-01 6,05E-02 4,97E-07
703 0,40 0,05 0,15 0,13519 0,02082 4,36E-02 1,46E-01 5,40E-02 4,98E-07
704 0,40 0,05 0,20 0,14591 0,02085 5,12E-02 1,33E-01 4,91E-02 4,99E-07
705 0,40 0,05 0,25 0,15451 0,02086 5,66E-02 1,23E-01 4,53E-02 4,99E-07
706 0,40 0,05 0,30 0,16137 0,02088 6,07E-02 1,15E-01 4,23E-02 5,00E-07
707 0,40 0,05 0,35 0,16693 0,02089 6,37E-02 1,08E-01 4,00E-02 5,00E-07
708 0,40 0,05 0,40 0,17147 0,0209 6,61E-02 1,03E-01 3,81E-02 5,00E-07
709 0,40 0,05 0,45 0,17524 0,0209 6,80E-02 9,92E-02 3,66E-02 5,00E-07
710 0,40 0,05 0,50 0,17841 0,02091 6,96E-02 9,58E-02 3,53E-02 5,00E-07
711 0,40 0,10 0,05 0,28266 0,02022 6,47E-03 6,62E-02 2,44E-02 4,84E-07
712 0,40 0,10 0,10 0,27729 0,02021 1,34E-02 6,51E-02 2,40E-02 4,83E-07

Parameter der Sensitivitätsanalyse LXXXI
713 0,40 0,10 0,15 0,2727 0,0202 1,92E-02 6,42E-02 2,37E-02 4,83E-07
714 0,40 0,10 0,20 0,26874 0,02019 2,41E-02 6,35E-02 2,34E-02 4,83E-07
715 0,40 0,10 0,25 0,26529 0,02018 2,84E-02 6,30E-02 2,32E-02 4,83E-07
716 0,40 0,10 0,30 0,26225 0,02017 3,20E-02 6,25E-02 2,31E-02 4,83E-07
717 0,40 0,10 0,35 0,25956 0,02016 3,52E-02 6,21E-02 2,29E-02 4,82E-07
718 0,40 0,10 0,40 0,25716 0,02016 3,81E-02 6,18E-02 2,28E-02 4,82E-07
719 0,40 0,10 0,45 0,255 0,02015 4,06E-02 6,15E-02 2,27E-02 4,82E-07
720 0,40 0,10 0,50 0,25305 0,02015 4,29E-02 6,13E-02 2,26E-02 4,82E-07
721 0,40 0,15 0,05 0,33143 0,01961 3,16E-03 3,35E-02 1,23E-02 4,69E-07
722 0,40 0,15 0,10 0,32656 0,01959 6,78E-03 3,44E-02 1,27E-02 4,69E-07
723 0,40 0,15 0,15 0,32212 0,01958 1,01E-02 3,52E-02 1,30E-02 4,68E-07
724 0,40 0,15 0,20 0,31805 0,01957 1,31E-02 3,60E-02 1,33E-02 4,68E-07
725 0,40 0,15 0,25 0,3143 0,01956 1,58E-02 3,68E-02 1,36E-02 4,68E-07
726 0,40 0,15 0,30 0,31084 0,01955 1,83E-02 3,75E-02 1,38E-02 4,68E-07
727 0,40 0,15 0,35 0,30764 0,01954 2,07E-02 3,81E-02 1,41E-02 4,67E-07
728 0,40 0,15 0,40 0,30465 0,01953 2,28E-02 3,87E-02 1,43E-02 4,67E-07
729 0,40 0,15 0,45 0,30187 0,01952 2,48E-02 3,93E-02 1,45E-02 4,67E-07
730 0,40 0,15 0,50 0,29927 0,01951 2,67E-02 3,98E-02 1,47E-02 4,67E-07
731 0,40 0,20 0,05 0,35098 0,01901 1,83E-03 2,06E-02 7,59E-03 4,55E-07
732 0,40 0,20 0,10 0,34758 0,019 4,00E-03 2,15E-02 7,93E-03 4,55E-07
733 0,40 0,20 0,15 0,34437 0,01899 6,03E-03 2,24E-02 8,25E-03 4,54E-07
734 0,40 0,20 0,20 0,34133 0,01898 7,96E-03 2,32E-02 8,55E-03 4,54E-07
735 0,40 0,20 0,25 0,33845 0,01897 9,78E-03 2,40E-02 8,84E-03 4,54E-07
736 0,40 0,20 0,30 0,33572 0,01896 1,15E-02 2,47E-02 9,11E-03 4,54E-07
737 0,40 0,20 0,35 0,33312 0,01895 1,31E-02 2,54E-02 9,38E-03 4,53E-07
738 0,40 0,20 0,40 0,33065 0,01894 1,47E-02 2,61E-02 9,63E-03 4,53E-07
739 0,40 0,20 0,45 0,32829 0,01893 1,62E-02 2,67E-02 9,86E-03 4,53E-07
740 0,40 0,20 0,50 0,32603 0,01892 1,76E-02 2,74E-02 1,01E-02 4,53E-07
741 0,40 0,25 0,05 0,36091 0,01844 1,19E-03 1,42E-02 5,24E-03 4,41E-07
742 0,40 0,25 0,10 0,35851 0,01843 2,61E-03 1,49E-02 5,51E-03 4,41E-07
743 0,40 0,25 0,15 0,35621 0,01842 3,98E-03 1,56E-02 5,77E-03 4,41E-07
744 0,40 0,25 0,20 0,35399 0,01841 5,29E-03 1,63E-02 6,01E-03 4,41E-07
745 0,40 0,25 0,25 0,35185 0,01841 6,55E-03 1,69E-02 6,25E-03 4,40E-07
746 0,40 0,25 0,30 0,34979 0,0184 7,77E-03 1,76E-02 6,48E-03 4,40E-07
747 0,40 0,25 0,35 0,3478 0,01839 8,95E-03 1,82E-02 6,70E-03 4,40E-07
748 0,40 0,25 0,40 0,34587 0,01838 1,01E-02 1,88E-02 6,92E-03 4,40E-07
749 0,40 0,25 0,45 0,34401 0,01837 1,12E-02 1,93E-02 7,12E-03 4,40E-07
750 0,40 0,25 0,50 0,34222 0,01837 1,22E-02 1,99E-02 7,32E-03 4,39E-07
751 0,40 0,30 0,05 0,36678 0,0179 8,35E-04 1,06E-02 3,90E-03 4,28E-07
752 0,40 0,30 0,10 0,36503 0,0179 1,83E-03 1,11E-02 4,11E-03 4,28E-07
753 0,40 0,30 0,15 0,36333 0,01789 2,80E-03 1,17E-02 4,31E-03 4,28E-07
754 0,40 0,30 0,20 0,36167 0,01788 3,75E-03 1,22E-02 4,50E-03 4,28E-07
755 0,40 0,30 0,25 0,36006 0,01787 4,67E-03 1,27E-02 4,69E-03 4,28E-07
756 0,40 0,30 0,30 0,35849 0,01787 5,56E-03 1,32E-02 4,87E-03 4,27E-07
757 0,40 0,30 0,35 0,35696 0,01786 6,43E-03 1,37E-02 5,05E-03 4,27E-07

LXXXII Parameter der Sensitivitätsanalyse
758 0,40 0,30 0,40 0,35547 0,01785 7,28E-03 1,42E-02 5,23E-03 4,27E-07
759 0,40 0,30 0,45 0,35401 0,01785 8,11E-03 1,46E-02 5,40E-03 4,27E-07
760 0,40 0,30 0,50 0,35259 0,01784 8,92E-03 1,51E-02 5,56E-03 4,27E-07
761 0,40 0,35 0,05 0,37065 0,01739 6,18E-04 8,29E-03 3,06E-03 4,16E-07
762 0,40 0,35 0,10 0,36932 0,01739 1,36E-03 8,72E-03 3,22E-03 4,16E-07
763 0,40 0,35 0,15 0,36802 0,01738 2,08E-03 9,14E-03 3,37E-03 4,16E-07
764 0,40 0,35 0,20 0,36675 0,01737 2,79E-03 9,56E-03 3,53E-03 4,16E-07
765 0,40 0,35 0,25 0,36551 0,01737 3,48E-03 9,97E-03 3,68E-03 4,16E-07
766 0,40 0,35 0,30 0,36429 0,01736 4,16E-03 1,04E-02 3,82E-03 4,15E-07
767 0,40 0,35 0,35 0,36309 0,01736 4,83E-03 1,08E-02 3,97E-03 4,15E-07
768 0,40 0,35 0,40 0,36191 0,01735 5,48E-03 1,11E-02 4,11E-03 4,15E-07
769 0,40 0,35 0,45 0,36076 0,01734 6,12E-03 1,15E-02 4,25E-03 4,15E-07
770 0,40 0,35 0,50 0,35963 0,01734 6,75E-03 1,19E-02 4,39E-03 4,15E-07
771 0,40 0,40 0,05 0,37339 0,01691 4,76E-04 6,74E-03 2,49E-03 4,05E-07
772 0,40 0,40 0,10 0,37236 0,01691 1,04E-03 7,08E-03 2,61E-03 4,04E-07
773 0,40 0,40 0,15 0,37134 0,0169 1,60E-03 7,42E-03 2,74E-03 4,04E-07
774 0,40 0,40 0,20 0,37034 0,01689 2,15E-03 7,75E-03 2,86E-03 4,04E-07
775 0,40 0,40 0,25 0,36935 0,01689 2,69E-03 8,08E-03 2,98E-03 4,04E-07
776 0,40 0,40 0,30 0,36838 0,01688 3,22E-03 8,41E-03 3,10E-03 4,04E-07
777 0,40 0,40 0,35 0,36743 0,01688 3,75E-03 8,73E-03 3,22E-03 4,04E-07
778 0,40 0,40 0,40 0,36649 0,01687 4,27E-03 9,04E-03 3,33E-03 4,04E-07
779 0,40 0,40 0,45 0,36556 0,01687 4,77E-03 9,35E-03 3,45E-03 4,04E-07
780 0,40 0,40 0,50 0,36465 0,01686 5,28E-03 9,65E-03 3,56E-03 4,03E-07
781 0,40 0,45 0,05 0,37545 0,01645 3,78E-04 5,64E-03 2,08E-03 3,94E-07
782 0,40 0,45 0,10 0,37463 0,01645 8,27E-04 5,91E-03 2,18E-03 3,94E-07
783 0,40 0,45 0,15 0,37381 0,01644 1,27E-03 6,19E-03 2,28E-03 3,93E-07
784 0,40 0,45 0,20 0,373 0,01644 1,71E-03 6,46E-03 2,38E-03 3,93E-07
785 0,40 0,45 0,25 0,37221 0,01644 2,14E-03 6,73E-03 2,48E-03 3,93E-07
786 0,40 0,45 0,30 0,37142 0,01643 2,57E-03 7,00E-03 2,58E-03 3,93E-07
787 0,40 0,45 0,35 0,37064 0,01643 2,99E-03 7,26E-03 2,68E-03 3,93E-07
788 0,40 0,45 0,40 0,36988 0,01642 3,41E-03 7,52E-03 2,77E-03 3,93E-07
789 0,40 0,45 0,45 0,36912 0,01642 3,82E-03 7,78E-03 2,87E-03 3,93E-07
790 0,40 0,45 0,50 0,36837 0,01641 4,23E-03 8,03E-03 2,96E-03 3,93E-07
791 0,40 0,50 0,05 0,37708 0,01602 3,07E-04 4,82E-03 1,78E-03 3,83E-07
792 0,40 0,50 0,10 0,3764 0,01602 6,72E-04 5,05E-03 1,86E-03 3,83E-07
793 0,40 0,50 0,15 0,37573 0,01601 1,03E-03 5,28E-03 1,95E-03 3,83E-07
794 0,40 0,50 0,20 0,37507 0,01601 1,39E-03 5,50E-03 2,03E-03 3,83E-07
795 0,40 0,50 0,25 0,37441 0,01601 1,74E-03 5,73E-03 2,11E-03 3,83E-07
796 0,40 0,50 0,30 0,37377 0,016 2,09E-03 5,95E-03 2,19E-03 3,83E-07
797 0,40 0,50 0,35 0,37312 0,016 2,44E-03 6,17E-03 2,27E-03 3,83E-07
798 0,40 0,50 0,40 0,37249 0,01599 2,78E-03 6,38E-03 2,35E-03 3,83E-07
799 0,40 0,50 0,45 0,37186 0,01599 3,12E-03 6,60E-03 2,43E-03 3,83E-07
800 0,40 0,50 0,50 0,37123 0,01599 3,46E-03 6,81E-03 2,51E-03 3,83E-07
801 0,45 0,05 0,05 0,10886 0,0208 1,76E-02 2,21E-01 8,16E-02 4,98E-07
802 0,45 0,05 0,10 0,13083 0,02087 3,44E-02 1,93E-01 7,11E-02 4,99E-07

Parameter der Sensitivitätsanalyse LXXXIII
803 0,45 0,05 0,15 0,1509 0,02092 4,59E-02 1,70E-01 6,26E-02 5,01E-07
804 0,45 0,05 0,20 0,16744 0,02095 5,36E-02 1,52E-01 5,61E-02 5,01E-07
805 0,45 0,05 0,25 0,18052 0,02097 5,90E-02 1,38E-01 5,11E-02 5,02E-07
806 0,45 0,05 0,30 0,19081 0,02099 6,29E-02 1,28E-01 4,72E-02 5,02E-07
807 0,45 0,05 0,35 0,19902 0,021 6,59E-02 1,20E-01 4,42E-02 5,02E-07
808 0,45 0,05 0,40 0,20564 0,021 6,81E-02 1,13E-01 4,18E-02 5,03E-07
809 0,45 0,05 0,45 0,21108 0,02101 6,99E-02 1,08E-01 3,99E-02 5,03E-07
810 0,45 0,05 0,50 0,21561 0,02102 7,13E-02 1,04E-01 3,83E-02 5,03E-07
811 0,45 0,10 0,05 0,3125 0,02037 7,10E-03 8,04E-02 2,97E-02 4,87E-07
812 0,45 0,10 0,10 0,30837 0,02036 1,47E-02 7,79E-02 2,87E-02 4,87E-07
813 0,45 0,10 0,15 0,30487 0,02035 2,09E-02 7,59E-02 2,80E-02 4,87E-07
814 0,45 0,10 0,20 0,30186 0,02035 2,61E-02 7,43E-02 2,74E-02 4,87E-07
815 0,45 0,10 0,25 0,29927 0,02034 3,06E-02 7,29E-02 2,69E-02 4,87E-07
816 0,45 0,10 0,30 0,29699 0,02034 3,44E-02 7,18E-02 2,65E-02 4,87E-07
817 0,45 0,10 0,35 0,29499 0,02033 3,77E-02 7,08E-02 2,61E-02 4,86E-07
818 0,45 0,10 0,40 0,29322 0,02033 4,07E-02 7,00E-02 2,58E-02 4,86E-07
819 0,45 0,10 0,45 0,29164 0,02033 4,32E-02 6,93E-02 2,56E-02 4,86E-07
820 0,45 0,10 0,50 0,29022 0,02032 4,55E-02 6,86E-02 2,53E-02 4,86E-07
821 0,45 0,15 0,05 0,37101 0,01982 3,50E-03 4,07E-02 1,50E-02 4,74E-07
822 0,45 0,15 0,10 0,36609 0,01981 7,51E-03 4,13E-02 1,53E-02 4,74E-07
823 0,45 0,15 0,15 0,36164 0,0198 1,11E-02 4,20E-02 1,55E-02 4,74E-07
824 0,45 0,15 0,20 0,35758 0,01979 1,44E-02 4,26E-02 1,57E-02 4,73E-07
825 0,45 0,15 0,25 0,35388 0,01978 1,74E-02 4,31E-02 1,59E-02 4,73E-07
826 0,45 0,15 0,30 0,35047 0,01977 2,01E-02 4,36E-02 1,61E-02 4,73E-07
827 0,45 0,15 0,35 0,34733 0,01976 2,26E-02 4,41E-02 1,63E-02 4,73E-07
828 0,45 0,15 0,40 0,34442 0,01976 2,49E-02 4,45E-02 1,64E-02 4,73E-07
829 0,45 0,15 0,45 0,34172 0,01975 2,70E-02 4,50E-02 1,66E-02 4,73E-07
830 0,45 0,15 0,50 0,33921 0,01974 2,90E-02 4,54E-02 1,67E-02 4,72E-07
831 0,45 0,20 0,05 0,39453 0,01928 2,04E-03 2,49E-02 9,20E-03 4,61E-07
832 0,45 0,20 0,10 0,39091 0,01927 4,46E-03 2,58E-02 9,53E-03 4,61E-07
833 0,45 0,20 0,15 0,38751 0,01926 6,71E-03 2,67E-02 9,84E-03 4,61E-07
834 0,45 0,20 0,20 0,38431 0,01925 8,84E-03 2,75E-02 1,01E-02 4,61E-07
835 0,45 0,20 0,25 0,38129 0,01924 1,08E-02 2,82E-02 1,04E-02 4,60E-07
836 0,45 0,20 0,30 0,37843 0,01923 1,27E-02 2,89E-02 1,07E-02 4,60E-07
837 0,45 0,20 0,35 0,37573 0,01923 1,45E-02 2,96E-02 1,09E-02 4,60E-07
838 0,45 0,20 0,40 0,37316 0,01922 1,62E-02 3,03E-02 1,12E-02 4,60E-07
839 0,45 0,20 0,45 0,37072 0,01921 1,78E-02 3,09E-02 1,14E-02 4,60E-07
840 0,45 0,20 0,50 0,3684 0,0192 1,93E-02 3,15E-02 1,16E-02 4,59E-07
841 0,45 0,25 0,05 0,40642 0,01876 1,33E-03 1,72E-02 6,33E-03 4,49E-07
842 0,45 0,25 0,10 0,40381 0,01875 2,92E-03 1,79E-02 6,61E-03 4,49E-07
843 0,45 0,25 0,15 0,40131 0,01874 4,44E-03 1,86E-02 6,87E-03 4,48E-07
844 0,45 0,25 0,20 0,39892 0,01874 5,90E-03 1,93E-02 7,13E-03 4,48E-07
845 0,45 0,25 0,25 0,39662 0,01873 7,30E-03 2,00E-02 7,37E-03 4,48E-07
846 0,45 0,25 0,30 0,3944 0,01872 8,65E-03 2,06E-02 7,61E-03 4,48E-07
847 0,45 0,25 0,35 0,39227 0,01871 9,94E-03 2,12E-02 7,84E-03 4,48E-07

LXXXIV Parameter der Sensitivitätsanalyse
848 0,45 0,25 0,40 0,39022 0,01871 1,12E-02 2,18E-02 8,05E-03 4,48E-07
849 0,45 0,25 0,45 0,38824 0,0187 1,24E-02 2,24E-02 8,27E-03 4,47E-07
850 0,45 0,25 0,50 0,38633 0,01869 1,35E-02 2,30E-02 8,47E-03 4,47E-07
851 0,45 0,30 0,05 0,41339 0,01826 9,35E-04 1,27E-02 4,69E-03 4,37E-07
852 0,45 0,30 0,10 0,41146 0,01826 2,05E-03 1,33E-02 4,91E-03 4,37E-07
853 0,45 0,30 0,15 0,4096 0,01825 3,14E-03 1,39E-02 5,12E-03 4,37E-07
854 0,45 0,30 0,20 0,40778 0,01824 4,19E-03 1,45E-02 5,33E-03 4,37E-07
855 0,45 0,30 0,25 0,40602 0,01824 5,22E-03 1,50E-02 5,53E-03 4,36E-07
856 0,45 0,30 0,30 0,40431 0,01823 6,21E-03 1,55E-02 5,72E-03 4,36E-07
857 0,45 0,30 0,35 0,40265 0,01822 7,18E-03 1,60E-02 5,91E-03 4,36E-07
858 0,45 0,30 0,40 0,40103 0,01822 8,12E-03 1,65E-02 6,10E-03 4,36E-07
859 0,45 0,30 0,45 0,39946 0,01821 9,03E-03 1,70E-02 6,28E-03 4,36E-07
860 0,45 0,30 0,50 0,39793 0,01821 9,92E-03 1,75E-02 6,45E-03 4,36E-07
861 0,45 0,35 0,05 0,41793 0,01779 6,92E-04 9,93E-03 3,66E-03 4,26E-07
862 0,45 0,35 0,10 0,41646 0,01779 1,52E-03 1,04E-02 3,84E-03 4,26E-07
863 0,45 0,35 0,15 0,41503 0,01778 2,33E-03 1,09E-02 4,00E-03 4,25E-07
864 0,45 0,35 0,20 0,41362 0,01778 3,12E-03 1,13E-02 4,17E-03 4,25E-07
865 0,45 0,35 0,25 0,41225 0,01777 3,90E-03 1,17E-02 4,33E-03 4,25E-07
866 0,45 0,35 0,30 0,41091 0,01776 4,66E-03 1,22E-02 4,49E-03 4,25E-07
867 0,45 0,35 0,35 0,4096 0,01776 5,40E-03 1,26E-02 4,65E-03 4,25E-07
868 0,45 0,35 0,40 0,40831 0,01775 6,13E-03 1,30E-02 4,80E-03 4,25E-07
869 0,45 0,35 0,45 0,40705 0,01775 6,84E-03 1,34E-02 4,95E-03 4,25E-07
870 0,45 0,35 0,50 0,40582 0,01774 7,53E-03 1,38E-02 5,09E-03 4,25E-07
871 0,45 0,40 0,05 0,42111 0,01734 5,33E-04 8,04E-03 2,97E-03 4,15E-07
872 0,45 0,40 0,10 0,41996 0,01734 1,17E-03 8,42E-03 3,11E-03 4,15E-07
873 0,45 0,40 0,15 0,41883 0,01733 1,80E-03 8,79E-03 3,24E-03 4,15E-07
874 0,45 0,40 0,20 0,41772 0,01733 2,41E-03 9,16E-03 3,38E-03 4,15E-07
875 0,45 0,40 0,25 0,41663 0,01732 3,02E-03 9,51E-03 3,51E-03 4,14E-07
876 0,45 0,40 0,30 0,41556 0,01732 3,61E-03 9,87E-03 3,64E-03 4,14E-07
877 0,45 0,40 0,35 0,41451 0,01731 4,20E-03 1,02E-02 3,77E-03 4,14E-07
878 0,45 0,40 0,40 0,41347 0,01731 4,77E-03 1,06E-02 3,89E-03 4,14E-07
879 0,45 0,40 0,45 0,41245 0,01731 5,34E-03 1,09E-02 4,02E-03 4,14E-07
880 0,45 0,40 0,50 0,41144 0,0173 5,90E-03 1,12E-02 4,14E-03 4,14E-07
881 0,45 0,45 0,05 0,42348 0,01692 4,23E-04 6,71E-03 2,47E-03 4,05E-07
882 0,45 0,45 0,10 0,42256 0,01691 9,29E-04 7,01E-03 2,59E-03 4,05E-07
883 0,45 0,45 0,15 0,42165 0,01691 1,43E-03 7,32E-03 2,70E-03 4,05E-07
884 0,45 0,45 0,20 0,42075 0,0169 1,92E-03 7,62E-03 2,81E-03 4,04E-07
885 0,45 0,45 0,25 0,41987 0,0169 2,40E-03 7,91E-03 2,92E-03 4,04E-07
886 0,45 0,45 0,30 0,41899 0,0169 2,88E-03 8,20E-03 3,03E-03 4,04E-07
887 0,45 0,45 0,35 0,41813 0,01689 3,35E-03 8,49E-03 3,13E-03 4,04E-07
888 0,45 0,45 0,40 0,41728 0,01689 3,82E-03 8,77E-03 3,24E-03 4,04E-07
889 0,45 0,45 0,45 0,41644 0,01688 4,28E-03 9,05E-03 3,34E-03 4,04E-07
890 0,45 0,45 0,50 0,41562 0,01688 4,73E-03 9,33E-03 3,44E-03 4,04E-07
891 0,45 0,50 0,05 0,42532 0,01651 3,44E-04 5,72E-03 2,11E-03 3,95E-07
892 0,45 0,50 0,10 0,42456 0,01651 7,54E-04 5,97E-03 2,20E-03 3,95E-07

Parameter der Sensitivitätsanalyse LXXXV
893 0,45 0,50 0,15 0,42382 0,0165 1,16E-03 6,22E-03 2,30E-03 3,95E-07
894 0,45 0,50 0,20 0,42308 0,0165 1,56E-03 6,47E-03 2,39E-03 3,95E-07
895 0,45 0,50 0,25 0,42235 0,0165 1,96E-03 6,72E-03 2,48E-03 3,95E-07
896 0,45 0,50 0,30 0,42163 0,01649 2,35E-03 6,96E-03 2,57E-03 3,95E-07
897 0,45 0,50 0,35 0,42091 0,01649 2,74E-03 7,21E-03 2,66E-03 3,94E-07
898 0,45 0,50 0,40 0,42021 0,01648 3,12E-03 7,44E-03 2,75E-03 3,94E-07
899 0,45 0,50 0,45 0,41951 0,01648 3,50E-03 7,68E-03 2,83E-03 3,94E-07
900 0,45 0,50 0,50 0,41882 0,01648 3,87E-03 7,91E-03 2,92E-03 3,94E-07
901 0,50 0,05 0,05 0,1087 0,02086 1,83E-02 2,57E-01 9,49E-02 4,99E-07
902 0,50 0,05 0,10 0,13821 0,02094 3,60E-02 2,23E-01 8,22E-02 5,01E-07
903 0,50 0,05 0,15 0,16607 0,021 4,79E-02 1,94E-01 7,14E-02 5,02E-07
904 0,50 0,05 0,20 0,18904 0,02103 5,57E-02 1,71E-01 6,31E-02 5,03E-07
905 0,50 0,05 0,25 0,20699 0,02105 6,11E-02 1,54E-01 5,68E-02 5,04E-07
906 0,50 0,05 0,30 0,22092 0,02107 6,48E-02 1,41E-01 5,21E-02 5,04E-07
907 0,50 0,05 0,35 0,23185 0,02108 6,76E-02 1,31E-01 4,84E-02 5,04E-07
908 0,50 0,05 0,40 0,24058 0,02109 6,97E-02 1,23E-01 4,54E-02 5,05E-07
909 0,50 0,05 0,45 0,24769 0,02109 7,14E-02 1,17E-01 4,31E-02 5,05E-07
910 0,50 0,05 0,50 0,25356 0,0211 7,27E-02 1,11E-01 4,11E-02 5,05E-07
911 0,50 0,10 0,05 0,34093 0,02049 7,69E-03 9,56E-02 3,53E-02 4,90E-07
912 0,50 0,10 0,10 0,33845 0,02048 1,58E-02 9,15E-02 3,38E-02 4,90E-07
913 0,50 0,10 0,15 0,33636 0,02048 2,25E-02 8,82E-02 3,25E-02 4,90E-07
914 0,50 0,10 0,20 0,33458 0,02048 2,80E-02 8,55E-02 3,15E-02 4,90E-07
915 0,50 0,10 0,25 0,33305 0,02047 3,26E-02 8,32E-02 3,07E-02 4,90E-07
916 0,50 0,10 0,30 0,33173 0,02047 3,66E-02 8,13E-02 3,00E-02 4,90E-07
917 0,50 0,10 0,35 0,33057 0,02047 4,00E-02 7,96E-02 2,94E-02 4,90E-07
918 0,50 0,10 0,40 0,32954 0,02047 4,30E-02 7,82E-02 2,88E-02 4,90E-07
919 0,50 0,10 0,45 0,32863 0,02047 4,56E-02 7,70E-02 2,84E-02 4,90E-07
920 0,50 0,10 0,50 0,32782 0,02046 4,79E-02 7,59E-02 2,80E-02 4,90E-07
921 0,50 0,15 0,05 0,4098 0,01999 3,84E-03 4,85E-02 1,79E-02 4,78E-07
922 0,50 0,15 0,10 0,40499 0,01998 8,22E-03 4,88E-02 1,80E-02 4,78E-07
923 0,50 0,15 0,15 0,40066 0,01997 1,21E-02 4,91E-02 1,81E-02 4,78E-07
924 0,50 0,15 0,20 0,39674 0,01997 1,56E-02 4,94E-02 1,82E-02 4,78E-07
925 0,50 0,15 0,25 0,39318 0,01996 1,88E-02 4,97E-02 1,83E-02 4,78E-07
926 0,50 0,15 0,30 0,38992 0,01995 2,17E-02 5,00E-02 1,84E-02 4,77E-07
927 0,50 0,15 0,35 0,38693 0,01995 2,43E-02 5,03E-02 1,85E-02 4,77E-07
928 0,50 0,15 0,40 0,38417 0,01994 2,68E-02 5,05E-02 1,86E-02 4,77E-07
929 0,50 0,15 0,45 0,38162 0,01994 2,90E-02 5,07E-02 1,87E-02 4,77E-07
930 0,50 0,15 0,50 0,37926 0,01993 3,10E-02 5,10E-02 1,88E-02 4,77E-07
931 0,50 0,20 0,05 0,43762 0,0195 2,25E-03 2,97E-02 1,10E-02 4,67E-07
932 0,50 0,20 0,10 0,43384 0,01949 4,91E-03 3,05E-02 1,13E-02 4,66E-07
933 0,50 0,20 0,15 0,43031 0,01948 7,38E-03 3,13E-02 1,15E-02 4,66E-07
934 0,50 0,20 0,20 0,427 0,01947 9,69E-03 3,20E-02 1,18E-02 4,66E-07
935 0,50 0,20 0,25 0,42389 0,01947 1,19E-02 3,27E-02 1,21E-02 4,66E-07
936 0,50 0,20 0,30 0,42096 0,01946 1,39E-02 3,34E-02 1,23E-02 4,66E-07
937 0,50 0,20 0,35 0,4182 0,01945 1,58E-02 3,40E-02 1,25E-02 4,65E-07

LXXXVI Parameter der Sensitivitätsanalyse
938 0,50 0,20 0,40 0,41559 0,01945 1,76E-02 3,46E-02 1,28E-02 4,65E-07
939 0,50 0,20 0,45 0,41311 0,01944 1,93E-02 3,52E-02 1,30E-02 4,65E-07
940 0,50 0,20 0,50 0,41076 0,01943 2,09E-02 3,57E-02 1,32E-02 4,65E-07
941 0,50 0,25 0,05 0,45164 0,01902 1,47E-03 2,04E-02 7,51E-03 4,55E-07
942 0,50 0,25 0,10 0,44886 0,01901 3,23E-03 2,11E-02 7,79E-03 4,55E-07
943 0,50 0,25 0,15 0,44619 0,01901 4,90E-03 2,18E-02 8,06E-03 4,55E-07
944 0,50 0,25 0,20 0,44365 0,019 6,50E-03 2,25E-02 8,31E-03 4,55E-07
945 0,50 0,25 0,25 0,44121 0,01899 8,03E-03 2,32E-02 8,56E-03 4,54E-07
946 0,50 0,25 0,30 0,43887 0,01899 9,50E-03 2,39E-02 8,80E-03 4,54E-07
947 0,50 0,25 0,35 0,43663 0,01898 1,09E-02 2,45E-02 9,02E-03 4,54E-07
948 0,50 0,25 0,40 0,43447 0,01897 1,23E-02 2,51E-02 9,24E-03 4,54E-07
949 0,50 0,25 0,45 0,4324 0,01897 1,36E-02 2,56E-02 9,45E-03 4,54E-07
950 0,50 0,25 0,50 0,43041 0,01896 1,48E-02 2,62E-02 9,66E-03 4,54E-07
951 0,50 0,30 0,05 0,45982 0,01856 1,03E-03 1,50E-02 5,55E-03 4,44E-07
952 0,50 0,30 0,10 0,45773 0,01856 2,27E-03 1,57E-02 5,78E-03 4,44E-07
953 0,50 0,30 0,15 0,45572 0,01855 3,47E-03 1,63E-02 6,00E-03 4,44E-07
954 0,50 0,30 0,20 0,45376 0,01854 4,63E-03 1,69E-02 6,21E-03 4,44E-07
955 0,50 0,30 0,25 0,45187 0,01854 5,76E-03 1,74E-02 6,42E-03 4,44E-07
956 0,50 0,30 0,30 0,45004 0,01853 6,85E-03 1,80E-02 6,63E-03 4,43E-07
957 0,50 0,30 0,35 0,44826 0,01853 7,90E-03 1,85E-02 6,82E-03 4,43E-07
958 0,50 0,30 0,40 0,44653 0,01852 8,93E-03 1,90E-02 7,01E-03 4,43E-07
959 0,50 0,30 0,45 0,44485 0,01852 9,92E-03 1,95E-02 7,20E-03 4,43E-07
960 0,50 0,30 0,50 0,44322 0,01851 1,09E-02 2,00E-02 7,38E-03 4,43E-07
961 0,50 0,35 0,05 0,4651 0,01812 7,65E-04 1,17E-02 4,32E-03 4,34E-07
962 0,50 0,35 0,10 0,46349 0,01812 1,69E-03 1,22E-02 4,50E-03 4,34E-07
963 0,50 0,35 0,15 0,46193 0,01811 2,58E-03 1,27E-02 4,68E-03 4,33E-07
964 0,50 0,35 0,20 0,46041 0,01811 3,46E-03 1,32E-02 4,86E-03 4,33E-07
965 0,50 0,35 0,25 0,45892 0,0181 4,31E-03 1,36E-02 5,03E-03 4,33E-07
966 0,50 0,35 0,30 0,45747 0,0181 5,15E-03 1,41E-02 5,20E-03 4,33E-07
967 0,50 0,35 0,35 0,45605 0,01809 5,96E-03 1,45E-02 5,36E-03 4,33E-07
968 0,50 0,35 0,40 0,45466 0,01809 6,76E-03 1,50E-02 5,52E-03 4,33E-07
969 0,50 0,35 0,45 0,4533 0,01808 7,54E-03 1,54E-02 5,68E-03 4,33E-07
970 0,50 0,35 0,50 0,45198 0,01808 8,30E-03 1,58E-02 5,83E-03 4,33E-07
971 0,50 0,40 0,05 0,46877 0,0177 5,89E-04 9,45E-03 3,49E-03 4,24E-07
972 0,50 0,40 0,10 0,46751 0,0177 1,30E-03 9,86E-03 3,64E-03 4,24E-07
973 0,50 0,40 0,15 0,46627 0,0177 1,99E-03 1,03E-02 3,78E-03 4,23E-07
974 0,50 0,40 0,20 0,46506 0,01769 2,67E-03 1,07E-02 3,93E-03 4,23E-07
975 0,50 0,40 0,25 0,46387 0,01769 3,34E-03 1,10E-02 4,07E-03 4,23E-07
976 0,50 0,40 0,30 0,4627 0,01768 4,00E-03 1,14E-02 4,21E-03 4,23E-07
977 0,50 0,40 0,35 0,46155 0,01768 4,64E-03 1,18E-02 4,35E-03 4,23E-07
978 0,50 0,40 0,40 0,46042 0,01767 5,28E-03 1,22E-02 4,48E-03 4,23E-07
979 0,50 0,40 0,45 0,45932 0,01767 5,90E-03 1,25E-02 4,61E-03 4,23E-07
980 0,50 0,40 0,50 0,45823 0,01767 6,51E-03 1,29E-02 4,74E-03 4,23E-07
981 0,50 0,45 0,05 0,47147 0,0173 4,68E-04 7,86E-03 2,90E-03 4,14E-07
982 0,50 0,45 0,10 0,47045 0,0173 1,03E-03 8,19E-03 3,02E-03 4,14E-07

Parameter der Sensitivitätsanalyse LXXXVII
983 0,50 0,45 0,15 0,46946 0,0173 1,58E-03 8,52E-03 3,14E-03 4,14E-07
984 0,50 0,45 0,20 0,46847 0,01729 2,13E-03 8,85E-03 3,26E-03 4,14E-07
985 0,50 0,45 0,25 0,4675 0,01729 2,66E-03 9,17E-03 3,38E-03 4,14E-07
986 0,50 0,45 0,30 0,46655 0,01729 3,19E-03 9,48E-03 3,50E-03 4,14E-07
987 0,50 0,45 0,35 0,4656 0,01728 3,71E-03 9,79E-03 3,61E-03 4,13E-07
988 0,50 0,45 0,40 0,46468 0,01728 4,23E-03 1,01E-02 3,72E-03 4,13E-07
989 0,50 0,45 0,45 0,46376 0,01727 4,73E-03 1,04E-02 3,84E-03 4,13E-07
990 0,50 0,45 0,50 0,46286 0,01727 5,23E-03 1,07E-02 3,94E-03 4,13E-07
991 0,50 0,50 0,05 0,47355 0,01692 3,81E-04 6,68E-03 2,47E-03 4,05E-07
992 0,50 0,50 0,10 0,47272 0,01692 8,36E-04 6,96E-03 2,57E-03 4,05E-07
993 0,50 0,50 0,15 0,47189 0,01691 1,29E-03 7,24E-03 2,67E-03 4,05E-07
994 0,50 0,50 0,20 0,47108 0,01691 1,73E-03 7,51E-03 2,77E-03 4,05E-07
995 0,50 0,50 0,25 0,47028 0,01691 2,17E-03 7,77E-03 2,87E-03 4,05E-07
996 0,50 0,50 0,30 0,46949 0,0169 2,60E-03 8,04E-03 2,97E-03 4,04E-07
997 0,50 0,50 0,35 0,4687 0,0169 3,03E-03 8,30E-03 3,06E-03 4,04E-07
998 0,50 0,50 0,40 0,46793 0,0169 3,46E-03 8,56E-03 3,16E-03 4,04E-07
999 0,50 0,50 0,45 0,46716 0,01689 3,87E-03 8,81E-03 3,25E-03 4,04E-07
1000 0,50 0,50 0,50 0,46641 0,01689 4,29E-03 9,07E-03 3,34E-03 4,04E-07

LXXXVIII Kaskadenreaktion inklusive Regenerierung
XVI Kaskadenreaktion inklusive Regenerierung
Abbildung 80: Langzeittest der Dehydrierung von n-Butan bei TR = 500 °C mit zwischenzeitlicher
Regenerierung/Reduzierung des heterogenen Katalysators. Umsatz und Selektivität in Abhängigkeit
des Reaktionsverlaufes am heterogenen Cr/AlOx-Katakysator.
T = 500 °C, pn-butane = 1 bar, VGes= 43.4 mlN min-1, mCr/AlOx = 10 g, wCr = 10 Gew-%.
Xn-Butan, S1-Buten, Strans-2-Buten, Scis-2-Buten.
0 20 40 60 80 100 120 140 160 180 200 220 240 260 280 300
0
10
20
30
40
50
Xn-B
uta
n /
%
Zeit / h
0
10
20
30
40
50
Si /
%