Organische Chemie · zentralen, tetraedrischen C-Atom, welches durch Addition bzw. Substitution in...
Transcript of Organische Chemie · zentralen, tetraedrischen C-Atom, welches durch Addition bzw. Substitution in...

Dr. Sabrina Höbenreich SoSe 2019 Philipps-Universität Marburg Veranstaltungsnummer: LV-20-107-006
Experimentalchemie
für Mediziner, Zahnmediziner und Biologen (LA)
Teil 2: Organische Chemie
https://www.uni-marburg.de/de/fb15/studium/lehrexport/praktikum-humanmedizin-zahnheilkunde-biologie_l3

2
Fazit der Woche 9: Carbonsäuren und ihre Derivate
Carbonsäuren: Carbonsäureester: Carbonsäureamide: Carbonsäurechloride:
Additions-Eliminierungsmechanismus an der Carboxylgruppe:
Derivate der Carbonsäuren:
Additionsschritt: Addukt Eliminierungsschritt
Fettsäuren: Aminosäuren: Isoelektrische Punkte von Aminosäuren:

3
10. Stereochemie: Identität von Bild und Spiegelbild
10. Grundlagen der Stereochemie
Allgemeines Beispiel:
Cyanhydrin
Merke: Bei dieser Reaktion entstehen zwei Produkte, nämlich zwei Enantiomere!

4
10. Stereochemie: Identität von Bild und Spiegelbild
10. Grundlagen der Stereochemie
Allgemeines Beispiel:
Cyanhydrin
Merke: Bei dieser Reaktion entstehen zwei Produkte, nämlich zwei Enantiomere!
Enantiomer A Enantiomer B
enantiofacialer Halbraum Re-Seite
enantiofaciale Differenzierung
enantiofacialer Halbraum Si-Seite

5
10. Stereochemie: Identität von Bild und Spiegelbild
10. Grundlagen der Stereochemie
Allgemeines Beispiel:
Enantiomer A Enantiomer B
Merke: Die beiden Enantiomere lassen sich nicht zur Deckung bringen!

6
10. Stereochemie: Identität von Bild und Spiegelbild
10. Grundlagen der Stereochemie
Allgemeines Beispiel:
Merke: • Enantiomere sind Strukturen, die
nicht identisch, sondern Spiegelbilder voneinander sind.
• Strukturen sind chiral, wenn sie mit
ihrem jeweiligen Spiegelbild nicht zur Deckung gebracht werden können.
Enantiomer A Enantiomer B
Merke: Die beiden Enantiomere lassen sich nicht zur Deckung bringen!

7
10. Stereochemie: Identität von Bild und Spiegelbild
10. Grundlagen der Stereochemie
Allgemeines Beispiel:
Bild Spiegelbild

8
10. Stereochemie: Identität von Bild und Spiegelbild
10. Grundlagen der Stereochemie
Allgemeines Beispiel:
Bild
Spiegelbild Bild
Spiegelbild
Merke: Achirale Strukturen lassen sich mit ihrem jeweiligen Spiegelbild zur Deckung bringen!
=

9
10. Stereochemie: Moleküle mit und ohne Symmetrieebenen
10. Grundlagen der Stereochemie
Allgemeine Beispiele:
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg

10
10. Stereochemie: Konfiguration und Konformation
10. Grundlagen der Stereochemie
Beispiel: Konfiguration
Zwei Konfigurationen: Übergang von einem Enantiomer zum anderen erfordert den Bruch und die Neuknüpfung von Bindungen Merke: • Im Falle der Punktchiralität bedeutet die
Änderung der Konfiguration eines Moleküls immer den Bruch und die Neuknüpfung von Bindungen am stereogenen C-Atom
• Eine andere Konfiguration ist ein anderes Molekül!
Beispiel: Konformation
Drei Konformationen desselben Enantiomers: Um von einer Konformation zur anderen zu gelangen, ist nur die Rotation um eine Einfachbindung nötig – alle Darstellungen sind ein und dasselbe Molekül Merke: • Eine Änderung der Konformation eines Moleküls beruht
lediglich auf der Rotation um Bindungen, nicht auf ihrem Bruch!
• Verschiedene Konformere sind lediglich unterschiedliche räumliche Anordnungen ein und desselben Moleküls
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg

11
10. Stereochemie: Chiralität und Stereogene Zentren
10. Grundlagen der Stereochemie
Allgemeines:
stereogenes Zentrum
chirales Molekül
2 1
3 4
Merke: • Wenn ein Molekül ein Kohlenstoffatom enthält, das vier verschiedene Gruppen trägt, besitzt
es keine Symmetrieebene und muss folglich chiral sein.
• Das C-Atom, an das die vier unterschiedlichen Reste gebunden sind, nennt man stereogenes Zentrum
• Eine 1:1 Mischung zweier Enantiomere nennt man Racemat
• Ein Stoff ist enantiomerenrein, wenn er nur aus chiralen Molekülen derselben Konfiguration besteht.
• „chiral“ bedeutet nicht enantiomerenrein!!!
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg
Bestimmung der Konfiguration:
Schritt 1 Weisen Sie allen Substituenten gemäß ihrer Ordnungszahl aufsteigend eine Priorität von 4 (kleinste) bis 1 (größte) zu:
4 H 3 C(H3), weil H3 < als O2
2 C(O2H), weil O2 > als H3 1 N
2 1
3 4

12
10. Stereochemie: Chiralität und Stereogene Zentren
10. Grundlagen der Stereochemie
Allgemeines:
stereogenes Zentrum
chirales Molekül
2 1
3 4
Merke: • Wenn ein Molekül ein Kohlenstoffatom enthält, das vier verschiedene Gruppen trägt, besitzt
es keine Symmetrieebene und muss folglich chiral sein.
• Das C-Atom, an das die vier unterschiedlichen Reste gebunden sind, nennt man stereogenes Zentrum
• Eine 1:1 Mischung zweier Enantiomere nennt man Racemat
• Ein Stoff ist enantiomerenrein, wenn er nur aus chiralen Molekülen derselben Konfiguration besteht.
• „chiral“ bedeutet nicht enantiomerenrein!!!
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg
Bestimmung der Konfiguration:
Schritt 1 Weisen Sie allen Substituenten gemäß ihrer Ordnungszahl aufsteigend eine Priorität von 4 (kleinste) bis 1 (größte) zu:
4 H 3 C(H3), weil H3 < als O2
2 C(O2H), weil O2 > als H3 1 N
2 1
3 4
Schritt 2 Richten Sie das Molekül so aus, dass der Substituent mit der niedrigsten Priorität von Ihnen weg zeigt. 2 1
3 4

13
10. Stereochemie: Chiralität und Stereogene Zentren
Allgemeines:
stereogenes Zentrum
chirales Molekül
2 1
3 4
Merke: • Wenn ein Molekül ein Kohlenstoffatom enthält, das vier verschiedene Gruppen trägt, besitzt
es keine Symmetrieebene und muss folglich chiral sein.
• Das C-Atom, an das die vier unterschiedlichen Reste gebunden sind, nennt man stereogenes Zentrum
• Eine 1:1 Mischung zweier Enantiomere nennt man Racemat
• Ein Stoff ist enantiomerenrein, wenn er nur aus chiralen Molekülen derselben Konfiguration besteht.
• „chiral“ bedeutet nicht enantiomerenrein!!!
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg
Bestimmung der Konfiguration:
Schritt 1 Weisen Sie allen Substituenten gemäß ihrer Ordnungszahl aufsteigend eine Priorität von 4 (kleinste) bis 1 (größte) zu:
4 H 3 C(H3), weil H3 < als O2
2 C(O2H), weil O2 > als H3 1 N
2 1
3 4
Schritt 2 Richten Sie das Molekül so aus, dass der Substituent mit der niedrigsten Priorität von Ihnen weg zeigt. 2 1
3 4
Schritt 3 Wandern Sie gedanklich von der Priorität 1 über 2 zu 3. Wenn dabei eine Linksdrehung entsteht, liegt eine S-Konfiguration vor, bei einer Rechtsdrehung liegt eine R-Konfiguration vor.
2 1
3 4
S
10. Grundlagen der Stereochemie

14
10. Stereochemie: Cahn-Ingold-Prelog Konvention
10. Grundlagen der Stereochemie
Definition: Die Cahn-Ingold-Prelog-Konvention (kurz: CIP-Konvention) dient zur eindeutigen Beschreibung der räumlichen Anordnung der unterschiedlichen Substituenten an Atomen oder an Doppelbindungen.
Butan-2-ol
Weisen Sie allen Substituenten gemäß ihrer Ordnungszahl aufsteigend eine Priorität von 4 (kleinste) bis 1 (größte) zu.
• besitzen mindestens zwei Atome am stereogenen Zentrum dieselbe Ordnungszahl (OZ), dann vergleichen Sie die Atome, die an ersteren gebunden sind hinsichtlich ihrer OZ.
• Lässt sich auf dieser Ebene auch kein Unterschied feststellen, gehen solange jeweils eine Bindungsebene weiter weg vom stereogenen Zentrum, bis ein Unterschied auftritt.
Weitere Unterscheidungskriterien:
Bei Isotopen erhält das schwerere Isotop die höhere Priorität (Bsp. D > H)
Bei Doppelbindungen A=B wird angenommen, dass A zweimal einfach gebunden an B und B zweimal einfach gebunden an A vorliegt

15
10. Stereochemie: Fischer-Projektion
10. Grundlagen der Stereochemie
Quelle: https://de.wikipedia.org/wiki/Fischer-Projektion
Erläuterung: Die Fischer-Projektion ist eine Methode, die Raumstruktur einer linearen, chiralen chemischen Verbindung eindeutig zweidimensional abzubilden. Sie wurde von Emil Fischer entwickelt und wird häufig für Moleküle mit mehreren, benachbarten Stereozentren wie Zuckern verwendet.
Fischer-Projektionen
Regeln: 1. Eine Kette von C-Atomen wird von oben nach unten gezeichnet,
wobei das am stärksten oxidierte Atom oben steht. Für die Bestimmung der Oxidationsstufe eines gegebenen C-Atoms gilt:
a. für jede C–X Bindung mit X elektronegativer als C wird ein Wert von +1 angenommen
b. für jede C–H Bindung wird ein Wert von –1 angenommen
c. für jede C–C Bindung wird ein Wert von 0 angenommen
d. die Summe aller Werte aller Bindungen = Oxidationsstufe
2. Horizontale (waagerechte) Linien zeigen aus der Projektions-ebene hinaus auf den Betrachter zu. Dies kann auch durch ausgefüllte, zum Zentrum hin dünner werdende Keile angedeutet werden.
3. Vertikale (senkrechte) Linien laufen hinter die Projektionsebene, vom Betrachter weg. Dies kann auch durch quergestrichelte, zum Zentrum hin ebenfalls dünner werdende Keile angedeutet werden.
R S

16
10. Stereochemie: Fischer-Projektion
10. Grundlagen der Stereochemie
Quelle: https://de.wikipedia.org/wiki/Fischer-Projektion
Erläuterung: Die Fischer-Projektion ist eine Methode, die Raumstruktur einer linearen, chiralen chemischen Verbindung eindeutig zweidimensional abzubilden. Sie wurde von Emil Fischer entwickelt und wird häufig für Moleküle mit mehreren, benachbarten Stereozentren wie Zuckern verwendet.
Fischer-Projektionen
Regeln: 1. Bei Zuckern richtet sich die D/L-Nomenklatur nach der Stellung
der OH-Gruppe an dem am weitesten vom höchst oxidierten C-Atom entfernten stereogenen C-Atom, d.h. an dem in der Projektion unten stehenden.
2. Steht dieser OH-Substituent rechts, bezeichnet man die Konfiguration mit D, steht er links, mit L
3. Bei Aminosäuren richtet sich die D/L-Nomenklatur nach der Stellung der a-Amino-Gruppe
4. threo = Substituenten in der Fischer-Projektion auf entgegengesetzten Seiten
5. erythro = Substituenten in der Fischerprojektion auf derselben Seite
Übung: Zeichnen Sie die Fischer-Projektionen für die beiden Enantiomere von Alanin (α-Aminopropansäure).

17
10. Stereochemie: Diastereomere und meso-Verbindungen
10. Grundlagen der Stereochemie
Definition: Diastereomere sind Stereoisomere, also chemische Verbindungen gleicher Konstitution aber unterschiedlicher Konfiguration, welche sich – im Gegensatz zu Enantiomeren – nicht wie Bild und Spiegelbild verhalten.
Merke: meso-Verbindungen sind Moleküle, die mindestens zwei Stereozentren besitzen, aber dennoch achiral sind.

18
10. Stereochemie: Relative und absolute Konfiguration
10. Grundlagen der Stereochemie
Definition: Konfiguration bezeichnet die räumliche Anordnung von Atomen eines Moleküls beziehungsweise dessen räumlichen Bau, wobei Drehungen um Einfachbindungen nicht berücksichtigt werden.
absolute Konfiguration: Räumliche Anordnung der Substituenten um ein stereogenes Zentrum. Letzteres kann mittels Cahn-Ingold-Prelog Konvention (CIP-Konvention) genau definiert werden.
relative Konfiguration: Räumliche Anordnung der Substituenten um ein stereogenes Zentrum relative zu einem weiteren innerhalb desselben Moleküls.
2 1
3 4
S R S
threo erythro
S S
R S
S S
S R
R
S

19
10. Stereochemie: Prochiralität
10. Grundlagen der Stereochemie
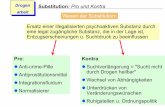
Definition: Prochiralität beschreibt die Eigenschaft eines Moleküls, das an einem zentralen, planaren C–Atom drei verschiedene Substituenten trägt, oder eines nichtchiralen Moleküls mit höchstens zwei identischen Substituenten an einem zentralen, tetraedrischen C-Atom, welches durch Addition bzw. Substitution in ein chirales Molekül überführt zu werden.
J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin Heidelberg
enantiotope H-Atome
homotope H-Atome
enantiotope Differenzierung
enantiofaciale Halbräume
homotope H-Atome
enantiofaciale Differenzierung

20
10. Stereochemie: Optische Aktivität
10. Grundlagen der Stereochemie
Allgemeines:
Quelle: https://en.wikipedia.org/wiki/Specific_rotation
Enantiomere besitzen dieselben chemischen und physikalischen Eigenschaften (Basizität, Elektrophilie, Smp. etc.), jedoch unterschieden sie sich in ihren Wechselwirkungen mit anderen chiralen Entitäten!
Polarimeter:
Lichtquelle
Polarisations-ebenen
Polarisator
linear polarisiertes Licht
Probe
Änderung der Polarisationsebene
drehbarer Polarisationsfilter
Analysator
Merke: Chirale Verbindungen können die Polarisationsebene von linear polarisiertem Licht beim Durchstrahlen verändern. Derartige Moleküle und Ionen werden optisch aktiv genannt. • Drehwinkel a = Ausmaß der Veränderung der
Polarisationsebene (in Grad)
• Rechtsdrehung der Polarisationseben = +
• Linksdrehung der Polarisationseben = –
• + und – sind unabhängig von R und S • achirale Verbindungen sind optisch inaktiv
• Racemate weisen einen Drehwinkel a von 0°
auf, da sich die Drehwerte der beiden Enantiomere ausmitteln

21
10. Stereochemie: Chirale Erkennung
10. Grundlagen der Stereochemie
Bei chemischen Reaktionen:
• Achirale Reaktanden reagieren mit chiralen Reaktionspartnern jeweils identisch.
• Chirale Reaktanden können mit chiralen Reaktionspartnern jeweils unterschiedlich reagieren. Derartige Prozesse werden als doppelte Stereodifferenzierung bezeichnet, wenn bei der Reaktion mindestens ein zusätzliches stereogenes Zentrum entsteht.
• Enantiomere können in biologischen Systemen unterschiedliche Eigenschaften (Wirkungen) haben.
• Enzyme (chirale Biokatalysatoren) können beispielsweise hoch selektiv Enantiomere voneinander unterscheiden oder prochirale Gruppen defferenzieren.
In der Natur:

22
10. Stereochemie: Racematspaltung
10. Grundlagen der Stereochemie
A) Salzbildung:
Quellen: a) https://www.quora.com/Can-we-separate-enantiomers; b) https://en.wikipedia.org/wiki/Aminoacylase
(R)-Säure
(S)-Säure
(S)-Amin + (R,S)-Salz
(S,S)-Salz
Diastereomerengemisch (unterschiedliche Eigenschaften)
Trennung (Kristallisation)
(S,S)-Salz
(R,S)-Salz
Freisetzung (Ansäuern)
(R)-Säure
(S)-Säure
getrennte Enantiomere

23
10. Stereochemie: Racematspaltung
10. Grundlagen der Stereochemie
A) Salzbildung:
Quellen: a) https://www.quora.com/Can-we-separate-enantiomers; b) https://en.wikipedia.org/wiki/Aminoacylase
B) Chromatographie:
(R)-Säure
(S)-Säure
(S)-Amin + (R,S)-Salz
(S,S)-Salz
Diastereomerengemisch (unterschiedliche Eigenschaften)
Trennung (Kristallisation)
(S,S)-Salz
(R,S)-Salz
Freisetzung (Ansäuern)
(R)-Säure
(S)-Säure
getrennte Enantiomere
Chirales Polymer
Ch
iral
e S
äule

24
10. Stereochemie: Racematspaltung
10. Grundlagen der Stereochemie
A) Salzbildung:
Quellen: a) https://www.quora.com/Can-we-separate-enantiomers; b) https://en.wikipedia.org/wiki/Aminoacylase
B) Chromatographie:
(R)-Säure
(S)-Säure
(S)-Amin + (R,S)-Salz
(S,S)-Salz
Diastereomerengemisch (unterschiedliche Eigenschaften)
Trennung (Kristallisation)
(S,S)-Salz
(R,S)-Salz
Freisetzung (Ansäuern)
(R)-Säure
(S)-Säure
getrennte Enantiomere
Chirales Polymer
Ch
iral
e S
äule
C) Enzymatisch:
Aminoacylase 1 (Enzym)

25
10. Stereochemie: Zusammenfassung Isomerie
10. Grundlagen der Stereochemie
Moleküle mit gleicher Summenformel
sind die Moleküle deckungsgleich?
Ja! Nein!
identisch Isomere
Beispiel: Konformere

26
10. Stereochemie: Zusammenfassung Isomerie
10. Grundlagen der Stereochemie
Moleküle mit gleicher Summenformel
sind die Moleküle deckungsgleich?
Ja! Nein!
identisch Isomere
Ja! Nein!
gleiche Konstitution?
Konstitutionsisomere Stereoisomere
Beispiel: Konformere

27
10. Stereochemie: Zusammenfassung Isomerie
10. Grundlagen der Stereochemie
Moleküle mit gleicher Summenformel
sind die Moleküle deckungsgleich?
Ja! Nein!
identisch Isomere
Ja! Nein!
gleiche Konstitution?
Konstitutionsisomere Stereoisomere
Ja! Nein!
spiegelbildliches Verhalten?
Diastereomere Enantiomere
Beispiel: Konformere
R S