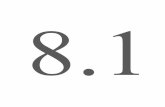Photochemie kleiner Ringe, XX1) Reaktionen von Carbena-cyclopentadienen mit Cycloheptatrien Synthese...
-
Upload
heinz-duerr -
Category
Documents
-
view
214 -
download
2
Transcript of Photochemie kleiner Ringe, XX1) Reaktionen von Carbena-cyclopentadienen mit Cycloheptatrien Synthese...
1970 H. Diirr, R. Sergio und G. Scheppers 63 Liebigs Ann. Chem. 740, 63-73 (1970)
Photochemie kleiner Ringe, XX 1)
Reaktionen von Carbena-cyclopentadienen mit Cycloheptatrien Synthese von Homonorcaradienen und Sesquifulvalenen
von Heinz Riirr *), Rene' Sergio und Gerd Scheppers
Aus dem Institut fur Organische Chemie der Universitit des Saarlandes, D-66 Saarbriicken
Eingegangen am 18. Februar 1970
Die Photolyse von Carbena-cyclopentadienen 2 in Cycloheptatrien ergibt Spiro-homonorcara- diene 6 und Cyclopentadienyl-cycloheptatriene 7. Die Verbindungen 6 lassen sich durch Diels- Alder-Reaktion und katalytische Hydrierung charakterisieren. Eine Cope-Umlagerung findet nicht statt; statt dessen tritt irreversible Bildung von 13 ein. Kiltalytische Hydrierung von 7f fiihrt zum bekannten 15f. Die Dehydrierung von 7 liefert die Sesquifulvalene 17. - Die Bil- dung von 6 und 7 verlauft iibei eine n-n*-Anregungvon 5, dessen S1-Zustand zwischen 71 und 72 kcal/Mol liegen diirfte. Die Multiplizitiit der Carbene sowie sterische Faktoren bei 2 scheinen von ausschlaggebender Bedeutung fur den Reaktionsverlauf zu sein.
Photochemistry of small Kings, X X I ) . Reactions of Carbena-cyclopentadirnes with Cyclohepta- triene. - Synthesis of' Homonorcaradienes and Sesquijdvalenes Photolysis of carbena-cyciopentadienes 2 in cycloheptatriene leads to spiro- homonorcaradienes 6 and cyclopentadienyl-heptatrienes 7. The compounds 6 can be characterized by Diels- Alder-reaction and catalytic hydrogenation. 6 does not undergo Cope-rearrangement but irreversibly forms 13. Catalytic hydrogenation of 7 f produces the known 15f. Dehydrogena- tion of 7 gives the sesquifulvalenes 17. - The formation of 6 and 7 involves an n-x+-exci- tation of 5 whose &-state has an energy of 71 -72 kcal/mole. The multiplicity of the carbene as well as steric factors of 2 seem to be important for the reaction.
Carbena-cyclopentadiene 2 gehoren wie die Carbene 3 zu den Cycloalkencarbenen mit 4 n + 2x-Elektronen. 2 und 3 besitzen, wie die Reihe der Carbene 1-4 zeigt, infolge Mesomerie elektrophilen Charakter, 1 und 4 reagieren dagegen nucleophil*).
Die Carbena-cyclopcntadiene 2 addieren sich an Benzol, wobei in Abhangigkeit von den Substituenten Spiro-norcaradiene3.4) entstehen, dcren Stabilitat von den Substituenten abhangt. Teils zersetzen sie sich spontan3.4), teils sind sie isolierbars,6).
+) Herrn Prof. E. Muller zum 65. Geburtstag gewidmet. 1) XIX. Mitteilung: H . Diirr und L. Schrader, Chem. Ber. 103, 1344 (1970). 2 ) Literaturubersicht zu diesem Problem bei H . Diirr und G . Scheppers, Liebigs Ann. Chem.
3) H. Diirr und G. Scheppers, Angew. Chem. 80, 359 (1968). 4) H. Diirr und G. Scheppers, Tetrahedron Letters [London] 1969, 6059. 5 ) M. Jones j r . , J. org. Chemistry 33, 2538 (1968). 0 ) D. Schiinleber, Chem. Ber. 102, 1789 (1969).
734, 141 (1970).
64 H. Durr, R. Sergio und G. Scheppers Bd. 740
x
1 2 3 4 - T-TI ekt ronan: 4n 4x1 + .? 4 11
Diese Beobachtungen warfen die Frage auf, welche Stabilitat die entsprechenden Spiro-homonorcaradiene 6 aufweisen wiirden. Daher wurde die Reaktion der Car- bena-cyclopentadiene 2 mit Cycloheptatrien untersucht ; die dabei moglichen Inser- tionsprodukte erschiencn als Dihydrosesquifulvalene 7 von praparativem Interesse, da sie in Sesquifulvalene iiberfiihrbar sind.
Umsetzung yon Carbena-cyclopentadienen mit Cycloheptatrien Die Carbena-cyclopentadiene 2 wurden photochemisch 2) aus den entsprechend
substituierten Diazo-cyclopentadienen7) 5 in situ erzeugt. Zur Photolyse wurden 0.8 proz. Losungen der Verbindungen 5 in Cycloheptatrien mit Hg-
Hochdruckbrennern (Pyrex-Filter) bestrahlt und die Reaktionsgemische durch Chrcmato- graphie an Kieselgel getrennt.
Man erhielt aus den Diazoverbmdungen 5a- fund Cycloheptatrien die Spiro-homo- norcaradiene 6a ~ e, und die Cyclopentadienyl-cycloheptatriene 7d- f mit den in TabeIle I angcgebenen Ausbeuten.
5 2
7) B. Eisrert, M. Regitz, G. Heck und H. Schwall, in Houben-Weyl-Muller, Methoden der organischen Chemie, 4. Aufl., Bd. 1014, S. 475, Thieme-Verlag, Stuttgart 1968.
1970 Photochemie kleiner Ringe, XX 65
Tabelle 1. Ausbeute an Spiro-homonorcaradienen 6 und Cyclopentadienyl-cycloheptatrienen 7 bei der Photolyse von 5 in Cycloheptatrien
Diazoverbindung nd Ausbeute an I / A d 5 R1 R2 R3 R4 6 7 716
a - o-Phenylen o-Phenylen 65 -
b o-Phenylen CsH5 C6H5 75 -_ -
C CI c1 Cl CI 35 -
d C6HS C6H5 C6H5 H 29 33 1 : l . l
e C6HS H H C6HS 18 45 1: 3.6
- 36 b) - f C6Hs C6H5 C6HS C6HS
a) Verhaltnis Insertionsprodukt (1) Additionsprodukt (A). b) Nur bei der Photolyse von 5f In Cycloheptatrlen konnte Tetraphenylcyclopentadien 8f in 1 -2proz. Aus-
beute isoliert werden.
Die Struktur der Reaktionsprodukte 6 und 7 folgt auger aus ihren Reaktionen (S. 67) vor allem aus den NMR-Spektren. Als Beispiele werden nur je ein NMR- Spektrum eines Additionsproduktes vom Typ 6 und eines Insertionsproduktes vom Typ 7 eingehender betrachtet; die NMR-Daten der iibrigen Spektren sind Tabelle 2 zu entnehmen.
So zeigt das NMR-Spektrum des Additionsprodukts Fluoren-9‘-~piro-8-bicyclo[5,l.Oj- octadien-(2.5) ( 6 4 drei nichtaromatische Signalgruppen was fur die hochsymmetrische Struktur spricht. Bei T = 7.40 und 7.12 beobachtet man zwei Multipletts fur vier Protonen (HI, 2H4, H7). Bei T = 4.00 erkennt man ein breites Smgulett fur die vier olefinkchen Pro- tonen (H2, H3, Hj, H6). Die Fluoren-Protonen ergeben ein komplexes AzBz-Muster, das bei T = 2.25, 2.72 und 3.05 zentriert ist (8H).
6a ‘w 7e +
Das NMR-Spektrum des Tnsertionsproduktes 7-[1.4-Diphenyl-cyclopentadien- (1.3) -yl-(5) 1- cycluheptatrien-(1.3.5) (7e) ist als 10-Spin-System (A2M2N2R2XYj wesentlich komplexer. Es zeigt bei t = 3.18 und bei 3.55 je ein breites Singulett fur HZ’lH3’ und H3/H4. Bei T = 3.9-4.1 erkennt man zwei Multipletts fur H2/Hs und bei 5.50 zwei doppelte Dubletts (J = 9.0 und 5.0 Hzj fur H1/H6. Das fur Insertionsprodukte typische Cyclopentadienyl-Proton (H5‘) tritt als Dublett bei 5.89 ppm (J = 5.0 Hz) auf und H7 erscheint bei t = 7.78 als Dublett (J = 5.0 Hz). Die aromatischen Signale liegen bei T = 2.3 -2.9. Das Verhaltnis der einzelnen Pro- tonen ist 10 : 2 : 2: 2: 2 : 1 : 1.
Liebigs Ann. Chcm. Bd. 740 5
Tab
elle
2. N
MR
-Dat
en d
er A
dditi
onsp
rodu
kte
6 un
d In
sert
ions
prod
ukte
7 in
CD
C13
diej
enig
en in
eck
igen
Kla
mm
ern
die
Kop
plun
gsko
nsta
nten
(in
Hz)
. - b
r. s =
bre
ites
Sing
ulet
t. A
ngab
en in
-c-
Wer
ten.
- D
ie A
ngab
en i
n ru
nden
Kla
mm
ern
betr
effe
n di
e M
ultip
lizitP
ten
und
Inte
nsitt
iten,
Ver
- H
i, H7
H4
HZ, H
3 H
5, H
6 ar
omat
isch
e un
d iib
rige
Pro
tone
n
6a
7.
40 (m
, 2)
7.12
(m
, 2)
4.00
(br
. s, 4
) 2.
25,2
.72 (in)
3.05
(8)
6b
7.51
(m, 2
) 7.
25 (m
, 2)
3.95
(br
. s, 4
) 2.
1 -3
.2
(m, 1
4)
bind
ung
6c
7.24
(m, 2
) 6.
94 (m
, 2)
4.42
(dd
, 2)
[I0 u. 2
.51
3.96
(m, 2
) -
-
6d
7.
27 (
m, 2
) 6.
98 (rn, 2
) 4.
18 (
br. s
, 4)
2.8-
3.9
(m, 1
5)
3.60
is,
1)
Ver
- bi
ndun
g H
7 H
5 H
I, H
6 H
2, H
5 H
3,
H4
HZ’
, H3’
ar
omat
. H
7e
7.
78 (
d, 1
) 5.
89 (
d, 1
) 5.
50(d
d, 2
) 3.
9-4.
1 (m
, 2)
3.55
(br.
s, 2
) 3.
18 (
br. s
, 2)
3.
2-2.
9 (m
. 10
) r5
.01
r5.0
1 [9
.0 u
. 5.0
1
7f
8.1-
7.8
(m, 1
) 5.
42 (d
, 1)
4.91
(dd
, 2)
4.2-
3.8
(m, 2
) 3.
7-3.
4 (m
, 2)
2.88
(10
) PI
[9
.5 u
. 5.5
1 2.
77 (1
0)
1970 Photochemie kleiner Ringe, XX 67
Fast alle dargestellten Verbindungen (Tab. 1) sind kristalline, definierte Substanzen. Lediglich 6e und 7 d konnten nur als olige Rohprodukte durch ihre Spektren charak- terisiert werden, da sie infolge ihrer Zersetzlichkeit nicht kristallin und analysenrein erhalten wurden (vgl. hierzu Lit. 8)).
Reaktionen der Photoprodukte 6 und 7 Die Strukturen der Additionsprodukte 6 und der Insertionsprodukte 7 uvrden
durch folgende Umsetzungen wei ter erhartet : Katalyfische Hydrierung des Homo- norcaradiens 6 d fuhrte unter Aufnahme von 2 Mol HZ/Mol zu dem unabhangig auf dem angegebenen Wege 8) synthetisierten Spiro-norcaran 10d.
R3 RZ
- N , I, v R4 QR1 (==J 6d h ,, ,FtO R4g:1
10d N2
Die Diets-Alder-Reaktion von 6b mit Tetracyclon ergab das envartete orangerote Produkt 9b. Infolge der Schwerloslichkeit von 9b konnte kein NMR-Spektrum auf- genommen werden, so daR die Strukturzuordnung im wesentlichen auf der Elementar- analyse und dem IR-Spektrum beruht.
Im IR-Spektrum von 9 b treten die C-0-Valenzschwingung bei 1780 und die Valenz- schwingungen der Phenyl-Kerne bei 1610, 1495 und 1450 cm-1 auf. Bei 1028 cm-1 beobachtet man die Cyclopropan-Bande.
R3 R2
6b f Rq R R R4&:9b
R 0
I?. CGH, R
Die Therrnolyse der Homonorcaradiene 6 sollte in einer Cope-Urnlugerung ( Weg a) zu 11 fiihren. Die Cope-Umlagerung fand jedoch nicht statt, sondern es entstand nach Weg b und c, wahrscheinlich fiber das Diradikal 12b, das Bicyclo[3.3.0]octadien-Deri- vat 13b (NMR-Daten S. 73) .
Eine ahnliche Umlagerung wurde von Doeringg) fur das Homotropyliden beschrieben. Ein Versuch die Umlagerung, analog diesen Studien, mit Hilfe von NMR-Spektren bei 40- 180' zu untersuchen, fiihrte in einer irreversiblen Zersetzung von 6b zu einem Produkt unbekannter Struktur.
8) H. Diirr und L. Schrader, Chem. Ber. 102, 2026 (1969). 9) W. von E. Doering, Tetrahedron [London] 19,126 (1963).
5.
68 H. Durr, R. Sergio und G. Scheppers Bd. 740
6b
12b
Bei der Hydrierung nimmt 13b 2 Mol Hz/Mol auf und ergibt 14b. Die katalytische Hydriening des Insertionsprodukts, namlich des Dihydro-sesqui-
fulvalen-Derivats 7f, ergab das Hexahydro-Derivat 15f. Dieses war mit dem durch Hydricrung aus 16flo) hergestellten Produkt identisch (Mischprobe, TR-Spektrum).
R3 R2 R3 R2
7f H:,'F'tO,, 'I4
15f l h f
Umwandlung von 7e und 7f in Sesquifulvalene
Die Dihydrosesquifulvalene 7e und 7f, die Prinzbachll-13) aus den entsprechend substituierten Cyclopentadienyl-natrium-Verbindungen und Tropyliumbroniid erhal- ten hatte, wurden mit Chloranil in die bereits synthetisierten Sesquifulvalenell-13) 17e (25 % d. Th.) und 17f (48 % d. Th.) umgewandelt. Als Nebenprodukt entstand aus 7e das Phenylfulven 18e12).
R3 1t2
10) H. Durr und G . Scheppers, Chem. Ber. 100, 3236 (1967). 11) H. Prinzbach, D. Seip, L. Knothe und W. Fa&, Liebigs Ann. Chem. 698, 34 (1966). 12) H. Prinzbach und D . Seip, Liebigs Ann. Chem. 698, 57 (1966); 17e und 18e sind hier nur
13) H. Prinzbach und W. Rosswug, Tetrahedron Letters [London] 1963, 1967. in einer FuDnote erwahnt.
1970 Photochemie kleiner Ringe, XX 69
Die UV-Absorptionen der erhaltenen Sesquiterpene stimmen mit den von Prinzbachll-13) angegcbenen iiberein.
Die photochemische Synthese von 7 und deren Dehydrierung zu 17 erscheint als elegante Methode zur Darstellung von Sesquifulvalenen; jedoch ist ihre praparative Anwendung begrenzt, da sich die Verbindungen 7 nur aus solchen Carbenen 2 bilden, die in I - und 4-Stellung sperrige Reste tragen.
Diskussion
Die photochemische Ativegiing der Diazo-cyclopentadiene 5 diirfte zunachst zu einem n --f x"-Zustand 14) fiihren, wie aus den Iangstwelligcn Absorptionsbanden von 5 zu entnehmen 1st (Tab. 4). Dieser n + n*-Anregungszustand ist ein Singulett- Zustand, dessen Energie S I - 71 kcal/hliol im Falle von 5 e entspricht15). Aus dem Fluoreszenzspektrum (in Cyclohexan bei 25") ergibt die Lage dcr kurzestwelligen 0 0-Bande (Emission bei 404 nm) die Energie des S1-Zustandes zu FX 72 kcal/Mol. Ilic Lebcnsdauer des angeregten Zustands liegt mit T =- 3.7 '10-8 sek. (fur 2e, f) in der erwarteten GroBenordnungls). Die Photolyse von 5 fiihrt von diescm 11 +n"- Singulettzustand dann unter N2-Abspaltung zum jeweiligen Carben 2.
Tabelle 4. U V-Spektren der umgesetzten Diazoverbindungen 5
5 A,,,-Werte in nm (E. 10-4) T~ek.'~)
a a) 242 (4.49) 305 (1.27)
ha) 248 (3.34) C.1) 305 (2.14)
a 1 252 (2.46) e 243 (1.49)
368 (0.40) f 230 (2.69)
390 (0.28)
270 (1.07) 292 (1.87) -
335 (1.14) 348 (1.43) 278 (2.01) 345 (1.34) 310 (2.05) 335 (1.95) ~
234 (1.65) 270 (1.06) 3 I8 (0.59) 3.7.10.8 404 (0.28) 285 (1.77) 335 (1.30) 3.7.10-8
a) Bei diesen Verbindungen ist die llngstwellige 11 + n*-Bande verdeckt.
Je nachdem wie schnell die Interkombination von 2 --f 2' ablauft, reagiert das Car- bena-cyclopentadien 2 aus dem S1- oder T1-Zustand. Nach Untersuchungen von
14) J. G. Ctrlvert und 1. N . Pitts, Photochemistry, S. 453, J . Wiley & Sons, New York 1967. 1 5 ) N. J . Turro, Molecular Photochemistry, S. 92, Benjamin, Inc., New York 1967.
70 H. Dfirr, R. Sergio und G . Scheppers Bd. 740
Wassermann16.17) und HMO-Berechnungen von Hofmannls) ist der Grundzustand von 2 ein Triplett. Dies bestatigt auch die nicht-stereospezifische Addition von Zalg) ,
wahrend 2~203, ds) und f4) bei Raumtemperatur als S1-Carbene reagieren. Neben dieser verschiedenen Multiplizitat der Carbene 2 a - f scheinen auch sterische
Faktoren der verschiedenen Substituenten von Bedeutung fur den Reaktionsverlauf zu sein. Im Gegensatz zu 6a, b, c nimmt bei dd, e, f die sterische Hinderung am Car- ben-Kohlenstoff mit der Anzahl der voluminosen Phenyl-Reste stetig zu, was offenbar die Bildung des Insertionsprodukts 7 begiinstigt.
Herrn Prof. Dr. B. Eistert danken wir fur sein stetes Interesse und die finanzielle Unter- stutzung dieser Arbcit aus Institutsmitteln. Der Deutschen Forschungsgemeinschajt sei fur eine Sachbeihilfe gedankt. Den Herren Dr. H. G. Hahn und J. Mriller haben wir fur die Auf- nahme dcr IR- und NMR-Spektren, Herrn DipLChem. G. Humme fur die Ausfiihrung der Elementaranalysen zu danken.
Beschreibung der Versuche
Die Schrnelzpunkte wurden im Heizblock bestimmt und sind unkorrigiert. - Die IR- Spektren wurden an KBr-PreBlingen rnit einem Beckman-Gerat IR-4, die NMR-Spektren rnit dem Varian-Gerat A 60 aufgenommen (1Oproz. Losung in CDC13, Tetramethylsilan als innerer Standard). Zur Aufnahme der UV-Spektren diente das Beckman-Gerat DK 2, zu derjenigen der Fluoreszenzspektren ein Cary-Gerat Modell 14. ~ Die ElementaranaZysen wurden nach der Ultramikroschnellmetliodc von Walisch 21) ausgefiihrt. - Die Dunnschicht- chromatogramme (DC) wurden auf 250-p-Schichten von Kieselgel GF254 (nach Stahl) rnit Benzol/Pctrolather (60-90") als Laufmittel hergestellt. - Saulenchromatographien wurden rnit Hilfe eines automatischen Fraktionssammlers (1 8-ccm-Frdktionen) ausgefiihrt ; der hierzu venvendete Petrolather besaB den Sdp. 60-90" - Fur die Photolysen venvandten wir ein BestrahlungsgefiB (Pyrex-Glas) nach Schenck 22) . Vor Reaktionsbeginn wurde stets (10 bis 15 Min.) rnit Reinstickstoff gespiilt und die Bestrahlung ebenfalls unter Reinstickstoff vor- genommen.
- Allgemeine Vorschrif: Die Losung von 2.00 g substit. Diazo-cyclopentadien7) in 250 ccm Cycloheptatrien wurde unter Nz 1-2 Stdn. bei 18-19' rnit einer Hg-Hochdrucklampe (Typ HPK, 125 w) belichtet. Die Photolyse im BestrahlungsgefaB aus Pyrex-Glas gewahrleistete die Einstrdhlung von uv- Licht mit > 290 nm, was fur die Diazovcrbindungen, die bei 234-4155 nm absorbieren, erforderlich ist. Nach beendeter Belichtung (Endpunktsbestimmung durch Messung des ent-
16) R . W. ;Murra)i. A. M. Trozzolo, E. Wassermann und W. A , Yager, J. Amer. chem. SOC.
Photolyse von Diazo-cyclopentadienen in Cycloheptatrien.
84, 3213 (1962). 17) E. Wassermann. L. Barash, A. M . Trozsolo, R. W . Murray und W. A . Yager, J. Amer.
chem. SOC. 86, 2304 (1964). 18) R. Gleiter und R. Hofmann, J. Amer. chem. SOC. 90, 5457 (1968). 19) W. von E. Doering und M. Jones jr., Tetrahedron Letters [London] 1963, 791. 20) E. T. MacBee, J. A . Bosoms und C . J . Morton, J. org. Chemistry 31, 768 (1966). 21) W. Walisch, Chem. Ber. 94, 2314 (1961). 22) C. 0. Schenck, in A . SchZinberg, Praparative organische Photochemie, 1. Aufl., S. 210,
Springer-Verlag, Berlin 1958.
1970 Photochemie kleiner Ringe, XX 71
wickelten Stickstoffs oder durch DC) wurde das Photolysat vom uberschiissigen Cyclohep- tatrien bei 30" i. Vak. befreit und d a m der Chromatographie an Kieselgel (0.2-0.5 mm) unterworfen. Als Elutionsmittel wurden die bei den einzelnen Versuchen angegebenell Gemische verwendet. Fluoren-9'-spiro-8-bicyclo~5.l.Oloc!~dien-(2.5) (6a). - 2.00 g (10.6 mMol) 9-Diazo-fluoren
(5a) wurden in 250 ccm (2.41 Mol) Cycloheptatrien unter Ruhren und N2 2 Stdn. bestrahit. Nach Abdestillieren des Losungsmittels i.Vak. wurde der Ruckstand an Kieselgel mit Benzol/ Petrolather (10 : 90) chromatographiert. Ausbeute 1.04 g (65 %) 6a als 61. - ZR-Spektrum: 2950, 1600, 1500, 1440, 734 (Aromat), 700 (C=C), 2925 (CH2), 1020 cm-1 (Cyclopropan- Geriist).
C20H16 (256.3) Ber. C 93.71 H 6.29 Gef. C 93.6 H 6.27
2'.3'-Diphenyi-inden-l-spiro-8'-bicyclo[5.l.Oloctadien-(2.5) (6b). - 2.00 g (6.79 mMol) 5b in 250 ccm Cycldheptatrren wurden unter Riihreii 2 Stdn. bestrahlt. Nach Abziehen des Cycloheptatrieiis i. Vak. wurde das Photolysat in k h e r aufgenomrnen. Nach kurzem Stehen- lassen fie1 ein weil3er Niederschlag aus. Ausbeute 1.82 g (75%) 6b; Schmp. 156 -158" (aus Tetrahydrofuran). - IR-Spektrum: 2940, 1603, 1592, 1478 (Aromat), 698 (C=C), 1006, 1022 cm-1 (Cyclopropan-Geriist).
C28H22 (358.4) Ber. C93.8 H 6.18 Gef. C93.5 H 6.19
Tetrachlor-bicyclo[5.I.O]octadien-(2.5) -8-spiro-5'-cyclopentadien-( I l.3') (6c). - Die Losung von 2.00 g (8.70 mMol) 5-Diazoo-tetrachlor-cyelopentadien-(l.3) (5c) in 250 ccm Cycloheptn- frien wurde nach der allgemeinen Vorschrift 1 Stde. besirahit und das Photolysat an 150 g Kieselgel mit Petrolather gereinigt. Ausbeute 0.62 g (24%) 6c. Watteartige Nadeln vom Schmp. 110-1 11" (aus xther/Methanol). - IR-Spektrum: 2960 (CHz), 698 (C=C), 1026, 1032 cm-1 (Cyclopropan-Geriist).
C12H&14 (294.0) Ber. C 49.01 H 2.72 CI 48.4 Gef. C 48.9 H 2.61 C148.4
2'.3'.4'-Triphenyi-bicyclo[5.I.O,'octadien-(2.5)-8-spiro-5'-cyclopentadien-(1'.3') (66). - Die Losung von 2.00 g (8.17 mMol) 5-Diuzo-1.2.3-triphenyl-cyclopentadien-(l.3) (5d) in 250 ccm Cycloheptatrien (frisch dest.) wurde entsprechend der allgemeinen Vorschrift beiichtet und aufgearbeitet. Das Rohprodukt wurde an 150 g Kieselgel mit Benzol/Petrolather (5 : 95) chromatographisch gereinigt. Das hellgelbe 6d wurde aus kher/Methanol umkristallisiert. Schmp. 150-151"; Ausbeute 0.70 g (29%). - IR-Spektrum: 2975, 1590, 1485, 1435, 758, 779 (Aromat), 698 cm-1 (C-C).
C30H24 (384.5) Ber. C 93.71 H 6.29 Gef. C 93.62 H 6.36
7-[1.4-Diphenyl-cyclopentiidrert-(1.3]-yl-(5)]-cyclohepptatrien-(1.3.5) (7e). - 2.00 g (6.79 mMol) 5-Diazo-I.4-diphenyl-cyclopentadien-(l.3) (Se) wurden in 250 ccm Cycloheptatrien unter den S. 70 angegebenen Bedingungen 1 Stde. beiichtet. Das Losungsmittel wurde bei 18" i. Vak. abgezogen und der Ruckstand an 150 g Kieselgei mit Benzol/Petrolather (5 : 95) chromatographiert. Die Fraktionen bis 580 ccm enthielten 7e, das aus hher/Methanol um- kristallisiert wurde. Schmp. 121 -122'; Ausbeute 1.13 g (45%).
CZ4HZo (308.4) Ber. C 93.46 H 6.54 Gef. C 93.40 H 6.68
Die Fraktion.cn von 900 - I210 ccm lieferten nach dem Eindampfen ein nicht kristallisieren- des 61, dessen NMR-Spektrum zeigte, daB es sich um 6e (S. 64) handelte.
12 H. Durr, R. Sergio und G. Scheppers Bd. 740
7-/1.2.3.4-Tetraphenyl-cyclapentadien-(1.3)-yl-(5)]-cycloheptatrien-(1.3.5) (7f). - 2.00 g (5.06 mMol) 5-Diazo-1.2.3.4-tetraphenyl-cyclopentadien-(l.3) (5f) wurden in 250 ccm Cyclo- heptatrien (frisch dest.) nach der allgemeinen Vorschrift (S. 70) 50 Min. belichtei. Nach Abzie- hen des Solvens i. Vak. wurde der Ruckstand an 150 g Kieselgel mit Benzol/Petrolather (10 : 90) chromatographiert: Die Frakfion van 1-420 ccm liefertc 10-40 mg (1 -2%) Tetraphenyl-cyclopenfadien (8f) vom Schmp. 175-176'. Dann folgten 0.72 g (36%) 7f. Schmp. 186-187" (aus Benzol/Methanol). - IR-Spektrum: 1605, 1495, 1445 (Aromat), 3030, 1505, 1408 (=C-H), 915 cm-1 (Ring-Schwingung). - NMR-Spektrum: T = 8.1 bis 7.8 (m), 5.42(d,3), 4.91 (dd, J = 9.5 und 5.5 Hz),4.2-3.8,3.7-3.4,2.88 und 2.77 imverhalt- n i s 1 : 1 : 2 : 2 : 2 : 1 0 : 1 0 .
C36H28 (460.5) Ber. C93.87 H 6.13 Gef. C 93.7 H 6.15
Bei mehrfach wiederholter Saulenchromatographie wie oben wurden noch 0.39 g (27 %) eines Isomeren unbekannter Struktur vom Schmp. 162 - 163' isoliert, das kein Additions- produkt ist.
C36H28 (460.5) Ber. C 93.87 H 6.13 Gef. C 93.8 H 6.10
Diels-Alder-Reaktion des 2'.3'-Diphenyl-inden-I'-spir0-8-bicyclo[5.1 .O]octadiens-(2.5) (6h) : Eine Losung von 0.50 g (1.43 mMol) 6b und 0.55 g (1.43 mMol) Tetraphen~l-cyclapentadie- nonz3) in 50 ccm Benzol wurdc 10 Stdn. unter RuckfluB gekocht. Nach Eiitfernen des Lo- sungsmittels blieb das orangerote 1 : I-Addukt 9 b zuriick, das aus Benzol/Methanol umkri- stallisiert wurdc. Schmp. 224-225"; Ausbeute 0.72 g (70 7:). - IR-Spektrum: 3030, 1610, 1495, 1450, 700 (Aromat), 1028 (Cyclopropan-Gerust), 1780 cm-1 ( C z O ) .
C57H420 (742.9) Ber. C 92.24 H 5.71 Gef. C 92.1 H 5.66
2'.3'.4'- Triphenyl-bicyclo[j.l.0]octan-8-spiro- 1'-cyclopentadien- (2'.4) (1Od). ~ 26 mg (0.067 mMol) 6d wurden in 5 ccm Essigester mit Pt02/H2 in einer Mikrohydrierapparatur, 5 Stdn. hydriert. Die Wasserstofl-Aufnahme betrug 3.15 ccm (2.1 MoljMol). Das Filtrat wurde eingedampft und der Ruckstand aus dthanol umkristallisiert. Ausbeute 21 mg (82%) farblose Kristalle vom Schmp. 167-168". - IR-Spektrum: Aromatische Banden wie bei 6d, 3030 (=C-H-), 2930, 2850 (CH2), 1008, 1035 cm-1 (Cyclopropan-Gerust).
5-Cycloheptyl-1.2.3.4-tetraphenyl-cyclopentadien-(1.3) (15 f). - a) Durch Hydrierung von 7f: lOOmg 7f (s. oben) wurden in lOOccm Essigestermit Pt02/H2 2Stdn. hydriert. Das Filtrat wurde eingedampft und der Ruckstand aus Benzol/Methanol umkristallisiert. Ausbeute 90 mg (90%) 15f; Schmp. 179-180". - IR-Spekbum: 2930, 2850, 1460 (CHz), 3030 cm (CH). - NMR-Spektrum: 7 = 8.9-8.3, 5.9-5.7, 2.95, 2.78 im Verhaltnis 13 : 1 : 10 : 10.
C36H34 (466.6) Ber. C 92.66 H 7.34 Gef. C 92.5 H 7.33
b) Durch Hydrierung von I.2.3.4-Tetraphenyl-5-cyclohepten(2) -yl-cyclopentadien- (1.3) (160 : I n einer Mikrohydrierapparatur wurden in Essigester als Solvens mittels PtOdHz 40.9 mg bzw. 41.4 mg 16f hydriert, wobei 80 bzw. 98% der fur die Absattigung einer Doppelbindung erforderlichen Menge Hz aufgenommen wurden. Nach der bei a) beschriebenen Aufarbeitung wurde 15f vom Schmp. 181 -182" erhalten; nach Mischprobe und IR-Spektrum identisch mit dem entsprechend a) erhaltenen Produkt.
23) W. Dilthey und E. Quint, J. prakt. Chem. [2] 128, 139 (1930).
1970 Photochemie kleiner Ringe, XX 73
2'.3'-Diphen~~l-inden-l'-spiro-I-bicyclo~3.3.O]octadien-(2.5~ (13 b). - Zur Thermolyse wurde die Losung von 1.00 g (2.86 mMol) 6b (S. 71) in 50 ccm Toluol 5 Stdn. unter RuckfluB gekocht. Hierbei trat Rotfarbung ein, was auf eine Zersetzung der Ausgangsverbindung hin- deutete. Der Endpunkt der Reaktion wurde am Verschwinden von 6 b im DC festgestellt. Nach Abdestillieren des Losungsmittels wurde der rote Ruckstand an 100 g Kieselgel mit Petrolither chromatographiert, 13 b isoliert und aus Ather/Methanol umkristallisiert. Schmp. 197-198"; Ausbeute 0.50 ~ ( 5 0 % ) . - IR-Spektrum: 696 (wagging-Schw.), 2925 cm 1 (CH2). - NMR-Spektrum: T = 2.5-3.1 (in),3.8-4.2(m),4.51 (dd, J = 10.5und2.5Hz),6.9(m),7.4(m) im Verhaltnis 14 : 2 : 2 : 2 : 2.
C28H22 (358.5) Ber. C93.81 H 6.19 Gef. C 93.5 H 6.12
Hydrierung von 13b: 12 mg (0.039 mMol) der Verbindung wurden unter Ruhren in 5 ccm Essigester gelost. Die Losung wurde mittels Proz in einer Mikrohydrierapparatur 6 Stdn. hydriert. Die Wassersrqf-Aufnahme betrug 2.96 ccm (1.97 Mol/Mol), d. h. 13b besitzt zwei olefinische Bindungen.
7.10-Diphenyl-sesquifulvalen (17e) und 2.5.6-Triphen~l-fulvalen (18e). - Die Losung von 0.80 g (2.6 mMol) 7e (S. 71) und 1.28 g (5.2 mMol) Chloranil in 100 ccm absol. CCl4 wurde 10 Stdn. unter RuckfluB gekocht, wobei R o t k b u n g eintrat. Nach dem Abkuhlen wurde filtricrt, die rothraune Losung mit 200 ccm Ather versetzt und mehrmals mit l0proz. Kali- lauge gewdschen. Sobald die wal3rige Phase farblos blieb, wurde die orangerote Atherphase mit Wasser neutral gewaschen und uber Na2S04 getrocknet. Das nach dem Eindampfen zuruckbleibende rote 01 wurde der Saulenchromatographie an 80 g Kieselgel mit Benzol/ Petrolather (20 : 80) unterworfen. Es wurden zwei rote Produkte, 18e und 17e nacheinander eluiert und durch priiparative Diinnschichtchromatographie gereinigt, bis Kristallisation eintrat. Ausbeute 48 mg (12%) 18e und 100 mg (25%) 17e. - NMR-Spektrum yon 18e: 'c = 2.4-2.7 (m), 3.20 (m), 3.62 (m) im Verhaltnis 15 : 2 : 1 ; von 17e: T = 2.4-2.8 (m), 3.19 (m) 3.28 (m), 3.65 (m), 4.18 (m) im Verhaltnis 10 : 2 : 2 : 2 : 2.
CzdHie (306.4) Ber. C 94.08 H 5.92 18e: Gef. C 94.4 H 5.61 17e: Gef. C93.91 H6.01
7.8.9.10-Tetraphenyl-sesqsi~ufulvalen (17f). ~ 0.30 g (1.92 mMol) 7 f (S. 72) und 0.47 (1.92
mMol) Chlornnil wurden nach Lit.11) dehydriert und aufgearbeitet. Man erhielt 140 mg (48 %) 17f vom Schmp. 249-250".
[39/701














![Reaktionen in der Cavity · Reaktionen in der Cavity Übergangsmetall -katalysierte Reaktionen mit konkaven 1,10 -Phenanthrolin -überbrückten Calix[6]arenen Dissertation](https://static.fdokument.com/doc/165x107/5ba0926309d3f259468d095a/reaktionen-in-der-cavity-reaktionen-in-der-cavity-uebergangsmetall-katalysierte.jpg)