Strahlung bei elektronischen Übergängen im Atom. Inhalt Emission und Absorption...
-
Upload
izaak-beck -
Category
Documents
-
view
104 -
download
2
Transcript of Strahlung bei elektronischen Übergängen im Atom. Inhalt Emission und Absorption...

Strahlung bei elektronischen Übergängen im Atom

Inhalt
• Emission und Absorption elektromagnetischer Strahlung bei Änderung in der Elektronenkonfiguration eines Atoms

Bohrsches Atommodell
r1
r2=4r1
r3=9r1
r4=16r1
E1=-13,6 eV
E2=-3,4 eV
E3=-1,5 eV
E1=-0,85 eV

1 J Kinetische Energie, Bahn n
1 JEnergieverlust bei Übergang von innerer Bahn n zu äußerer Bahn m
1 1/sFrequenz der emittierten elektromagnetischen Strahlung
Energie der Strahlung bei Bahnwechsel
2
2
20
4
8
n
Z
h
emE e
n
2222
0
42 11
8
mnh
emZh e
mn
2232
0
42 11
8
mnh
emZ emn

Einheit Anmerkung
1 1/s „Rydbergfrequenz“
1 1/sFrequenz der emittierten elektromagnetischen Strahlung
Energie der Strahlung bei Bahnwechsel
22215 11
103,29 mn
Zmn
15
320
4
1029,38
h
emR e
hEEE mn
Zur Anregung eines neuen elektronischen Zustands muss die Energie der elektromagnetischen Strahlung der Energiedifferenz zur Anregung des neuen Zustands entsprechen

1 1/sFrequenz der emittierten elektromagnetischen Strahlung
1 m Wellenlänge der Strahlung
Wellenlänge der Strahlung bei Bahnwechsel
2215 11
103,29 mnmn
mnmn v
c
1 1/sÜbergang von Bahn 2 zu 1 im Wasserstoff
1 mWellenlänge der Strahlung (erste Linie der „Lyman-Reihe“)
215
2
1
1
1103,29 mn
71022,1 mn
Beispiel:

Einheit Anmerkung
E= hν 1 JEnergie elektromagnetischer Strahlung
ν 1 1/sFrequenz der elektromagnetischen Strahlung
h = 6,63 10-34 1 JsPlancksches Wirkungsquantum
Energie elektromagnetischer Strahlung

Bohrs Atommodell: Wasserstoff mit Absorption und Emission elektromagnetischer Strahlung beim Übergang 2
1
r1
r2=4r1
E1=-13,6 eV
E2=-3,4 eV
n m
Anregung 1 2
ca. 10-8 s
Emission λ=121,6 nm

n m
Anregung 1 3
ca. 10-8 s
Emission 2 3
656,1nm
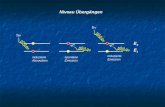
Strahlungsemission beim Übergang (132)
Anregung 13

m
H, n=1,m=2
121,6 nm
H, n=2,m=3
656,1 nm
H, n=3,m=4
1874,6 nm
Freie Atome: Einzelne, scharfe Linien

m
380 nmViolett
7,9 1014Hz780 nm
rot3,8 1014Hz
Technische Schwingkreise
Molekül-schwingungen
Valenz Elektronen
Innere Orbitale
Frequenzbereiche der Oszillatoren
Kern-reaktionen

m
60 kHz(Versuch)
2,5GHz Mikro-
wellenherd
50 Hz(Netz) Kosmische
Sekundär-Strahlung
50 kV Röntgen-strahlung
380 nmViolett
7,9 1014Hz780 nm
rot3,8 1014Hz
9 GHzCs Uhr
77,5 kHzDCF 77
H2 Linie
Position der Emissionslinie im elektromagnetischen Spektrum
7 cm kosmische
Hintergrundstrahung

Beispiel für die Emission an freien Atomen
Emissionsspektrum der Quecksilberdampflampe Quelle: Meyers Enzyklopädisches Lexikon

Emission der Sonne (analog zu einem heißen Festkörper)
Quelle: Meyers Enzyklopädisches Lexikon
„Weiße“ Strahlung der Sonne (an der Oberfläche ca. 6000 K)
(Vergessen Sie zunächst die schwarzen Linien)

Fraunhofer Linien im Sonnenspektrum
• Gasatome in der Atmosphäre der Sonne und der Erde werden durch die passenden Frequenzen im Sonnenspektrum angeregt
• Von der Erde aus betrachtet „fehlen“ diese Frequenzen im Sonnenspektrum
• Diese schwarzen Linien bezeichnet man als „Fraunhofer-Linien“
• Joseph von Fraunhofer (1787-1826) entdeckte sie 1814 zeitgleich mit William Hyde Wollastone (1766-1828)
Beispiel für die Absorption an freien Atomen:

Zusammenfassung
• Beim Wechsel der Bahn wird elektromagnetische Strahlung ausgesandt
• Die Energie der Strahlung bei Wechsel zwischen Bahnen mit Quantenzahlen m und m beträgt hν=Em-En

Formel-zeichen
Wert SI Einheit Anmerkung
e 1,60 10-19 1 C Elementarladung
1,05 10-34 1 JsPlancksches Wirkungsquantum
me 9,11 10-31 1 kgMasse des Elektrons
8,85 10 1 C2/Nm2 Feldkonstante
Konstanten
,
0