Bohrs Atommodell und Strahlung bei elektronischen Übergängen.
-
Upload
philipp-radeke -
Category
Documents
-
view
109 -
download
0
Transcript of Bohrs Atommodell und Strahlung bei elektronischen Übergängen.

Bohrs Atommodell und
Strahlung bei elektronischen Übergängen

Inhalt
• Bohrs Atommodell
• Änderung in der Elektronenkonfiguration eines Atoms– Emission und Absorption elektromagnetischer
Strahlung

Bohrs Atommodell• Elektronen kreisen als geladene, mechanische Objekte um den Kern
– Gleichgewicht zwischen Coulomb- und Zentrifugalkraft• Der Radius der Elektronenbahn ist konstant:
– Die Erklärung dafür erfordert die Erweiterung der klassischen Physik zur Quantenmechanik
Kern, Ladung Z e

Bohrs Atommodell• Elektronen kreisen als geladene, mechanische
Objekte auf Bahnen mit konstantem Radius um den Kern– Gleichgewicht zwischen Coulomb- und
Zentrifugalkraft– Aber: trotz beschleunigter Ladung werden keine
elektromagnetischen Felder aufgebaut/gesendet• Die Quantenbedingung für den Drehimpuls führt auf
diskrete, mit den Quantenzahlen n = 1, 2, 3, … nummerierbare Bahnen,
– kleinster Radius, „Bohr-Radius“, r1= 0,0529 nm
Zum Vergleich: Satelliten umkreisen die Erde auf beliebigen Bahnen

Energie eines Elektrons auf „Schale“ n
1 eVEnergie auf Bahn n für ein Atom mit Kernladung Z
1 eVE1 ist die Energie auf Bahn 1 des Wasserstoffatoms (Z=1)
eV 13,68
22
0
4
1
h
meE
2
2
1 n
ZEEn
Die Radien der Bahnen wachsen mit n2
Die Energie der elektronischen Zustände ist •proportional zum Quadrat der Kernladungszahl: ~ Z2
•umgekehrt proportional zum Quadrat der Quantenzahl der Bahn: ~1/n2
Detaillierte Rechnungen dazu: Atom_Bohr_mit_Berechnung_des_Bahnradius_10.pps Atom_Bohr_mit_Berechnung_der_Energie_10.pps

Energieeinheit „Elektronenvolt“
• Die Energie einzelner Elektronen wird in der Einheit „Elektronenvolt“ [eV] anstelle von „Joule“ [J] angegeben
• Die Energie „Ein Elektronenvolt“ wird einem Elektron bei Bewegung zwischen zwei Punkten mit der Potentialdifferenz von einem Volt zugeführt oder abgenommen
e = 1,60 ·10-19 C Ladung eines Elektrons
W = U·e = U ·1,60 ·10-19 J Arbeit bei Transport eines Elektrons zwischen zwei Punkten mit Potentialdifferenz U W = U·e = U ·1 eV
1 eV = 1,60 ·10-19 J Ein Elektronenvolt in Joule
Vorteil dieser Konvention: Auf atomarer Skala vermeidet man „winzige“ Zahlen

Bohrs Atommodell für Wasserstoff
r1
r2=4r1
r3=9r1
r4=16r1
E1=-13,6 eV
E2=-3,4 eV
E3=-1,5 eV
E4=-0,85 eV
Zur Bedeutung der Energie-Werte: Energie von 13,6 eV ist aufzuwenden, um ein Elektron aus der innersten Schale (Quantenzahl n=1) abzulösen, d.h. von dieser Bahn „ins Unendliche“ (wo der Atomkern keine Kraft mehr ausübt) zu transportieren

Absorption und Emission elektromagnetischer Strahlung
• Wechselt eine Elektron von einer Bahn m zu n, dann Bahnen wird elektromagnetische Strahlung– absorbiert falls m < n– emittiert falls m > n
• Aus der Energie-Erhaltung folgt:
Einheit
h·f = Em - En 1 eV
f ist die Frequenz der beim Übergang von Niveau m zu n absorbierten oder emittierten elektromagnetischen Strahlung
h = 4,1357 10-15 1 eVs Plancksches Wirkungsquantum

Wellenlänge der am Übergang beteiligten Strahlung
1m
λmn ist die Wellenlänge der beim Übergang von Niveau m zu n absorbierten oder emittierten elektromagnetischen Strahlung
RH = 1,10·107 1m-1 Rydbergkonstante für das H Atom
22
22
2
1
nm
mn
RZ Hmn
Diese Angabe gilt streng nur für Wasserstoff ( Z = 1 ) und - mit abnehmender Genauigkeit mit zunehmendem Z -für „Wasserstoff-ähnliche“ Atome mit einem Elektron in der äußeren Schale. Für andere, schwere Atome liefert sie trotz ihres einfachen Aufbaus –immerhin- die Größenordnung der Strahlung
λ ~ 1/Z2 zeigt die mit zunehmender Ladungszahl schnell abnehmende Wellenlänge

Das Periodensystem der Elemente
•Link zum Periodensystem: http://www.chemicool.com/
Kernladungszahl Z=29

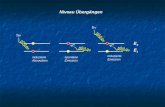
Absorption und Emission elektromagnetischer Strahlung bei Bahnwechsel
“Anregung” des Elektrons und Rückkehr nach der “mittleren Lebensdauer” (etwa 10-8 s) unter Strahlungs-Emission auf das Ausgangs Niveau
Die Farben der Pfeile zeigen –qualitativ- die mit zunehmender Energiedifferenz der am Übergang beteiligten Schalen zunehmende Energie der Photonen

Energie der Strahlung bei Bahnwechsel
Springt ein Elektron von einer kleineren Bahn (n) auf eine größere Bahn (m), dann wird Energie aufgenommen.
Zur Energie-Aufnahme gibt es zwei Möglichkeiten
1. Zufuhr der Energie aus elektromagnetischer Strahlung bei Absorption eines Photons
• E = h · f [eV]
2. Zufuhr mechanischer Energie bei einem „Stoß“
• E = m/2 · v2 [eV]
Die aufgenommene Energie ist Differenz der Energien zwischen den Schalen m und n

Wasserstoff mit Absorption und Emission elektromagnetischer Strahlung beim Übergang 2 1
n m
Anregung 1 2
ca. 10-8 s
Emission λ=121,6 nm
E1=-13,6 eV
E2=-3,4 eV
Diese Strahlung liegt im UV-Bereich

Anregung des Atoms durch Stoß
n m
Anregung 1 2
ca. 10-8 s 1 2
Emission λ=121,6 nm
E1=-13,6 eV
E2=-3,4 eV
Diese Strahlung liegt im UV-Bereich

m
2,5GHz Mikro-
wellenherd
50 Hz(Netz)
77,5 kHzDCF 77
Einige besonderen Frequenzen und Bereiche im elektromagnetischen Spektrum
7 cm kosmische
Hintergrundstrahung
H, n=1,m=2
121,6 nm

n m
Anregung 1 3
ca. 10-8 s
Emission 2 3
656,1nm
Strahlungsemission im Wasserstoff beim Übergang (32) (Hα Linie bei 656 nm)
Hα = 656 nm
1
2
3

Wasserstoff Linien im Sichtbaren bei Übergängen zur Schale 2
Hα = 656 nm Hβ = 486 nm Hγ = 434 nm
n=4 n=5n=3
„Balmer Serie“ des Wasserstoffatoms f = R·(1/22-1/n2)
m=2 m=2 m=2

m
50 Hz(Netz)
Einige besondere Frequenzen und Bereiche im elektromagnetischen Spektrum
H, m=2,n=3
656,1 nm
H, m=2,n=4
486 nm
H, m=2,n=5
434 nm

Versuch
• Wasserstoff-Spektrum einer Entladungslampe
• Betrachtung mit Prisma
• oder Gitter-Folie, Typ „Rainbow Peephole“

Zusammenfassung• Bohrs Modell: Elektronen kreisen als geladene, mechanische
Objekte auf diskreten Bahnen um den Kern. Für ein Elektron auf Bahn n = 1,2,… gilt:– Der Drehimpuls ist quantisiert: J = n · h– Bei Kernladungszahl Z ist die Energie des Elektrons : En = E1 · Z2 / n2 ,
E1 = 13,6 [eV]
• Beim Wechsel der Bahn wird entweder mechanische Energie zugeführt oder elektromagnetische Strahlung absorbiert oder emittiert
• Die Frequenz der Strahlung bei Übergang von einer Bahn mit Quantenzahlen m zu n beträgt
fmn= 3,29·1015 ·Z2·(1/n2-1/m2) [Hz]
die Wellenlänge λmn = c / fmn [m]• Detaillierte Rechnungen zu Bahnradien / Energie-Werten:
Atom_Bohr_mit_Berechnung_des_Bahnradius_10.pps Atom_Bohr_mit_Berechnung_der_Energie_10.pps

Bohrs Atommodell für Z=4, Be
Gesamt-Drehimpuls 0 wird durch den Drehsinn der Elektronen erreicht : J =-1+2+3-4

Formel-zeichen
Wert SI Einheit Anmerkung
e 1,60 10-19 1 C Elementarladung
1,05 10-34 1 JsPlancksches Wirkungsquantum
me 9,11 10-31 1 kgMasse des Elektrons
RH 1,10·107 1m-1 Rydberg-Konstante
Konstanten
,
• Link zum Periodensystem: http://www.chemicool.com/• Link zu Tabellen der Chemie: http://webbook.nist.gov/chemistry/