Casestudy„Lundbeck“ | Die Infocenter-Kampagne „Behandlung von Erkrankungen des ZNS im Fokus“
8 ZNS Skript+Praktikum-Anleitung 2009Ri-2 · Das Rückenmark (Medulla spinalis) stellt die...
Transcript of 8 ZNS Skript+Praktikum-Anleitung 2009Ri-2 · Das Rückenmark (Medulla spinalis) stellt die...
Autoren: Corinne Breit, David Conrad, Katja Rieck, PD Dr. Elmar Krause, Prof. Dr. Jens Rettig
In diesem Praktikumteil werden im Wesentlichen zwei Aspekte des ZNS behandelt. Dabei geht es zum einen um das Erfassen kortikaler Neuronenaktivität mit dem Elektroenzephalo-gramm (EEG). Zum anderen werden Versuche zur Hautsensibilität angestellt. Das vorliegende Skript liefert nicht nur die theoretischen Grundlagen für die Praktikums-aufgabe, sondern versucht, das ZNS in seiner Gesamtheit zu beschreiben. Dennoch kann dieses Skript das Studium eines Lehrbuchs keinesfalls ersetzen. Es kann aber helfen, die theoretischen Schwerpunkte des Praktikums zu erkennen. Es sei ausdrücklich darauf hinge-wiesen, dass das Skript sich nicht am Gegenstandskatalog ihres Studienganges orientiert sondern ausschließlich an den theoretischen Anforderungen des Praktikums. Wir möchten darauf hinweisen, dass in diesem Skript das vegetative Nervensystem keinerlei Berücksichtigung findet. Bitte machen sie sich Informationen darüber selbst zugänglich. Außerdem werden sie dieses Skript kaum verstehen können, ohne den Praktikumsteil "Nerv" durchgearbeitet zu haben. Aus diesem Praktikumsteil ist vor allem das Verständnis der neuronal-zellulären Prozesse wichtig. Weiterhin finden Sie viele Aspekte, die das Nerven-system betreffen in den Praktikumsteilen "Muskel" (Motorik) und "Hören, Sehen, Gleich-gewicht" (Sensorik). Gliederung:
• Einleitung neuronale Grundprozesse
• Aufbau des ZNS a. Rückenmark b. Gehirn
• Funktionen des peripheren und zentralen Nervensystems a. allgemeine Sinnesphysiologie b. somatoviszerale Sensibilität und Schmerz c. Motorik d. Integrative Funktionen des ZNS
• Pathophysiologische Aspekte des ZNS
• Praktikumsanleitung zur Aufgabe „ZNS“
Z N S
ZNS 21. Einleitung Der Begriff Nervensystem (lat. Systema nervosum) bezeichnet die Gesamtheit aller Nerven-zellen in einem Organismus und beschreibt, wie diese angeordnet und miteinander verbunden sind. Es hat die Aufgabe, Informationen über die Umwelt und den Organismus aufzunehmen, zu verarbeiten und Reaktionen darauf zu veranlassen, um möglichst optimal auf Veränder-ungen zu reagieren. Unser Körper besitzt ein sehr komplexes Netzwerk aus Nervenzellen (ca. 1011 Neurone). Die Komplexität kommt dadurch zum Ausdruck, dass jede Nervenzelle mit etwa 1000 anderen Nervenzellen in Verbindung steht. Anatomisch wird das Zentralnervensystem (ZNS, siehe unten) vom peripheren Nervensystem unterschieden. Das periphere Nervensystem mit seinen afferenten und efferenten Nerven-fasern zieht vom ZNS zu den Erfolgsorganen. Afferenzen tragen dabei sensorische Signale unterschiedlichster Art in Richtung ZNS, während Efferenzen den umgekehrten Weg beschreiben und Signale vom ZNS zum Erfolgsorgan leiten. neuronale Grundprozesse Den funktionellen Baustein unseres Nervensystems stellt das Neuron dar, welches aus dem Zellleib (Soma = Perikaryon), Ausläufern (Dendriten und Axone) und den Synapsen besteht. Die enorme Komplexität des ZNS ergibt sich aus der Menge der Zellen und der Anzahl ihrer Verbindungen untereinander. Die zellulären Grundprozesse, die den höheren Funktionen des ZNS zu Grunde liegen, bestehen aus wenigen Mechanismen, die relativ gut verstanden sind. Dazu gehören: -- Aktionspotenzialbildung und -weiterleitung (siehe hierzu das Praktikum "Nerv") -- Neurotransmitterbildung und -freisetzung (siehe hierzu das Praktikum "Nerv") -- Exzitatorische (EPSP) und inhibitorische postsynaptische Potenziale (IPSP)
Elsevier GmbH, Urban & Fischer Verlag, Deetjen, Speckmann, Hescheler: Physiologie 4. Aufl. 2004
ZNS 3 Synaptische Eingänge können in Nervenzellen zu unterschiedlichen Reaktionen führen. Je nachdem, ob ein präsynaptischer Neurotransmitter in der nachfolgenden Zelle zur Depolarisation (= Erregung) oder Hyperpolarisation (= Inhibition) führt, spricht man von EPSPs oder IPSPs. Bei mehreren vorgeschalteten Neuronen entscheidet dann die Summe aus IPSPs und EPSPs ob ein Aktionspotenzial in der postsynaptischen Zelle entsteht (siehe nächsten Punkt) -- räumliche und zeitliche Summation
Elsevier GmbH, Urban & Fischer Verlag, Deetjen, Speckmann, Hescheler: Physiologie 4. Aufl. 2004 Unter Summation versteht man die Tatsache, dass sich mehrere unterschwellige Reize zu einem überschwelligen Reiz addieren. Dabei unterscheidet man zeitliche und räumliche Summation. Letztere zeichnet sich dadurch aus, dass die einzelnen Impulse von unter-schiedlichen Neuronen mehr oder weniger zeitgleich die Zielzelle erreichen. Die zeitliche Summation hingegen meint, dass in jedem Neuron eintreffende Signale mit einer bestimmten Zeitkonstante abfallen. Treffen mehrere Signale kurz hintereinander ein, so können sich diese in Ihrer Wirkung "zeitlich" summieren. -- synaptische Plastizität
Elsevier GmbH, Urban & Fischer Verlag, Deetjen, Speckmann, Hescheler: Physiologie 4. Aufl. 2004
ZNS 4 Synaptische Plastizität ist ein Begriff, der die aktivitätsabhängige Änderung der Stärke der synaptischen Übertragung beschreibt. Die Effizienz, mit der Erregung von einer Prä- auf eine Postsynapse übertritt ist also nicht festgelegt, sondern kann sich ändern. Je nach Dauer der synaptischen Veränderungen nach einer bestimmten Form der synaptischen Aktivierung unterscheidet man zwischen kurzzeitiger und lang andauernder Plastizität (short-term plasticity und long-term plasticity). Die Verstärkung der synaptischen Übertragung durch synaptische Plastizität bezeichnet man als Potenzierung, die Abschwächung als Depression. Je nach Dauer spricht man von Langzeit-Potenzierung (long-term potentiation, LTP), Kurzzeit-Potenzierung (short-term potentiation, STP), Langzeit-Depression (long-term depression, LTD) und Kurzzeit-Depression (short-term depression, STD). Synaptische Plastizität ist deshalb von großem Interesse, da sie als ein möglicher neurophysiologischer Mechanismus für Lernprozesse und Gedächtnis gilt. -- Divergenz und Konvergenz
Elsevier GmbH, Urban & Fischer Verlag, Deetjen, Speckmann, Hescheler: Physiologie 4. Aufl. 2004 Für die Ausbreitung in Neuronenverband ist Art der Verschaltung zwischen Neuronen (Anzahl der Verbindungen zu anderen Neuronen, Synapsenstärke, hemmende oder erregende Synapse usw.) wichtig. Divergenz bedeutet, dass die Impulse ausgehend von einem Neuron über mehrere Kollaterale weitere Neurone erregen, welche wiederum die betreffende Information über ein Netzwerk von Ausläufern auf weitere Neurone übertragen können. Konvergenz beschreibt das Phänomen des „Zusammenlaufens“ mehrerer Informationsimpulse auf ein Neuron, wie es bspw. typisch für die α–Motoneurone des Rückenmarks ist. -- Vorwärts- und Rückwärtshemmung Vorwärtshemmung bedeutet, dass über eine inhibitorische Synapse die Zielzelle gehemmt wird, wohingegen bei der Rückwärtshemmung (= rekurrente Hemmung) die Zielzelle über eine hemmende Synapse "ihre" aktivierende Zelle inhibiert. Auf Rückenmarksebene nennt man diese inhibitorischen Interneurone "Renshaw–Zellen"; sie hemmen mittels des Neurotransmitters Glycin die α–Motoneurone. -- laterale Hemmung (Inhibition) (siehe Praktikumsteil Auge)
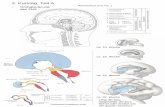
ZNS 5 -- Bahnung (Faszilitation) und Entbahnung (Disfaszilitation) Bahnung beschreibt das Phänomen, dass eine wiederholte Erregung bestimmter Nerven-bahnen den Wirkungsgrad von Reizen gleicher Stärke erhöht und/oder eine Erregung dieser Nervenbahn schon auf Grund schwächerer Reize ermöglicht wird. Eine einmal festgelegte Bahn kann unterbrochen werden (Entbahnung), indem entweder die Synapsenstärken in der Bahn sich ändern (siehe synaptische Plastizität) oder indem hemmende Neurone eine Bahn beeinflussen. 2. Aufbau des ZNS Beim Menschen fasst man mit dem Begriff "ZNS" Gehirn und Rückenmark zusammen und grenzt es gegen das periphere Nervensystem ab, das aus den Fortsätzen der motorischen oder sensiblen Neuronen des ZNS besteht. Zusammenfassend gehört alles das zum ZNS, was von den Hirnhäuten umschlossen wird. Diese strenge anatomische Gliederung des Nervensystems wird den Ansprüchen einer physio-logischen Betrachtung allerdings nicht immer gerecht. Deshalb werden im folgenden Skript die afferenten und efferenten Nerven (Anteile des peripheren Nervensystems) an ver-schiedenen Stellen (z.B. bei der Betrachtung von Sensibilität und Motorik) mit besprochen. a.) Rückenmark Das Rückenmark (Medulla spinalis) stellt die Verbindung zwischen intrakraniellem ZNS und peripherem Nervensystem dar und liegt, umhüllt von den Meningen, im Canalis vertebralis. Kranial grenzt das Rückenmark an die Medulla oblongata (anatomische Grenze: Decussatio pyramidalis) und endet kaudal beim Erwachsenen ungefähr auf Höhe von L1/L2 mit dem Conus medullaris. Das Rückenmark gliedert sich insgesamt in 31 Segmente: 8 Zervikalsegmente (C1–C8), 12 Thorakalsegmente (Th 1–Th 12), 5 Lumbalsegmente (L1–L5), 5 Sakralsegmente (S1–S5) und meist 1 Cokzygealsegment (Co 1). Daraus entspringen 31 Spinalnervenpaare, wobei der erste Spinalnerv zwischen dem Os occipitale und C1 entspringt. Der jeweilige Spinalnerv entsteht durch Vereinigung der Radix dorsalis (dorsolateral, afferent/sensibel) und der Radix ventralis (ventrolateral, efferent).
Im Querschnitt gliedert sich das Rückenmark in die schmetterlingsförmige graue Substanz (Substantia grisea, die aus Nervenzellkörpern besteht (>Reflexverschaltungen etc.) und die umgebende weiße Substanz (Substantia alba), die die Nervenfasern (auf – und absteigende Bahnen) enthält. Des Weiteren unterscheidet man im Querschnitt ein Vorderhorn (Cornu anterior), ein Hinterhorn (Cornu posterior) und im Thorakalbereich ein Seitenhorn (Cornu lateralis), welches v.a. die vegetativen Nervenzellen des Sympathikus enthält. Auf beiden Seiten lassen sich drei Stränge voneinander abgrenzen: 1. Paramedian der Fissura mediana ant. der Vorderstrang (Funiculus anterior); 2. paramedian des Septum medianum post. der Hinterstrang (Funiculus posterior); 3. dazwischen der Seitenstrang (Funiculus lateralis). Abbildung aus Wikipedia
ZNS 6 Als Besonderheit lassen sich am Rückenmarksstrang zwei Verdickungen ausmachen, die Intumescentia cervicalis (C4 – Th1) und lumbalis (Th10 – Th12). Diese entstehen dadurch, dass sich dort besonders viele α–Motoneurone für die motorische Innervation der oberen und unteren Extremität befinden. Funktion des Rückenmarks ist die Verbindung des Gehirns mit den efferenten und afferenten Nerven der Peripherie. Dazu verlaufen innerhalb des Rückenmarks aufsteigende (sensible) und absteigende (motorische) Bahnen. Außerdem werden in der grauen Substanz des Rückenmarks motorische Reflexe generiert (siehe Praktikum "Muskel"). Folgende Abbildungen geben einen Überblick über die wichtigsten Kerne der grauen Substanz und die wichtigsten Bahnen in der weißen Substanz.
Kerne der grauen Substanz: aus Wikipedia
Bahnen der weißen Substanz Abbildung aus Wikipedia
ZNS 7 b.) Gehirn Als Gehirn (Hirn, lateinisch cerebrum) bezeichnet man den im Kopf gelegenen Teil des Zentralnervensystems (ZNS) der Wirbeltiere. Es liegt geschützt in der Schädelhöhle, wird umhüllt von der Hirnhaut und besteht aus Nervengewebe und Glia. Das menschliche Gehirn kann in 4 Hauptbereiche untergliedert werden. Es handelt sich um die Bereiche Großhirn, Kleinhirn, Zwischenhirn und Hirnstamm. Aufbau und Funktion dieser Bereiche sollen im Folgenden kurz besprochen werden.
1.) Großhirn mit Basalganglien Das Großhirn (Cerebrum) ist der größte Hirnabschnitt. Es besteht aus den beiden halbkugel-förmigen Großhirnhälften (Hemisphären) und den darunter liegenden (subkortikalen) Kernen (Basalganglien). Die beiden Hemisphären beider Seiten sind durch drei Querbahnen (Kommissuren) miteinander verbunden:
• Corpus callosum (Balken) • Commissura rostralis • Commissura fornicis
Der oberflächliche Teil der Hemisphären ist der Kortex (Hirnrinde). Oft wird synonym dafür der Begriff Pallium (Hirnmantel) verwendet. Die Großhirnrinde lässt sich in fünf bis sechs Hirnlappen einteilen. Vier davon liegen an der Oberfläche (siehe Bild), der Insellappen und der limbische Lappen, liegen von außen verborgen. Frontaler Kortex: → motorische Zentren in und um den Gyrus präcentralis; in den rostralen
Abschnitten liegt der präfrontale Kortex, der für Handlungsplanung und –initiierung zuständig ist. Außerdem spielt er eine entscheidende Rolle für die Ausbildung der Persönlichkeit.
Parietaler Kortex: → primäre sensible Zentren (Gyrus postcentralis) Temporaler Kortex: → Hörzentrum Okzipitaler Kortex: → Sehzentrum
Aufbau des Gehirns Abb. aus Wikipedia
ZNS 8 Werden in die Betrachtung der Großhirnrinde nicht nur makroskopische Aspekte sondern auch der zytologische Aufbau der Rindenschicht berücksichtigt, bzw. funktionelle Aspekte in die Betrachtung einbezogen, kommt man zu unterschiedlichen Einteilungen der Rindenregion. Dabei ist die Einteilung in so genannte "Brodman-Areale" gängig und nach der Zytologie des Kortex entstanden. Die Einteilung in assoziative, motorische und sensorische Rindenfelder hingegen betont den funktionellen Aspekt.
Elsevier GmbH, Urban & Fischer Verlag, Deetjen, Speckmann, Hescheler: Physiologie 4. Aufl. 2004
Wie bereits beschrieben, erfolgt die Einteilung in Brodmann Areale nach dem zytologischen Aufbau des Kortex. Generell ist der Kortex in 6 zelluläre Schichten gegliedert. Allerdings ist die Dicke bzw. Zelldichte innerhalb der Schichten sehr unterschiedlich. Von außen nach innen treten folgende Schichten auf:
- I. Stratum moleculare: zellarm, faserreich (vereinzelte Interneurone) - II. Stratum granulosum externum: v.a. kleine bedornte Sternzellen - III. Stratum pyramidale externum: kleinere Pyramidenzellen - IV. Stratum granulosum internum: in dieser Schicht liegen die größeren primär
afferenten bedornten Sternzellen, die Projektionen aus anderen Hirnarealen (v.a. Thalamus) enthalten; diese Schicht ist in der Hör-, Seh-, und sensiblen Rinde besonders stark ausgeprägt, während sie in motorischen Rindenfeldern praktisch völlig fehlt (agranulärer Kortex)
ZNS 9- V. Stratum pyramidale internum: Sitz der großen Pyramidenzellen, die aus der
Hirnrinde herausprojizieren (diese Schicht ist im granulären Kortex kaum vertreten)
- VI. Stratum multiforme: viele verschiedene Zelltypen; Pyramiden- und bedornte Sternzellen
Funktionen von Großhirn und Kortex: Der Kortex ist Ursprung aller bewussten und vieler unbewussten Handlungen, Sammelstation aller bewussten Sinneseindrücke, Sitz des Gedächtnisses und vieles mehr. Die eingehenden Informationen gelangen über den Thalamus zum sensorischen Kortex. In den sensorischen Arealen werden die Afferenzen der Sinnesorgane verarbeitet und dort findet der entscheidende Schritt des Bewusstwerdens statt. In den sekundär sensorischen Rindenteilen findet die Weiterverarbeitung statt. Die Information erreicht in den sensorischen Bahnen die Hirnrinde über eine Neuronenkette aus wenigen Gliedern: 1. primär afferentes 2. sekundäres 3. thalamisches und kortikales Neuron.
Vom motorischen Kortex entspringen die entscheidenden Bahnen der Willkürbewegung zu den Hirnnervenkernen und ins Rückenmark zu den Motoneuronen. Der primär motorische Kortex, aus dem die Efferenzen die Hirnrinde verlassen (kortikospinale Bahnen), leitet die Durchführung der Bewegung ein. Ihm vorgeschaltet sind supplementär-motorische Areale und die prä-motorische Rinde. Der supplementär-motorische Kortex spielt eine Rolle beim Erlernen von Handlungsabläufen und bei der Vorbereitung komplexer Bewegungsmuster. Der prämotorische Kortex erstellt Bewegungsentwürfe und stimmt sie mit Kleinhirn und Basal-ganglien ab. Auch das für die Sprachproduktion wichtige Broca-Areal ist Teil der prä-motorischen Rinde. Der kortikospinale Trakt kommt nicht nur aus motorischen, sondern auch aus sensorischen Kortexgebieten (30 % aus Area 4, 30 % aus Area 6, 40 % aus dem parietalen Kortex u.a. Areae 1, 2 und 3). Sowohl bei der primär motorischen Rinde als auch bei der primär sensorischen Rinde liegt eine sogenannte Somatotopie vor, d.h. benachbarte Regionen des Körpers liegen auch in ihren Repräsentationen auf der Hirnrinde nebeneinander. Somit wird der Körper verkleinert und Kopf stehend als "Homunculus" abgebildet. Allerdings sind die Proportionen verzerrt, da bestimmte Körperbereiche feiner abgestimmt werden und somit einem größeren Rindenareal entsprechen.
ZNS 10
Neben den sensorischen und motorischen Kortizes nehmen die sogenannten Assoziations-areale den größten Raum im Kortex ein. Die drei wichtigsten Areale sind:
- frontaler Assoziationskortex: Sitz der Persönlichkeit - limbischer Assoziationskortex: zusammen mit subkortikalen Strukturen wie Hippo-
kampus und Amygdala zuständig für die Entstehung von Emotionen; außerdem hat der temporale Teil wesentlichen Anteil an Lernprozessen » Entfernung beider Temporallappen führt zu lebenslanger anterograder Amnesie
- parieto-temporo-okzipitaler Assoziationskortex: sensorische Aufgaben, Sprache, Intelligenz; weist ein hohes Maß an Seitenasymmetrie auf. rechts und links unter-schiedliche Grundfunktionen:
Dominante (linke) Hemisphäre
Abstraktion Sprache rationales Handeln
Intellektualität
Subdominante (rechte) Hemisphäre
Konkretion Räumlich-virtuelles Vorstellungsvermögen
Emotionalität Intuition
2.) Kleinhirn
Beim Kleinhirn bezeichnet man, wie beim Großhirn, die nach außen gewandte, nervenzellhaltige Schicht als Rinde (Kortex), die im inneren liegende weiße Substanz (nur Faserverbindungen, keine Zellleiber) als Mark (Medulla). Im Mark vorhandene Ansamm-lungen von Nervenzellen heißen "Kerne".
Die Rinde lässt sich in drei Schichten einteilen, die jeweils eine charakteristische Auswahl von fünf verschiedenen Zelltypen enthalten:
• Molekularschicht, Stratum moleculare, ganz außen o Sternzellen (GABAerg, inhibitorisch) o Korbzellen (GABAerg, inhibitorisch)
• Purkinjezellschicht, Stratum purkinjense
ZNS 11
o Purkinjezellen (GABAerg, inhibitorisch) • Körnerschicht, Stratum granulosum, nach innen
o Körnerzellen (Glutamaterg, erregend) o Golgizellen (GABAerg, inhibitorisch).
Die Aufgabe des Kleinhirns ist vor allem eine Feinabstimmung der Motorik, sprich eine Hemmung überschwänglicher "Grobmotorik". Die Informationen über den Bewegungsplan werden der Kleinhirnrinde über die Kletter- und Moosfasern aus dem Kortex zugeleitet. Die Ergebnisse der Kleinhirnarbeit werden über die Projektionen der Kleinhirnkerne aus dem Kleinhirn herausgeleitet.
3.) Zwischenhirn mit Thalamus, Hypothalamus, Hypophyse
Das Zwischenhirn (Diencephalon) schließt sich anterior dem Mesencephalon (Mittelhirn, siehe nächsten Abschnitt) an. Es umschließt auf beiden Seiten den 3. Ventrikel.
Aufgrund funktioneller Unterschiede kann es in folgende Strukturen eingeteilt werden: • Thalamus • Epithalamus • Subthalamus • Hypothalamus/Hypophyse • Metathalamus
Der Thalamus bildet den größten Anteil des Zwischenhirns. Er setzt sich aus vielen Kerngebieten zusammen, die eine besonders starke Verbindung zur gesamten Großhirnrinde aufweisen. Im Thalamus werden sensible und sensorische Impulse aus der Peripherie gesammelt und nach Filterung an die Großhirnrinde weitergegeben ("Tor zum Bewusstsein"). Zur Erfüllung dieser Aufgabe gibt es eine Reihe von relevanten Kerngebieten:
Kern Afferenz Efferenz Funktion Ncl. ventralis anterior Basalganglien zum prämotorischen
Kortex Verarbeitung von Bewegungsentwürfen
Ncl. ventralis lateralis Cerebellum, Ncl. ruber zum motorischen Kortex Weiterleitung motorischer Informationen des Cerebellums
VPL Ende des lemniscus medialis und Tractus spinothalamicus
zum sensiblen Kortex Umschaltung und Filterung protopath. und epikritischer Faserbahnen
VPM Somatosensorik des Kopfes (Trigeminus)
zum sensiblen Kortex Umschaltung und Filterung
CGL (corpus geniculatum laterale)
Tractus opticus Radiatio optica zur Area striata
Teil der Sehbahn
CGM (corpus geniculatum mediale
Colliculi inferiores Zur primären Hörrinde Teil der Hörbahn
Ein weiterer wichtiger Anteil des Zwischenhirns ist der Hypothalamus mit der anhängenden Hypophyse (die nicht Teil des Gehirns ist). Der Hypothalamus ist die wichtigste Regelstelle der vegetativen Funktionen des Körpers. Er koordiniert das Zusammenspiel zwischen vegetativem Nervensystem und hormonellem System über die Hypophyse.
ZNS 12 4.) Hirnstamm Hierzu gehören: Mesenzephalon, Medulla oblongata und Pons mit den für die Motorik wichtigen Kerngebieten: Ncl. ruber, mediale und laterale Teile der Formatio reticularis, sowie die Vestibulariskerne. Die Afferenzen hauptsächlich aus Motorkortex, Kleinhirn, Propriozeptoren des Halses und Gleichgewichtssystem, ebenso wie die Efferenzen, die als Traktus ins Rückenmark proji-zieren, lassen den Hirnstamm wichtige Aufgaben der Stützmotorik und Anpassung der Motorik an aktuelle Situationen übernehmen. Darüber hinaus befinden sich in der Medulla oblongata wichtige vegetative Steuerzentren für Blutkreislaufs, der Atmung und für den Nies- Husten-, Schluck- und Saugreflex sowie des Erbrechens.
Urban & Fischer; Golenhofen, Physiologie, 3. Aufl. 2004
3. Funktionen des peripheren und zentralen Nervensystems Viele Funktionen des ZNS sind bei der Besprechung des Aufbaus des ZNS bereits ange-sprochen worden. Im folgenden Kapitel sollen einige Aspekte des ZNS vertieft werden. Außerdem wird die theoretische Grundlage des zum peripheren Nervensystem gehörenden sensorischen Systems beschrieben. a) Allgemeine Sinnesphysiologie (Sensorik) Sinnesrezeptoren (= Sensoren) ermöglichen es, Reize aus der Umwelt aufzunehmen und auf unterschiedlichste Art und Weise zu verarbeiten. In Bezug auf Sensoren unterscheidet man adäquate und inadäquate Reize: Adäquate Reize sind solche, die einen Sensor optimal erregen; inadäquate hingegen führen ebenfalls zu einer Erregung, jedoch ist die Reizschwelle höher. Nach der Art der adäquaten Reize unterscheidet man Thermo-, Photo-, Mechano- und Chemosensoren. Schmerzrezeptoren (Nozizeptoren) sind polymodale Sensoren, d.h., sie sprechen auf alle genannten Reizarten an, wenn sie nur stark genug sind.
ZNS 13 Eine weitere Klassifikation erfolgt anhand der Reizstärke und der Änderung der Reizstärke pro Zeiteinheit. Man unterscheidet:
• Proportionalfühler/Intensitätssensoren: Sie registrieren sowohl die Amplitude als auch die Dauer des Reizes und adaptieren langsam (sog. tonische Sensoren).
• Differenzialfühler/Geschwindigkeitssensoren: Sie reagieren überproportional auf die Änderung des Reizes, detektieren die Geschwindigkeit der Reizänderung und die Dauer und adaptieren schnell (sog. phasische Sensoren).
• PD–Sensoren (Mischform): Sie reagieren sowohl auf Reizintensität als auch auf Reizänderungen. Auf konstante Reize reagieren sie mit einer der Intensität proportionalen Impulsfrequenz; bei zu– oder abnehmender Reizstärke kommt es zu einer entsprechenden zu– oder abnehmenden Impulsrate.
Weiterhin können Sinnesrezeptoren schnell (phasische Sensoren syn. FA–Sensoren (fastly adapting)) oder langsam (tonische Sensoren syn. SA–Sensoren (slowly adapting)) adaptieren. Der Begriff der Adaptation beschreibt in der Sinnesphysiologie die Gewöhnung an einen Dauerreiz (daran sind v.a. die Rezeptoren selbst beteiligt). Von der Adaptation verschieden ist die Habituation, welche v.a. auf zentralnervöse Vorgänge zurückzuführen ist. Außerdem erfolgt eine Differenzierung in primäre und sekundäre Sinneszellen:
• Primäre Sinneszellen zeichnen sich dadurch aus, dass sie ein eigenes Axon besitzen, also in der Lage sind, Aktionspotenziale zu generieren. Bsp.: Geruchsrezeptoren, Rezeptoren der somatoviszeralen Sensibilität
• Sekundäre Sinneszellen können nur Rezeptorpotenziale ausbilden, die nachfolgend in Aktionspotenziale übersetzt werden müssen. Deshalb sind sie durch eine chemische Synapse mit ihrer afferenten Nervenfaser verbunden. Bsp.: Rezeptoren des Innenohrs
Reiztransduktion und Reiztransformation: Im Zuge einer adäquaten Reizung eines Rezeptors entsteht ein sog. Rezeptorpotenzial. Reiztransduktion bedeutet also Umsetzung eines Reizes in ein rezeptoreigenes Signal. Rezeptorpotenziale besitzen im Gegensatz zu Aktionspotenzialen keine Schwelle und keine Refraktärzeit. Sie können sowohl durch De– als auch durch Hyperpolarisation erzeugt werden, und es ist eine Summation von Impulsen möglich. Dabei ist die Höhe der Reizung proportional zu der Amplitude des Rezeptorpotenzials (Amplitudenmodulation). Nachfolgend wird das Rezeptorpotential in Aktionspotenziale mit frequenter Abfolge umgewandelt. Hierbei wird die Höhe des Rezeptorpotenzials proportional zu der Frequenz der ausgelösten Aktionspotenziale umkodiert (Frequenzmodulation). Dieser Prozess wird als Reiztransformation bezeichnet. Ein rezeptives Feld ist als das Gebiet definiert aus dem Rezeptoren Signale an ein einziges nachgeschaltetes Neuron weitergeben.
ZNS 14 Absolut - und Unterschiedsschwelle: Absolutschwelle: die Intensität, die ein Reiz haben muss, um gerade noch
empfunden zu werden Unterschiedsschwelle: der Betrag, um den sich die Intensität ändern muss, damit eine
Änderung empfunden wird Von Grundlegender Wichtigkeit in der Sensorik ist außerdem das Weber-Fechner-Gesetz. Es besagt, dass sich die subjektive Stärke von Sinneseindrücken logarithmisch zur objektiven Intensität des physikalischen Reizes verhält. Diese Eigenschaft macht es erst möglich, dass die gesamte Bandbreite physikalischer oder chemischer Stimuli überhaupt proportional empfunden werden kann. Beim Sehen können beispielsweise Lichtintensitäten über 10 Zehnerpotenzen auftreten. Ein linearer Maßstab wäre für die Sinnesempfindung "Licht" nicht möglich. Außer in der Aufgabe "ZNS" werden spezielle Aspekte der Sinnesphysiologie auch bei der Aufgabe "Hören und Sehen" bearbeitet. Im vorliegenden Skript wird nur auf die somato-viszerale Sensibilität näher eingegangen, da unmittelbare Bezüge zur Aufgabe bestehen. b) Somatoviszerale Sensibilität Somatoviszerale Sensibilität fasst sensible Eigenschaften des Körpers zusammen, die Informationen über die Haut, Muskeln, Sehnen und innere Organe sammeln:
Rezeptoren der somatoviszeralen Sensibilität werden zwei Gruppen zugeordnet. Extero-zeptoren befinden sich nahe der Körperoberfläche. Enterozeptoren und Propriozeptoren geben Auskunft über Tiefensensibilität und Stellungssinn.
ZNS 15 Überblick über die wichtigsten Exterozeptoren:
Bezeichnung Lage Sensortyp Funktion Besonderheit Merkel – Zellen / -Tastscheiben
zwischen Korium und Epidermis
Mechanorezeptor, PD – Sensoren, SA – I - Sensoren
registrieren senkrecht auf die Haut ausgeübten, anhaltenden Druck
Merkel – Zellen: in unbehaarter Haut Merkel – Tastscheiben: in behaarter Haut
Ruffini - Körperchen
tiefere Schichten des Koriums
Mechanorezeptor, P – Sensoren, SA – II –Sensoren
registrieren v.a. Dehnung von Gewebe
auch in Gelenkkapseln, große rezeptive Felder
Meissner – Körperchen
in den Papillen des Koriums der unbehaarten Haut
Mechanorezeptor, D – Sensoren, FA – Sensoren
registrieren druck-bedingte Hautdeformationen
kleine rezeptive Felder
Haarfollikel-sensoren
in den Papillen des Koriums der behaarten Haut
Mechanorezeptor, D – Sensoren, FA – Sensoren
registrieren die Auslenkungs-geschwindigkeit der Haarschäfte
kleine rezeptive Felder
Vater – Pacini – Körperchen
im subcutanen Bindegewebe
Mechanorezeptor, PC – Sensoren, adaptieren sehr schnell
registrieren die Beschleunigung der Hautdeformation -> Vibrationen
Empfindungsoptimum: 100 – 400 Hz, lamellen – bzw. zwiebelschalenartiger Aufbau um sensible Nervenendigung, niedrigste Reizschwelle aller Mechanorezeptoren, große rezeptive Felder
Kaltsensoren unmittelbar unter der Epidermis
Thermorezeptor, PD – Sensoren
vermitteln keine absolute Temperatur, bilden APs im Bereich von 15 – 35°C, max. Impulsfrequenz bei ca. 20°C, Abfall der Hauttemperatur unter 30°C wird als Kälte empfunden
freie Nervenendigungen, auf ca. 20 Tastpunkte kommen ca. 3 Kältepunkte, Kälteschmerz < 15°C (Nozizeptoren werden miterregt), paradoxe Kälteempfindung > 45°C
Wärmesensoren tiefer im Korium
Thermorezeptor, PD – Sensoren
vermitteln keine absolute Temperatur, bilden APs im Bereich von 30 – 43°C, max. Impulsfrequenz bei ca. 40°C, Anstieg der Hauttemperatur über 36°C wird als Wärme empfunden
freie Nervenendigungen, auf ca. 20 Tastpunkte kommen ca. 1 – 2 Wärmepunkte, Hitzeschmerz > 45°C
Funktionelle Organisation der Exterozeptoren: In Bezug auf die Mechanosensoren sind v.a. die beiden Begriffe der räumlichen Unter-schiedsschwelle (sukzessive Raumschwelle, Zweipunktdiskrimination) als Maß für das räum-liche Auflösungsvermögen und die simultane Raumschwelle von großer Bedeutung.
ZNS 16 Die räumliche Unterschiedsschwelle beschreibt die Entfernung, die zwei nacheinander ein-tretende Reize voneinander haben müssen, um getrennt wahrgenommen werden zu können. Die simultane Raumschwelle hingegen setzt voraus, dass die beiden Reize gleichzeitig einsetzen. Es gilt: desto kleiner die Raumschwelle, desto größer das räumliche Auflösungs-vermögen ist. In der Regel ist die räumliche Unterschiedschwelle kleiner als die simultane Raumschwelle, d.h., es können kleinere Entfernungen zwischen zwei Reizen wahrgenommen werden, wenn sie sequenziell eintreten. Übersicht über das räumliche Auflösungsvermögen unseres Körpers: Zungenspitze (Zweipunktschwelle~1mm) < Fingerkuppen (Zweipunktschwelle~ 2 mm) < Lippe < Stirn < Handrücken < Fußrücken <Rücken (Zweipunktschwelle~54 mm) Propriozeption und Enterozeption: Propriozeptoren dienen zur Wahrnehmung der Tiefensensibilität, indem sie uns Infor-mationen über die Lage und Bewegungen unseres Körpers liefern und tragen folglich zur sensomotorischen Steuerung bei. Diese Sensoren umfassen bspw. Muskelspindeln oder Golgi–Sehnenorgane und vermitteln die drei Sinnesmodalitäten "Stellungssinn", "Beweg-ungssinn" und "Kraftsinn". Enterozeptoren sind die Sensoren der sog. Viszeralen Sensibilität und informieren das ZNS über lebensnotwendige homöostatische Parameter (Atmung, Flüssigkeitshaushalt, Kreislauf). Hierzu zählen z.B. Chemosensoren, Pressosensoren, Osmosensoren oder Dehnungssensoren, Ein Großteil der Informationen dieser Sensoren dringt jedoch nur bei Mangelzuständen oder bestimmten Bedürfnissen bis zu unserem Bewusstsein vor. Nozizeption: In strenger Definition ist Nozizeption die Aufnahme, die anschließende Weiterleitung und zentrale Verarbeitung irgendeines Reizes über Nozizeptoren (polymodal !). Hiervon ist der Terminus „Schmerz“ abzugrenzen, der die subjektive Empfindung dieses Reizes wider-spiegelt. Dabei entspricht der empfundene Schmerz nicht unbedingt dem Ausmaß der Nozi-zeption, sondern wird durch zahlreiche psychische oder sonstige modulierende Faktoten beeinflusst. Nozizeptoren sind freie Nervenendigungen, die sich in so gut wie jedem Gewebe befinden, mit Ausnahme des Organparenchyms und des Gehirns. Sie können durch verschiedenste Mediatoren (z.B. Histamin, Prostaglandine, Leukotriene) in ihrer Empfindlichkeit beeinflusst werden, können jedoch auch selbst die entzündungsfördernde Substanz P ausschütten. Des Weiteren kommen Nozizeptoren in größerer Dichte als die anderen genannten Sensoren vor (auf einen Druckpunkt kommen ca. 7 Schmerzpunkte). Daraus ergibt sich zusammenfassend die folgende Verteilung der besprochenen Sensoren (Anzahl pro Hautfläche): Schmerzpunkte > Druckpunkte > Kältepunkte > Wärmepunkte Nozizeptoren stellen P–Sensoren dar, die nur schwach adaptieren. Veränderungen der Schmerzschwelle sind immer auf De-Sensitisierungen der Sensoren selbst (z.B. durch parakrine Substanzen) oder Regulationen innerhalb des ZNS zurückzuführen.
ZNS 17 Schmerzeinteilung nach dem Entstehungsort:
Bezeichnung Schmerzcharakter Funktion / Details Weiterleitung Oberflächenschmerz (somatischer Schmerz)
1. frühe, helle Komponente 2. späte, dumpfe Komponente
zu 1.: gute Lokalisierbarkeit, Aktivierung der Schutz-/Fluchtreflexe zu 2.: schlechtere Lokalisierbarkeit, Einleitung einer Schonhaltung
zu 1.: markhaltige/-arme Fasern der Klasse III bzw. A δ zu 2.: marklose Fasern der Klasse IV bzw. C
Tiefenschmerz (somatischer Schmerz)
meist nur die dumpfe Komponente
dazu gehören auch Zahn– und Kopfschmerzen
marklose Fasern der Klasse IV bzw. C
Viszeraler Schmerz meist nur die dumpfe Komponente
schlechte Lokalisierbarkeit, häufiges Ausstrahlen in Umgebung, Nozizeptoren v.a. in Kapseln und serösen Häuten
Formen des Schmerzes: Der projizierte Schmerz wird immer in dem Innervationsgebiet eines bestimmten Nerven empfunden, obwohl eigentlich nicht das rezeptive Feld dieses Nerven erregt wurde, sondern der Nerv in seinem Verlauf irritiert wurde. Der neuralgische Schmerz stellt eine Sonderform des projizierten Schmerzes dar und entsteht durch langanhaltende, mechanische oder entzündliche Irritation. (Bsp.: Schmerz bei Bandscheibenvorfall oder die Trigeminusneuralgie) Der übertragene Schmerz wird immer in dem Dermatom (Innervationsgebiet eines Spinal-nerven eines Rückenmarkssegments) empfunden, zu dem auch die entsprechenden Fasern des viszeralen Schmerzes gehören (sog. Head–Zonen). Dieser Mechanismus entsteht dadurch, dass unser ZNS nicht in der Lage ist, die auf ein und dasselbe Neuron des Hinterhorns zusammenlaufenden Schmerzafferenzen zu unterscheiden. c) Motorik Wesentliche Bereiche der Motorik (vor allem Reflexe) werden im Praktikumsteil "Muskel" behandelt und sollen hier nicht wiederholt werden. Für die Willkürmotorik ist das Zusammenspiel zwischen dem Kortex seinen Basalganglien und dem Cerebellum entscheidend (siehe auch "Aufbau des ZNS"). Einen schematischen Überblick über die Prozesse gibt die folgende Abbildung:
ZNS 18
Urban & Fischer; Golenhofen, Physiologie, 3. Aufl. 2004 Machen Sie sich die Details insbesondere der Verschaltungen der Basalganglien und im Kleinhirn im Eigenstudium klar. Eine detaillierte Beschreibung würde den Rahmen des vorliegenden Skripts sprengen. d) Integrative (höhere) Funktionen des ZNS Zu den integrativen bzw. höheren Funktionen des ZNS gehören die Steuerung von Trieben und Emotionen, die Regulation des Schlaf-/Wachrhythmus, die Prozesse Lernen, Gedächtnis-bildung und Kognition und schließlich Bewusstsein und Sprache. Diese Prozesse sind weit-gehend im Großhirn lokalisiert. An dieser Stelle soll kurz auf den Schlaf und das Gedächtnis eingegangen werden. Schlaf: Die Schlafrhythmen werden vor allem mit Schrittmacherprozessen im Thalamus in Verbindung gebracht. Den Schlaf teilt man in non-REM-Schlaf (orthodoxer Schlaf) und REM-Schlaf (paradoxer Schlaf) ein, wobei man den non-REM-Schlaf noch einmal in vier Stadien unterteilen kann. Die Stadienunterteilung orientiert sich im Wesentlichen an dem Auftreten verschiedener Elektroenzephalogrammformen (EEG, siehe dazu die Aufgabenbeschreibung). Stadien des non-REM-Schlafs:
Stadium 1 Übergang zum Schlaf, weniger regelmäßige α-Wellen, β-Wellen geringer Amplitude, Auftreten von τ-Wellen, langsame Augenbewegungen
Stadium 2 charakteristische Schlafspindeln, κ-Komplexe Stadium 3 τ-Wellen und vermehrt δ-Wellen Stadium 4 (Tiefschlaf) δ-Wellen mit hoher Amplitude, Wellen immer regelmäßiger,
höchste Weckschwelle
ZNS 19 REM-Schlaf: Ein Stadium, das im EEG dem Wachsein ähnelt (β-Wellen-ähnlich) aber trotzdem durch eine hohe Weckschwelle und niedrigen Muskeltonus gekennzeichnet ist. Weitere charakteristische Merkmale dieser Phase sind höherer Blutdruck, höhere Herzfrequenz, beschleunigte Atmung, Klitoris- und Peniserregung, Erinnerbare Träume und schnelle Augenbewegungen (REM: Rapid-Eye-Movement) Im Verlaufe des Schlafes einer Nacht werden die Perioden von non-REM und REM Schlaf in regelmäßigen Zyklen 5-7 mal durchlaufen.
Urban & Fischer; Golenhofen, Physiologie, 3. Aufl. 2004 Der Schlaf-Wach-Rhythmus folgt einer zirkadianen Rhythmik, die durch eine innere Uhr und äußere Einflüsse bestimmt wird. Eine entscheidende Rolle spielen die suprachiasmatischen Nuclei des Hypothalamus und die Glandula pinealis (Ausschüttung von Melatonin). Langzeitgedächtnis: Man unterscheidet 2 Formen von Langzeitgedächtnis: Das deklarative, explizite Gedächtnis (semantisch oder episodisch) speichert Informationen ab, die bewusst abgerufen werden müssen, z.B. um bestimmte Dinge wiederzuerkennen. Das prozedurale, implizite Gedächtnis speichert Handlungsabläufe und benötigt keine bewusste Aktivierung. Die längerfristige Speicherung von deklarativem Wissen erfolgt im Hippocampus (wichtigster Transmitter ist Glutamat-NMDA-Rezeptoren, siehe unten). Das prozedurale Gedächtnis ist bei Läsionen im Hippocampus nicht beeinträchtigt. Es erlaubt Prägung, Erlernen von Fertigkeiten, Sensibilisierung, Gewöhnung und Konditionierung. Je nach Aufgabe werden Kleinhirn, Basalganglien, Amygdala und kortikale Areale einbezogen. (Erlernen von Fertig-keiten → Kleinhirn und Basalganglien, Konditionierung von Angstreaktionen → Amygdala). Lernprozesse beruhen wahrscheinlich auf dem Gebrauch von bestimmten Synapsen. Dadurch entsteht ein Pfad, der bei Bedarf immer wieder gegangen werden kann. Im Hippocampus, der entscheidend für die Gedächtnisfunktion ist, wurde das Phänomen der Langzeitpotenzierung (LTP, „long term potentiation“, siehe auch Abschnitt "neuronale Grundprozesse) entdeckt. Erregt man dort eine Zelle für kurze Zeit mit hoher Frequenz, so sind danach die EPSPs, die durch Einzelreize ausgelöst werden für lange Zeit (bis zu Tagen) vergrößert (Erhöhung der Synapsenstärke). Man stellt sich vor, dass auf diese Weise Bahnungen im Hippokampus geschaffen werden, die einen Gedächtnisinhalt repräsentieren
ZNS 20 und beim Erinnern leicht aktiviert werde können. Wichtig für Lernprozesse ist vermutlich auch die Langzeitdepression (LTD) an Zellen des Kleinhirns, die der umgekehrte Vorgang zur LTP ist. Bei LTD wird die Synapsenstärke vermindert und damit die Signalübertragung zwischen Neuronen abgeschwächt. 4. Pathophysiologische Aspekte des ZNS Schädigungen des Nervensystems (Verletzungen, Vergiftungen, Erkrankungen) sind oft mit massiven Beeinträchtigungen der Fähigkeiten von Patienten verbunden. Mitunter sind die Beeinträchtigungen auch befremdlich und lösen neben den körperlichen Einschränkungen auch soziale Probleme aus. Folgende Zusammenstellung ist rein subjektiv und soll nur einige der bekannteren Pathophysiologien ansprechen. Hypertonische-Hypokinetische Bewegungsstörung - M. Parkinson: Untergang von dopaminergen Neuronen in der Substantia nigra (Basalganglien) mit resultierendem Überwiegen des indirekten, motorikhemmenden Wegs. Typische Trias: - Rigor: erhöhter Muskeltonus, gesteigerte tonische Dehnungsreflexe - Tremor: Ruhetremor, typisch im Handbereich (Pillendrehertremor) - Akinesie: allg. Bewegungsarmut mit verzögertem Bewegungsbeginn (Zahnradphänomen) Die Gabe von L-Dopa ist zurzeit die Therapie der Wahl. Bei fortgeschrittenem Krankheits-verlauf wird die sogenannte Tiefenhirnstimulation angewendet. Hypotonische-Hyperkinetische Störung - Chorea Huntington: Untergang GABAerger Neurone im Corpus striatum (Basalganglien). Dadurch stärkere Hemmung des Globus pallidus internus. Dadurch Ausfall der Hemmung des Thalamus. Es kommt zu plötzlichen schnellen und unkontrollierbaren Bewegungen. Weitere hyperkinetische Störungen sind u.a. die Athetose und Hemiballismus Epilepsie: Bei dem Krankheitsbild der Epilepsie liegt eine pathophysiologische Übererregbarkeit der Neurone vor, die z.B. durch ein gesteigertes Angebot an exzitatorischen Transmittern, eine Verminderung von inhibitorischen Transmittern oder durch Ausfall hemmender Synapsen entstehen kann. Dadurch können sich Neuronenverbände (z.B. im motorischen Kortex) unkontrolliert ent-laden, wobei man fokale und generalisierte Entladungen unterscheidet. Querschnittslähmung: Eine Querschnittslähmung setzt eine komplette Durchtrennung des Rückenmarks voraus. Unmittelbar nach der Verletzung kommt es im Rahmen des sog. Spinalen Schocks zunächst zu einer schlaffen Lähmung unterhalb des betroffenen Rückenmarkssegments. Im weiteren Verlauf (ca. 6 Wochen später) geht der spinale Schock in das chronische Querschnitts-syndrom über, welches durch eine Spastik und meist gesteigerte Reflexe gekennzeichnet ist. Ursache dieser Hyperreflexie ist vermutlich eine Übererregbarkeit spinaler Interneurone, hervorgerufen durch Aussprossungen erregender Afferenzen, die die "herrenlosen" Synapsen der degenerierten absteigenden Bahnen übernehmen.
ZNS 21 Brown–Séquard–Syndrom (dissoziierte Empfindungsstörung): Unter diesem Syndrom versteht man die Symptomatik einer halbseitigen Durchtrennung des Rückenmarks. Typisch hierfür sind: ipsilateral: 1. Lähmung der Extremitäten unterhalb der Läsion
(Grund: 80 % der Fasern kreuzen schon oberhalb der Läsion) 2. Verlust der Epikritik
(Grund: die beiden Hinterstrangbahnen kreuzen erst auf Höhe der Medulla oblongata)
kontralateral: Verlust der Prothopathik (Grund: die betreffenden Bahnen kreuzen schon unterhalb der Läsion) Split-Brain: Bei einem Split-Brain-Patient wurde das Corpus callosum (Verbindung zwischen linker und rechter Hemisphäre) durchtrennt. Dadurch können die beiden Hemisphären nicht mehr mit-einander kommunizieren. Durch die Asymmetrie der Hirnhälfte und die fehlende Kommu-nikation können die Patienten Dinge, die sie nicht sehen sondern nur mit der linken Hand tasten nicht mehr verbal benennen, da das Sprachzentrum in der linken Hemisphäre liegt. Dabei werden die Dinge noch richtig erkannt und können auch richtig genutzt werden.
5. Praktikumsanleitung zur Aufgabe „Z N S“
ZNS 22
Praktikum Z N S
A. Elektroenzephalogramm (EEG) B. Visuell evoziertes Potenzial (VEP) C. Sensibilität
Literatur: Für extrazelluläre Messmethoden wie EEG und VEP bietet von den bekannten Lehrbüchern das Lehrbuch von Deetjen/Speckmann/Hescheler 4. Auflage; Urban & Fischer Verlag) die beste Vorbereitung. Es sei hier aber auch auf die Lehrbücher Klinke/Pape/Silbernagl (5. Auf-lage; Thieme Verlag) und Schmidt/Unsicker (1. Auflage, Deutscher Ärzte-Verlag) verwiesen. Ein Blick in die Schwarze bzw. Gelbe Reihe ist gut, um sich über Themen- bzw. Fragen-schwerpunkte im Physikum zu informieren. Sie dienen aber, wie die zahlreich am Markt vorhandenen Kurzlehrbücher, keinesfalls zur alleinigen Vorbereitung des Themengebietes. Die wohl beste Vorbereitung bietet der Besuch meiner Vorlesung „ZNS“ mit anschließender Nachbereitung an den Computern des CIP-Pools (Gebäude 59, 2.Etage, Raum „Nerv“; Dort werden .pdf-Files der Vorlesungen abgelegt). Vorkenntnisse in Stichworten: Physikalische Grundkenntnisse: Definition von Strom und Spannung; was ist Wechsel- und was ist Gleichspannung; wie berechnet sich der Gesamtwiderstand bei Reihen- und Parallel-schaltung von Widerständen; Ohm´sches Gesetz; Kondensator. Zu A (EEG): Aktions- und synaptische Potenziale; Aufbau und Funktion der Thalamuskerne; thalamocorticale Beziehungen; sensorische Funktionen im Thalamus; sensorische und motorische Areale im Cortex; Aufbau und Funktion efferenter Bahnen; Aufbau und Funktion der Basalganglien; Aufbau und Funktion des Kleinhirns; Entstehungsmechanismus des EEG; synchronisierte und desynchronisierte Hirnpotenziale; EEG Grundrhythmus; Amplitude und Frequenz der EEG-Wellen; alpha-Blockade; Pathophysiologie des ZNS: Epilepsie, Morbus Alzheimer, Creutzfeld-Jakob/BSE, Morbus Parkinson, Chorea Huntington, Ballismus; Schlaf; Schlaf-Wachrhythmus; Bewusstseinszustand; Vigilanz; molekulare Mechanismen des Lernens: LTP und LTD. Zu B (VEP): evozierte Potenziale: akustische, visuelle und andere sensorisch evozierte Potenziale; Erwartungspotenziale; Bereitschaftspotenziale; Ereignis-korrelierte Potenziale (EKP); Aufbau und Funktion des Hirnstamms; visuelle Bahn, visueller Cortex, visuelle thalamo-corticale Beziehungen; Unterschiede zwischen EEG und VEP, Entstehungs-mechanismen, Lokalisation, Variabilität, Wellenmuster: Amplituden und Latenz, technische Voraussetzungen zur Unterscheidung von EEG-Wellen. Die vorliegende Aufgabe hat das Ziel, die durch die elektrische Aktivität von corticalen Neu-ronen entstehenden Potenziale an der unverletzten Kopfhaut abzuleiten und nach graphischer Wiedergabe zu beurteilen, auszuwerten und physiologisch zu deuten. Diese bioelektrische Aktivität wird unter zwei unterschiedlichen Bedingungen untersucht: 1) während ihres spontanen, ausschließlich von physiologischen Einflüssen geprägten Auftretens. Die graphische Darstellung dieses Aktivitätsmusters ist das Elektroenzephalogramm (EEG). Erfolgt die Ableitung z.B. während eines neurochirurgischen Eingriffs durch direkt auf die Cortexoberfläche angebrachte Elektroden, so erhält man ein Elektrocorticogramm (ECoG). Die Amplitude der EEG-Potenziale beträgt etwa 1/10 derjenigen des ECoG. Die Gründe dafür sind in Abb.1 dargestellt. 2) Nach adäquater Reizung der Retina. Die dadurch am visuellen Cortex ausgelöste elektrische Antwort ist das visuell evozierte Potenzial (VEP).
ZNS 23
Zu C (Sensibilität): Rezeptoren; rezeptives Feld; Rezeptorpotenzial; elektrotonische Weiterleitung; adäquater Reiz; Sinneszellen: primär und sekundär; Verlauf und Funktion afferenter Bahnen im ZNS; Physiologie und Anatomie des Rückenmarks; Aufbau und Funktion des Hirnstamms; Sensorische Areale im Cortex; periphere Sensibilität; segmentale Sensibilität; Dermatome; Bahnung und Hemmung in afferenten Systemen; sensible Wahrnehmungen; periphere Überleitung und zentrale Empfindung; sensorische Modalitäten; sensorische Lokalisation; Weber-Fechner-Gesetz; Lagesinn; Schmerzempfindung.
Abb. 1: Spannungsabfall der elektrischen Aktivität an der Cortexoberfläche (Elektrocorticogramm) auf dem Weg zur EEG-Elektrode. a) Kopfschwarte, b) Tabula externa des Schädelknochens, c) Substantia spongiosa, d) Tabula interna, e) Liquorraum, f) Cortex mit Dipolen als Spannungs-generatoren, g) EEG-Elektrode (nach Tönnies).
A. Elektroenzephalogramm (EEG) a) Elektroden: Die Elektroden haben einen Durchmesser von ca. 8-10 mm und sind mit einem kurzen Stift zum Anschluss an das Registriergerät versehen. Die Auflageflächen werden mit Flanellstoff umhüllt und vor der Ableitung mit physiologischer Kochsalzlösung getränkt. Sie werden mittels einer Haube befestigt, die aus Gummischläuchen besteht. Die Brückenelektroden werden dazu an den entsprechenden Stellen unter den verstellbaren Gummischläuchen befestigt. b) Elektrodenanordnung: EEG-Elektroden können je nach Ziel der Ableitung nach sehr verschiedenen Systemen angeordnet werden. Für Routine-Untersuchungen wird das inzwischen weitverbreitete 10-20-System verwendet. Dieser Anordnung liegen vier normierte Punkte des Kopfes zugrunde: Das Nasion, das Inion, das linke und das rechte Ohr (Abb. 2) Zunächst wird der Abstand zwischen den Messpunkten Nasion (über der Nasenwurzel) und Inion (über der Protuberantia occipitalis
ZNS 24 externa) in einer sagittalen Linie bestimmt. Diese Strecke wird gleich 100 % gesetzt. Bei einem Messwert von z.B. 35 cm wird bei 50 %, also bei 17,5 cm, die Vertex-Elektrode (Cz) platziert. Alle Elektroden der Mittellinie werden dann im Abstand von 10 % oder 20 % dieser Strecke gesetzt. In gleicher Weise wird der Abstand zwischen den Ohrmuscheln gemessen, wobei diese Strecke über Cz führt. Diese Strecke wird ebenfalls gleich 100 % gesetzt. Die Elektroden auf dieser Strecke werden erneut in 10 % und 20 % Abständen platziert.
Abb. 2: Ableitungsschema mit den internationalen Bezeichnungen der Elektroden. Schematische Darstellung von unipolarer und bipolarer Ableitung (nach Deetjen/Speckmann). Dabei ist zu beachten, dass es bei den frontopolaren und okzipitalen Elektroden keine Elektrode in der Mediosagittalebene gibt. Hier wird stattdessen der Kopfumfang durch zwei Punkte bestimmt, die sich in jeweils 10 % Abstand (hier also 3,5 cm) vom Inion oder Nasion auf der Sagittalebene befinden. Von diesem Umfang (z.B. 55 cm) berechnet man 5 % und platziert die Elektroden auf der Linie, auf der man eben den Umfang gemessen hat in 5 %, also hier 2,75 cm Abstand von der Mediosagittalebene. So bestimmt man die Position der Elektroden Fp1, Fp2, O1 und O2. c) Ableitungsarten: Durch das EEG wird die Potenzialdifferenz zwischen zwei Elektrodenpositionen gemessen. Aus der oben beschriebenen Elektrodenanordnung ergeben sich zwei Ableitungsarten, die unipolare und die bipolare Ableitung. Bei der unipolaren Ableitung liegt eine Elektrode auf dem Schädel an einem elektrisch aktiven Gebiet, die andere auf einer elektrisch inaktiven Referenzstelle. Bei der bipolaren Ableitung liegen beide Elektroden auf elektrisch aktiven Regionen. (Hier sei darauf hingewiesen, dass jede EEG-Ableitung bipolar sein muss, weil eine Potenzialdifferenz nur zwischen zwei Elektroden gemessen werden kann. Die grundsätzliche Unterscheidung liegt darin, dass bei der unipolaren Ableitung eine Elektrode auf eine Region gelegt wird, welche im Vergleich zu den anderen Positionen am Schädel weitgehend spannungsfrei ist. Da es diese ideale spannungsfreie Lage in Wirklichkeit nicht gibt, muss man diejenige Region wählen, an der am wenigsten eine eigene elektrische Aktivität erwartet wird, und die von den Schädelelektroden in etwa gleichem Abstand liegt. Die Region, welche diesen Bedingungen am nächsten kommt, ist das Ohrläppchen.) Die unipolare Ableitung erlaubt eine bessere Beurteilung der Größe, Form und Polarität der EEG-Wellen. Der lokalisatorische Wert ist jedoch geringer. Die bipolare Ableitung ermöglicht die Abgrenzung von aktiven Gebieten, die pathologisch verändert sind, weil sie die Differenz zwischen den Amplituden der EEG-Wellen wiedergibt: Je größer die Potenzialdifferenz, umso größer die abgeleiteten Amplituden. Im Praktikum können 8 Kanäle entweder unipolar oder bipolar abgeleitet werden. d) Durchführung der EEG-Ableitung: Die Versuchsperson sitzt im ruhigen Wachzustand, körperlich und geistig entspannt, mit geschlossenen Augen und nach Möglichkeit in geräuscharmer Umgebung. Um elektrische Störungen zu minimieren, sitzt die Person auf einem Stuhl in einem Faraday-Käfig. Die EEG-
ZNS 25 Aufzeichnung wird in folgender Reihenfolge vorgenommen: 1) uni- und bipolare Ableitungen nach Abb. 2; 2a) Effekte von externen Artefaktquellen (Einstreuung): schlechter Elektroden-kontakt, mangelhafte Kabelverbindungen, Störungen am Registriergerät; 2b) von der Versuchsperson ausgehende Artefakte: Augenbewegungen, Muskelanspannung, Kauen; 3) visuelle Desynchronisation: die Versuchsperson wird aufgefordert, die Augen kurz zu öffnen und wieder zu schließen; 4) mentale Desynchronisation: durch Kopfrechnen; 5) akustische Desynchronisation: durch eine Tonsalve; 6) Effekte der Hyperventilation: Die Versuchs-person atmet tief und regelmäßig mit einer Frequenz von etwa 20/min für etwa 2-4 min. Alle EEG-Spuren werden dabei von einem Computer aufgezeichnet und später „offline“ ausgewertet.
e) Beurteilung und Auswertung: Die im Praktikum gewonnenen Kurven werden wie folgt analysiert: 1) Identifizierung und Deutung von Artefakten. 2) Beschreibung des Grundrhythmus. 3) In kurzen EEG-Kurven-abschnitten werden Amplitude und Frequenz der abgeleiteten Aktivität gemessen.
Abb. 3: Beispiel eines im Praktikum aufgenommenen EEGs. Gezeigt ist hier der Übergang von alpha- nach beta-Wellen (alpha-Blockade bzw. „Arousal-Reaktion“), der in fünf der sechs Ableitungen sichtbar ist.
ZNS 26
Abb. 4: Die Hauptformen des EEG nach Jung. Links: Charakteristische Wellenarten bei Gesunden im Schlaf- und Wachzustand. Im Wachzustand überwiegen alpha- und beta-Wellen, im Schlaf und bei Kindern dominieren delta-Wellen. Rechts: Pathologische EEG-Muster (z.B. Epilepsie).
f) Abschließende Beurteilung: Einordnung der Kurven in eine der folgenden Kategorien: - α-EEG - unregelmäßiges α-EEG - Vigilanzschwankungen - stark artefaktgestörtes EEG - β-EEG
Abb. 5: Frequenzband des EEG (nach Jung). Oben: Korrelation verschiedener Altersstufen und Verhaltensweisen mit den jeweiligen Grundfrequenzen des EEG. Unten: Pathologische Formen des EEG. Bei den meisten pathologischen Veränderungen des Gehirns ist das EEG verlangsamt. g) Computer-Demonstration: Zusammenfassend werden die grundsätzlichen Eigenschaften des EEG am Computer besprochen und analysiert.
ZNS 27 h) Klinische Anwendungsbereiche und Bedeutung: 1) Diagnostik der Epilepsie. 2) Diag-nostik diffuser Hirnschädigung (Hirnentzündungen, Stoffwechselkrankheiten und insbeson-dere Koma). 3) Diagnostik und Feststellung des Hirntodes. 4) Pharmakologische Wirkung vieler Medikamente. 5) Pathophysiologische Erkrankungen des ZNS. Jede EEG-Beurteilung muss der Tatsache Rechnung tragen, dass viele Menschen regelmäßig zentralnervös wirksame Medikamente einnehmen.
B. Visuell evoziertes Potenzial (VEP)
Messungen evozierter Potenziale stellen eine objektive und in gewissem Grade quantitative Funktionsprüfung des sensiblen Systems dar, denn die selektive Reizung der verschiedenen sensorischen Afferenzen löst in umschriebenen corticalen Arealen evozierte Potenziale aus, die nach Latenz, Wellenmuster und Dauer charakterisiert werden können. Besonders wichtig bei Patienten, die keine oder unzuverlässige Angaben bei Sensibilitätsprüfungen machen können, z. B. Kleinkinder, Bewusstseinsgestörte, Debile, Simulanten. In dieser Aufgabe wird die Retina mittels eines Schachbrettmusters (die schwarzen und weißen Felder des Schachbrettmusters werden ständig gewechselt = Kontrastumkehr) oder Lichtblitzen adäquat gereizt. Mit Hilfe eines Mittelwertrechners wird die ausgelöste Aktivität aus dem EEG herausgehoben und Latenz und Amplituden des erhaltenen visuell evozierten Potenzials (VEP) ausgewertet. Trotz erheblicher interindividueller Schwankungen lassen sich bei den sensorisch evozierten Potenzialen verschiedene Wellengipfel und -täler unterscheiden. Beim VEP tritt besonders eine positive Welle, die wegen ihrer Latenzzeit von ca. 100 ms nach dem Reiz P100 Welle genannt wird, in Erscheinung. Versuchsaufbau und technische Durchführung der Messungen werden im Folgenden ver-deutlicht:
Abb. 6: Schematische Darstellung des Signalpfades bei der VEP-Messung.
Der Signalpfad: Die Ableitelektroden sind mit den Eingängen eines hochohmigen Differenzverstärkers verbunden, der das Signal 100-fach verstärkt. Nach einer weiteren Verstärkung um den Faktor 100 im zweiten Verstärker gelangt das Signal zum Eingang des Messrechners. Hier wird das Signal digitalisiert, gemittelt und graphisch dargestellt. Der Messablauf: Der Messrechner löst im Sekundentakt den gewünschten Reiz aus (Kontrastwechsel bzw. Lichtblitz) und startet gleichzeitig den Messvorgang. Gemessen wird jeweils über eine Zeitspanne von etwa 500 ms. Das Auswerteprogramm überprüft, ob das Signal zu keiner Zeit den erwarteten Spannungs-bereich überschritten hat (horizontale gelbe Balken): Die EPs liegen wie die spontanen EEG-
Differenz-verstärker
(1:100)
ElektrodenSchach-
brett-projektor
Verstärker(1:100)
Meß-rechner
ZNS 28 Signale im µV-Bereich (sind allerdings um etwa den Faktor 10 kleiner), während durch Augenrollen hervorgerufenen Myogramm-Potenziale oder durch schlechten Elektroden-kontakt aufgefangene 50 Hz-Störspannungen erheblich größere Amplituden aufweisen. Es werden nur solche Signalverläufe aufsummiert, die keine abnormal hohen Amplituden enthalten, da diese das Ergebnis völlig verfälschen würden. Der Sinn der Mittelung: Da sich einzelne EPs nicht genügend von der Spontanaktivität der EEG-Wellen abheben, kann man sie nicht direkt auswerten. Summiert man dagegen eine größere Anzahl (n ≥ 100) von Signalverläufen, heben sich die statistisch verteilten, spontanen EEG-Signale größtenteils auf, während die Amplitude der mit dem Reiz synchronisierten Signale, eben der EPs, gleich bleibt. Auswertung und klinische Bedeutung des VEP: Die erhaltenen Kurven werden beurteilt und ausgewertet bezüglich 1) Amplituden, insbesondere der größten positiven Komponente (P-100 Welle) und 2) deren Latenzen (siehe Abb. 7). Abschließend werden die wichtigsten Merkmale des VEP am Computer demonstriert und diskutiert.
Abb. 7: Messung des VEPs
Die klassische Anwendung des VEPs ist die Diagnostik der Neuritis nervi optici (NNO), die im Rahmen einer Multiplen Sklerose auftreten kann. Dabei ist die Latenz deutlich erhöht (um 20 ms und mehr), die Amplitude wenig reduziert (Abb. 8). Die Latenzverlängerung bleibt in der Mehrzahl der Fälle über Jahrzehnte bestehen, auch wenn eine völlige klinische Remission eingetreten ist. Die Latenzverlängerung ist unabhängig von der Karogröße des Schachbrett-musters, soweit eine ausreichende Sehschärfe vorliegt. Bei einer akuten NNO hingegen ist das VEP nicht hilfreich: Da durch das Begleitödem ein partieller Leitungsblock auftritt, kommen im Kortex keine Signale an ("Der Patient sieht nichts, der Arzt sieht nichts, und das VEP ist auch nicht zu sehen"). Die Amplitude des VEPs kann man als Maß für die Anzahl funktionsfähiger Axone ansehen. Bei Leitungsblock, z.B. in Folge von Tumorkompression, ist entsprechend die Amplitude
ZNS 29 reduziert und die Latenz wenig erhöht. Bei Amblyopie ist die Latenz des VEPs erhöht, die Amplitude normal oder leicht reduziert. Die Differentialdiagnose gegenüber einem entzünd-lichen Geschehen kann durch Vergleich des VEPs bei verschiedenen Karogrößen getroffen werden: Zwar ist die Latenz bei Amblyopie bei der Standard-Karogröße von 0,5° erhöht, doch normalisiert sie sich bei 1° bis 2° Karogröße, je nach Stärke der Amblyopie. Eine interessante Anwendung findet das VEP in der Diagnose des okulären Albinismus: bei dieser Form kann die Pigmentierung von Haaren, Haut und Iris normal sein. Genauso wie beim okulokutanen Albinismus liegt beim okulären Albinismus eine Fehlprojektion der Sehbahn vor: Die Zahl der kreuzenden Fasern ist zu hoch, und als Folge davon treten die klinischen Zeichen und Symptome wie Strabismus, geminderte Stereopsis, reduzierte Sehschärfe und Nystagmus auf. Diese Kreuzungsanomalie (die wahrscheinlich mit der embryonalen Steuerung des Faserwachstums durch Pigmentzellen als Marker zu erklären ist) lässt sich mit einem geeigneten Untersuchungsablauf mit dem VEP mit sehr hoher Treff-sicherheit nachweisen.
Abb. 8: VEP bei einseitiger Neuritis nervi optici. Oben sind zwei VEP-Ableitungen bei Reizung des gesunden rechten Auges dargestellt. Die Latenz schwankt etwas bei Wiederholung (hier um 2 ms, ein typischer Wert). Die Latenz des linken Auges (unten) liegt im Mittel um 25 ms höher, bei ähnlicher Amplitude wie rechts. Dies ist ein typisches Beispiel einer einseitigen Neuritis nervi optici: Korrekte optische Abbildung vorausgesetzt, zeigt eine Latenzerhöhung ein entzündliches Geschehen an; hier offenbar vor dem Chiasma, da nur einseitig.
ZNS 30C. Sensibilität
Versuche zur Hautsensibilität A) Druckempfindung: Der adäquate Reiz für die Druckrezeptoren ist die Deformation der Haut. Punktförmige Reize werden mit Hilfe der Methode von M. v. Frey verabreicht. Man verwendet an Stäben befestigte Haare und Borsten, deren Biegsamkeit und Durchmesser gemessen wurde. Die Druckwerte sind in mg/mm2 angegeben. Verschiedene Hautareale werden abgetastet: Finger-kuppen (Daumen und Kleinfinger); die Dorsalseite des Unterarms; Waden. Durch einen Gummistempel wird ein Koordinatennetz auf diese Areale gestempelt. Durch Abtasten mit Reizhaaren verschiedener Druckwerte werden die Druckpunkte mit Hilfe einer Lupe gesucht und entsprechend in das untenstehende Koordinatennetz des Protokolls eingetragen (Sie müssen nur das grau unterlegte Areal bearbeiten). Es werden gemessen: a) Anzahl der Druckpunkte pro cm2 bei verschiedenen Druckwerten; b) die Schwelle der Druckempfindung an ausgewählten Stellen innerhalb eines untersuchten Feldes. Zur Bestimmung der Schwelle werden mindestens sechs Messungen mit v. Freyschen Haaren verschiedener Stärke vor-genommen und der Schwellenreiz bestimmt. Die aus verschiedenen Hautarealen gewonnenen Schwellenreize werden verglichen.
Fingerbeere Unterarm Wade Zahl/cm2: Schwellenwerte:
Prüfung der Zweipunktdiskrimination: Mit einem Testzirkel wird ermittelt, in welchem Abstand zwei verschiedene Reizpunkte gerade noch getrennt wahrgenommen werden. Bei gleichzeitigem Aufsetzen misst man die simultane Raumschwelle, werden die Reize hinter-einander gesetzt, ergibt sich die sukzessive Raumschwelle. Die Zweipunktdiskrimination wird an den folgenden Stellen geprüft: Zungenspitze, Fingerkuppen, Lippen, Unterarm, Rücken. Auf den Fingerkuppen sollten sich z.B. nicht mehr als 5-7 mm ergeben. Ort der Untersuchung Finger Unterarm
quer Unterarm längs
Stirn Wade
VP1 Simultanschwelle
Sukzessivschwelle
VP2 Simultanschwelle
Sukzessivschwelle
ZNS 31Bestimmung der Unterschiedsschwelle ∆E (Weber-Fechnersches Gesetz): Bei einem gegebenen Basisreiz wird ein Zusatzreiz gleicher Modalität gegeben. Die VP gibt an, ob die Empfindung unverändert oder verstärkt ist. Ein Empfindungs-Unterschied liegt vor, wenn im statistischen Mittel die Empfindung zu 50 % als unverändert und zu 50 % als ver-stärkt angegeben wird. Für jede Schwelle sind viele Versuche notwendig. Die Unterschieds-schwellen für verschiedene Basisreize können zu einer Empfindungs-Reizstärkekurve zusammengesetzt werden. Diese Methode führt zur Weberschen Regel und zum Weber-Fechner-Gesetz. Die Unterschiedsschwelle der Druckrezeptoren der Haut wird gefunden, indem man drei verschiedene Gewichte mit gleichen Grundflächen nacheinander auf dieselbe Hautstelle setzt. Der Unterarm wird auf den Tisch gelegt, um eine Verfälschung durch den Kraftsinn zu vermeiden. Auf der Dorsalseite des Unterarms wird eine Stelle markiert, auf die nacheinander zwei zylindrische Behälter aufgesetzt werden. In diese werden verschiedene Gewichte gelegt. Man beginnt mit je 50 g und vergrößert das eine Gewicht durch Zulegen von 1 g, 3 g, 5 g, usw. Die VP hat anzugeben, welches Gefäß schwerer ist. Die Angaben werden protokolliert. In der Nähe der Unterschieds-Schwelle sind 50 % richtige und 50 % falsche Angaben zu erwarten bzw. die Antworten "gleich" oder "ich weiß nicht".
Beispiel: Grundgewicht 50 g, je fünf Prüfungen mit Zusatzgewichten von 1-10 g. Zeichenerklärung + : richtig - : falsch ± : gleich oder zweifelhaft
In diesem Beispiel werden 3 g Unterschied noch in der Mehrzahl der Versuche erkannt, bei 1 g weist dieses Beispiel ebenso viele richtige wie falsche bzw. zweifelhafte Angaben auf. Die relative Unterschiedsschwelle (Der Quotient aus Reizzuwachs ∆R und Ausgangsstärke R) liegt demzufolge zwischen 1 und 3 g, d.h., der eben wahrnehmbare Unterschied beträgt zwischen 2 bis 6 % des Gesamtgewichtes. Die relativen Unterschiedsschwellen sind über einen gewissen Messbereich konstant (Webersche Regel) und liegen unter Optimal-bedingungen für das Auge bei 1 %, für Ohr und mechanische Sinne bei 3 % und für die übrigen Modalitäten bei 10 %. Führen Sie den Versuch mit Grundgewichten von 50 g, 100 g und 200 g aus und tragen Sie die Ergebnisse in untenstehende Tabellen ein. Anschließend tragen Sie die Ausgangsstärke R gegen den Reizzuwachs ∆R auf. Aus dieser Weber-Beziehung können Sie den Reizzuwachs entnehmen, der bei einer jeweiligen Ausgangsstärke zur Überschreitung der Unterschieds-schwelle nötig ist. 50 g Differenz 100 g Differenz # 1 g 3 g 5 g 10 g # 1 g 3 g 5 g 10 g 1 1 2 2 3 3 4 4 5 5
Differenz # 1 g 3 g 5 g 10 g 1 - + + + 2 + - + + 3 + ± ± + 4 ± + + + 5 - + ± +
ZNS 32
B) Temperaturempfindung: Aufsuchen der Kalt- und Warmrezeptoren in verschiedenen Hautgebieten. Die Kalt- und Warmpunkte der Haut werden mit Hilfe von zugespitzten, hohlen Metallzylindern aufgespürt, die durch Einfüllen von kaltem (0 C) bzw. warmem (40 C) Wasser abgekühlt bzw. erwärmt werden. Zum Aufsuchen der Kaltpunkte kann auch eine Kupfer- oder Silberperle benutzt werden. Auf den Handrücken und auf das Protokollpapier wird mit dem Gummistempel ein Koordinatennetz aufgebracht. Dann wird die Spitze eines der Metallzylinder bzw. die Kupferperle vom Versuchsleiter (VL) systematisch über die Haut geführt, z.B. in parallelen Strichen in 2 mm Abstand. Die VP gibt an, wann eine Kalt- bzw. Warmempfindung eintritt. Dieser Punkt wird im Protokoll vermerkt. Man findet pro cm2 im Mittel: Kaltpunkte: auf dem Handrücken 7 bis 8; am Mund 16 bis 19; auf der Handfläche 1 bis 5; am ganzen Körper ca. 250.000; Warmpunkte: am Vorderarm etwa 0,3; an den Fingern 1 bis 2. Ganze Gebiete sind jedoch auch frei von Warmpunkten. Ort der Untersuchung Handrücken
VP1 Warmpunkte/cm2
Kaltpunkte/cm2
VP2 Warmpunkte/cm2
Kaltpunkte/cm2
C) Schmerzempfindung: Aufsuchen der Schmerzpunkte auf einer bestimmten Fläche mit einer Schmerzborste (Igelstachel). Man benutze den Gummistempel wie oben angegeben.
Fingerbeere Unterarm Wade Zahl/cm2:
Schwellenwerte:
200 g Differenz # 3 g 5 g 10 g 20 g 1 2 3 4 5
Ausgangsstärke R
Rei
zzuw
achs
ΔR
ZNS 33
Versuche zur Tiefensensibilität Überprüfung des Lagesinns des Schultergelenks: Methode: Es wird ermittelt, mit welcher Genauigkeit die VP ihren Zeigefinger bei geschlos-senen Augen auf vorgegebene Bezugspunkte aufsetzen kann. Auf einer Plexiglasscheibe (Ziel) wurden konzentrische Reihen von jeweils 12 Bezugspunkten nach der Uhreinteilung angebracht. Die Radien sind: 65 cm, 50 cm, 30 cm, 10 cm. Somit ergeben sich auf dem Ziel 48 Bezugspunkte. Durchführung: Die VP wird so gestellt, dass eine ihrer Schultern dem Mittelpunkt der Kreise gegenübersteht. Zunächst werden die 12 Punkte des äußersten Kreises (65 cm) getestet, es folgen die Kreise mit kleinerem Radius. Für jeden Kreis ist der Abstand der VP zum Ziel so zu wählen, dass der Zeigefinger die zugehörigen Punkte bei locker ausgestrecktem Arm mühelos erreicht. Die gleichzeitige Extensionsstellung von Arm und Hand und Zeigefinger verursacht beim Aufsetzen auf die Bezugspunkte lediglich Bewegungen des Schultergelenks. Infolgedessen kann man annehmen, dass durch die Testsituation vorwiegend der Lagesinn der Schulter geprüft und untersucht wird. Zu Beginn des Tests wird auf die Kuppe des entsprech-enden Zeigefingers der VP ein Kreuz aufgezeichnet. Der VL steht, von der VP aus gesehen, hinter der Scheibe. Die VP versucht jetzt, ihren Zeigefinger möglichst exakt auf den jeweiligen Bezugspunkt zu setzen, wobei der VL assistiert. Ist dies erreicht, schließt die VP die Augen, zieht ihren Finger vom Bezugspunkt zurück und führt ihren Arm in die normale Ruhelage (seitlich hängend) zurück. Jetzt beginnt der eigentliche Test: Nach einigen Sekunden soll die VP, immer noch mit geschlossenen Augen, versuchen ihren Zeigefinger auf den eben vereinbarten Bezugspunkt zu setzen. Der dabei gezeigte Testpunkt wird vom VL markiert. Sind alle Punkte getestet, werden die Abstände zwischen Bezugs- und Testpunkten (Fehler) auf 0,5 cm genau gemessen und ins Protokoll (nächste Seite) übertragen. Lern- und Ermüdungseinflüsse werden durch eine zufällige Reihenfolge (Zufallszahlen) der zu testenden Bezugspunkte ausgeglichen. Man kann den Einfluss der eigenen Motorik der VP testen, indem man sie zum Aufsetzen des Zeigefingers mit offenen Augen auffordert. Soll die Genauigkeit einer VP mit der einer anderen verglichen werden, muss man auf eine Standardarmlänge (70 cm) normieren; beträgt beispielsweise die aus allen Tests durch Mittelung errechnete Genauigkeit bei einer VP 3,8 cm bei einer Armlänge von 63 cm, dann ergibt sich für die normierte Genauigkeit: 3,8 cm * 70 cm / 63 cm = 4,2 cm. Messungen und Auswertungen: a) Für zwei bzw. drei VP soll ein Testpunkt pro Bezugspunkt bestimmt werden. Mittelwert und Standardabweichung werden errechnet. b) Für eine VP sollen 10 Testpunkte pro Bezugspunkt bestimmt werden. Zu ermitteln sind: Durchschnitts-fehler pro Kreis; Gesamtfehler ± Standardabweichung; mögliche Anhäufung von besten (kleine Fehler) bzw. schlechtesten Testpunkten (große Fehler); Anhäufung von Fehlern als Funktion des Kreises.
ZNS 34
Grundzüge der klinischen Sensibilitätsprüfung
Die Routineuntersuchung umfasst die Überprüfung der folgenden sensiblen Qualitäten: 1. Schmerz (mit einem Nadelrad oder einer Nadel) 2. Temperatur (mit Reagenzröhrchen, in denen vorher warmes bzw. kaltes Wasser
eingefüllt wurde) 3. Berührung (mit einem Wattestäbchen) 4. Vibration (mit einer kalibrierten Vibrationsgabel) 5. Lageempfindung (manuell) 6. 2-Punkt-Diskrimination (mit zwei Nadeln / mit dem Zirkel) Bei der praktischen Durchführung sind folgende Punkte zu beachten: - Es empfiehlt sich ein schematisches Vorgehen, bei dem die verschiedenen Qualitäten im Seitenvergleich an den Extremitäten, am Rumpf und am Kopf geprüft werden. Dabei werden zunächst die gleichen Körperregionen bilateral vergleichend geprüft. Anschließend erfolgt eine unilaterale Untersuchung von proximal nach distal. Dieses Procedere ist wichtig, da man sonst z.B. bei einer Polyneuropathie, die typischerweise mit distal betonten Sensibilitäts-störungen an den Extremitäten einhergeht, dieses Verteilungsmuster nicht erfassen würde. - Bei der Untersuchung mit dem Nadelrad und mit dem Wattestäbchen empfiehlt sich ein zirkuläres Umfahren der Extremitäten, um möglichst alle Dermatome und Innervationsfelder peripherer Nerven einzubeziehen (s. Abb. 7 und 8).
ZNS 35 - Die exakte Prüfung der Vibrations-Empfindung ist wichtig, da diese Qualität bei Polyneuro-pathien als erste beeinträchtigt ist und das Ausmaß der Pallhypästhesie quantifizierbar ist, wodurch eine Verlaufsbeurteilung ermöglicht wird. Die Vibrationsgabel wird an prominenten Knochenpunkten (Beckenkamm, Tibia, Malleolen, Zehen, Olecranon, Handknöcheln, Finger) aufgesetzt und die VP wird aufgefordert mitzuteilen, wann sie die Vibration nicht mehr verspürt. Der Untersucher ließt dann an der Skala der Gabel die noch scharf sichtbare Zahl ab und gibt das Ausmaß der Pallästhesie (0/8 bis 8/8) an. - Bei der Prüfung des Lagesinnes wird die VP aufgefordert, die Augen zu schließen und Gelenkstellungen an distalen Extremitätenabschnitten, die vom Untersucher eingestellt werden, mit "oben" bzw. "unten" zu benennen. Der Untersucher sollte die Zehen oder Finger des Patienten seitlich anfassen, da sonst die Gelenkexkursionen von der VP über Druck-rezeptoren erfasst werden könnten. Ferner sollten nur geringe Gelenkexkursionen vor-genommen werden. Die Klinische Untersuchung: Die Sensibilitätsüberprüfung erfordert ein hohes Maß an Kooperation des Patienten und wird in der Regel am Ende der klinisch neurologischen Unter-suchung durchgeführt. Hirnnervenfunktionen, Motorik, Reflexe und Koordination werden vorher geprüft und die Befunde bei der Sensibilitätsprüfung berücksichtigt. So wird man z.B. bei einer Lumboischialgie mit Fußsenkerparese und ipsilateraler Abschwächung des Achilles-Sehnenreflexes gezielt nach einer Sensibilitätsstörung im S1-Dermatom suchen; ferner muss dann die Sensibilität im perianalen Bereich und an der Oberschenkelinnenseite geprüft werden, um eine Kaudaläsion auszuschließen. Bei einer Querschnittsläsion wird man gezielt versuchen, die Begrenzung des sensiblen Querschnittes festzulegen, und die ausgefallenen Qualitäten zu bestimmen. Die Sensibilitätsuntersuchung sollte zeitlich auf maximal 30 Minuten beschränkt werden, da erfahrungsgemäß die Konzentration der Patienten bei längeren Untersuchungen abnimmt und die Angaben unzuverlässig werden. Häufig sind Nachuntersuchungen erforderlich. Wichtig ist die Identifizierung von psychogenen Sensibilitätsstörungen, die häufig als Halbseiten-störungen beschrieben werden. Psychogene Störungen sind dann leicht zu erkennen, da sie in der Regel als streng median begrenzt angegeben werden, während echte Halbseitenausfälle paramedian begrenzt sind. Ferner wird bei psychogenen Halbseitenstörungen häufig im Seitenvergleich eine Pallhypästhesie der ipsilateralen Stirnseite angegeben, die in Wirklich-keit nicht existieren kann.