Ethanol und seine Verwandten die Chemie der Alkohole · kaum mehr, als dass Alkohol eine...
Transcript of Ethanol und seine Verwandten die Chemie der Alkohole · kaum mehr, als dass Alkohol eine...

6 RAAbits Realschule Chemie März 2014
1 von 30Organische Verbindungen 3. Die Chemie der Alkohole (Kl. 9/10)VII/A
Ethanol und seine Verwandten – die Chemie der Alkohole
Beitrag und Illustrationen von Peter Baumgartner, Freiburg
Alkohol ist für viele Schüler eine ge-heimnisvolle und zumeist verbotene Substanz. Obwohl in ihrem sozialen
Umfeld dauernd präsent, wissen die Schüler kaum mehr, als dass Alkohol eine Flüssigkeit ist, die betrunken macht.
In dieser Unterrichtseinheit erforschen die Schüler in einfachen und spannenden Expe-rimenten die Eigenschaften von Ethanol und Glycerin und lernen den Aufbau von Alkohol-molekülen kennen. Anhand des Wissens über den Bau der Moleküle deuten die Schüler die spezifischen Eigenschaften der Alkohole. Au-ßerdem lernen sie die Nomenklaturregeln für Alkohole kennen und können damit sowohl einwertige als auch mehrwertige Alkohole be-nennen.
Das Wichtigste auf einen Blick
Klasse: 9/10
Dauer: 6 Stunden (Minimalplan: 4)
Kompetenzen: Die Schüler …
• könnenmitExperimentenEigenschaftender Alkohole ermitteln.
• kennenMolekülaufbauundNomenklaturein- und mehrwertiger Alkohole.
• können beobachtbare Eigenschaften derAlkohole in chemischer Fachsprache er-klären.
Versuche:
• DieEthanolrakete(LV)
• Ethanolbrennt(LV)
• EthanolundseineEigenschaften(SV)
• Wasser, Ethanol und Benzin – lässt sichdasmischen?(SV)
• ElektrischeLadungvonEthanol(SV)
• Glycerin–einFrostschutzmittel?(SV)
Übungsmaterial:
• Ethanolkreuzundquer
• DasEthanolmolekül–wieistesaufgebaut?
• Alkohol-Trimino
• Jetztweißich’s!–Alkohole
• DrehscheibeAlkohol
Alkohol kann man trinken – oder etwa nicht? Hierlernen Ihre Schüler, dass Alkohol nicht gleich Alko-hol ist.
Foto
:Th
inks
tock
/iS
tock
Alle Versuche auch
als Kurzfilm auf CD!
zur Vollversion
VORS
CHAU

6 RAAbits Realschule Chemie März 2014
VII/A2 von 30 3. Die Chemie der Alkohole (Kl. 9/10) Organische Verbindungen
Was Sie zum Thema wissen müssen
Was versteht man unter Alkoholen?
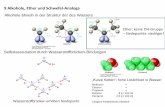
Alkohole sind chemisch gesehen eine Gruppe von Kohlenwasserstoffen, die eine oder mehre-re Hydroxygruppen (OH-Gruppen) enthalten.DieKohlenstoffatome,dieeineHydroxygruppebesitzen, sind entweder mit einem weiteren Kohlenstoffatom oder/und mit Wasserstoffato-men verbunden.
AlkoholemiteinerHydroxygruppesindeinwertig und werden nach dem verwandten Alkan und der Endung -ol benannt (allgemeine Summenformel C
nH
2n+1OH). Befinden sich mehrere
HydroxygruppenimMolekül(mehrwertige Alkohole), wird deren Stellung im Molekül durch Nummerierung und Nennung der Anzahl vor der Endung -ol angegeben (z. B. Propan-1,2,3-triol).
Die bekanntesten einwertigen Alkohole sind Methanol und Ethanol. Bekannte mehrwertige Alkohole sind die süßen Alkohole Glycol (Ethan-1,2-diol), Glycerin (Propan-1,2,3-triol) und Sorbit(Hexanhexol).FürSchülerversucheeignetsichdashygroskopische(wasseranziehen-de) Glycerin, da es ungiftig ist, den Gefrierpunkt von Wasser in Minusgrade verschiebt und denSchülerinnenundSchüler*imAlltagoftbegegnet(VerwendunginCremes,alsLebens-mittelzusatz etc.).
Eigenschaften von Ethanol
Ethanol,auchTrinkalkoholgenannt,istderbekannteste Alkohol. Ethanol ist flüssig, brennbar und– imGegensatz zuMethanol – fürdenChemieunterrichtbesonders interessant,daesrelativ ungiftig ist. Es ist aktuell in aller Munde wegen seiner Verwendung als Treibstoff. Für diemeistenVersuchekannderbilligeBrennspiritusverwendetwerden,derzu96%ausEtha-nol besteht. Brennspiritus ist von der Branntweinsteuer befreit, aber mit Stoffen vergällt und damit ungenießbar gemacht.
Ethanol ist sowohl polar als auch unpolar und mischt sich deshalb sowohl mit Wasser als auch mit (kurzkettigen) unpolaren Kohlenwasserstoffen. Die Polarität kommtvonderHyd-roxygruppe, da deren Sauerstoffatom das bindende Elektronenpaar zwischen sich und dem Wasserstoffatom zu sich heranzieht. Somit bilden sich eine negativeTeilladung am Sauer-stoffatom und eine positiveTeilladung amWasserstoffatom aus. Das Mischverhalten lässt sich also damit erklären, dass sich die polaren Wassermoleküle elektrostatisch an die gelade-neHydroxygruppeanlagern.Kurzkettige,unpolareKohlenwasserstoffe,wiez.B.Wundbenzin(einGemischausüberwiegendPentanundHexan),könnensichdagegenamunpolarenRestdesEthanolsanlagern.InVersuchenermittelndieSchülernebenderMischbarkeitdieDichte (0,79 g/ml) und die Siedetemperatur(78,3°C)vonEthanol.
Herstellung von Ethanol
Hefepilze benötigen Zucker für ihren Stoffwechsel und erzeugen bei dessen Abbau unter Luftabschluss (anaerob) Kohlenstoffdioxid und Ethanol. Da Ethanol die Hefepilze ab einerKonzentrationvon17%abtötet,erhältmanhöhereKonzentrationennurdurchDestillation. WerdenalsRohstoffeGetreide,KartoffelnoderMaisverwendet,mussderenStärkevordereigentlichen Alkoholproduktion in Zucker umgewandelt werden.
IneinemalternativenVerfahrenkannEthanolausWasserundEthensynthetisiertwerden.
* Im weiteren Verlauf wird aus Gründen der besseren Lesbarkeit nur „Schüler“ verwendet.
Vorschläge für Ihre Unterrichtsgestaltung
Voraussetzungen der Lerngruppe
Zur erfolgreichen Bearbeitung dieser Unterrichtseinheit sollten die Schüler die homologe Rei-he der AlkanemitNamenkennen.Siesolltenwissen,dasssichaufeinanderfolgendeVerbin-dungen jeweilsumeineCH2-Gruppe unterscheiden und dass in den zunehmenden Ketten-längen der Moleküle die Änderung der Eigenschaften begründet ist. ZumVerständnis der
zur Vollversion
VORS
CHAU

6 RAAbits Realschule Chemie März 2014
3 von 30OrganischeVerbindungen 3.DieChemiederAlkohole(Kl.9/10)VII/A
PolaritätderHydroxygruppesolltendieSchülerdiechemischen BindungstypenunddieTen-denz mancher Elemente, Elektronen stärker anzuziehen und polare Strukturen auszubilden, kennengelernt haben. Die Schüler sollten außerdem im Umgang mit dem Molekülbaukasten geübt sein.
Aufbau der Unterrichtseinheit
Als motivierender Einstieg in die Einheit stehen Ihnen zweiVarianten zurVerfügung: Eineeinfache,auseinerleerenPET-GetränkeflaschehergestellteEthanolrakete(Variante1)sorgtfür einen spektakulären Start in diese Einheit. Mit der Farbfolie M 1(Variante2)erhaltendieSchülerersteInformationenzumThema„Alkohol“undbringeneigenesVorwissenein.DerLehrerversuch „Ethanol brennt“, bei dem Ethanol entzündet wird, demonstriert den Schü-lern, dass Ethanol leicht entzündlich ist.
In den Schülerversuchen M 2 und M 3 werden die Dichte und der Siedepunkt von Ethanol ermittelt. Das Arbeitsblatt M 4 und das Kreuzworträtsel M 5 dienen dazu, den Schülern nahe-zubringen, wie Ethanol hergestellt und verwendet wird.
Mithilfe des Schülerversuchs M 6 erfahren die Schüler mehr über die Mischbarkeit von Etha-nol, Wasser und Benzin. Arbeitsblatt M 7 leitet die Schüler dazu an, das Ethanolmolekül mit dem Molekülbaukasten nachzubauen und sich so dessen Struktur zu verinnerlichen. Über den Schülerversuch M 8findendieSchülermehrüberdaselektrostatischeVerhaltenvonEthanol,WasserundWundbenzinheraus.Sieerfahren,dassdieOH-Gruppepolarist.
Die Schüler lernen weitere Alkohole kennen und üben mithilfe des Arbeitsblattes M 9 deren Nomenklatur. Das Trimino M 10 dient zur Übung der Nomenklatur von Alkoholen. Als weite-rer Alkohol wird das Glyceringenauerbetrachtet.HierzudientArbeitsblatt M 11 und mit der Versuchsanleitung M 12 wird seine Eignung als Frostschutzmittel getestet.
Alternative AlleVersuchesindaufderCD als Filmegespeichert.DieVideoserleichternIhreVorbereitungundkönnen–fallsSieauszeitlichenodersonstigenGründennichtzurDurchführungimUnterrichtkommen–denSchülernvorgeführtwer-den. So kann auch das brennende Ethanol als Film gezeigt werden.
Angebote zur Differenzierung
Arbeitsblatt M 4findenSieaufderCDinvereinfachterVersionmitLösungswörternanstattSilben.
Im Kreuzworträtsel M 5sindeinigeBuchstabenvorgegeben.FürTüftlergibtesaufderCDeineVorlageohnedieseBuchstabenhilfen.
Das Trimino M 10könnenSienachdemVersuchM12austeilenundsonutzen,dassschnelle-reSchüleresschonbearbeiten,währendlangsamereSchülernochdenVersuchM12durch-führen.WerdasTriminonichtinderStundeschafft,solldenRestalsHausaufgabebearbeiten.
Ideen für die weitere Arbeit
DasThema„Alkohol“ istmitdieserUnterrichtseinheitnochnichtausgeschöpft.DasThema„Ethanol als Treibstoff“ bietet die Möglichkeit einer Auseinandersetzung mit den sozialen Folgen („Lebensmittel imTank“). Auch dasThema „Auswirkungen des Alkohols auf den menschlichen Körper“ und „Alkoholismus“könnten–eventuellfächerübergreifendmitdemFachBiologie–behandeltwerden.
In praktischenVersuchen können die SchülerAlkohol durch Vergärung von Zuckerwasser selbst herstellen und destillieren.
Den Abschluss der Einheit bildet die Anfertigung einer Drehscheibe M 13, auf der sich die Eigenschaften verschiedener Alkohole ablesen lassen, und das Arbeitsblatt M 14, das zur Wiederholung des in dieser Einheit Gelernten dient.
Üben
zur Vollversion
VORS
CHAU

6 RAAbits Realschule Chemie März 2014
5 von 30OrganischeVerbindungen 3.DieChemiederAlkohole(Kl.9/10)VII/A
Die Einheit im Überblick
·V=Vorbereitung FO=Folie AB=Arbeitsblatt
·D=Durchführung SV=Schülerversuch LEK=Lernerfolgskontrolle
VP=Versuchsprotokoll LV=Lehrerversuch LP=Lehrerpräsentation
=ZusatzmaterialaufCD
Stunde 1–2: Eigenschaften von Ethanol
LV
·V:5min
·D: 10 min
Die Ethanolrakete
1 Schutzbrille
1PET-Getränkeflasche(1,5Liter)
1 Streichholz an einem langem Stock
1 Glasrohr oder Nagel
1 Kunststoffregenrinne 1 Meter
10 ml Ethanol oder Brennspiritus
(Film) Kurzfi lm zum Lehrerversuch „Die Ethanolrakete“
M 1 (FO) Was haben diese Dinge gemeinsam?
LV
·V:5min
·D:5min
Ethanol brennt
1 Schutzbrille
1 Uhrglas
1 Flasche Ethanol
1 Feuerzeug
(Film) Kurzfi lm zum Lehrerversuch „Ethanol brennt“
M 2 (AB/SV)
·V:5min
·D: 10 min
Ethanol – welche Dichte hat es?
2 Schutzbrillen (pro Gruppe)
1 Waage
1 Messzylinder (pro Gruppe)
100 ml Ethanol (pro Gruppe)
M 3 (AB/SV)
·V:5min
·D:15min
Ethanol – wie hoch liegt seine Siedetemperatur?
2 Schutzbrillen (pro Gruppe)
1 Stativmaterial
1Teelicht(proGruppe)
1Thermometer(proGruppe)
1 Streichholzschachtel (pro Gruppe)
1 Stoppuhr (pro Gruppe)
Siedesteinchen
1Reagenzglas,ca.2cmhochge-füllt mit Ethanol (pro Gruppe)
(Film) Kurzfi lm zum Schülerversuch M 3
M 4 (AB) Ethanol – wie wird es hergestellt?
M 5 (AB) Ethanol kreuz und quer – Vorkommen und Verwendung
Stunden 3: Der Aufbau des Ethanolmoleküls
M 6 (SV/AB)
·V:10min
·D: 10 min
Wasser, Ethanol und Benzin – lässt sich das mischen?
3 Schutzbrillen (pro Gruppe)
3 Pipetten (pro Gruppe)
3 Stopfen (pro Gruppe)
3Reagenzgläser(proGruppe)
1Reagenzglasständer(proGruppe)
3ReagenzgläsermitWasser,Etha-nol, Benzin (pro Gruppe)
(Film) Kurzfi lm zum Schülerversuch M 6
(LP) Präsentation „Ethanol liebt Wasser“
(LP) Präsentation „Erforschung des Ethanolmoleküls“
füllt mit Ethanol (pro Gruppe)
zur Vollversion
VORS
CHAU

6 RAAbits Realschule Chemie März 2014
VII/A6 von 30 3. Die Chemie der Alkohole (Kl. 9/10) Organische Verbindungen
(LP) Präsentation „Die OH-Gruppe“
M 7 (SV/AB)
·V:5min
·D: 10 min
Das Ethanolmolekül – wie ist es aufgebaut?
aus dem Molekülbaukasten:
2 Kohlenstoffatome (pro Gruppe)
6 Wasserstoffatome (pro Gruppe)
1 Sauerstoffatom (pro Gruppe)
8Verbindungsstücke(proGruppe)
(Film) Das Ethanolmolekül im Modell
M 8 (AB/SV)
·V:5min
·D: 10 min
Die OH-Gruppe unter der Lupe
3 Schutzbrillen (pro Gruppe)
1 Glaspipette mit Pipettierhilfe (pro Gruppe)
1 breite Glasschale (pro Gruppe)
1Hartgummistab(proGruppe)
1 Kunstfasertuch (pro Gruppe)
3ReagenzgläsermitWasser, Ethanol, Benzin (pro Gruppe)
Stunden 4–5: Mehrwertige Alkohole
(Quiz) Interaktives Quiz
(LP) Präsentation „Benennung mehrwertiger Alkohole“
M 9 (AB) Mehrwertige Alkohole
M 10 (AB) Alkohol-Trimino
Präsentation „Mindmap Glycerin“
M 11 (AB) Glycerin – ein süßer Alkohol
M 12 (SV/AB)
·V:10min
·D: 10 min
Glycerin – ein Frostschutzmittel?
4 Schutzbrillen (pro Gruppe)
1 Waage
1 Glasstab (pro Grup-pe) (pro Gruppe)
1 Stoppuhr (pro Gruppe)
1 hohes Becherglas (pro Gruppe)
2Reagenzgläser (pro Gruppe)
2Thermometer (pro Gruppe)
gecrushtes Eis
Glycerinlösungen (20%und40%)
Kochsalz
(Film) Kurzfilm zum Schülerversuch M 12
Stunden 6: Drehscheibe Alkohol
M 13 (AB)
·V:5min
·D:15min
Drehscheibe Alkohol
1 Schere (pro Schüler)
1Cutter(proSchüler)
1 Schneideunterlage (pro Schüler)
1Locher
1Rundklammer(proSchüler)
M 14 (LEK) Jetzt weiß ich’s! – Alkohole
Minimalplan
Durch Weglassen des Triminos M 10 und der Drehscheibe M 13 undVerschiebenvon Arbeits-blatt M 14 indie5.Stunde,könnenSiedieEinheitumeineStundeverkürzen.LassenSiezusätzlich den Schülerversuch M 12 weg, dann benötigen Sie für die Einheit nur vier Stunden.
zur Vollversion
VORS
CHAU

6 RAAbits Realschule Chemie März 2014
7 von 30OrganischeVerbindungen 3.DieChemiederAlkohole(Kl.9/10)VII/A
M 1Was haben diese Dinge gemeinsam?
Medikamente (Echinacin, Iberogast, Umckaloabo)
Spiritusbrenner
Wein Bier
Tankstelle(E10) Ethanol
Fo
tos:
1,
2u
nd
5,
6:T
hin
ksto
ck/i
Sto
ck;
3,
4:
ww
w.c
olo
urb
ox
.co
m
1
3
5
2
4
6
zur Vollversion
VORS
CHAU

6 RAAbits Realschule Chemie März 2014
9 von 30OrganischeVerbindungen 3.DieChemiederAlkohole(Kl.9/10)VII/A
M 3Ethanol – wie hoch liegt seine Siedetemperatur?
Die Siedetemperatur ist vom Luftdruck, also der Höhe über dem Meeresspiegel, abhängig. In
diesem Versuch messt ihr die Siedetemperatur von Ethanol, die an eurem Ort gültig ist.
Schülerversuch in Zweiergruppen ·Vorbereitung:5min Durchführung:15min
Aufgabe
FührtdenfolgendenVersuchdurch.
Zeit [min]
0:30 1:00 1:30 2:00 2:30 3:00 3:30 4:00 4:30 5:00 5:30 6:00 6:30 7:00
Temp[°C]
So führt ihr den Versuch durch
1. Einer von euch holt die folgenden Materialien an den Platz.
2 Schutzbrillen
1 Stativmaterial
1Teelicht
1Thermometer
1 Streichholzschachtel
1 Stoppuhr
Siedesteinchen
1Reagenzglas,ca.2 cm hoch gefüllt mit Ethanol
2. Setzt die Schutzbrillen auf. Gebt einige Sie-desteinchenzumEthanolundbefestigtdasRea-genzglas am Stativ.
3. Zündet dasTeelicht an und stellt den Abstandzwischen Flammenspitze und Reagenzglas soein,dasssichdasReagenzglasmindestens3cmüber der Flammenspitze befi ndet.
Öffnung des Reagenzglases nicht auf Perso-nenrichten!
4. Messtalle30SekundendieTemperaturdesEtha-nolsundtragtdieWerteindieTabelleein.
5. LöschtdieFlamme,wenndasEthanolzukochenbeginnt und dieTemperatur längere Zeit kons-tant bleibt.
6. Formuliert einen Ergebnissatz.
Thermo-meter
Ethanol
Siede steinchen
Wusstest du schon, …
… dass Wasser auf dem Mount Everest (höchster Berg der Erde: 8848 Meter über
demMeeresspiegel)schonbei70°Csiedet?IndieserHöheistvielwenigerLuftüber dem Kochwasser als in Meereshöhe. Die Wassermoleküle benötigen des-
halb weniger Energie (Wärme), um sich aus dem fl üssigen Molekülverbund zu
lösen und gasförmig zu werden.
…dassEthanolaufdemMountEverestseinenSiedepunktschonbeica.40°Cerreicht?
Beobachten und Dokumentieren
zur Vollversion
VORS
CHAU

6 RAAbits Realschule Chemie März 2014
VII/A16 von 30 3. Die Chemie der Alkohole (Kl. 9/10) Organische Verbindungen
M 6 Wasser, Ethanol und Benzin – lässt sich das mischen?
Habt ihr den Versuch aufmerksam durchgeführt und verstanden? Hier könnt
ihr es beweisen.
Ergänzt die Beschriftung in den Kästchen oben und notiert eure Beobachtun-genindieFelderunterhalbderReagenzgläser.
Aufgabe 2
ErgänztdenLückentext.
DasEthanolmolekülistaneinerSeite„ “( ), an
deranderenSeite„wasserabstoßend“( ).
Ethanol löst sich in Wasser, da sich an der Seite der Ethanolmoleküle
anlagern.
Ethanol löst sich in Benzin, da sich an der Seite des Ethanolmoleküls das
____________________ Benzin anlagert.
EthanolisteingutesLösungsmittelfürviele Stoffe:
1. 2. 3. 4.
Aufgabe 1
zur Vollversion
VORS
CHAU

6 RAAbits Realschule Chemie März 2014
VII/A22 von 30 3. Die Chemie der Alkohole (Kl. 9/10) Organische Verbindungen
M 10 Alkohol–Trimino
Hast du verstanden, wie die Alkohole benannt werden? Dann wird das
Trimino kein Problem für dich darstellen.
Aufgabe
SchneidedieBestandteiledesTriminosausund legesierichtigzusammen.
Stimmt alles? Dann klebe die Bestandteile auf.
zur Vollversion
VORS
CHAU