Einfluss von Substanz P auf den Schlaf - uni-freiburg.de
Transcript of Einfluss von Substanz P auf den Schlaf - uni-freiburg.de

Aus der Universitätsklinik für Psychiatrie und Psychosomatik
Abteilung für Psychiatrie und Psychotherapie mit Poliklinik
der Albert-Ludwigs-Universität Freiburg i. Br.
Der Einfluss von Substanz P
auf den Schlaf bei Gesunden.
I N A U G U R A L – D I S S E R T A T I O N
zur
Erlangung des Medizinischen Doktorgrades
der Medizinischen Fakultät
der Albert-Ludwigs-Universität
Freiburg i. Br.
Vorgelegt 2005
Von Katharina Kampik
Geboren in Bonn

2
Dekan Professor Dr. J. Zentner
1. Gutachter PD Dr. U. Voderholzer
2. Gutachter PD Dr. St. Sorichter
Jahr der Promotion 2005

3
1. EINLEITUNG .......................................................................................................... 6
1.1 Substanz P........................................................................................................ 6
1.1.1 Allgemeines................................................................................................ 6
1.1.2 Physiologie von SP..................................................................................... 6
1.1.3 Verbreitung und Einfluss auf physiologische Prozesse von SP.................. 8
1.1.4 Ätiopathologische Bedeutung von SP ....................................................... 9
1.1.4.1 Allgemeines ........................................................................................ 9
1.1.4.2 SP in der Pathogenese somatischer Erkrankungen............................ 9
1.1.4.3 SP in der Pathogenese psychiatrischer Erkrankungen ..................... 10
1.1.5 Neurokinin1 (NK1) -Rezeptor-Antagonisten............................................... 12
1.2 Schlaf und Schlafregulation ........................................................................... 13
1.2.1 Allgemeines.............................................................................................. 13
1.2.2 Schlafstadien............................................................................................ 14
1.2.3 Hormonfreisetzung und Schlaf-Wach-Rhythmus...................................... 15
1.2.4 Einfluss von Hormonen auf den Schlaf-Wach-Rhythmus ......................... 16
1.3 Depression...................................................................................................... 16
1.3.1 Allgemeines.............................................................................................. 16
1.3.2 Ätiologie und Pathogenese....................................................................... 17
1.3.3 Depression und Schlaf ............................................................................. 18
1.4 Fragestellung .................................................................................................. 19
2 UNTERSUCHUNGSTEILNEHMER, MATERIAL UND METHODEN.................... 20
2.1 Untersuchungsteilnehmer ............................................................................... 20
2.1.1 Allgemeines.............................................................................................. 20
2.1.2 Ein- und Ausschlusskriterien .................................................................... 20
2.1.3 Demographische Daten der Probanden ................................................... 22
2.2 Material ........................................................................................................... 22
2.2.1 Materialien und Geräte für die polysomnographische Ableitung .............. 22
2.2.2 Materialien zur Blutentnahme................................................................... 23
2.3 Untersuchungsmethoden ................................................................................ 23
2.3.1 Untersuchungsablauf................................................................................ 23

4
2.3.2 Messparameter......................................................................................... 25
2.3.2.1 Hormonanalyse.................................................................................. 25
2.3.2.2 Polysomnographie ............................................................................. 26
2.3.2.3 Psychometrische Analysen................................................................ 28
2.3.3 Statistische Auswertung ........................................................................... 29
3 ERGEBNISSE ....................................................................................................... 32
3.1 Effekte von SP auf Befindlichkeit, Stimmung und Verhalten ........................... 32
3.2 Effekte von SP auf den Puls ........................................................................... 36
3.3 Effekte von SP auf den Blutdruck ................................................................... 38
3.4 Effekte von SP auf subjektive Schlafparameter .............................................. 39
3.5 Effekte von SP auf objektive Schlafparameter ................................................ 44
3.6 Polysomnographische Darstellung.................................................................. 55
4 DISKUSSION ........................................................................................................ 58
4.1 Versuchsprotokoll ........................................................................................... 58
4.2 Effekte von SP auf Schlafparameter ............................................................... 59
4.3 Effekte von SP auf psychometrische Parameter............................................. 60
4.4 Effekte anderer Neuropeptide auf den Schlaf ................................................. 60
4.4.1 Corticotropin releasing hormone (CRH) ................................................... 61
4.4.2 Adrenocorticotropes Hormon (ACTH)....................................................... 62
4.4.3 Arginin vasopressin (AVP)........................................................................ 62
4.4.4 Wachstumshormon (GH) und
Growth hormone releasing hormone (GHRH) ......................................... 63
4.4.5 Neuropeptid Y (NPY)................................................................................ 63
4.4.6 Thyreotropin-releasing hormone (TRH).................................................... 64
4.4.7 Cholezystokinin (CZK).............................................................................. 64
4.4.8 Vasoaktives intestinales Polypeptid (VIP) ................................................ 65
4.4.9 Tabellarische Darstellung ......................................................................... 66
4.5. Die Rolle der Bluthirnschranke....................................................................... 67
4.6 Zusammenfassung.......................................................................................... 68

5
5 TABELLEN UND ABBILDUNGEN......................................................................... 69
6 QUELLENVERZEICHNIS...................................................................................... 78
7 LEBENSLAUF ....................................................................................................... 88
8 DANKSAGUNG ..................................................................................................... 89
8 ANHANG ............................................................................................................... 90

1. Einleitung
1.1 Substanz P
1.1.1 Allgemeines
Die vorliegende Dissertationsschrift beschäftigt sich mit dem Einfluss von Substanz P
auf den Schlaf-Wach-Rhythmus des Menschen.
Im Jahre 1931 entdeckten von Euler und Gaddum, dass ein Extrakt aus Pferde-
intestinum und -gehirn Kontraktionen intestinaler glatter Muskulatur hervorruft. Sie
nannten dieses Extrakt Substanz P (SP). P steht für „preparation“ (engl. Zubereitung)
(Maggio et al. 1988). Nach langer Forschungsarbeit wurde SP 1970 durch Chang
und Lehmann (Chang et al. 1970) als ein aus 11 Aminosäuren bestehendes
Neuropeptid identifiziert, welches der Gruppe der Tachykinine angehört.
Als Tachykinine werden Peptide zusammengefasst, welche die Carboxy-terminale
Aminosäuresequenz Phe-X-Gly-Leu-Met·NH2 aufweisen (Erspamer 1981). Der Name
entstand durch ihre Fähigkeit, glatte Muskulatur rasch kontrahieren zu lassen (im
Gegensatz zu Bradykininen). Im Nervensystem von Säugetieren gefundene Tachyki-
nine werden als Neurokinine bezeichnet. Dies sind, neben SP, Neurokinin A (NKA)
sowie Neurokinin B (NKB). Im zentralen Nervensystem (ZNS) ist SP das am
weitesten verbreitete Tachykinin (Arai et al. 1986).
Insbesondere SP-enthaltende Neurone sind im gesamten menschlichen Körper weit
verbreitet und vermitteln eine Vielzahl physiologischer Prozesse. Ebenso sind sie an
der Entstehung verschiedener Pathologien beteiligt.
1.1.2 Physiologie von SP
SP kann von drei alternativ gespleissten Formen des Prepro-Tachykinin-A (PPT-A)
Gens synthetisiert werden (Krause et al. 1987).
SP vermittelt seine Effekte über G-Protein-gebundene Rezeptoren, den Neurokinin-
Rezeptoren. SP bindet an Neurokinin-1-Rezeptoren (NK-1-R) und mit geringerer
Affinität an NK-2- und NK-3-Rezeptoren, vergleiche Abbildung 1. Die NK1-Rezep-

7
toren können durch spezifische NK1-Rezeptor-Antagonisten wirkungsvoll geblockt
werden (Kramer et al. 1998; Stout et al. 2001).
Abbildung 1: Tachykinin-Liganden und Rezeptor-Familien (die gemeinsame Tachy-
kinin-Aminosäurensequenz ist fett gedruckt). Entnommen aus Stout et al. 2001.
Die metabolische Eliminierungsrate liegt bei 0.361 x kg-1 x min-1 und die Halbwerts-
zeit exogen zugeführter SP beträgt 1,6 Min. (Schaffalitzky et al. 1986).
Der Abbau von SP erfolgt durch enzymatische Spaltung. Tierversuche unter in vitro
und in vivo Bedingungen führten zu der Annahme, dass SP das Substrat verschie-
dener Endopeptidasen wie Angiotensin converting enzyme (ACE), prolyl-Endopepti-
dase und neutrale Endopeptidase (Yokosawa et al. 1985; Casceiri et al. 1983;
Welches et al. 1993) ist.

8
1.1.3 Verbreitung und Einfluss auf physiologische Prozesse von SP
SP-enthaltende Neurone sind im menschlichen Körper weit verbreitet, SP ist somit
an der Regulation einer Vielzahl physiologischer Prozesse beteiligt. SP-Immuno-
reaktivität ist unter anderem in gastrointestinalen Neuronen, in der Lunge, im Gefäß-
system, im peripheren und zentralen Nervensystem zu finden. Im Bereich des ZNS
sind SP-immunoreaktive Neurone in distinkt verteilten neuronalen Netzen lokalisiert.
Im Hirnstamm sind SP-Neurone in der Medulla oblongata, genauer im Tractus solita-
rius (Pioro et al. 1990), in den dorsalen Motoneuronen des Nucleus Nervi Vagi
(Halliday et al. 1988), in der Formatio reticularis sowie in Nucleus raphe und Nucleus
pallidus zu finden. Auch stellen sich Bereiche der Pons positiv dar. Im Mittelhirn,
besonders in der Substantia Nigra sind in hoher Dichte SP-positive Neurone zu fin-
den. SP-immunoreaktive Neurone finden sich in allen Bereichen des Neokortex
(Pioro et al. 1990), vor allem in den oberen drei kortikalen Schichten und in der
subkortikalen weißen Hirnsubstanz. Die Basalganglien sind ebenfalls SP-immuno-
reaktiv. Der Hippokampus enthält diese Neurone (hiläre Region der Linea dentata
und Unkus) ebenso wie die Amygdala, endokrine Zellgruppen des Hypothalamus,
das limbische System und das Rückenmark (Pioro et al. 1990).
Da SP im ZNS häufig auch mit anderen Neurotransmittern kolokalisiert ist, kann sie
weitreichende neuromodulatorische Effekte ausüben. Beispiele sind das gemein-
same Vorkommen mit Serotonin im Raphekern (Sergeyev et al. 1999), mit Dopamin
in Mittelhirn und Striatum, mit GABA und Acetylcholin im Kortex und mit Corticotropin
releasing hormone (CRH) im Hypothalamus (Otsuka et al. 1993).
Die wesentlichen physiologischen Funktionen von SP umfassen die Neurotransmis-
sion im ersten afferenten Neuron, dort im besonderen die Nozizeption, ferner die
Funktion als Entzündungsmediator sowie neuromodulatorische Effekte (Newby et al.
1997). Beispiele dafür sind die Regulation der Acetylcholin-Freisetzung im humanen
Kortex (Feuerstein et al. 1997) und die Modulation der noradrenergen Neurotrans-
mission im Locus coeruleus (Hahn et al. 1999). Des weiteren hat SP ausgeprägte
vasodilatatorische Effekte, welche über endothelial gebundenes Stickstoffmonoxid
vermittelt werden (Luu et al. 1992, Rees et al. 1989).

9
1.1.4 Ätiopathologische Bedeutung von SP
1.1.4.1 Allgemeines
Aufgrund seiner weiten Verbreitung und seiner neuromodulatorischen Eigenschaften
wird angenommen, dass SP neben der Regulation diverser physiologischer Erschei-
nungen auch mit der Ätiopathologie verschiedener Erkrankungen in Zusammenhang
steht. Beispiele sind Asthma, entzündliche Darmerkrankungen, Erbrechen, Schmerz-
syndrome inklusive Fibromyalgie und Migräne sowie die Psoriasis und diverse
Bewegungsstörungen (Quartara und Maggi 1998; Rupniak und Kramer et al. 1999).
Auch wird eine mögliche Beteiligung von SP an der Entstehung psychiatrischer
Erkrankungen diskutiert. Dabei handelt es sich im einzelnen um Schizophrenie,
affektive Störungen, Angststörungen und soziale Phobien (Quartara und Maggi 1998;
Rupniak und Kramer et al. 1999; Stout et al. 2001).
Diese große Bandbreite möglicher Indikationen für einen NK1-Rezeptorblocker inten-
sivierte in den frühen neunziger Jahren die pharmazeutische Forschung auf diesem
Gebiet.
1.1.4.2 SP in der Pathogenese somatischer Erkrankungen
Am weitesten fortgeschritten ist die bereits Anfang der fünfziger Jahre begonnene
Forschung über die Bedeutung von SP in der Schmerzwahrnehmung. SP wird in
primär sensorischen Neuronen exprimiert (Hockfelt et al. 1975). Experimentell führte
eine prolongierte schädigende Stimulation zu einer vermehrten Ausschüttung von SP
in den Hinterhörnern des Rückenmarks (Shults et al. 1984). Des weiteren werden bei
verschiedenen Schmerzsyndromen wie der Fibromyalgie, der peripheren Neuro-
pathie und der rheumatoiden Arthritis erhöhte Konzentrationen von SP im Liquor
cerebrospinalis gefunden (Russell et al. 1994; Russell et al. 1998; Rupniak et al.
1999). Aufgrund dieser Erkenntnisse lag es nahe, NK1-Rezeptorantagonisten zur
Behandlung akuter Schmerzzustände wie zum Beispiel Zahnschmerzen, Migräne,
rheumatoide Arthritis und postherpetische Neuralgie zu verwenden. In klinischen
Versuchen erwies sich dies jedoch als unwirksam (Block et al. 1998; Rupniak et al.
2000). Wie anhand von Tierversuchen mit Knockout-Mäusen für den NK1-Rezeptor
gezeigt werden konnte, scheint SP weniger eine Rolle für die Vermittlung akuter

10
Schmerzen, als vielmehr für die Amplifikation („wind up“) nozizeptiver Signale zu
spielen (De Felipe et al. 1998). Somit könnte die Bedeutung von SP und damit auch
die Wirksamkeit von NK1-Rezeptorantagonisten eher im Bereich chronifizierter
Schmerzzustände liegen. Entsprechende Studien stehen jedoch noch aus.
Die Beteiligung an der Kontrolle des Würgereflexes wird durch das vermehrte Vor-
kommen von SP in den im Hirnstamm lokalisierten Zentren des Würgereflexes, dem
Nucleus solitarius sowie der Area postrema vermutet (Pioro et al. 1990). In Tierver-
suchen konnten antiemetische Eigenschaften von NK1-Rezeptorantagonisten gezeigt
werden. Beim Menschen wurde in verschiedenen klinischen Studien eine Hemmung
des zytostatikainduzierten Erbrechens nach oraler Gabe eines NK1-Rezeptorantago-
nisten festgestellt (Navari et al. 1999).
Ferner wird diskutiert, ob SP eine kausale Funktion in der Genese des Karzinoid-
Syndroms hat, da hier erhöhte Konzentrationen des Neuropeptids gemessen werden
(Vinik et al. 1990).
In Gehirnen von Patienten, die an der Parkinson’schen und der Alzheimer’schen
Erkrankung litten, wurden veränderte SP-Konzentrationen gemessen. So stellt sich
die Frage einer eventuellen Bedeutung der Substanz in der Pathogenese auch die-
ser Erkrankungen, von denen bekannt ist, dass sie viele Neurotransmitter-Systeme
beeinflussen. Eine Studie beschreibt eine erhöhte SP-Konzentration in Gehirnen
unbehandelter Parkinson-Patienten (Constantinidis et al. 1983), andere berichten,
dass diese vermindert sei (Beal und Martin, 1983). Untersuchungen an Gehirnen von
Alzheimer-Patienten, ergaben in einigen Studien eine Entleerung der SP-Vorkom-
men (Beal und Martin 1986) und in anderen Studien keine Veränderung (Ferrier et al.
1983, Yates et al. 1983). Diese unterschiedlichen Ergebnisse können durch das un-
terschiedliche Alter der Patienten und durch verschiedene Krankheitsstadien erklärt
werden. In einem kleinen Teil der kortikalen, senilen Plaques bei Alzheimer Patienten
findet sich SP-Immunoreaktivität (Armstrong und Terry, 1985) - ein weiterer Hinweis
für eine mögliche Bedeutung von SP in der Entstehung dieser Erkrankung.
1.1.4.3 SP in der Pathogenese psychischer Erkrankungen
SP scheint die Aktivität von Dopamin im mesolimbischen System zu beeinflussen,
welches den Hauptwirkort vieler etablierter Psychopharmaka darstellt. Ferner bilden

11
SP-enthaltende Neurone im Mittelhirn Synapsen mit dopaminergen Neuronen. Im
Tierversuch führte die Gabe von SP-Agonisten zu einem erhöhten dopaminergen
Umsatz im Nucleus accumbens und zu gesteigerter Bewegungsaktivität der Tiere
(Elliot et al. 1991, 1992; Tamiya et al. 1990). Aufgrund dieser drei Erkenntnisse
wurde postuliert, dass eine gesteigerte Aktivität der SP-enthaltenden Neurone an der
Entstehung der Schizophrenie beteiligt sein könnte. Im Liquor cerebrospinalis
schizophrener Patienten konnte jedoch keine gesteigerte Konzentration von SP
gefunden werden (Heikkila et al. 1990; Miller et al. 1996; Rimon et al. 1984). Auch
hatte die Gabe des NK1-Rezeptor-Antagonisten MK-869 keinen Einfluss auf die
psychotische Aktivität schizophrener Patienten (Kramer et al. 1998, Lieb et al. 2000).
Ein Zusammenhang von SP mit der Pathogenese affektiver Erkrankungen und
Angsterkrankungen wird hergestellt durch das Vorkommen SP-enthaltender Neurone
in den Regionen des Gehirns, die für die Entstehung dieser Störungen verantwortlich
gemacht werden (Maubach et al. 1999; Rupniak et al. 1999; Pioro et al. 1990). Dies
sind im einzelnen der Locus coeruleus, das limbische System mit Hippokampus und
Amygdala, der Hypothalamus (Pioro et al. 1990) und die Raphe-Kerne, in welchem
SP mit Serotonin kolokalisiert ist (Sergejev et al. 1999).
Weitere Hinweise auf den Einfluss von SP auf die Entstehung von Depression und
Angststörungen ergaben sich aus einigen Tierstudien. In präklinischen Studien an
Ratten konnte gezeigt werden, dass die chronische Gabe von klassischen Antide-
pressiva eine Verminderung der Konzentration von SP im limbischen System verur-
sacht (Shirayama 1996). Diese Eigenschaft könnte für die klinischen Wirkungen von
Antidepressiva von Bedeutung sein. NK1-Rezeptorantagonisten verminderten,
ähnlich wie klassische Antidepressiva (Imipramin, Fluoxetin) oder Anxiolytika (Diaze-
pam) effektiv stressinduzierte Vokalisierungen bei Meerschweinchen-Jungen, die von
ihren Müttern getrennt wurden (Kramer et al. 1998). Diese Trennung vom Muttertier
führte zu einer Vermehrung von Neuronen, die eine NK1-Rezeptorinternalisierung im
limbischen System zeigten. Das weist darauf hin, dass Stressbedingungen zu einer
erhöhten Freisetzung von SP in diesen Regionen führen.
In zwei Studien an Knockout-Mäusen für den NK1-Rezeptor konnte gezeigt werden,
dass die Modulation von Angst durch das SP-System zumindest teilweise über das
serotoninerge System gesteuert wird (Froger et al. 2001; Santarelli et al. 2001). Dies
ist von Bedeutung, da die Wirkung mancher Antidepressiva über eine Erhöhung von

12
Serotonin im synaptischen Spalt vermittelt wird (mittels Hemmung des Sertonin-
Transportproteins).
Zwei weitere Studien zeigten erhöhte Plasmalevel für SP bei Menschen, die chroni-
schem Stress ausgesetzt waren (Schedlowski et al. 1995 bei unerfahrenen Fall-
schirmspringern; Weiss et al. 1996 bei Zivilisten unter Raketenangriffen im Krieg).
1.1.5 Neurokinin1 (NK1) -Rezeptor-Antagonisten
Selektive, nicht-peptiderge Antagonisten für Tachykinin-Rezeptoren wurden erstmals
1991 erhältlich. Anfänglich wurden NK1-Rezeptor-Antagonisten als potentielle
Schmerzmittel untersucht, doch bald ergaben sich aufgrund der oben beschriebenen
Bedeutung von SP in der Ätiopathologie von affektiven Störungen und Angststörun-
gen Hinweise auf eine mögliche Verwendung der NK1-Rezeptor-Antagonisten als
Antidepressiva und Anxiolytika.
Die erste am Menschen durchgeführte Studie mit dem NK1-Rezeptor-Antagonisten
MK-869 zur Therapie von Depression bzw. zur Anxiolyse wurde 1998 von Kramer et
al. veröffentlicht. In dieser placebokontrollierten Studie erhielten 213 Patienten über
einen Zeitraum von 6 Wochen 300 mg MK-869, 20 mg Paroxetin (Antidepressivum
als Verum) oder Placebo. MK-869 und Paroxetin zeigten sich der Placebobehand-
lung überlegen, sowohl hinsichtlich der anxiolytischen als auch der antidepressiven
Wirkung. Der Therapieeffekt wurde mittels Hamilton-Skalen für Depression und
Angst und der CGI-S Skala (Clinical Global Impressions-Severity of Illness Skala)
überprüft. Unter MK-869 kam es bei über 54% der Patienten zu einer über 50%igen
Reduktion des Hamilton-Wertes. Dieses Ergebnis wurde nur bei 28% der Placebo-
therapierten Patienten beobachtet. Eine komplette Remission der Depression war bei
43% der Patienten unter MK-869 (17% unter Placebo) zu verzeichnen. Nebenwir-
kungen traten nicht häufiger auf als bei Placebo-Gabe. In einer anschließenden zur
Dosisfindung durchgeführten Studie an 800 depressiven Patienten konnten diese
Ergebnisse jedoch nicht reproduziert werden. Weder MK-869 noch das Referenz-
Antidepressivum Fluoxetin zeigten sich der Placebo-Behandlung überlegen
(Enserink 1999). Im Anschluss an dieses Ergebnis folgerten Rupniak und Kramer
1999, dass die Wirksamkeit von MK-869 auf ein bestimmtes Patientenkollektiv be-

13
schränkt sei. Für eine genaue Charakterisierung dieser Gruppe reicht der derzeitige
Wissenstand jedoch nicht aus.
Weitere mögliche Indikationen ergeben sich aus Tierversuchen. So hat sich ein im
Tierversuch verwendeter NK1-Rezeptor-Antagonist als anxiolytisch im sozialen
Interaktions-Test erwiesen (File 1997). Eine eventuelle Einsatzmöglichkeit zur
Therapie sozialer Phobien wurde vorgeschlagen. Ein weiterer Indikationsbereich
ergibt sich aus den antiepileptischen Eigenschaften des NK1-Rezeptor-Antagonisten,
die bei Tieren nachgewiesen werden konnten (Liu et al. 1999 a,b). Ferner wurde im
Mai 2000 berichtet, dass Opiate ihre Verstärkerwirkung bei Mäusen verlieren, wenn
diese keinen SP-Rezeptor besitzen (Murtra et al. 2000).
Die derzeitig noch limitierte Datenlage lässt eine genaue Einordnung der Bedeutung
von NK1-Rezeptor-Antagonisten als antidepressives oder anxiolytisches Wirkprinzip
nicht zu. Jedoch kann gesagt werden, dass dieser Ansatz aufgrund der vielfältigen
neuromodulatorischen Effekte von SP und der geringen Nebenwirkungen der NK1-
Rezeptor-Antagonisten viel versprechend scheint.
Weitere psychopharmakologische Studien zu diesem Thema stehen noch aus.
1.2 Schlaf und Schlafregulation
1.2.1 Allgemeines
Schlaf wurde bis weit in das 20. Jahrhundert hinein als ein passiver Zustand verstan-
den, in dem die Körperfunktionen auf ein notwendiges Minimum reduziert waren. Erst
seit wenigen Jahrzehnten, insbesondere seit der Entwicklung des Elektroenzephalo-
gramms (EEG) im Jahre 1924, wurde deutlich, dass sich das Gehirn im Schlaf kei-
neswegs in einem passiven Ruhezustand befindet. Es laufen vielmehr komplexe
Funktionsmuster im ZNS ab, die sich regelmäßig wiederholen. Diese Erkenntnis
führte zu der späteren Einteilung von Schlafstadien.

14
1.2.2 Schlafstadien
Im Jahre 1954 differenzierte man zwischen zwei Schlafarten, dem REM-Schlaf, der
sich durch rasche Augenbewegungen (Rapid-Eye-Movement) auszeichnet, und dem
Non-REM-Schlaf. Später erfolgte die Unterteilung des Non-REM-Schlafes in vier
Schlafstadien, die sich durch spezifische Charakteristika in EEG, Elektrookulogramm
(EOG) und Elektromyogramm (EMG) unterscheiden lassen (Tabelle 1). Stadium 3
und Stadium 4 werden zusammen als Tiefschlafstadien oder slow wave sleep (SWS)
definiert. Durch diese Einteilung konnte man Unterschiede zwischen normalen und
gestörten Schlaf feststellen. In Abbildung 2 ist das Schlafprofil eines Gesunden dar-
gestellt.
Abbildung 2: Schlaf-EEG eines 25 jährigen gesunden Mannes: Einteilung in Non-
REM-Schlaf und Wachzeiten (Berger 1993).

15
Tabelle 1: Charakteristika der verschiedenen Schlafstadien.
Schlafstadium EEG EOG EMG
Wach Alpha-Aktivität Lidschläge, rasche
Augenbewegungen
Hoher Tonus, Be-
wegungsartefakte
REM Theta-Aktivität,
Sägezahnwellen
Konjugierte, rasche
Augenbewegungen
Niedriger Tonus,
phasische Aktivität
Stadium 1 Theta-Aktivität,
Vertexzacken
Langsame
Augenbewegungen
Stadium 2 Theta-Aktivität,
K-Komplexe,
Schlafspindeln
Keine
Augenbewegungen
(EEG-Artefakte)
Stadium 3 Gruppen hoher
Delta-Wellen
(> 20 und < 50%)
Keine
Augenbewegungen
(EEG-Artefakte)
Stadium 4 Gruppen hoher
Delta-Wellen
(> 50%)
Keine
Augenbewegungen
(EEG-Artefakte)
Von Stadium 1 bis 4
Abnahme des
mittleren
Muskeltonus, kaum
Bewegungsartefakte
EEG: Elektroencephalogramm; EOG: Elektrookulogramm; EMG: Elektromyogramm; REM: rapid eye
movement
1.2.3 Hormonfreisetzung und Schlaf-Wach-Rhythmus
Der zirkadiane Verlauf einiger Hormone korreliert mit dem Schlaf-Wach-Rhythmus:
Plasma-Renin und Prolaktin zeigen eine starke NonREM-REM-Korrelation, im
Gegensatz zu einem konstant niedrigen Niveau in den Wachphasen. Das Schilddrü-
senhormon TSH (Thyreoidea-stimulierendes Hormon) hat kurz vor dem Einschlafen
einen Gipfel und fällt im Schlaf ab. Vom Schlaf unabhängig hingegen scheint die
Melatoninausschüttung zu sein, die durch Helligkeit und einen zirkadianen Faktor
gesteuert wird. Auch Kortisol sinkt schlafunabhängig am Abend ab und steigt in den
frühen Morgenstunden an.

16
1.2.4 Einfluss von Hormonen auf den Schlaf-Wach-Rhythmus
Trotz intensiver Bemühungen sind die genauen Mechanismen der Schlaf-Wach-
Regulation bisher nicht genau bekannt. Sicher scheint jedoch zu sein, dass es nicht
einen, sonder ein komplexes System von schlaffördernden und schlafinhibierenden
Faktoren gibt. Neben diversen Hormonen, denen man eine Wirkung zuschreibt (z.B.
Stimulation von REM-Schlaf durch Vasointestinales Peptid (VIP), Prolaktin und
cholinerge Substanzen, eine Verminderung des Tiefschlafes durch Corticotropin
Releasing Hormone (CRH)), gibt es auch Hinweise, dass Komponenten der
somatotropen Achse an der Schlafregulation beteiligt sind. Studien mit Ratten und
Katzen und eine Studie beim Menschen (Mendelson et al. 1980, Copinschi et al.
1997) belegen einen dosisabhängigen Anstieg von REM-Schlaf und eine
Unterdrückung von Tiefschlaf nach GH (Growth Hormone)-Injektionen. In anderen
Untersuchungen wird eine Erhöhung von Tiefschlaf durch GHRH (Growth Hormone
Releasing Hormone) (Steiger et al. 1992; Krüger et al. 1999) und eine REM-Schlaf-
Unterdrückung bei älteren Patienten durch Somatostatin (Frieboes et al. 1997)
angenommen. Bei jüngeren Patienten konnte kein Einfluss von Somatostatin auf die
Schlafqualität nachgewiesen werden.
1.3 Depression
1.3.1 Allgemeines
Die Depression ist eine in der Bevölkerung häufig vorkommende Erkrankung. 7-18%
aller Personen erkranken in ihrem Leben an einer depressiven Episode.
Die drei Hauptsymptome einer Depression sind Interessensverlust oder Verlust von
Freude, gesteigerte Ermüdbarkeit sowie niedergedrückte Stimmung. Weitere
depressionstypische Beschwerden werden als Nebensymptome eingestuft. Diese
sind im Einzelnen Suizidgedanken und –handlungen, Minderung der Konzen-
trationsfähigkeit und der Aufmerksamkeit, vermindertes Selbstwertgefühl und
Selbstvertrauen, Gefühl der Wertlosigkeit und Schuldgefühle, Appetitminderung,
pessimistische und negative Zukunftsperspektiven sowie Schlafstörungen.

17
Die Diagnosestellung einer depressiven Episode („major depression“) folgt den
Richtlinien der Internationalen Klassifikation psychischer Störungen (nach ICD-10).
Hiernach wird die depressive Episode in drei Schweregrade eingeteilt. Zur
Diagnosestellung müssen mindestens zwei der drei Hauptsymptome vorhanden sein.
Treten noch mindestens zwei weitere Nebensymptome auf, handelt es sich um eine
leichte depressive Episode. Bei weiteren drei zusätzlich depressionstypischen
Beschwerden spricht man von einer mittelgradigen depressiven Episode und bei
Auftreten von vier Nebensymptomen von einer schweren depressiven Episode. Die
Nebensymptome müssen zur Diagnosestellung jeweils über einen Zeitraum von
mindestens zwei Wochen bestehen.
1.3.2 Ätiologie und Pathogenese
Sowohl zu der genauen Ätiologie als auch zu der Pathogenese der Depression ist
das heutige Wissen noch lückenhaft. Als gesichert werden eine genetische
Vorbelastung sowie neurobiologische Faktoren betrachtet, eine exakte Zuordnung
dieser Faktoren ist bisher jedoch noch nicht erfolgt. Eine wichtige Rolle spielen
zudem noch psychosoziale Aspekte wie das soziale Umfeld oder psychische
Traumata.
In den letzten dreißig Jahren wurden verschiedene Hypothesen über den Einfluss
neurochemischer Stoffe auf die Ätiopathogenese der Depression aufgestellt. Disku-
tiert wurden dabei die Acetylcholin-Hypothese, die Katecholaminmangel-Hypothese,
die Monoaminmangel-Hypothese sowie die cholinerg-aminerge Imbalance-Hypo-
these. Jedoch konnte keine dieser Theorien die Anforderungen an ein allgemein
gültiges, biologisches Depressionsmodell erfüllen.
Bei der Erhebung neurobiologischer Befunde bei depressiven Patienten sind einige
Gemeinsamkeiten aufgetreten. Die konsistentesten Befunde sind hierbei ein Hyper-
cortisolismus (Holsboer 1995), welcher die Freisetzung von GH und Hormonen der
Schilddrüsenachse zu inhibieren scheint und eine REM-Schlaf-Desinhibition (Berger
und Riemann 1993) verursacht.

18
1.3.3 Depression und Schlaf
Schlafstörungen sind eines der häufigsten Symptome einer depressiven Erkrankung
(Voderholzer et al. 1996). Der Anteil der depressiven Patienten mit ungestörtem
Schlaf oder vermehrtem Schlafbedürfnis ist mit 10-20% gering (atypische Depres-
sion).
Mittels polysomnographischer und klinischer Beobachtungen lässt sich eine gestörte
Schlafkontinuität objektivieren. Dies zeigt sich in Form von verlängerter Einschlafla-
tenz, erhöhter Anzahl von Wachperioden, morgendlichem Früherwachen, Verminde-
rung von Gesamtschlafzeit, Schlafeffizienz und Tiefschlafdauer. Veränderungen des
REM-Schlafes treten als Verkürzung der REM-Latenz, als Verlängerung der ersten
REM-Periode und als erhöhte REM-Dichte auf (Benca et al. 1992; Übersicht siehe
Berger und Riemann 1993 sowie Riemann et al. 2001).
Diese Befunde sind jedoch nicht pathognomonisch für eine affektive Erkrankung, sie
können auch bei anderen psychischen Erkrankungen auftreten (z.B. Alkoholab-
hängigkeit und Schizophrenie).
Eine graphische Darstellung eines Schlafprofils eines depressiven Patienten findet
sich in Abbildung 3: gestörte Schlafkontinuität, reduzierter Tiefschlaf, Verkürzung der
REM-Latenz und Zunahme der REM-Dichte.
Abbildung 3: Schlafprofil eines depressiven Patienten mit verkürzter REM-Latenz,
verlängerter erster REM-Periode, erniedrigten Tiefschlafanteil und Störungen der
Schlafkontinuität, besonders der zweiten Nachthälfte. S1-4: Schlafstadien zuneh-
mender Schlaftiefe (vergleiche Tabelle 1).

19
1.4 Fragestellung
Für verschiedene Neuropeptide wie zum Beispiel Corticotropin releasing hormone
(CRH), Wachstumshormon (GH), Thyreotropin-releasing hormone (TRH) und einige
andere wurden einerseits veränderte Konzentrationen in Blut oder Liquor bei
psychisch erkrankten Patienten nachgewiesen. Andererseits konnte gezeigt werden,
dass eine intravenöse Gabe dieser Neuropeptide beim Gesunden eine spezifische
Veränderung des Schlafprofils hervorruft, wie sie auch teilweise bei psychischen
Erkrankungen beobachtet werden (z.B. Inhibition des REM-Schlafes, Steigerung des
kurzwelligen Schlafes (SWS), Verminderung der Einschlaflatenz (SOL)).
Unsere Studie schließt sich hier an. Es werden erstmalig die Auswirkungen von
intravenös gegebener SP auf den Schlaf und auf diverse Verhaltensparameter beim
Menschen untersucht.
In Anlehnung an die Hypothese, dass SP ein die Depression förderndes Agens
darstellt, formulierten wir die folgende Hauptfragestellung unserer Untersuchung:
Welche Veränderungen der Schlafparameter ruft SP beim
Menschen hervor?
Führt SP zu ähnlichen Veränderungen des Schlafes, wie sie
bei affektiven Störungen beschrieben werden?

2 Probanden, Material und Methoden
2.1 Untersuchungsteilnehmer
2.1.1 Allgemeines
Diese Studie wurde an der Abteilung für Psychiatrie und Psychotherapie an der
Universitätsklinik Freiburg durchgeführt. Durch persönliche Kontakte konnten 12
Probanden zur Teilnahme an der Studie gewonnen werden, von denen 2 Probanden
(Nummer 5 und Nummer 9) aufgrund signifikanter Schlafstörungen in der Baseline-
Nacht ausgeschlossen werden mussten.
Die verbleibenden zehn Probanden hatten ein Durchschnittsalter von 26,5 ±2,8
Jahre. Alle eingeschlossenen Probanden wurden einem Screening unterzogen
welches eine Routinelabor- Untersuchung, einen Urintest, ein Drogenscreening,
EEG, EKG, körperliche und neurologische Untersuchung umfasste. Durch einen
Facharzt für Psychiatrie und Psychotherapie wurden in einem ausführlichen
Gespräch körperliche und psychische Vorerkrankungen eruiert. Die Probanden
selbst schätzten ihre Depressivität durch das Beck-Depressions-Inventar (BDI) und
die subjektive Schlafqualität durch den Pittsburgher Schlafqualitätsindex (PSQI) ein.
Die Probanden füllten vor Studienbeginn ein Schlaftagebuch über eine Woche aus.
Nach Überprüfung der Ein- und Ausschlusskriterien für die Studie wurden die
Probanden mündlich und schriftlich über den genauen Studienablauf informiert und
erklärten sich im Anschluss daran schriftlich dazu bereit, dass sie freiwillig an der
Studie teilnehmen und dass sie diese jederzeit abbrechen können. Die Experimente
wurden unter Achtung der Helsinki Deklaration von 1975 durchgeführt. Das Protokoll
wurde von der Ethik Kommission der Universität Freiburg genehmigt (siehe Anhang).
2.1.2 Ein- und Ausschlusskriterien
Für die Probanden wurden folgende Ein- und Ausschlusskriterien festgelegt:
Einschlusskriterien:
4männliches Geschlecht

21
4 Alter zwischen 20 und 30 Jahren
4 Fähigkeit, den Anforderungen der Studie gerecht zu werden
4 schriftliche Einwilligung der Probanden zur freiwilligen Teilnahme an der Studie
Ausschlusskriterien:
4 klinisch relevante körperliche oder neurologische Erkrankungen
4 psychische Erkrankung des Probanden oder eines Verwandten 1. Grades
4 anamnestischer Hinweis auf Schlafstörungen
4 Abweichungen vom Normbereich der folgenden Laborparameter: Großes Blutbild,
Kalium, Natrium, Calcium, Harnstoff, Kreatinin, Bilirubin gesamt, GOT, GPT, γ-GT,
Gesamteiweiß, CRP, Urinstatus
4 positiver Drogenscreeningbefund (Barbiturate, Amphetamine, Opiate, Benzodi-
azepine, Kokain, Cannabis)
4 Einnahme jeglicher Medikamente innerhalb der letzten zwei Monate vor Beginn
der Studie
4 Schichtarbeiter
4 Restless-legs- oder Schlaf-Apnoe-Syndrom
4 Polysomnographisch nachgewiesener erhöhter Apnoe-Hypopnoe-Index (>5,0/h)
oder Index der periodischen Beinbewegungen mit Arousals (>5,0/h)
4 Vorgeschichte mit Drogen- oder Alkoholabusus
4 Suizidalität
4 regelmäßiger Nikotinkonsum
4 mehr als 15 % Standardabweichung des Normalgewichtes
4 Blutverlust bzw. Blutspende von mehr als 500 ml in den letzten 3 Monaten

22
2.1.3 Demographische Daten der Probanden
Tabelle 2: Demographische Daten der Probanden.
Proband Nr. Alter (Jahre) Geschl.
1 25 M
2 25 M
3 21 M
4 24 M
6 29 M
7 28 M
8 29 M
10 26 M
11 29 M
12 29 M
MW ±SD 26,5±2,8
2 Probanden (Nummer 5 und Nummer 9) wurden aufgrund signifikanter Schlaf-
störungen in der Baseline-Nacht ausgeschlossen.
2.2 Material
2.2.1 Materialien und Geräte für die polysomnographische Ableitung
Die Ableitungen wurden mittels Ag/AgCl-Becherelektroden der Firma Nihon Kohden
durchgeführt. Die Elektroden wurden mit einer Elektrodenpaste zunächst gefüllt, auf
die mit Alkohol entfettete Kopfhaut platziert und mit Collodium oder
Leukoplastpflaster befestigt. Die Signale wurden mit einem 32-Kanal-Walter-
Graphtek-Biosignalverstärker übernommen, mit 102,4 Hz digitalisiert und auf einer

23
Festplatte gespeichert. Zur Atmungsdiagnostik wurden Bauch- und Brustgürtel mit
Druckaufnehmer (Effort. Gürtel, Firma Jäger), ein nasal-oral Thermisator (Firma
Jäger), sowie ein Pulsoximeter (Durasensus DS 100-A, Firma Neucor) eingesetzt.
2.2.2 Materialien zur Blutentnahme
Zur Blutentnahme wurde eine Venenverweilkanüle (Vasofix Braunüle, Firma Braun),
eine Perfusor-Leitung (Firma Braun), ein Dreiwegehahn (Discofix, Firma Braun), ein
Multiadapter (Firma Sarstedt) sowie Blutentnahmeröhrchen (Sarstedt Monovetten)
eingesetzt. Zwischen den Blutentnahmen wurde die Perfusorleitung mit einer
Heparin-Lösung (500 ml NaCl 0,9%, 200 i.E. Heparin), die über einen Perfusor
(Perfusor secura FT, Firma Braun) und eine Perfusor-Spritze (OPS 50 ml, Firma
Braun) gesteuert wurde, freigehalten. Die entnommenen Blutproben wurden in einer
Zentrifuge (Varifuge RF, Heraeus Sepatech) bei 3000 Umdrehungen pro Minute 10
Minuten zentrifugiert. Der Überstand wurde mit einer Eppendorf- Pipette abpipettiert,
in Eppendorfröhrchen (5 Alliquots à 500 µl, Firma Grener) eingefüllt und kurzfristig
bei –20 Grad Celsius tiefgefroren. Bis zum Versand in das Zentrallabor der Univer-
sitätsklinik Freiburg, der in Trockeneis erfolgte, wurden die Proben langfristig bei –80
Grad Celsius gelagert.
2.3 Untersuchungsmethoden
2.3.1 Untersuchungsablauf
Vor Beginn der Studie wurde das Versuchsprotokoll von der Ethikkommission der
Medizinischen Fakultät der Universität Freiburg geprüft und genehmigt (siehe
Anhang). Die Untersuchungen fanden in den Räumen der Universitätsklinik für
Psychiatrie und Psychotherapie in Freiburg statt.
Die Experimente wurden doppelblind im randomisierten cross-over Design durchge-
führt. Alle Versuchsteilnehmer nahmen an einem Verum- (SP-Infusion) und einem
Placebo- (NaCl-Infusion) Untersuchungs-Block teil.

24
Diese zwei Blöcke erstreckten sich über jeweils 3 polysomnographische Ableitungen,
1) Adaptationsnacht, 2) Baselinenacht, 3) SP- oder NaCl-Infusion. Zwischen den
beiden Blöcken bestand ein Mindestabstand von einer Woche.
Eine Übersicht über den Untersuchungsablauf findet sich am Ende dieses Kapitels,
siehe Tabelle 3 und Abbildung 4.
1) Die erste Nacht eines jeden Blockes diente der Adaptation an die Schlafbedingun-
gen im Schlaflabor und dem Ausschluss von organischen Erkrankungen des Schla-
fes (Schlaf-Apnoe- und Restless-Legs-Syndrom). Um 21.00 Uhr trafen die Proban-
den im Schlaflabor ein, es wurde bei ihnen eine komplette polysomnographische
Diagnostik inklusive der Atmungs- und Beinbewegungsdiagnostik durchgeführt. Der
Ableitzeitraum in den schallisolierten Räumen erstreckte sich von 23:00 bis 7:00 Uhr.
Während dieser Zeit wurden die Probanden durch eine Infrarotkamera überwacht
und konnten über eine Gegensprechanlage Kontakt zum Pflegepersonal der Station
herstellen.
2) In der zweiten Nacht, der Baseline-Nacht, erfolgte wiederum eine polysomno-
graphische Ableitung von 23:00 bis 7:00 Uhr. Auf eine Diagnostik der Atmung wurde
nun, nach Ausschluss atmungsbedingter Störungen, verzichtet.
3) Am Abend vor der dritten Nacht wurden die Untersuchungsteilnehmer um 18.30
Uhr in das Schlaflabor einbestellt. Es wurde ihnen um 19.00 Uhr eine Braunüle in
eine Vene des rechten Unterarmes gelegt und mittels eines angeschlossenen Perfu-
sors mit 0,9% NaCl- 200 i.E. Heparin-Gemisch (20ml/h) durchgängig gehalten. Über
diesen venösen Zugang erfolgten die SP/NaCl-Infusionen und die Blutentnahmen.
Blutentnahmen erfolgten in halbstündlichen Abständen von 21:00 bis 8:30 Uhr. Damit
bei den Blutentnahmen der Proband nicht geweckt werden musste, wurde an die
Braunüle ein 2 m langer Schlauch angeschlossen, welcher durch eine Öffnung in der
Wand in einen benachbarten Raum geführt wurde.
Die Infusionen synthetischer SP (Clinalpha, Läuflingen, Schweiz) oder 0,9%iger
NaCl-Lösung erfolgten an vier Zeitpunkten über einen Zeitraum von jeweils 20
Minuten. Infundiert wurde um 22.30 Uhr, 30 Minuten vor „Licht aus“ (23.00 Uhr),
sowie drei mal während des Schlafes: um 23.30 Uhr, 00.30 Uhr und um 1.30 Uhr.
Dieses Applikationsschema wurde gewählt, da in vorherigen Studien, welche die
Effekte anderer Neuropeptide auf Schlafparameter untersuchten, gezeigt werden
konnte, dass eine Intervall-Gabe dieser Neuropeptide günstiger für die Aufdeckung

25
ihrer Effekte auf den Schlaf ist, als die kontinuierliche Infusion (Steiger und Holsboer
1997). SP wurde den Probanden in einer Dosis von 3 pmol/kg/min gegen, eine Dosis
die sich als gut tolerierbar gezeigt hat (Schaffalitzky De Muckadell et al. 1986).
Zur Dokumentation eventueller durch Substanz bedingter Nebeneffekte saß während
der ersten Gabe von SP/NaCl-Lösung (22.30 Uhr) der Studienarzt bei den Pro-ban-
den und überprüfte kurz vor der ersten Infusion, 2 min. nach Beginn und dann alle 5
Minuten die folgenden Parameter/Symptome:
- systolischer und diastolischer Blutdruck (mmHg)
- Pulsfrequenz (Schläge in der Minute)
- Flush von Gesicht, Nacken, Armen und Händen
- konjunktivale Rötung
- Lakrimation
- Hitzegefühl
- Kopfschmerz
- Diarrhö
- abdominale Koliken
Die subjektiven Parameter wurden auf einer 10 Punkte Likert Skala durch den Pro-
banden oder den Prüfarzt eingeschätzt (0 Punkte bedeutet keine, 9 Punkte bedeutet
ausgeprägte Symptome (siehe Anhang).
Im Anschluss an jede Nacht wurden die Probanden nach dem Wecken um 7:00 Uhr
gebeten, den Fragebogen zur Subjektiven Einschätzung der Schlafqualität der
vorausgegangenen Nacht (SF-A) auszufüllen (siehe Anhang).
2.3.2 Messparameter
2.3.2.1 Hormonanalyse
Das Blut wurde in den Infusionsnächten von 21.00 Uhr bis 8.30 Uhr alle 30 Minuten
entnommen.
Bestimmt wurden
4Thyreoidea stimulierendes Hormon (engl.: thyroid stimulating hormone, TSH)

26
4Wachstumshormon (engl.: growth hormone, GH)
4Serum Kortisol
Aufgrund seiner langen Halbwertzeit wurde TSH nur alle 2 Stunden entnommen. Alle
Parameter wurden mit speziellen Chemolumineszenz und Enzyme-immuno Essays
auf Autoanalysatoren bestimmt.
2.3.2.2 Polysomnographie
In den Untersuchungsnächten erfolgte die standardisierte polysomnographische
Ableitung mittels eines 14 Kanal Nihon Koden EEG Polysomnographen von 23.00
Uhr („Licht aus“) bis 7.00 Uhr („Licht an“). Im Einzelnen abgeleitet wurden zwei
Einzelkanal EEG-Elektroden (C3-A2; C4-A1), vier EOG- Elektroden (zwei horizontal
und zwei vertikal), zwei submental und zwei am M. tibialis anterior platzierte EMG-
Elektroden und EKG-Elektroden. Während der Adaptationsnacht erfolgte bei allen
Probanden ein Screening auf Apnoen und periodische Beinbewegungen. Hierzu
wurde den Probanden ein Dehnungsmessstreifen an Bauch und Brust, ein nasaler
Thermistor, Pulsoximeter und bilateral EMG-Elektroden an M. tibialis anterior ange-
bracht. Mehr als 5 Apnoen oder Hypopnoen pro Stunde oder mehr als 5 periodische
Beinbewegungen pro Stunde wurden als Ausschlusskriterium gewertet. Es wurden
die folgenden Filtereinstellungen verwendet:
EEG: Sensitivität 7 µV/mm, TC (Zeitkonstante) 0.3 s, HI (Hochfrequenzfilter) 70 Hz
EOG: Sensitivität 30 µV/mm, TC 2.0 s, HI 35 Hz
EMG: Sensitivität 5 µV/mm, TC 0.03 s, HI 500 Hz
Die Auswertung erfolgte computergestützt durch geschultes Personal nach den Krite-
rien von Rechtschaffen und Kales (1968). Das auswertende Personal war blind
gegenüber den Experimenten. Die Zuverlässigkeit dieser Mitarbeiter wird in zwei-
monatlichen Abständen überprüft. Die Konkordanz aller Schlafstadien beträgt 90-
95% für 5 auswertende Personen.
Es wurden die folgenden Schlafparameter bestimmt:
Schlafarchitektur Variablen:
4Einteilung der Schlafstadien (Wachzustand, Stadium 1-4, REM-Stadium): Prozen-
tuale Verteilung bezogen auf die Schlafperiode, Schlafzeit und Registrierzeit,
Minutenzahl der einzelnen Schlafstadien, zeitliche Zuordnung der Schlafstadien.

27
Variablen der Schlafkontinuität:
4Registrierzeit (time in bed, TIB): Zeitraum zwischen Anfang und Ende der
polysomnographischen Aufzeichnung.
4Gesamtschlafzeit (total sleep time, TST): Gesamtzeit in Minuten in den Schlafsta-
dien 1-4 und REM-Schlaf.
4Schlafeffizienz: Gesamtschlafzeit (TST) im Verhältnis zu Registrierzeit (TIB) in
Prozent.
4Dauer der Schlafperiode (sleep period time, SPT): Zeitraum zwischen dem
Einschlafen und dem zuletzt aufgetretenem Schlafstadium.
4Einschlaflatenz (sleep onset latency, SOL): Differenz von Beginn der Ableitung bis
zum ersten Auftreten des Schlafstadiums 2, dem Schlafbeginn.
4Anzahl von Weckreaktion (Arousals).
4Arousal-Index: Anzahl der Arousals bezogen auf die Gesamtschlafzeit.
4Anzahl der Wachperioden: mindestens eine Wachphase während der SPT
REM-Schlaf Variablen:
4REM-Latenz: Differenz zwischen erstem Auftreten von Schlafstadium 2 und erst-
maligen Auftreten von REM-Schlaf.
4korrigierte REM-Latenz: wird errechnet durch Subtraktion der Dauer von Wach-
phasen zwischen Schlafbeginn und erster REM-Phase von der REM-Latenz
4Dauer der ersten REM-Phase in Minuten
4Gesamtzahl der REM im Verlauf der Nacht
4Dichte der Augenbewegungen in der ersten REM-Phase in Prozent
4REM-Dichte: Prozentuales Verhältnis zwischen 3-Sekunden-Epochen mit Augen-
bewegungen und der gesamten Anzahl der 3-Sekunden-Epochen der REM-
Perioden.

28
2.3.2.3 Psychometrische Analysen
Um die Schlafqualität zu bestimmen, wurden die folgenden Fragebögen verwendet:
4der Pittsburger Schlaf Qualitäts Index (PSQI; Buysee et al. 1989)
Er dient der Beurteilung einer Beeinträchtigung des Schlafes durch
Erfassung der subjektiven Schlafqualität. Der PSQI besteht aus 19
Fragen zu den 7 Themengebieten Schlafeffizienz, subjektive Schlaf-
qualität, Schlafdauer, Schlafstörungen, Schlafmittelkonsum, Schlaf-
latenz sowie Tagesmüdigkeit. 5 der 19 Fragen werden von Partnern
oder Mitbewohnern beantwortet. Jeder der 7 Frageblöcke wird mit
Werten zwischen 0 (keine Schwierigkeit) und 3 (große Schwierigkeit)
bewertet. Werte von 0-5 gelten als unauffällig, Werte von 5-10 bedeu-
ten eine leichte Beeinträchtigung, Werte von 10-15 eine mäßige und
Werte von 15-21 eine schwere Beeinträchtigung des Schlafes.
Dieser Test wurde zum Ausschluss eventueller Schlafstörungen von
den Probanden einmalig vor Teilnahme an der Studie ausgefüllt. Das
Ergebnis jedes Probanden war kleiner als 5 Punkte (Mittelwert
3,5±1,26)
4der Schlaf-Fragebogen (SF-A; Görtelmeyer 1981)
Dieser Fragebogen dient dem Vergleich zwischen der durch die Poly-
somnographie objektivierten Güte und dem subjektiven Empfinden der
generellen Schlafqualität. Dem Probanden werden 22 Fragen über sein
Einschlafen, Durchschlafen, Aufwachen und die beeinflussenden und
störenden Faktoren in der Nacht und des vorherigen Tages gestellt. Die
Antworten werden in 5 Kategorien zusammengefasst: generelle Schlaf-
qualität, Gefühl des Erholtseins nach dem Schlaf, psychische Aus-
geglichenheit am Abend, psychische Erschöpftheit am Abend und
psychosomatische Symptome in der Schlafphase. Der Test wird pro
Kategorie mit Punktzahlen zwischen 1 und 5 bewertet. Ergebnisse von
1 Punkt sprechen für, 5 Punkte sprechen gegen eine Beeinträchtigung.
Der SF-A wurde von den Probanden im Anschluss an jede Nacht eine
halbe Stunde nach „Licht an“ um 7.30 Uhr ausgefüllt.

29
4Subjektive Befindlichkeitsskala (Bf-S; von Zerssen 1986)
Diese Selbstbeurteilungsskala dient der Erfassung des momentanen
subjektiven Empfindens. Sie besteht aus 28 Gegensatzpaaren von
Eigenschaftswörtern sowie der Antwortmöglichkeit „weder noch“; z.B.
frisch-matt-„weder noch“. Das positive Empfinden und eine fehlende
Antwort wird mit 0 Punkten, das negative Befinden mit 2 Punkten und
die „weder noch“ Bewertung mit 1 Punkt bewertet. Daraus ergeben sich
mögliche Ergebnisse zwischen 0 und 56 Punkten.
Bei Männern gelten Ergebnisse ab 16 Punkten als „fraglich erhöht“, ab
23 als „deutlich erhöht“ und ab 31 als „stark erhöht“.
Der Bf-S wurde von den Probanden in beiden Blöcken in der jeweils
ersten Nacht um 22.00 Uhr, in der jeweils dritten Nacht unmittelbar
nach der ersten Infusion (22.50 Uhr) sowie um 7.00 Uhr am darauf
folgenden Morgen ausgefüllt.
2.3.3 Statistische Auswertung
Zur mathematischen Darstellung der Ergebnisse wurden Mittelwert und Standardab-
weichung errechnet. Die statistische Auswertung der Vergleiche polysomnographi-
scher Parameter und psychischer Effekte zwischen SP-Infusion und NaCl-Kontroll-
infusion bei derselben Person wurde mittels T-Test für abhängige Stichproben durch
die Programme Excel und SPSS errechnet. Bei nicht normalverteilten Ergebnissen
wurde die Auswertung mittels Wilcoxon-Test (nicht-parametrischer Test) durchge-
führt. Zur Beurteilung der neuroendokrinen Messungen wurden „areas under the
curve“ (AUCs) als eine Summe aller Konzentrationen im ausgewählten Zeitintervall
(zwischen dem ersten und dem letzten Wert durch 2 geteilt) multipliziert mit dem
Abstand zwischen den Blutentnahmen (0.5 Stunden) bestimmt. Das Signifikanz-
niveau der Irrtumswahrscheinlichkeit (p) wurde für alle Berechnungen auf p<0.05
gesetzt.

30
Tabelle 3: Studienprotokoll.
Polysom-
nographie I
Polysom-
nographie II
Pacebo/Verum
Injektionen
Blutentnahme
SF-A
BFS
Nacht 1 X X X
Nacht 2 X X
Nacht 3 X X X X X
X
Nacht 4 X X
Nacht 5 X X
Nacht 6 X X X X X
X
Polysomographie I: EEG mit Überwachung der Atmung sowie der Arm- und Beinbewegungen; Polysomnographie II: EEG mit Überwachung der Atmung jedoch ohne Ableitung Arm- oder Bein-bewegungen; Placebo/Verum Injektionen waren aufgelöst in einem 0,9%NaCl- 200i.E. Heparin-Gemisch (Injektions-geschindigkeit 20ml/h); SF-A: Schlaf-Fragebogen, wurde am nächsten Morgen abgefragt; Bf-S: subjektive Befindlichkeitsskala, wurde abgefragt in der ersten und vierten Nacht um 22.00 Uhr sowie unmittelbar nach der ersten Infusion und am folgenden Morgen der dritten und sechsten Nacht

31
Abbildung 4: Studienprotokoll der Nächte mit Verum-/Placebo-Infusion.
Braunüle legen 19.0
Halbstündliche Blutentnahmen 21.0
1. 22.3
22.5
„Licht aus“ 23.0
2. Infusion 23.3
23.5
3. Infusion 0.30
0.50
4. Infusion 1.30
1.50
Ende der halbstündlichen Blutentnahmen 8.30
„Licht an“ und Ausfüllen des Bf-S 7.00
- währenddessen Fragebogen - danach Ausfüllen des Bf-S

3 Ergebnisse
Die wesentlichen Symptome, welche im Rahmen der SP-Infusion auftraten, sind ein
Anstieg der Pulsgeschwindigkeit, eine Erhöhung des systolischen Blutdruckes sowie
eine Rötung in Gesichts- und Nackenbereich.
3.1 Effekte von SP auf Befindlichkeit, Stimmung und Verhalten
Die intravenöse Gabe von SP hatte periphere Effekte: die auffälligsten Symptome
waren eine Rötung und Überwärmung (Flush) des Gesichtes in Verbindung mit
einem Pulsanstieg in den ersten 1-2 Minuten nach Beginn der SP-Infusion. Dies war
bei allen Probanden festzustellen. Dieser Flush wurde auf der Likert 10 Punkte Skala
im Mittel bei 7,1 ±1,5 eingeschätzt. Nach weiteren 5 Minuten verschwanden diese
Symptome bei fortgeführter Infusion. 10 bis 15 Minuten nach Beginn der Infusion
traten sie jedoch in wellenförmigen Schüben wieder auf, allerdings nicht mit der glei-
chen Intensität wie zu Anfang der Infusion.
Dieser Symptomkomplex aus Gesichts- und Nackenrötung und Pulsanstieg wurde
von den Probanden weitgehend gut toleriert. Zwei der Probanden gaben ein „körper-
liches Angstgefühl“ an. Hitzegefühl und Kopfschmerz wurden weniger häufig ange-
geben. Diarrhö trat nur bei einer Person auf. Ein anderer Proband klagte über
Stimmversagen, Zittern und Ohrensausen. Hinweise für eine Atemobstruktion fanden
sich bei keinem der Probanden.
Abbildung 5 zeigt die Mittelwerte mit Standardabweichung der Symptome, welche
während der ersten Infusion (22.30 – 22.50 Uhr), vor Beginn der Infusion, 2 Minuten
nach Infusionsbeginn und dann alle 5 Minuten durch den Prüfarzt (Gesichtsflush und
konjunktivale Injektion) bzw. den Probanden (alle übrigen Symptome) selbst be-
stimmt wurden. Dargestellt sind nur die Ergebnisse während der SP-Infusionen, da
die Placebo (NaCl 0.9%)-Infusion keine signifikanten Veränderungen der Parameter
verursachte.

33
0 1 2 3 4 5 6 7 8 9 10
Durchfall
Bauch
Kopf
Herzklopfen
Hitzegefühl
Druckgefühl
Erwärmung
Tränenfluß
Konjunktivale Injektion
Hände
Arme
Hals
Gesicht
Schm
erze
n
Flus
h
Subj
ektiv
e Sy
mpt
ome
Likert-Skala
Abbildung 5: Intensität der Symptome während der ersten Injektion von SP. Ange-
geben sind Mittelwerte und Standardabweichung nach der Likert-Skala, anhand
derer die Ausprägung der Beschwerden eingeschätzt wurde. Keines dieser
Symptome wurde bei Placebo-Infusion berichtet.

34
Das subjektive Wohlbefinden wurde anhand der BF-S (Subjektive Befindlichkeits-
skala, siehe 2.3.2.3) bestimmt. Diese füllten die Probanden in der jeweils ersten
Nacht eines Blockes um 22.00 Uhr, in der jeweils dritten (Infusions-) Nacht kurz nach
der ersten Infusion sowie um 7.00 Uhr am darauf folgenden Morgen aus.
Während die Gabe von Placebo zu keiner signifikanten Veränderung des subjektiven
Wohlbefindens der Probanden führte (siehe Tabelle 4), zeigte sich durch SP-Gabe
eine Verschlechterung der Stimmung. Dies war sowohl unmittelbar nach der Infusion
als auch am darauf folgenden Morgen zu beobachten (siehe Tabelle 5). Der Normbe-
reich, der für die BF-S innerhalb von 5 bis 16 Punkten festgesetzt ist, wurde jedoch
nie verlassen.
Tabelle 4: Werte des BF-S ±SD des Placeboblocks (bei 9 Probanden). Daneben die
Ergebnisse des T-Tests für unabhängige gepaarte Stichproben innerhalb des Place-
boblocks. Weder unmittelbar nach der 1. Placebo-Infusion noch am Morgen nach
Placebo-Infusion zeigt sich ein signifikanter Unterschied in Bezug auf die Befindlich-
keit.
NaCl-Infusion BF-S
BF-S am 1. Abend 12,1±9,5
BF-S nach der 1. Infusion 10,5±6,1
T=0,523
(p=0,615)
BF-S am Morgen nach der Infusion 13,8±8,6
T=-0,507 (p=0,626)

35
Tabelle 5: Werte des BF-S ±SD des Verumblocks (bei 9 Probanden). Daneben die
Ergebnisse des T-Tests für unabhängige gepaarte Stichproben innerhalb des
Verumblocks. Unmittelbar nach SP-Infusion zeigt sich ein statistisch signifikanter
Unterschied in den Werten der BF-S (*).
SP-Infusion BF-S
BF-S am 1. Abend 8,3±4,2
BF-S nach der 1. Infusion 14,2±5,7
T=-3,247
(p=0,012*)
BF-S am Morgen nach der Infusion 15±8
T=-2,060 (p=0,073)
Bei genauer Betrachtung der einzelnen Symptome ist festzustellen, dass die Para-
meter aus dem depressiven Symptombereich (z.B. „erfolglos“, „schwermütig“ und
„unglücklich“) für die Signifikanz der veränderten BF-S Werte verantwortlich sind.
Depressive Symptome waren unmittelbar nach SP-Injektion signifikant gesteigert
(0.1 ±0.3 gegenüber 1.1 ±1.2, p=0.041) und auch am nächsten Morgen noch
signifikant erhöht (0.1 ±0.3 gegenüber 1.2 ±1.3, p=0,041).
Im Vergleich der BF-S-Ergebnisse beider Infusionsnächte miteinander zeigte
sich nach SP-Infusion eine signifikante Erhöhung depressiver Symptome die
gleichwohl niedrig waren (1.1 ±1.2 gegenüber 0.3 ±0.7, p=0,041).
Die Symptomkomplexe Müdigkeit und Agitation zeigten keine signifikanten Verände-
rungen durch SP-Infusion.
1 Wilcoxon-Test für abhängige Stichproben

36
3.2 Effekte von SP auf den Puls
Die Gabe von SP führte zu einer signifikanten Steigerung der Pulsrate, nicht jedoch
die Infusion von Placebo.
Vor Placebo-Infusion war eine mittlere Pulsrate von 61,8 ±7,8 x min-1 (n=10) zu
messen. Während der Placebo-Infusion stieg die mittlere Pulsrate auf 63,1 ±10,8 x
min-1, dieser Unterschied ist nicht signifikant. Abbildung 7 stellt die mittlere Pulsrate ±
Standartabweichung zu unterschiedlichen Zeitpunkten während der Placeboinfusion
dar.
Vor Beginn der Verum-Infusion lag die mittlere Pulsrate bei 60,0 ±12,2 x min-1
(n=10). Während der SP-Infusion (2 Minuten nach Beginn) stieg der mittlere Puls auf
90,1 ±10,24 x min-1. Dieser Unterschied ist hochsignifikant (p<0,001). Im Anschluss
an dieses Pulsmaximum fiel die Pulsrate 5 Minuten nach Infusionsbeginn auf 75
±11,2 x min-1 , nach 10 Minuten lag sie bei 75,3 ±13,15 x min-1, nach 15 Minuten bei
75,9 ±7,3 x min-1 und 20 Minuten nach Beginn der Infusion fiel die mittlere Pulsrate
dann auf 61,1 ±11,11 x min-1 (Abbildung 8). Ein typischer Pulsverlauf eines
Probanden ist in Abbildung 6 dargestellt. Alle Abbildungen der Pulswerte der
einzelnen Probanden finden sich im Anhang.
Proband 12
64
83
102
66
9485
70
0
20
40
60
80
100
120
vor I
nfusio
n
Begin
n
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls
Abbildung 6: Typischer Pulsverlauf eines Probanden (12) vor und während der SP-
Injektion.

37
0
20
40
60
80
100
120
vor In
fusion
Infus
ionsb
eginn
nach
2 min
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls
Abbildung 7: Mittelwerte der Pulsverläufe vor und während der Placebo-Injektionen
(± Standardabweichung). Nach Placebo-Infusion zeigt sich kein signifikanter Puls-
anstieg.
0
20
40
60
80
100
120
vor Infusio
nBeg inn
nach 2 min.
nach 5 min.
nach 10 min.
nach 15 min.
nach 20 m
in.
Puls
Abbildung 8: Mittelwerte der Pulsverläufe vor und während der SP-Injektionen
(± Standardabweichung). Nach SP-Infusion zeigt sich ein signifikanter Pulsanstieg.

38
3.3 Effekte von SP auf den Blutdruck
Der systolische Blutdruck stieg signifikant durch die Infusion von SP. Der diastolische
Blutdruck veränderte sich nicht signifikant gegenüber der Placebo-Infusion.
Bei den Probanden (n=10) wurde vor Placebo-Infusion ein mittlerer systolischer Blut-
druck von 121,5 ±9,7 mmHg gemessen, vor Verum-Infusion betrug dieser Wert im
Mittel 125,7 ±9,0 mmHg (kein signifikanter Unterschied). Die Infusion von NaCl führte
zu einem Anstieg des systolischen Blutdrucks auf 130 ±8,7 mmHg. Im Verlauf der
Verum Infusion stieg der systolische Blutdruck auf 138,0 ±10,6 mmHg. Dieser Unter-
schied ist mit p<0,05 signifikant.
Vor der NaCl-Infusion wurde ein mittlerer diastolischer Blutdruck von 74,7
±9,1 mmHg gemessen. Vor SP-Infusion betrug dieser Wert 68,2 ±5,9 mmHg (kein
signifikanter Unterschied). Während der Placebo-Infusion fiel der Wert des mittleren
diastolischen Blutdrucks auf 73,8 ±6,0 ab (kein signifikanter Unterschied). Im Verlauf
der Verum-Infusion fiel dieser Wert ab auf 63,4 ±7,6 (kein signifikanter Unterschied).
Ein Vergleich der beiden Messergebnisse für den diastolischen Blutdruck während
Pacebo- und Verum-Infusion ergibt keinen signifikanten Unterschied.
In Abbildung 9 sind die Werte des systolischen und diastolischen Blutdruck zu ver-
schiedenen Zeitpunkten während der Infusion von SP graphisch dargestellt.

39
0
20
40
60
80
100
120
140
160
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Blu
tdru
ck (m
mH
g)
systolischdiastolisch
Abbildung 9: Mittelwerte der Blutdruckverläufe vor und während der SP-Injektion
(± Standardabweichung). Der systolische Blutdruck stieg signifikant durch die Infu-
sion von SP. Der diastolische Blutdruck veränderte sich nicht signifikant gegenüber
der Placebo-Infusion.
3.4 Effekte von SP auf subjektive Schlafparameter
Der Schlaf wurde mittels Skalen zur Einschätzung der Schlafqualität (SF-A) subjektiv
bewertet. Der SF-A wurde von den Probanden im Anschluss an jede Nacht um 7.30
Uhr ausgefüllt. Ergebnisse von 1 Punkt sprechen für, 5 Punkte sprechen gegen eine
Beeinträchtigung.
Innerhalb des Placebo-Blockes zeigte die Infusion von NaCl keine signifikanten Ver-
änderungen der SF-A Ergebnisse.
Bei Vergleich der SF-A-Werte innerhalb des Verum-Infusions-Blockes fällt eine signi-
fikant verminderte Schlafqualität auf (p=0,002). Im Anschluss an die Verum-Nacht
werden ferner psychosomatische Symptome während der Schlafphase signifikant
häufiger beklagt (p=0,004).

40
Vergleicht man nun die beiden Challenge-Nächte miteinander, fand sich eine signifi-
kante Abnahme der im SF-A bestimmten subjektiven Schlafqualität (3.3 ±0.7 in der
NaCl-Infusions-Nacht gegenüber 2.7 ±0.5 in der SP-Infusions-Nacht; p=0,017).
Ferner wurde ein signifikanter Anstieg „psychosomatischer Beschwerden“ während
der Schlafphase nach der Infusion von SP beobachtet (1.6 ±0.6 in der NaCl-
Infusions-Nacht gegenüber 1.9 ±0.5 in der SP-Infusions-Nacht; p=0,024).
Die übrigen Testparameter des SF-A Fragebogens erbrachten zwar keine signifi-
kanten Unterschiede zwischen den beiden Untersuchungsblocks, jedoch zeigt sich
eine tendenziell verminderte psychische Ausgeglichenheit am Abend der Verum-
Infusion sowie ein vermindertes Gefühl des Erholtseins.
Tabelle 6 zeigt die Gegenüberstellung der beiden Challenge-Nächte mit
Signifikanzen.

41
Tabelle 6: Ergebnisse der SF-A-Fragebögen der Placebo- und der Verum-
Infusionsnächte mit Signifikanzen des Vergleiches beider Blöcke miteinander (T-Test
für gepaarte Stichproben). Es zeigten sich signifikante Unterschiede hinsichtlich der
Schlafqualität und der psychosomatischen Symptome der Schlafphase (*).
Testparameter
NaCl-Infusion
Mittelwert±SD
SP-Infusion
Mittelwert±SD n T P
Schlafqualität 3,3±0,7 2,7±0,5 7 3,273 0,017*
Gefühl des Erholtseins 3,23±0,7 3,0±0,8 7 1,158 0,291
Psychische Ausgeglichenheit
am Abend 3,9±0,5 3,5±0,9 7 1,911 0,105
Psychische Erschöpftheit am
Abend 2,7±0,7 2,6±0,56 7 0,341 0,744
Psychosomatische Symptome der Schlafphase 1,6±0,6 1,9±0,5 8 -2,876 0,024*
Ergebnisse von 1 Punkt sprechen für, 5 Punkte sprechen gegen eine Beeinträchtigung.
Um zu erfassen, wie groß die Unterschiede der SF-A-Ergebnisse sind, die allein
durch die veränderten Bedingungen in der Challenge-Nacht (z.B. venöser Zugang)
verursacht wurden, haben wir die Mittelwerte dieser Nacht mit denen der Baseline-
Nacht innerhalb eines Untersuchungsblockes verglichen. Innerhalb des Placebo-
blockes zeigten sich keine statistisch signifikant veränderten Parameter. Die
subjektive Schlafqualität ist jedoch leicht verringert: Sie beträgt in der Baseline-Nacht
3,65 ±0,6 und in der Challenge-Nacht 3,33 ±0,6 (p=0,153, nicht signifikant).
Innerhalb des Verumblockes zeigten sich signifikante Unterschiede. Die subjektive
Schlafqualität ist in der Infusions-Nacht verringert (p=0,02) und die psychosomati-

42
schen Symptome innerhalb der Schlafphase vermehrt (p=0,004). Es zeigt sich, dass
die psychische Ausgeglichenheit am Abend der Challenge-Nacht signifikant verbes-
sert ist (p=0,04). Die Ergebnisse dieser Auswertung zeigt Tabelle 7.
Tabelle 7: Verumblock. Ergebnisse der SF-A-Fragebögen der Baseline-Nacht und
der Verum-Infusions-Nacht mit Signifikanzen (T-Test für gepaarte Stichproben).
Testparameter
Baseline-Nacht Mittel-
wert±SD
SP-Infusion
Mittelwert±SD N T P
Schlafqualität 3,55±0,5 2,52±0,5 8 4,882 0,02*
Gefühl des Erholtseins 3,4±0,8 2,94±0,74 8 2,207 0,063
Psychische Ausgeglichenheit
am Abend 4,0±0,6 3,33±1 8 2,515 0,040*
Psychische Erschöpftheit am
Abend 2,85±0,5 2,7±0,5 8 1,414 0,200
Psychosomatische Symptome der Schlafphase 1,35±0,3 2,0±0,6 9 -4,004 0,004*
Ergebnisse von 1 Punkt sprechen für, 5 Punkte sprechen gegen eine Beeinträchtigung.
Um mögliche Veränderungen der subjektiven Schlafqualität, welche auch ohne
Infusion von Placebo/SP zwischen den Untersuchungsblöcken bestanden haben
könnten, zu entdecken, verglichen wir die Testergebnisse der beiden Baseline-
Nächte miteinander. Es zeigten sich keine signifikanten Unterschiede. Am
deutlichsten verändert waren die psychosomatischen Symptome der Schlafphase.
Sie waren mit einer Signifikanz von p=0,088 in der Baseline-Nacht des Placebo-
blockes erhöht. Die Ergebnisse dieser Auswertung finden sich in Tabelle 8.

43
Tabelle 8: Baseline-Nacht Ergebnisse der SF-A-Fragebögen der Verum- und der
Placebo-Infusions-Nacht mit Signifikanzen (T-Test für gepaarte Stichproben). Es
fanden sich keine signifikanten Unterschiede.
Ergebnisse von 1 Punkt sprechen für, 5 Punkte sprechen gegen eine Beeinträchtigung.
Testparameter
Baseline-Nacht Placebo
Mittelwert±SD
Baseline-Nacht Verum
Mittelwert±SD N T Signifikanz
Schlafqualität 3,51±0,7 3,5±0,5 9 0,222 0,830
Gefühl des Erholtseins 3,3±0,8 3,5±0,7 9 -0,802 0,446
Psychische Ausgeglichenheit
am Abend 3,9±0,6 3,8±0,6 9 0,426 0,681
Psychische Erschöpftheit am
Abend 2,4±0,6 2,8±0,6 9 -1,235 0,252
Psychosomatische Symptome der Schlafphase 1,5±0,3 1,3±0,3 9 1,941 0,88

44
3.5 Effekte von SP auf objektive Schlafparameter
Bei Betrachtung der objektiven, polysomnographisch ausgewerteten Schlaf-
parameter zeigte sich eine signifikant verlängerte REM-Latenz (und korrigierte REM-
Latenz) in der Challenge-Nacht des Verumblockes. Die übrigen Schlafparameter
wiesen keine signifikanten Unterschiede zwischen den beiden Untersuchungsblocks
auf. Tabelle 9 zeigt die Werte der wichtigsten polysomnographischen Parameter
(über die gesamte Nacht betrachtet).

45
Tabelle 9: Schlafparameter während der gesamten SP- und NaCl-Infusions-Nacht.
Nach SP-Infusion ist die REM-Latenz und korrigierte REM-Latenz signifikant verlän-
gert gegenüber Placebo-Infusion (siehe *, T-Test für gepaarte Stichproben, n=10).
Schlafparameter
NaCl-Infusion
SP-Infusion
T
P
Gesamtschlafzeit (TST, min.) 414 ±36 403 ±51 0,728 0,485
Wachanteil an Schlafperiode (%)
6.7 ±6.2
10.1 ±8.6
-1,681
0,127
Schlafeffizienz (%)
86 ±8 84 ±11 0,742 0,477
Einschlaflatenz (SOL, min.)
34 ±28
30 ±17
0,364
0,725
REM-Latenz (min.)
69 ±27
113 ±50
-2,566
0,030*
Korr. REM-Latenz (min.)
66 ±24
85 ±27
-3,350
0,009*
Anteil S1 an Schlafperiode (%)
7.6 ±4.6
8.4 ±3.8
-0,938
0,373
Anteil Schlafstadium 2 an Schlafperiode (%)
55.1 ±8.5
52.3 ±8.8
1,339
0,213
Anteil Schlafstadium 3 und 4 an
Schlafperiode (%)
9.1 ±6.2
7.9 ±6.0
1,795
0,106
Anteil REM-Schlaf
an Schlafperiode (%)
21.0 ±5.2
20.8 ±4.4
0,144
0,889
Anzahl der Wachperioden (Arousals) 18.7 ±11.6 24.8 ±9.9 -1,609 0,142
Dauer der ersten REM-Phase (min.) 10.4 ±4.8 17.0 ±12.3 -1,561 0,153
Gesamtanzahl der Augenbewegungen
406 ±159
378 ±114
0,632
0,543
REM-Dichte (%)
22 ±8
21 ±5
0,802
0,443
TST: total sleeping time = Gesamtschlafzeit – Wachzeit

46
In den untenstehenden Abbildungen 10 bis 19 werden die Einzelwerte der
Probanden sowie die Mittelwerte aus Tabelle 9 graphisch dargestellt. Die mittels T-
Test für abhängige Stichproben errechneten Signifikanzen (p) sind in die
Abbildungen eingefügt. Statistisch signifikante Testergebnisse sind fett gedruckt.
Veränderung derGesamtschlafzeit (TST)
von Placebo zu Verum-Nachtbei 10 Probanden
300
320
340
360
380
400
420
440
460
480
Min
uten
Placebo Substanz P
Mittelwert
p=0,485
Abbildung 10: Gesamtschlafzeit in Minuten der Placebo- und der Verum-Infusions-
Nacht mit Signifikanzen (errechnet mittels T-Test für abhängige Stichproben).

47
Veränderung der REM-Dichte
von Placebo zu Verum-Nachtbei 10 Probanden
0
5
10
15
20
25
30
35
Placebo Substanz P
Mittelwert
%
p=0,443
Abbildung 11: REM-Dichte in Prozent der Placebo- und der Verum-Infusions-Nacht
mit Signifikanzen (errechnet mittels T-Test für abhängige Stichproben).

48
Veränderung der REM-Latenz
von Placebo zu Verum-Nachtbei 10 Probanden
0
50
100
150
200
250
Min
uten
Placebo Substanz P
Mittelwert
p=0,030
Abbildung 12: REM-Latenz in Minuten der Placebo- und der Verum-Infusions-Nacht
mit Signifikanzen (errechnet mittels T-Test für abhängige Stichproben).
Veränderung der korrigierten REM-Latenz
von Placebo zu Verum-Nachtbei 10 Probanden
0
20
40
60
80
100
120
140
160
Min
uten
Placebo Substanz P
Mittelwert
p=0,009
Abbildung 13: Korrigierte REM-Latenz in Minuten der Placebo- und der Verum-
Infusions-Nacht mit Signifikanzen (errechnet mittels T-Test für abhängige
Stichproben).

49
Veränderung des REM- Schlafanteils an der Schlafperiode
von Placebo zu Verum-Nachtbei 10 Probanden
0
5
10
15
20
25
30
Placebo Substanz P
Mittelwert
%
p=0,889
Abbildung 14
Veränderung des Stadium 1 Schlafanteils an der Schlafperiode
von Placebo zu Verum-Nachtbei 10 Probanden
0
2
4
6
8
10
12
14
16
18
Placebo Substanz P
Mittelwert%
p=0,373
Abbildung 15

50
Veränderung des Stadium 2 Schlafanteils an der Schlafperiode
von Placebo zu Verum-Nachtbei 10 Probanden
30
35
40
45
50
55
60
65
70
Placebo Substanz P
Mittelwert
%
p=0,213
Abbildung 16
Veränderung des Stadium 3 und 4 Schlafanteils an der
Schlafperiode von Placebo zu Verum-Nacht
bei 10 Probanden
0
2
4
6
8
10
12
14
16
18
20
Placebo Substanz P
Mittelwert%
p=0,106
Abbildung 14-17: Anteile von REM-Schlaf sowie von Schlafstadium 1-4 an der
Schlafperiode (in Prozent) der Placebo- und der Verum-Infusions-Nacht mit
Signifikanzen (errechnet mittels T-Test für abhängige Stichproben).

51
Veränderung des Wachanteils an der Schlafperiode
von Placebo zu Verum-Nachtbei 10 Probanden
0
5
10
15
20
25
30
Placebo Substanz P
Mittelwert
%
p=0,127
Abbildung 18: Wachanteil in Prozent der Placebo- und der Verum-Infusions-Nacht
mit Signifikanzen (errechnet mittels T-Test für abhängige Stichproben).
Veränderung der Anzahl der Arousals
von Placebo zu Verum-Nachtbei 10 Probanden
0
5
10
15
20
25
30
35
40
45
50
Placebo Substanz P
Mittelwert
p=0,142
Abbildung 19: Anzahl der Arousals in der Placebo- und der Verum-Infusions-Nacht
mit Signifikanzen (errechnet mittels T-Test für abhängige Stichproben).

52
Da SP nur in der ersten Nachthälfte gegeben wurde, überprüften wir ein Auftreten
von SP-Effekten auf den Schlaf auch anhand einer vergleichenden Untersuchung
beider Nachthälften. Als die erste Nachthälfte wird dabei der Zeitraum von 23.00
(Beginn der polysomnographischen Aufzeichnung) bis 2.00 Uhr betrachtet, die
zweite Nachthälfte endet mit dem Abschluss der polysomnographischen Aufzeich-
nung um 7.00 Uhr (siehe Tabelle 10 und 11).
Die Analyse zeigte einen signifikanten Anstieg von Stadium 1-Schlaf in der ersten
Nachthälfte (8,0 ±4,6% in der Verum- gegenüber 5,9 ±4,5% in der NaCl-Infusions-
Nacht) sowie eine signifikante Verringerung der REM-Dichte in der zweiten Nacht-
hälfte (19,3 ±5,4% in der SP- gegenüber 24,2 ±2,5% in der Placebo-Infusions-Nacht).
Um herauszufinden ob SP einen Weckeffekt hat, errechneten wir ebenfalls die
Wachzeit während der drei SP-Infusionen in der Nacht. Sie zeigte sich als signifikant
verlängert gegenüber der Wachzeit während der drei nächtlichen Placebo-Infusionen
(29,3 ±29,0 in der Verum- gegenüber 10,5 ±13,9 Minuten in der Placebo-Infusions-
Nacht; p=0,006; T=-3,664; n=10). Die Wachzeit zwischen den Infusionen ist nicht
signifikant größer während der SP-Infusionen (24,3 ±18,9 Min. bei Placebo-
gegenüber 29,1 ±16,8 in der Verum-Infusions-Nacht; p=0,958; T= 0,054; n=9).
Wenn man die erste Nachhälfte von 23.00 bis 2.00 Uhr betrachtet, ist der Unter-
schied in der Dauer der Wachzeit in Minuten nicht signifikant (63,6 ±43,6 Min. in der
Verum- gegenüber 34,8 ±31,3 in der Placebo-Nacht; p=0,07; T=2,071; n=8). Auch
der Unterschied in der prozentualen Wachzeit während dieser ersten Nachthälfte ist
nicht signifikant (35,4 ±24,2% in der Verum- gegenüber 19,3 ±17,4 in der Placebo-
Nacht; p=0,07; T=2,071; n=8)
Die Anzahl der Wachperioden sowie der prozentuale Anteil der Wachphasen an der
Gesamtschlafzeit (total sleep time, TST) waren ebenfalls nicht signifikant unter-
schiedlich (siehe Tabelle 10).

53
Tabelle 10: Schlafparameter während der ersten Nachthälfte der SP- und NaCl-
Infusions-Nacht (23.-02.00 Uhr) (T-Test für gepaarte Stichproben, n=10).
Schlafparameter
NaCl-Infusion
SP-Infusion
T
p
Gesamtschlafzeit (TST, min.)
13,6 ±5,4
13,0 ±5,6
0,373
0,718
Wachanteil an Schlafperiode (%)
6.5 ±8,4
15,5 ±16,6
-1,765
0,11
Schlafeffizienz (%)
93,4 ±8,4
84,5 ±16,7
1,759
0,112
Anteil Schlafstadium 1 an Schlafperiode (%)
5,9 ±4,5
8,0 ±4,6
-2,336
0,044*
Anteil Schlafstadium 2 an Schlafperiode (%)
57,9 ±11,7
50,6 ±15,2
1,531
0,16
Anteil Schlafstadium 3 und 4 an Schlafperiode (%)
15,7 ±10,1
12,5 ±8,9
2,095
0,066
Anteil REM-Schlaf
an Schlafperiode (%)
13,6 ±5,4
13,0 ±5,6
0,373
0,718
Anzahl der Wachperioden
(Arousals)
14,3 ±5
15,5 ±3,7
-0,648
0,533
Gesamtanzahl der Augenbewegungen
107,7 ±78,4
132,2 ±77,4
-0,811
0,438
REM-Dichte (%)
17,1 ±7,5
23,8 ±11,2
-2,060
0,07

54
Tabelle 11: Schlafparameter während der zweiten Nachthälfte der SP- und NaCl-
Infusions-Nacht (02.-07.00 Uhr) (T-Test für gepaarte Stichproben, n=10).
Schlafparameter
NaCl-Infusion
SP-Infusion
T
p
Gesamtschlafzeit (TST, min.)
206,3 ±19,7
212,4 ±12,1
-0,801
0,444
Wachanteil an Schlafperiode (%)
7 ±7,5
4,9 ±2,5
0,824
0,431
Schlafeffizienz (%)
93 ±7,5
95,1 ±2,5
-0,833
0,426
Anteil Schlafstadium 1 an Schlafperiode (%)
9,4 ±5,14
8,7 ±3,5
0,483
0,641
Anteil Schlafstadium 2 an Schlafperiode (%)
52,3 ±9,9
54,1 ±7,9
-0,436
0,673
Anteil Schlafstadium 3 und 4 an Schlafperiode (%)
2,6 ±3,9
3,4 ±3,8
-1,357
0,208
Anteil REM-Schlaf
an Schlafperiode (%)
28,3 ±5,8
28,5 ±7,1
-0,080
0,938
Anzahl der Wachperioden
(Arousals)
13 ±5,6
16,2 ±6,6
-1,488
0,171
Gesamtanzahl der Augenbewegungen
298 ±104,5
247 ±88,3
2,205
0,055
REM-Dichte (%)
24,2 ±8,5
19,4 ±5,4
2,513
0,033*

55
3.6 Einfluss von Substanz P auf den Schlaf am Beispiel eines Probanden
Die untenstehenden Abbildungen zeigen exemplarisch die Polysomnographien
(PSG) eines Probanden von beiden Infusionsnächten. Abbildung 20 zeigt die PSG
von Proband 6 in der Placebo-Infusions-Nacht, Abbildung 21 zeigt die PSG dessel-
ben Probanden während der Verum-Infusions-Nacht. Beide Abbildungen enthalten
zudem den parallelen Pulsverlauf beider Nächte.
In Abbildung 20 ist ein gleichmäßiger Pulsverlauf zu erkennen. Pulsanstiege
während der Placebo-Infusionen bleiben aus. Im Gegensatz dazu findet sich
synchron zu den SP-Infusionen eine deutliche Veränderung des Pulses. Kurz nach
Beginn der Infusion erreicht der Puls sein Maximum, um dann wieder abzufallen und
im Verlauf der Infusion wellenförmig wieder anzusteigen, ohne jedoch die gleichen
Werte wie zu Beginn der Infusion zu erreichen. Zwischen den Infusionen nähert sich
der Puls seinem Ruhewert an. Des weiteren befindet sich dieser Proband während
den Placebo-Infusionen im REM-Schlaf, wohingegen er im Verlauf der SP-Infusion
vermehrt wach ist.
Weitere Unterschiede der Schlafarchitektur zwischen der Placebo- und der Verum-
Infusions-Nacht wurden in Kapitel 3.4 anhand der Mittelwerte der Schlafparameter
aller Probanden besprochen.

56
= Placebo Infusionen
Abbildung 20: Schlaf EEG mit Pulsverlauf von Proband 6 in der Placebo Infusionsnacht.
BPM: Puls (Beats per Minute); Arousal: Aufwachen; REM, Stadium 1-4: Schlafstadien

57
= SP-Infusion
Abbildung 21: Schlaf EEG mit Pulsverlauf von Prodand 6 in der SP Infusionsnacht.
BPM: Puls (Beats per Minute); Arousal: Aufwachen; REM, Stadium 1-4: Schlafstadien

4 Diskussion
In dieser Studie wurden erstmals die Effekte infundierter SP auf Schlafparameter bei
gesunden jungen Männern untersucht. Die Hauptaufgabe war, die durch SP hervor-
gerufenen Veränderungen von Schlafparametern darzustellen. Ferner waren für uns
die Folgen der SP-Infusion auf die Stimmung der Versuchspersonen von Interesse.
Es wird vermutet, dass SP bei der Pathogenese der Depression beteiligt ist. Ziel
dieser Arbeit war es, die durch SP hervorgerufenen Veränderungen von Schlafpara-
metern mit den Schlafprofilen von Depressiven zu vergleichen.
Die Studie konnte zeigen, dass die Infusion von SP bei jungen gesunden Männern
zu einer signifikanten Verschlechterung der Stimmung, einer signifikanten Verlänge-
rung der REM-Latenz, der Wachzeit während der SP-Infusionen sowie des Anteils an
Stadium 1-Schlaf in der ersten Nachthälfte führt. Ferner führt die Gabe von SP zu
einer signifikanten Verringerung der REM-Dichte in der zweiten Nachthälfte.
4.1 Versuchsprotokoll
Das von uns gewählte Versuchsprotokoll umfasst die viermalige SP-Infusion über
einen Zeitraum von jeweils 20 Minuten. Wir bevorzugten diese Intervallgabe gegen-
über einer Dauerinfusion, da frühere Studien, welche den Effekt von Neuropeptiden
auf den Schlaf untersuchten (siehe Kapitel 4.4), gezeigt haben, dass eine konstante
Infusion dieser Substanzen geringere Effekte auf das Schlaf-EEG hatte und einige
nach pulsatiler Gabe beobachtete Veränderungen nicht auftraten (Steiger und
Holsboer, 1997).
Schaffalitzky et al. berichten in einer 1986 veröffentlichten Studie über verwendete
Dosen von 0,5 bis hin zu 16 pmol/kg KG/min. In dieser Studie konnte gezeigt
werden, dass der Anstieg der SP-Konzentration im Plasma linear mit der verab-
reichten Dosis korreliert ist und ab einer Konzentration von 1,5 pmol/kg KG/min
exogener SP menschliche Normalwerte im Plasma erreicht werden. Die Intensität
einer nach der Infusion auftretenden Hautrötung vergrößert sich mit der Menge der
infundierten SP. Er beschreibt, dass eine Rötung von Gesicht und Nacken 1-2

59
Minuten nach dem Start der Infusion auftrat, diese Symptome nach 5-10 Minuten bei
konstanter Infusionsrate jedoch wieder verschwanden. Höhere Dosen führten zu
einer Ausdehnung der Symptome im Sinne einer zusätzlichen Rötung von Armen
und Händen, konjunktivaler Injektion, Lakrimation und Palpitationen. Das transiente
Auftreten dieser Nebenwirkungen (1-2 Minuten nach Infusionsbeginn und Rückgang
während der Infusion) wird auch in anderen, früheren Studien beschrieben (Liljedahl
et al. 1958, Dunér et al. 1960). Es werden keine Fälle von Diarrhö oder abdominaler
Koliken beschrieben. Es traten auch bei der maximalen Dosis von 16 pmol/kg
KG/min keine signifikanten Veränderungen von Blutdruck oder Puls auf.
Ebenso beschreibt Coiro et al. (1991, 1992a, 1993), dass bei einer infundierten Dosis
von 1,0-1,5 pmol/kg KG/min über einen Zeitraum von 60 Minuten keine vegetativen
Nebenwirkungen auftraten (Coiro et al. 1992a). Jedoch traten nach diesen Infusionen
signifikante Veränderungen einiger Hormonparameter, wie zum Beispiel ein Anstieg
der ACTH- und Cortisol-Plasmalevel auf (Coiro et al. 1992b).
An den oben genannten Studienergebnissen orientiert, infundierten wir in der
vorliegenden Studie SP in einer Konzentration von 3 pmol/kg KG/min über 20
Minuten. Diese Konzentration wurde von den Probanden gut toleriert. Die aufgetre-
tenen Nebenwirkungen entsprachen in Art und Intensität denen der vorherigen
Studien.
4.2 Effekte von SP auf Schlafparameter
In dieser Studie wurden erstmalig die Folgen einer SP-Infusion auf Schlafparameter
untersucht.
Von allen über die gesamte Nacht betrachteten Schlafparameter zeigte sich die
REM-Latenz signifikant erhöht. Bei getrennter Betrachtung der Nachthälften findet
sich ein signifikant vermehrter Anteil von Stadium 1-Schlaf in der ersten Nachthälfte
und eine erniedrigte REM-Dichte in der zweiten Nachthälfte.
Diese Art des Einflusses von SP auf die Schlafparameter steht im Gegensatz zu der
von uns postulierten Hypothese, dass SP zu einer der Depression gleichsinnigen
Veränderung der Schlafparameter führt.

60
Die REM-Latenz ist ein sehr sensibler Schlafparameter, welcher durch unspezifische
Stressoren leicht beeinflusst werden kann (Lauer et al. 1987). Daher können wir nicht
ausschließen, dass die beobachtete Verlängerung der REM-Latenz durch SP
bedingte Störungen auf die Befindlichkeit des Probanden verursacht wurde. Eine
dieser Störungen könnte der zu den SP-Infusionen simultane Anstieg der Pulsfre-
quenz sein. Dieser könnte ebenfalls die Erhöhung des Anteils an Stadium 1-Schlaf in
der ersten Nachthälfte, sowie die vermehrte Wachzeit während der SP-Gaben
bedingt haben. Um diese Frage zu klären, wären Vergleichsanalysen verschiedener
SP-Fragmente, welche die für die Tachykinin-artigen Effekte verantwortliche Domäne
tragen bzw. nicht tragen, notwendig.
4.3 Effekte von SP auf psychometrische Parameter
Die Auswirkungen der SP-Infusionen auf die Stimmung der Probanden wurden
unmittelbar im Anschluss an die Infusionen bestimmt. SP führte nicht zu klinisch
relevanten Symptomen wie depressiven Zuständen oder Panikattacken, jedoch
bedingte sie eine signifikante Verschlechterung der Stimmung der Probanden. Die
Signifikanz dieses Ergebnisses wurde vornehmlich durch Parameter aus dem
depressiven Formenkreis bedingt (Gefühl des Unglücklichseins, Melancholie,
Depression), nicht durch Symptome, welche Müdigkeit oder Agitation beschreiben.
Weitere Studien sollten die Effekte von SP auf Angst und Depression bei Gabe mit
geringeren Dosen, welche keine merklichen Nebenwirkungen verursachen, in
längeren Applikationsintervallen, sowie bei Patienten, die an Depression oder Angst-
störungen erkrankt sind, untersuchen.
4.4 Effekte anderer Neuropeptide auf den Schlaf
Neuropeptide wie z.B. SP haben in ihrer Wirkung als Neuromodulatoren und
Neurotransmitter im ZNS Anteil an der Regulation verschiedener Gehirnfunktionen,
so auch an der Regulation des Schlafes. Weitere Mitglieder dieser Gruppe sollen hier
näher besprochen werden, um die in unserer Studie erstmalig untersuchten Auswir-

61
kungen infundierter SP auf den Schlaf gesunder Männer vergleichend betrachten zu
können.
Von dieser Gruppe werden Corticotropin releasing hormone (CRH), Growth hormone
releasing hormone (GHRH), Arginin vasopressin (AVP), Neuropeptid Y (NPY),
Thyreotropin-releasing hormone (TRH), Cholezystokinin und Vasoaktives intestinales
Polypeptid (VIP) im Folgenden besprochen und deren Auswirkungen auf den Schlaf
anschließend tabellarisch dargestellt (siehe Tabelle 13).
4.4.1 Corticotropin releasing hormone (CRH)
CRH wird im Nucleus paraventricularis des Hypothalamus gebildet und stimuliert im
Hypophysenvorderlappen die Synthese und Freisetzung von ACTH sowie die Aus-
schüttung von β-Endorphin. Durch die Freisetzung von ACTH wird die Nebennieren-
rinde zur Cortisol-Sekretion stimuliert. CRH spielt somit die Schlüsselrolle in der
Regulierung des hypothalamischen hypophysären adrenokortikalen Systems (engl.
Hypothalamic-pituitary-adrenocotical system, HPA). CRH scheint über die Erhöhung
der Cortisol-Sekretion schlafstörende Effekte zu haben. Die pulsatile Infusion von
CRH in einer Dosis von 4 x 50 µg jeweils zur vollen Stunde zwischen 22.00 und
01.00 Uhr führt zu einer Verringerung von slow wave sleep (SWS) in der zweiten
Nachthälfte, zu einer Verminderung des REM-Schlafes während der gesamten
Nacht, zu einer Verminderung der Schlafeffizienz (Steiger et al. 1997) und zu einer
Steigerung des Anteils von Stadium 1- und 2-Schlaf (Tsuchiyama et al. 1995) (siehe
auch 4.4.9, Tabellarische Darstellung).
Diese Effekte zeigten sich jedoch nicht bei einer kontinuierlichen Gabe von CRH in
einer zur Intervallgabe äquivalenten Dosis. Ebenso wenig konnte nach einer Gabe
des Hormons am Tag eine Veränderung der nächtlichen Schlafarchitektur gemessen
werden (Kellner et al. 1997).
Wie in der vorliegenden Arbeit gezeigt werden konnte, führt die Infusion von SP
ebenfalls zu einer Steigerung des Anteils von Stadium 1-Schlaf. Stadium 2-Schlaf
bleibt jedoch unbeeinflusst. Ebenso wie bei der Gabe von CRH nimmt bei SP-Infu-
sion die REM-Schlaf Dichte ab.

62
4.4.2 Adrenocorticotropes Hormon (ACTH)
Die konstante Infusion von ACTH über acht Stunden in einer Dosis von 350 µg führte
bei den gesunden männlichen Probanden zu einer deutlichen Verminderung des
REM-Schlafes (Gillin et al. 1974). Die Autoren nehmen an, dass diese Effekte durch
die ACTH-bedingte Steigerung der Cortisol-Sekretion entstehen.
Dieser Effekt von ACTH auf den REM-Schlaf korreliert mit der durch SP-Infusion
bedingten Reduktion der REM-Dichte in der 2. Nachthälfte. Die übrigen durch SP
hervorgerufenen Veränderungen des Schlafes werden bei ACTH-Gabe nicht beo-
bachtet (siehe auch 4.4.9, Tabellarische Darstellung).
4.4.3 Arginin vasopressin (AVP)
AVP ist ein Peptid, welches neben der Regulierung von ZNS-Funktionen an der
Steuerung der peripheren Hormonsekretion und der Salz- und Wasser-Homöostase
beteiligt ist. In der Aktivierung des HPA dient es als Co-Faktor von CRH (Rinaman et
al. 1995).
Eine intranasale Applikation von AVP führte bei jungen, gesunden Männern zu einer
geringen, jedoch signifikanten Steigerung von Stadium 2-Schlaf, wohingegen SWS
und REM-Schlaf vermindert wurden (Timsit-Berthier et al. 1982). Die kontinuierliche
intravenöse Gabe bewirkte bei jungen Männern eine Unterdrückung des REM-
Schlafes (Born et al. 1992). Jedoch führte die subchronische, intranasale Gabe von
AVP bei älteren Versuchspersonen mit einer verlängerten Schlafdauer, einer länge-
ren SWS-Phase und einer in der zweiten Nachthälfte verlängerten REM-Schlafperi-
ode zu einer Verbesserung des Schlafes. Diese unterschiedlichen Folgen einer AVP-
Gabe werden durch ein altersbezogenes AVP-Defizit im Nucleus suprachiasmaticus
erklärt.
Wie in Tabelle 4.4.9 gezeigt, sinkt bei pulsatiler SP-Gabe in der zweiten Nachthälfte
ebenfalls die REM-Dichte, die REM-Latenz steigt. Der Stadium 1-Schlaf ist bei SP-
Infusion vermehrt, wohingegen der Stadium 2-Schlaf nicht signifikant verändert wird.

63
4.4.4 Wachstumshormon (GH) und Growth hormone releasing hormone
(GHRH)
Bei Menschen ist die Ausschüttung von Wachstumshormon (engl. Growth hormone,
GH) zeitlich eng mit dem Beginn der ersten großen Phase von SWS gekoppelt (Stei-
ger et al. 1987). Mit dem Altern sowie mit einer Major Depression geht eine Vermin-
derung von SWS und eine verringerte Ausschüttung von GH einher.
Die intervallartige Gabe von GHRH bei jungen gesunden Männern (50 µg GHRH
zwischen 22.00 und 01.00 Uhr jeweils zur vollen Stunde) führte neben einer gestei-
gerten Konzentration von GH zu einer Steigerung von SWS und zu einer vermehrten
Cortisol-Sekretion (Steiger et al. 1992). Dieses Ergebnis steht im Gegensatz zu einer
durch pulsatile SP-Gabe verringerten REM-Dichte (siehe 4.4.9, Tabellarische Dar-
stellung). Eine kontinuierliche Applikation von GHRH hatte auch hier, ähnlich zu Stu-
dien mit CRH, keinen Einfluss auf den Schlaf der Probanden (Marshall et al. 1997,
Kern et al. 1993).
4.4.5 Neuropeptid Y (NPY)
Neuropeptid Y (NPY) hat Anteil an der Steuerung von Nahrungsaufnahme, Anxiolyse
und Sedierung sowie an der Regulierung der HPA-Achse. Im Tierversuch zeigt eine
Verabreichung höherer Dosen eine Steigerung der ACTH- und Kortikosteroid-Kon-
zentration, die Gabe geringerer Mengen einer Reduzierung (Bartfai et al. 1995).
In zwei Studien wurde die intravenöse Gabe von NPY bei gesunden jungen Männern
untersucht. Das Peptid wurde im Intervall mit 4 x 50 µg oder 4 x 100 µg von 22.00 bis
01.00 Uhr jeweils zur vollen Stunde verabreicht (Bohlhalter et al. 1997). Nach Gabe
der niedrigen Dosis erschien das Schlaf EEG weitgehend unauffällig. Die hohe Dosis
NPY hatte eine deutliche Verkürzung der Einschlaflatenz sowie eine Reduzierung
der Delta-Aktivität im Schlaf EEG der zweiten Nachthälfte zur Folge. Diese beiden
Veränderungen werden von GABAA-Rezeptor-Agonisten wie den Benzodiazepinen
in gleicher Weise bedingt (Copinschi et al. 1990, Steiger et al. 1994). Bei SP-Gabe
zeigt sich die Einschlaflatenz erhöht, die Delta-Aktivität wird nicht signifikant
beeinflusst (siehe 4.4.9).
Des weiteren wird aus Tierstudien (Ehlers et al. 1997) und aus Studien an Menschen
(Bohlhalter et al. 1997) die Funktion von NPY als CRH-Antagonist wahrscheinlich.

64
NPY scheint als GABAA-Agnoist zu wirken und dadurch CRH zu supprimieren
(Owens et al. 1989). Somit ist es wahrscheinlich, dass NPY über GABAA-Rezepto-
ren an der Modulierung des Verhaltens, inklusive des Schlafes, beteiligt ist.
4.4.6 Thyreotropin-releasing hormone (TRH)
Untersuchungen über den endokrinen Status depressiver Patienten im Vergleich zu
gesunden Normalpersonen ergeben neben einem niedrigeren CRH-Level auch eine
Verminderung der Aktivität von TRH. Auch die klinische Erfahrung deutet auf einen
Zusammenhang von Schilddrüsenerkrankungen mit dem Schlafverhalten hin. Den-
noch hat es auf diesem Gebiet bislang nur wenige klinische Studien gegeben, die die
Bedeutung von TRH für die Schlafsteuerung untersuchen.
Nur in einer Studie wurden die Effekte von TRH bei gesunden Probanden untersucht
(Hemmeter et al. 1998). Den Probanden wurden 4 x 50 µg TRH oder Placebo zwi-
schen 22.00 und 01.00 Uhr jeweils zur vollen Stunde infundiert. Die dadurch hervor-
gerufenen Veränderungen der Schlaf-EEGs sind eine Minderung der Schlafeffizienz
sowie eine Tendenz zu einem Anstieg der intermittierenden Schlaflosigkeit. Diese
Ergebnisse sprechen gegen eine große Bedeutung von TRH in der Regulierung des
Schlafes. Sie entsprechen den in der vorliegenden Studie gefundenen Veränderun-
gen der Schlafarchitektur durch SP-Gabe (siehe 4.4.9, Tabellarische Darstellung).
Somit lässt sich auf eine Funktion von TRH als eventueller Co-Faktor von CRH in der
Genese der Schlafstörungen depressiver Patienten schließen.
4.4.7 Cholezystokinin (CZK)
CZK ist ein Peptid, welches sowohl im Gastrointestinaltrakt als auch im ZNS zu fin-
den ist. Es ist an der Steuerung des CZK-Vagalen Reflexes beteiligt und dient als
Sättigungsfaktor (Smith et al. 1981).
Die genaue Bedeutung von CZK für den Schlaf ist noch nicht hinreichend untersucht.
In einer an gesunden Probanden durchgeführten Studien konnte gezeigt werden,
dass die nächtliche intramuskuläre Applikation des CZK-Analogon Caerulein eine
geringe Vermehrung des REM-Schlafes (Watanabe et al. 1986) auslöst. Einer intra-
venösen Applikation des Analogons Cerulitid folgte jedoch keine Beeinflussung der

65
Schlafparameter (Pietrowsky et al. 1990). Um auf die genaue Funktion von CZK in
der Schlafregulierung schließen zu können, sind weitere Studien erforderlich.
4.4.8 Vasoaktives intestinales Polypeptid (VIP)
Ergebnisse an Menschen durchgeführter Studien legen einen Einfluss von VIP auf
die Steuerung des zirkadianen Rhythmus nahe (Murck et al. 1996). Dies wird durch
die neuroanatomische Verteilung von VIP-immunoreaktiven Neuronen bei Ratten
bestätigt. Es finden sich Vorkommen im Vorderhirn und vor allem im ventrolateralen
Anteil des Nucleus suprachiasmaticus, der die Funktion des zirkadianen Schrittma-
chers hat (van den Pol et al. 1985, Besson et al. 1986). Dass die Konzentration von
VIP im Nukleus suprachiasmaticus durch das Licht gesteuert wird, resultiert ebenfalls
aus Tierversuchen. Bei Helligkeit wurden niedrigere Konzentrationen von VIP gefun-
den als bei Dunkelheit (Morin et al. 1993). Der zirkadiane Rhythmus der Plasmalevell
von VIP verschwindet mit dem Alterungsprozess (Rolandi et al. 1990), ebenso ver-
ringert sich damit der VIP-Gehalt im Nucleus suprachiasmaticus (Chee et al. 1988).
Beim Menschen wurden die Folgen einer intravenösen Verabreichung von VIP in
zwei unterschiedlichen Dosen untersucht. Den Probanden wurde entweder 4 x 10 µg
oder 4 x 50 µg VIP zwischen 22.00 und 01.00 Uhr jeweils zur vollen Stunde gegeben
(Murck et al. 1996). Unter der höheren Dosis wurden durch eine Verlängerung der
REM- und der Non-REM-Schlafphasen die Schlafzyklen verzögert. Ferner stieg die
REM/non-REM Ratio an.
Für SP wurden in dieser Studie gegensätzlich Effekte auf den REM-Schlaf gefunden.
Es zeigt sich eine Verlängerung der REM-Latenz und eine Verminderung der REM-
Dichte in der zweiten Nachthälfte (siehe 4.4.9, Tabellarische Darstellung).

66
4.4.9 Tabellarische Darstellung
Tabelle 13: Vergleich des Einflusses verschiedener Neuropeptide in unterschiedli-
chen Applikationsformen auf Parameter des Schlafes.
( =vermehrt, = vermindert)
Neuropeptid
Applikation Auswirkungen auf das Schlaf-EEG Quellenangabe
Substanz P
Pulsatil, 4 x 3 pmol/kg KG/min über 20 Minuten
REM-Latenz Intermittierende Schlaflosigkeit S1-Schlaf
REM-Dichte 2. Nachthälfte
CRH
Pulsatil, 4 x 50 µg i.v.
SWS 2. Nachthälfte REM-Schlaf Schlafeffizienz
S1- u. S2-Schlaf
Steiger et al. 1997 Tsuchiyama et al.
1995
ACTH Konstant, 350µg über 8 Std.
REM-Schlaf Gillin et al. 1974
AV
1) Intranasal 2) kontinuierlich i.v.
1) S2-Schlaf SWS REM-Schlaf
2) REM-Schlaf
1) Timsit-Berthier et al. 1982
2) Born et al. 1992
GH / GHRH
1) Intervall i.v. 4 x 50 µg 2) kontinuierlich i.v.
1) SWS 2) ---
1) Steiger et al. 1992 2) Marshall et al. 1997
NPY
1) Intervall i.v. 4 x 50 µg 2) Intervall i.v. 4 x 100 µg
1) --- 2) SOL ∆-Aktivität 2. Nachthälfte
1) Bohlhalter et al. 1997 2) Bohlhalter et al. 1997
TRH Intervall i.v. 4 x 50 µg
Schlafeffizienz Intermittierende
Schlaflosigkeit
Hemmeter et al. 1998
Cholezystokinin
1) Caerulein i.m. 2) Cerulitid i.v.
1) REM-Schlaf 2) ---
1) Watanabe et al. 1986 2) Pietrowsky et al. 1990
VIP
1) Intervall 4 x 10 µg 2) Intervall 4 x 50 µg
1) --- 2) REM-Schlaf Non-REM-Schlaf REM-non-REM-Ratio
1) Murck et al. 1996 2) Murck et al. 1996

67
4.5. Die Rolle der Bluthirnschranke
Wie und ob Peptide die Bluthirnschranke (BHS) überwinden, wird weitreichend dis-
kutiert (Holsboer et al. 1988, Murck et al. 1996, Kastin et al. 1978). So ist es ebenso
wie bei anderen Neuropeptiden auch bei SP fraglich, wie dessen Auswirkungen bei
peripherer Gabe auf den Schlaf und auf zentral ausgeschüttete Hormone vermittelt
werden.
Verschiedene Quellen weisen auf, dass aus einer intranasalen ebenso wie aus einer
oralen Applikation von Neuropeptiden und deren Analoga Veränderungen im Schlaf-
EEG resultieren. Dies deutet darauf hin, dass die BHS nicht notwendigerweise zent-
rale Effekte peripher gegebener Peptide verhindert.
Verschiedene Hypothesen über die Wirkungsweise peripher gegebener Peptide wur-
den erstellt. Zum Einen besteht die Möglichkeit der Vermittlung der Effekte über peri-
phere Rezeptoren, zum Anderen sind der Eintritt der Peptide über die circumventri-
kulären Organe und der aktive Transport durch die Bluthirnschranke eventuelle Pas-
sagemöglichkeiten.
Einige Peptide, so auch GHRH und CRH überwinden die Bluthirnschranke intakt
(Begley et al. 1994). Aktiver Transport durch die Bluthirnschranke konnte für das
ACTH-Fragment Ebiratid (Terasaki et al. 1992) und für NPY (Drewe et al. 1997) de-
monstriert werden. Auch wurde postuliert, dass endogene Serumpeptide von der
Größe des Immunoglobin M (500 kDa) das ZNS über die circumventrikulären Organe
und durchlässige Gefäße im Subarachnoidalraum erreichen (Broadwell et al. 1993).
Ob periphere SP die BHS überwinden kann, ist bisher nicht bekannt. Es wird jedoch
aufgrund ihrer Proteinstruktur eher für unwahrscheinlich gehalten (Coiro et al. 1992,
1993). Da in den zirkumventrikulären Organen SP-haltige Nervenzellen gefunden
wurden (Mikkelsen et al. 1986, 1989), ist es möglich, dass sie hier über die Bindung
an NK-1-Rezeptoren indirekt Auswirkungen auf die Kerne des Thalamus ausübt.
Ferner kann SP an die Eminentia medialis und den Hypophysenvorderlappen bin-
den, da diese außerhalb der BHS liegen.

68
4.6 Zusammenfassung
Substanz P (SP) ist ein Neuropeptid, welches in erhöhten Konzentrationen im Liquor
cerebrospinalis von Patienten gefunden werden kann, die an affektiven Störungen
wie z.B. Depression erkrankt sind. Daher nahm man an, das SP eine Rolle in der
Äthiopathogenese dieser Erkrankungen spielt. Zudem scheinen SP-Rezeptor-Anta-
gonisten bei depressiven Patienten einen antidepressiven Effekt zu haben.
In der vorliegenden Arbeit wurde untersucht, ob die exogene Gabe von SP eine Ver-
änderung der Stimmung und der Schlafarchitektur bei gesunden Probanden verur-
sacht. Ferner wurde überprüft, ob diese Veränderungen den bei einer Depression
auftretenden Veränderungen des Schlafes ähneln.
Für die Studie wurde ein randomisiertes, doppelblindes Versuchsprotokoll gewählt.
Wir rekrutierten 12 männliche, gesunde Probanden, welchen in 2 Blocks à 3 Nächten
während der jeweils dritten Nacht entweder SP oder Plazebo infundiert wurde. Die
intravenöse Infusion erfolgte in 4 Intervallen à 20 Minuten mit je 40 Minuten Pause.
Während dieser Infusionsnächte wurde den Probanden alle 30 Minuten Blutproben
abgenommen, ferner wurde während allen Nächten ein Schlaf-EEG abgeleitet.
Im Anschluss an diese pulsatile SP-Infusion war eine signifikante Verlängerung der
REM-Latenz, eine erhöhte Wachzeit der Probanden während der SP-Infusion sowie
eine Vermehrung des Stadium 1-Schlafes in der ersten Nachthälfte messbar. Zudem
zeigte sich eine signifikante Verschlechterung der Stimmung der Probanden.
Diese Auswirkungen der SP-Gabe können ein Hinweis auf direkte zentrale Effekte
der Substanz sein. SP löst somit bei gesunden Probanden eine depressionsähnliche
Stimmungslage und zum Teil depressionsähnliche Veränderungen des Schlafprofils
aus.
Es lässt sich durch diese Studie jedoch nicht ausschließen, dass die Effekte auf
Schlafparameter durch die von den Probanden als unangenehm empfundenen
vegetativen Nebenwirkungen während der Infusionen von SP verursacht wurden.
Zukünftige Studien werden untersuchen, ob die Gabe von SP bei Patienten mit
affektiven Störungen oder Angststörungen zu Stimmungsveränderungen oder Panik-
attacken führt. Des weiteren soll untersucht werden, ob sich durch die Verwendung
verschiedener SP-Fragmente eine Differenzierung der in dieser Studie beschriebe-
nen Effekte in Tachykininartige- und SP-bedingte Effekte vornehmen lässt.

69
5 Tabellen und Abbildungen
Abbildung 22: Intensität der subjektiv wahrgenommenen Symptome während der
ersten Injektion von SP. Angegeben sind die Einzelwerte der Probanden nach der
Likert-Skala, anhand derer jeder Proband die Ausprägung der Beschwerden ein-
schätzen sollte. Keines dieser Symptome wurde bei Placebo-Infusion berichtet. Eine
Abbildung der Mittelwerte mit Standartabweichung ist in Kap. 3.1 zu finden.
Proband 1
0123456789
10
Flus
h-G
esic
ht
Flus
h-H
als
Flus
h-A
rme
Flus
h-H
ände
Kon
junk
tival
eIn
jekt
ion
Trän
enflu
ß
Erw
ärm
ung
Dru
ckge
fühl
Hitz
egef
ühl
Her
zklo
pfen
Kop
f-
Bau
ch-
Dur
chfa
ll
schmerzen
Proband 2
0123456789
10
Flus
h-G
esic
ht
Flus
h-H
als
Flus
h-A
rme
Flus
h-H
ände
Kon
junk
tival
eIn
jekt
ion
Trän
enflu
ß
Erw
ärm
ung
Dru
ckge
fühl
Hitz
egef
ühl
Her
zklo
pfen
Kop
f-
Bau
ch-
Dur
chfa
ll
schmerzen

70
Proband 3
0123456789
10Fl
ush-
Ges
icht
Flus
h-H
als
Flus
h-A
rme
Flus
h-H
ände
Kon
junk
tival
eIn
jekt
ion
Trän
enflu
ß
Erw
ärm
ung
Dru
ckge
fühl
Hitz
egef
ühl
Her
zklo
pfen
Kop
f-
Bau
ch-
Dur
chfa
ll
schmerzen
Proband 6
0123456789
10
Flus
h-G
esic
ht
Flus
h-H
als
Flus
h-A
rme
Flus
h-H
ände
Kon
junk
tival
eIn
jekt
ion
Trän
enflu
ß
Erw
ärm
ung
Dru
ckge
fühl
Hitz
egef
ühl
Her
zklo
pfen
Kopf
-
Bauc
h-
Dur
chfa
ll
schmerzen

71
Proband 7
0123456789
10Fl
ush-
Ges
icht
Flus
h-H
als
Flus
h-A
rme
Flus
h-H
ände
Kon
junk
tival
eIn
jekt
ion
Trän
enflu
ß
Erw
ärm
ung
Dru
ckge
fühl
Hitz
egef
ühl
Her
zklo
pfen
Kopf
-
Bauc
h-
Dur
chfa
ll
schmerzen
Proband 8
0123456789
10
Flus
h-G
esic
ht
Flus
h-H
als
Flus
h-Ar
me
Flus
h-H
ände
Konj
unkt
ival
eIn
jekt
ion
Trän
enflu
ß
Erw
ärm
ung
Dru
ckge
fühl
Hitz
egef
ühl
Her
zklo
pfen
Kopf
-
Bauc
h-
Dur
chfa
ll
schmerzen

72
Proband 10
0123456789
10Fl
ush-
Ges
icht
Flus
h-H
als
Flus
h-A
rme
Flus
h-H
ände
Kon
junk
tival
eIn
jekt
ion
Trän
enflu
ß
Erw
ärm
ung
Dru
ckge
fühl
Hitz
egef
ühl
Her
zklo
pfen
Kopf
-
Bauc
h-
Dur
chfa
ll
schmerzen
Proband 11
0123456789
10
Flus
h-G
esic
ht
Flus
h-H
als
Flus
h-A
rme
Flus
h-H
ände
Kon
junk
tival
eIn
jekt
ion
Trän
enflu
ß
Erw
ärm
ung
Dru
ckge
fühl
Hitz
egef
ühl
Her
zklo
pfen
Kop
f-
Bau
ch-
Dur
chfa
ll
schmerzen

73
Proband 12
0123456789
10Fl
ush-
Ges
icht
Flus
h-H
als
Flus
h-A
rme
Flus
h-H
ände
Kon
junk
tival
eIn
jekt
ion
Trän
enflu
ß
Erw
ärm
ung
Dru
ckge
fühl
Hitz
egef
ühl
Her
zklo
pfen
Kop
f-
Bauc
h-
Dur
chfa
ll
schmerzen

74
Abbildung 23: Pulsverläufe der einzelnen Probanden mit Einzelwerten vor und wäh-
rend der SP-Injektion; eine Abbildung der Mittelwerte mit Standartabweichung findet
sich in Kapitel 3.2
Proband 1
51
65
8275
64
74
48
0
10
20
30
40
50
60
70
80
90
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls
Proband 2
72
102 9890
83 83
61
0
20
40
60
80
100
120
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls

75
Proband 3
45
73
102
7058
76
55
0
20
40
60
80
100
120
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls
Proband 4
60
70
80
7061
66 63
0
10
20
30
40
50
60
70
80
90
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls
Proband 6
4250
88
59
79
70
43
0
10
20
30
40
50
60
70
80
90
100
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls

76
Proband 7
7880
86
79
74
86
79
6870727476788082848688
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls
Proband 8
62
71 74
64 64 67
55
0
10
20
30
40
50
60
70
80
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls
8
Proband 10
73 74
10291 93
7265
0
20
40
60
80
100
120
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls

77
Proband 11
53 55
87 86 83 8072
0
10
20
30
40
50
60
70
80
90
100
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls
Proband 12
64
83
102
66
9485
70
0
20
40
60
80
100
120
vor In
fusion
Beginn
nach
2 min.
nach
5 min.
nach
10 m
in.
nach
15 m
in.
nach
20 m
in.
Puls

78
6 Quellenverzeichnis
Arai H, Emson PC (1986): Regional distribution of neurokinins K and other
tachykinins (neurokinin A, neurokinin B and substance P) in rat central nervous
system. Brain Research 399:240-249.
Armstrong DM, Terry RD (1985): Substance P immunoreactivity within neuritic
Plaques. Neurosci Lett 58 :139-144.
Bartfai J, Galanin (1995): A neuropeptide with important central nervous system
actions. In: Bloom FE, Kupfer DJ, eds. Neuropsychopharmacology. 4th
generation of progress. New York: Raven Press 563-71.
Beal MF, Martin JB (1986): Neuropeptides in neurological disease. Ann neurol
20:547-565.
Begley DJ (1994): Peptides and the blood-brain barrier: the status of our
understanding. Ann NY Acad Sci 739:89-100.
Berger M, Riemann D (1993): Normal and abnormal REM sleep regulation: REM
sleep in depression- an overview. J Sleep Res 2:211-223.
Besson J, Sarrieau A, Vial M, Marie JC, Rosselin G, Rostende W (1986) :
Characterization and autoradiographic distribution of vasoactive intestinal
peptide binding sites in the rat central nervous system. Brain Res 398: 329-36.
Block GA, Rue D, Panebianco D, Reines SA (1998) The substance P antagonist L-
754,030 (MK-0869) is ineffective in the treatment of postherpetic neuralgia.
Neurology 50:A225.
Bohlhalter S, Antonijevic IA, Brabant G, Holsboer F, Steiger A (1997): Short term
pulsatile administration of neuropeptide Y suppresses ACTH and cortisol
secretion, promotes sleep, but does not affect leptin secretion in man. Exp Clin
Endocrinol Diabetes Suppl 1:111
Born J, Kellner C, Uthgenannt D, Kern W, Fehm HL (1992): Vasopressin regulates
human sleep by reducing rapid-eye-movement sleep. AM J Physiol 262: E295-
300.

79
Broadwell RD, Sofroniew MV (1993): Serum proteins bypass the blood-brain fluid
barriers for extracellular entry to the central nervous system. Exp Neurol
120:245-63.
Casceiri MA, Bull HE, Mumford RA, Patchett AA, Thornberry NA, Liang T. (1983)
Carboxy-terminal tripeptide hydrolysis of substance P by purified rabbit lung
angiotensin-converting enzyme and the potentiation of substance P activity in
vivo by captopril and MK-422. Mol Pharmacol; 25: 287-93.
Chee CA, Roozendaal B, Swaab DF, Goudsmit E, Mirmiran M (1988): Vasoactive
intestinal polypeptide neurone changes in the senile rat suprachiasmatic
nucleus. Neurobiol Ageing 9:307-12.
Coiro V, Capretti L, Volpi R, Davoli C, Marcato A, Cavazzini U, Caffarri G, Rossi G,
Chiodera P (1992b): Stimulation of ACTH/Cortisol by intravenously infused
Substance P in normal men: Inhibition by sodium valproate.
Neuroendocrinology 56:459-463.
Coiro V, Volpi R, Capretti L, Caiazza A, Caffarri G, Rossi G, Marchesi C, Chiodera P
(1993): Intravenously infused substance P is unable to change basal and TRH-
stimulated PRL secretion in normal men. Horm Res 39:73-76
Coiro V, Volpi R, Capretti L, Speroni G, Bocchi R, Caffarri G, Colla R, Rossi G,
Chiodera P (1992a): Intravenously infused Substance P enhances basal and
growth hormone (GH) releasing hormone-stimulated GH secretion in normal
men. Peptides 13:843-846.
Copinschi G, Leproult R, Van Onderbergen A, Caufriez A, Cole KY, Schilling LM,
Mendel CM, De Lepeleire I, Bolognese JA, van Cauter E (1997): Prolonged oral
treatment with MK-677, a novel growth hormone secretagogue improves sleep
quality in man. Neuroendo; 66: 278-86.
Copinschi G, Van Onderbergen A, L’Hermite-Baleriaux M, et al. (1990): Effects of the
short-acting benzodiazepine triazolam, taken at bedtime, on circadian and
sleep-related hormonal profiles in normal men. Sleep 13:232-44.
De Felipe C, Herrero JF, O’Brien JA et al. (1998) Altered nociception, analgesia and
aggression in mice lacking the receptor for substance P. Nature 392:394-397.
Drewe J, Fricker G, Behrens U, Gutmann H, Beglinger C, Huwyler J (1997): Are
peripheral gut hormones able to cross the blood-brain barrier? Naunyn
Schmiedebergs Arch Pharmacol 335:R106

80
Dunér H, Pernow B (1960) Acta Physiol Scand 49:261-266.
Ehlers CL, Somes C, Lopez A, Kirby D, Rivier JE (1997): Electrophysiological actions
of neuropeptide Y and its analogues: new measures for anxiolytic therapy?
Neurophysopharmacology 17:34-43.
Elliott PJ, Mason GS, Graham EA, Turpin MP, Hagan RM (1992): Modulation of the
rat mesolimbic dopamine pathway by neurokinins. Behav Brain Res 51: 77-82.
Elliott PJ, Mason GS, Stephens-Smith M, Hagan RM (1991): Behavioural and
biochemical responses following activation of midbrain dopamine pathways by
receptor selective neurokinin agonists. Neuropeptides 19: 119-126.
Enserink M (1999) : Can the placebo be the cure? Science 284:238-240.
Erspamer, V. (1981). The tachykinin peptide family. Trends Neusosci.;4:267-269.
Ferrier IN, Cross AJ, Johnson JA, Roberts GW, Crow TJ, Corsellis JA, Lee YC,
O’Shaughnessey D, Adrian TE, McGregor GP, Baracese-Hamilton AJ, Bloom
SR (1983): Neuropeptides in Alzheimer type dementia. J Neurol Sci 62:159-170.
Feuerstein TJ, Seeger W (1997): Modulation of acetylcholine release in human
cortical slices: possible implications for Alzheimer’s disease. Pharmacological
therapy; 74: 333-347.
File SE (1997):Anxiolytic action of a neurokinin 1 receptor antagonist in the social
interaction test. Pharmacol Biochem Behav 58:747-752.
Froger N, Gardier AM, Moratella R, Alberi I, Lena I, Boni C, De Felipe C, Rupniak
NM, Hunt SP, Jacquot C, Hamon M, Lanfumey L (2001): 5-hydroxytryptamine
(5-HT) 1A autoreceptor adaptive changes in substance P (neurokinin 1)
reseptor knock-out mice mimic antidepressant-induced desensitization. J
Neurosci 21: 8188-97.
Gillin JC, Jacobs LS, Snyder F, Henkin RI (1974): Effects of ACTH on the sleep of
normal subjects and patients with Addison’s disease. Neuroendocrinology
15:21-31.
Hahn MK, Bannon MJ (1999): Stress- induced C- fos expression in the rat locus
coeruleus is dependent on neurokinin- 1 receptor activation. Neuroscience; 94:
1183- 1188.
Halliday G.M., Li Y.W., Joh T.H., Cotton R.G.H:, Howe P.R.C., effen L.B. and
Blessing W.W. (1988). Distribution of substanze P like immunoreactive neurons

81
in the human medulla oblongata: Co-lokalization with monoamine- synthesizing
neurons. Synapse; 2: 353-370.
Heikkila L, Rimon R, Terenius L (1990): Dynorphin A and substance P in the
cerebrospinal fluid of schizophrenic patients. Psychiat Res 34: 229-236.
Hemmeter U, Rothe B, Guldner J, Holsboer F, Steiger A (1998): Effects of
Thyreotropin-Releasing Hormone on the Sleep EEG and Nocturnal Secretion in
Male Volunteers. Neuropsychology 38: 25-31.
Holsboer F, von Bardeleben U, Steiger A (1988): Effects of intravenous corticotropin-
releasing hormone upon sleep-related growth hormone surge and sleep EEG in
man. Neuroendocrinology 48: 32-8.
Jarrett DB, Miewald JM, Kupfer DJ (1990): Recurrent depression is associated with a
persistent reduction in sleep-related growth hormone secretion. Arch Gen
Psychiatry 47: 113-118.
Kastin AJ, Coy DH, Schally AV, Miller LH (1978): Peripheral administration of
hypothalamic peptides results in CNS changes. Pharmacol Res Commun
10:293-312.
Kellner M, Yassouridis A, Manz B, Steiger A, Holsboer F, Wiedemann K (1997):
Corticotropin-releasing hormone inhibits melatonin secretion in healthy
volunteers - a potential link to low-melatonin syndrome in depression?
Neuroendocrinology 16: 339-45.
Kern W, Halder R, al-Reda S, Späth-Schwalbe E, Fehm HL, Born J (1993): Systemic
growth hormone does not affect human sleep. J Clin Endocrinol Metab 76:
1428-32.
Kramer MS, Cutler N, Feighner J, Shrivastava R, Carman, Smarek JJ, Reines SA,
Liu G, Snavely D, Wyatt-Knowles E, Hale JJ, Mills SG, MacCoss M, Swain CJ,
Harrison T, Hill RG, Hefti F, Scolnick EM, Cascieri MA, Chicchi GG, Sadowski
S, Williams AR, Hewson L, Smith, Rupniak NM (1998): Distinct mechanism for
antidepressant activity by blockade of central substance P receptors. Science
281: 1640-1645.
Krüger JM, Obal Jr J, Jidong F (1999): Humoral regulation of physiological sleep:
cytokines and GHRH. J Sleep Res,; 8: 53-59.

82
Lauer C, Riemann D, Lund R, Berger M (1987): Shortened REM latency: a
consequence of psychological strain? Psychophysiology 24:263-271.
Liljedahl SO, Mattson O, Pernow B. (1958) Scand J Clin Lab Invest 10:16-25.
Lieb K, Fiebich BL, Berger M. (2000): Substanz P-Rezeptor-Antagonisten als neues
antidepressives und anxiolytisches Wirkprinzip? Nervenarzt 71:758-761.
Liu H, Cao Y, Basbaum AI, Mazarati AM, Sankar R, Wasterlain CG (1999):
Resistance to excitotoxin-induced seizures and neuronal death in mice lacking
the preprotachkinin A gene. Proc Natl Acad Sci USA 96: 12096-12101.
Liu H, Mazarati AM, Katsumori H, Sankar R, Wasterlain CG (1999): Substance P is
expressed in hippocampal principal neurones during status epilepticus and
plays a critical role in the maintenance of status epilepticus. Proc Natl Acad Sci
USA 96:5286-5291.
Luu TN, Chester AH, O’Neill GS, et al. (1992): Effects of vasoactive neuropeptides
on human saphenous vein. Br Heart J 67:474-77
Maggio J.E. and Hunter J.C. (1984). Regional distribution of kassinin-like
immunoreactivity in rat central and peripheral tissues and the effect of capsicain.
Brain Res.; 307: 370-373.
Marshall L, Moelle L, Boeschen G, Steiger A, Fehm HL, Born J (1996): Greater
efficacy of episodic than continuous growth hormone releasing hormone
(GHRH) administration in promoting slow wave sleep (SWS). J Clin Endocrinol
Metab 81: 1009-13.
Maubach KA, Rupniak NM, Kramer MS, Hill RG (1999): Novel strategies for
pharmacotherapy of depression. Curr Opin Chem Biol 3:481-488.
Mendelson WB, Slater S, Gold P, Gillin JC (1980): The effect of growth hormone
administration on human sleep: A dose-response study. Biol psych; 15: 613-
618.
Mikkelsen JD, Larsen PJ, Moeller M, Vilhardt H, Soemark T (1989): Substance P in
the median eminence and pituitary of the rat: demonstration of immunreative
fibres and specific binding sites, Neuroendocrinology, 50:100-108.
Mikkelsen JD, Moeller M (1986): The presence of substance P-immunoreactive fibres
in the organum vasculosum lamina terminalis of the Mongolian gerbil (lat.
Meriones unguiculatus). Cell Tiss. Res 346:219-222.

83
Miller C, Kirchmair R, Toger J et al. (1996): CSF of neuroleptic- naïve first- episode
schizophrenic patients: levels of biogenic amines, substance P, and peptides
derived from chromogranin A (GE-25) and secretogranin II (secretoneurin). Biol
Psychiatry 39: 911-918.
Morin AJ, Denoroy L, Jouvet M (1993): Daily variations in concentration of vasoactive
intestinal peptide immunoreactivity in hypothalamic nuclei of rats rendered
diurnal by restricted-schedule feeding. Neurosci Lett 152:121-4.
Murck H, Guldner J, Frieboes R-M, et al. (1996): VIP decelerates non-REM-REM
cycles and modulates hormone secretion during sleep in men. Am J Physiol
271: R905-11.
Murtra P, Sheasby AM, Hunt SP, De Felipe C (2000): Rewarding effects of opiates
are absent in mice lacking the receptor for substance P. Nature 405:180-183.
Navari RM, Reinhardt RR, Gralla RJ et al. (1999) Reduction of cisplatin- enduced
emesis by a selective neurokinin-a-receptor antagonist. L-754,030 Antiemetic
Trials Group. New Eng J Med 340: 190-195.
Ogawa T, Kanazawa I and Kimura S (1985). Regional distribution of substance P,
neurokinin A and neurokinin B in rat spinal cord, nerve roots and dorsal root
ganglia, and the effects of dorsal root section or spinal transection. Brain Res.;
359: 152-157.
Otsuka m, Yoshioka K (1993): Neurotransmitter functions of mammalian tachykinins.
Physiological Reviews; 73: 229-308.
Owens MJ, Bissette G, Nemeroff CB (1989): Acute effects of alprazolam and
adinazolam on the concentrations of corticotropin-releasing factor in the rat
brain. Synapse 4: 196-202.
Pietrowsky R, Fehm HL, Er A, Bathelt B, Born J (1990): Influences of the
cholecystokinin analogue ceruletide on human sleep and evoked potentials.
Neuropsychobiology 23: 41-7.
Pioro EP, Mai JK and Cuello AC (1999): Distribution of substance P and enkephalin
immunoreactive neurones and fibres. In: The human nervous system. Paxinos,
ed. Academic press: 1051-1094.
Quartara L, Maggi CA (1998): The tachykinin MK1 receptor. Part II: Distribution and
pathophysiological roles. Neuropeptides; 32: 1- 49.

84
Rees DD, Palmer RM, Hodson HF, et al. (1989): A specific inhibitor of nitric oxide
formation from L-arginine attenuates endothelium-dependant relaxation. Br J
Pharmacol 96:418-27.
Riemann D, Berger M, Voderholzer U (2001): Sleep and Depression- Results from
psychobiological studies: An overview. Biological Psychology 57:67-103.
Rimon R, Le Greves P, Nyberg F, Heikkila L, Salmela L, Terenius L (1984): Elevation
of substance P-like peptides in the CEF of psychiatric patients. Biol. Psychiatry
19: 509-516.
Rinaman L, Sherman TG, Stricker EM (1995): Vasopressin and oxytocin in the
central nervous system. In: Bloom FE, Kupfer DJ, eds.
Neuropsychopharmacology. 4th generation of progress. New York: Raven
Press 531-42.
Rolandi E, Franceshini R, Cataldi A, Barreca T (1990): Twenty-four-hour secretory
pattern of vasoactive intestinal polypeptide in the elderly. Gerontology 36:356-
60.
Rupniak NM, Hill RG (2000): Novel aspects of pain: opioids and beyond. John Wiley
Press, pp 135-155.
Rupniak NM, Kramer MS(1999): Discovery of the antidepressant and anti-emetic
efficacy of substance P receptor (NK1) antagonists. Trends Pharmacological
science; 20: 485- 490.
Russel IJ, Orr MD, Littmann B, Vipraio GA, Albourek D, Michalek JE, Lopez Y,
Mackillip F (1994): Elevated cerospinal fluid levels of substance P in patients
with the fibromyalgia syndrome. Arthritis Rheum. 37 (11): 1593-601.
Russel IJ (1998): Neurochemical pathogenesis of fibromyalgia. Z Rheumatol.
57[Suppl 2]: 63-66.
Santarelli L, Gobbi G, Debs PC, Sibille ET, Blier P, Hen R, Heath MJ (2001); Genetic
and pharmacological disruption of neurokinin 1 receptor decreases anxiety
related behaviours and increases serotonergic function. Proc Nat Acad Sci USA
98: 1912-7.
Schedlowski M, Fluge T, Richter S, Tewes U, Schmidt RE, Wagner TO (1995): Beta-
endorphin, but not substance P, is increased by acute stress in humans.
Psychoendocrinology 20:103-10.

85
Sergejev V, Hokfelt T and Hurd Y (1990): Serotonin and substance p co-exist in
dorsal raphe neurones of the human brain. Neuroreport; 10: 3967-3970.
Shirayama Y, Mitsushio H, Takashima M, Ichikawa H, Takahashi K (1996):
Reduction of substance P after chronic antidepressants treatment in the
stratum, substanta nigra and amygdala of the rat. Brain Res 739:70-78.
Smith GP, Jerome C, Cushin BJ, Eterno R, Simansky KJ (1981): Abdominal
vagotomy blocks the satiety effect of cholecystokinin in the rat. Science
213:1036-7.
Steiger , von Bardeleben U, Guldner J, Lauer C, Rothe B, Holsboer F (1993): The
sleep EEG and nocturnal hormonal secretion studies on changes during the
course of depression and on effects of CNS-active drugs. Prog
Neuropsychopharmacol Biol Psychiatry 17:125-137.
Steiger A, Guldner J, Hemmeter U, Rothe B, Wiedemann K, Holsboer F (1992):
Effects of growth hormone-releasing hormone and somatostatin on sleep EEG
and nocturnal hormone secretion in male controls. Neuroendo; 56: 566-573.
Steiger A, Guldner J, Lauer C, Meschenmoser C, Pollmächer T, Holsboer F (1994):
Flumazenil exerts intrinsic activity on sleep EEG and nocturnal hormone
secretion in normal controls. Psychopharmacology 113:334-8.
Steiger A, Herth T, Holsboer F (1987): Sleep-electroencephalography and the
secretion of cortisol and growth hormone in normal controls. Acta Endocrinol
(Copenh) 116: 36-42.
Steiger A, Holsboer F (1997): Neuropeptides and human sleep. Sleep 20:1038-1052.
Stout S, Owens M, Nemeroff C (2001): Neurokinin 1 receptor antagonists as
potential antidepressants. Annu. Rev. Pharmacol. Toxicol. 41: 877-906.
Tamiya R, Hanada M, Kawai Y, Inagaki S, Takagi H (1990): Substance P afferents
have synaptic contacts with dopaminergic neurons in the ventral tegmental area
of the rat. Neurosci Lett 110: 11-15.
Terasaki T, Takakuwa S, Saheki A, et al. (1992): Absorptive-mediated endocytosis of
an adrenocorticotropic hormone (ACTH) analogue, ebiratide, into the blood-
brain barrier: studies with monolayers of primary cultured bovine brain capillary
endothelial cells. Pharm Res 9:529-34

86
Timsit-Berthier M, Mantanus H, Devos JE, Spiegel R (1982): Action of lysine-
vasopressin on human electroencephalographic activity. Night sleep pattern,
auditory evoked potential, contingent negative variation.
Neuropsychopsychobiology 8: 248-58.
Tsuchiyama Y, Uchimura N, Sakamoto T, Maeda H, Kotorii T (1995): Effects of
hCRH on sleep and body temperature rhythms. Psychiatry Clin Neurosci; 49:
299-304.
Vinik AI, Gonin J, England BG, et al. (1990) : Substance P in neuroendocrine tumors
and idiopathic flushing : The value of pentagastrin stimulation tests and the
effects of somatostatin analogue. J Clin Endocrinol Metab 70:1702-1709.
Voderholzer U, Laakmann G, Wittmann R, Daffner-Bujia C, Hinz A, Haag C, Baghai
T (1993): Profiles of spontaneous 24-hour and stimulated growth hormone
secretion in male patients with endogenous depression. Psychiatry Res 47: 215-
227.
Voderholzer U, Riemann D, Hohagen F, König A, Berger M (1996): Schlaf und
Depression. Internist; 37: 483-489.
Watanabe N, Sakai T, Tada K, Masuno J, Morji T (1986): The effects of caerulein on
nocturnal sleep. Prog Neuropsychopharmacol Biol Psychiatry 10: 749-54.
Weiss DW, Hirt R, Tarcic N, Berzon Y, Ben-Zur H, Breznitz S, Glasxer B, Grover NB,
Baras M, O’Dorisio TM (1996): Studies in psychoneuroimmunology:
Psychological, immunological, and neuroendocrinological parameters in Israeli
civilians during and after period of Scud missile attacks. Behav Med 22: 5-14.
Welches WR, Brosnihan KB, Ferrario CM (1993): A comparison of the properties and
enzymatic activities of three angiotensin processing enzymes: angiotensin
converting enzyme, prolyl endopeptidase and neutral endopeptidase 24.11. Life
Sci; 52: 1461-80.
Yates CM, Harmar AJ, Rosie R, Sheward J, Sanchez de Levy G, Simpson J,
Maloney AFJ, Gordon A, Fink G (1983): Thyreotropin-releasing hormone,
luteinizing hormone-releasing hormone and substance P immuno-reactivity in
post-mortem brain from cases of Alzheimer-type dementia and Down’s
syndrome. Brain Res 258:45-52.

87
Yokosawa H, Endo S. Ohgaki Y, Maeyama J, Ishii S (1985): Hydrolysis of substance
P and its analogues by angiotensin-converting enzyme from rat lung.
Characterisation of endopeptidase activity of the enzyme. J Biochem;89:1293-9.

88
7 Lebenslauf
Katharina Kampik Klinikstr. 12, 97070 Würzburg
geb. Dancker Tel: (0931) 8807671, email: [email protected]
Geboren am 07.04.1976 in Bonn
Verheiratet, deutsch
Schulausbildung
1982 - 1986 Löwenburggrundschule Bad Honnef
1986 - 1995 Gymnasium der Insel Nonnenwerth im Rhein
Mai 1995 Abitur Hochschulausbildung
Okt. 1995 – Aug. 1998 Medizinstudium an der Rheinischen Friedrich-
Wilhelms-Universität zu Bonn
Okt. 1998 – April 2002 Medizinstudium an der Albert-Ludwigs-Universität
zu Freiburg i. Brsg.
Okt. 1998 Erster Abschnitt der ärztlichen Prüfung
April 2001 Zweiter Abschnitt der ärztlichen Prüfung
April 2002 Dritter Abschnitt der ärztlichen Prüfung
April 2002 Abschluss des Medizinstudiums an der Universität
zu Freiburg
Berufliche Tätigkeit Augenklinik der Julius-Maximilians-Universität
Würzburg
16.09.2002 – 15.03.2004 Ärztin im Praktikum
seit 15.05.2004 Assistenzärztin
Würzburg, den 19.02.2005 Katharina Kampik

89
8 Danksagung
Vielen Dank an Herrn Prof. Dr. Berger und Herrn PD Dr. Voderholzer für die
Bereitstellung des Themas.
Ganz herzlich danke ich Herrn PD Dr. Voderholzer für die tatkräftige Unterstützung
und für das sehr schnelle Korrekturlesen der Arbeit.
Vielen Dank an Frau Dr. Weske für die vielen guten Tips und die Hilfe im Schlaflabor
und bei der Durchführung dieser Studie!
Mein Dank gilt auch dem Team des Schlaflabors – jede Frage wurde auch bei
wiederholtem Auftreten geduldig beantwortet.
Meinen Eltern danke ich für die großartige Unterstützung! Ohne Euch wäre das nicht
möglich gewesen.
Daniel, vielen Dank für die ganze Geduld und für alles andere in unserem
gemeinsamen Leben!

90
8 Anhang

91

92

93

94

95

96

97

98

99











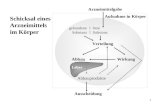





![SOMNOtouch™ NIBP - somnomedics.de · Blutdruck-Report Aktigraphie Blutdruck Wach mmHg Puls [bpm] PP [mmHg] Wach Wach Schlaf Schlaf Schlaf SOMNOtouch NIBP • Kontinuierliches 24-Stunden](https://static.fdokument.com/doc/165x107/5d64e3d688c9933c688bba9b/somnotouch-nibp-blutdruck-report-aktigraphie-blutdruck-wach-mmhg-puls-bpm.jpg)

