Fluorapatit Ca F(P0 Ein Modell zur Synthese der...
-
Upload
truongtruc -
Category
Documents
-
view
215 -
download
0
Transcript of Fluorapatit Ca F(P0 Ein Modell zur Synthese der...

This work has been digitalized and published in 2013 by Verlag Zeitschrift für Naturforschung in cooperation with the Max Planck Society for the Advancement of Science under a Creative Commons Attribution4.0 International License.
Dieses Werk wurde im Jahr 2013 vom Verlag Zeitschrift für Naturforschungin Zusammenarbeit mit der Max-Planck-Gesellschaft zur Förderung derWissenschaften e.V. digitalisiert und unter folgender Lizenz veröffentlicht:Creative Commons Namensnennung 4.0 Lizenz.
Fluorapatit Ca5F(P04)3 -Ein Modell zur Synthese der Zahnhartsubstanz im System CaF2-Ca3(P04)2
Fluorapatite - A Model for the Synthesis of Dental Enamel in the System CaF2-Ca3(P04)2
Ernst-Dieter Franz Institut für Mineralogie und Kristallchemie der Universität, Pfaffenwaldring 55, D-7000 Stuttgart-80 (Vaihingen) Z. Naturforsch. 88b, 1037-1040 (1983); eingegangen am 25. Mai 1983 Fluorapatite, Hydroxylapatite, Dental Enamel, Synthesis, Phase Equilibria
Fluorapatite Ca5F(PC>4)3 can be synthesized by melting of CaF2 together with Ca3(P04)2 at 1660 °C in the molar ratio CaF2 • 3 Ca3(PÜ4)2. Fluorapatite is more resistant against acids than hydroxylapatite Cas0H(P04)3 and can activate the remineralisation in dental enamel. The apatite of dental enamel is more resistant against mechanical stress than synthetic apatite due to a different microstructure of the crystal grains.
Einleitung Der Zahnschmelz besteht weitestgehend aus
Hydroxylapatit Ca50H(PC>4)3. Der Abbau bezie-hungsweise die Zerstörung der Zahnhartsubstanz, die Zahnkaries, ist eine Krankheit, die wahrschein-lich so alt ist wie die Menschheit selbst. Durch die starke Ausbreitung dieser Krankheit in den letzten hundert Jahren, hauptsächlich in den Industrie-nationen, kommt der Kariesprophylaxe eine beson-dere Bedeutung zu.
Bereits 1916 gibt Black [1] seine Untersuchungs-ergebnisse über sogenannte „verfärbte Zähne" (mottled enamel) bekannt, die bei den Bewohnern vieler Ortschaften in den USA beobachtet wurden. Die Ursache für die eigenartigen Flecken im Zahn-schmelz war zwar noch unbekannt. Man hatte aber bereits festgestellt, daß Zähne mit,,mottled enamel" offensichtlich recht kariesresistent sind. Erst 1931 konnte dann Churchill [2] nachweisen, daß für ,,mottled enamel" ein lokal hoher Fluoridgehalt im Trinkwasser verantwortlich war.
Groß angelegte Studien von Dean [3] und Dean et al. [4] in den dreißiger und vierziger Jahren in den USA zeigten, daß steigende Fluoridgehalte im Trink-wasser eindeutig die Karieshäufigkeit reduzieren. Diese Erkenntnis hat eine Vielzahl von Unter-suchungen ausgelöst, deren Ergebnisse 1970 in der World Health Organisation Monography „Fluorides and Human Health" [5] zusammengefaßt sind. Die Wirkungsmechanismen einer Fluoridanwendung können nach Naujoks [6] in drei Schwerpunkte ein-geteilt werden:
0340-5087/83/0900-1037/$ 01.00/0
1. Erhöhung der Säureresistenz des Zahnschmelzes. 2. Verbesserung der Remineralisation des Zahn-
schmelzes. 3. Beeinflussung der Säureproduktion in den Zahn-
belägen. Zu Punkt 1 ist zu bemerken, daß durch gezielte Gaben von Fluorid offensichtlich bereits präeruptiv fluorapatitischer Zahnschmelz gebildet wird oder zumindest ein Fluorapatit-Hydroxylapatit-Misch-kristall. Dieser soll säureresistenter sein als reiner Hydroxylapatit. Zu Punkt 2 kann man folgendes sagen: Die Apatitkristalle der Zahnhartsubstanz bilden sich über eine apatitähnliche Vorstufe, das Oktacalciumphosphat Ca4H(P04)3 • 2H20. Nach Newesely [7] können nun bereits Spuren von Fluorid diese Umwandlung wesentlich beschleunigen. Meh-rere Analysen des Autors haben ergeben, daß der Speichelstein - eine Hartsubstanz, die sich auf und zwischen den Zähnen bilden kann - ebenfalls wie der Zahnschmelz weitestgehend aus Hydroxylapatit besteht. Der Speichel liefert also alle Komponenten, die zu einer Hydroxylapatitbildung notwendig sind. Geht man nun davon aus, daß kleine Fissuren in der Zahnhartsubstanz ohnehin verheilen können, so wird dieser Vorgang durch einen fluoridhaltigen Speichel offensichtlich beschleunigt. Eventuell kommt es durch einen fluoridhaltigen Speichel sogar bei einem posteruptiven Zahn zu einer oberfläch-lichen Fluorapatitbildung durch Fluormetasoma-tose.
Punkt 1 und 2 zeigen deutlich die zahnmedizini-sche Überlegenheit des Fluorapatits gegenüber dem Hydroxylapatit.

1038 E.-D. Franz • Fluorapatit Ca5F(P04)3
Es erhebt sich nun die Frage, inwieweit synthe-tischer Fluorapatit als dentalkeramischer Werkstoff Verwendung finden könnte. Als Grundlage zur Er-örterung dieser Frage soll in der vorliegenden Arbeit das gesamte System CaF2-Ca3(P04)2 überarbeitet werden, in dem der Fluorapatit CasF(P04)3 durch Reaktion zwischen CaF2 und Ca3(P04)2 im Mol Ver-hältnis CaF2 • 3Ca3(P04)2 bei 1660 °C als diskrete Verbindung entsteht. Präparation
Als Ausgangsmaterial wurde synthetisches CaF2 verwendet sowie tertiäres Calciumphosphat Ca3(P04)2. Kommerzielles tertiäres Calciumphos-phat besteht aus schlecht kristallisiertem Hydroxyl-apatit, der nach Erhitzen auf ungefähr 1000 °C in /9-Ca3(P04)2 übergeht [8]. Um alle Schmelzreaktio-nen innerhalb des Systems zu erfassen, wurde das gesamte System CaF2-Ca3(P04)2 in 10 Gewichts-prozentschritten durchsynthetisiert. Die im ent-sprechenden Mengenverhältnis eingewogenen Aus-gangssubstanzen wurden im Platintiegel beziehungs-weise in Korundtiegeln zusammengeschmolzen und langsam wieder abgekühlt. Die Bestimmung der Schmelzprodukte erfolgte röntgenographisch und durch optische Untersuchungen an Dünnschliffen. Die Synthese von reinem Fluorapatit erfolgte bei 1660 °C nach der Gleichung:
3 Ca3(P04)2 + CaF2 2 Ca5F(P04)3.
Das System CaF2-Ca3(P04)2
Das System CaF2-Ca3(P04)2 stellt ein binäres System dar mit Verbindungsbildung, dem Fluor-apatit Ca5F(P04)3- Das Diagramm zeichnet sich durch zwei eutektische Punkte aus sowie ein Maxi-mum in der Schmelzkurve, dem Schmelzpunkt des Fluorapatits. Nacken [9], der das System teilweise synthetisierte, gibt den Schmelzpunkt für CaF2 mit 1392 °C an. In neuer Literatur [10] werden 1400 °C genannt. Der Schmelzpunkt des Fluorapatits liegt bei 1660 °C [11]. Diese Werte wurden übernommen. Den Schmelzpunkt des tertiären Calciumphosphats festzulegen, der in der Literatur zwischen 1720 °C [11], 1730 °C [12] und 1670 °C [13] schwankt, er-wies sich bei den Schmelzversuchen als sehr schwie-rig, da das Ca3(P04)2 bereits oberhalb 1400 °C eine äußerst aggressive Substanz zu entbinden begann. Es wird hier der Schmelzpunkt von tertiärem Cal-ciumphosphat bei 1700 ± 30 °C festgelegt.
Die Schmelzreaktionen von CaF2, Ca5F(P04)3 und Ca3(P04)2 untereinander ergeben somit das in Abb. 1 dargestellte Phasendiagramm.
Die Schmelzpunkte des CaF2 und des Ca5F(P04)3 liegen bei 1400 °C bzw. 1660 °C, der des Ca3(P04)2 bei 1700 ± 30 °C. Das Eutektikum Ei zwischen CaF2
1200
1 100 -
1000 -
O 10 20 30 *»0 50 60
C a F . G e w i c h t s p r o z e n t
70 80 90 100
Ca3(l>0;i)2
Abb. 1. Das System CaF2-Ca3(P04)2 im Temperaturbereich 900-1700 °C.

E.-D. Franz • Fluorapatit Ca5F(P04)3 1039
und Fluorapatit Ca5F(P04)3 kann auf 1210 ± 5 °C und 25 Gewichtsprozent Ca3(P04)2 festgelegt wer-den. Als besonders schwierig erwies sich die Be-stimmung des Eutektikums E2 zwischen Fluor-apatit und tertiärem Calciumphosphat. Berück-sichtigt man den Schmelzpunkt des Ca3(P04)2 mit 1700 ± 3 0 °C, so kann E2 durch Extrapolation der experimentellen Ergebnisse bei 1550 ± 30 °C und 95 Gewichtsprozent Ca3(P04)2 festgelegt werden.
Das Röntgenbeugungsdiagramm des syntheti-schen Fluorapatits entspricht exakt der ASTM -Karte 15 - 876 [14].
Diskussion und Schlußfolgerung
Der Fluorapatit bietet gegenüber dem Hydroxyl-apatit aus zahnmedizinischer Sicht Vorteile, die eingangs in den Punkten 1 und 2 zusammengefaßt wurden. Die Synthese des Fluorapatits bereitet nach dem oben genannten Verfahren keinen außerge-wöhnlichen experimentellen Aufwand. Die Frage, ob synthetischer Fluorapatit als dentalkeramischer Werkstoff als Zement mit einem geeigneten Binder oder für eine Direktverschmelzung mit der Zahn-ruine zum Beispiel durch Laser-Bestrahlung [15] geeignet ist, kann grundsätzlich positiv beantwortet werden.
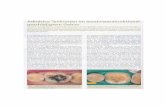
Man muß jedoch vorerst eine Einschränkung machen. Wie aus Abb. 2 zu ersehen ist, besteht syn-thetischer Fluorapatit aus kleinen Kristallnadeln, die vollkommen regellos angeordnet sind. Der Fluor -apatitregulus ist spröde und hat die Härte 5 nach Mohs. Er zeigt somit Eigenschaften eines in der un-belebten Natur entstandenen Apatits.
Abb. 3 zeigt zum Vergleich einen natürlichen hydroxylapatitischen Zahnschmelz aus einem Zahn-längsschnitt. Nach Höhling [16] sind im Zahn-schmelz submikroskopische Apatitkristalle zu grö-ßeren langgestreckten Partien zusammengefaßt, die ihrerseits miteinander verflochten sind. Diese Ver-flechtung, die ungefähr in der Bildmitte von Abb. 3 gut zum Ausdruck kommt, gibt dem an sich spröden Apatit im Zahnschmelz die gewünschte mechani-sche Härte und Elastizität.
Nachdem nun die Synthese fluorapatitischen Materials keine außergewöhnlichen experimentellen Schwierigkeiten bereitet, müßte somit der nächste Schritt sein, durch Verbesserung der Textur der Fluorapatitkristalle im dentalkeramischen Apatit-werkstoff die mechanischen Eigenschaften noch zu steigern. Vielleicht ist diese Schwierigkeit der Grund, weswegen Apatit, der als körpereigene Substanz be-zeichnet werden kann, bislang in der Zahnmedizin
\ßr <• *
• <» <k • '7 \ X . i l V i / ' "» > •.«'
. • - \ti . f
•s > ?
' ' ^ r ^ v ^ - • v . : - . . v, r*
v > ¥ .>. \ ' . « \ . \ f* ^ • N • •
Abb. 2. Synthetischer Fluorapatit ( + Nic., Vergr. 30 X ).

1040 E.-D. Franz • Fluorapatit Ca5F(P04)3
Abb. 3. Verflochtene Hydroxylapatit-Kristallaggregate in einem Zahnlängsschnitt (-j-Nic., Vergr. 30 x ).
durch körperfremde Werkstoffe ersetzt werden mußte.
Es besteht aber durchaus die Möglichkeit, daß synthetischer Fluorapatit - entsprechend den Über-legungen im Punkt 2 der Einleitung - sich durch Umkristallisation in der Mundhöhle dem natür-lichen Baumotiv der verbliebenen Zahnhartsub-stanz angleicht und somit zu den günstigen chemi-
schen Eigenschaften auch die gewünschten mecha-nischen Eigenschaften bekommt.
Unserem Präparator, Herrn Wilhelm, möchte ich für die Anfertigung des Dünnschliffmaterials dan-ken. Mein Dank gilt ebenfalls Herrn Dipl.-Min. R . Teile für die Mithilfe bei den Syntheseversuchen sowie Herrn Dr. med. dent. W. Diehl für die Über-lassung von Zahnmaterial.
[1] Gr. V. Black, Dent. Cos. 58, 129 (1916). [2] H. V. Churchill, Ind. Eng. Chem. 23, 996 (1931). [3] H. T. Dean, Pub. Health Rep. 48, 703 (1933). [4] H. T. Dean, F. A. Arnold und E. Elvove, Pub.
Health Rep. 57, 1155 (1942). [5] World Healthy Organisation Monograph Series
No. 59, 364 Seiten, Genf 1970. [6] R. Naujoks, Münchener Medizinische Wochen-
schrift 49, 1633 (1978). [7] H. Newesely, Dtsch. Zahnärztl. Zschr. 22. 1483
(1967). [8] H. C. Hodge, M. L. Lefevre und W. F. Bale, Ind.
Eng. Chem. 10, 156 (1938). [9] R. Nacken, Zentr. Mineral. Geol. 1912, 545.
[10] A. F. Holleman und E. Wiberg, Lehrbuch der
anorganischen Chemie, Walter De Gruyter & Co., Berlin 1960.
[11] J. P. Wyllie, J. Am. Ceram. Soc. 50, 43 (1967). [12] J. D'Ans und E. Lax, Taschenbuch für Chemiker
und Physiker, Bd. I, Springer-Verlag, Berlin-Heidelberg-New York 1967.
[13] R. C. Weast, Handbook of Chemistry and Physics, 61st Ed. CRC Press, Boca Raton, Florida 1980-1981.
[14] J. H. De Groot, Natl. Bur. Stds. (U. S.) Mono. 25, Sec. 322, 22 (1964).
[15] J. Vahl, Habilitationsschrift Univ. Münster, 91 Seiten, 1970.
[16] H. J. Höhling, Habilitationsschrift Univ. Mün-ster, 127 Seiten, 1966.