INAUGURAL-DISSERTATION - elib.tiho-hannover.de · Gerade die IVP humaner Blastozysten und der...
Transcript of INAUGURAL-DISSERTATION - elib.tiho-hannover.de · Gerade die IVP humaner Blastozysten und der...
Aus dem Institut für Reproduktionsmedizin
der Tierärztlichen Hochschule Hannover
Charakterisierung der porcinen Zona pellucida
und ihrer Veränderungen während der In-vitro-Maturation
INAUGURAL-DISSERTATION
Zur Erlangung des Grades einer Doktorin
der Veterinärmedizin
(Dr. med. vet.)
durch die Tierärztliche Hochschule Hannover
Vorgelegt von
Silja Ebeling
aus Hannover
Hannover 2002
Wissenschaftliche Betreuung:
Univ.-Prof. Dr. rer. nat. Dr. med. habil. Edda Töpfer-Petersen
1. Gutachter/in: Univ.-Prof. Dr. rer. nat. Dr. med. habil. Edda Töpfer-Petersen 2. Gutachter/in: Univ.-Prof. Dr. rer. nat. Bernd Otto Tag der mündlichen Prüfung: 04. Juni 2002
You hold a candle in your heart You shine the light on hidden parts You make the whole world wanna dance You‘ve bought yourself a secound chance
(Garbage, beautifulgarbage)
Inhaltsverzeichnis
Inhaltsverzeichnis
ABKÜRZUNGSVERZEICHNIS······························································································ 7
A EINLEITUNG······················································································································ 11
B LITERATURÜBERSICHT································································································· 14
1. Vorbemerkungen·········································································································· 14
2. Das Spermium·············································································································· 17
2.1. Aufbau und Entwicklung···································································································17
2.2. Epididymale Reifung und Einfluss des Seminalplasmas·················································· 19
2.3. Spermienveränderungen im weiblichen Genitale····························································· 20
3. Die Oozyte····················································································································22
3.1. Entwicklung und Aufbau···································································································22
3.2. Maturation der Oozyte in vivo···························································································24
4. Gameteninteraktion······································································································ 26
5. Die Zona pellucida······································································································· 28
5.1. Aufbau und Entwicklung···································································································29
5.2. Oligosaccharidstrukturen···································································································31
5.3. Spermien-Zona pellucida-Interaktionen············································································37
5.4. Die Zona pellucida nach der Befruchtung·········································································41
5.5. Antikörper gegen Zona pellucida als Immunokontrazeptiva············································ 43
C MATERIAL UND METHODEN························································································ 44
1. Isolierung der Zona pellucida················································································· 44
1.1. Massenaufarbeitung···········································································································44
1.2. Gewinnung von Zonae pellucidae aus frischen Ovarien···················································45
1.3. In-vitro-Maturation der Oozyten······················································································· 47
1.4. Überprüfung des Kernreifungsstatus·················································································47
2. Elektrophoretische Auftrennungen·········································································48
2.1. Eindimensionale SDS-Polyacrylamid-Gelelektrophorese der ZP·····································48
2.2. Zweidimensionale SDS-Polyacrylamid-Gelelektrophorese der ZP·································· 50
3. Immuno- und lektinologische Analyse der ZP Glykoproteine am Proteinblot·············································································································· 52
3.1. Chemilumineszenzverfahren····························································································· 52
3.2. Immunologische Identifizierung der Glykoproteine der ZP··············································54
3.3. Lektinologische Analyse der Kohlenhydratstrukturen der ZP·········································· 55
Inhaltsverzeichnis_____________________________________________________________
4. Rasterelektronenmikroskopie················································································· 57
5. Funktioneller Vergleich von ZP ungereifter und in vitro gereifter Oozyten··········58
5.1. Aufbereitung der Spermien································································································58
5.2. Spermatologische Untersuchungen····················································································59
5.3. Induktion der Akrosomreaktion durch die Zona pellucida················································61
5.4. Statistische Auswertung·····································································································62
D ERGEBNISSE····················································································································· 64
1. Gewinnung der Oozyten und Isolierung der Zonae pellucidae······························ 64
2. SDS-Gelelektrophorese·························································································· 65
2.1. 1D-PAGE der Glykoproteine der Zona pellucida······························································65
2.2. 2D-PAGE der Glykoproteine der Zona pellucida······························································67
3. Immunologische Charakterisierung der ZP Proteine············································· 69
4. Lektinologische Analyse der Kohlenhydratstrukturen der ZP······························· 71
5. Rasterelektronenmikroskopische Studien······························································ 78
6. Die Fähigkeit der ZP zur Induktion der Akrosomreaktion in Abhängigkeit vom Reifungsstatus der Oozyte ····················································································· 80
E DISKUSSION······················································································································ 92
1. Verhalten der porcinen ZP in der PAGE································································ 92
2. Charakterisierung der ZP durch Antikörper und Lektine·······································96
3. Ultrastrukturelle Untersuchung der ZP································································ 102
4. Funktioneller Vergleich von ungereifter und gereifter ZP··································· 104
5. Unterschiede zwischen der ZP von in vitro und in vivo gereiften Oozyten········ 108
6. Abschlussbetrachtung und Ausblick···································································· 109
F ZUSAMMENFASSUNG··································································································· 111
G SUMMARY······················································································································· 113
H LITERATURVERZEICHNIS··························································································· 115
J ANHANG···························································································································· 136
1. Rezeptverzeichnis·································································································136
2. Tabellen zur Auswertung der funktionellen Bindungstests··································139
3. Multifaktorielle Varianzanalyse··········································································· 142
K DANKSAGUNG················································································································144
Abkürzungsverzeichnis
Abkürzungsverzeichnis
Abb. Abbildung aggl. agglutinin (Lektin) AK Antikörper APS Ammoniumpersulfat AQN Protein der porcinen Spermadhäsine; A, Q und N stehen für die ersten drei Aminosäuren des N-Terminus Aqua bidest. Aqua bidestillata Asn203 Asparagin an der 203. Stelle ATP Adenosintriphosphat AWN Protein der porcinen Spermadhäsine; A, W und N stehen für die ersten drei Aminosäuren des N-Terminus BSA Bovine Serum Albumin (Rinderserumalbumin) bZP bovine Zona pellucida bzw. beziehungsweise °C Grad Celcius ca. circa Ca2+ Kalziumionen cAMP cyclic adenosin monophosphate cm Zentimeter CO2 Kohlenstoffdioxid conj. conjugiert Da Dalton db-cAMP dibutyryl-cAMP DNA desoxyribonucleotide acid, Desoxyribonukleinsäure 1D-Membran PVDF-Membran mit transferierten Proteinen nach 1D-PAGE 2D-Membran PVDF-Membran mit transferierten Proteinen nach 2D-PAGE 1D-PAGE eindimensionale Polyacrylamidgelelektrophorese 2D-PAGE zweidimensionale Polyacrylamidgelektrophorese DTT Dithiothreitol EM Elektronenmikroskop et al. et alii (und andere) etc. et cetera (und so weiter) evtl. eventuell g Gramm FITC Fluoreszeinisothiocyanat GalTase Galaktosyltransferase GmbH Gesellschaft mit beschränkter Haftung GV Germinalvesicle GVBD Germinalvesicle Breakdown h hour (Stunde) hCG human Chorionic Gonadotropin Hepes N-(2-hydroxyethyl)piperazin-N’-2-ethan
Abkürzungsverzeichnis________________________________________________________
HPLC High Pressure Liquid Chromatography HRPO horse radish peroxidase (Meerrettichperoxidase) hZP humane Zona pellucida ICSI intrazytoplasmatische Spermieninjektion IP isoelektrischer Punkt IPG immobilisierter pH-Gradient IVF In-vitro-Fertilisation IVM In-vitro-Maturation IVP In-vitro-Produktion kDa Kilodalton kg Kilogramm KOK Kumulus-Oozyten-Komplex l Liter LM Lichtmikroskop LMW Low Molecular Weight LPC Lyso-Phosphatidylcholin M Molar M II Metaphase II mA/cm2 Milliampere pro Quadratzentimeter mg Milligramm min Minute ml Milliliter mM Millimolar mm Millimeter mmHg Millimeter Quecksilbersäule mod. modifiziert mZP murine Zona pellucida NaCl Natriumchlorid NCSU North-Carolina-State-University neg. negativ ng Nanogramm N-Glykan/glykosidisch Protein mit Zuckerkette, welche über eine NH2-Gruppe einer
Aminosäure mit diesem verknüpft ist NH2-Gruppe Aminogruppe nm Nanometer Nr. Nummer OD Optische Dichte OH-Gruppe Hydroxylgruppe O-Glykan/glykosidisch Protein mit Zuckerkette, welche über eine OH-Gruppe einer
Aminosäure mit diesem verknüpft ist p Probabilität, Irrtumswahrscheinlichkeit PAGE Polyacrylamidgelelektrophorese PBS Phosphat-Buffered-Saline (Phosphatgepufferte Kochsalzlösung) pH pondus Hydrogenii, Wasserstoffionenkonzentration PI Propidiumjodid pI pH-Wert am isoelektrischen Punkt PMSG Pregnant Mare’s Serum Gonotropin
Abkürzungsverzeichnis
pos. positiv PSP porcine Seminalplasmaproteine PVA Polyvinylalkohol PVDF Polyvinylidene Difluoride PVM perivitelline Matrix pZP porcine Zona pellucida REM Rasterelektronenmikroskop s. siehe SDS Sodium-Dodecyl-Sulfate Standardabw. Standardabweichung sec Sekunde SUZI subzonale Insemination Tab. Tabelle TBS Tris-Buffered-Saline (Trisgepufferte Kochsalzlösung) TEMED N,N,N’N’-Tetramethylethylendiamin TG-Sperma Tiefgefriersperma Tris Tris(hydroxymethyl)-aminomethan u. und u.a. unter anderem µg Mikrogramm µl Mikroliter µm Mikrometer V Volt vgl. vergleiche v/v volume/volume (Volumen/Volumen) vWW van der Waal’sche Wechselwirkungen w/v weight/volume (Gewicht/Volumen) xg x-fache der Erdbeschleunigung z.B. zum Beispiel ZBP Zona pellucida bindende Proteine ZP Zona pellucida Einbuchstaben- und Dreibuchstabencode der angesprochenen Aminosäuren A Ala Alanin P Pro Prolin C Cys Cystein Q Gln Glutamin D Asp Asparaginsäure R Arg Arginin E Glu Glutaminsäure S Ser Serin G Gly Glycin T Thr Threonin I Ile Isoleucin V Val Valin K Lys Lysin W Trp Tryptophan L Leu Leucin Y Tyr Tyrosin N Asn Asparagin
Abkürzungsverzeichnis________________________________________________________
Erläuterungen zu den Zuckerstrukturen Fuc Fukose
Gal Galaktose
GalNAc N-Acetylgalaktosamin
Glc Glukose
GlcNAc N-Acetylglukosamin
Man Mannose
Neu Neuramin- oder Sialsäure
NeuNAc, NANA N-Acetylneuramin- oder N-Acetylsialsäure
Manα Mannose in α-Stellung verknüpft (gilt auch für andere Zucker)
Manβ Mannose in β-Stellung verknüpft (gilt auch für andere Zucker)
(1-4) zwei Monozucker sind über ihre Kohlenstoffatome C1 und C4
verknüpft, gilt auch für andere Zahlenkombinationen
Lektine AAA Anguilla anguilla agglutinin
ACA Amaranthus caudatus agglutinin
Con A Concanavalin A agglutinin
DSA Datura stramonium agglutinin
ECA Erythrina cristagalli agglutinin
GS I Griffonia simplicifolia agglutinin I
Jacalin Artocarpus integrifolia agglutinin
MAA II Maackia amurensis agglutinin II
PNA Peanut agglutinin
RCA I Ricinus communis agglutinin I
SNA Sambucus nigra agglutinin
Die Begriffe Spermium und Spermatozoon werden synonym verwendet,
ebenso die Bezeichnungen Eizelle und Oozyte.
A Einleitung
11
A Einleitung
Im Laufe der letzten Jahre haben die assistierenden und In-vitro-Produktionstechniken (IVP)
im Bereich der Fortpflanzung immer mehr an Bedeutung gewonnen. Gerade die IVP humaner
Blastozysten und der kommerzielle Transfer boviner mittels IVF (In-vitro-Fertilisation)
erzeugten Blastoysten (BOUSQUET et al. 1999) werden schon routinemäßig angewendet.
Beim Schwein hingegen sind die Methoden auf Laborebene gut entwickelt (PRATHER u.
DAY 1998), aber zur Zeit nicht als praxisrelevant zu betrachten.
Als Ursachen der geringen Befruchtungsraten der IPV sind u.a. Polyspermie und übermäßiges
Zona hardening zu nennen. Ein weiterer Aspekt ist die In-vitro-Reifung der Eizellen im
Vorfeld der eigentlichen IVF. Die Oozyte wird als gereift angesprochen, wenn sie sich im
überprüfbaren Kernstatus der Metaphase II befindet. Von der Kernreifung sind jedoch noch
die zytoplasmatische Reifung und die Reifungsprozesse an der Zona pellucida abzugrenzen.
Die beiden zuletzt genannten Veränderungen sind schwerer zu erfassen, scheinen aber eine
funktionelle Bedeutung zu besitzen. Um Ansatzpunkte für Verbesserungen der
Fertilisationsraten der IPV zu erreichen, bietet sich eine genauere Untersuchung der die
Oozyte umgebenden Zona pellucida (ZP) an.
Die erste Kontaktaufnahme zwischen Spermium und Eizelle, Bindung und
Gametenerkennung finden an der ZP statt. Sie induziert die Akrosomreaktion der
kapazitierten Spermien und ist am Polyspermieblock beteiligt. Die Polyspermie ist ein
Problem der IVP, welches als insuffizienter Zonablock zwischen Spermium und Oozyte
anzusehen ist (KOUBA et al. 2000). Weiterhin schützt die ZP die Eizelle und die Blastocyste
vor äußeren Einflüssen.
Aufgrund der Bedeutung der ZP für die Befruchtung wurden Hemizonabindungsassays
(BURKMAN et al. 1988) etabliert, um die Qualität und Eignung von Spermien für bestimmte
Oozyten testen zu können.
Ein weiteres Forschungsgebiet ist die Entwicklung von immunologischen Kontrazeptiva
(KIRKPATRICK et al. 1996), die gegen bestimmte Antigene der ZP gerichtet sind.
A Einleitung_________________________________________________________________
12
Die Bindung und Signalübertragung des Spermatozoons an die ZP wird über
oberflächenassozierte Proteine der Spermien und die Zuckerseitenketten der ZP vermittelt.
Bei der Maus sind die Strukturen weitestgehend aufgeklärt, bei den höheren Säugetieren
jedoch noch nicht. Die fehlende Schichtung in der räumlichen Struktur (TALBOT u. DI
CARLANTONIO 1984) und die alleinige Synthese der ZP durch die Eizelle bei der murinen
ZP (BLEIL u. WASSARMAN 1980b) stehen den Variationen in der morphologischen
Architektur (VANROOSE et al. 2000) und der zusätzlichen Beteiligung von Granulosazellen
(SINOWATZ et al. 2001) an der ZP Synthese bei höheren Säugern gegenüber. Dies spricht
für auch genauso große Unterschiede in der Kohlenhydratstruktur und der dreidimensionalen
Architektur der Zona pellucida.
Gerade das Schwein eignet sich gut als Modelltier für biochemische Analysen, da über das
Schlachthofmaterial relativ große Mengen von Eizellen zur Verfügung stehen und homologe
Gensequenzen (HARRIS et al. 1994) mit denen der ZP z.B. von Rind und Mensch
nachgewiesen worden sind. Viele Strukturen wurden bereits über die Lektinhistochemie und
durch Hochdruckflüssigkeitschromatographie mit anschließender Aminosäuren- und
Zuckeranalyse untersucht.
Nur bei der Maus ist ebenfalls schon aufgeklärt, wie die drei Glykoproteine der ZP strukturell
zu einander angeordnet (WASSARMAN u. MORTILLO 1991) und welches ihre einzelnen
Aufgaben sind (WASSARMAN 1988). Bei den höheren Haussäugetieren und beim
Menschen stehen genauere Erkenntnisse, beispielsweise welches ZP Protein nun für welche
Bindung an das Spermium verantwortlich ist, noch aus.
A Einleitung
13
In der vorliegenden Arbeit sollten nun mögliche Veränderungen der Zona pellucida während
der In-vitro-Maturation näher untersucht werden. Um Veränderungen aufzeigen zu können,
mussten zunächst Charakterisierungen der ZP ungereifter Oozyten vorgenommen werden.
Dazu wurden die Proteine durch eine zweidimensionale SDS-Polyacrylamid-
Gelelektrophorese nach isoelektrischen Punkt und relativen Molekulargewicht aufgetrennt.
Nach Transfer auf PVDF-Membranen erfolgte eine Analyse der Kohlenhydratstrukturen.
Diese wurde mit Lektinen durchgeführt, die an definierte Zuckerstrukturen binden. Mittels
Antikörpern wurden die einzelnen Glykoproteine der ZP charakterisiert. Im Anschluss an die
lektinologischen und immunologischen Untersuchungen der ZP Glykoproteine von
ungereiften Eizellen sollten sich entsprechende Analysen von Glykoproteinen der ZP in vitro
gereifter Eizellen anschließen. So ist es möglich, Umstrukturierungen bezüglich des
isoelektrischen Verhaltens und/oder der Kohlenhydratstrukturen der ZP während der In-vitro-
Reifung auf die Spur zu kommen.
Neben der biochemischen Untersuchung sollten auch Analysen zur Verteilung der
exponierten Kohlenhydrate über die die Oberfläche der ZP angefertigt werden. Dies geschah
mittels rasterelektronenmikroskopischen Aufnahmen der ZP von intakten Eizellen, nachdem
diese mit goldgekoppelten Lektinen und einer Silverenhancement-Technik behandelt worden
waren.
Damit die funktionelle Bedeutung eventueller Veränderungen gezeigt werden kann, sollte
zum Abschluss ein Spermatozoen-Zona pellucida-Bindungstest folgen. Als Untersuchungs-
parameter wurde die Fähigkeit der Zona pellucida zur Induktion der Akrosomreaktion von
kapazitierten Spermien gewählt. Ein diesbezüglicher Vergleich von ungereifter und gereifter
ZP sollte nähere Erkenntnisse über die Modifikationen der Zona pellucida während der
Reifung liefern.
Diese Untersuchungen sollten einen Beitrag leisten zur biochemischen, morphologischen und
funktionellen Charakterisierung der ZP und ihrer Reifungsprozesse, um so ein besseres
Verständnis der physiologischen Befruchtungsvorgänge und Ansätze zur weiteren Forschung
zwecks Optimierung von Biotechniken zu ermöglichen.
B Literaturübersicht___________________________________________________________
14
B Literaturübersicht
1. Vorbemerkungen Um eine erfolgreiche Befruchtung zu gewährleisten, müssen beide Gameten
Entwicklungsprozesse und Aktivierungsstufen durchlaufen. Die Spermatozoen unterliegen
nach ihrer Bildung im Hoden bestimmten Reifungsvorgängen und einer Versetzung in einen
Ruhezustand der eigentlich schon befruchtungskompetenten Spermien durch das
Nebenhodensekret und das Seminalplasma. Nach der Ejakulation werden sie im weiblichen
Genitaltrakt durch Barrieren selektiert und durch Sequenzen von Aktivierungsstufen
reaktiviert. Erst kapazitierte Spermien sind in der Lage, eine Eizelle zu befruchten.
Die Eizelle ihrerseits muss durch die Wiederaufnahme der Meiose nach Arretierung in der
Prophase I im Sexualzyklus das fertile Stadium der Metaphase II erreichen. Neben dieser
Kernreifung laufen auch Maturationsveränderungen an der Zona pellucida, den Zellorganellen
und dem Zytoplasma ab (PRATHER u. DAY 1998). Diese sind sehr schwer zu definieren und
noch nicht sehr weit erforscht.
Diese physiologischen Konditionierungen müssen nun entsprechend der jeweiligen
künstlichen Manipulationen auf dem Weg zu einer befruchteten Eizelle berücksichtigt
werden. Bei der künstlichen Insemination ist also ein Verdünnungsmedium und eventuelle
Lagerungsbedingungen für das Ejakulat so zu wählen, dass die Spermien zwar ernährt
werden, aber keine übermäßige Aktivierung mit Energieverlusten entsteht. Weiterhin ist es
von Bedeutung, dass durch die Verdünnungsmedien keine größeren Veränderungen des
weiblichen Genitalsekretes hervorgerufen werden, sei es durch Milieuveränderungen oder
übermäßige Induktion von Entzündungsreaktionen auf Fremdantigene. Eine zentrale Rolle bei
der Samenkonservierung spielt die Erhaltung der Membranintegrität. Bei größeren Schäden
stirbt die Zelle ab, aber auch kleine Veränderungen können für die Kontaktaufnahme mit dem
Eileiterepithel und der Eizelle erhebliche Einschränkungen mit sich bringen. Dies kommt
gerade bei der Verwendung von Tiefgefriersperma zum Tragen. So wurden spezielle
Einfriermedien und Programme entwickelt, um einen bestmöglichen Schutz der
Plasmamembran zu gewährleisten. Bei aktuellen Forschungen zum Einsatz von
B Literaturübersicht
15
flowzytometrisch gesexten Spermien hat sich die Bedeutung der Zusammensetzung der
Plasmamembran gezeigt, da durch Anlegen eines elektrischen Feldes die Membranstrukturen
der Spermatozoen so verändert werden, dass eine Erkennung durch die Oozyte und die
Auslösung erforderlicher Mechanismen zur Induktion des Zonablocks kaum noch stattfinden
(RATH et al. 1999).
Der Einsatz von Frischsamen in der künstlichen Besamung ist inzwischen bei
Warmblutpferden und Schweinen zur Routine geworden. Gleiches gilt für Tiefgefriersamen in
der Rinderzucht.
Bei Befruchtung außerhalb des weiblichen Genitaltraktes, also in vitro, muss neben der
Spermaaufbereitung noch die Vorbereitung der Eizelle berücksichtigt werden. Für den
Kontakt mit den Spermien müssen die Oozyten gereift sein und sich im Metaphase II
Kernstatus befinden. Dies ist zum einen durch eine Superovulation beim weiblichen Spender
durch Hormoneinsatz und anschließender operativer Gewinnung von Eizellen aus
sprungreifen Follikeln zu erzielen. Eine andere Möglichkeit ist, unreife Eizellen, sei es mittels
invasiver Methoden oder einer Gewinnung nach der Schlachtung, in vitro zu reifen (In-vitro-
Maturation, IVM).
Bei der In-vitro-Produktion (IVP) stehen nun verschiedene Verfahrensweisen zur Verfügung.
Für die In-vitro-Fertilisation (IVF) müssen die Spermien in künstlichen Medien kapzitiert
werden und es folgt eine Koinkubation mit der gereiften Eizelle. Weiterhin gibt es
mikroassistierte Fertilisationstechniken wie die Zona-Öffnung (Zona drilling), die subzonale
Injektion (SUZI) von Spermien und die intrazytoplasmatische Injektion (ICSI) (CATT 1996).
Die Verfahren wurden an Labortieren erprobt, dann in der Humanmedizin zur Therapie bei
andrologischer Sub- und Infertilität eingesetzt und anschließend auf die Haussäugetiere
übertragen (IRITANI 1991). Bei den Nutztieren steht weniger eine therapeutische Absicht im
Vordergrund, vielmehr spielen züchterische und genetische Einsatzmöglichkeiten, wie z.B.
die Anwendung von gesextem Sperma (RATH et al. 1996), eine Rolle. Auch für die
Arterhaltung, wenn nur wenige Tiere mit schlechter Samenqualität zur Verfügung stehen,
kommt ICSI zum Einsatz (z.B. Katzen: POPPE et al. 1997).
Für das Zona drilling und SUZI sind Grenzen gesetzt, weil für diese Verfahren die
Spermienpopulation nur begrenzt Schädigungen aufweisen darf. Bevor die Spermien
erfolgreich in Kontakt mit der Eizelle gebracht werden können, müssen sie erst kapazitiert
B Literaturübersicht___________________________________________________________
16
und akrosomreagiert vorliegen. Eine künstliche Auslösung dieser beiden Prozesse ist jedoch
bei intakten Spermien möglich. Bei ICSI müssen die Spermien weder kapazitiert noch
akrosomreagiert sein (PAYNE 1995), da durch die Injektion eines einzelnen Spermiums die
natürliche Penetration umgangen wird und ein Signal an die Zona pellucida für den
Polyspermieblock nicht von Nöten ist. Der Erfolg von ICSI in der Humanmedizin zeigt sich
daran, dass laut der Ergebnisse der Datenerhebung des Deutschen IVF-Registers 1996 die
ICSI-Behandlungen (16.233) die Anzahl der IVF-Behandlungen (14.494) überschritten hatten
(FELBERBAUM u. DAHNKE 1997).
Wie dieser Überblick zeigt, sind die Nachahmungen oder Umgehungen der physiologischen
Reifungsvorgänge sowohl für Spermien als auch für Oocyten für die Fertilisation essentiell.
Es kann zwar durch sehr spezielle Techniken (ICSI) Kapazitation und Akrosomreaktion
umgangen werden, jedoch eine gereifte Eizelle bleibt Grundvoraussetzung. Daher sind die
Veränderungen der Eizelle während der IVM Gegenstand der vorliegenden Arbeit. Die Zona
pellucida, als erste Kontaktstelle zwischen Oocyte und Spermium, stellt dabei das
Untersuchungsobjekt dar.
Im folgenden werden nun die angesprochenen Entwicklungsprozesse von Spermium und
Oocyte näher erläutert. Es folgen detailliertere Angaben zur Zona pellucida.
B Literaturübersicht
17
2. Das Spermium
2.1. Aufbau und Entwicklung
Das Spermatozoon setzt sich aus Kopf, Hals und Schwanz, welcher in Mittel-, Haupt- und
Endstück unterteilt wird, zusammen (SETCHEL 1982). Die Gesamtlänge des Spermiums
beträgt 50 bis 70 µm. Der Spermienkopf wird fast vollständig vom Zellkern eingenommen,
welcher das Erbmaterial in Form von hochgradig kondensiertem Chromatin enthält (MONESI
1976). Der Zellkern wird von einer inneren und äußeren Kernmembran umgeben, an die sich
in den vorderen zwei Dritteln die Kopfkappe, das Akrosom, anschließt. Die akrosomale
Matrix wird ebenfalls durch eine innere und äußere Membran begrenzt (EDDY u. O’BRIAN
1994). Das Akrosom entsteht aus Vesikeln des Golgikomplexes und enthält hydrolytische
Enzyme u.a. Hyaluronidase, Neuraminidase und Akrosin, welche die Penetration der ZP
ermöglichen (YANAGIMACHI 1994).
Im Spermienhals, ein bewegliches Gelenkstück zwischen Kopf und Schwanz, befinden sich
das proximale Zentriol und der Rest des distalen. Das proximale Zentriol wird nach der
Befruchtung für die erste Zellteilung benötigt, da der Eizelle ein eigenes Zentriol fehlt. Der
Schwanz besitzt eine für Geißeln typisches Mikrotubulussystem mit einer 9+2
Fibrillenstruktur. Im Mittelstück wird in den Mitochondrien die Menge ATP produziert, die
für die Beweglichkeit von Nöten ist, so dass Geschwindigkeiten bis 4 mm/min erreicht
werden können (SAYONSKI u. SMOLLICH 1990).
Bei einem ausgereiften Spermium ist die Plasmamembran, welche das ganze Spermatozoon
umhüllt, für die Kontaktaufnahme der Zelle mit ihrer Umwelt verantwortlich. Sie besteht aus
einer Phospholipiddoppelschicht, in der verschiedene Proteine eingebaut sind. Die die
Membran völlig durchziehenden Tunnelproteine bilden Poren und Kanäle. Des Weiteren
existieren wasserunlösliche integrale Proteine, die nur in einer Lipidschicht eingelagert sind,
und lösliche Proteine, die sich peripher an der Membranaußenfläche befinden (ALBERTS et
al. 1990).
Während der Reifung im Nebenhoden, der Ejakulation, den Kapazitationsvorgängen und der
Akrosomreaktion finden zahlreiche Umbauvorgänge an der Plasmamembran des
Spermatozoons statt, die für die jeweiligen Funktionen eine Grundvoraussetzung darstellen
B Literaturübersicht___________________________________________________________
18
(TÖPFER-PETERSEN et al. 1996). An der Plasmamembran gibt es verschiedene Areale, die
sich entsprechend ihrer Aufgabe spezifisch zusammensetzen (GADELLA et al. 1994). Das
Apikalsegment der Kopfkappe ist an der Akrosomreaktion beteiligt, daher haben einige über
der akrosomalen Region liegende Glykoproteine die Aufgabe, die Plasmamembran zu
stabilisieren und so eine vorzeitige Akrosomreaktion zu verhindern.
Andere Proteine sind für die Interaktionen zwischen Spermium und Zona pellucida bzw.
Eizelle zuständig. So fusionieren während der Akrosomreaktion nur der apikale und
periakrosomale Teil der Plasmamembran mit der äußeren akrosomalen Membran. Im
Gegensatz dazu leitet die Plasmamembran über dem Äquatorialsegment die Fusion des
Spermiums mit der Zellmembran der Eizelle ein (DRIESCH et al. 1991). Mit der
Plasmamembran des Schwanzes scheinen Moleküle in Verbindung zu stehen, die an der
Bewegungsaktivität beteiligt sind. Eine verfrühte Hyperaktivierung könnte so durch die
Absorption und Integration von bestimmten Glykoproteinen vermieden werden.
Die Reifung der diploiden Stammzellen im Hoden zu morphologisch ausdifferenzierten
haploiden Spermatozoen bezeichnet man als Spermatogenese. Im Gegensatz zur Oogenese,
die bereits in der Embryonalphase ihre Anfänge hat, beginnt die Spermatogenese erst mit der
Geschlechtsreife und dauert beim Eber ca. 34 Tage (SCHNORR 1989).
Die Spermatogenese besteht aus drei Phasen:
1. die mitotischen Teilungen und Differenzierungen der diploiden Spermatogonien ,
2. die meiotischen Reifeteilungen der tetraploiden Spermatozyten und
3. die Entwicklung der haploiden Spermatiden zu Spermatozoen (Spermiogenese).
Die wesentlichen Schritte der Spermiogenese, die weitreichende morphologische und
funktionelle Umbauprozesse mit sich bringt, sind die Fusion der Golgi-Vesikel zur
Akrosomvakuole und Bildung des Akrosoms, die Kondensation des Chromatins und die
damit verbundene speziesspezifische Formung des Spermienkopfes und die Entwicklung der
Geißel (WUTTKE 1990). Gegen Ende der Reifungsphase wird das überschüssige Zytoplasma
abgeschnürt und von Sertolizellen im Hoden phagozytiert. Erst im Nebenhoden wird der
kleine Teil, der als Zytoplasmatröpfchen in der Halsregion bestehen bleibt, abgebaut.
B Literaturübersicht
19
2.2. Epididymale Reifung und Einfluss des Seminalplasmas
Im männlichem Geschlechtstrakt schließt sich an die Spermatogenese im Hoden die
posttestikuläre Spermienreifung bzw. –modifikation an, da die Spermien trotz
abgeschlossener morphologischer Entwicklung noch nicht befruchtungsfähig sind. Die
Spermien erlangen während ihrer Passage durch den Nebenhoden durch den Erwerb einer
gerichtete Vorwärtsbeweglichkeit und der Fähigkeit, an die Zona pellucida zu binden, ihre
Fertilität (KIRCHHOFF u. IVELL 1995). Dies dauert beim Säuger 10-15 Tage (HAFEZ
1987), wobei die Spermatozoen je nach Spezies ihre Befruchtungskompetenz in
unterschiedlichen Nebenhodenabschnitten erreichen. Obwohl beim Eber die Spermien erst im
Nebenhodenschwanz voll befruchtungsfähig werden, können sie bereits mit ihrem im
Nebenhodenkopf erreichten Status in vitro eine Eizelle befruchten (COOPER 1996).
Die biochemischen Umbauprozesse der Spermienplasmamembran während der
Nebenhodenreifung bestehen u.a. aus Lokalisationsänderungen einiger Membranproteine,
Glykosylierung von Proteinen und Lipiden, sowie Maskierung, Entfernung und teilweiser
Einlagerung von Peptidstrukturen aus Proteinen, die im Nebenhoden sezerniert werden
(OVERSTREET 1983; DACHEUX et al. 1989). Im Nebenhoden wird auch Cholesterin
synthetisiert, dass in die Plasmamembran des Spermiums eingebaut wird (SEKI et al. 1992)
und so eine Membranstabilisierung bewirkt, die vor mechanischen Schädigungen schützt. Die
negative Ladung der Spermienoberfläche wird durch den Einbau von Sialoglykoproteinen,
Steroidsulfaten und Sulfoglycerolipiden verstärkt (TULSIANI 1993). Durch die erhöhte
Abstoßung aufgrund gleichgerichteter Ladung wird die laterale Beweglichkeit der
Makromoleküle in den Membranen reduziert und die Membran so stabilisiert. Durch den
Kontakt mit dem Seminalplasma während der Ejakulation werden die Spermien durch
bestimmte Inhaltsstoffe vor Schädigungen, Umwelteinflüssen und frühzeitiger Kapazitation
geschützt (SHIVAIJI 1990).
Das Seminalplasma setzt sich beim Eber aus Sekreten der Samenblase, der Prostata und der
Bulbourethraldrüse zusammen. Es besteht aus vielerlei Komponenten, u.a. die Peptidhormone
LH, FSH und Prolaktin, Enzyme wie Glykosidasen, Glykosyltransferasen, Phosphatasen, den
biogenen Amine Spermin und Carnitin, Proteaseinhibitoren, Monosaccharide (Fruktose und
Glukose), sowie Östrogenen und Prostaglandinen (MANN u. LUTWACK-MANN 1981).
Den Hauptanteil bilden Spermadhäsine, die vorwiegend als Dekapazitationsfaktoren wirken
B Literaturübersicht___________________________________________________________
20
(TÖPFER-PETERSEN et al. 1994). Durch die erwähnten Inhaltsstoffe wird den prinzipiell
befruchtungskompetenten Spermien ihre Befruchtungsfähigkeit vorläufig entzogen. Die
Versetzung in diesen Ruhestatus verhindert Energieverluste, verfrühte Umbauprozesse und
unspezifische Bindungen bis kurz vor Erreichen der Eizellen im weiblichen Eileiter und
vergrößert die Chance auf eine erfolgreiche Befruchtung.
2.3. Spermienveränderungen im weiblichen Genitale
Mit Eintritt in den weiblichen Genitaltrakt nach der Ejakulation müssen die Spermien
verschiedene Barrieren überwinden. Es existieren mechanische (Falten, Krypten, Cilien),
physikochemische (Vaginalsekret, Zervixmucus) und immunologische Abwehrvorgänge als
Selektionsstufen (HUNTER 1988). Bei den Scheidenbesamern (z.B. Rind, Kaninchen, Affe
und Mensch) gilt als erste Hürde der Gebärmuttermund mit dem Zervixschleim, welche die
Spermien überwinden, in dem sie durch Micellenkomplexe des Zervikalmucus in die Krypten
der Schleimhaut geleitet werden. Dort entsteht so ein erstes Spermienreservoir. Das Schwein
zählt zu den Arten (wie Pferd und Hund) mit uteriner Samenportionierung, bei denen die
Passage durch die uterotubale Verbindung die erste Barriere darstellt. Die Schleimhautfalten
in diesem Bereich, welche während des Östrus ödematisieren, verhindern den Eintritt von
Seminalplasma und Uterusekret in den Eileiter und reduzieren den Anteil der Spermien, der
bis in den Isthmus des Eileiters vordringt (HUNTER 1995). Der caudale Teil des Isthmus
stellt für beide angesprochenen Besamungstypen ein funktionelles Spermienreservoir dar, in
dem in einem bestimmten Zeitfenster die Vitalität der Spermien geschützt wird. An
Spermatozoen, die sich im Lumen befinden, laufen die Alterungsprozesse in beschleunigter
Form ab.
Wichtig für das Überleben und die Kapazitation der Spermien ist eine Bindung zwischen dem
apikalen Teil des Spermienkopfes und dem Eileiterepithel (SUAREZ et al. 1991). Dieser
Kontakt wird wahrscheinlich durch Kohlenhydrate des Oviduktepithels und
kohlenhydratbindenden Proteinen des Spermatozoons, entsprechend einer Lektin-Zucker-
Bindung, hergestellt (SUAREZ 1998). Die Tatsache, dass Kohlenhydrate diese Bindung
hemmen können (WAGNER et al. 2002), spricht für einen solch vermittelten Kontakt. Es ist
B Literaturübersicht
21
von großer Bedeutung, dass die Spermien in dem präovulatorischen Zeitraum nicht weiter den
Eileiter hinauf wandern, da sie sonst die ovulierte Eizelle nicht mehr befruchten können
(HUNTER 1995).
Für eine erfolgreiche Befruchtung müssen die Spermatozoon ihre Befruchtungsfähigkeit
wieder erlangen, in dem sie verschiedene Kapazitationsprozesse durchlaufen. Ein Spermium
gilt als kapazitiert, wenn bei seinem intakten Akrosom durch die Zona pellucida, die
Akrosomreaktion induziert werden kann (KOPF u. GERTON 1991). Die ersten Schritte der
Kapazitation bestehen aus der Entfernung der oberflächenassozierten Inhaltsstoffe aus dem
Seminalplasma von den Spermien. Dies geschieht je nach Samendeponierung in der Zervix
oder erst im Bereich der uterotubalen Verbindung (YANAGIMACHI 1994). Der Anteil der
Spermien, der eine Bindung mit dem Eileiterepithel im Bereich des caudalen Isthmus
eingehen kann, durchläuft weitere Schritte der Kapazitation. Kapazitierte Spermien weisen
eine reduzierte Bindungsfähigkeit zum Oviduktepithel auf (FAZELI et al. 1999) und
kennzeichnen sich durch sichtbare hyperaktive Geißelbewegungen, mit denen sie aktiv zum
Ort der Befruchtung, der Ampulla, gelangen (SMITH 1998).
Die biochemischen Veränderungen von Membrankomponenten und intrazellulären
Ionenkonzentrationen (BEDFORD u. HOYKINS 1990), die Hyperaktivität und Ablösung von
dem Oviduktepithel zur Folge haben, sind von einer sehr komplexen Natur. Im wesentlichen
werden die durch die Komponenten des Nebenhodensekretes und des Seminalplasmas
hervorgerufenen Veränderungen rückgängig gemacht. Hydrolasen des weiblichen
Genitalsekretes bewirken eine Entfernung von Sialsäuren und Sulfatresten aus der
Spermienplasmamembran, so dass die negative Oberflächenladung wieder abnimmt
(LANGLAIS et al. 1981). Durch diese Vorgänge und die Entfernung von Cholesterin aus der
Plasmamembran wird diese durchlässiger und es kommt zu einem zweiphasigen
Kalziumeinstrom. Der zweite, stärkere Influx ist für die Auslösung der Akrosomreaktion
verantwortlich (FRASER 1995) und der erste scheint mit der Kapazitation verbunden zu sein.
So bewirkt die Aktivierung einer Ca2+-abhängigen Adenylatzyklase über weitere
Enzymaktivierungskaskaden Tyrosinphosphorylierung. Dies konnte an einer Reihe von
Proteinen des Spermatozoons bei der Maus (VISCONTI et al. 1997), beim Eber und Bullen
(TÖPFER-PETERSEN et al. 1996) nachgewiesen werden. Weitere Forschungsergebnisse zur
genaueren Bedeutung stehen noch aus.
B Literaturübersicht___________________________________________________________
22
3. Die Oocyte
3.1. Entwicklung und Aufbau
Die Entwicklung der Eizellen beginnt schon im weiblichen Fetus mit der Einwanderung der
Urkeimzellen in die Gonadenanlagen und anschließender Differenzierung über
Primordialkeimzellen zu Oogonien. Diese vermehren sich mitotisch und werden mit dem
Eintritt in die Prophase der ersten meiotischen Reifeteilung als primäre Oozyten bezeichnet.
Es folgt nach Rekombination homologer Chromosome (LEIBFRIED-RUTLEDGE et al.
1989) eine Arretierung der Eizellen in der Prophase I (Diplotän). Dieser Block wird unter In-
vivo-Bedingungen mit dem Eintritt in die Geschlechtsreife durch den präovulatorischen
Gonadotropinimpuls wieder aufgehoben (BUCCIONE et al 1990) und die Meiose fortgesetzt
(sekundäre Oozyte). Allerdings nur wenige der arretierten Oozyten gelangen wirklich zur
Ovulation, viele verfallen einer Atresie. Während der beschriebenen meiotischen Pause ruht
aber nicht die ganze Entwicklung der Oozyte. Es finden vielmehr hohe Syntheseleistungen
und eine 200fache Vergrößerung ihres Volumens statt (MOOR et al. 1990). Erst durch diese
Wachstumsphase erhält die Oozyte die Fähigkeit, die Meiose wieder aufzunehmen.
Die ablaufenden Prozesse zwischen Wiederaufnahme und erneuter Arretierung im
Kernstadium der Metaphase II ist die eigentliche Eizellreifung, auch Maturation genannt. Der
Abschluss der zweiten Reifeteilung erfolgt erst nach der Aktivierung durch das Spermium
oder einem entsprechenden Stimulus.
In dem Zeitraum bis zur Aktivierung im Geschlechtszyklus bilden die primären Oozyten mit
dem sie einschichtig und flach umgebenden Follikelepithel die Primordialfollikel. Mit der
Aktivierung wird er als Primärfollikel bezeichnet. Es folgt eine mitotische Proliferation des
umgebenden Follikelepithels mit der Folge, dass dieses mehrschichtig wird
(Sekundärfollikel). Die Follikelzellen, welche die Eizelle unmittelbar umgeben, produzieren
Fortsätze und an der Oberfläche der Eizelle entwickeln sich Mikrovilli. Zwischen der Oozyte
und den Follikelzellen beginnt die Bildung der Zona pellucida. Der Follikel wird zum
Tertiärfollikel, wenn die Follikelzellen beginnen, Flüssigkeit (Liquor follikuli) in den
Interzellularraum auszuscheiden. Dadurch wird die Eizelle an den Rand des Follikels
B Literaturübersicht
23
gedrängt und der Cumulus oophoros entsteht. Die innerste Schicht, die Corona radiata,
entsendet durch die Zona pellucida Zellfortsätze in das Ooplasma (ALBERTINI u. RIDER
1994). Die Kumuluszelllen sind sowohl unter einander als auch mit den wandständigen
Granulosazellen über Gap junctions verbunden. So wird ein Austausch von Metaboliten und
Signalen von der Follikelperipherie bis in das Innerste der Eizelle gewährleistet (MOTTA et
al. 1994).
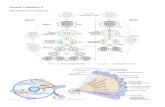
Abb. 1: Tertiärfollikel mit Eizelle, Follikelhöhle und Theca follicularis Färbung Hämatoxylin-Eosin, 120fache Vergrößerung (nach LIEBICH 1993)
Corona radiata
Ooplasma
Follikelhöhle
Kern
Zona pellucida
Theca follicularis externa
Theca follicularis interna
Follikelhöhle
Follikelepithelzellen
Corona radiata
Cumulus oophorus
B Literaturübersicht___________________________________________________________
24
3.2. Maturation der Oozyte in vivo
Die Maturation der Oozyte ist in Kernreifung, zytoplasmatische Reifung und strukturelle
Veränderungen untergliedert. Noch im Fetus tritt die DNA der Oozyte in die Prophase I ein
und wird nach Durchlaufen der Stadien Leptotän, Zygotän und Pachytän im Diplotän arretiert.
Dieser Ruhestatus wird als Diktyotän bezeichnet und wird bis zur Induktion der Reifung
beibehalten (LEIBFRIED-RUTLEDGE et al. 1989). Während der Wachstumsphase
vergrößert sich der Nukleus so, dass er als Keimbläschen bzw. Germinalvesikel (GV)
bezeichnet wird. Als Germinalvesikle Breakdown (GVBD) wird von MOTLIK und FULKA
(1976) der gesamte Kernreifungsprozess von der Auslösung der Reifung bis zum Beginn der
Metaphase I bezeichnet und sie unterteilten den Vorgang in sechs Stadien, die
lichtmikroskopisch zu unterscheiden sind:
GV I:
Der Zellkern und der Nukleolus sind deutlich zu erkennen. Das Chromatin ist ring- oder
hufeisenförmig um das Kernkörperchen verdichtet.
GV II:
Zellkern und Nukleolus sind erhalten und im Bereich der Kernmembran sind einige orcein-
positive Strukturen, Chromozentren, nachzuweisen.
GV III:
Nukleolus und Zellkern sind noch intakt und das Chromatin liegt in einzelnen Clustern oder
fädigen Strukturen vor.
GV IV:
Der Nukleolus ist bei einem erhaltenen Zellkern nicht mehr zu erkennen. Das Chromatin stellt
sich in der Orceinfärbung als irreguläres Netzwerk oder einzelne Bivalente dar.
Frühe Diakinese:
Die Membran des Zellkerns ist nicht mehr zu sehen. In der Region des ehemaligen Zellkerns
befinden sich nun die Bivalente.
Späte Diakinese:
Die Chromosomen sind kondensiert und als individuelle Teile darstellbar.
B Literaturübersicht
25
Nach dem GVBD schließen sich die Stadien Metaphase I, Anaphase I, Telophase I und die
Metaphase II an, in der es zu einem erneuten Block kommt.
Metaphase I:
Der Zellkern existiert nicht mehr und die Chromosomen sind bei maximaler Kondensation in
einem Cluster angeordnet.
Anaphase I:
Die Chromosomen befinden sich in der Äquatorialebene und eine Spindel ist zu erkennen.
Telophase I:
Die meiotische Spindel ist nun deutlich zu sehen und Chromosomen weichen in zwei
Gruppen auseinander.
Metaphase II:
Die Chromosomen sind auf zwei Cluster verteilt und ein Polkörper ist zu finden.
Die zytoplasmatische Reifung ist von der Kernreifung abzugrenzen, beide Prozesse treten
jedoch in Wechselwirkung (EPPIG 1996). Eine befriedigende Befruchtungs- und embryonale
Entwicklungskompetenz wird keines Falls nur durch eine erfolgreich abgelaufene
Kernreifung garantiert (LAURINCIK et al. 1994). So konnte CRAN 1985 nachweisen, dass
in vivo gereifte porcine Eizellen eine Umstrukturierung der Zellorganellen aufzeigen. Die
Mitochondrien beispielsweise verteilen sich aus ihrer Gruppierung am Rande der Eizelle
gleichmäßig im gesamten Ooplasma. Die kortikale Granula verdoppelt sich in ihrer Menge
und ordnet sich in einem ca. 4 µm breiten Bereich unterhalb der Plasmamembran an. Die
Verfügbarkeit der Granula in dieser Lokalisation korreliert mit dem Vermögen der Eizelle
zum Polyspermieblock (DUCIBELLA 1996).
B Literaturübersicht___________________________________________________________
26
4. Gameteninteraktion
Die ersten Schritte der Gameteninteraktionen finden zwischen Spermium und Zona pellucida
statt. Es werden folgende Stufen der Annäherung des Spermatozoons an die Eizelle
unterschieden (WASSARMAN 1990):
1. Attachement: lockere, nicht speziesspezifische Kontaktaufnahme des
Spermiums mit der ZP
2. primäre Bindung: Bindung von akrosomintakten, kapazitierten Spermien an die ZP
3. sekundäre Bindung: Bindung von akrosomreagierten Spermien an die ZP
4. Penetration: akrosomreagierte Spermien wandern durch die ZP.
Diese Prozesse werden über Protein-Kohlenhydrat-Erkennungsmechanismen vermittelt
(MILLER u. AX 1990). Oberflächenassozierte Spermienproteine binden speziesspezifisch an
Kohlenhydrate der Zona pellucida und als Folge wird die Akrosomreaktion induziert
(MEIZEL 1985).
Akrosomreaktion:
Als Akrosomreaktion wird der exocytische Prozess beschrieben, durch den der akrosomale
Inhalt mit seinen lytischen Enzymen (u.a. Akrosin) freigesetzt wird. Dies geschieht durch die
Verschmelzung der äußeren akrosomalen Membran mit der darüber liegenden
Plasmamembran (siehe Abb. 2). Für die Befruchtung ist dieser Vorgang essentiell, da erst
eine partielle Hydrolyse der ZP dem Spermium die Penetration ermöglicht. Unterschiedliche
Signalübertragungssysteme werden kaskadenartig aktiviert und als Hauptresultat entsteht ein
massiver Kalziuminflux in das Zellinnere der Spermien (FRASER 1993). Durch die Bindung
von Kalzium an Calmodulin erfolgen Phosphorylierungen verschiedener Membranproteine.
B Literaturübersicht
27
Abb. 2: Schematischer Ablauf der Akrosomreaktion beim Säugetier (nach YANAGIMACHI 1994), AM: akrosomale Membran; PM: Plasmamembran
Mit der In-vitro-Induktion der Akrosomreaktion kann ein funktioneller Teilaspekt von
Spermienpopulationen untersucht werden; sind die Spermien kapazitiert und sind sie in der
Lage, auf den entsprechenden Reiz mit der Akrosomreaktion zu reagieren. Die Induktion der
Akrosomreaktion ist möglich mit Lyso-Phosphatidylcholin (LPC) und Glukosaminoglykanen
z.B. Heparin, Hyaluronsäure und Chondroitinsulfat (KOPF u. GERTON 1991; VARNER et
al. 1993).
Die anschließende sekundäre Bindung ist für die Verbindung der akrosomreagierten Spermien
mit der ZP-Matrix verantwortlich. Sowohl durch die bei der Akrosomreaktion freigesetzten
Enzyme als auch durch den eigenen motorischen Antrieb penetriert das Spermium die Zona
pellucida. Das Spermium lagert sich nun tangential mit der ganzen Fläche seines Kopfes an
die Plasmamembran der Eizelle an. Im seitlichen Bereich des Spermatozoons sind viele
Proteine lokalisiert, die an der Fusion der Spermienmembran mit den Mikrovilli der
Eizellmembran beteiligt sind. Nach der Verschmelzung der Plasmamembranen wird erst der
Spermienkopf und dann das ganze Spermium in die Eizelle aufgenommen. Dabei entsteht der
sogenannte Empfängnishügel (impregnation cone), da sich die Eizelle für die
phagozytoseähnliche Inkorporation des Spermiums vorwölbt.
B Literaturübersicht___________________________________________________________
28
Im Gegensatz zur Bindung an die ZP ist die Fusion von Eizelle und Spermatozoon nicht
speziesselektiv. Dieser Umstand wurde bei der Entwicklung von heterologen IVF-Tests
genutzt. So kann die Fertilität von humanen Spermien mit Hamsteroocyten überprüft werden
(ROGERS 1988), welches von großem Vorteil ist, da die Bereitstellung von humanen
Eizellen aus ethischer Sicht sehr problematisch ist.
Nach Eintritt des Spermiums in die Eizelle wird diese aktiviert, die Meiose vollendet und die
kortikale Reaktion ausgelöst. Dabei werden die proteolytischen Enzyme der kortikalen
Granula von der Eizelle in den perivitellinen Spaltraum abgegeben. Die Enzyme sind nun in
der Lage, die Zellmembranproteine der Oocyte so zu verändern, dass diese nicht mehr von
den Spermien erkannt werden können. Weiterhin bewirken diese Enzyme eine partielle
Proteolyse der ZP Glykoproteine, so dass dort kein weiteres Erkennen, Binden und
Vordringen von Spermien möglich ist. Diese Reaktion wird als Zona-Reaktion angesprochen.
Eine weitere Umstrukturierung der Eizellmembran für die Verhinderung der Polyspermie
erfolgt durch eine Depolarisationswelle, die unmittelbar nach der Verschmelzung der
Gameten über die Plasmamembran der Oocyte hinweg läuft.
5. Die Zona pellucida
Die Zona pellucida (Glashaut) ist eine extrazelluläre Matrix, welche die Oocyte gelartig
umgibt. Sie bildet sich in ihrer Struktur während der Follikulogenese aus und bleibt auch noch
nach der Befruchtung der Eizelle eine gewisse Zeit zum Schutz der entstandenen Blastozyste
bestehen. Die weiteren Aufgaben bestehen aus der speziesspezifischen Bindung von
kapazitierten Spermien und nachfolgender Induktion der Akrosomreaktion mit anschließender
Penetration des Spermiums durch die ZP. Weiterhin trägt die ZP durch ihre im Anschluss an
die Befruchtung entstehenden Modifikationen zum Polyspermieblock mit bei (DUNBAR u.
WOLGEMUTH 1984).
B Literaturübersicht
29
5.1. Aufbau und Entwicklung
Die azelluläre ZP zeigt in ihrer Dicke größere Unterschiede im Vergleich von niederen und
höher entwickelten Tieren. So beträgt ihre durchschnittliche Breite bei der Maus 5 µm, 13-16
µm bei Mensch und Schwein (DUNBAR u. WOLGEMUTH 1984; DUNBAR et al. 1991)
und beim Rind 27µm (DUNBAR et al. 1994). Die Schweineeizelle besitzt mit der ZP einen
Durchmesser von ca. 100 bis 150 µm und ist annähernd rund. Der Proteingehalt beträgt je
nach Reifungszustand 15-30 ng/ZP (TÖFER-PETERSEN, persönliche Mitteilung). Die
Proteine sind durch nicht-kovalente Bindungen in einem feinverküpften Netzwerk angeordnet
(WASSARMAN 1988). Mittels Elektronenmikroskopie ist zu erkennen, dass die ZP eine
zweischichtige Struktur aufweist. Die äußere Schicht besitzt größere Löcher, gleich einem
Schweizer Käse, und der innere Bereich ist von amorpher Struktur. An Hand von
Untersuchungen der bovinen ZP konnte gezeigt werden, dass nach der Befruchtung der
Oozyte die ZP dünner wird und die Lochstrukturen verschwinden (SUZUKI et al 1994).
Die ZP der Säugetiere besteht aus drei Glykoproteinen, die posttranslationalen
Umbauprozessen wie Glykosylierung und Sulfatierung unterliegen, so dass eine gewisse
Heterogenität entsteht (WASSARMAN, 1988).
Die Nomenklatur der ZP-Glykoproteine ist teilweise recht missverständlich. Die Maus war
die erste untersuchte Spezies, bei der die einzelnen Proteine mittels Gelelektrophorese isoliert
werden konnten. Die drei erhaltenen Proteine wurden einfach nach absteigendem
Molekulargewicht mit ZP1 (200 kDa), ZP2 (120 kDa) und ZP3 (83 kDa) bezeichnet (BLEIL
u. WASSARMAN 1980a). Bei den ersten biochemischen Analysen der porcinen ZP konnten
unter reduzierenden Konditionen bei der Elektrophorese (PAGE) vier Komponenten mit
einem Molekulargewicht von 90, 65, 55, 25 kDa isoliert werden. Werden allerdings nicht
reduzierende Bedingungen gewählt, so erscheinen nur eine 90 und eine 55 kDa Bande
(HEDRIK u. WARDRIP 1980; SACCO et al. 1981).
In weiteren Untersuchungen von HEDRICK und WARDRIP konnte 1987 gezeigt werden,
dass sich das porcine ZP1 (pZP1), die 90 kDa Bande der nicht reduzierenden PAGE, unter
Reduktion durch Spaltung von Disulfidbrücken in die 65 kDa und 25 kDa Komponenten der
reduzierenden PAGE auftrennt. Durch eine isoelektrische Fokussierung konnten HEDRICK
und WARDRIP (1980) den Proteinanteil, welcher der breiten 55 kDa Bande der nicht
reduzierenden PAGE entsprach, in einen sauren Anteil pZP3α und einen basischen pZP3β
B Literaturübersicht___________________________________________________________
30
auftrennen. Später konnte nachgewiesen werden, dass es sich dabei nicht um zwei
Proteinketten, sondern um zwei verschiedene Proteine handelt (TÖPFER-PETERSEN et al.
1993). Eine einheitliche speziesübergreifende Nomenklatur wurde durch die Identifizierung
der kodierenden Gene für die einzelnen Glykoproteine ermöglicht (HARRIS et al. 1994). Die
Bezeichnungen der ZPA-, ZPB- und ZPC-Genfamilien wurden etabliert. Die Einstufung
wurde nach der Anzahl der Basenpaare vorgenommen, und zwar stellt dabei ZPA das größte
und ZPC das kleinste Gen dar.
Tab. 1: Nomenklatur der Proteine der Zona pellucida
ZPA
ZPB
ZPC Maus
mZP2
mZP1
mZP3
Mensch
hZP2
hZP1
hZP3
Schwein
pZP1 (pZP2)
pZP3α (pZP1)
pZP3β (pZP3)
Bei jeder der drei Proteinfamilien konnte gezeigt werden, dass zu 50-98 % Homologien auf
der Ebene der Nukleinsäure bestehen (EPIFANO u. DEAN 1994, MCLESKEY et al. 1998).
Die strukturelle Bedeutung der einzelnen Glykoproteine ist bisher nur bei der Maus geklärt.
Nach WASSARMAN und MORTILLO (1991) sind dort jeweils ZPA und ZPC zu
Heterodimeren zusammengelagert. Diese Einheiten bilden lange Filamente, welche durch das
ZPB an diversen Stellen verbunden werden.
Die ZP ist während der Follikulogenese ab dem Stadium des Sekundärfollikels zwischen
Oolemn und den Granulosazellen nachweisbar (LEE u. DUNBAR 1993). Über den
Syntheseort der ZP bestanden kontroverse Meinungen. Kern der Auseinandersetzungen war
die Beteiligung der Granulosazellen neben der Oozyte und bei welcher Tierart welche
Systeme vorherrschen. Bei der Maus wurde nachgewiesen, dass die ZP nur in der Eizelle
selbst synthetisiert wird (WASSARMAN u. KINLOCH 1992; EPIFANO et al. 1995). Bei
anderen Arten (Kaninchen, Schwein, Rind, Marmoseten und Mensch) konnte mRNA
B Literaturübersicht
31
und/oder Protein der ZP in den Granulosazellen nachgewiesen werden. GROOTENHUIS et
al. (1996) konnte mittels Antikörpern gegen ZPC ZP Proteine in Granulosazellen markieren.
Mittels in situ Hybridisierung konnten KÖLLE et al. (1996 u. 1998) pZPB und bZPC in einer
Entwicklungsstufenabhängigkeit in den Granulosazellen von Sekundärfollikeln nachweisen.
Dabei ist die bovine Oocyte während der gesamten Follikologenese in die ZP Synthese
involviert, wenn auch bei den Tertiärfollikeln am meisten ZPC im Zytoplasma der Corona
radiata Zellen nachgewiesen werden konnte.
Beim Schwein hingegen wird im Stadium des Tertiärfollikels die ZP nicht mehr von der
Eizelle selbst synthetisiert. ZP bzw. die entsprechenden Transskripte konnten dann nur noch
in den Granulosazellen detektiert werden. Untersuchungen an fetalen Ovarien haben gezeigt,
dass Zona pellucida Proteine schon während der pränatalen Entwicklung von Follikelzellen
synthetisiert werden. In bovinen Feten konnte ZPC bei Primordial- und Primärfollikeln in der
Eizelle selbst und bei Sekundär- und Tertiärfollikeln zusätzlich noch in den Follikelzellen
nachgewiesen werden (TOTZAUER et al. 1998).
5.2. Oligosacchridstrukturen der ZP
Der wichtigste Informationsträger der Zellen ist die Desoxyribonukleinsäure (DNA). Die
Erbinformationen werden durch ihre Nukloetidsequenz kodiert, abgelesen, in Proteine
übersetzt und durch diese werden dann die folgenden biologischen Prozesse induziert.
Eine weitere Struktur, die als Informationsträger fungiert und immer mehr in das Interesse
verschiedener Forschungen rückt, sind die Kohlenhydrate (GABIUS et al. 1988; HURTLEY
et al. 2001). Die Zuckerketten sind an Proteine und Lipide gebunden, so dass Glykokonjugate
(Glykoproteine, Glykolipide, Proteoglykane) entstehen. Die Bildung der Polypeptidketten der
Proteine wird genetisch durch den DNA-Code terminiert. Die Glykosylierung wird jedoch
durch ein hochspezifisches Enzymsystem, es existiert für jeden Zucker und jede
Verknüpfungsmöglichkeit ein spezielles Enzym, gesteuert und unterliegt so nur indirekt einer
genetischen Kontrolle.
B Literaturübersicht___________________________________________________________
32
Zwischen den Kohlenhydraten gibt es viel mehr Verbindungsformen und –möglichkeiten als
zwischen Aminosäuren und somit auch ein größeres Potential zur Übertragung von
Informationen. Werden zwei Aminosäuren verknüpft, so gibt es nur eine Möglichkeit. Bei
zwei Zuckern hingegen können aufgrund der vielfältigen möglichen Bindungsformen, α- oder
β-Verknüpfung und verschiedene Konformationsmöglichkeiten (Wannen- oder Sesselform),
bis zu 16 isoforme Strukturen entstehen (KOBATA 1992). Weiterhin bestehen zwei
Möglichkeiten, die Zuckerkette an ein Proteingerüst zu binden. Bei der O-Glykosylierung
werden die Kohlenhydrate an die OH-Gruppen der Aminosäuren Serin oder Threonin und
sehr selten auch an Hydroxylysin geheftet. Die zweite Form der Anheftung ist die N-
Glykosylierung über die Aminogruppe (NH2) der Aminosäure Asparagin. Nicht jedes
Asparagin ist jedoch eine potentielle Glykosylierungsstelle, vielmehr sind sogenannte
Signalsequenzen von Nöten. Die Signalsequenz besteht aus einer Asparagin-X-Serin oder
Asparagin-X-Threonin Abfolge, in der X für jede Aminosäure exklusive Prolin steht.
Die Informationen, welche die Glykokonjugate festlegen, können durch geeignete Rezeptoren
abgelesen werden (GABIUS u. GABIUS 1992). In den Zellmembranen kommen
Glykoproteine vor, deren Zuckerketten weit in den interstiellen Raum hinausragen, und sind
somit hervorragend für die interzelluläre Kommunikation geeignet. Sie agieren als
Oberflächenrezeptoren und übertragen die extrazellulären Signale in das Zellinnere.
Lektine Lektine sind Glykoproteine, die zunächst aus Pflanzen, in letzter Zeit aber auch aus tierischen
Organismen, isoliert wurden, und gehören zur Klasse der zuckerbindenden Proteine. Sie
zeichnen sich durch ihr substratspezifisches Verhalten gegenüber Kohlenhydraten
(SCHUMACHER et al. 1990)und durch das Fehlen einer enzymatischen Aktivität aus und
weisen auch keine Homologien zu Antikörpern auf (GABIUS u. GABIUS 1992).
Die ersten Berichte über Lektine erschienen schon 1888 von STILLMARK. Er fand heraus,
dass der giftige Inhaltsstoff Ricin des Wunderbaumes Erythrozyten agglutiniert. Seitdem sind
viele Arbeiten mit und über Lektine entstanden. Paul Ehrlich beispielsweise benutzte die
Lektine um die Jahrhundertwende bei seinen Immunisierungsversuchen. Bei diesen
Forschungen war die Zuckerspezifität eher nebensächlich, da toxische Lektine hier als
hochwirksame Antigene zur Produktion von Antikörpern eingesetzt wurden. Die Fähigkeit
B Literaturübersicht
33
zur Hämagglutination rückte erst später wieder in den Blickpunkt des wissenschaftlichen
Interesses. Lektine können z.B. die einzelnen menschlichen Blutgruppen unterscheiden, in
dem sie die unterschiedlichen Blutgruppenantigene anhand einzelner endständiger
Zuckerreste erkennen (GABIUS et al. 1988). Das „auswählende“ Verhalten der Lektine
veranlasste BOYD u. SHAPLEIGH 1954, ihnen den Namen Lektine zu geben (nach
lateinisch legere → auswählen).
Die Bindungsfähigkeit der Lektine wird durch verschiedene Faktoren beeinflusst. Sie ist
abhängig von der Tertiärstruktur des Rezeptors, der Lage der umliegenden Zuckerstrukturen
sowie von den Liganden des C3- und C4-Atoms des zu bindenden Zuckermoleküls. Lektine
weisen zwei oder bis zu 18 Zuckerbindungsstellen pro Molekül auf, wobei die
Bindungsaktivität durch das Vorhandensein von Schwermetallionen und dem pH-Wert
beeinflusst wird (LEATHEM 1986).
Neben der weitverbreiteten Anwendung von Lektinen in der Histologie und Biochemie
kommen die Lektine auch in der diagnostischen Medizin zur Anwendung. Zu erwähnen sind
die Diagnosen von entzündlichen Darmerkrankungen (Morbus Crohn, Colitis ulcrosa) und
verschiedener Speicherkrankheiten. Weiterhin werden Lektine zur Identifizierung von
speziellen Zellpopulationen und zur Erkennung von metastasierenden Mammakarzinomen
verwendet (SCHUMACHER et al. 1990).
Zur Analyse der Kohlenhydratstrukturen der Zona pellucida wurden zunächst Lektine
eingesetzt, da sie wie beschrieben mit hoher Spezifität ähnlich einem Schlüssel-Schloss-
Prinzip an bestimmte Zuckerstrukturen binden. Verschiedene Autoren haben die ZP von
unterschiedlichen Spezies mit Hilfe von Lektinen untersucht (AVILES et al. 1994;
MAYMON et al. 1994). So konnte mittels Elektronenmikroskopie gezeigt werden, dass die
ZP in Schichten organisiert ist, in denen definierte Zuckerstrukturen eine bestimmte
räumliche Verteilung aufweisen (SHALGI et al. 1991). In der murinen ZP befinden sich die
GalNAc-β(1-4)-Gal-Strukturen vorwiegend in der inneren Region (AVILES et al. 1999).
Eine umfangreiche Studie an verschiedenen Arten wurde 1994 von SKUTELSKY et al.
durchgeführt. Die Lektinbindungsmuster weisen eine speziesbezogene Spezifität auf. Bei den
Nagetieren konnten in strukturellen Untersuchungen mit Lektinen nur α-Galaktose und/oder
β-N-Acetylgalaktosamin nachgewiesen werden. Bei der ZP von humanen, caninen, felinen
B Literaturübersicht___________________________________________________________
34
und porcinen Eizellen markierten die entsprechenden Lektine keine Zuckerstrukturen.
Allgemein ist zu sagen, dass die Unterschiedlichkeit der Lektinbindungsmuster mit
wachsender phylogenetischer Distanz sich ebenfalls vergrößert (SHALGI u. RAZ 1997).
Neben diesen Unterschieden bestehen aber auch Gemeinsamkeiten. Bestimmte Zuckerreste,
wie Mannose und N-Acetylglukosamine, sind bei allen untersuchten Spezies nachzuweisen,
und zwar meistens in der Core-Region von N-glykosidisch gebundenen Kohlenhydraten
(GEYER u. GEYER 1998).
Neben der Lektinologie wurden in den letzten Jahren die Kohlenhydrate der ZP mit Hilfe
neuer Analysemöglichkeiten direkt untersucht. Die Zusammensetzung der Oligosaccharide
der porcinen ZP (NOGUCHI u. NAKANO 1992; HOKKE et al. 1994; NAKANO u.
YONEZAWA 2001), der murinen ZPA und ZPC Proteine (NOGUCHI u. NAKANO 1993;
NAGDAS et. al. 1994) sowie der unfraktionierten bovinen ZP (KATSUMA et al. 1996) sind
bereits veröffentlicht worden.
Soweit untersucht, besitzen alle ZP Glykoproteine sowohl N-glykosidisch als auch O-
glykosidisch gebundene Seitenketten. N-glykosidisch verknüpfte Zuckerketten weisen im
Allgemeinen eine höhere Komplexität und mehr Verzweigungen als O-glykosidisch
verknüpfte Zuckerketten auf. Es werden mannosereiche (High-Mannose) Zuckerketten von
komplexen unterschieden und die Mischformen als Hybridtyp bezeichnet. Diese Ketten
kommen in di-, tri- und tetraantennärer Form vor.
Das ZPA des Schweins weist sechs potentielle N-Glykosylierungsstellen auf, die Anzahl der
O-Glykosylierungen ist hingegen nicht bekannt. ZPB und ZPC besitzen jeweils drei N-
glykosidisch verknüpfte und drei bzw. bei ZPC sechs O-glykosidisch verknüpfte
Zuckerketten (YUREWICZ et al. 1991).
Die N-gebundenen Glykane der ZP bei Schwein, Rind und Maus besitzen die gleiche
Grundstruktur. Sie gehören zum fukosylierten Komplex-Typ und sind verlängert mit
unverzweigten N-Acetyllaktosamineinheiten. Bei sauren Glykanen sitzen am nicht
reduzierten Ende Sialsäure- und/oder Sulfatreste an der C-6 Position der N-
Acetylglukosamine der sich wiederholenden Laktosamineinheiten. Zusätzlich wurden beim
Schwein auch Sulfatreste bei sich nicht wiederholenden Einheiten und an der C-3 Position der
N-Acetylglukosaminreste am reduzierten Ende gefunden (MORI et al. 1998).
B Literaturübersicht
35
Das Verhältnis der di-, tri- und tetraantennären Ketten und der Grad der Sulfatierung und
Sialylierung ist bei den einzelnen Arten zum Teil recht unterschiedlich. Die Glykoproteine der
ZP von Maus und Rind bestehen aus sauren tri- und tetraantennären Ketten, die hauptsächlich
Sialylreste tragen und nur wenig sulfatiert sind. Die Acidität der N-gebundenen sauren
Zuckerketten beim Schwein hingegen wird vornehmlich durch das Vorhandensein von
Sulfatresten hervorgerufen.
Die Struktur der neutralen N-Glykane gestaltet sich bei den angesprochenen Arten in
unterschiedlicher Weise. Die Hauptstruktur der N-glykosidisch gebundenen neutralen
Oligosaccharide bei der ZP des Rindes ist der High-Mannose-Typ, während beim Schwein
unter den N-Glykanen die diantennären fukosylierten Glykane mit N-Acetyllaktosamin-
Ketten vorherrschen.
Der Anteil der neutralen N-glykosylierten Zuckerketten an der Gesamtheit aller
Kohlenhydrate der ZP beträgt bei Rind und Schwein circa 25% und bei der Maus hingegen
weniger als 5%.
Ausgehend von einem Gal-β(1-3)-GalNAc Disaccharidkern besitzt die sulfatierte
Polylaktosamingrundstruktur (β(2-3)-Verknüpfung) der O-glykosidisch verknüpften Zucker
der porcinen ZP die gleiche Anordnung wie die N-glykosidisch verknüpften Zucker (HOKKE
et al. 1993). Die Sialsäurereste können an das nicht reduzierte Ende der Zuckerkette und/oder
an den proximalen N-Acetylgalaktosaminrest des Kerndisaccharides gebunden sein. Das nicht
reduzierte Ende der Kohlenhydratkette endet mit neutralen Strukturen mit β-Galaktose- und
β-N-Acetylglukosaminresten oder auch zu einem geringen Anteil mit α-Galaktose- und β-N-
Acetylgalaktosaminresten (TÖPFER-PETERSEN 1999).
Mittels Oligosaccharid-Analyse von den N-Glykanen der porcinen ZP konnte gezeigt werden,
dass an Asn203, Asn220 und Asn333 von ZPB neutrale diantennäre Zuckerketten N-
glykosidisch konjugiert sind. An Asn220 sind zusätzlich noch tri- und tetraantennäre Ketten
lokalisiert, welche sich bei ZPC an Asn271 befinden. An alle drei Glykosylierungsstellen des
ZPC (Asn124, Asn146 und Asn271) sind auch wieder diantennäre Zuckerketten N-
glykosidisch gebunden. Von den drei O-Glykosylierungsstellen des ZPB sind Ser293 und
Thr303 bekannt. Die Lokalisationen Thr155, Thr161 und Thr162 des pZPC sind drei der
potentiellen sechs O-Glykosylierungsstellen (NAKANO u. YONEZAWA 2001).
B Literaturübersicht___________________________________________________________
36
A O-glykosidische Zuckerkette Gal(β1-4)GlcNAc(β1-3)Gal(β1-3)GalNAc Beispiel für eine Zuckerstruktur bei einem O-Glykan der pZP B Diantennäre Struktur eines komplexen Zuckers Gal(β1-4)GlcNAc(β1-2)Man(α1-6) Man(β1-4)GlcNAc(β1-4)GlcNAc Gal(β1-4)GlcNAc(β1-2)Man(α1-3) dominierende neutrale Oligosaccharidstruktur der N-Glykane der pZP C Triantennäre Struktur eines komplexen Zuckers Gal(β1-4)GlcNAc(β1-6)Man(α1-6) Man(β1-4)GlcNAc(β1-4)GlcNAc Gal(β1-4)GlcNAc(β1-4) Man(α1-3) Gal(β1-4)GlcNAc(β1-2) Beispiel für eine triantennären Zuckerkette eines N-Glykans der pZPB, welches neben den tetraantennären in der Lage ist, die Bindung zwischen Spermatozoon und Eizelle zu inhibieren (KUDO et al. 1998). D Mannosereicher Zucker Man(α1-6) Man(α1-6) Man(α1-3) Man(β1-4)GlcNAc(β1-4)GlcNAc Man(α1-3) Dominierende Struktur eines neutralen N-Glykans des „High-Mannose“-Typs, welches sich beim Rind durch inhibierende Wirkung(en) auf die Spermatozoon-Eizell-Bindung und die IVF auszeichnet (NAKANO u. YONEZAWA 1998). Abb. 3: Schematische Darstellung von porcinen und bovinen biologisch aktiven Glykanen der ZP (nach TÖPFER-PETERSEN 1999) Gal = Galaktose; Man = Mannose; Fuc = Fukose; GlcNAc = N-Acetylglukosamin
B Literaturübersicht
37
5.3. Spermien-Zona pellucida-Interaktionen
Zuckerstrukturen der ZP bei der Gameteninteraktion Zahlreiche Untersuchungen belegen, dass die Oligosaccharidstrukturen der ZP bei der
Gameteninteraktion eine maßgebliche Rolle spielen. Die genauen Prozesse sind jedoch noch
sehr unzureichend erklärbar. Nur bei wenigen Arten ist bisher bekannt, welches Glykoprotein
für die Spermienbindung zuständig ist. Bei der Maus und beim Hamster wird ZPC sowohl die
Fähigkeit zur Erkennung des Spermiums als auch zur Induktion der Akrosomreaktion
zugeordnet. Die Bindungsaktivität der ZP von Schwein und Kaninchen ist hingegen am ZPB
lokalisiert (HEDRICK 1996; PRASAD et al. 1998). Zur Komplettierung der
Speziesunterschiede ist anzumerken, dass bei Xenopus laevis (Krallenfrosch) der
Spermienrezeptor (gp69/64) am ZPA liegt (TIAN et al. 1999). Beim Menschen wird wie bei
der Maus ZPC die Rezeptoraktivität zugewiesen. Es fehlen jedoch die direkten Beweise für
eine Bindungslokalisation, da bisher nur die Fähigkeit zur Induktion der Akrosomreaktion
beim rekombinanten hZPC nachgewiesen werden konnte (BREWIS et al. 1996) und nicht die
Bindungsfähigkeit direkt.
Sowohl bei der Maus als auch beim Schwein wurde die Spermienrezeptoraktivität
hauptsächlich einer bestimmten Klasse von O-glykosidisch gebundenen Zuckern zugeordnet
(FLORMAN u. WASSARMAN 1985; YUREWICZ et al. 1991). Im Gegensatz dazu
postulieren in neuerer Zeit andere Autoren die Beteiligung von neutralen N-glykosidisch
gebundenen Zuckern an der Gametenbindung (TÖPFER-PETERSEN et al. 1995; NAKANO
u. YONEZAWA 2001). Bei beiden angesprochenen Arten scheint ein Zusammenspiel von
diversen biologisch aktiven Oligosacchariden für eine ausreichend starke Bindung von Nöten
zu sein. Bei der Maus kann die Rezeptoraktivität einer Region im C-terminalen 28kDa Peptid
von mZPC zugeordnet werden (WASSARMAN u. LITSCHER 2001). JOHNSTON et al.
(1998) entwickelten bei der Maus ein komplexes Modell der Spermienerkennung. Demnach
besitzen die Spermien Bindungsstellen, die eine hohe Affinität für α3-fukosylierte
Oligosaccharide und eine niedrigere Affinität für α3-galaktosylhaltige und β-galaktosehaltige
Strukturen zeigen. Der Grad der Sialylierung und Sulfatierung scheint keinen Effekt auf die
Bioaktivität auszuüben (SHUR 1998).
B Literaturübersicht___________________________________________________________
38
YUREWICZ et al. konnten 1992 zeigen, dass die Poly-N-Acetyllaktosamineinheiten
anscheinend keine Rolle bei der Spermienbindung im porcinen Organismus spielen. Nach
einer Trypsinspaltung von isoliertem pZPB und pZPC wies nur der Anteil der O-Glykane von
pZPB noch eine Rezeptoraktivität auf. Bei den O-Glykanen von pZPC ist dies nicht der Fall,
so dass von einem unterschiedlichen O-Glykolysierungsmuster ausgegangen werden kann.
Im Gegensatz dazu konnte in aktuellen Ergebnissen gezeigt werden, dass die neutralen N-
glykosidisch verknüpften Oligasaccharide vom porcinen ZPB/ZPC-Komplex eine
Bindungsaffinität für Spermien besitzen (YONEZAWA et al. 1999; NAKANO u.
YONEZAWA 2001). Bei all diesen Zuckerketten vom komplexen Typ wird den tri-und
tetraantennären Ketten eine größere Bindungsaktivität als den diantennären Ketten
zugesprochen. Eine dominierende Rolle scheinen dabei die Zuckerstrukturen, die an Asn220
in der N-terminalen Region von endo-β-Galaktosidase gespaltenen ZPB geknüpft sind,
einzunehmen. Den Strukturen von ZPC wird eine unterstützende Funktion zugeordnet.
Bei anderen Spezien werden interessanter Weise andere Kohlenhydrate als Spermienrezeptor
angesprochen. Beim Rind konnte gezeigt werden, dass isoliertes bZPB mit seinen
hauptsächlich neutralen N-Glykanen des High-Mannose-Typs in der Lage ist, die Spermien-
Eizell-Bindung und die In-vitro-Fertilisation zu hemmen. Weiterhin konnte gezeigt werden,
dass die Bindungskapazität nach der Befruchtung herabgesetzt ist, ein Indiz also für
Veränderungen der ZP in Struktur und/oder Konformation während der Fertilisation
(NAKANO et al. 1996; NAKANO u. YONEZAWA 1998).
Die Bindung von humanen Spermien an hZP kann durch diverse Zucker (Fukose, Mannose,
Galaktose und N-Acetylglukosaminreste) gehemmt werden (MIRANDA et al. 1997).
Weiterhin zählen auch komplexe Glykokonjugate mit selektinartigen Liganden, wie Sialyl-
Lewis und fukosylierte und sialylierte GalNAc-β(1-4)-GlcNAc (LacdiNAc)-Antennen der N-
Glykane, zu den Inhibitoren. OEHNINGER et al. (2001) kommen daher zu der Erkenntnis,
dass beim Menschen die Gametenerkennung und –bindung über einen selektinähnlichen
Mechanismus vermittelt wird.
Alle diese Daten zeigen, dass es sich bei der Spermienerkennung und der Bindung an die ZP
um ein sehr komplexes und spezifisches System handelt. Homologen ZP Proteinen können
keineswegs die gleichen Funktionen zu geordnet werden. Die Gameteninteraktion scheint ein
Ergebnis kooperierender multimerer Rezeptorsysteme darzustellen (SHUR 1998).
B Literaturübersicht
39
ZP bindende Proteine der Spermien Diverse Zona pellucida bindende Proteine (ZBP) der Spermienmembran sind zur Zeit schon
bekannt, aber von nur wenigen ist auch die Struktur und ihre biochemische Wirkungsweise
detailliert erforscht. Bei den ZBP handelt es sich um kohlenhydratbindende Enzyme oder
lektinähnliche Proteine, die jeweils spezifische Bindungsstellen für die ZP und ihre
Zuckerstrukturen aufweisen.
Die β(1-4)-Galaktosyltransferase (GalTase) der Maus ist in die anfängliche Bindung des
Spermiums an die ZP involviert. Sie hat nachweislich einen Anteil an der Aktivierung der G-
Proteine der Spermatozoenmembran, welche Phosphorylierung und Induktion der
Akrosomreaktion zur Folge hat. Allerdings sind GalTase defiziente Mäuse trotzdem ohne
große Einschränkungen befruchtungsfähig. Dies untermauert die Vermutung, dass die
GalTase die Gametenbindung in einem speziesspezifischen System von mehreren Rezeptoren
lediglich unterstützt (TÖFPER-PETERSEN et al. 1995; SHUR 1998). Es erfolgt dabei eine
nicht katalytische Bindung der GalTase an die N-Acetylgalaktosaminreste des mZPC
(MILLER et al. 1992). Das murine sp56 ist im Gegensatz zum integralen Membranprotein
GalTase ein peripheres Membranprotein der Spermien. Es erkennt die O-glykosidischen
Zuckerketten des ZPC, welche für die Spermienrezeptoraktivität des ZPC unabdingbar sind
(BLEIL u. WASSARMAN 1988). So kann auch dem sp56 eine Beteiligung an der primären
Spermien-ZP-Bindung zugesprochen werden (CHENG et al. 1994).
Das sp17 des Kaninchens bindet über einen Kohlenhydrat-Sulfat-Erkennungsmechanismus an
die ZP und es kann wahrscheinlich einer Untergruppe der Lektine, die spezifisch an Galaktose
binden, zugeordnet werden (ABDULLAH et al. 1991; RICHARDSON et al. 1994).
Ein weiteres Protein der Spermienmembran, das an der Interaktion mit der ZP beteiligt ist, ist
das PH-20. Es handelt sich hierbei um ein Glykoprotein testikulärer Abstammung, das über
einen GPI-Anker an die Spermatozoenmembran gekoppelt ist. Mittels spezifischer Antikörper
gegen PH-20 konnte die Kontaktaufnahme des PH-20 an die ZP gehemmt werden und somit
die Bedeutung für den Bindungsvorgang nachgewiesen werden (PRIMAKOFF et al. 1988).
Weiterhin besitzt das angesprochene Protein auch eine Hyaluronidaseaktivität (HUNNICUTT
et al. 1996). PH-20 wurde beim Meerschwein (PRIMAKOFF et al. 1997) und weiterhin beim
Affen und Menschen (LIN et al. 1993) nachgewiesen.
B Literaturübersicht___________________________________________________________
40
Beim Schwein sind bereits diverse spermienassozierte Proteine, die an die ZP binden,
bekannt. Es handelt sich dabei um P47, Zonadhäsin, Spermadhäsine und Pro/Akrosin. P47 ist
ein peripheres Spermienmembranprotein, das auch im testikulären Gewebe von Schwein,
Rind, Maus, Mensch und Pferd (ENSSLIN et al. 1998; TÖPFER-PETERSEN u. GENTZEL
persönliche Mitteilung) mit einer Sequenzhomologie von 60-100% lokalisiert werden konnte.
Das porcine Zonadhäsin bindet speziesspezifisch an homologe ZP. Ob die Bindung über die
Zuckerstrukturen der ZP oder direkt mit dem Polypeptidcore abläuft, wird noch diskutiert.
Vermutlich erfolgt die Erkennung über heparinbindende speziesspezifische Sequenzen der
Zonadhäsine von sulfatierten Oligosaccharidstrukturen der ZP (TÖPFER-PETERSEN 1999).
Bei der Gruppe der Spermadhäsine handelt es sich um eine Gruppe von Komponenten des
Seminalplasmas, die in die Spermienmembran eingebaut werden. Es werden beim Eber
AWN, AQN, die Buchstaben stehen für die drei ersten Aminosäuren der N-terminalen
Sequenz, und das Porcine Seminal Plasma Protein (PSP) unterschieden (CALVETE et al.
1994; SOLIS et al. 1997). Proteine der Spermadhäsinfamilie konnten auch beim Hengst
(REINERT et al. 1996) und Bullen (WEMPE et al. 1992) nachgewiesen werden. Die
Bindungsfähigkeit der Spermadhäsine erstreckt sich über verschiedene Stoffe. Sie binden an
Serinproteaseinhibitoren (SANZ et al. 1992), O-Phosphorylethanolamin (DOSTALOVA et al.
1995b) und sulfatierte Glukosaminoglykane z.B. Heparin (CALVETE et al. 1996b). Da die
Spermadhäsine auch mit sehr hoher Affinität an Zuckerstrukturen binden, werden sie auch als
Lektine tituliert. Die Zuckerstrukturen Gal-β(1-3)-GalNAc und Gal-β(1-4)GlcNAc der O- und
N-glykosidisch verknüpften Oligosaccharide werden von AWN (DOSTALOWA et al. 1995b)
und AQN-1 und AQN-3 (CAVELTE et al. 1996a) erkannt. PSP-II hingegen weist eine hohe,
von divalenten Kationen (z.B. Ca2+) abhängige Bindungsaffinität für Mannose-6-Phosphat
auf.
Das Pro/Akrosin fungiert als Penetrationsenzym (TÖPFER-PETERSEN et al. 1990). Es liegt
bei intakten Spermien als die inaktive Vorstufe Proakrosin vor. Die Interaktion mit der ZP im
Rahmen der sekundären Bindung an die ZP nach der Akrosomreaktion bewirkt die
Umwandlung in das enzymatisch aktive Akrosin, welches dem Spermium die Penetration
durch die ZP erleichtert. Der Kontakt mit der ZP wird durch einen Polysulfat-
B Literaturübersicht
41
Erkennungsmechanismus vermittelt. Die basischen Aminosäuren des Pro/Akrosins agieren
dabei mit den laktosaminhaltigen N- und O-gebundenen Kohlenhydratstrukturen der ZP.
5.4. Die Zona pellucida nach der Befruchtung
Nach der Verschmelzung beider Gameten und ihrer Vorkerne bekommt die Zona pellucida
neue Aufgaben und unterliegt einer Umstrukturierung. Sie verhindert Aggregationen von
mehreren Blastomeren und zu frühe Kontaktaufnahme mit dem Eileiterepithel bzw. dem
Endometrium der Gebärmutter. Weiterhin schützt die Zona den Keimling vor mechanischen,
toxischen und mikrobiologischen Einflüssen bis zum Schlupf des Trophoblasten aus der ZP
mit anschließender Einnistung in die Gebärmutterschleimhaut (HERRLE u. BEIER 2000).
Nicht nur die ZP bildet eine Schutzhülle, auch die nach Freisetzung der kortikalen Granula
entstehende perivitelline Matrix (PVM) übernimmt Schutzfunktionen und scheint auch beim
Polyspermieblock beteiligt zu sein (DANDEKAR u. TALBOT 1995). Es ist bekannt, dass die
ZP von der ungereiften Eizelle bis zur Zygote in ihrer Zusammensetzung Veränderungen
erfährt (HEDRICK et al. 1987). Die Veränderungen werden u.a. durch den Kontakt zur
freigesetzten Granula der Eizelle und dem Eileitersekret hervorgerufen.
Die Granulasekrete bewirken eine Härtung (hardening) der Zona, die für den
Polyspermieblock, den Schutz der Blastocyste und den Transport durch den Eileiter von
Nöten ist. Mit der Härtung wird die ZP auch dünner, so dass der Schlupf des Embryos
erleichtert wird. Für den Aufbruch der ZP werden zum einen der Druck der Blastozyste selbst
und lytische Enzyme verantwortlich gemacht (SCHIEWE et al. 1995). Die Enzyme stammen
aus der Zygote und/oder dem Uterussekret.
Ein übermäßiges Zona hardening wurde bei der In-vitro-Kultur beobachtet, welches beim
Schlüpfen der Blastozyste aus der ZP im Uterus mit Problemen verbunden ist (DE VOS u.
VAN STEIRTEGHEM 2000). Zur Umgehung dieses Hindernisses wurden spezielle
mikroassistierende Methoden, und zwar mechanische, chemische und lasergesteuerte,
entwickelt. Zunächst wurden Schlupflöcher in die ZP gesetzt (Drilling) wie COHEN et al.
1989 beschreiben. Um einen besseren Schutz des Embryos zu gewährleisten, befassen sich
B Literaturübersicht___________________________________________________________
42
neuere Untersuchungen mit einer partiellen Ausdünnung der ZP (GORDON u. DAPUNT
1993).
Neben dem mechanischen Schutz durch das Hardening selektiert die ZP auch die Stoffe, die
bis zum Embryo vordringen können. Die Selektion scheint nicht nur über eine
Größenbegrenzung der Moleküle abzulaufen. Bei vielen Arten konnte gezeigt werden, dass
die ZP permeabel ist für Moleküle von einer Größe wie Immunglobuline ( z.B. GUILLOMOT
u. BETTERIGE 1984), beim Schwein hingegen scheint dies nicht der Fall zu sein
(STROBAND u. VAN DER LENDE 1990). Es wurde auch beobachtet, dass große Viren,
Bakterien, Pilze und einige Toxine die ZP nicht passieren können (EAGLESOME et al. 1980;
FLEMING et al. 1987). TURNER und HOROBIN (1997) konnten zeigen, dass der
physikochemische Charakter eines Moleküls über dessen Verbleib außerhalb, innerhalb oder
durch die ZP entscheidet.
Tab. 2: Beziehungen zwischen Moleküleigenschaften und der Zona pellucida
Moleküleigenschaften (vWW: van der Waal’sche-
Wechselwirkungen)
Abstoßung durch ZP
Anreicherung
innerhalb der ZP
Erreichen
des Embryos durch ZP
schwache vWW, stark hydrophil
vorhanden
nicht vorhanden
nicht vorhanden
starke vWW,
hydrophil
nicht vorhanden
vorhanden
nicht vorhanden
starke vWW,
lipophil
nicht vorhanden
vorhanden
vorhanden
schwache vWW,
lipophil/schwach hydrophil
nicht vorhanden
nicht vorhanden
vorhanden
Durch diese Selektion werden Signalstoffe von dem Mutterorganismus und von dem Embryo
akkumuliert und modifiziert. Die Zona pellucida wirkt also ähnlich einer Mailbox (HERRLE
u. BEIER 2000).
B Literaturübersicht
43
5.5. Antikörper gegen Zona pellucida als Immunokontrazeptiva
Es stellte sich bei einer Reihe von immunologischen Versuchen heraus, dass die ZP eine
starke Immunogenität besitzt. Ziel ist es nun eine Vakzine zu entwickeln, die reversibel nur
die normale Spermien-Zona pellucida-Bindung verhindert, aber keine Auswirkungen auf den
ovariellen Zyklus mit sich bringt. Es wurden Antikörper gegen verschiedene Epitope,
hauptsächlich von ZPC, auf ihre empfängnisverhütenden Eigenschaften getestet. Meist
wurden gute Kontrazeptionsraten erzielt, allerdings mit teilweise erheblichen unerwünschten
Nebenwirkungen, wie Eierstockentzündungen (HERRLE u. BEIER 2000). Es konnten zwar
auch durch gezieltere Auswahl der Antigenregion die unerwünschten Nebenwirkungen
minimiert werden, dies ging aber bei den Versuchen mit Primaten mit einer reduzierten
Kontrazeptivität einher.
Außerhalb der Primaten wurde vor allem heterologe ZP eingesetzt. Solubilisierte porcine
Zona pellucida als aktive Immunisierung wurde bei 27 Arten mit einer 90%igen Sicherheit,
gegebener Reversibilität und ohne Nebenwirkungen eingesetzt (KIRKPATRICK et al. 1996).
Einem breiten Einsatz zur Vermehrungskontrollen in den Wildtierpopulationen stehen noch
einige Probleme gegenüber. Einerseits sind für die Erstellung der heterologen Vakzine die
homologen Genabschnitte bei vielen Arten ein großer Vorteil, anderseits verhindern sie aber
auch den Einsatz von Impfungen mittels Fressköder (entsprechend der Tollwutimpfung für
Füchse in Deutschland). Fast jedes Tier würde durch den Fraß der Köder steril werden. Also
bleibt nur noch die gezielte Impfung und Markierung jedes einzelnen Tieres, welches
natürlich mit größeren Kosten und Aufwänden verbunden ist.
In neuerer Zeit wurden Versuche mit gentechnisch veränderten Mäusen durchgeführt.
Murines ZPC wurde durch humanes ZPC ersetzt und nach Verabreichung von Antikörpern
gegen hZP3 konnte eine langanhaltende, reversible Kontrazeption erreicht werden
(GREENHOUSE et al. 1999). Die Maus stellt somit ein gutes Testsystem für die Entwicklung
einer humanen Vakzine dar.
C Material und Methoden______________________________________________________
44
C Material und Methoden
1. Isolierung der Zona pellucida
1.1. Massenaufarbeitung
Zur Gewinnung der Zona pellucida im großen Rahmen wurde folgende Aufarbeitung
modifiziert nach DUNBAR et al. (1980) angewendet:
Ovarien von peripubertären Jungsauen wurden am Band eines Schlachthofes in gekühlte
Oozytenpufferlösung (s. Rezeptverzeichnis in J Anhang) gesammelt und bei – 20°C
eingefroren.
Am Vortag der eigentlichen Aufarbeitung wurden ca. 1,5 kg Ovarien über Nacht im
Kühlschrank in 1-2 Litern Oozytenpuffer aufgetaut.
Am nächsten Tag wurden Ovarien mit Gelbkörpern, Zysten etc. aussortiert und
Bindegewebsreste abpräpariert. Dann wurden die Ovarien mit einem Fleischwolf
(Körnungsdurchmesser 5mm; Scharfen) zerkleinert und mit kühlschrankkaltem
Oozytenpuffer versetzt (1/3 Ovarien zu 2/3 Puffer) und eine Stunde im Kühlschrank mittels
Magnetrührer gerührt.
Die anschließenden Filtrationsschritte fanden alle auf ständig eisgekühlten Gefäßen statt.
Die durchmischte Ovariensuspension filtert man über Nylonnetze mit abnehmender
Porengröße, und zwar 8mal mit 2000 µm, 3mal mit 1000 µm, 3mal mit 600 µm und 6mal mit
200 µm (Mondurnetze; Josef Hepfinger, München).
Es wurde stets der Durchfluss gesammelt, wobei die zerkleinerten Gewebereste, welche auf
den Netzen liegen blieben, während der ersten vier Filtrationsschritte nochmals je 10 Minuten
lang bei 4°C gerührt wurden.
Als abschließenden Schritt wurde ein Netz mit einer Porengröße von 80 µm verwendet. Hier
wurden nun die Rückstände, die sich beim zweimaligem Durchspülen auf dem Netz
gesammelt hatten, mit Puffer abgespült. Die aufgefangene Suspension lagert man über Nacht
im Kühlschrank, währenddessen die Oozyten, aber auch ein großer Teil des Zelldetritus, zu
Boden sinken.
C Material und Methoden
45
Am nächsten Morgen wurde der Überstand mit Hilfe einer Wasserstrahlpumpe abgesaugt.
Über eine Percoll-Dichtezentrifugation wurden Eizellen und Zelldetritus aus der
verbleibenden Suspension getrennt. Dafür wurden 50 ml Zentrifugengläser (Schott Duran®;
Carl Roth GmbH & Co., Karlsruhe) mit 5 ml 40%iger Percolllösung und je 10 ml 20%iger
und 10%iger Percolllösung (s. Rezeptverzeichnis in J Anhang) beschickt. Den Abschluss
bildeten 10 ml der ungereinigten Oozytensuspension. Nach erfolgter Zentrifugation (20 min.
bei 1900 xg; Megafuge 2.0 R, Heraeus, Hanau) wurden die Eizellen aus der 10%igen Percoll-
Schicht mittels Pipette abgesammelt.
Diese Suspension wurde durch ein 42,5 µm Netz filtriert und die auf dem Netz liegenden
Oozyten mit Aqua bidest. abgespült.
In fünf Tropfen von je 5 µl wurden die Oozyten und Zonae pellucidae unter einem
Stereomikroskop (Zeiss 4750 03, Jena) gezählt und der Durchschnittswert ermittelt. Anhand
dieser Zahl wurde eine Schätzung der Gesamtanzahl an Oozyten und Zonae in der
vorliegenden Suspension ermittelt.
Diese wurde anschließend durch einen Hub (Stroke) in einem 2 ml Potter (B. Braum AG,
Melsungen) homogenisiert, erneut durch ein 42,5 µm Netz filtriert, dieses mit Aqua bidest.
abgespült und die Flüssigkeit in 1,5 ml Eppendorfgefäße (Eppendorf, Sarstedt) überführt. Es
folgte eine Zentrifugation der Gefäße (für 15 min bei 4500 xg), der Überstand wurde
verworfen und die Zonae pellucidae nach und nach durch Resuspension in einem Gefäß
vereinig. Die weitere Lagerung erfolgte bei –20°C.
1.2. Gewinnung von Zonae pellucidae aus frischen Ovarien
Auf einem Schlachthof wurden am Versuchstag Ovarien von peripubertären Jungsauen in ein
auf 30°C angewärmtes Thermosgefäß gesammelt. Der Transport zum Labor erfolgte
innerhalb von ca. einer Stunde. Dort wurden die Ovarien sofort mit physiologischer
Kochsalzlösung (39°C) gespült. Anschließend wurden Follikel mit einem Durchmesser von 2-
5 mm und heller, durchsichtiger Oberfläche mit einer Aspirationsnadel (18-gauge; Mikrolance
3, Dickinson) punktiert. Die Nadel war über ein Schlauchsystem und einem Adapter mit
einem sterilen Auffanggefäß verbunden (50 ml Zentrifugenröhrchen, Greiner GmbH,
C Material und Methoden______________________________________________________
46
Frickenhausen), welches mit einer Unterdruckpumpe (20 mmHg) gekoppelt war. Die
Follikelflüssigkeit in dem Auffanggefäß mit den Kumulus-Oozyten-Komplexen (KOK)
wurde nach der Punktion mit Spülmedium (s. Rezeptverzeichnis in J Anhang) auf ca. 50 ml
aufgefüllt und zur Sedimentation stehen gelassen. Nach 10 min wurde der Überstand
abgegossen und das Sediment wieder mit Spülmedium gewaschen. Nach weiteren 10 min
wurden nach Abgießen des Überstandes drei ml des Sedimentes in einer Petrischale
(Durchmesser 94 mm) mit 10 ml PBS (s. Rezeptverzeichnis in J Anhang) verdünnt.
Unter einem Stereomikroskop (20-50fache Vergrößerung) wurden die KOK nach
morphologischen Kriterien beurteilt und klassifiziert. Die Einteilung wurde nach den von
LEIBFRIED und FIRST (1979) aufgestellten Kriterien hinsichtlich der Integrität der Zona
pelllucida, der Zahl der Kumuluszellschichten, der strukturellen Homogenität und der
einheitlichen Färbung des Zytoplamas vorgenommen. Für die Versuche wurden KOK
ausgewählt, die mindestens drei kompakte Kumuluszellagen und keine expandierte
Kumulusschicht besaßen. Die ausselektierten KOK wurden zweimal im Spülmedium
gewaschen und in einer kleinen Petrischale (35 mm) gesammelt.
Wurden ungereifte Zonae pellucidae benötigt, so wurden die KOK zur Denudierung durch
mehrmaliges Aufziehen und Ausspülen mit einer ausgezogenen Mikropipette mechanisch von
den Kumuluszellen befreit. Zur Isolierung der Zona pellucida wurde die Eizelle erneut mittels
einer Mikropipette, deren Durchmesser ca. ein Drittel kleiner als der einer Oozyte sein sollte,
aufgezogen und ausgespült, so dass die Eizelle und die Zona pellucida durch den
mechanischen Defekt, der durch die Scherkräfte entsteht, von einander getrennt wurden.
Die Zona pellucida konnte nun für weitere Versuche verwendet werden oder wurde in Aqua
bidest. bei -20°C eingefroren. Alternativ konnten auch die denudierten Eizellen in einer
hyperosmolaren Salzlösung (s. Rezeptverzeichnis in J Anhang) bei 4°C bis zu drei Monaten
gelagert werden.
Am Versuchsvortag wurden sie dann in PBS/2% PVA gewaschen, die Zona pellucida
mechanisch isoliert und in PBS/2% PVA im Kühlschrank bis zum nächsten Tag aufbewahrt.
C Material und Methoden
47
1.3. In-vitro-Maturation der Oozyten
Die wie unter 1.2. beschrieben selektierten KOK wurden in äquilibrierten Maturationsmedium
(s. Rezeptverzeichnis in J Anhang) dreimal gewaschen. Die Reifung erfolgte in five well
dishes (Embryokulturschale mit fünf Vertiefungen; Minitüb, Tiefenbach) mit je 500 µl
Maturationsmedium in den Vertiefungen. Zur Äquilibrierung wurden die Schalen einige
Stunden vor Gebrauch bei 38,5 °C und 5% CO2 in feuchtigkeitsgesättigter Luft in einem
Inkubator (Nuaire NU 2700 E, Zapf Instrumente, Sarstedt) einige Stunden vorinkubiert.
Es wurden jeweils 50 KOK in eine Vertiefung verbracht und zur Supplementierung Hormone
(PMSG/hCG) und db-cAMP hinzugegeben. Die Reifung erfolgte bei 38,5°C und 5% CO2
über 44-46 Stunden. Nach den ersten 24 Stunden wurden die KOK in Maturationsmedium
ohne Supplementierung umgesetzt.
Nach Ende der Reifungszeit wurden die KOK aus dem Maturationsmedium entnommen und
in einem Spülmedium (PBS/2% PVA) mehrmals gewaschen. Durch mehrmaliges Pipettieren
mit einer 100 µl Eppendorf-Pipette wurde eine grobe Ablösung der Kumuluszellen erreicht.
Die Eizellen konnten nun in einer hyperosmolaren Salzlösung bei 4°C gelagert werden oder
sie wurden mittels ausgezogener Mikropipette feindenudiert und die Zonae pellucidae isoliert.
Diese konnten bei Bedarf bei –20°C eingefroren werden.
1.4. Überprüfung des Kernreifungsstatus
Die Darstellung des Meiosestadiums erfolgte modifiziert nach HANCOCK (1958). Die
denudierten Eizellen, jeweils Stichproben des entsprechenden Eizellpools, wurden in 0,7 %ige
Kaliumchloridlösung für fünf Minuten inkubiert. Die Eizellen wurden nun in einem ca. 50 µl
großen Tropfen der Kaliumchloridlösung auf Deckgläschen mittig platziert. In die Ecken gibt
man als Abstandshalter „Paraffin-Vaseline-Füßchen“ (9 Teile Vaseline u. 1 Teil Paraffin). Ein
fettfreier Objektträger wurde nun so an den Tropfen mit den Eizellen herangeführt, so dass
sich dieser am Objektträger „fängt“ und dann der Objektträger mit dem anhaftenden Deckglas
umgedreht.
C Material und Methoden______________________________________________________
48
Die Fixation der Eizellen erfolgte für mindestens 24 Stunden in einer frisch angesetzten
Lösung aus einem Teil Essig und drei Teilen Ethanol. Anschließend legt man das Präparat für
30 min in reinen Alkohol. Zur Färbung wurde ein Tropfen 2%iger Orceinlösung neben das
Deckglas gegeben, welcher durch die Kapillarkraft unter das Deckglas gezogen wurde. Nach
dem gleichen System wurde nach zwei Minuten mit 25%iger Essigsäure überschüssiger
Farbstoff abgewaschen. Der Fluss der Säure wurde durch ein saugfähiges Tuch am
gegenüberliegendem Rand des Deckglases verstärkt. Die Beurteilung des Kernstatus erfolgte
mit einem Phasenkontrastmikroskop (Zeiss 1697, Jena) bei 200-400-facher Vergrößerung.
2. Elektrophoretische Auftrennungen
2.1. Eindimensionale SDS-Polyacrylamid-Gelelelektrophorese der ZP
Für die Gelelektrophorese musste zunächst eine Probenaufarbeitung erfolgen. Die in Aqua
bidest., pH 8,0 eingestellt mit Natronlauge, vorliegenden Zonae pellucidae (ZP) wurden in
einem Heizblock für zwei Stunden bei 72°C solubilisiert. Anschließend zentrifugiert man das
Gemisch für 10 min bei 15.000 xg scharf ab, um nicht gelöste Anteile abzutrennen.
Der Überstand konnte für die Analysen verwendet werden.
Die Proteinkonzentration wurde bei einer nicht genau definierten Anzahl an Zonae pellucidae,
beispielsweise wenn sie durch die Massenaufarbeitung gewonnen wurden, mittels Messung
der Optischen Dichte (OD) ermittelt und dafür die Extinktion bei einer Wellenlänge von 280
nm bestimmt.
Nach folgender Formel wurde dann die Kozentration der ZP-Lösung bestimmt:
gemessene OD bei 280 nm Konzentration der ZP-Lösung = ____________________________________ 1,17 (1 mg/ml ZP ≈ 1,17 OD)
C Material und Methoden
49
Die eindimensionale SDS-Polyacrylamid-Gelelektrophrese (1D-PAGE) wurde in
modifizierter Form mit der nach LAEMMLI (1970) beschriebenen Methode durchgeführt.
Hierbei wurden die Proteine gemäß ihrer Netto-Ladung, Größe und Gestalt durch das Anlegen
eines elektrischen Feldes getrennt. Durch die Einstellung der Porengröße des sehr stark
vernetzte Polyacrylamidgels, welches als trennende Matrix fungiert, kann die
Wanderungsstrecke eine optimale Trennung der Proteine in einem bestimmten
Molekulargewichtsbereich ermöglichen. Anhand eines mitlaufenden Standards können die
Molekulargewichte neuer, unbekannter Proteine ermittelt werden.
Es wurden selbsthergestellte, 0,75 mm starke, 10%ige (s. Rezeptverzeichnis in J Anhang) und
6 x 8,3 cm große Polyacrylamidgele verwendet. Diese wurden nach Polymerisierung mit
einem 4,5%igem Sammelgel überschichtet, in dem durch den Einsatz eines
Kunststoffkammes jeweils zehn Taschen zur Probenaufnahme ausgeformt wurden.
Die Proben zur Analyse wurden im Verhältnis 1:2 mit Laemmli-Auftragspuffer (s.
Rezeptverzeichnis in J Anhang) verdünnt, fünf Minuten bei 95°C erhitzt und eine Minute bei
13.000 xg zentrifugiert. Ebenso wurde mit dem Standard LMW (Low Molecular Weight
Proteinstandard, 161-0304; BioRad, München) verfahren. Sollten im Anschluss an die 1D-
PAGE die Proteine auf eine PVDF-Membran transferiert werden, so wurde ein biotinylierter
LMW Standard (161-0306; BioRad, München) verwendet.
Die Trennung der Proteinproben erfolgte in einer Elektrophoresekammer (Mini-Protean II;
BioRad, München), welche mit Laufpuffer (s. Rezeptverzeichnis in J Anhang) gefüllt wurde.
Während der Passage der Proben des Sammelgeles (Marker: Bromphenolblau) startet man
den Elektrophoreselauf mit 100 V, im Trenngel wird auf 200 V erhöht. Der Lauf wurde mit
dem Auslaufen des Frontmarkers am unteren Rand beendet.
Die aufgetrennten Polypeptide wurden nun für weitere Analysen auf eine PVDF-
Blotmembran transferiert oder wurden direkt auf dem Gel angefärbt Coomassie-Färbung
detektiert.
Dazu wurden die Gele für ca. 30 min bei Raumtemperatur in der Färbelösung (0,25%
Coomassie Brilliant Blue R (Nr. 35051; Serva, Heidelberg); 40% Methanol; 10% Eisessig)
leicht geschwenkt. Zur Entfärbung des Hintergrundes wurden die Gele unter leichtem
Schütteln in einer Entfärbelösung (20% Methanol; 10% Eisessig), welche mehrmals
C Material und Methoden______________________________________________________
50
gewechselt wurde, gewaschen. Das Gel wurde zwischen zwei Cellophanseiten (Gel Drying
Film; Promega, Madison) getrocknet.
Anhand der 1D-PAGE wurden die Zona pellucida-Proben auf ihre Reinheit überprüft und die
molekularen Massen ihrer Polypeptide ermittelt.
2.2. Zweidimensionale SDS-Polyacrylamid-Gelelektrophorese der ZP
Bei der zweidimensionalen SDS-Polyacrylamid-Gelelektrophorese (2D-PAGE) werden die
Proteine nicht nur nach der molekularen Masse, sondern auch nach ihrem isoelektrischen
Punkt aufgetrennt. Die beiden Auftrennungskriterien stehen im Gel senkrecht zueinander, so
dass ein zweidimensionales Trennungsbild entsteht. In einem Gel mit linearem pH-Gradienten
wandern die geladenen Substanzen nach Anlegung einer elektrischen Spannung an eine
Position, die ihrem isoelektrischen Punkt entspricht. Der isoelektrische Punkt (IP) ist der pH-
Wert einer Lösung, bei dem die Dissoziation der basischen und sauren Gruppen eines
amphoteren Stoffes gleich stark und folglich die Summe der Ladungen gleich Null ist.
Die isoelektrische Fokussierung (IEF) der ersten Dimension wurde mittels des Multiphor II
Systems (Amersham Pharmacia Biotech, Uppsala, Schweden) durchgeführt. Dazu wurden
immobilisierte pH-Gradienten-Gele (IPG) mit einem linearen pH-Gradienten von pH 3 bis pH
10 mit einer Länge von 7 cm (Immobiline DryStrips; Amersham Pharmacia Biotech, Uppsala,
Schweden) verwendet.
Die zu untersuchende Zona pellucida-Probe wurde nach der Solubilisierung im SpeedVacPlus
(Sc 110 A; Servant, Incorporated, New York, USA) auf 15 µl eingeengt, welche anschließend
mit Rehydrationslösung (s. Rezeptverzeichnis in J Anhang) auf 125 µl aufgefüllt wurde.
Diese Lösung gibt man in einem der Länge des IPG-Strips entsprechenden IPGphor Strip
Holder (Amersham Pharmacia Biotech, Uppsala, Schweden). Der aufgetaute IPG-Strip wurde
vorsichtig aufgelegt und mit ca. 250 µl Mineralöl überschichtet.
Die Fokussierung wurde bei 20°C durchgeführt und nach einem ausgearbeitetem Programm
(15 h Rehydration bei 50 V, 1 h bei 150 V, 1 h bei 500 V, 1 h bei 1000 V und in der letzten
Stufe bei 4000 V bis zum Erreichen von 20.000 Vh) gestartet.
C Material und Methoden
51
Am Tag nach der Fokussierung (Dauer ca. 24 h) ist es möglich, die Streifen mit den
fokussierten Proteinen bei –80°C einzufrieren. Bei den beschriebenen Versuchen wurde
jedoch darauf verzichtet und die zweite Dimension gleich angeschlossen.
Für die zweite Dimension, die PAGE, muss der IPG-Strip erst in einer Lösung bei
Raumtemperatur unter Schütteln äquilibriert werden. Für die ersten 15 Minuten gibt man
DTT und für die nächsten 15 Minuten Jodacetamid zu der Äquilibrierlösung (s.
Rezeptverzeichnis in J Anhang). Um eine Reduktion und die damit verbundene Aufspaltung
von Proteinen zu vermeiden, wurde nach einigen Versuchen auf den Zusatz von DTT
verzichtet.
Die Gele und die Vorbereitung des Proteinstandards für die 2D-PAGE entsprachen denen der
1D-PAGE, lediglich wurde für die Formung der Taschen ein anderer Kunststoffkamm
verwendet, so dass eine Tasche für den Standard und eine sieben cm lange Tasche für den
IPG-Strip geschaffen wurde. Der äquilibrierte Gelstreifen wurde mittels Laemmli-
Auftragspuffer so in die Geltasche eingeschoben, dass die Anode (pH 3) an der Seite mit den
Molekulargewichtsstandardproteinen positioniert wurde. Der Streifen wurde abschließend mit
erhitzter flüssigen 0,3%igen Agarose überschichtet.
Der Elektrophoreselauf wurde mit 100 V gestartet und mit Erreichen der Front des Trenngels
auf 200 V erhöht.
Die doppelt aufgetrennten Proteine wurden entweder auf eine Blotmembran übertragen, oder
mit einer Silberfärbung, welche sensitiver als die Coomassie-Färbung ist, angefärbt.
Bei der Silberfärbung wurde eine modifizierte Methode nach HEUKESHOVEN (1988)
angewendet. Zunächst wurden die Gele über Nacht in 12,5% Trichloressigsäure fixiert.
Anschließend wurden sie viermal für 10 Minuten mit Aqua bidest. auf einer Schüttelbank
gewaschen und für 60 Minuten in der Inkubationslösung (s. Rezeptverzeichnis in J Anhang)
geschwenkt. Nach erneuter Waschung (6 x 10 min in Aqua bidest.) schloss sich der
30minütige Färbevorgang (s. Rezeptverzeichnis in J Anhang) an. Die Gele wurden nun nach
kurzem Schwenken in Aqua bidest. in der Entwicklerlösung (s. Rezeptverzeichnis in J
Anhang) bis zum gewünschten Ergebnis (sec-min) gefärbt. Die Farbreaktion wurde durch
eine Stopplösung (0,05 M Glycin) beendet. Nach 5-10 min konnten die Gele in Wasser
gelagert und anschließend getrocknet werden.
C Material und Methoden______________________________________________________
52
3. Immuno- und lektinologische Analyse der ZP Glykoproteine am Proteinblot
3.1. Chemilumineszenzverfahren
Nachweise von Proteinen mittels Antikörpern und von Kohlenhydratstrukturen durch Lektine
sind sehr empfindliche Verfahren in der Biochemie, die eine Charakterisierung von sehr
geringen Glykoproteinmengen erlauben.
Für die gewählte Versuchsanordnung mussten die Proteine von einem Gel nach
elektrophoretischer Auftrennung auf eine Membran durch ein Blotting-Verfahren transferiert
werden.
Die vorliegenden Versuche wurden nach der von TOWBIN et al. (1979) beschriebenen
Methode durchgeführt. In einem Semidry-Apparatus (Biometra, Göttingen) wurde unter
Wasserkühlung (1 l/min) auf PVDF-Membranen (Nr. 1722026; Boeringer Mannheim,
Mannheim) geblottet. Die 6 x 8,3 cm große Membran wurde vor ihrer Verwendung für 30 sec
in 100% Methanol geschwenkt, kurz in Aqua bidest. gewaschen und für 2-3 min in
Blottingpuffer (s. Rezeptverzeichnis in J Anhang) äquilibriert.
Das Blotten erfolgte in einem Sandwichverfahren. Dieses „Sandwich“ bestand dabei von
unten nach oben aus drei Lagen in Blottingpuffer getränktem Blotpapier (GB 003;
Schleicher&Schell, Dassel), der Membran, dem Gel und erneut drei Lagen getränktem
Blotpapier. Nach der Positionierung dieses „Sandwiches“ zwischen den beiden mit
Blottingpuffer angefeuchteten Graphitplatten des Semidry-Apparatus wurde bei konstantem
Strom (1mA/cm2) für zwei Stunden bei Raumtemperatur geblottet.
Der Bloterfolg wurde durch eine Anfärbung mit Ponceau Rot (s. Rezeptverzeichnis in J
Anhang) für fünf min und anschließender Entfärbung mit Aqua bidest. überprüft. Es handelt
sich dabei um eine reversible Färbung, die die weiteren Reaktionen nicht beeinflusst.
Für die immunologischen und die lektinologischen Untersuchungen wurden die Membranen
über Nacht in TBS/ Tween 1% (v/v) bei 4°C blockiert, um unspezifische Bindungen zu
verhindern.
Am nächsten Tag wurden die Membranen mit Antikörpern bzw. biotinylierten Lektinen
inkubiert (siehe 3.2 u. 3.3.) und die Reaktionen mittels einem Peroxidase-Chemilumineszenz-
Verfahren detektiert.
C Material und Methoden
53
Nach der Inkubation mit horse radish-peroxidase (HRPO) gekoppelten Reagenzien wurden
die Membranen in eine durchsichtige Plastikfolie mit 3 ml working solution des
Chemilumineszenz-Substrates (Super Signal West Pico; Pierce über KMF Laborchemie, St.
Augustin-Buisdorf) eingeschweißt und für fünf Minuten leicht geschwenkt. Danach wurde
das Substrat aus der Folie ausgestrichen und diese erneut zugeschweißt. Die Membran wurde
mit Klebefilm in einer Röntgenkassette befestigt.
In einer Dunkelkammer mit röntgenfilmgeeigneter Lichtquelle (Lampenfilter 6BX-2 Safe
Light; Kodak GmbH, Stuttgart) wurde ein Röntgenfilm (XAR-5; Kodak GmbH, Stuttgart)
belichtet, in dem er auf die Membran platziert wurde. Je nach Reaktionsintensität reichten im
Durchschnitt 10-30 sec für die Belichtungszeit aus. Der Film wurde ca. 30 sec im
Entwicklungsbad (G 150; Agfa Deutschland, Köln) geschwenkt, kurz in einem Stoppbad
(Aqua bidest. mit einem Spritzer Essig) gewaschen, mindestens eine Minute im Fixierbad (G
350; Agfa Deutschland, Köln) fixiert und schließlich für fünf Minuten gewässert. Die
Trocknung des Röntgenfilmes wurde hängend und lichtgeschützt vorgenommen.
Die Vorteile der Chemilumineszenz sind, dass man ein hochempfindliches Detektionssystem
hat und durch veränderbare Belichtungszeiten unterschiedlich intensive Bilder von einer
Membran erhält. Ferner kann man die Membran für andere Analysen weiter verwenden. Dazu
wurde die Membran nach der Chemilumineszenz aus der Folie genommen und zweimal in
TBS/Tween 1% (v/v) gewaschen und in 3 M Kaliumthiocyanatlösung (Merck, Darmstadt)
zum „Abstrippen“ gegeben. Dies dauert bei Antikörpern 1-2 Tage, bei Lektinen erreicht man
in diesem Zeitraum eine Reduktion/Eliminierung möglicher unspezifischer
Hintergrundbindungen. Ein vollständiges „Abstrippen“ der Lektine ist nur bei einigen
schwach bindenden nach ca. 5-7 Tagen möglich. Zur Kontrolle des „Striperfolges“ wurden
die Membranen wieder gewaschen und blockiert. Anschließend folgte eine Inkubation mit
Peroxidase gekoppeltem Streptavidin oder Peroxidase gekoppeltem Zweitantikörper. Die
Chemilumineszenz wurde dann erneut wie beschrieben durchgeführt. Der biotinylierte
Standard bietet dabei eine gute Systemkontrolle, da Streptavidin an das Biotin bindet.
C Material und Methoden______________________________________________________
54
3.2. Immunologische Identifizierung der Glykoproteine der ZP
Zur Charakterisierung der einzelnen Glykoproteine der Zona pellucida nach der Auftrennung
durch die 1D- und 2D-PAGE wurden unterschiedliche Antikörper gegen die einzelnen
Glykoproteine bzw. deren Sequenzausschnitte verwendet.
Zum Einsatz kamen zwei verschiedene polyklonale Antikörper, die gegen ZPB (pZP3α) und
ZPC (pZP3β) gerichtet sind. Diese Antikörper werden hier im weiteren AK ZPB und AK
ZPC genannt.
TÖPFER-PETERSEN et al. (1993) erhielten diese Antikörper, indem nach Solubilisierung,
Auftrennung über HPLC-Chromatographie und Endo-β-Galactosidase-Spaltung porcines ZPB
und ZPC isoliert werden konnten. Mit diesen beiden Proteinanteilen wurden Hühner
immunisiert und aus den Eiern wurden die gebildeten Antikörper gewonnen.
Von Frau Prof. Dr. Elvira Hinsch, Zentrum für Dermatologie und Andrologie der Justus-
Liebig-Universität Gießen, wurden freundlicher Weise Antikörper, die gegen synthetische
Peptidsequenzen der Zona pellucida gerichtet sind, zur Verfügung gestellt. Es handelt sich
dabei um Sequenzen, die homolog in verschiedenen Säugetieren vorhanden sind (vgl.
HARRIS et al. 1994). Die Antiseren wurden in Kaninchen hergestellt und werden hier als AK
ZPA-20 (gegen Peptidsequenz D-P-N-I-K-L-V-L-D-D-C-W-A-T-S in ZPA) und AK ZPC-5a
(gegen P-I-E-C-R-Y-P-R-Q-G-N-V-S-S in ZPC) bezeichnet.
Die immunologischen Versuche wurden mit auf PVDF-Membranen transferierten Proteinen
von ungereiften und gereiften Zonae pellucidae sowohl nach 1D-PAGE, als auch nach 2D-
PAGE Auftrennung durchgeführt.
Nach Blockierung der Membranen mit TBS/Tween 1% über Nacht bei 4°C wurden die
Membranen eine Stunde mit den Antikörpern (Verdünnungsstufen siehe Tab. 3) inkubiert. In
Folge des dreimaligen Waschens mit TBS/Tween 1% für jeweils 10 min wurden die
Membranen mit dem entsprechenden Zweitantikörper, der HRPO-gekoppelt war, für eine
weitere Stunde inkubiert. Anschließend wurde wieder 3 x 10 min gewaschen.
Zur Markierung des biotinylierten Molekulargewichtsstandards wurde die Membran noch mit
HRPO-Streptavidin behandelt.
Die folgenden Waschprozesse und die Entwicklung per Chemilumineszenz entsprachen der
schon beschriebenen Vorgehensweise (siehe 3.1.).
C Material und Methoden
55
Tab. 3: Verwendete Antikörper
Erstantikörper
Verdünnung in
TBS/Tween 1% (v/v)
Zweitantikörper
Verdünnung in
TBS/Tween 1% (v/v)
AK ZPB
1 : 3.000 HRPO-AntiChicken (Dianova, Hamburg)
1 : 10.000
AK ZPC
1 : 10.000
HRPO-AntiChicken (Dianova, Hamburg)
1 : 10.000
AK ZPA-20
1 : 50
HRPO-AntiRabbit (Dianova, Hamburg)
1 : 5.000
AK ZPC-5a
1 : 100
HRPO-AntiRabbit (Dianova, Hamburg)
1 : 5.000
Zum Nachweis der Spezifität wurden auch Versuche mit den entsprechenden Präimmunseren
statt der Antiseren durchgeführt.
3.3. Lektinologische Analyse der Kohlenhydratstrukturen der ZP
Die lektinologischen Untersuchungen der Glykoproteine der Zona pellucida wurden sowohl
an 1D-PAGE- als auch an 2D-PAGE-Membranen durchgeführt. Dabei wurden zum einem
ungereifte (GV I) und zum anderen in-vitro-gereifte (Metaphase II) Zonae pellucidae
verwendet.
Nach der Blockierung der Membranen in TBS/Tween 1% über Nacht bei 4°C wurden die
Membranen mit biotinylierten Lektine (Vektor über Alexis Deutschland, Grünberg), 5µg/ml
in TBS/Tween 1%, unter leichtem Schwenken für 30 bis 60 Minuten bei Raumtemperatur
inkubiert. Dann wurden sie 3 x 10 min lang in TBS/Tween 1% (v/v) kräftig gewaschen, um
die überschüssigen Lektinanteile zu entfernen. Anschließend wurde die Membran mit HRPO-
Streptavidin (Horse radish peroxidase conj. Streptavidin; Dianova, Hamburg), 1:20.000
verdünnt in TBS/Tween 1%, für 30 Minuten inkubiert und 6 x 5 min gewaschen. Dann wurde
die beschriebene Chemilumineszenz durchgeführt.
C Material und Methoden______________________________________________________
56
Tab. 4: Nomenklatur und Spezifität der verwendeten Lektine (aggl. → agglutinin)
Gruppe
Lektin
Abk.
Spezifität I Gluc/Man
Concanavalin A aggl. Con A α-D-Man; α-D-GlcNAc
Datura stramonium aggl. DSA [Gal-β(1-4)-GlcNAc]N II GlcNAc Ricinus communis aggl. I RCA I Gal-β(1-4)-GlcNAc
Griffonia simplicifolia aggl. I GS I α-D-Gal, α-D-GalNAc
Peanut aggl. PNA Gal-β(1-3)-GalNAc; α/β-Gal
Erythrina cristagalli aggl. ECA α/β-Gal; α/β-GalNAc; Gal-β(1-4)-GlcNAc
III GalNAc/ Gal
Artocarpus integrifolia Aggl. Jacalin Gal-β(1-3)-GalNAc
IV L-Fuc
Anguilla Anguilla aggl. AAA Fuc-α(1-6)-GlcNAc
Maackia amurensis aggl. II MAA II NeuNAc-α(2-3)-Gal
Amaranthus caudatus aggl. ACA NeuNAc-α(2-3/6)-Gal-β(1-3)-GalNAc
V Neuramin- säure Sambucus nigra aggl. SNA NeuNAc-α(2-6)-Gal;
NeuNAc-α(2-6)-GalNAc
Zur Kontrolle der Spezifität der Lektinbindungen wurden in weiteren Versuchen den Lektinen
gemäß einer kompetitiven Hemmung die entsprechenden Zucker während des ersten
Inkubationsschritts mit der Membran zugesetzt.
Tab. 5: Lektine mit den verwendeten Hemmzuckern und ihrer eingesetzten Konzentration
Lektin
Hemmzucker
Konzentration Con A α-Methylmannopyranosid 0,5 M GS I; PNA; Jacalin Galaktose 0,5 M ECA; RCA I; ACA Laktose 0,5 M DSA Chitotriose 0,2 M AAA α-L-Fukose 0,5 M SNA; MAA II Sialyllaktose 0,2 M
C Material und Methoden
57
4. Rasterelektronenmikroskopie
Darstellung von Lektinen an Oozyten mittels Silverenhancement in der REM Zur Analyse der räumlichen Verteilung der oberflächlichen Kohlenhydratstrukturen der Zona
pellucida Glykoproteine ist es möglich, intakte Oozyten mit Lektinen zu beladen.
Die ultramorphologische Darstellung der Zona pellucida mit gebundenen Lektinen wurde
mittels Rasterelektronenmikroskopie (REM) ermöglicht, mit der sich Objekte mit großer
Tiefenschärfe (Plastizität) darstellen lassen. Diese Versuche wurden im Zentrum für
Anatomie der Georg-August-Universität Göttingen in Kooperation mit Herrn Dr. P. Schwartz
und Herrn Prof. Dr. H. W. Michelmann (Zentrum für Frauenheilkunde) durchgeführt.
Die Technik entsprach einer modifizierten Methode nach SCHWARTZ et. al. (1996).
Um die gebundenen Lektine in der REM sichtbar machen zu können, verwendete man eine
Silverenhancement-Methode. Die Silverenhancement-Technik beruht darauf, dass eine
Silberlösung kleine Goldpartikel (Durchmesser 10 nm) auf etwa 250 nm „wachsen“ lassen
kann. Diese Partikelgröße lässt sich dann im REM gut auswerten.
Die Eizellen für die REM wurden nach Grobdenudierung mit einer 100 µl Eppendorfpipette
in hyperosmalarer Salzlösung bei 4°C gelagert. Zum Einsatz kamen ungereifte Oozyten, die
wie unter 1.2. beschrieben gewonnen worden waren.
Die in hyperosmolarer Salzlösung gelagerten Oozyten wurden in PBS gewaschen und für
zwei Stunden in 2,25 % Glutaraldehyd/0,1 M Cacodylatpuffer fixiert. Anschließend wurden
sie zweimal für 10 min mit PBS gewaschen und mit biotinylierten Lektinen (Konz. 10µg/ml)
für zwei Stunden inkubiert. Es folgte ein erneuter zweimaliger Waschvorgang mit PBS für je
10 Minuten und eine weitere Inkubation für anderthalb Stunden mit goldgekoppeltem
Streptavidin (Goldpartikelgröße 10nm; Plano W. Plannet GmbH, Wetzlar). Nachdem die
Eizellen mehrmals gewaschen worden waren, wurden sie in einer Silberlösung (LM/EM
Silver Enhancing Kit; Plano W. Planet GmbH, Wetzlar) für 35 Minuten kultiviert. Nach
erneutem Waschen wurden die Eizellen auf Glasplättchen aufgesetzt, in einer Alkoholreihe
dehydriert und in einem Polaron-Trockner (Polaron, Waterford, England) getrocknet. Für die
Analyse mit einem Rasterelektronenmikroskop (DSM 960 Zeiss, Oberkochen) wurden die
C Material und Methoden______________________________________________________
58
Präparate auf einem Aluminiumträger befestigt und mit Gold/Pallladium bedampft (Cool
sputter coater SC510; Fisions Instruments, England).
Die folgende REM-Analyse der Verteilung der Partikel wurde per Foto dokumentiert.
Zum Einsatz kamen die Lektine AAA und Con A. Die Spezifität der Bindungen wurden mit
Hemmversuchen in Parallelansätzen mit den entsprechenden Zuckern (AAA → α-L-Fukose;
Con A → α-Methylmannopyranosid) überprüft. Die Oozyten wurden dazu in der jeweiligen
Zuckerlösung (0,2 M) für 30 Minuten vorinkubiert. Der Lektinlösung und dem Waschpuffer
wurden gleichermaßen ebenfalls der Hemmzucker (0,5 M) zugesetzt.
5. Funktioneller Vergleich von ZP ungereifter und in vitro gereifter Oozyten
Zur Untersuchung des funktionellen Einflusses des Reifungsgrades der Zona pellucida wurde
ein Spermien-ZP-Bindungstest entwickelt. Mit diesem Assay konnte die Fähigkeit der ZP, die
Akrosomreaktion zu induzieren, beurteilt werden. Als Spermienpopulationen wurden
ejakuliertes Frischsperma und kryokonserviertes Nebenhodensperma einer Charge verwendet.
5.1. Aufbereitung der Spermien
Frischsperma:
Es wurde die spermienreiche Phase eines Institutsebers gewonnen und Volumen, Aussehen,
Dichte, Motilität, Morphologie, Vitalität und Akrosomstatus bestimmt. Zur Selektion der
motilen Spermien und Entfernung des größten Teils an Seminalplasma wurde ein Swim-up
durchgeführt. Dazu wurden acht Zentrifugenröhrchen (20ml mit rundem Boden; Sarstedt,
Niembrecht) mit 10 ml vorgewärmten Androhep-Puffer (s. Rezeptverzeichnis in J Anhang)
mit je einem ml der spermienreichen Phase unterschichtet und für 45 Minuten bei 37°C in
einem Wasserbad (Typ 1012, Gesellschaft für Labortechnik, Burwedel) inkubiert. Nach dem
Swim-up wurde die motile Spermienfraktion aus dem oberen Drittel der Röhrchen
entnommen und zur Konzentration zentrifugiert (5 min bei 550 xg; Megafuge 2.0 R, Haraeus,
C Material und Methoden
59
Hanau). Das Spermienpellet wurde mit modifizierter Tyrodelösung (s. Rezeptverzeichnis in J
Anhang) aufgeschwemmt. Mittels Zählkammer nach Thoma wurde die Dichte auf 107
Spermien pro ml eingestellt.
Tiefgefriersperma:
Als Tiefgefrier-(TG)-Sperma wurden freundlicher Weise 0,25 ml Pailletten (Minitüb GmbH,
Landshut) mit je 50 Millionen Nebenhodenspermien von der Arbeitsgruppe Prof. Dr. D. Rath
(Forschungsanstalt für Landwirtschaft, Mariensee) zur Verfügung gestellt. Die in flüssigem
Stickstoff gelagerten Pailletten wurden für 30 sec in einem 37°C warmen Wasserbad
aufgetaut. Zur Entfernung des TG-Verdünners wurde jeweils der Inhalt von zwei Pailletten in
10 ml Androhep-Puffer bei 550 xg für fünf Minuten zentrifugiert. Das Pellet wurde in
modifizierter Tyrodelösung resuspendiert und die Dichte ebenfalls auf 107/ml eingestellt.
5.2. Spermatologische Untersuchung
Die Frischsamenproben wurden nach Gewinnung untersucht auf Aussehen, Motilität, Dichte,
Morphologie, Vitalität und Akrosomstatus. Nach der Resuspendierung, Dichteeinstellung und
folgender 15minütigen Äquilibrierung im Brutschrank (Nuaire US Autoflow; Zapf,
Langenhagen) bei 38,5°C und 5% CO2 wurden die Spermien erneut auf Motilität und Vitalität
untersucht und der akrosomale Status bestimmt. Die Untersuchungen des TG-Spermas
erfolgten analog.
Die primären Analysen (alle Punkte bis auf Vitalität und Akrosomstatus) wurden mit einem
Phasenkontrastmikroskop (Zeiss 1697, Jena) durchgeführt. Die verwendeten Deckgläser,
Objektträger und Pasteurpipetten wurden auf einem Heiztisch (Minitüb GmbH, Landshut) bei
38°C vorgewärmt. Ebenso war die Wärmeplatte des Mikroskops angewärmt.
- Makroskopische Beurteilung
Die Ejakulate wurden nach ihrer Farbe (grau bis weiß) und ihrer augenscheinlichen Dichte
(wässrig-molkig, molkig-milchig, und milchig-rahmig) eingestuft.
- Motilitätsbestimmung
Im nativen Ejakulat und in den Inkubationsmedien wurde der Prozentsatz der motilen
Spermien geschätzt. Als motil galten sowohl die vorwärts- als auch die ortsbeweglichen
C Material und Methoden______________________________________________________
60
Spermien. Jeweils ein 5 µl Tropfen wurde unter dem Mikroskop bei 160facher Vergrößerung
beurteilt.
- Dichtebestimmung
Die Bestimmung erfolgte mittels einer Zählkammer nach Thoma. In 10 ml 0,9%iger NaCl-
Lösung wurden 25 µl (natives Ejakulat) bzw. 50 µl Spermasuspension verdünnt. Die
Spermien in der Kammer wurden ausgezählt und die Dichte der Ursprungssuspension
errechnet.
- Morphologie
Für die Bestimmung der abweichenden Spermienformen wurden 50 µl Spermiensuspension in
300 µl Formolzitrat-Lösung (37%ige Formaldehydlösung u. 29%ige Natriumzitratlösung im
Verhältnis 1:24) fixiert. Die Beurteilung der morphologischen Abweichungen erfolgte bei
1000facher Vergrößerung (mit Ölimmersion) nach den von KRAUSE (1966) aufgestellten
Kriterien.
-Vitalität
Die Impermeabilität der intakten Zellmembran für den Fluoreszenzfarbstoff Propidiumjodid
(PI) erlaubt eine Unterscheidung der lebenden und toten Spermien. Die Zellen mit
beschädigter Kopfmembran (zu meist tote) stellen sich bei Betrachtung durch einen 560 nm
Filter leuchtend rot dar. Membranintakte Spermien weisen keine Fluoreszenz auf.
Der Farbstoff Propidiumjodid (Sigma Aldrich, Deisenhoffen) wurde vorbereitend in Aqua
bidest. mit einer Konzentration von 0,5 mg/ml gelöst und in 1 ml Aliquoten bei –18°C in
Dunkelheit gelagert (HARRISON u. WICKERS 1990). Kurz vor Gebrauch wurde die Lösung
aufgetaut und im Dunklen gehalten. Für die PI-Färbung wurde die jeweilige
Spermiensuspension 50:1 mit der aufgetauten Färbelösung versetzt und fünf Minuten bei
Raumtemperatur unter Lichtausschluss inkubiert. Die Auswertung mit einer Zählung von
mindestens 100 Spermien erfolgte unter einem Fluoreszenzmikroskop (Axiovert; Zeiss, Jena)
mit dem entsprechenden Filtereinsatz.
- Bestimmung des akrosomalen Status
Für den Nachweis der Akrosomreaktion wurde das Lektin Peanut agglutinin (PNA), welches
an den Fluoreszenzfarbstoff Fluoreszeinisothiocyanat (FITC) gekoppelt war, eingesetzt
(CROSS u. MEIZEL 1989). Im Gegensatz zu den humanen Spermatozoen, bei denen die
Zielstruktur von PNA die äußere akrosomale Membran ist, bindet PNA beim Eber an die
C Material und Methoden
61
Glykoproteine in der akrosomalen Matrix, wenn die äußere Membran permeabel ist. In
diesem Fall leuchtet der akrosomale Inhalt grün-gelb bei der Betrachtung durch einen Filter
mit einem Exzitationsmaximum bei 365 nm.
PNA-FITC (Vektor über Alexis Deutschland, Grünberg) wurde in einer Konzentration von 10
µg/ml in 1 ml Portionen bei –20°C eingefroren und am Versuchstag unter Lichtausschluss
aufgetaut. Zu 9 Teilen Spermiensusspension wurde 1 Teil Lektinlösung gegeben
(Endkonzentration 1 µg/ml). Nach fünfminütiger Inkubation bei Raumtemperatur erfolgte die
Auszählung unter dem Fluoreszenzmikroskop.
Die PI-Anfärbung wurde gleichzeitig mit der PNA-FITC-Anfärbung in der jeweils selben
Suspension durchgeführt.
5.3. Induktion der Akrosomreaktion durch die Zona pellucida
Um die funktionellen Unterschiede der einzelnen Reifungsstadien der Zona pellucida zu
untersuchen, wurde ein Spermatozoon-Zona pellucida-Bindungstest durchgeführt, der den
Verlauf des akrosomalen Zustandes der gebundenen Spermien darzustellen erlaubt.
Die in hyperosmolarer Salzlösung gelagerten Oozyten wurden nach mehrfachem Waschen
durch PBS/PVA 2% Tropfen mit einer dünn ausgezogenen Pipette eröffnet und die Zonae
pellucidae isoliert. Diese wurden dann bis zum Versuchsanfang in PBS/PVA 2% gelagert.
Die folgenden Versuche wurden vergleichend mit Oozyten im GV I und Metaphase II
Stadium durchgeführt.
Die zwei Populationen von Spermien (Frischsperma u. TG-Sperma) wurden wie beschrieben
aufbereitet und untersucht. Nach Einstellung der Dichte auf 107 Mio/ml in modifizieter
Tyrodelösung wurden die Spermien für 15 Minuten im Brutschrank (38,5°C, 5%CO2)
äquilibriert.
Genauso wurde mit den Zonae pellucidae verfahren, nachdem 30 Stück in eine der vier
Abteilungen einer Gewebekulturschale (Greiner GmbH, Frickenhausen) in je 50 µl
modifizierter Tyrodelösung platziert worden waren.
Nun wurden zu den Zonae pellucidae in die entsprechende Abteilung 5 µl der
Spermiensuspension gegeben (ca. 50.000 Spermien) und im Brutschrank koinkubiert. Nach 1
C Material und Methoden______________________________________________________
62
Minute wurden alle Zonae pellucidae mehrmals in PBS/PVA 2% gewaschen und 10 Zonae
zur Fixation entnommen. Weitere 10 wurden jeweils für 10 und 20 min ab Beginn weiter
koinkubiert, dann jeweils wieder gewaschen und fixiert. Parallel zu diesen Zeitpunkten
wurden die Spermien, die zur Kontrolle ohne Zona pellucida weiter im Brutschrank inkubiert
wurden, auf Motilität, Vitalität und Akrosomreaktion untersucht.
Die Zona pellucida wurde mit den gebundenen Spermien für 10 Minuten in 2,5 %
Glutardialdehyd fixiert. Nach kurzem Waschen in 0,1 M Glycinlösung wurden die einzelnen
Zonae pellucidae nochmals fünfmal durch PBS/PVA 2% Tropfen gewaschen. Zum Anfärben
der gebundenen Spermien wurden die ZP in 50 µl PBS/PVA 2% mit PI- und PNA-FITC-
Färbelösung entsprechend der Spermienanfärbung gesetzt. Diese wurden dann für fünf
Minuten im Dunklen bei Raumtemperatur inkubiert.
Die PI-Anfärbung dient hier als reine Zählfärbung (vgl. FLESCH et al. 2001), da die äußere
Spermienmembran in jedem Fall durch die Fixierung beschädigt wurde.
Nach Färbung der koinkubierten Zonae pellucidae wurden diese auf Poly-L-Lysin
beschichtete Objektträger gesetzt. Die gebundenen Spermien wurden nun unter einem
Fluoreszenzmikroskop bei 400facher und 1000facher (mit Ölimmersion) Vergrößerung
ausgewertet. Es wurde die Gesamtanzahl der gebundenen Spermien, die PI-positiven
Spermien, die PNA- und PI-positiven Spermien, die Menge der isolierten abgelösten
Akrosome und die der PI positiven Spermien mit abgelöstem Akrosom bestimmt.
Die Dokumentation erfolgte mittels einer angeschlossenen Fotoeinrichtung.
5.4. Statistische Auswertung
Zum Vergleich der ungereiften und der gereiften Zona pellucida in ihrer Wirkung auf die
jeweiligen Spermienpopulationen wurde eine statistische Auswertung vorgenommen.
Mit Hilfe der deskriptiven Statistik wurden jeweils für die Zonae pelucidae mit gleichem
Reifungsstatus, Beobachtungszeitpunkt und Spermienart dieselben Parameter erfasst.
Mit der zur Verfügung stehenden Prozedur MEANS des Statikstik-Paketes SAS® (Statistical
Analysis System Institute Ltd, Version 6.02) wurden Mittelwerte, Standardabweichung,
Minimum und Maximum berechnet.
C Material und Methoden
63
Mit Hilfe der multifaktoriellen Varianzanalyse wurden die Werte der PNA-FITC positiven
Spermien an der ZP im Rahmen der GLM(General Linear Models)-Prozedur in Abhängigkeit
von Reifungsstatus der ZP, Zeitpunkt, Spermienpopulation und der jeweiligen
Wechselwirkungen dieser Faktoren untereinander untersucht.
Das zugrundeliegende Modell wird folgender Maßen beschrieben (GOGOLOK et al. 1992;
SCHUEMER et al. 1992):
Yijkl = µ + αi + βj + γk + αβij + αγik + βγjk + αβγijk + εijkl wobei
Yijk der Messwert der abhängigen Variablen Y für die l-te Beobachtung unter der Stufe j, i bzw. k von dem jeweiligen Einflussfaktor ist,
µ der Gesamtmittelwert ist,
αi, βj, γk die Mittelwerte für die Effekte von Einflussfaktoren A, B und C sind,
αβij, αγik, βγjk, αβγijk die Wechselwirkungseffekte für die jeweilige Stufe von A, B und C sind und
εijkl ein Fehler ist.
Aufgrund der sich bei der dreifaktoriellen Varianzanalyse ergebenen signifikanten Einflüsse
wurde zur Bestimmung einzelner Zusammenhänge die Parameter dieser Analysenform
weiterführend untersucht. Es wurden nach Reifungsstadium der ZP, Spermienpopulation und
Beobachtungszeitpunkt Gruppen gebildet und diese entsprechend dem erläuterten Modell in
einer zwei- bzw. einfaktoriellen Varianzanalyse beschrieben.
Für eine optimierte Darstellung des Zeiteinflusses wurde die Steigung der Geraden ermittelt,
die in einem Zeitdiagramm mit den PNA-FITC positiven Werten entsteht. Für die
Beschreibung der Geraden wurde folgende Formel angewendet:
y = ax + b mit a = Steigung; b = y-Achsenabschnitt;
x = Wert der x-Achse; y= Wert der y-Achse
Die Wahrscheinlichkeitswerte p≤0,001 wurden als statistisch hoch signifikant, die Werte
p≤0,05 als statistisch signifikant und die Werte p≤0,1 als statistisch auffallend betrachtet.
D Ergebnisse________________________________________________________________
64
D Ergebnisse
1. Gewinnung der Oozyten und Isolierung der Zonae pellucidae
Mit der beschriebenen Methode der Massenaufarbeitung zur Isolierung der Zonae pellucidae
(ZP) war es möglich, eine für weiterführende biochemische Analysen benötigte Menge an ZP
Glykoproteinen im mg-Bereich zu gewinnen. Durch die Zerkleinerung mit dem Fleischwolf
wurden sehr viele Follikel auch im Inneren des Ovars aufgebrochen, so dass eine große
Anzahl an Oozyten isoliert werden konnte. Große Anteile des anfallenden Zelldetritus wurden
von der Oozytensuspension bereits durch die Filtrationsschritte separiert, die Percoll-
Dichtezentrifugation sorgte für die weitere Aufreinigung. Die Eizellen sammelten sich in der
10%igen Percoll-Lösungsschicht und der Detritus in den darunterliegenden, höher
konzentrierteren Schichten. Nach der Homogenisierung mit anschließender Filtration erhielt
man eine lichtmikroskopisch saubere Suspension an einzelnen ZP. Aus 300 Ovarien konnten
ca. 150.000 ZP gewonnen werden, dies entspricht 2,25 mg (bei 1 ZP = 15 ng).
Im Gegensatz dazu ließen sich pro Ovar bei der Follikelpunktion um die 20 Eizellen isolieren.
Die Überprüfung des Kernreifestatus ergab, dass sich nach der Isolierung der Oozyten aus den
Ovarien frisch geschlachteter Sauen so gut wie alle Eizellen im GV I Stadium (siehe
Abbildung 4a) befanden. Analog sah es bei der Oozyten der eingefrorenen Ovarien für die
Massenaufarbeitung aus.
Bei der stichprobenartigen Überprüfung des Kernstatus der gereiften Oozyten durch die
Orceinfärbung befanden sich im Durchschnitt 79,5 % im Metaphase II Stadium (siehe
Abbildung 4b) mit Polkörper. Dieser konnte auch im Stereomikroskop ohne Anfärbung
identifiziert werden.
D Ergebnisse
65
a Eizelle im GV I Kernstadium
Der Zellkern und der Nukleolus sind deutlich zu erkennen, das Chromatin ist hufeisenförmig um das Kernkörperchen verdichtet. ( Kernmembran)
b Eizelle im M II Kernstadium
Die Chromosomem sind auf zwei Cluster verteilt und es ist ein Polkörper zu finden. ( Polkörper)
Abb. 4: Orceinanfärbungen von Eizellen zur Beurteilung des Reifungsstadiums
2. SDS-Gelelektrophorese
2.1. 1D-PAGE der Glykoproteine der Zona pellucida
Die eindimensionale Gelelektrophorese der ZP diente vor allem der Überprüfung der Reinheit
der einzelnen ZP Isolierungen. Weiterhin wurden alle späteren Schritte der
zweidimensionalen Gelelektrophorese zunächst in der 1D-PAGE bzw. dem nachfolgenden
Transfer auf PVDF-Membranen mit anschließender Chemilumineszenz ausgetestet.
a
b
D Ergebnisse________________________________________________________________
66
Die für die elektrophoretische Auftrennung erforderliche Solubilisation der Zonae pellucidae
wurde im Lichtmikroskop überprüft. Die kreisförmige Struktur der ZP war dabei nicht mehr
zu erkennen, sehr vereinzelt zeigten sich kleinere Fäden. Die Hitzesolubilisation in Aqua dest.
pH 8,0 bei 72°C ist eine der einfachsten und am häufigsten verwendeten Methoden. Es
besteht u.a. auch die Möglichkeit, die ZP durch 5 mM Phosphorsäure bei pH 2,5 oder mit 5
mM Ammoniumbicarbonat bei pH 8,2 jeweils bei 72 °C zu lösen.
In der Coomassieanfärbung der 1D-PAGE der ZP Glykoproteine unter nicht reduzierenden
Bedingungen zeigten sich zwei Banden. Die obere Bande bei 90 kDa stellt ZPA und die
untere großflächige Bande (Molekulargewichtsbereich 45-60 kDa) das Gemisch von ZPB und
ZPC dar. Diese Breite wird durch den hohen Glykosylierungsgrad hervorgerufen.
Geltasche Nr.: 1 2 3 4 5 6
Abb. 5: 1D-PAGE ungereifter ZP; Coomassie Blue Färbung (Die Geltaschen enthalten folgende Mengen an ZP: Nr. 1 u. 5: ca. 4 µg, Nr. 2 u. 6: ca. 2,7 µg, Nr. 3: ca. 8 µg, Nr. 4: ca. 5,3 µg; es wurde ein 10%iges Trenngel verwendet; weist auf die schwache Bande der 90 kDa Komponente hin, diese wurde hier durch β-Merkaptoethanol reduzierend gespalten)
relatives Molekulargewicht:
97,4 kDa ► (Phosphorylase b)
66,2 kDa ► (Serumalbumin)
45,0 kDa ► (Ovalbumin)
◄ ZPA
◄ ZPB/ ZPC
D Ergebnisse
67
2.2. 2D-PAGE der Glykoproteine der Zona pellicida
Die bisher veröffentlichten zweidimensionalen Gelelektrophoresen der nativen ZP wurden
zumeist unter reduzierenden Bedingungen erstellt. Diese Bedingungen ergeben sich stets
durch die Verwendung von DTT in der Äquilibrierlösung des Gelstrips vor der zweiten
Dimension. Dies hat u.a. zur Folge, dass ZPA durch Aufspaltung von Disulfidbrücken in
mehrere Bereiche separiert wird. So wird die ohnehin schon gegenüber dem ZPB/ZPC-
Bereich geringe Proteinmenge des 90 kDa Anteils noch gestreut, welches Probleme bei der
Detektion mit sich bringen kann. Vor allem wird aber die native Struktur der ZP, die
eigentlich Gegenstand der Untersuchung war, stark verändert. Daher wurden die Versuche
hauptsächlich unter nicht reduzierenden Konditionen durchgeführt und während die
reduzierenden Ansätze nur zum Vergleich dienten.
Die zweidimensionale Elektrophorese wurde mit Zonae pellucidae von ungereiften
(Kernstadium GV I) und in vitro gereiften (Kernstadium M II) Oozyten durchgeführt, um
mögliche Veränderungen des isolelektrischen Verhaltens der ZP Glykoproteine während
dieser Entwicklung darzustellen. Der dem isoelektrischen Punkt entsprechende pH-Wert wird
im folgenden als pI-Wert bezeichnet.
Die 2D-PAGE unter reduzierenden Bedingungen (mit DTT) der ungereiften ZP wies folgende
Glykoproteinverteilung auf: ZPA war partiell gespalten und nahm die Bereiche pI 4,7-6,4 bei
110-90 kDa und pI 4,6-7,0 bei 90-65 kDa ein. Die große Bande von ZPB/ZPC erstreckte sich
von pI 3,0-7,2 bei 70-50 kDa (s. Abb. 6a).
Bei der 2D-PAGE von Glykoproteinen ungereifter Zona pellucida unter nicht reduzierenden
Bedingungen (ohne DTT) waren nur zwei klar abgrenzbare Spotbereiche zu erkennen. ZPA
erstreckte sich über pI 3,9-6,7 bei 120-95 kDa und ZPB/ZPC über pI 3,0-7,8 bei 60-45 kDa (s.
Abb. 6b). Neben der ungespaltenen Darstellung des Glykoproteins ZPA fiel die Ausdehnung
der ZPB/ZPC Spotbande in den alkalischeren Bereich um 0,8 pI-Einheiten auf. Der Bereich
der 90 kDa Komponente war im Vergleich zu den 90 und 65 kDa Anteilen von ZPA in der
reduzierenden 2D-PAGE jedoch um 0,3 pI-Einheiten in Richtung Anode verschoben.
Es bleibt zu erwähnen, dass keine Unterschiede in den angesprochenen 2D-PAGE-Analysen
zwischen ZP Proteinen aus frischen punktierten Ovarien und ZP Proteinen aus aufgetauten
und per Fleischwolf zerkleinerten Ovarien zu beobachten waren.
D Ergebnisse________________________________________________________________
68
pI 3 4 5 6 7 8 pI 3 4 5 6 7 8 b 2D-PAGE unter nicht reduzierenden Bedingungen
ZPA ist nicht gespalten. Abb. 6: 2D-PAGE der Glykoproteine ungereifter ZP, Silberfärbung (jeweils 6,0 µg ZP und 10%iges Trenngel)
Bei der 2D-PAGE mit ZP gereifter Oozyten (Kernstadium M II) wurde nur einzelnd isolierte
ZP verwendet. Alle Versuche wurden ohne Reduktionsmittel durchgeführt, da die
Materialmenge limitiert war. Die Spotbanden von ZPA erstreckten sich von pI 4,3-5,9 bei ca.
115-90 kDa und der Bereich von ZPB/ZPC von pI 3,0-6,5 bei ca. 60-50 kDa. Im Vergleich
zur entsprechenden Auftrennung der ungereiften ZP zeigte die 2D-PAGE der gereiften ZP in
der Silberfärbung für ZPA eine Verschiebung von 0,8 pI-Einheiten und für ZPB/ZPC von 1,3
pI-Einheiten in Richtung Anode und somit eine Zunahme der Acidität.
ZPA
ZPA
ZPB/ZPC
ZPB/ZPC
97,4
66,2
45,0
31,0
97,4
66,2
45,0
31,0
a 2D-PAGE unter reduzierenden Bedingungen
ZPA ist gespalten.
kDa
kDa
a
b
D Ergebnisse
69
Für das eingesetzte Fokussierungssystem (Multiphor II; Amersham Pharmacia Biotech,
Uppsala, Schweden) standen leider keine immobilisierten pH-Gradienten-Gele mit einem
niedrigeren pH-Wert als 3,0 zur Verfügung. Für eine genauere Analyse des sauren Bereichs
von ZPB/ZPC wäre dies sinnvoll gewesen.
3. Immunologische Charakterisierung der ZP Proteine
Zur eindeutigen Identifizierung der ZP Glykoproteine wurden diese nach der
elektrophoretischen Auftrennung auf PVDF-Membranen transferiert. Im Western Blot mit
definierten Antikörpern gegen die einzelnen drei Proteine der ZP sollten diese näher
analysiert werden. Es kamen dabei sowohl polyklonale Antikörper als auch monospezifische
Peptidantikörper zum Einsatz. Die Unterscheidung der Bereiche von ZPA und ZPB/ZPC war
bereits in der Gelanfärbung offensichtlich. Die große Bande von ZPB/ZPC sollte jedoch auch
ihren einzelnen Bestandteilen zu geordnet werden können. Die Markierungen der Antikörper
wurden durch ein Chemilumineszenzverfahren entwickelt. Die Kontrolle der Spezifität wurde
durch den Einsatz von entsprechenden Präimmunseren überprüft.
Bei durch 1D-PAGE aufgetrennten Glykoproteinen der ZP konnte die 90 kDa Bande mit dem
AK ZPA-20 als ZPA identifiziert werden. Die anderen drei verwendeten Antikörper (AK
ZPB; AK ZPC; AK ZPC-5a) zeigten alle die gleiche Markierung über die gesamte 45-60 kDa
Bande. Eine Unterscheidung von ZPB und ZPC war nicht möglich, sowohl bei ungereiften als
auch bei gereiften Zonae pellucidae.
AK ZPA-20 markierte bei den Membranen mit Proteine nach 2D-PAGE Auftrennung das
ZPA zugeordnete Bandenmuster analog der entsprechenden Silberfärbung oberhalb des
breiten dominanten Bereichs von ZPB/ZPC. Dies galt sowohl für den Ansatz unter
reduzierenden Bedingungen als auch für den unter nicht reduzierenden Konditionen.
Die Unterscheidung von ZPB und ZPC innerhalb der zweidimensional aufgetrennten ZP
Proteine war wie bei der 1D-PAGE Auftrennung ebenfalls nicht eindeutig möglich, da sich
die Areale zum größten Teil überlappten (vgl. Abb. 7). Allerdings erhielt man schon zwei
D Ergebnisse________________________________________________________________
70
97,4
66,2
45,0
kDa
unterschiedliche Signalmuster, so dass eine Tendenz beschrieben werden kann. Diese galt für
alle drei untersuchten ZP Gruppen, die ungereifte nicht reduzierte ZP, die ungereifte
reduzierte ZP und die gereifte nicht reduzierte ZP. AK ZPC und AK ZPC-5a markierten
vornehmlich verstärkt im sauren pI-Bereich und AK ZPB gleichmäßig über die gesamte
Breite der Proteinbande um die 55 kDa. Die Signale von AK ZPC/AK ZPC-5a endeten
auslaufend ca. 1,0-1,5 pI Einheiten vor dem Ende der Proteinsspots auf Seiten der Kathode
verglichen mit der jeweiligen Silberfärbung.
Allgemein ist zu sagen, dass die reale Verteilung der einzelnen Proteinanteile wahrscheinlich
etwas weiter in den basischen pI-Bereich hineinreichten. Dort wird die Proteinkonzentration
im Vergleich zum sauren Abschnitt wesentlich geringer, so dass eine sichtbare Detektion auch
nicht mehr durch verlängerte Belichtungszeiten erfolgen konnte. Der durch den AK ZPB
markierte Bereich endete bis zu 0,5 pI-Einheiten vor dem basischen Ende der entsprechenden
Silberfärbung.
Die Chemilumineszenz mit den Präimmunseren statt der Antiseren wies keine Signale auf.
Die beschriebenen Spotbanden sind folglich als spezifisch anzusehen.
AK ZPB AK ZPC
pI 3 4 5 6 7 8 pI 3 4 5 6 7 8
Abb. 7: Chemilumineszenz ungereifter nicht reduzierter ZP mit Antikörpern (bei AK ZPB war Belichtungszeit verlängert, daher Standard intensiver und noch schwache Signale zu erkennen, bei AK ZPC ergaben längere Belichtungszeiten keine weiteren Signale)
kDa
66,2
97,4
45,0
D Ergebnisse
71
4. Lektinologische Analyse der Kohlenhydratstrukturen der ZP
Alternativ zur immunologischen Charakterisierung wurden die durch die Elektrophorese
aufgetrennten ZP Proteine mit Lektinen untersucht. Mittels Lektinen konnten definierte
Kohlenhydratstrukturen der ZP näher analysiert werden. Zur Detektion kam ein
Biotin/Streptavidin-System zum Einsatz und die Visualisierung erfolgte wiederum durch das
Verfahren der Chemilumineszenz.
Alle Lektine wurden zunächst an Membranen mit Proteinen ungereifter ZP nach
eindimensionaler elektrophoretischer Auftrennung (1D-Membranen) getestet. Nach einem
positivem Signal in der Chemilumineszenz wurden die jeweiligen Lektine auch in der
Analyse von zweidimensional elektrophoretisch separierten Proteinen (2D-Membranen)
eingesetzt.
Die Spezifität der Lektinbindung wurde durch den Zusatz von Zuckern überprüft. Gemäß
einer kompetitiven Hemmung wurden in Parallelansätzen während des Inkubationsschritts der
Lektinlösung der jeweilige Bindungshemmzucker (Lektine mit Hemmzuckern siehe Tabelle 5
unter 3.2. in C Material und Methoden) zugesetzt. Wurden die Zucker in einer Konzentration
von 0,2 M bei einer Lektinkonzentration von 5 µg/ml verwendet, so konnte eine deutliche
Signalreduktion erzielt werden. Beim Einsatz einer 0,5 M Zuckerlösung wurde in der
Chemilumineszenz keine Markierung der ZP Proteine durch die Lektine mehr nachgewiesen.
Die eingesetzten biotinylierten Standardproteine diente neben der Bestimmung des relativen
Molekulargewichtes der ZP Glykoproteine zur Kontrolle eines korrekten
Entwicklungssystems.
In Tabelle 6 sind die eingesetzten Lektine und die von ihnen markierten Bereiche der ZP
Glykoproteine von ungereiften Eizellen auf dem Röntgenfilm dargestellt. Die ZP Erkennung
wurde unterteilt nach Markierungen im Bereich des höher molekularen ZPA und des
großflächigeren ZPB/ZPC Gebietes. Die Versuche mit 2D-PAGE Auftrennung der ZP
wurden sowohl unter reduzierenden Bedingungen als auch unter nicht reduzierenden
Bedingungen durchgeführt. Für den jeweiligen Versuchsansatz ergaben sich keine
Unterschiede; es wurden in beiden Fällen die gleichen Muster analog der Silberfärbung
D Ergebnisse________________________________________________________________
72
erkannt. Entsprechend verhielten sich auch die Signale der 1D-Membranen. In der
Besprechung der einzelne Muster wurde sich daher auf die der 2D-Membranen konzentriert.
Tab. 6: Ergebnisse der Chemilumineszenz zur Analyse der ungereiften ZP auf 1D- und 2D-Membranen mit Lektinen (— = kein Signal; + = geringes Signal; + + = mittleres Signal; + + + = starkes Signal)
Signal im ZP Bereich
Gruppe
Lektin
Spezifität ZPA ZPB/ZPC
I Gluc/Man Con A α-D-Man; α-D-GlcNAc + + + (+)
DSA [Gal-β(1-4)-GlcNAc]N + + + + + + II
GlcNAc RCA I Gal-β(1-4)-GlcNAc + + + + +
GS I α-D-Gal, α-D-GalNAc — —
PNA Gal-β(1-3)-GalNAc; α/β-Gal — —
ECA α/β-Gal; α/β-GalNAc; Gal-β(1-4)-GlcNAc
+ + +
+ + +
III
GalNAc/ Gal
Jacalin Gal-β(1-3)-GalNAc + + + + +
IV L-Fuc AAA Fuc-α(1-6)-GlcNAc + + + + + +
MAA II NeuNAc-α(2-3)-Gal + + + +
ACA NeuNAc-α(2-3/6)-Gal-β(1-3)-GalNAc + + + +
V Neuramin- säure SNA NeuNAc-α(2-6)-Gal;
NeuNAc-α(2-6)-GalNAc
+
+
Die Beurteilung der angegebenen Signalstärke erfolgte durch einen Vergleich der
Schwärzungen auf den Röntgenfilmen innerhalb der Versuche in Intensität und
Flächenausmaß.
D Ergebnisse
73
Die Lektinbindungsmuster auf den erstellten Röntgenfilmen waren grob in vier Typen zu
unterteilen (vgl. Abb. 8):
Typ I (ohne Signal)
Die Lektine GS I und PNA zeigten weder auf 1D-Membranen noch auf 2D-Membranen ein
Signal. Sie binden beide spezifisch an terminale Galaktose, die folglich durch diese nicht
nachgewiesen werden konnte.
Typ II (Signal nur im ZPA Bereich)
Dieses Muster war nur bei Con A zu finden, welches vornehmliche α-D-Mannose erkennt und
schwächer an α-D-GlcNAc bindet. Bei allen beschriebenen Versuchsanordnungen, 1D- oder
2D-Membran, reduzierend oder nicht reduzierend, wurde von diesem Lektin nur der jeweilige
ZPA Bereich erkannt, und zwar deutlich. Minimale Signale waren jedoch beim Lektinblot der
nicht reduzierten 2D-Membran auch im ZPB/ZPC Bereich zu sehen (s. Abb. 8a+b).
Typ III (mittlere Signale bei ZPA und ZPB/ZPC)
Zu diesem Typ wurden die Lektine SNA, ACA und MAA II gezählt. Sie gehören alle zur
Gruppe der Lektine , die Sialsäure in bestimmten Verknüpfungen erkennen. SNA und MAA II
markieren diese Strukturen in N-Glykanen und ACA komplexe sialsäurehaltige Bereiche in O-
Glykanen.
Bei SNA war auffällig, dass gerade zum sauren Bereich hin die Signale in beiden
Proteinbereichen der ZP immer schwächer werden (s. Abb. 8d), obwohl die
Glykoproteinkonzentration zur Anode größer wird. Dort haben die Lektine mit dem
Signalmuster vom Typ IV und ACA ihre stärkste Markierung.
MAA II rief im Vergleich zum SNA stärkere Markierungen hervor. Sie umfassten beide
Proteinbereiche, wiesen aber ähnlich dem SNA gerade am basischen Ende beider Spotbanden
(ZPA und ZPB/ZPC) den intensivsten Signalbereich auf. Dies wurde bei reduzierten 2D-
Membranen (s. Abb. 8c) mit aufgespaltenem ZPA und nicht reduzierten 2D-Membranen mit
einheitlichem ZPA Bereich deutlich.
ACA markierte zwar beide Spotbanden komplett (s. Abb. 8e), jedoch insgesamt schwächer als
die Lektine mit Typ IV, so dass längere Belichtungszeiten (ca. 2-4fache) von Nöten waren.
D Ergebnisse________________________________________________________________
74
Abb. 8: Chemilumineszenz von 2D-Membranen mit ungereifter ZP und Lektinen (Banden der Molekulargewichtsstandardproteine auf den jeweils linken Seiten von oben nach unten: 97,4 kDa, 66,2 kDa und 45,0 kDa; red. = reduziert; Signalm. = Signalmuster) a : Con A; red. ZP; Signalm. Typ II b : Con A; nicht red. ZP; Signalm. Typ II c : MAA II; red. ZP; Signalm. Typ III d : SNA; nicht red. ZP; Signalm. Typ III e . ACA; nicht red. ZP; Signalm. Typ III f : AAA; nicht red. ZP; Signalm. Typ IV
a b
c d
e f
pI 3 4 5 6 7 pI 3 4 5 6 7
pI 3 4 5 6 7 pI 3 4 5 6 7
pI 3 4 5 6 7 pI 3 4 5 6 7
D Ergebnisse
75
Typ IV (starke Signale bei ZPA und ZPB/ZPC)
AAA, DSA, ECA, RCA I und Jacalin bewirkten sehr ähnliche starke Signale in beiden
Spotbanden. Die Markierungen waren gleichmäßig stark über die Breiten der jeweiligen
Banden verteilt (vgl. Abb. 8f). Im sauren Bereich waren die Signale dichter entsprechend der
Proteinverteilung in der Silberfärbung. AAA, spezifisch für Fuc-α(1-6)-GlcNAc, war das
Lektin mit den stärksten Signalen.
In der Silberfärbung der 2D-PAGE war ein auffälliger Shift der pI-Bereiche zur Anode im
Vergleich zwischen ungereifter und gereifter ZP zu beobachten. Es finden folglich
Veränderungen an der ZP während der In-vitro-Reifung auf biochemischer Ebene statt. Daher
wurde auch die ZP von gereiften Oozyten mittels Lektinen untersucht. Es wurden nur einige
der bei den ungereiften ZP eingesetzten Lektine verwendet, da die Materialbeschaffung mit
einem großem Aufwand verbunden war. Die Oozyten mussten gereift werden und zur
Vermeidung von unnötigen Materialverlusten wurde jede ZP einzeln isoliert und auf den
Einsatz von Siebtechniken verzichtet. Die einzelnen Lektine untereinander wiesen auch in
ihren Detektionsmustern auf den Röntgenfilmen meistens eine sehr ähnliche Verteilung auf.
Es wurde fast immer der gesamte Proteinbereich der entsprechenden Coomassie Blue-(1D)
oder Silberfärbung (2D) markiert.
Bei der Analyse der gereiften ZP der Eizellen im M II Stadium wurden also vornehmlich
Lektine mit unterschiedlichen Mustern eingesetzt. Die 2D-PAGE wurden mit den gereiften
Eizellen für die Chemilumineszenz nur unter nicht reduzierenden Konditionen durchgeführt.
So wird die Aufspaltung der Disulfidbrücken des ZPA umgangen und die Proteinmenge des
ZPA auf einen kleineren Bereich konzentriert. Daher konnte auch trotz geringer
Glykoproteinmengen (120 ZP ~ 1,8 µg pro Membran) der Zuckeranteil des ZPA mittels
beschriebener lektinologische Analyse dargestellt werden. Als Ausnahme wurde nur für die
Untersuchung mit Con A auch ein 2D-Ansatzt mit DTT (reduzierend) durchgeführt, da die
selektive Erkennung von Kohlenhydratstrukturen im ZPA Bereich durch das Con A eine
Untersuchung unter Aufspaltung der 90 kDa Komponente von ZPA interessant machte.
Die Ergebnisse der lektinologischen Untersuchungen der gereiften ZP sind in Tabelle 7
zusammengefasst.
D Ergebnisse________________________________________________________________
76
Tab. 7: Ergebnisse der Chemilumineszenz zur Analyse der gereiften ZP mittels Lektinen (— = kein Signal; + = geringes Signal; + + = mittleres Signal; + + + = starkes Signal; 2D red. = Auftrennung der ZP Proteine vor Transfer aus Membran durch 2D-PAGE unter reduzierenden Bedingungen; ohne Angabe = nicht reduzierende Bedingungen)
Signal im Bereich der ZP
Gruppe
Lektin
Spezifität
Art der PAGE ZPA ZPB/ZPC
1D + + + —
2D + + + —
I
Gluc/Man
Con A α-D-Man; α-D-GlcNAc
2D red. + + —
1D + + + + + + DSA [Gal-β(1-4)-GlcNAc]N
2D + + + + + +
II
GlcNAc
RCA I Gal-β(1-4)-GlcNAc 2D + + + + +
III
GalNAc/Gal
ECA α/β-Gal; α/β-GalNAc;
Gal-β(1-4)-GlcNAc
2D
+ + +
+ + +
IV L-Fuc AAA Fuc-α(1-6)-GlcNAc 2D + + + + + +
1D + + + V Neuramin-säure
SNA NeuNAc-α(2-6)-Gal;
NeuNAc-α(2-6)-GalNAc 2D + + +
Die bei gereiften ZP eingesetzten Lektine führten jeweils zu den gleichen Signalmustern wie
diese bei ungereiften ZP. Bei Con A war dies folglich Typ II, bei SNA Typ III und bei AAA,
ECA, RCA-I und DSA Typ IV (vgl. Abb. 9). Allerdings verliefen die Markierungen der
Spotbanden entsprechend der Silberfärbung der gereiften ZP nicht so weit in den basischen
pI-Bereich wie die bei den 2D-Membranen der ungereiften Eizellen. Über dies hinaus war der
pI-Shift, wenn man nur die lektinologische Untersuchung betrachtet, noch größer als der in
der Silberfärbung. Dort betrug der Unterschied etwas über eine pI-Einheit und bei der
Analyse mit Lektinen ca. 2 pI-Einheiten (z.B. AAA: vgl. Abb. 8f mit Abb. 9a2). Diese
Vergrößerung der Differenz beruht darauf, dass bei den 2D-Membranen mit ZP von M II
Oozyten selbst die Lektine mit Signalmuster Typ IV nicht mehr den kompletten Bereich von
ZPB/ZPC bis zum basischen Ende entsprechend der Silberfärbung sichtbar markierten, auch
nicht bei erhöhten Konzentrationen und verlängerten Belichtungszeiten.
D Ergebnisse
77
Abb. 9: Chemilumineszenz von 1D- und 2D-Membranen mit gereifter ZP und Lektinen (alle PAGE unter nicht reduzierenden Konditionen; die Banden der Molekulargewichts-standardproteine auf der jeweiligen linken Seite der Bilder entsprechen von oben nach unten einem relativen Molekulargewicht von 97,4 kDa, 66,2 kDa und 45,0 kDa) a1 u. a2: ein und dieselbe 2D-Membran mit 120 ZP,
erst mit Con A (a1), Signalmuster Typ II, und nach „Strippen“ mit AAA (a2), Signalmuster Typ IV, inkubiert
b1, b2 u. b3: b1 = Standardproteine; b2 u. b3 ein und dieselbe Proteinspur auf derselben 1D-Membran mit 30 ZP, erst mit Con A (b2), Signalmuster Typ II, und nach „Strippen“ mit AAA (b3), Signalmuster Typ IV, inkubiert
c: 2D-Membran (265 ZP) mit DSA, Signalmuster Typ IV
a1 a2
c b3 b2 b1
pI 3 4 5 6 7 pI 3 4 5 6 7
pI 3 4 5 6 7
D Ergebnisse________________________________________________________________
78
5. Rasterelektronenmikroskopische Studien
In der Rasterelektronenmikroskopie (REM) sollte die räumliche Verteilung der Lektine und
somit der entsprechenden Kohlenhydratstrukturen über die Oberfläche der intakten ZP an
ganzen Eizellen dargestellt werden. Die fixierten Eizellen wurden dazu mit biotinylierten
Lektinen inkubiert, an die anschließend goldgekoppeltes Streptavidin band. Danach folgte
eine Behandlung in einer Silberlösung, welche die Goldpartikel von 10 nm auf ca. 250 nm
wachsen ließ. Abschließend wurden die Präparate für die REM-Analyse dehydriert und
getrocknet.
Es kamen die Lektine AAA und Con A an ungereiften Eizellen zum Einsatz. Das
fukosebindende AAA wurde als Übersichtsmarkierung gewählt, da es bei der lektinologischen
Untersuchung im Western Blot die stärksten und großflächigsten Signale aufwies. Die
Untersuchungen mit Con A sind insoweit besonders interessant, da dieses mannosebindende
Lektin im Lektinblot im Vergleich zu den anderen verwendeten ein ganz spezielles
Bindungsmuster besaß. Als einziges rief es nur Signale im ZPA Bereich hervor und der große
ZPB/ZPC Bereich blieb ohne Markierung. So kann man unter Umständen durch diese
Versuchsanordnung neben der Kohlenhydratverteilung auch Rückschlüsse über die
Zuordnung der einzelnen Proteine zu einander gewinnen.
In den REM Aufnahmen war die typische Struktur der ZP zu erkennen. An der Oberfläche
war eine netzgitterartige Struktur mit Löchern von ca. 3-5 µm Durchmesser zu sehen. In deren
Tiefe befanden sich kleine Poren, welche von Ebene zu Ebene nach innen immer kleiner
wurden (vgl. Abb. 10 b u. d).
Auf den Bildern mit AAA war die ZP mit Partikeln voll beladen (Abb. 10 a). Die dichte
Lagerung war sowohl an der Oberfläche als auch in der Tiefe der Löcher und Poren
vorhanden, deren Größe noch sterisch eine Partikelanheftung erlaubte. Die Spezifität dieser
Bindungen wurde durch die komplette Hemmung mit 0,5 M α-L-Fukoselösung untermauert.
Bei den Versuchen mit Con A waren insgesamt viel weniger Partikel auf der ZP zu sehen
(Abb. 10 c). Sie waren eher isoliert und nicht dicht an dicht gepackt. Auffällig war, dass sie
zumeist nur an den oberflächlichen Gitterstrukturen und nur vereinzelt in sehr großen Poren
D Ergebnisse
79
zu finden waren. Mit einer 0,5 M α-Methylmannopyranosidlösung wurde zwar keine
komplette Hemmung der Con A-Bindung erreicht, aber eine sehr deutliche Reduktion.
Die Ergebnisse der REM-Analyse zeigten, dass die Kohlenhydratstrukturen der ZP an der
Außenseite viel Fukose und weniger Mannose enthalten. Diese Verteilung entsprach den
Mengenverhältnissen im Lektinblot.
Abb. 10: REM-Analyse ungereifter Eizellen mit AAA, Con A und jeweiliger Hemmung (5000fache Vergrößerung) a : AAA; b : AAA/0,5 α-L-Fukose; c : Con A; d : Con A/0,5 M α-Methylmannopyranosid
c d c
a b
D Ergebnisse________________________________________________________________
80
6. Die Fähigkeit der ZP zur Induktion der Akrosomreaktion in Abhängigkeit vom Reifungsstatus der Oozyte Nach den vorangegangenen Untersuchungen sollte nun der Einfluss der beobachteten
Veränderungen der Zona pellucida während der In-vitro-Reifung in funktioneller Hinsicht
untersucht werden. Eine Aufgabe der ZP unter physiologischen In-vivo-Bedingungen ist es,
die Akrosomreaktion des gebundenen (first binding) Spermiums zu induzieren. Daher wurde
diese Funktion unter In-vitro-Bedingungen vergleichend zwischen isolierter ZP von Oozyten
im GV I und M II Stadium untersucht. Dazu wurden ejakulierte Frischspermien bzw.
kryokonservierte epididymale Spermien (TG-Sperma) nach 15minütiger Vorkapazitation mit
den ZP für eine Minute koinkubiert und dann der ungebundene Anteil entfernt. Die
Auswertung der Anzahl der gebundenen Spermien erfolgte nach einer, zehn und zwanzig
Minuten. In Akrosomreaktion befindliche Spermien stellten sich als PNA-FITC-positiv dar (s.
Abb. 11). Schon der optische Vergleich der Bilder innerhalb eines Reifungsstadiums zu den
verschiedenen Beobachtungszeitpunkten lässt eine Zunahme der sich in Akrosomreaktion
befindlichen Spermatozoen erkennen (s. Abb. 12).
Abb. 11: Spermienanfärbung mit PI und PNA-FITC 1.: isoliertes Spermium der Suspension, in Akrosomreaktion befindlich 2.: Spermien an der ZP, fixiert und somit permeabilisiert für PI auch wenn Akrosom intakt ( ) a : Fluoreszenzlicht; b: Hellfeld; a u. b : 1000fache Vergrößerung, Ölimmersion
1.b
2.b
1.a
2.a
D Ergebnisse
81
Abb. 12: Spermien, gebunden an ZP, in Propidiumjodid (PI) und PNA-FITC Anfärbung
Die Bilder wurden von ZP ungereifter Oozyten mit ejakulierten Frischspermien angefertigt, aufgrund der Fixation sind die Membranen aller Spermien durchlässig für PI. a : Beobachtungszeitpunkt 1min
b : Beobachtungszeitpunkt 10 min
c : Beobachtungszeitpunkt 20 min
a b
c
D Ergebnisse________________________________________________________________
82
Die deskriptive Statistik der erhobenen Parameter, sowohl an der ZP als auch bei den
Spermien in der Kontrollsuspension ohne ZP, sind unter 2. in J Anhang tabellarisch
aufgelistet. Die Werte des untersuchten nativen Frischspermas und der Kontrollsuspension
von Frisch- und TG-Sperma befanden sich in physiologischer Norm, so dass die beurteilten
Spermienfraktionen zum Versuchseinsatz kommen konnten. Der erhöhte Anteil der
Plasmatropfen (ca. 25 %) bei den epididymalen TG-Spermien ist auf die noch nicht
abgeschlossene Abschnürung dieses Tropfens im Nebenhoden zurückzuführen (vgl. 2.1.
Aufbau u. Entwicklung des Spermiums unter B Literaturübersicht).
Die folgende Analyse bezieht sich vornehmlich auf die erhobenen Werte für den Anteil der
PNA-FITC positiven Spermien als Maß der Akrosomreaktion. Die Auswertung der
beschreibenden Statistik dieses Beobachtungsparameters sind in Tabelle 8 aufgeführt.
Tab. 8: Deskriptive Statistik der PNA-FITC positiven an ZP gebundenen Spermien a. ejakulierte Frischspermien
Kernstatus der Oozyte
Zeitpunkt
(min)
Anzahl der ZP
Mittelwert
(%)
Standard- abw. (%)
Minimum
(%)
Maximum
(%) 1
27
22,6
7,69
10,9
42,1
10
28
34,2
12,2
11,1
54,5
GV I
20
26
46,5
16,0
25,5
100 1
19
20,2
6,40
5,00
34,0
10
22
42,2
15,1
20,0
83,3
M II
20
20
42,3
9,17
24,7
58,3
D Ergebnisse
83
b. epididymale TG-Spermien
Kernstatus der Oozyte
Zeitpunkt
(min)
Anzahl der ZP
Mittelwert
(%)
Standard- abw. (%)
Minimum
(%)
Maximum
(%) 1
25
36,2
11,8
20,0
66,7
10
25
36,7
10,5
15,3
70,0
GV I
20
23
38,4
13,1
6,67
69,2 1
18
36,6
20,1
13,0
64,6
10
18
45,1
10,5
22,2
62,5
M II
20
20
47,7
11,1
28,9
66,7
Die Ausgangswerte der PNA-FITC positiven Spermien beim Zeitpunkt von 1 min bewegten
sich sowohl bei ungereifter und gereifter ZP innerhalb derselben Spermienpopulationen
jeweils im gleichen Wertebereich. Der höhere Ausgangswert der aufgetauten Spermien war
u.a. durch die aufgrund der Ein- und Auftauprozesse hervorgerufene geringere Stabilität der
Spermatozoenmembran zu begründen.
Bei den Versuchen mit Frischsperma fällt auf, dass sich die Mittelwerte des Anteils der
akrosomreagierenden Spermien 20 min nach Versuchsbeginn bei den ZP unterschiedlichen
Reifungsgrades wieder in etwa angleichen. Auffällig ist die Entwicklung dazwischen zum
Beobachtungszeitpunkt von 10 min. Der Anteil der akrosomreagierenden Spermien bei der
ZP ungereifter Eizellen verläuft über die gesamte beobachtete Zeitspanne von 20 min
annähernd linear. Bei den gereiften Eizellen hingegen wird schon nach 10 min so gut wie der
Endwert bei 20 min erreicht.
Betrachtet man die Auswertung für die Versuche mit den aufgetauten Nebenhodenspermien,
so ist diese schnellere Zunahme des Anteils der PNA-FITC positiven Spermatozoen bei der
ZP in M II im Vergleich zur ZP im GV I zur Zeit von 10 min noch rasanter. Bemerkenswert
ist die geringe Induktion der Akrosomreaktion durch die ungereifte ZP. Der Endwert bei 20
min ist sowohl im Vergleich zu dem bei der GV I-ZP mit Frischsperma als auch bei der M II-
ZP mit ebenfalls aufgetautem Sperma deutlich niedriger (ca. 9 Prozentpunkte).
D Ergebnisse________________________________________________________________
84
a. Verwendung von ejakuliertem Frischsperma
0
5
10
15
20
25
30
35
40
45
50
1 10 20
Zeitpunkt (min)
Ant
eil d
er P
NA
-FIT
C p
os. S
perm
ien
(%)
GV I
M II
b. Verwendung von kryokonserviertem Nebenhodensperma
0
5
10
15
20
25
30
35
40
45
50
55
1 10 20
Zeitpunkt (min)
Ant
eil d
er P
NA
-FIT
C p
os. S
perm
ien
(%)
GV I
M II
Abb. 13: Darstellung des Anteils der in Akrosomreaktion befindlichen Spermien, die an die ZP gebunden sind, in Abhängigkeit vom Beobachtungszeitpunkt
Zur Untersuchung der Einwirkungen der einzelnen Parameter zum Anteil der
akrosomreagierenden Spermien wurde eine multifaktorielle Varianzanalyse durchgeführt. Es
wurde zwischen drei-, zwei- und einfaktorieller Analyse unterschieden.
Alle erhobenen Wahrscheinlichkeitswerte (p, für die gilt: p≤0,001 = statistisch hoch
signifikant; p≤0,05 = statistisch signifikant; p≤0,1 = statistisch auffallend) und das
Bestimmheitsmaß (R2) sind unter 2. in J Anhang aufgeführt.
D Ergebnisse
85
Dreifaktorielle Varinazanalyse:
Die verwendeten Spermienpopulationen, der Reifungsstatus der ZP und der Zeitpunkt hatten
einen statistisch signifikanten Einfluss auf den Anteil der PNA-FITC positiven Spermien. Das
gleiche galt für die Wechselwirkungen der Parameter Reifungsstatus mit Zeitpunkt und
Spermienpopulation mit Zeitpunkt. Die Kombination von Spermienpopulation und
Reifungszustand der ZP und die Dreifachwechselwirkung von Spermienpopulation,
Reifungszustand und Zeitpunkt hatten jedoch keinen statistisch signifikanten Einfluss.
Zweifaktorielle Varianzanalyse:
Hierbei wurden die Versuche aufgrund der nachgewiesenen Einflüsse und Wechselwirkungen
in der dreifaktoriellen Analyse nach Spermienpopulation getrennt ausgewertet.
Innerhalb der Gruppe mit den ejakulierten Frischspermien stieg der Anteil der
akrosomreagierenden Spermien mit der Zeit statistisch hoch signifikant an und die
Wechselwirkung von Reifungsstatus der ZP mit dem Beobachtugnszeitpunkt war statistisch
signifikant. Der Anteil der PNA-FITC positiven Spermien bei der ZP von GV I Eizellen
unterschied sich nicht statistisch signifikant von dem bei der ZP von M II Eizellen.
Bei der Gruppe, in der TG-Sperma eingesetzt wurde, hingegen hatte der Reifungsstatus der
eingesetzten ZP einen statistisch signifikanten Einfluss auf die Induktion der
Akrosomreaktion. Der Zeiteinfluss wurde als statistisch auffallend eingestuft und die
Wechselwirkungen zwischen Reifungsstatus und Zeit spielten hier keine statistisch
signifikante Rolle.
Ebenfalls mit der zweifaktoriellen Varianzanalyse wurden Gruppen untersucht, die nach dem
Reifungsstatus der ZP eingeteilt worden waren.
Die Werte der PNA-FITC positiven Spermatozoen unterschieden sich bei der ungereiften ZP
statistisch nicht signifikant nach der verwendeten Spermienart. Einen statistisch hoch
signifikanten Einfluss wiesen aber sowohl der Beobachtungszeitpunkt als auch die
Wechselwirkungen von diesem mit der Spermienpopulation auf.
Innerhalb der Gruppe der gereiften ZP von Oozyten im M II Stadium erhöhte die Nutzung
von TG-Sperma den Anteil der akrosomreagierenden Spermien statistisch hoch signifikant.
Gleiches galt für den zeitlichen Verlauf. Den Wechselwirkungen von Spermienpopulation und
Zeitpunkt kam eine statistisch auffällige Rolle zu (0,05<p≤0,1).
D Ergebnisse________________________________________________________________
86
Einfaktorielle Varianzanalyse:
Aufgrund der sich ergebenen Abhängigkeiten und Wechselwirkungen der drei- und
zweifaktoriellen Varianzanalyse wurden noch diverse einfaktorielle Analysen erstellt. So
konnten die Zusammenhänge einzelner Parameter genau beschrieben werden. Für die Bildung
einer Untersuchungsgruppe wurden zwei Variablen fest geschrieben und der Einfluss einer
dritten innerhalb dieser Gruppe auf die Induktion der Akrosomreaktion untersucht.
Bei der Verwendung von Frischsperma hatte der Reifungsstatus nur zum Zeitpunkt von 10
min einen statistisch signifikanten Einfluss auf den Anteil der PNA-FITC positiven
gebundenen Spermien.
Betrachtet man hingegen die Verhältnisse beim Einsatz des TG-Spermas, so wurde die
Induktion der Akrosomreaktion durch die gereifte ZP gegenüber der ungereiften sowohl beim
Beobachtungszeitpunkt von 10 min als auch bei 20 min statistisch signifikant verstärkt.
Neben dem Einfluss des Reifungsstadiums der ZP wurde auch die Abhängigkeit vom
Zeitfaktor überprüft.
Der Zeitfaktor hatte beim Gebrauch von Frischsperma mit ungereifter ZP und auch mit
gereifter ZP einen statistisch hoch signifikanten Einfluss auf den Anteil der PNA-FITC
positiven Spermien. Bei Zona pellucida von GV I Oozyten unter Einsatz von aufgetauten
Nebenhodenspermien war dies nicht der Fall, aber bei der gleichen Spermienpopulation mit
Verwendung von gereifter ZP war eine statistische Auffälligkeit nachzuweisen.
Zur Kontrolle des Einwirkens der ZP wurden zu denselben Zeitpunkten wie die Spermien an
der ZP Spermien in Suspension untersucht (alle Angaben siehe unter 2. in J Anhang). Der
Anteil der PNA-FITC positiven Spermien in Suspension unterschied sich statistisch hoch
signifikant von dem der an die ZP gebundenen. Die Zona pellucida hatte folglich in dem
beschriebenen Versuchsaufbau die Fähigkeit zur Induktion der Akrosomreaktion.
Im Vordergrund dieser Untersuchung stand vor allem die Charakterisierung des Einflusses
des Reifungsgrades der ZP auf die Spermatozoen bezüglich der Induktion der
Akrosomreaktion. Aus der bisherigen Darstellung der statistischen Ergebnisse wird deutlich,
dass die größte Unterscheidung im Zeitabschnitt von einer Minute gegenüber zehn Minuten
D Ergebnisse
87
vorlag. Zur konkreteren Auswertung wurde daher in Modellen die Steigung der Geraden
durch die entsprechenden Grafikpunkte bei 1min, 10 min und 20 min ermittelt
(siehe Abb.14).
0
5
10
15
20
25
30
35
40
45
50
55
1 10 20
Zeitpunkt (min)
Ant
eil P
NA
-FIT
C p
os. S
perm
ien
an Z
P
(%)
GV I; ejak. Frischsp.
M II; ejak. Frischsp.
GV I; aufget. Nh-Sp.
M II; aufget. Nh-Sp.
Abb. 14: Darstellung von Geraden durch die ermittelten Diagrammpunkte des Anteils der PNA-FITC positiven Spermien in Abhängigkeit vom Beobachtungszeitpunkt (ejak. Frischsp.= ejakulierte Frischspermien; aufget. Nh-Sp.= aufgetaute Nebenhodenspermien)
Die Gerade verlief bei der Verwendung von ungereifter ZP und ejakulierten Frischspermien
annähernd linear mit einer Steigung von 1,26. Bei der gleichen Zonaart mit kryokonservierten
Nebenhodenspermien ist anzumerken, dass die Zeit keinen statistisch signifikanten Einfluss
besaß und somit die Steigung auch sehr gering (0,12) war.
In der grafischen Darstellung des Versuchsansatzes mit gereifter ZP fiel der zweiphasige
Verlauf mit unterschiedlicher Steigung auf. Dieser Effekt war beim ejakuliertem
Frischsperma besonders ausgeprägt. Für beide Grafen wurden also die Steigung der Geraden
durch die Grafikpunkte bei 1 min bis 10 min und 10 min bis 20 min getrennt berechnet. Bei
den ejakulierten Frischspermien ergab sich im ersten Zeitabschnitt eine Steigung von 2,44, im
D Ergebnisse________________________________________________________________
88
zweiten von 0,01 (keine statistisch signifikante Unterscheidung des Zeiteinflusses von 10 min
gegenüber 20 min) und für den ganzen Grafen 1,13. Nach 10 Minuten war bereits eine Art
Sättigung erreicht. Der beschriebene biphasische Verlauf war unter Verwendung von
kryokonserviertem Nebenhodensperma schwächer ausgeprägt. Die Steigung beläuft sich für
den Bereich von 1 min bis 10 min auf 0,94, für den Bereich von 10 min bis 20 min auf 0,29
und insgesamt auf 0,58.
Die Steigung ist als Maß für die Geschwindigkeit der Induktion der Akrosomreaktion
anzusehen. Diese war unter Verwendung von ejakuliertem Frischsperma innerhalb der ersten
10 Minuten bei den Versuchen mit gereifter ZP ca. doppelt so groß gegenüber denen mit
ungereifter ZP. Bei Einsatz von aufgetauten epididymalen Spermien war die
Anfangsgeschwindigkeit gegenüber von Frischsperma bei gereifter ZP geringer als die Hälfte.
Dennoch war der Anstieg des Anteils der PNA-FITC positiven Spermien auch beim TG-
Sperma in den ersten 10 Minuten wesentlich stärker bei der gereiften ZP als bei der
ungereiften. Dies war vor allem durch die nur minimale Erhöhung des akrosomreagierenden
Anteils der Nebenhodenspermien an der ungereiften ZP begründet.
Zum besseren Vergleich des Einflusses der beiden verwendeten Spermienpopulationen
mussten zunächst beider Ausgangswerte in Suspension betrachtet werden. Schon dort lagen
Spermien vor, die PNA-FITC positiv reagierten. Dies war als sogenannte spontane
Akrosomreaktion, ein Zeichen des Zellverfalls, zu werten. Es war allerdings anzunehmen,
dass die Spermien, die in der kurzen Koinkubationszeit von 1 min an die ZP binden, aus der
vitalen akrosomintakten Teilmenge der Gesamtsuspension stammten. Der Anteil der PNA-
FITC positiven Spermien zu Beginn des Bindungsversuches in Suspension betrugt beim
Frischsperma ca. 8 % und beim TG-Sperma ca. 25 %. Die Ausgangswerte wurden jeweils
aufgrund des möglichen Einflusses der ursprünglichen Spermiensuspension von denen an der
ZP ausgezählten und prozentual dargestellten Werten abgezogen (siehe Abb.15).
Es ergaben sich dabei für alle Versuchsansätze ähnliche Ausgangswerte der PNA-FITC
positiven Spermien an der ZP. Die Reaktionskinetiken blieben unverändert, da die
Darstellungen in Abbildung 15 im Vergleich zu Abbildung 14 nur um die jeweiligen
Ausgangswerte in der Suspension in Richtung x-Achse verschoben wurden.
D Ergebnisse
89
Die statistisch signifikanten Einflüsse, die in den beschriebenen Varianzanalysen ermittelt
wurden, blieben fast unverändert. Es änderte sich lediglich das Einwirken der Spermien. In
der zweifaktoriellen Varianzanalyse innerhalb der Gruppe der ungereiften ZP waren die
Durchschnittswerte der PNA-FITC positiven Spermien der aufgetauten Nebenhodenspermien
im Vergleich zum Frischsperma jetzt statistisch signifikant niedriger.
0
5
10
15
20
25
30
35
40
45
1 10 20
Zeitpunkt (min)
Ant
eil P
NA
-FIT
C p
os. S
perm
ien
an Z
P
(%)
GV I; ejak. Frischsp.
M II; ejak. Frischsp.
GV I; aufget. Nh-Sp.
M II; aufget. Nh-Sp.
Abb.15: Darstellung von Geraden durch die ermittelten Diagrammpunkte des Anteils der PNA-FITC positiven Spermien in Abhängigkeit vom Beobachtungszeitpunkt nach Abzug der Ausgangswerte der jeweiligen Spermiensuspension (ejak. Frischsp.= ejakulierte Frischspermien; aufget. Nh-Sp.= aufgetaute Nebenhodenspermien)
Die bisher beschriebenen Ansätze waren vor allem geeignet, die unterschiedlichen Einflüsse
des Reifungsgrades der ZP herauszuarbeiten. Durch die ähnlichen Werte beim Zeitpunkt von
einer Minute wurde belegt, dass der Reifungsgrad der ZP die Selektion der Spermien aus der
Suspension nicht beeinflusst. Spermienpopulation abhängige Einwirkungen waren innerhalb
einer Beobachtungsgruppe mit gleichen verwendeten Spermien bei ungereifter und gereifter
ZP einheitlich. Für Aussagen über die Induktion der Akrosomreaktion durch die jeweilige ZP
musste auch die Entwicklung des Anteils der PNA-FITC positiven Spermien in der
Kontrollsuspension berücksichtig werden.
D Ergebnisse________________________________________________________________
90
Unter der Annahme, dass alle sich in der Suspension befindlichen Spermien die gleiche
Chance hatten, in der Koinkubationszeit von einer Minute an die ZP zu binden, wurden
folgendermaßen Daten erhoben. Von den jeweiligen Prozentwerten der PNA-FITC positiven
Spermien, die an die ZP gebunden hatten, wurden die entsprechenden Werte der Spermien in
der Kontrollsuspension zum selben Zeitpunkt abgezogen. Man erhielt so einen Wert, der als
Maß der Induktion der Akrosomreaktion durch die ZP angesprochen werden konnte.
-5
0
5
10
15
20
25
30
35
1 10 20
Zeitpunkt (min)
Ant
eil d
er P
NA
-FIT
C p
osit
iven
Sp
erm
ien
an d
er Z
P (
%)
GV I;ejak. Frischsp.
M II; ejak. Frischsp.
GV I; aufget. Nh-Sp.
M II; aufget. Nh-Sp.
Abb. 16: Induktion der Akrosomreaktion durch die ZP; Differenzen des Anteils der PNA-FITC positiven Spermien an der ZP und in Kontrollsuspension in Abhängigkeit von der Zeit (ejak. Frischsp.= ejakulierte Frischspermien; aufget. Nh-Sp.= aufgetaute Nebenhodenspermien)
Aus der Abbildung 16 im Vergleich zu den Abbildungen 14 und 15 war zu entnehmen, dass
der große Einfluss der gereiften ZP innerhalb der ersten 10 Minuten auf die Induktion der
Akrosomreaktion bei den ejakulierten Frischspermien durch die Differenzbildung mit den
Kontrollwerten noch verstärkt wurde. Der schwächere Einfluss der ungereiften ZP auf die
Frischspermien war jedoch noch stärker ausgeprägt als der der gereiften ZP auf die
aufgetauten Nebenhodenspermien. Beim epididymalen TG-Sperma fiel wieder der
biphasische Verlauf des Grafen bei gereifter ZP auf. Im Zeitabschnitt von 1 min zu 10 min
D Ergebnisse
91
wurde durch die gereifte ZP die Akrosomreaktion wesentlich stärker induziert als in den
folgenden 10 Minuten. Die Fähigkeit der ungereiften ZP, bei den gebundenen
Nebenhodenspermien gegenüber denen in der Kontrollsuspension die Akrosomreaktion
hervorzurufen, wurde mit fortschreitender Zeit immer geringer. Zum Zeitpunkt von 20 min
war kein Unterschied mehr festzustellen.
Weitere bei der Auswertung der an die ZP gebundenen Spermien erhobene Parameter waren
der Anteil der Spermien mit abgelöstem Akrosom und der der isolierten Kopfkappen (genaue
Werte siehe unter 2. in J Anhang).
Spermien mit abgelöstem Akrosom wurden relativ selten beobachtet. Unabhängig von der
Spermienpopulation und dem Reifestatus der ZP wurden bei einer Minute etwa 1,5 %, bei 10
Minuten ca. 2,4 % und bei 20 Minuten ca. 3,0 % Spermien ohne Kopfkappe beobachtet. Fast
alle der PNA-FITC negativen Spermien besaßen also noch ihr Akrosom.
Die vom Spermatozoon isolierten PNA-FITC positiven Kappen wurden vergleichsweise in
einem höheren Maße gefunden. Sie sind also nicht als abgelöste Akrosome noch an die ZP
gebundener Spermien zu betrachten. Sie konnten auch nicht vermehrt in der Nähe von den
wenigen Spermien ohne Kopfkappe lokalisiert werden. In der Spermiensuspension wurden
allerdings keine isolierten Kappen gefunden, so dass diese als Reste ehemals gebundener,
durch die Waschvorgänge abgelöster Spermien anzusehen sind. Relevant für die
Versuchsauswertung war, dass keine Unterschiede zwischen dem Einsatz von ungereiften und
gereifter ZP hinsichtlich des Anteils an abgelösten Akrosomen bestand.
Bei ejakuliertem Sperma bewegten sich die Werte für die isolierten Kappen an der ZP in etwa
von 5 % zum Zeitpunkt von einer Minute über ca. 15 % bei 10 min bis ca. 20 % bei 20 min.
Der Einsatz von aufgetautem Nebenhodensperma rief Daten von ca. 18 % bei 1 min, 22 % bei
10 min und 30 % bei 20 min hervor.
E Diskussion________________________________________________________________
92
E Diskussion
1. Verhalten der porcinen Zona pellucida in der PAGE
Die biochemische Analyse der ZP begann mit der Auftrennung der Glykoproteine mittels
Polyacrylamidgelelektrophorese (PAGE). In der eindimensionalen PAGE (1D-PAGE) wurde
eine Bande um ca. 90 kDa und eine breite, nicht scharf begrenzte Bande mit einem relativen
Molekulargewicht von 45-60 kDa ermittelt. Diese Ergebnisse stimmen mit denen von
YUREWICZ et al. (1983) in etwa überein. Diese Arbeitsgruppe erhielt zwei Banden mit 77-
97 kDa und 46-70 kDa. Die höher molekulare Bande entspricht ZPA und die andere dem
Gemisch von ZPB/ZPC. Durch den hohen Glykosylierungsgrad der einzelnen Proteine
erstreckt sich diese Bande über einen großen Molekulargewichtsbereich. Diese Heterogenität
wird durch posttranslationale Strukturierungsprozesse, wie dem Einbau von Kohlenhydrat-
strukturen, Sulfatierung und Sialylierung, hervorgerufen. Bei ZPA beträgt der Proteinanteil
ca. 85 % und bei ZPB/ZPC ca. 78 % des Gesamtgewichtes der jeweiligen Glykoproteine
(HEDRIK u. WARDRIP 1986).
Analog zu den entsprechenden Literaturstellen wurden keine Unterschiede in den PAGE von
ZP von Eizellen aus frischen oder tiefgefrorenen Oozyten beobachtet (DUNBAR et al. 1980;
HEDRIK u. WARDRIP 1986). Die Gewinnungsart der ZP, entweder Punktion einzelner
Follikel oder Massenaufarbeitung mit Siebtechnik, hatte ebenfalls keinen erkennbaren
Einfluss auf die PAGE.
Die meisten beschriebenen 2D-PAGE der porcinen ZP Glykoproteine wurden unter
reduzierenden Bedingungen durchgeführt. DUNBAR und RAYNOR (1980) hielten die
Reduktion für das Erreichen der Dissoziation der einzelnen Makromoleküle für notwendig.
Die zweidimensionale Auftrennung zeigte so stets vier Spotbanden bei ca. 90, 65, 55 und 25
kDa. Es wurde nachgewiesen, dass die 65 kDa und 25 kDa Anteile Fragmente der 90 kDa
Komponente von ZPA sind und nur durch die Spaltung von Disulfidbrücken entstehen
(HEDRIK u. WADRIP 1987). Es existiert im porcinen ZPA eine vorgegebene Spaltstelle
zwischen Ala168 und Asp169. In ovariellen Oozyten erfolgt eine partielle Aufspaltung des
E Diskussion
93
Zweikettenmoleküls durch Reduktion der Disulfidbrücken in einen 65 kDa und einen 25 kDa
Anteil (s. Abb. 17). Eine vollständige Spaltung dieser Prozessierungsstelle erfolgt erst nach
der Befruchtung der Oozyte.
Abb. 17: Proteolytisches Processing porcinen ZPA (Schema) ZP2 = 90 kDa, ZP1 = 65 kDa und ZP4 = 25 kDa Komponente von ZPA
Für die vorliegenden Arbeit sollten die Proteine der ZP so wenig wie möglich durch die
Aufarbeitung für die PAGE verändert werden. Es wurde daher sowohl auf Reduktion als auch
auf Enzymbehandlungen verzichtet, da im anschließenden Lektinblot die exponierten
Zuckerstrukturen analysiert werden sollten. In der 2D-PAGE wurde die ZP entsprechend der
1D-PAGE in zwei separierte Spotbanden aufgetrennt. Diese verliefen ca. von 120-95 kDa bei
pI 3,9-6,7 und von 60-55 kDa bei pI 3,0-7,8 (vgl. HEDRIK u. WARDRIP 1986: 2 Banden bei
101-73 kDa u. 73-46 kDa). Es wurden 10%ige Trenngele verwendet, da sich die
Bandenbereiche unter nicht reduzierenden Bedingungen so am besten darstellen ließen. Diese
wurden auch für die reduzierenden Ansätze verwendet, die zum Vergleich angefertigt wurden.
Nach Reduktion konnten so jedoch nur drei, nämlich die 90, 65 und 55 kDa Anteile der ZP
Proteine dargestellt werden. Das 25 kDa Fragment von ZPA war nur bei höher
Ala168 Asp169
ZP4 ZP1
ZP4 ZP1
Verbindung des Zweikettenmoleküls (ZP2) durch Disuldfidbrücken
potentielle Spaltstelle
E Diskussion________________________________________________________________
94
konzentrierteren Gelen zu finden. Zum besseren Vergleich wurde in der vorliegenden Arbeit
die elektrophoretische Auftrennung gewählt, mit der sich die nicht reduzierte Form der ZP
Proteine am optimalsten darstellen ließ. Das 25 kDa Fragment besteht auch nur aus 4 % des
Proteinanteils der Zona pellucida (HEDRIK u. WARDRIP 1986).
Interessant bei der 2D-PAGE war der Vergleich von ungereifter und gereifter ZP. Während
der Reifung, sowohl in vivo als auch in vitro, unterliegt die Oozyte bestimmten
Veränderungen. Am eindeutigsten ist die Veränderung des Kernstatus darzustellen. Mit
diversen Färbetechniken können die Chromatinstrukturen im Kern sichtbar und die
Entwicklung vom Germinalvesikel I Stadium zur Metaphase II dargestellt werden. Das
abgeschürte Polkörperchen in Metaphase II ist auch ohne Anfärbung mit einem Mikroskop
auszumachen. Diese Untersuchungen gehören zur Routine bei der Beurteilung des
Reifungsstatus bei Eizellen.
Während des Reifungsprozesses finden jedoch auch noch weitere Veränderungen an der
Oozyte statt, die durchaus entscheidende Rollen bei der weiteren Entwicklung der Zygote
spielen können. Die Mitochondrien sind in der M II nicht mehr in Gruppen am Rand
angeordnet, sondern gleichmäßig über das gesamte Ooplasma verteilt (CRAN 1985). In den
Randbereichen hingegen verdoppelt sich die kortikale Granula, deren Verfügbarkeit mit dem
Vermögen der Oozyte zur Ausbildung des Polyspermieblocks korreliert (DUCIBELLA
1996).
Untersuchungen zur Veränderung der Zona pellucida wurden zumeist vergleichend von ZP
ungereifter Eizellen und ZP von bereits befruchteten Eizellen, nicht im Vergleich zu
Metaphase II Stadien, durchgeführt. HATANAKA et al. (1992) untersuchten bei Schweinen
die ZP von in vitro gereiften M II Stadien und von fertilisierten Oozyten. Sie stellten fest, dass
die benötigte Zeit zur Solubilisation der ZP von M II Oozyten 30-40% kürzer war. Die
verlängerte Zeit bei der ZP von befruchteten Oozyten begründeten sie mit den Veränderungen
im Rahmen des Zona hardenings, induziert durch die Befruchtung. In der 2D-PAGE Analyse
konnten sie eine deutliche Verringerung der Menge an ZPA bei den ZP Proteinen von
befruchteten Eizellen aufzeigen, wohingegen Veränderungen bei den anderen Proteinfamilien
kaum zu beobachten waren. Sie machten dafür die durch Exozytose im Rahmen des
Polyspermieblocks freigesetzten Enzyme der kortikalen Granula verantwortlich. Weitere
E Diskussion
95
Veränderungen der ZP nach der Befruchtung in vivo sind die Einlagerungen von
Glykoproteinen aus dem Eileiter (HEDRIK et al. 1987).
Die Veränderungen nach der Befruchtung sind also vor allem durch geänderte
Funktionen/Aufgaben (Polyspermieblock, Schutz der Zygote) und Ortswechsel (in vivo:
Wanderung vom Eileiter in den Uterus) bedingt.
In der vorliegenden Arbeit sollten jedoch nun die Verhältnisse bis kurz vor der Befruchtung
untersucht werden. Erstmalig konnte ein Shift der Spotbanden in den sauren pI-Bereich beim
Vergleich der ZP von GV I Stadien und der ZP von in vitro gereiften M II Stadien aufgezeigt
werden. Es findet folglich eine Veränderung während der Reifung auf biochemischer Ebene
statt. Die Zunahme der sauren Anteile der ZP Glykoproteine kann durch diverse
Umbauprozesse hervorgerufen werden. Möglich wären Sulfatierungen, Sialylierungen und
veränderte Kohlenhydratstrukturen. Weiterhin sind auch Veränderungen innerhalb der
Polypeptidkette nicht vollständig auszuschließen.
Die Veränderungen des Proteinmusters der ZP Glykoproteine während der In-vitro-Reifung
können nicht als erste Stufe zu den bereits bekannten Modifikationen der ZP Proteine von
porcinen befruchteten Eizellen aufgefasst werden. Die Studien von HATANAKA et al. (1992)
zeigten, dass unter reduzierenden Konditionen bei der ZP von IVF Oozyten die 90 kDa
Spotbande (ein Teil von ZPA) nicht mehr in der 2D-PAGE zu identifizieren ist. Während der
Befruchtung unterliegt ZPA der vollständigen Spaltung der Disulfidbrücken im Rahmen des
Proteinprocessing (vgl. Abb. 17). Weitere Veränderungen der ZPA Anteile von befruchteten
Oozyten werden vermutlich durch Enzyme bewirkt, die im Verlauf der Fertilization
freigesetzt werden. PRASAD et al. (2000) beschreiben zu diesem Thema, dass sich die
morphologische Erscheinung im Lichtmikroskop von trypsin-behandelter ZP nicht von dem
der unbehandelten ZP unterscheidet. In der 2D-PAGE ist hingegen eine partielle Proteolyse
des 90 kDa Anteils und eine vollständige Proteolyse der 65 kDa und 25 kDa Anteile von ZPA
zu erkennen.
Bei den Untersuchungen von HATANAKA et al. (1992) wiesen die pI-Bereiche der
Glykoproteine im Gegensatz zu den von uns durchgeführten Versuchen (s. 2.2. 2D-PAGE der
Glykoproteine der Zona pellucida unter D Ergebnisse) von GV I über M II bis zu den
befruchteten Stadien keine Veränderungen auf. Eine mögliche Ursache dafür ist in der
Reduktion der Proteine zu suchen.
E Diskussion________________________________________________________________
96
2. Charakterisierung der ZP durch Antikörper und Lektine
Durch die immunologische Untersuchung der einzelnen Glykoproteine der ZP im Western
Blot nach zweidimensionaler Auftrennung konnte die Zuordnung der Spotbanden zu den
einzelnen Glykoproteinen bestätigt werden. ZPA, welches sich vom relativen
Molekulargewicht her mit um 90 kDa deutlich von dem Bereich um 55 kDa von ZPB/ZPC
abhebt, wurde von dem entsprechenden Antikörper als solches erkannt. Eine genaue
Abgrenzung des Bereiches von ZPB zu dem von ZPC war nicht möglich, da eine große
Überlappung vorlag. Diese ist als reale Überschneidung zu werten und weniger als
Kreuzreaktivitäten der Antikörper. Analog der Ergebnisse von BLASE und Mitarbeitern
(1998) konnten jedoch Unterscheidungstendenzen bezüglich des pI-Bereiches festgestellt
werden. ZPB erstreckt sich bis zum basischen Ende des Proteinbereiches und das ZPC
konzentriert sich mehr in den sauren pI-Bereichen. BLASE et al. (1998) weisen ZPB im
Vergleich zu ZPC eine etwas höhere Molekulargewichtsregion zu. Diese Ergebnisse konnten
nicht nachvollzogen werden. Dieser Unterschied könnte darauf zurückzuführen sein, dass
unsere entsprechenden Versuche unter nicht reduzierenden Bedingungen und nicht mit
Reduktionsmittel durchführt wurden. Der Einsatz von Reduktionsmittel bewirkt nicht nur eine
Aufspaltung von ZPA, sondern sicherlich auch einige noch nicht näher beschriebene
Veränderungen innerhalb von ZPB/ZPC.
In den vergangenen Jahren mehrten sich die Erkenntnisse über die Bedeutung der
Kohlenhydratstrukturen bei der Vermittlung von bestimmten Signalen und Prozessen im
lebenden Organismus. Auf dem Gebiet der Forschungen um die Zona pellucida kamen
Lektine als Erkennungsmarker von bestimmten Kohlenhydratstrukturen schon vielfältig zum
Einsatz. Es kann mit Lektinen zum einem gezielt nach vermuteten Strukturen gesucht werden,
zum anderen aber auch durch den Einsatz von verschiedenen Lektinen sich ein Überblick über
beteiligte Oligosaccharide verschafft werden. Die Zona pellucida wurde in vielen Studien oft
vor einer Inkubation mit Lektinen mit Glykosidasen behandelt aufgrund einer möglichen
Maskierung von definerten Zuckerstrukturen durch terminale Kohlenhydrate und/oder
Säurereste. Dies ist sinnvoll bei der Aufklärung der Gesamtheit aller in der ZP
vorkommenden Strukturen. Beispielsweise können mittels Neuraminidase Sialsäurereste
E Diskussion
97
abgespalten werden. Eine Desulfatierung und Deacetylierung sind ebenfalls möglich. Zur
Auftrennung von ZPB und ZPC wird oft Endo-β-Galaktosidase eingesetzt, die durch
Abspaltung von Laktosamineinheiten zur Verringerung der Heterogenität der Glykoproteine
beiträgt und so die Separierung der beiden Proteine ermöglicht. Da die
Kohlenhydratstrukturen der porcinen ZP (besonders von ZPB u. ZPC, zur Übersicht siehe
NAKANO u. YONEZAWA 2001) weitestgehend bekannt sind, war es nicht das Ziel dieser
Arbeit, durch die lektinologische Analysen bestimmte Oligosaccharide der ZP nachzuweisen.
Es sollten vielmehr durch möglichst wenige Manipulationen der Glykoproteine die für
Lektine freizugänglichen Kohlenhydrate und mögliche Veränderungen durch die IVM
dargestellt werden. Deshalb wurden die Versuche unter nicht reduzierenden Bedingungen und
ohne Modifizierungen, wie z.B. durch Enzymspaltungen, durchgeführt.
Folgende Zuckerstrukturen der nativen mittels 2D-PAGE aufgetrennten ZP Glykoproteine
konnten im Lektinblot ermittelt werden:
Das Lektin Con A detektiert Mannose (und/oder N-Acetylglukosamin), die typisch für das
Trimannosyl-Core der N-Glykane ist (vgl. Abb. 18). Zu beachten ist weiterhin, dass Con A
die Strukturen von diantennären Glykoproteinen, nicht aber von tri- und tetraantennären
erkennt, da beim Schwein keine Zuckerverknüpfungen vom „High-Mannose“-Typ vorhanden
sind. Auffällig war, dass stark positive Con A Signale auf den ZPA Bereich beschränkt
waren. Dies galt gleichermaßen für ungereifte und gereifte ZP. Das Vorhandensein von
mannosehaltigen, diantennären Kohlenhydratketten ist zwar auch für ZPB und ZPC belegt
(NAKANO u. YONEZAWA 2001), diese scheinen aber maskiert oder in einem zu geringen
Anteil vorzuliegen. Die Glykoproteinstrukturen von ZPA sind im Vergleich zu denen von
ZPB und ZPC weniger untersucht. Mittels N-terminaler Sequenzierung konnte in unsere
Arbeitsgruppe für über Con A Affinitätschromatographie isolierte diantennäre N-Glykane
eine dominante Glykosylierungsstelle im porcinen ZPA an Asn268 gefunden werden
(EKHLASI-HUNDRIESER et al., unveröffentlicht).
Bei den anderen eingesetzten Lektinen konnten keine Unterschiede innerhalb der einzelnen
Glykoproteine beobachtet werden. Mit AAA (vgl. Abb. 18) konnte der für die porcine ZP
typische hohe Fukosylierungsgrad dargestellt werden. ECA detektierte die Strukturen N-
Acetylgalaktosamin, N-Acetyllaktosamin oder terminale Galaktose innerhalb neutraler N-
E Diskussion________________________________________________________________
98
glykosidisch gebundener Ketten. Im Gegensatz zu HOKKE und Mitarbeitern (1993), die in
porciner ZP nur (2-3)-verknüpfte Sialsäure fanden, konnte hier neben dieser Struktur mit
MAA II auch (2-6)-verknüpfte Sialsäure mit SNA nachgewiesen werden. Auffällig war, dass
beide Lektine, obwohl sie relativ saure Strukturen erkennen, im Bereich der Anode eher
schwache Signale besaßen und ihr Signalmaximun mehr in der Mitte des
Spotbandenbereiches der Glykoproteine lag. Jacalin und ACA erkennen beide Strukturen, die
typischer Weise in O-Glykanen vorliegen (α-D-Gal-β(1-3)-GalNAc), wobei Jacalin die
neutrale und ACA die saure sialylierte Form markiert (vgl. Abb. 18). Weitere positive Signale
konnten mit DSA für repetierende N-Acetyllaktosamineinheiten nachgewiesen werden.
Die an terminale Galaktose bindenden Lektine PNA (β-D-Gal) und GS I (α-D-Gal) riefen
keine Markierungssignale hervor. Dies stimmt mit den Ergebnissen andere Arbeitsgruppen
überein. PARILLO et al. (2001) erhielten in der Histochemie von ZP von Wildschweinen bei
PNA (β-D-Gal) erst ein Signal nach Einsatz von Neuraminidase und α–D-Gal konnte nur
nach Desulfatierung nachgewiesen werden. Auch SKUTELSKY et al. (1994) erhielten bei
feliner, caniner und porciner ZP, jeweils ohne enzymatische oder chemische Vorbehandlung,
bei der Anwendung von PNA und GS I keine positive Detektion. Allerdings bei der ZP von
niederen Tieren wie Maus, Ratte und Hamster ließ sich mit PNA β-D-Gal auch an der ZP im
nativen Zustand nachweisen. Dies belegt, dass Sulfatierung und Sialylierung der ZP zu den
höher entwickelten Tieren hin zunimmt. Bei der Maus ist bekannt, dass die terminale
Galaktose als Erkennungsmerkmal für die Spermatozoen-Zona pellucida Bindung eine
wichtige Rolle spielt (BLEIL u. WASSARMAN 1988). Diese ist nach den
Lektinbindungsstudien auch gut zugänglich. Da dies u.a. bei der porcinen ZP nicht der Fall
ist, spricht dies für differenziertere Bindungsvorgänge.
E Diskussion
99
N-Glykane:
NeuAcα(2-3)Galβ(1-4)GlcNAcβ(1-2) Manα(1-6) Fucα(1-6)
Manβ(1-4)GlcNAcβ(1-4)GlcNAc-Asn NeuAcα(2-6)Galβ(1-4)GlcNAcβ(1-2) Manα(1-3)
O-Glykane:
-Ser/Thr -Ser/Thr
Abb. 18: Lektine und die von ihnen erkannten Kohlenhydratstrukturen ( )
Abgesehen von der vermehrten Acidität zeigten die Lektinmuster im Vergleich von ZP von
ungereiften und gereiften Oozyten keine Veränderungen. Die pI-Verschiebung stellte sich in
der lektinologischen Analyse allerdings mit einer Differenz von ca. zwei pI-Einheiten zu dem
in der Gelanfärbung mit Silberreagenz von ca. einer pI-Einheit noch ausgeprägter dar.
NeuAcα(2-3/6)Galβ(1-3)GalNAc Galβ(1-3)GalNAc
Galβ(1-4)GlcNAcβ(1-6) Manα(1-6) Fucα(1-6) Galβ(1-4)GlcNAcβ(1-2)
Manβ(1-4)GlcNAcβ(1-4)GlcNAc - Asn Galβ(1-4)GlcNAcβ(1-2)
Manα(1-3)
[Galβ(1-4)GlcNAcβ(1-3)]N-Galβ(1-4)GlcNAcβ(1-4)
MAA II Con A
SNA
DSA
AAA
ACA Jacalin
6 HSO4
potentielle Sulfatierungsstelle am C-6-Atom von N-Acetylglukosamin
E Diskussion________________________________________________________________
100
Bei der Interpretation von Lektinbindungsstudien muss einiges beachtet werden. Es besteht
immer die Möglichkeit, dass bestimmte Strukturen nicht erkannt werden, da Oligosaccharide
sehr komplexe Verbindungen sind. Das Bindungsverhalten der Lektine ist so
substratspezifisch entsprechend dem von Enzymen. Es erfolgt aber eine Bindung über
Wasserstoffbrücken und hydrophobe Wechselwirkungen wie bei einer Antigen-Antikörper-
Reaktion. Neben diesen molekularen Wechselwirkungen kann die Tertiärform der
Molekülketten und die Anwesenheit von maskierenden Strukturen das Bindungsverhalten von
Lektinen erheblich beeinflussen.
Daher werden oft Lektine, die gleiche oder ähnliche Kohlenhydrate erkennen, parallel
eingesetzt, um falsch negative Ergebnisse möglichst zu vermeiden. So wurden von vielen
Autoren als α-L-Fukose erkennendes Lektin UEA I (Ulex europaeus I) verwendet, welches in
der Histochemie keine Strukturen innerhalb der ZP zu markieren scheint (z.B. SKUTELSKY
et al. 1994; TREDE 1995). Bei den in dieser Arbeit beschriebenen Versuchen wurde statt
UEA I das Lektin AAA eingesetzt, welches auch den durch moderne Zuckeranalysemethoden
nachgewiesenen hohen Anteil an Fukose in der ZP des Schweins erkennen konnte.
Maskierungen von Sacchariden in der ZP sind z.B. durch andere Kohlenhydrate, Sulfate und
Sialsäurereste möglich. Es handelt sich bei letzteren beiden um negativ geladene Strukturen,
die u.a. für den sauren Charakter der ZP in der isoelektrischen Fokussierung verantwortlich
gemacht werden können. Aufgrund dieser Acidität wären eine vermehrte Sialylierung
und/oder Sulfatierung der Zona pellucida während der In-vitro-Maturation eine mögliche
Ursache für den nachgewiesenen pI-Shift in der 2D-PAGE.
Bedeutung von Sialylierung und Sulfatierung der ZP Studien bei diversen Tierarten haben gezeigt, dass die ZP reich an Sialsäureresten ist
(AVILES et al. 1994; PARILLO et al. 1996). Die negative Sialsäure ist aufgrund ihrer
Ladung in Bindungen und Transporte von positiv geladenen Teilchen involviert. Diese
spielen eine Rolle bei der Hydratation der ZP. Zusätzlich tragen die Sialsäurereste dazu bei,
dass dem Spermium die Penetration durch die ZP ermöglicht wird. Auf die Spermienbindung
an die Zona pellucida scheint die Sialsäure einen differenzierten Einfluss zu besitzten. Bei der
humanen ZP konnte gezeigt werden, dass die chemische Modifikation der terminalen
Sialsäurereste eine deutliche Reduktion der Spermienbindungskapazität der ZP hervorruft
E Diskussion
101
(OZGUR et al. 1998). Die Behandlung der ZP mit Neuraminidase bewirkt allerdings einen
signifikanten Anstieg der Anzahl der an die ZP gebundenen Spermatozoen. Diese Ergebnisse
lassen die Koexistenz von durch Sialsäure vermittelten Bindungen und durch Sialsäurereste
maskierten Bindungsstellen vermuten.
Die Sialylierungen über α(2-3)-Verknüpfungen sind relativ starr, aber in Verbindung mit den
besser frei drehbaren α(2-6)-Verknüpfungen erhält die ZP einen vikös-elastischen Charakter
(PARILLO u. VERINI-SUPPLIZI 2001). Mit dem Lektin SNA konnte in der vorliegenden
Arbeit der geringe, aber eindeutig vorhandene Anteil der α(2-6)-Verbindungen nachgewiesen
werden.
Sialsäurereste spielen folglich eine bedeutende Rolle bei den Befruchtungsvorgängen. Die
erbrachten lektinologischen Untersuchungen weisen jedoch nicht auf eine vermehrte
Sialylierung durch die IVM hin. Die Intensität des Bindungsmusters von SNA bei gereifter
ZP war nicht gesteigert im Vergleich zur ungereiften ZP.
Sulfate sind ebenfalls negativ geladene Strukturen, die zum sauren Charakter der ZP mit
beitragen. Sulfatierte Oligosaccharide konnten bereits bei den Glykoproteinen der porcinen
ZP nachgewiesen werden (MORI et al. 1998; PARILLO et al. 2000). Es ist bekannt, dass die
Sulfatierung bei der Bioaktivität von Glykoproteinen eine Rolle spielt, jedoch inwieweit sie
für die Prozesse innerhalb der Befruchtungsvorgänge relevant ist, muss noch diskutiert
werden. So führen Antikörper gegen sulfatierte Glykoproteine der ZP zur Immuno-
kontrazeption (PATERSON et al. 1996). JONES (1991) konnte zeigen, dass Oligosaccharide
mit Sulfatresten Proacrosin binden und mit als sekundäre Rezeptoren innerhalb der
Spermatozoon-Oozyten-Bindung agieren.
Mit der möglichen wichtigen funktionellen Rolle der Sulfatierung und Sialylierung befassten
sich in Studien LIU et al. (1997). Dabei wurde gezeigt, dass die Acidität von mZPC u.a. von
der Verknüpfung mit Sialsäureresten abhängt. Der pI-Wert stieg nach der Behandlung mit
Neuraminidase von ca. 4,7 auf ca. 6,0. Weiterhin wurde unter In-vitro-Bedingungen die
Fähigkeit von partiell deglykosylierten, desulfatierten oder desialylierten ZPC, Spermien zu
binden und die Akrosomreaktion zu induzieren, geprüft. Allerdings schienen Sulfatierung,
Sialylierung und der Grad der Glykosylierung bei der Bioaktivität von murinen ZPC keine
Rolle zu spielen. Inwieweit diese Erkenntnisse über den anscheinend fehlenden Einfluss von
Sulfatresten und Sialinsäureresten von der Maus auf höher entwickelte Tiere, wie dem
E Diskussion________________________________________________________________
102
Schwein, übertragen werden können, ist fraglich. Wie schon beschrieben, ist zum einen der
Aufbau der ZP bei Nagetieren wesentlich einfacher und zum anderen wird bei der Maus die
Spermienbindung O-Glykanen des ZPC zugesprochen.
Bei der porcinen ZP sind N-Glykane von ZPB mit Unterstützung der N-Glykane von ZPC in
die primäre Spermienbindung involviert. Während bei der Maus die Sialylierung ausgeprägter
ist (NOGUCHI u. NAKANO 1993), ist der Sulfatanteil der porcinen ZP besonders hoch
(NOGUCHI u. NAKANO 1992). Eine mögliche Sulfatierungstelle ist die Verknüpfung an der
C-6 Position von N-Acetylglukosamin innerhalb einer Laktosamineinheit (s. Abb. 18). N-
Acetyllaktosamineinheiten konnten hier durch das Lektin DSA nachgewiesen werden. Die
Laktosamineinheiten kommen innerhalb der N-Glykane oft in unverzweigter sich mehrfach
wiederholender Form vor, welches eine ausgeprägte Sulfatierung bewirken kann. Zusätzlich
wurden beim Schwein auch Sulfatreste an sich nicht repetierenden Einheiten und an der C-3
Position der N-Acetylglukosaminreste am reduzierten Ende gefunden (MORI et al. 1998).
3. Ultrastrukturelle Untersuchung der Zona pellucida
Mit der Rasterelektronenmikroskopie der intakten Eizellen mit AAA und Con A konnte eine
Mengenverteilung der exponierten Kohlenhydratstrukturen entsprechend der lektinologischen
Analysen der auf PVDF-Membranen transferierten ZP Glykoproteine dargestellt werden. Die
Markierung mit AAA zeigte sich fast flächendeckend und bestätigte somit wieder den hohen
Fukosylierungsgrad der porcinen ZP. Die Kügelchen mit Con A waren mehr isoliert über die
Oberfläche verteilt und weniger in den sich zentripedal verkleinernden Poren zu finden. Die
Zuckerstrukturen α-D-Mannose und α-D-GlcNAc, die vorliegend in diantennären Ketten von
Con A erkannt werden, sind an der Oberfläche der ZP folglich gut zugänglich. Die Muster
von Con A positiven Strukturen wurden an der humanen ZP von MICHELMANN und
Mitarbeitern (2001) untersucht. In dieser Studie konnten Verteilungen der Con A beladenen
Mikrobeads analog zur Spermienverteilung dargestellt werden. Statt der Goldkopplung mit
Silverenhancement, die die Goldpartikel auf ca. 250 nm wachsen lässt, wurden von ihm mit
Con A beladene Microbeads verwendet. Deren Größe belief sich auf ca. 2,8 µm und entsprach
E Diskussion
103
somit eher der Spermienkopfgröße, so dass die Microbeads als eine Art künstliches Spermium
Bindungsstellen markierten. Für ein solches Vorhaben sicherlich gut geeignet sind die
Microbeads allerdings zu groß für Untersuchungen, die sich mehr auf die Zuckerpräsentation
im allgemeinen und nicht auf die Spermienverteilung beziehen. Aufgrund des größeren
Durchmessers ist eine Markierung innerhalb der Poren der ZP nur schwer möglich.
Zur Zeit laufen noch Versuche mit gereiften Oozyten. Morphologisch bestehen bei der
unbehandelten ZP im REM zwischen ungereifter und gereifter ZP keine Unterschiede
(SCHWARTZ, persönliche Mitteilung). Die Wandlung des gitterartigen Netzwerkes der ZP
ungereifter Eizellen zu einer glatten und kompakteren Struktur konnte erst nach der
Fertilisation dargestellt werden. VANROOSE et al. (2000) wiesen dies für bovine ZP und
FUNAHASHI et al. (2001) für porcine ZP nach. Letztere konnten auch zeigen, dass sich der
Grad der fibrillären Aggregation von der ZP von in vivo erzeugten Zygoten von der ZP von in
vitro erzeugten Zygoten unterscheidet. Das In-vivo-Produkt stellt sich kompakter dar.
Veränderungen der ZP innerhalb der IVM konnten mit normaler REM nicht dargestellt
werden. Die lektinologischen Analysen der mittels 2D-PAGE separierten ZP Glykoproteine
zeigten keine Unterschiede zwischen GV I und M II Stadien bei den Lektinmustern. Nur der
pI-Shift, der auch in der Proteinanfärbung zusehen war, stellte eine Veränderung dar. Aus
diesem Grund sind auch für die Lektinverteilungen über die ZP intakter Eizellen vergleichend
zwischen ungereiften und gereiften kaum Unterschiede zu erwarten. In einer
elektronenmikroskopischen Auswertung goldgekoppelter Lektine in der Zytochemie von
muriner ZP konnte gezeigt werden, dass Veränderungen im Muster der Lektinmarkierungen
nach der Befruchtung auftreten (AVILES et al. 1997). Die Markierungen durch MAA II, PNA
und AAA waren nach der Fertilisation schwächer und die durch RCA I stärker. Diese
Untersuchung gibt Hinweise auf Veränderungen der exponierten Kohlenhydratstrukturen im
Rahmen von Befruchtung und Zona hardening. Bezüglich möglicher Veränderungen während
der Reifung der Oozyte wurden keine Angaben erhoben.
E Diskussion________________________________________________________________
104
4. Funktioneller Vergleich von ungereifter und gereifter ZP
Die lektinologischen Untersuchungen der Glykoproteine der ZP haben noch keine eindeutigen
Erklärungen für den pI-Shift in Richtung Anode nach der IVM gebracht. Es wurden auch
keine zusätzlichen Hinweise für weitere Veränderungen während der Reifung gefunden. Aus
diesem Grund wurde eine funktionelle Untersuchung angeschlossen, um die These über
Veränderungen der ZP während der In-vitro-Reifung zu untermauern. Die Fähigkeit der ZP,
die Akrosomreaktion bei kapazitierten Spermien auszulösen, wurde dazu als
Untersuchungsparameter eingesetzt. Isolierte ZP wurde mit kapazitierten Spermien inkubiert
und der Anteil der in Akrosomreaktion befindlichen Spermien ausgewertet. Parallel dazu
wurde der Prozentsatz der akrosomreagierenden Spermien einer Kontrollsuspension
bestimmt. Dieser Anteil wurde dann von dem im Bindungstest ermittelten subtrahiert und so
erhielt man den Wert, der für die Induktion durch die ZP steht.
Die Fähigkeit der ZP, die Akrosomreaktion zu induzieren, wurde schon vielfältig in
Untersuchungen als Hilfsmittel herangezogen. Beispielsweise kann so der Erhalt der
Funktionalität von gelagerten Eizellen überprüft werden. Weiterhin konnte gezeigt werden,
dass es möglich ist, die Akrosomreaktion einer bovinen Spermienpopulation durch ein
synthetisches Peptid analog zu einer ZPC-Sequenz zu induzieren (HINSCH 1998).
Mit dem in der vorliegenden Arbeit beschriebenen Spermien-ZP-Bindungstest konnte gezeigt
werden, dass die Induzierbarkeit der Akrosomreaktion durch die ZP abhängig vom
Reifungsstatus der Oozyten ist. Dieser Unterschied kommt bei dem gewählten
Beobachtungszeitraum von zwanzig Minuten besonders innerhalb der ersten zehn Minuten
zum Ausdruck. Der Anteil der akrosomreagierenden Spermien, welche an die ZP gebunden
hatten, war beim Vergleich der ZP verschiedenen Reifungsgrades zu Anfang und Ende des
Versuches in etwa gleich. Die Übereinstimmung am Anfang weist darauf hin, dass die
Reifungsstadien die Spermien der Populationen nicht unterschiedlich selektieren. Der
Unterschied besteht darin, dass die Entwicklung sowohl bei den Frischspermien als auch bei
den epididymalen TG-Spermien bei der ZP in M II zwischen einer und zehn Minuten
wesentlich schneller abläuft. Besonders ausgeprägt ist dies beim Einsatz der ejakulierten
Frischspermien. Innerhalb der ersten zehn Minuten wird bei diesen durch die gereifte ZP die
E Diskussion
105
Akrosomreaktion ca. doppelt so schnell induziert wie bei der ungereiften ZP. Nach zehn
Minuten hat der Anteil der PNA-FITC positiven Spermien schon fast seinen Endwert erreicht.
Um genauere Aussagen über die Funktionalität der ZP im Hinblick auf die Induktion der
Akrosomreaktion machen zu können, muss noch die sogenannte spontane Akrosomreaktion
berücksichtigt werden. YANAGIMACHI (1994) weist darauf hin, dass sich die wahre
Akrosomreaktion, die bei lebenden, motilen Zellen stattfindet, von dem degenerativ an toten
Zellen stattfindenden Vorgang zu unterscheiden ist. Unter der spontanen Akrosomreaktion
versteht man Spermien, die ohne Einfluss von ZP oder bestimmten Substanzen (z.B. Lyso-
Phosphatidylcholin, Heparin, Hyaluronsäure etc.) eine Auflösung der äußeren Membranen
aufweisen. Die durch Agonisten induzierte Akrosomreaktion findet mit größter Effizienz an
ZP derselben Spezies innerhalb weniger Minuten nach Erreichen des Kapazitationszustandes
statt (YANAGIMACHI 1994). Die spontane Akrosomreaktion verläuft hingegen eher
langsam. Ein Ansatzpunkt zur Unterscheidung dieser beiden Arten einer Akrosomreaktion ist,
parallel zur Akrosomreaktion eine Vitalfärbung der Spermien einzusetzen.
Dies war aber in den hier beschriebenen Bindungstests nicht möglich. Die aufgrund des
zügigen Ablaufs der ZP-induzierten Akrosomreaktion gewählten Beobachtungszeitpunkte von
einer, zehn und zwanzig Minuten machten eine Konservierung des Spermienstatus nötig, da
in den Zwischenzeiten die ZP mit den gebundenen Spermien nicht ausgewertet werden
konnte. Durch die Fixierung (mit 2,5% Glutardialdehyd) kommen die Spermatozoen in einen
avitalen Zustand, der sich in einer Propidiumjodid positiven Anfärbung darstellt. Diese
Anfärbung konnte folglich innerhalb der Bindungstests nur als reine Zählfärbung eingesetzt
werden (vgl. FLESCH et al. 2001). Die parallel untersuchte Spermienkontrollsuspension ohne
ZP wurde nicht fixiert. Bei den gleichzeitig durchgeführten Färbungen mit Propidiumjodid
und PNA-FITC wurden als Zeichen der spontanen Akrosomreaktion nur Spermien
beobachtet, die, wenn sie PNA-FITC positiv waren, auch durch Propidiumjodid markiert
wurden. Allerdings ist es auch schwierig, eine induzierte Akrosomreaktion (z.B. durch Lyso-
Phosphatidylcholin) in Suspension nachzuweisen, da flowzytometrische Untersuchungen
zeigten, dass der Zeitraum von der Induzierung der Akrosomreaktion bis zum Zelluntergang
sehr kurz ist (ASCHWORTH et al. 1995). Eine Erfassung ist daher nur im
E Diskussion________________________________________________________________
106
flowzytometrischen Diagramm und nicht in der Beurteilung von Spermienpräparaten aus
Suspensionen möglich.
Zur Vermeidung von Bindungen avitaler Spermien und Spermienaggregationen an die ZP
wurde mit einer Minute eine sehr kurze Koinkubationszeit gewählt. Es ist davon auszugehen,
dass daher nur kapazitierte, akrosomintakte Spermatozoen an die jeweilige ZP gebunden
haben. Trotzdem wurde in einem Rechenmodell bei allen drei Beboachtungszeitpunkten der
Ausgangswert bei einer Minute der in spontaner Akrosomreaktion befindlichen Spermien
innerhalb der Kontrollsuspension von dem Wert der PNA-FITC positiven gebundenen
Spermien abgezogen. Um auch die Möglichkeit zu berücksichtigen, dass eben doch der
gleiche Anteil der Spermien an der ZP, wie der in der Suspension, degenerativen Prozessen
unterliegt, wurde noch eine weitere Rechnung aufgestellt. Den Anteilen der
akrosomreagierenden Spermien an der ZP wurde der zu jedem Zeitpunkt entsprechende
Anteil in der Kontrollsuspension abgezogen. Welches Modell nun den Tatsachen entsprechen
mag, ist für den dargestellten Einfluss gereifter ZP nicht von größerer Bedeutung. Eine
beschleunigte Akrosomreaktion an der gereiften ZP innerhalb der ersten zehn Minuten war in
jedem Berechnungsmodell zu beobachten.
Somit konnte mit den Studien zur Induktion der Akrosomreaktion neben dem pI-Shift ein
weiterer Hinweis für Veränderungen der Zona pellucida während der IVM erbracht werden.
Ansatzpunkte zur Erklärung der beschleunigten Induktion der Akrosomreaktion durch die
Zona pellucida in vitro gereifter Oozyten
Für Aussagen über die Art der funktionellen Veränderungen der Zona pellucida während der
In-vitro-Reifung muss die Vermittlung der Spermienbindung an die ZP betrachtet werden.
Am besten untersucht sind dabei die Vorgänge bei der Maus. ZPC wurde als primärer
Spermienrezeptor identifiziert (BLEIL u. WASSARMAN 1980b) und α-Galaktosereste am
nicht reduzierten Ende von O-glykosidischen Kohlenhydraten als Spermienrezeptoren
proklamiert (BLEIL u. WASSARMAN 1988). In den folgenden Jahren wurden noch weitere
Zucker der O-Glykane der ZPC auf ihre Interaktionen mit murinen Spermien untersucht.
NIXON et al. (2001) beschreiben so, dass mindestens vier unterschiedliche
E Diskussion
107
Monosaccharidreste an der primären Spermienbindung beteiligt sind, nämlich α-Galaktose, β-
N-Acetylglukosamin, Fucose und Mannose. Weiterhin bestehen Hinweise, dass auch bei der
Maus Strukturen der N-glykosidischen Kohlenhydrate an der Gametenerkennung beteiligt
sein können (YAMAGATA 1985), wie es beim Schwein der Fall ist (NAKANO u.
YONEZAWA 2001).
Zunächst wurde im porcinen Organismus den O-Glykanen von ZPB eine Rezeptoraktivität
zugesprochen (YUREWICZ et al. 1992). In neueren Untersuchungen (NAKANO u.
YONEZAWA 2001) konnte jedoch gezeigt werden, dass die neutralen N-Glykane des
gesamten ZPB/ZPC Komplexes eine Bindungsaffinität für Spermatozoen besitzen. Innerhalb
der Kohlenhydratketten vom komplexem Typ wird den tri- und tetraantennären Ketten eine
größere Bindungsaffinität als den diantennären Ketten attestiert. Dominierend scheinen dabei
die Saccharide zu sein, die mit Asn220 in der N-terminalen Region von endo-β-
Galaktosidase-gespaltenen ZPB verknüpft sind. Den Strukturen von ZPC kommt eher eine
unterstützende Funktion zu.
Die beschriebenen Kohlenhydratketten sind für die primäre Bindung des Spermiums an die
Zona pellucida zuständig. Eventuell finden an der ZP während des Reifungsprozesses
Veränderungen statt, welche die Interaktion der Gameten optimiert. Die lektinologischen
Analysen wiesen keine Unterschiede in der Verteilung der untersuchten Zuckerstrukturen auf.
Eine für die Spermien günstigere Präsentation der Rezeptoren auf der Oberfläche der intakten
ZP wäre denkbar. Allerdings spricht die ähnliche Ausgangslage des Spermienstatus bei
ungereifter und gereifter ZP zum Zeitpunkt von einer Minute im Bindungstest nicht unbedingt
für eine veränderte Rezeptorpräsentation.
Es muss folglich der weitere Schritt, nämlich die Induktion der Akrosomreaktion und die
dafür verantwortlichen Strukturen betrachtet werden.
Bei der Maus ist dafür wiederum ZPC verantwortlich (WASSARMAN u. LITSCHER 2001).
Durch die Verbindung von β(1-4)-Galaktosyltransferasen (GalT) auf der Spermienmembran
durch ZPC wird ein pertussistoxin-sensitives G-Protein aktiviert. Dieses ist direkt mit der
entsprechenden GalT-Domäne im Zytoplasma verbunden, welche die Akrosomreaktion
auslöst (GONG et al. 1995). NIXON und Mitarbeiter (2001) sehen in Polymeren von N-
Acetylglukosamin (GlcNAc) die für die Klusterbildung der GalT verantwortliche Struktur.
Bei anderen Tierarten, eventuell auch zusätzlich bei der Maus, scheint die Peptidstruktur vom
E Diskussion________________________________________________________________
108
Glykoprotein ZPC für die Auslösung der Akrosomreaktion bedeutender zu sein als die
Kohlenhydratstruktur. Der Nachweis der Induzierbarkeit der Akrosomreaktion durch
synthetische Peptide basierend auf einer Aminosäurensequenz von ZPC bei bovinen
Spermatozoen untermauert diese Vermutung (HINSCH 1998).
Für das Schwein fehlen noch genauere Angaben über die Auslösung der Akrosomreaktion.
Die vorliegenden Ergebnisse weisen darauf hin, dass innerhalb der ZP während der IVM
Vorgänge ablaufen, die das Vermittlungs- und Aktivierungssystem zur Induktion der
Akrosomreaktion so konditioniert, dass diese Prozesse schneller und effektiver ablaufen
können.
5. Unterschiede zwischen der ZP von in vitro und in vivo gereiften Oozyten
Bei den in dieser Arbeit erhaltenen Ergebnissen ist zu berücksichtigen, dass in den Versuchen
die Eizellen unter In-vitro-Bedingungen gereift wurden. Bei Rückschlüssen über Verhältnisse
in vivo ist zu beachten, dass sich die Zonae pellucidae von in vivo gereiften Oozyten von
denen der in Kultur gereiften Oozyten unterscheiden.
Beim Vergleich von IVM Oozyten gewonnen aus Schlachtmaterial mit ovulierten, in vivo
gereiften Oozyten, die am zweiten Tag des Östrus der Sauen aus deren Eileitern gespült
worden waren, wiesen die jeweiligen ZP Unterschiede auf (WANG et al. 1998). Die Dicke
der ZP ovulierter Eizellen (17,9 ± 2,4 µm) war statistisch hoch signifikant (p < 0,001) erhöht
im Vergleich zu der ZP von in vitro gereiften (14,9 ± 2,1 µm). Weiterhin ließ sich die ZP der
IVM Oozyten mit 0,1%iger Pronase innerhalb von 2-2,5 Minuten auflösen, welches mit der
ZP der aus dem Ovidukt gespülten Eizellen innerhalb von zwei Stunden nicht gelang. Als
mögliche Ursache postulieren die Autoren die Einlagerungen von Sekretionsprodukten des
Eileiterepithels in die ZP. Dazu passen die Beobachtungen von DUBY und Mitarbeitern
(1997), dass der Kontakt von boviner ZP mit Eileitern von Rindern oder Schafen die ZP vor
Pronaseverdauung schützt. Die Einlagerung von weiteren Glykoproteinen kann auch als
Ursache für eine veränderte Lektinbindungsaktivität möglich sein. In den angesprochenen
Versuchen von WANG und Mitarbeitern (1998) wies die ZP ovulierter Oozyten eine
E Diskussion
109
intensive PNA Markierung auf. Bei der ZP von IVM Oozyten wurden keine Signale
beobachtet. Diese Untersuchungen wurden mit intakten, fixierten Eizellen und FITC
konjugiertem PNA durchgeführt. Zur weiteren Klärung des Einflusses von
Sekretionsprodukten des Oviduktes wäre die vergleichende Untersuchung der ZP von in vivo
gereiften und aus Follikeln punktierten Eizellen sinnvoll.
Aufgrund der geschilderten Verhältnisse ist es anzunehmen, dass der hier nachgewiesene pI-
Shift der Glykoproteine der ZP von GV I Stadien zu denen der ZP von IVM M II Stadien in
der 2D-PAGE unter in vivo Bedingungen noch größer sein könnte. Innerhalb der Säugetiere
unterliegt die Eizelle von der GV I Phase über die Reifung und der Ovulation bis kurz vor
dem Kontakt mit dem Spermium noch dem Weg durch Abschnitte des Ovidukts. Die unter
den geschilderten Bedingungen nachgewiesenen Veränderungen, wie pI-Shift und
beschleunigte Induktion der Akrosomreaktion bei der ZP von IVM Oozyten, könnten in vivo
noch durch weitere Umgestaltungen ergänzt bzw. verstärkt sein.
6. Abschlussbetrachtung und Ausblick
Die Erforschungen molekularer Vorgänge innerhalb dieser Arbeit gehören zum Bereich der
Grundlagenforschung. Diese sind auf dem Gebiet der Gameteninteraktionen notwendig, um
physiologische Prozesse besser zu verstehen. Erst dann sind Eingriffe zur Behebung von
physiologischen Fehlleistungen und Optimierungen von In-vitro-Systemen möglich.
Es konnte gezeigt werden, dass bei der In-vitro-Maturation bereits Veränderungen an der ZP
ablaufen. Diese treten in Erscheinung als vermehrte Acidität der Glykoproteine innerhalb der
isoelektrischen Fokussierung. Weiterhin ist die ZP von gereiften Oozyten in der Lage, die
Akrosomreaktion an homologen Spermien schneller zu induzieren als die der ungereiften. In
der lektinologischen Analyse konnten keine Hinweise erhoben werden, dass der pI-Shift
durch veränderte Kohlenhydratstrukturen oder vermehrte Sialylierung hervor gerufen wird.
In anschließenden Versuchen sollte daher besonders der Grad der Sulfatierung der ZP von
Oozyten unterschiedlichen Reifungstatus im Vordergrund stehen. Vergleichende
Untersuchungen von nativer und desulfatierter ZP, sowohl ungereifter als auch gereifter
E Diskussion________________________________________________________________
110
Oozyten, sollten durchgeführt werden. Analysen mittels 2D-PAGE und funktionelle
Bindungstest zur Induktion der Akrosomreaktion könnten dazu beitragen, die Rolle der
Sulfatreste bezüglich der ZP-Reifung und der Gameteninteraktionen aufzuklären. Aufgrund
der beschriebenen Unterschiede zwischen der ZP von in vitro und in vivo gereiften Oozyten
wären auch Untersuchungen zu diesen Differenzen interessant. Die in vivo gereiften Oozyten
lassen sich wiederum nochmals unterteilen, nämlich in aus antralen Follikeln aspirierten und
aus Eileitern gespülten Oozyten.
In dieser Arbeit wird die Komplexität und enorme Vielfalt bezüglich der Fertilitätsvorgänge
deutlich. Es kommt stets auf das Zusammenspiel unterschiedlichster Faktoren an, die bei den
einzelnen Tierarten auch recht unterschiedlich sein können. Dennoch ist das Schwein als
Modelltier mit Hinblick auf die Humanmedizin von großer Bedeutung. Es steht dem
Menschen entwicklungsgeschichtlich näher als z.B. die Maus, welche auch bezogen auf die
Morphologie der ZP größere Differenzen zur humanen ZP als die porcine ZP aufweist. Die
geschilderten Studien und deren weiterführende Untersuchungen am Modelltier Schwein sind
sinnvoll, um Methoden zu etablieren und Tendenzen zu erfassen, die dann auf den Menschen
übertragen werden können. Dort besteht ein großer Bedarf daran, Antworten auf bisher
ungeklärte Infertilitäten, Optimierungsansätzen von In-vitro-Techniken und neue
Möglichkeiten zur Kontrazeption zu erhalten.
F Zusammenfassung
111
F Zusammenfassung
Ziel dieser Arbeit war es, die porcine Zona pellucida (ZP) näher zu charakterisieren, mit
besonderem Blick auf mögliche biochemische und funktionelle Veränderungen während der
In-vitro-Maturation.
Als Untersuchungsmaterial standen Ovarien zahlreicher frisch geschlachteter Jungsauen zur
Verfügung. Nach der Gewinnung der Oozyten wurde entweder die ZP direkt isoliert oder die
Oozyten wurden zunächst einer In-vitro-Maturation unterzogen.
Die drei Glykoproteine der porcinen Zona pellucida wurden mittels ein- und
zweidimensionaler Polyacrylamidgelelektrophrose (1D- u. 2D-PAGE) aufgetrennt. Es folgte
eine immunologische und lektinologische Analyse der durch die PAGE separierten
Glykoproteine der ZP. Diese Studien wurden sowohl mit ZP ungereifter als auch gereifter
Oozyten durchgeführt. Weiterhin wurde ebenfalls mittels Lektinen die Verteilung der
Kohlenhydratketten über die Oberfläche der ZP in rasterelektronenmikroskopischen
Aufnahmen von intakten Oozyten untersucht.
Zur Klärung funktioneller Aspekte innerhalb der Veränderungen der ZP während der In-vitro-
Maturation wurde ein Spermien-ZP-Bindungstest entwickelt. Mit diesem konnte die
Induzierbarkeit der Akrosomreaktion vergleichend von ZP ungereifter und gereifter Oozyten
untersucht werden. Der akrosomale Status der Spermien wurde mit dem Lektin PNA, das an
einem Fluoreszenzfarbstoff gekoppelt war, ermittelt. Für die Bindungstests wurden
Frischejakulate eines institutseigenen Ebers und kryokonservierte Nebenhodenspermien einer
Charge verwendet.
Folgende Ergebnisse wurden erzielt:
In der 2D-PAGE wurde bei der ZP von gereiften Oozyten im Vergleich zur Auftrennung von
ungereiften ein pI-Shift von ca. einer pI-Einheit festgestellt. Diese Zunahme der Acidität stellt
sich mit einer Differenz von ca. zwei pI-Einheiten innerhalb der lektinologischen Analyse
noch deutlicher dar.
F Zusammenfassung__________________________________________________________
112
Im Lektinblot konnte gezeigt werden, dass mannosehaltige Strukturen innerhalb von
diantennären Seitenketten ausgeprägt im Glykoprotein ZPA vorliegen und bei ZPB/ZPC
durch Con A nicht erkannt werden.
Mit SNA, MAA II und ACA wurde unterschiedlich verknüpfte Sialsäure nachgewiesen.
Durch das Lektin AAA konnte der für das Schwein typische hohe Fukosylierungsgrad der ZP
nachvollzogen werden.
Ein negatives Ergebnis in der lektinologischen Untersuchung erhielt man nur für den
Nachweis von terminaler Galaktose (PNA u. GS I).
Das ermittelte Lektinbindungsverhalten wies keine Unterschiede bei ungereifter und gereifter
ZP auf.
Innerhalb der rasterelektronenmikroskopischen Analysen konnte das Mengenverhältnis von
Con A und AAA positiven Strukturen aus dem Lektinblot bestätigt werden.
Es konnte weiterhin nachgewiesen werden, dass die ZP während der In-vitro-Maturation
Prozessen unterliegt, die eine Funktionsänderung hervorrufen.
Die In-vitro-Reifung bewirkte statistisch signifikant eine beschleunigte Induktion der
Akrosomreaktion durch die ZP. Dies wurde für die ersten zehn Minuten nach der Bindung der
Spermien an die ZP gezeigt. Nach weiteren zehn Minuten erfolgte eine Angleichung an die
Verhältnisse bei der ungereiften ZP.
Diese Ergebnisse zeigen, dass die ZP schon während der Maturation und nicht erst nach der
Fertilisation nachweisbaren Veränderungen unterliegt. Bezüglich des pI-Shifts konnten keine
Hinweise erhoben werden, dass dieser durch veränderte Kohlenhydratstrukturen oder eine
vermehrte Sialylierung bewirkt wird. Die erhöhte Acidität der ZP Glykoproteine von gereiften
Oozyten könnte durch eine gesteigerte Sulfatierung hervorgerufen werden. Dies ist in
weiterführenden Untersuchungen abzuklären. Weiterhin muss überprüft werden, inwiefern
sich diese Ergebnisse vom In-vitro-Modell auf die Verhältnisse in vivo übertragen lassen und
ob dort noch umfangreichere Veränderungen auftreten.
G Summary
113
G Summary
Silja Ebeling:
Characterization of the porcine zona pellucida and the changes during in vitro maturation.
The aim of this study was to characterize the porcine zona pellucida (ZP) with a special view
of potential biochemical and functional changes during in vitro maturation.
Ovaries from many freshly slaughtered young sows were available as research-material. After
winning the oocytes either the ZP was isolated directly or first the oocytes were subjected to
in vitro maturation.
The three glycoproteins of the porcine zona pellucida were divided by one- and
twodimensional polyacrylamid-gelelectrophoresis (1D- and 2D-PAGE). An immunologic and
lectinologic analysis of the separated ZP glycoproteins was followed. This studies were
carried out as well with ZP of immatured as with matured oocytes. Further the distribution of
carbohydrates chains over the ZP surface was investigated by lectins in a scanning electron
microscopy assay with entire oocytes.
A spermatozoa-ZP-binding test was developed to find out functional aspects within the
changes of ZP during in vitro maturation. Using this test it was possible to investigate
comparatively the inducing of acrosome reaction by ZP from immatured and matured oocytes.
The acrosome status was determined with lectin PNA, which was conjugated with a
fluorescence dye. For the binding tests fresh ejakulated spermatozoa of an institute own boar
and kryoconserved epididymal spermatozoa of one population were used.
Following results were achieved: A pI-shift of about one pI unit was found out in comparsion from separated ZP proteins of
immatured to matured oocytes by 2D-PAGE. This increased acidic was expressed with a
more distinct difference of about two pI units within the lectionologic analysis.
G Summary_________________________________________________________________
114
The lectinblot with Con A has shown, that structures including mannose in diantennary chains
exist in glycoprotein ZPA and were not recognized in ZPB/ZPC.
Using SNA, MAA II and ACA differently connected sialic acid was proved.
The typical high fucosed degree of pig ZP was shown by the lectin AAA.
In the lectinologic examination a negativ result was got only for terminal galactose (PNA and
GS I).
Within scanning electron microscopy analysis the quantitative distribution of Con A to AAA
positive structures was confirmed with the results of the lectinblot.
Further it could be shown, that the ZP undergoes proceedings during in vitro maturation,
which caused an altered function.
Maturation results in a statistical significantly accelerated induction of acrosome reaction by
ZP. This was shown for the first ten minutes after sperm binding at the ZP. After further ten
minutes there was following an adjustment on the relations of the matured ZP.
This results showed, that the ZP already undergoes demonstrable changes during maturation
not only after fertilization. No information were found relating to the pI-shift, that it was
caused by changed carbohydrate structures or multiply sialylation. The increased acidic of ZP
glycoproteins from matured oocytes could be produced by an additional sulfation. This case
has to be cleared by continued examinations. Further it must be checked in what way the
results of an in vitro model could be transfer on in vivo relations and if there would be found
more extensive alterations.
H Literaturverzeichnis
115
H Literaturverzeichnis
ABDULLAH, M., E.E. WIDREN u. M.G. O’RAND (1991): A mammalian sperm lectin related to rat hepatocyte lectin-2/3. Purification from rabbit testis and identification as a zona binding protein. Mol. Cell Biochem. 103, 155-161 ALBERTINI, D.F., u. V. RYDER (1994): Patterns of intercellular connectivity in the mammalian cumulus-oocyte complex. Micros. Res. Tech. 27, 125-133 ALBERTS, B., D. BRAY, J. LEWIS, M. RAFF, K. ROBERTS u. J.D. WATSON (1990): Molekularbiologie der Zelle. VCH, Weinheim ASHWORTH, P.J.C., R.A.P. HARRISON, N.G.A. MILLER, J.M. PLUMMER u. P.F. WATSON (1995): Flow cytometric detection of bicorbonate-induced changes in lectin binding in boar and ram sperm populations. Mol. Reprod. Dev. 40, 164-176 AVILES, M., M.T. CASTELLS, J.A. MARTINEZ-MENARGUEZ, P. DRABER, F.W. KAN u. J. BALLESTA (1999): Cytochemical localization of GalNAc and GalNAcbeta1,4Galbeta1,4disaccharide in mouse zona pellucida. Cell Tissue Res. 295, 269-277 AVILES, M., J.A. MARTINEZ-MENARGUEZ u. M.T. CASTELLS (1994): Cytochemical characterization of oligosaccharide sites chains of the glycoproteins of rat zona pellucida: A ultrastructura study. Anat. Rec. 239, 127-149 AVILES, M., L. JABER, M.T. CASTELLS, J. BALLESTA u. F.W.K. KAN (1997): Modification of carbohydrate residues and ZP2 and ZP3 glycoproteins in the zona pellucida after fertilization. Biol. Reprod. 57, 1155-1163 BEDFORD, J.M., u. D.D. HOYKINS (1990): The mammalian spermatozoon: morphology, biochemistry and physiology. in: G.E. LAMMING (Hrsg.): Marshall’s Physiology of Reproduction. Churchill Livingstone, Edinburgh London Melborne and New York, Bd. 2, 4. Aufl., S. 379-568
H Literautrverzeichnis_________________________________________________________
116
BLASE, N., A.R. FAZELI, E. TOPPER, M.M. BEVERS, H. WOELDERS, E. TÖPFER-PETERSEN u. B. COLENBRANDER (1998): Inhibition of boar sperm binding to homologous zona pellucida by antibodies against ZP3α and ZP3β glycoproteins. Reprod. Dom. Anim. 33, 21-25 BLEIL, J.D., u. P.M. WASSARMAN (1988): Galactose on the non-reducing terminus of O-linked oligosaccharides of mouse egg zona pellucida glycoprotein ZP3 is essential for the glycoprotein’s sperm receptor activity. Proc. Natl. Acad. Sci. USA 85, 6778-6782 BLEIL, J.D., u. P.M. WASSARMAN (1980a): Synthesis of zona pellucida proteins by denuded and follicle-enclosed mouse oocytes during culture in vitro. Proc. Natl. Acad. Sci. USA 77, 1029-1033 BLEIL, J.D., u. P.M. WASSARMAN (1980b): Mammalian sperm-egg interaction: Identification of a glycoprotein in mouse egg zonae pellucidae possessing receptor activity for sperm. Cell 20, 873-882 BOUSQUET, D., H. TWAGIRAMUNGU, N. MORIN, D. BRISSON, G. CARBONEAU u. J. DUROCHER (1999): In vitro embryo production in the cow: an effective alternative to the conventional embryo production. Theriogenology 51, 59-70 BOYD, W.C., u. E. SHAPLEIGH (1954): Antigenic relations of blood group antigens as suggested by tests with lectins. J. Immunol. 73, 226-231 BREWIS, I.A., R. CLAYTON, C.E. BROWES, M. MARTIN, C.L. BARATT, D.P. HOMBY u. H.D. MOORE (1998): Tyrosin phosphorylation of a 95 kDa protein and induction of the acrosom reaction in human spermatozoa by recombinant human zona pellucida glycoprotein 3. Mol. Hum. Reprod. 4, 1136-1144 BUCCIONE, R., A.C. SCHROEDER u. J.J. EPPIG (1990): Interactions between somatic cells and germ cells throughout mammalian oogenesis. Biol. Reprod. 43, 543-547 BURKMAN, L.J., C.C. CODDINGTON, D.R. FRANKEN, T.F. KRUGER, Z. ROSENWARKS u. G. D. HODGEN (1988): The hemizona assay (HZA): development of a diagnostic test for the binding of human spermatozoa to the human hemizona pellucida to predict fertilization potential. Fertl. Steril. 49, 688-697
H Literaturverzeichnis
117
CALVETE, J.J., E. CARRERA, L. SANZ u. E. TÖPFER-PETERSEN (1996a): Boar spermadhesins AQN-1 and AQN-3: oligosaccharide and zona pellucida binding characteristics. Biol. Chem. 377(7-8), 521-527 CALVETE, J.J., Z. DOSTALOVA, L. SANZ, K. ADERMANN, H.H. THOLE u. E. TÖPFER-PETERSEN (1996b): Mapping the heparin-binding domain of boar spermadhesins. FEBS Lett. 379(3), 207-211 CALVETE, J.J., L. SANZ u. E. TÖPFER-PETERSEN (1994): Spermadhesins: Structure-function relationships. Ass. Reprod. Tech./Androl. 6, 316-330 CATT, J.W. (1996): Intracytoplasmatic sperm injektion (ICSI) and related technology. Anim. Reprod. Sci. 42, 239-250 CHENG, A., T. LE, M. PALACOIS, L.H. BOOKBINDER, P.M. WASSARMAN, F. SUZIKI u. J.D. BLEIL (1994): Sperm-egg recognition in the mouse: characterization of sp56, a spermprotein having specific affinity for ZP3. J. Cell Biol. 125, 867-878 COHEN, J., H. MALTER, G. WRIGHT, H. KORT, J. MASSEY u. D. MITCHELL (1989): Partial zona dissection of human oocytes when failure of zona pellucida penetration is anticipated. Hum. Reprod. 4, 435-442 COOPER, T.G. (1996): Epididymidis and sperm function. Andrologia 28, 57-59 CRAN, D.G. (1985): Qualitative and quantitative structural changes during pig oocyte maturation. J. Reprod. Fert. 74, 237-245 CROSS, N. L., u. S. MEIZEL (1989): Minireview: methods for evaluating the acrosomal status of mammalian sperm. Biol. Reprod. 41, 635-641 DACHEUX, J.L., F. DACHEUX u. M. PAPUIGON (1989): Changes in sperm surface membrane and luminal protein fluid content during epididymal transit. Biol. Reprod. 40, 635-651
H Literautrverzeichnis_________________________________________________________
118
DANDEKAR, P., u. P. TALBOT (1992): Perivitelline space of mammalian oocytes: Extracellular matrix of unfertilized oocytes and formation of a cortical granule envelope following fertilization. Mol. Reprod. Dev. 31, 135-143 DE VOS, A., u. A. VAN STEIRTEGHEM (2000): Zona hardening, zona drilling and zona hatching – new achievements in assisted reproduction. Cells Tissues Organs 166, 220-227 DOSTALOVA, Z., J.J. CALVETE, L. SANZ u. E. TÖPFER-PETERSEN (1995a): Boar spermadhesin AWN-1. Oligosaccharide and zona pellucida binding characteristics. Eur. J. Biochem. 230, 329-36 DOSTALOVA, Z., J.J. CALVETE u. E. TÖPFER-PETERSEN (1995b): Interaction of non-aggreated boar AWN-1 and AQN-3 with phospholipid matrices. A model for coating of spermadhesins to the sperm surface. Biol. Chem. 376(4), 237-242. DRIESCH, A., I. RÜSSE u. F. SINOWATZ (1991): Lehrbuch der Embryologie der Haustiere. Verlag Parey, Berlin, Hamburg, S. 53-70 DUBI, R.T., J.L. HILL, D. O’CALLGHAN, E.W. OVERSTROM u. M.P. BOLAND (1997): Changes induced in the bovine zona pellucida by ovine and bovine oviducts. Theriogenology 47, 332 (abstract) DUCIBELLA, T. (1996): The cortical reaction and development of activation competence in mammalian oocytes. Hum. Reprod. Update 2, 29-42 DUNBAR, B.S., S. AVERY, V. LEE, S.V. PRASAD, D. SCHWAHN, E. SCHWOEBEL, S.SKINNER u. B. WILKENS (1994): The mammalian zona pellucida: Its biochemistry, immunochemistry, molecular biology and developmental expression. Reprod. Fertil. Dev. 6, 59-76 DUNBAR, B.S., S.V. PRASSAD u. T. TIMMONS (1991): Comparative mammalian zonae pellucidae. in: B.S. DUNBAR u. M. O’RAND (Hrsg.): Comparative Overview of Mammalian Fertilization. Plenum Press, New York, S. 97-114 DUNBAR, B. S., N. J. WARDRIP u. J.L. HEDRICK (1980): Isolation, physicochemical properties, and macromolecular composition of zona pellucida from porcine oocytes. Biochemistry 19, 356-365
H Literaturverzeichnis
119
DUNBAR, B.S., u. D.J. WOLGEMUTH (1984): Structure and function of the mammalian zona pellucida, an unique extrazellular matrix. Mod. Cell Biol. 3, 77-111 EAGLESOME, M.D., W.C.D. HARE u. E.L. SINGH (1980): Embryo transfer: A discussion on its potential for infectious disease control based on a review of studies on infection of gametes and early embryos by various agents. Can. Vet. J. 21, 106-111 EDDY, E.M., u. D.A. O’BRIEN (1994): The spermatozoon. in: P.M. WASSARMAN (Hrsg.): Elements of Mammalian Fertilization. CRC Press, Boca Raton, Florida, Bd. 1, S. 1-20 EPIFANO, O., u. J. DEAN (1994): Biology and structure of the zona pellucida: A target for immunocontraception. Reprod. Fertil. Dev. 6, 319-330 EPIFANO, O., L. LIANG, M. FAMILARI, M.C. MOOS u. J. DEAN (1995): Coordinate expression of the three zona pellucida genes during mouse oogenesis. Development 121, 1947-1956 EPPIG, J.J. (1996): Coordination of nuclear and cytoplasmatic oocyte maturation in eutherian mammals. Reprod. Fertil. Dev. 8, 485-489 ESSLIN, M., T. VOGEL, J.J. CALVETE, H.H. THOLE, J. SCHMIDTKE, T. MATSUDA u. E. TÖPFER-PETERSEN (1998): Molecular cloning and characterization of P47, a novel boar sperm-associated zona pellucida-binding protein homologous to a family of mammalian secretory proteins. Biol. Reprod. 58, 1057-1064 FAZELI, A., A.E. DUNCAN, P.F. WATSON u. W.V. HOLT (1999): Sperm-oviduct interaction: induction of capacitation and preferential binding of uncapacitated spermatozoa to oviductal epithelial cells in porcine species. Biol. Reprod. 60, 879-886 FELBERBAUM, R., u. W. DAHNKE (1997): DIR-Deutsches IVF-Register Ergebnisse der Datenerhebung für das Jahr 1996. Fertilität 13, 99-112 FLEMMING, T.P., H.P. PRATT u. P.R. BRAUDE (1987): The use of mouse preimplantation embryos for quality control of culture reagents in human in vitro fertilization programs: A cautionary note. Fertil. Steril. 47, 838-860
H Literautrverzeichnis_________________________________________________________
120
FLESCH, F.M., E. WIJNAND, C.H.A. VAN DE LEST, B. COLENBRANDER, L.M.G. VAN GOLDE u. B.M. GADELLA. (2001): Capacitation depent activation of tyrosine phosphorylation generates two sperm head plasma membrane proteins with high primary binding affinity for zona pellucida. Mol. Reprod. Dev. 60, 107-115 FLORMAN, H.M., u. P.M. WASSARMAN (1985): O-linked oligosaccharides of mouse egg ZP3 account for its sperm receptor activity. Cell 41, 313-324 FRASER, L.R. (1995): Ionic control of sperm function. Reprod. Fert. Dev. 7, 905-925 FRASER, L.R. (1993): Calcium channels play a pivotal role in the ionic changes involved initiating mouse sperm acrosomal exocytosis. Mol. Reprod. Dev. 36, 368-376 FUNAHASHI, H., H. EKWALL, K. KIKUCHI u. H. RODRIGUEZ-MARTINEZ (2001): Transmission electron microscopy studies of the zona reaction in pig oocytes fertilized in vivo and in vitro. Reproduction 122, 443-452 GABIUS, H.J., u. S. GABIUS (1992): Angewandte Lektinforschung. Biology in unserer Zeit, 330-335 GABIUS, H.J., H. RÜDIGERr u. G. UHLENBRUCK (1988): Lectine. Spektrum der Wissenschaft, 50-60 GADELLA, B.M., T.W.J. GADELLA JR, B. COLENBRANDER, L.M.G. VAN GOLDE u. M. LOPEZ-CARDOZO (1994): Visualization and quantification of glycolipid polarity dynamics in the plasma membrane of mammalian spermatozoon. J. Cell Sci. 107, 2151-2163 GEYER, H., u. R. GEYER (1998): Strategies for glycoconjugate analysis. Acta. Anat. 161, 135-148 GOGOLOK, J., R. SCHUEMER u. G. STRÖHLEIN (1992): Datenverarbeitung und statistische Auswertung mit SAS. Band I: Einführung in das Programmsystem, Datenmanagement und Auswertung. Fischer Verlag, Stuttgart, Jena, New York
H Literaturverzeichnis
121
GONG, X., D.H. DUBOIS, D.J. MILLER u. B.D. SHUR (1995): Activation of a G-protein complex by aggregation of β1,4-galactosyltransferase on the surface of sperm. Science 269, 1718-1721 GORDON, J.W., u. U. DAPUNT (1993): Restoration of normal implantation rates in mouse embryos with a hatching impairment by use of a new method of assisted hatching. Fertil. Steril. 59, 1302-1307 GREENHOUSE, S., P.E. CASTLE u. J. DEAN (1999): Antibodies to human ZP3 induce reversible contraception in transgenic mice with ‘humanized’ zonae pellucidae. Hum. Reprod. 14, 593-600 GROOTENHUIS, A.J., H.L.A. PHILIPSEN, J.T.M. DE BREET-GRIJSBACH u. M. VAN DUIN (1996): Immunocytochemical localization of ZP3 in primordial follicles of rabbit, marmosets, rhesus monkeys and human ovaries using antibodies against human ZP3. J. Reprod. Fertil. 50 (Suppl.), 43-54 GUILLOMOT, M., u. K.J. BETTERIDGE (1984): Permeability of the capsule of the equine embryo. Proc. Soc. Study Fertil., Winter Meeting, abstract 58 HAFEZ, E.S.E. (1987): Reproduktion in Farm Animals. Lea and Febinger, Philadelphia HANCOCK, J. L. (1958): The examination of pig ova. Vet. Rec. 70, 1200-1201 HARRIS, J.D., D.W. HIBLER, G.K. FONTENOT, K.T. HSU, E.C. YUREWICZ u. A.G. SACCO (1994): Cloning and characterization of zona pellucida genes and cDNAs from a variety of mammalian species: the ZPA, ZPB and ZPC gene families. DNA Sequence 4, 361-393 HARRISON, R.A.P., B. MAIRET u. N.G.A. MILLER (1993): Flow cytometric studies of bicarbonate mediates Ca2+ influx in boar sperm populations. Mol. Reprod. Dev. 35, 197-218 HARRISON, R.A.P., u. S.E. WICKERS (1990): Use of fluoreszent probes to ascess membrane integrity in mammalian spermatozoa. J. Reprod. Fertil. 88, 343-352
H Literautrverzeichnis_________________________________________________________
122
HASEGAWA, A., K. KOYAMA, Y. OKAZAKI, M. SUGIMOTO u. S. ISOJIMA (1994): Amino acid sequence of a porcine zona pellucida glycoprotein ZP4 dertermined by peptide mapping and cDNA cloning. J. Reprod. Fertil. 100, 245-55 HATANAKA, Y., T. NAGAI, T. TOBITA u. N. NAKANO (1992): Changes in the properties and composition of zona pellucida of pigs during fertilization in vitro. J. Reprod. Fert. 95, 431-440 HEDRICK, J.L. (1996): Comparative studies and antigenic properties of zona pellucida glycoproteins. J. Reprod. Fertil. 50 (Suppl.), 9-17 HEDRICK, J.L., u. N.J. WARDRIP (1987): On the macromolecular composition of the zona pellucida from pig oocytes. Dev. Biol. 121, 478-488 HEDRIK, J.L., u. N.J. WARDRIP (1986): Isolation of the zona pellucida and purification of its glycoprotein families from pig oocytes. Anal. Biochem. 157, 63-70 HEDRICK, J.L., u. N.J. WARDRIP (1980): The macromolecular composition of the porcine zona pellucida. Fed. Proc. 39, 2081 HEDRICK, J.L., N.J. WARDRIP u. T. BERGER (1987): Differences in the macromolecular composition of the zona pellucida isolated from pig oocytes, and zygotes. J. Exp. Zool. 241, 257-262 HERRLE, A., u. H.M. BEIER (2000): Early embryonic coats: morphology, function, practical applications. Cells Tissues Organs 166, 233-246 HEUKESHOVEN, J. (1988): Improved silver staining procedure for fast staining in phast system development unit staining of SDS-gels. Electrophoresis 9, 29-32 HINSCH, E. (1998): Untersuchungen zur Lokalisation und Funktion von ZP2- und ZP3-Proteinen. Hannover, Tierärztl. Hochschule, Habil.-Schr.
H Literaturverzeichnis
123
HOKKE, C.H., J.B.L. DAMM, J.P. KAMERLING u. J.F.G. VLIEGENHART (1993): Structure of three acidic O-linked carbohydrate chains of the porcine zona pellucida glycoproteins. FEBS Lett. 329, 29-34 HOKKE, C.H., J.B.L. DAMM, B. PENNINKHOF, R.J. AITKEN, J.P. KAMERLING u. J.F.G. VLIEGENHART (1994): Structure of the O-linked carbohydrate chains of the porcine zona pellucida glycoproteins. Eur. J. Biochem. 221, 491-512 HUNNICUTT, G.R., P. PRIMAKOFF u. D.G. MYLES (1996): Sperm surface protein PH-20 is bifunctional: one activity is a hyaluronidase and a second, distinct activity is required in secondary binding. Bio. Reprod. 55, 80-86 HUNTER, R.H.F. (1995): Ovarian endocrine control of sperm progression in the fallopian tubes. in: H.M. CHARLTON (Hrsg.): Oxford Reviews of Reproduktiv Biology Oxford University Press, Bd 17, S. 85-124 HUNTER, R.H.F. (1988): Transport of gametes, selection of spermatozoa and gamete lifespans in the female reproductive tract. in: R.H.F. HUNTER (Hrsg.): The Fallopian Tubes: Their role in fertility and infertility. Verlag Springer, Berlin, Heidelberg, S. 53-80 HURTLEY, S., R. SERVICE u. P. SZUROMI (2001): Cinderella’s Coach is ready: Carbohydrates and Glycobiology. Science 291, 2337 IRITANI, A. (1991): Micromanipulation of gametes for in vitro assisted fertilization. Mol. Reprod. Dev. 28, 199-207 JOHNSTON, D.S., W.W. WRIGHT, J.H. SHAPER, C.H. HOKKE, D.H. VAN DEN EIJNDEN u. D.H. JOZIASSE (1998): Murine sperm-zona binding, a fucosyl residue is required for a high affinity sperm-binding ligand. J. Biol. Chem. 273, 1888-1895 JONES, R. (1991): Interaction of zona pellucida glycoproteins, sulphated carbohydrates and synthetic polymers with proacrosin, the putative egg-bindung protein from mammalian spermatozoa. Development 111, 1155-1163
H Literautrverzeichnis_________________________________________________________
124
KATSUMA, T., S. NOGUCHI, N. YONEZAWA, M. TANOKURA u. M. NAKANO (1996): Structural characterization of the N-linked carbohydrate chains of the zona pellucida glycoproteins from bovine ovarian and fertilized eggs. Eur. J. Biochem. 240, 448-453 KIRCHOFF, C., u. R. IVELL (1995): Molekulare Aspekte der Spermienreifung im Nebenhoden. Eine Übersicht. Fertilität 11, 167-174 KIRKPATRICK, J.F., J.W. TURNER, I.K. LIU u. R. FAYRER-HOSKEN (1996): Application of pig zona pellucida immunocontraception to wildlife fertility control. J. Reprod. Fertil. 50 (Suppl.), 183-189 KOBATA, A. (1992): Structures and functions of the sugar chains of glycoproteins. Eur. J. Biochem. FEBS 209, 483-501 KÖLLE, S., F. SINOWATZ, G. BOIE u. G. PALMA (1998): Differential expression of ZPC in the bovine ovary, oocyte and embryo. Mol. Reprod. Dev. 49, 435-443 KÖLLE, S., F. SINOWATZ, G. BOIE, I. TOTZAUER, W. AMSELGRUBER u. J. PLENDL (1996): Localization of the mRNA encoding the zona protein ZP3α in the porcine ovary, oocyte and embryo by non-radioactive in situ hybridization. Histochem. J. 28, 441-447 KOPF, G.S., u. G.L. GERTON (1991): The mammalian sperm acrosome and the acrosome reaction. in: J.W. WASSARMAN (Hrsg.): Elements of Mammalian Fertilization. CRC Press, Boca Raton, Florida, S.155-203 KOUBA, A.J., L.R. ABEYDEERA, I.M. ALVAREZ, B.N. DAY u. W.C. BUHI (2000): Effects of the porcine oviduct-specific glycoprotein on fertilization, polyspermy, and embryonic development in vitro. Biol. Reprod. 63, 242-250 KRAUSE, D. (1966): Untersuchungen am Bullensperma unter Berücksichtigung der fertilitätsdiagnostischen Bedeutung der Befunde. Hannover, Tierärztl. Hochsch., Habil.-Schr. KUDO, K., N. YONEZAWA, T. KATSUMATA, H. AOKI u. M. NAKANO (1998): Localization of carbohydrate chains of pig sperm ligand in the glycoprotein ZPB of egg zona pellucida. Eur. J. Biochem. 252, 492-499
H Literaturverzeichnis
125
LAEMMLI, U.K. (1970): Cleavage of structural proteins during assembly of bakteriophage T4. Nature, London 227, 680-685 LANGLAIS, J., M. ZOLLINGER, L. PLATE, A. CHAPDELAINE, G. BLEAU u. K.D. ROBERTS (1981): Localization of cholesteryl sulfate in human spermatozoa in support of a hypothesis for the mechanism of capacitation. Proc. Natl. Acad. Sci. USA 78, 7266-7270 LAURINCIK, J., D. RATH u. H. NIEMANN: Differences in pronucleus formation and first cleavage following in vitro fertilization between pig oocytes matured in vivo and in vitro. J. Reprod. Fert. 102, 277-284 LEATHEM, A. (1986): Lectin Histochemistry. in: POLACK (Hrsg.): Immunhistochemistry Wright, Bristol, 167-188 LEE, V.J., u. B.S. DUNBAR (1993): Developmental expression of the rabbit 55-kDa zona pellucida (ZP) protein and messenger RNA in ovarian follicles. Dev. Biol. 155, 371-382 LEIBFRIED, M.L., u. N.L. FIRST (1979): Characterization of bovine follicular oocytes and their ability to mature in vitro. J. Anim. Sci. 48, 76-86 LEIBFRIED-RUTLEDGE, M.L., H.M. FLORMANN u. N.L. FIRST (1989): The generation of oocytes. in: H. SCHATTEN u. G. SCHATTEN (Hrsg.): The Molecular Biology of Fertilization. Academic Press, London, S. 273-275 LIEBICH, H.-G. (1993): Funktionelle Histologie. Farbatlas und Kurzlehrbuch der mikroskopischen Anatomie der Haussäugetiere. Schattauer Verlag, Stuttgart, New York, 2. Aufl. LIN, Y., L.H. KIMMEL, D.G. MYLES u. P. PRIMAKOFF (1993): Molecular cloning of the human and monkey sperm surface protein PH-20. Proc. Natl. Acad. Sci. USA 90, 10071-10075 LIU, C., E.S. LITSCHER u. P.M. WASSARMAN (1997): Zona pellucida glycoprotein mZP3 bioactivity is not dependent on the extent of glycosylation of its polypeptide or on sulfation and sialylation of its oligosaccharides. J. Cell Sci. 110, 745-752
H Literautrverzeichnis_________________________________________________________
126
MANN, T., u. C. LUTWACK-MANN (1981): Male reproductive Function and Semen. Springer Verlag, New York MAYMON, B.B., R. MAYMON, I. BEN-NUN (1994): Distribution of carbohydrates in the zona pellucida of human oocytes. J. Reprod. Fertil. 102, 81-86 MCLESKEY, S.B., C. DOWDS, R. CARBALLADA, R. WHITE u. P.M. SALING (1998): Molecules involved in mammalian sperm-egg interaction. Int. Rev. Cytol. 177, 57-133 MEIZEL, S. (1985): Molecules that initiate or help stimulate the acrosome reaction by their interaction with the mammalian sperm surface. Am. J. Anat. 174, 285-302 MICHELMANN, H.W., E. TÖPFER-PETERSEN, P. SCHWARTZ, G. GRATZ u. C. MAGERKURTH (2001): Use of microbeads for the detection of binding sites on the human zona pellucida: a scanning electron microscopy (SEM) assay. Andrologia 33, 266-271 MILLER, D.J., u. R.L. AX (1990): Carbohydrates and fertilization in animals. Mol. Reprod. Dev. 26, 184-198 MILLER, D.J., M.B. MACEK u. B.D. SHUR (1992): Complementarity between sperm surface β-1,4-galactosyl-transferase and egg-coat ZP3 mediates sperm-binding. Nature 357, 589-593 MILLER, D.J., A. MARTIN, A. WINER u. R.L. AX (1990): Heparin-binding proteins from seminal plasma bind to bovine spermatozoa and modulate capacitation by heparin. Biol. Reprod. 42, 899-915 MIRANDA, P.V., F. GONZALEZ-ECHEVERIA u. C.I. MARIN-BRIGGILER (1997): Glycosidic residues involved in human sperm-zona pellucida binding in vitro. Mol. Hum. Reprod. 3, 399-404 MONESI, V. (1976): Spermatogenesis and spermatozoa. in: C.R. AUSTIN u. R.V. SHORT (Hrsg.): Fortpflanzung der Säugetiere: 1. Keimzellen und Befruchtung. Verlag Parey, Berlin, Hamburg, S. 43-71
H Literaturverzeichnis
127
MOOR, R.M., M. MATTIOLI, J. DING u. T. NAGHAI (1990): Maturation of pig oocytes in vivo and in vitro. J. Reprod. Fert. 40 (Suppl.), 197-210 MORI, E., J.L. HEDRICK, N.J. WARDRIP, T. MORI u. S. TAKASAKI (1998): Occurrence of reducing terminal N-acetylglucosamine-3-sulfate and fucosylated outer chains in acidic N-glycans of porcine zona pellucida glycoprotein. Glycoconj. J. 15, 447-456 MOTLIK, J., u. J. FULKA (1976): Breakdown of the germinal vesicle in bovine oocytes cultivated in vitro. J. Exp. Zool. 198, 155-162 MOTTA, P.M., S. MAKABE, T. NAGURO u. S. CORRER (1994): Oocyte follicle cells association during development of human ovarian follicle. A study by high resolution scanning and transmission electron microscopy. Arch. Histol. Cytol. 57, 369-394 NAGDAS, S.K., Y. ARAKI, C.A. CHAYKO, M.-C. ORGEBIN-CHRIST u. D.R.P. TULSIANI (1994): O-linked trisaccharide and N-linked poly-N-acetyllactosamine glycans are present on mouse ZP2 and ZP3. Biol. Reprod. 51, 262-272 NAKANO, M., u. N. YONEZAWA (2001): Localization of sperm-ligand carbohydrate chains in pig zona pellucida glycoproteins. Cells Tissues Organs 168, 65-75 NAKANO, M., u. N. YONEZAWA (1998): Pig and bovine sperm receptors in the egg zona pellucida. Zygote 6 (Suppl. 1), 21-30 NAKANO, M., N. YONEZAWA, Y. HATANAKA u. S. NOGUCHI (1996): Structure and function of the N-linked carbohydrate chains of pig zona pellucida glycoproteins. J. Reprod. Fertil. 50, 25-34 NIXON, B., Q. LU, M.J. WASSLER, C.I. FOOTE, M.A. ENSSLIN u. B.D. SHUR (2001): Galactosyltransferase function during mammalian fertilization. Cells Tissues Organs 168, 46-57 NOGUCHI, S., u. M. NAKANO (1993): Structural characterization of the N-linked carbohydrate chains from the mouse zona pellucida glycoproteins ZP2 and ZP3. Biochim. Biophys. Acta 1158, 217-226
H Literautrverzeichnis_________________________________________________________
128
NOGUCHI, S., u. M. NAKANO (1992): Structure of the acidic N-linked carbohydrate chains of the 55-kDa glycoprotein family (PZP3) from porcine zona pellucida. Eur. J. Biochem. 209, 883-894 OEHNINGER, S. (2001): Molecular basis of human sperm-zona pellucida interaction. Cells Tissues Organs 168, 58-64 OVERSTREET, M.G. (1983): Transport of gametes in the reproductive tract of the female mammal. in: J.F. HARTMANN (Hrsg.): Mechanism Controling Fertilization. Academic Press, New York, S. 499-543 OZGUR, K., M.S. PATANKAR, S. OEHNINGER u. G.F. CLARK (1998): Direct evidence for the involvement of carbohydrate sequences in human sperm-zona pellucida bindung. Mol. Hum. Reprod. 4(4), 318-324 PARILLO, F., S. DIVERIO, L. TODINI u. O. FAGIOLI (2001): Histochemical detection of the lectin-binding carbohydrates in the zona pellucida during oocyte growth in the wild boar (Sus scrofa scrofa). Vet. Res. 32, 581-590 PARILLO, F., O. FAGIOLI, C. DALL’AGLIO u. A. VERINI-SUPPLIZI (2000): Lectin histochemical detection of sulfoglycans in the zona pellucida of mammalian antral oocytes. Acta Histochem. 102, 1-10 PARILLO, F., G. STRADAIOLI, C. DALL’AGLIO u. A. VERINI-SUPPLIZI (1996): Characterization of the complex carbohydrates in the zona pellucida of mammalian oocytes using lectin histochemistry. Vet. Res. Com. 20, 225-236 PARILLO, F. u. A. VERINI-SUPPLIZI (2001): Glycohistochemistry of the zona pellucida of developing oocytes in the rabbit and hare. Res. Vet. Sci. 70, 257-264 PATERSON, M., M.R. WILSON, M. VAN DUIN u. R.J. AITKEN (1996): Evaluation of zona pellucida antigens as potential candidates for immunocontraception. J. Reprod. Fertil. 50 (Suppl), 175-182 PAYNE, D. (1995): Micro-assisted Fertilization. Reprod. Fert. Dev. 7, 831-839
H Literaturverzeichnis
129
PETTERS, R.M., u. M.L. WELLS (1993): Culture of pig embryos. J. Reprod. Fertil. 48 (Suppl.), 62-73 POPPE, C.E., C.A. JOHNSON, M.A. MCRAE, G.L. KELLER u. B.L. DRESSER (1997): Development of embryos produced by intracytoplasmic sperm injection of domestic cat oocytes. Theriogenology 47, 403 (abstract) PRASAD, S.V., B. WILKINS, S.M. SKINNER u. B.S. DUNBAR (1998): Evaluating zona pellucida structures and function using antibodies to rabbit 55kDa ZP protein expressed in baculovirus expression system. Mol. Reprod. Dev. 43, 519-529 PRATHER, R.S., u. B.N. DAY (1998): Practical considerations for the in vitro production of pig embryos. Theriogenology 49, 23-32 PRIMAKOFF, P., W. LATHROP, L. WOOLMAN, A. COWAN u. D.G. MYLES (1988): Fully effective contraception in male and female guinea pigs immunized with the sperm protein PH-20. Nature 335, 543-546 PRIMAKOFF, P., L. WOOLMAN-GAMER, K.S. TUNG u. D.G. MYLES (1997): Reversible contraceptive effect of PH-20 immunization in male guinea pigs. Biol. Reprod. 56, 1142-1146 RATH, D., C.R. LONG, J.R. DOBRINSKY, G.R. WELCH, L.L. SCHREIER u. L.A. JOHNSON (1999): In vitro production of sexed embryos for gender preselection: High speed sorting of X-chromosome bearing sperm to produce piglets after embryo transfer. J. Anim. Sci. 77, 3346-3352 RATH, D., L.A. JOHNSON u. A. GÖRLACH (1996): Geschlecht von Kälbern jetzt vor der Besamung durch BSST vorausbestimmbar. Informationsblatt der Tierzucht- und Besamungstechniker 102, 3-4 REINERT, M., J.J. CALVETE, L. SANZ u. E. TÖPFER-PETERSEN (1996): Primary structure of stallion seminal plasma protein HSP-7, a zona-pellucida-binding protein of the spermadhesin family. Eur. J. Biochem. 242, 636-640 RICHARDSON, R.T., N. YAMASAKI u. M.G. O’RAND (1994): Sequenz of rabbit sperm zona pellucida binding protein and localization during acrosome reaction. Dev. Biol. 165, 688-701
H Literautrverzeichnis_________________________________________________________
130
ROGERS, B.J. (1988): Sperm penetration assay in diagnosing and treating male infertility. in: A.F. HOLSTEIN, F. LEIDENBERGER, K.H. HÖLTZER u. G. BETTENDORF (Hrsg.): Carl Schirren Symposium, Advances in Andrology. Diesbach Verlag, Berlin SACCO, A.G. (1987): Zona pellucida: Current status as a candidate antigen for contrazeptive vaccine development. Am. J. Reprod. 41, 523-532 SACCO, A.G., E.C. YUREWICZ, M.G. SUBRAMANIAN u. F.J. DEMAYO (1981): Zona pellucida composition: species cross reactivity and contraceptive potential of antiserum to a purified pig zona antigen (PPZA). Biol. Reprod. 25, 997-1008 SANZ, L., J.J. CALVETE, W. SCHAFER, K. MANN u. E. TÖPFER-PETERSEN (1992): Isolation and biochemical characterization of two isoforms of a boar sperm zona pellucida-binding protein. Biochim. Biophys. Acta. 1119, 127-132 SCHIEWE, M.C., E. ARAUJO, R.H. ASCH u. J.P. BALMACEDA (1995): Enzymatic characterization of zona pellucida hardening in human eggs and embryos. J. Assist. Reprod. Genet. 12, 2-7 SCHNORR, B. (1989): Embryologie der Haustiere. Ein Kurzlehrbuch. 2. Aufl. Verlag Enke, Stuttgart SCHUEMER, R., G. STRÖHLEIN u. J. GOGOLOK (1992): Datenverarbeitung und statistische Auswertung mit SAS. Band II: Komplexe statistische Analyseverfahren. Fischer Verlag, Stuttgart, Jena, New York SCHUMACHER, U., U. WELSCH, S. BROOKS u. A. LEATHEM (1990): Lectinhistochemie. Histochemie, 1229-1232 SCHWARTZ, P., C. MAGERKURTH u. H.W. MICHELMANN (1996): Scanning electron microscopy of the zona pellucida of human oozytes during intracytoplasmic sperm injection (ICSI). Hum. Reprod. 11, 2693-2696 SEKI, N., J. TOYAMA u. T. NAKANO (1992): Changes in the distrubution of filipin-sterol complexes in the boar sperm head plasma membrane during epididymal maturation and in the uterus. Anat. Rec. 232, 221-230
H Literaturverzeichnis
131
SETCHEL, B.P. (1982): Spermatogenesis and spermatozoa. in: C.R. AUSTIN u. R.V. SHORT (Hrsg.): Reproduction of Mammals. Cambridge University Press, Bd. 1 SHALGI, R., B. MAYMON u. B. BAR-SHIRA (1991): Distribution of lectin receptor sites in the zona pellucida of follicular and ovulated oocytes. Mol. Reprod. Dev. 29, 365-372 SHALGI, R., u. T. RAZ (1997): The role of carbohydrate residues in mammalian fertilization. Histol. Histopathol. 12, 813-822 SHIVAIJI, S., K.-H. SCHEIT u. P.-M. BHARGARA (1990): Proteins of Seminal Plasma. John Wiley and Sons Inc., New York SHUR, B.D. (1998): Is sperm galactosyltransferase a signalling subunit of a multimeric gamete receptor? Biochem. Biophys. Res. Com. 250, 537-543 SINOWATZ, F., E. TÖPFER-PETERSEN u. S. KÖLLE (2001): Biosynthesis and expression of zona pellucida glycoproteins in mammals. Cells Tissues Organs 168, 24-35 SKUTELSKY, E., E. RANEN u. R. SHALGI (1994): Variations in the distribution of sugar residues in the zona pellucida as possible species-specific determinantes of mammalian oocytes. J. Reprod. Fertil. 100, 35-41 SMITH, T.T. (1998): The modulation of sperm function by the oviductual epithelium. Biol. Reprod. 58, 1102-1104 SOLIS, D., J.J. CALVETE, L. SANZ, C. HETTEL, M. RAIDA, T. DIAZ-MAURINO u. E. TÖPFER-PETERSEN (1997): Fractionation and characterization of boar seminal plasma spermadhesion PSP-II glycoforms reveal the presence of uncommon N-acetylgalactosamine-containing N-linked oligosaccharides. Glycoconj. J. 14(2), 275-280 STILLMARK, H. (1888): Über Ricin, ein giftiges Ferment aus Ricinus communis und einigen Euphorbiaceae. Inaugural Diss., Dorpat
H Literautrverzeichnis_________________________________________________________
132
STROBAND, H.W., u. T. VAN DER LENDE (1990): Embryonic and uterine development during early pregnancy in pigs. J. Reprod. Fertil. 40 (Suppl.), 261-277 SUAREZ, S.S. (1998): The oviductual sperm reservoir in mammals: Mechanism of formation. Biol. Reprod. 58, 1105-1107 SUAREZ, S.S., K. REDFERN, P. RAYNOR, F. MARTIN u. D. PHILLIPS (1991): Attachment of boar sperm to mucosal explants of oviduct in vitro: possible role in formation of a sperm reservoir. Biol. Reprod. 44, 99-104 SUZUKI, H., X. YANG u. R.H. FOOTE (1994): Alterations of the bovine oocyte and its investigations during and after maturation and fertilization in vitro. Mol. Reprod. Dev. 38, 421-430 TALBOT, P., u. G. DI CARLANTONIO (1984): The oocyte-cumulus-complex: ultrastructure of the extracellular components in hamsters and mice. Gam. Res. 10, 127-142 TIAN, J., H. GONG u. W.J. LENNARZ (1999): Xenopus laevis sperm receptor gp69/64 glycoprotein is a homolog of the mammalian sperm receptor ZP2. Proc. Natl. Acad. Sci. USA 96, 829-834 TÖPFER-PETERSEN, E. (1999): Carbohydrate-based interactions on the route of a spermatozoon to fertilization. Hum. Reprod. Update 5(4), 314-329 TÖPFER-PETERSEN, E., J.J. CALVETE u. L. SANZ (1994): Spermadhesin: a multifunctional carbohydrat-binding protein family involved in boar sperm capacitation/zona pellucida binding. ARTA 6, 53-63 TÖPFER-PETERSEN, E., J.J. CALVETE, L. SANZ u. F. SINOWATZ (1995): Carbohydrate- and heparin-binding proteins in mammalian fertilization. Andrologia 27(6), 303-324 TÖPFER-PETERSEN, E., D. CECHOVA, A. HENSCHEN, M. STEINBERGER, A.E. FRIESS u. A. ZUCKER (1990): Cell biology of acrosomal proteins. Andrologia 22(1), 110-121
H Literaturverzeichnis
133
TÖPFER-PETERSEN, E., M. ENSSLIN u. D. WABERSKI (1996): Kapazitation: Eine kurze Übersicht. Fertilität 12, 183-189 TÖPFER-PETERSEN, E., K. MANN u. J. J. CALVETE (1993): Identification of porcine oocyte 55 kDa α and β proteins within the zona pellucida glycoprotein families indicates that oocyte sperm receptor activity is associated with different zona pellucida proteins in different mammalian species. Biol. Chem. Hoppe-Seyler 374, 411-417 TOTZAUER, I., S. KÖLLE, F. SINOWATZ, J. PLENDEL, W. AMSELGRUBER u. E. TÖPFER-PETERSEN (1998): Localization of the zona glycoproteins ZPB (ZP3 alpha) and ZPC (ZP3 beta) in the bovine ovary during pre- and postnatal development. Ann. Anat. 180, 37-43 TOWBIN, H., T. STACHELIN u. J. GORDON (1979): Electrophoretic transfer of proteins from polyacrylamid gels to nitrocellulose sheets: Procedure and some applications. Proc. Natl. Acad. Sci. USA 76, 4350 TREDE, C. (1995): Histologische, ultrastrukturelle und histochemische Untersuchungen an der Zona pellucida des Schweines. München, Ludwig-Maximilians-Univ., Tierärztl. Fak., Diss. TULSIANI, D.R., M.D. SKUDLAREK, M.K. HOLLAND u. M.C. ORGEBIN-CHRIST (1993): Glycosylation of rat sperm plasma-membrane during epididymal maturation. Biol. Reprod. 48, 417-428 TURNER, K., u. R.W. HOROBIN (1997): Permeability of the mouse zona pellucida: A structure-staining-correlation model using coloured probes. J. Reprod. Fertil. 111, 259-265 VANROOSE, G., H. NAUWYNCK, A. VAN SOOM, M.T. YSEBAERT, G. CHARLIER, P. VAN OOSTVELDT u. A. DE KRUIF (2000): Structural aspects of the zona pellucida of in vitro-produced bovine embryos: A scanning electron and confocal laser scanning microscopic study. Biol. Reprod. 62, 463-649 VARNER, D.D., J.A. BOWEN u. L. JOHNSON (1993): Effect of heparin on capacitation/acrosome reaction of equine sperm. Arch. Androl. 31(3), 199-207)
H Literautrverzeichnis_________________________________________________________
134
VISCONTI, P.E., L.R. JOHNSON, M. OYASKI, M. FORNES, M. MOSS, S.B. GERTON u. G. S. KOPF (1997): Regulation, localization, and anchoring of protein phosphorylation during sperm capacitation. Biol. Reprod. 59, 1-6 WAGNER, A., M. EKHLASI-HUNDRIESER, C. HETTEL, A. PETRUNKINA, D. WABERSKI, M. NIMTZ u. E. TÖPFER-PETERSEN (2002): Carbohydrate-based interactions of oviductal sperm reservoir formation – studies in the pig. Mol. Reprod. Dev. 61, 249-257 WANG, W.-H., L.R. ABEYDEERA, R.S. PRATHER u. B.N. DAY (1998): Morphologic comparison of ovulated and in vitro-matured porcine oocytes, with particular reference to polyspermy after in vitro fertilisation. Mol. Reprod. Dev. 49, 308-316 WASSARMAN, P.M. (1990): Regulation of mammalian fertilization by zona pellucida glycoproteins. J. Reprod. Fert. 42 (Suppl.), 79-87 WASSARMAN, P.M. (1988): Zona pellucida glycoproteins. Ann. Rev. Biochem. 57, 415-422 WASSARMAN, P.M., u. R.A. KINLOCH (1992): Gene expression during oogenesis in mice. Mutat. Res. 296, 3-15 WASSARMAN, P.M., u. E. LITSCHER (2001): Towards the molecular basis of sperm and egg interaction during mammalian fertilization. Cells Tissues Organs 168, 36-45 WASSARMAN, P.M. u. S. MORTILLO (1991): Structure of the mouse egg extrazellular coat, the zona pellucida. Int. Rev. Cytol. 130, 85-110 WEMPE, F., K. EINSPANIER u. K.H. SCHEIT (1992): Characterization by cDNA cloning of the mRNA of a new growth factor from bovine seminal plasma: acidic seminal fluid protein. Biochem. Biophys. Res. Com. 183, 232-237 WUTTKE, W. (1990): Sexualfunktionen. in: R.F. SCHMIDT u. G. THEWS (Hrsg.): Physiologie des Menschen. Springer Verlag, Berlin, 24.Aufl., S. 820-831
H Literaturverzeichnis
135
YAMAGATA, T. (1985): The role of saccarides in fertilization of the mouse. Dev. Growth. Differ. 27, 176-177 YANAGIMACHI, R. (1994): Mammalian Fertilization. in: E. Knobil u. J.D. NEILL (Hrsg.): The Physiology of Reproduction. Raven Press, New York, 2. Aufl., S. 189-317 YONEZAWA, N., N. FUKUI, K. KUDO u. M. NAKANO (1999): Localization of neutral N-linked carbohydrate chains in pig zona pellucida glycoprotein ZPC. Eur. J. Biochem. 260, 57-63 YUREWICZ, E.C., B.A. PACK u. A.G. SACCO (1992): Porcine oocyte zona pellucida Mr 55,000 glycoproteins: Identification of O-glycosylated domains. Mol. Reprod. Dev. 33, 182-188 YUREWICZ, E.C., B.A. PACK u. A.G. SACCO (1991): Isolation, composition, and biological activity of sugar chains of porcine oocyte zona pellucida 55kDa glycoprotein. Mol. Reprod. Dev. 30, 126-134 YUREWICZ, E.C., A.G. SACCO, S.K. GUPTA, N. XU u. D.A. GAGE (1998): Hetero-oligomerization-depent binding of pig oocyte zona pellucida glycoproteins ZPB and ZPC to boar membrane vesicles. J. Biol. Chem. 273, 7488-7494
Eigene Veröffentlichung: EBELING, S., P. SCHWARTZ, H.W. MICHELMANN, M. EKHLASI-HUNDRIESER, A.M. PETRUNKINA u. E. TÖPFER-PETERSEN (2002): Characterization of the porcine zona pellucida during in vitro maturation. in: 35th Annual Meeting on Physiology and Pathology of Reproduction, 27th Veterinary-Human Medical Communal Meeting, Leipzig, 2002 Dt. Veterinärmed. Ges., Gießen
J Anhang___________________________________________________________________
136
J Anhang
1. Rezeptverzeichnis
Alle Chemikalien stammen von Merck, Darmstadt, soweit nicht anders angegeben. Pufferlösungen: PBS (Phosphat buffered saline): 154 mM NaCl; 9,1 mM Na2HPO4; 2,71 mM KH2PO4; pH-Wert 7,4
TBS (Tris buffered saline): 50 mM Tris; 150 mM NaCl; pH-Wert 7,5 Physiologische Kochsalzlösung:
0,9% NaCl (154 mM) Oozytenpuffer: 10 mM Na2HPO4; 125 mM NaCl; 3 mM Na3-Citrat x 2 H2O; 2 mM EDTA; 10 mM NaH2PO4 pH-Wert 7,0-7,4 Hyperosmolare Salzlösung: 1,5 M MgCl2 x 6 H2O; 40 mM Hepes; 0,1% Dextran pH-Wert 7,0-7,4 Percoll-Lösungen: a. Stammlösung 90% Original-Percoll-Lösung (Sigma Diagnostics, Taufkirchen) 10% physiolog. Kochsalzlsg
b. 40% Percoll-Lsg 40% Stammlsg 60% physiolog. Kochsalzlsg
c. 20% Percoll-Lsg 20% Stammlsg 80% physiolog. Kochsalzlsg
d. 10% Percoll-Lsg 10% Stammlsg 90% physiolog. Kochsalzlsg
J Anhang
137
Spül- und Waschmedium für Oozyten bzw. Zonae pellucidae (PBS/PVA):
PBS/ 2% PVA (w/v)
Maturationsmedium NCSU 37 (PETTERS u. WELLS 1993):
1,7 mM CaCl2 x 2 H2O; 0,6 mM Cystein; 10 ng/ml EGF; 5,6 mM Glucose; 1,0 mM Glutamin; 10% immature Follikelflüssigkeit; 5,0% Insulin; 4,8 mM KCl; 1,2 mM KH2PO4; 1,2 mM MgSO4 x 6 H2O; 108,7 mM NaCl; 25,1 mM NaHCO3; 100 IE/l Penicillin G; 12 mM Sorbitol; 50 mg/l Streptomycin
für die ersten 24 h zusätzliche Supplementierung von: 1,0 mM db-cAMP; 10 IE/l hCG; 10 IE/l PMSG
Polyacrylamidgele:
10% Trenngel: 30% Acrylamidlösung (Roth, Karlsruhe): 3,3 ml 1,5 M Tris/HCl pH 8,8: 2,5 ml 10 ml 10% SDS Ultrapure (Roth, Karlsruhe): 100 µl Aqua bidest.: 4,0 ml TEMED (Serva, Heidelberg): 4 µl 40% Ammoniumpersulfat (Serva, Heidelberg):100 µl
4,5% Sammelgel: 30% Acrylamidlösung (Roth, Karlsruhe): 0,5 ml 1,0 M Tris/HCl pH 6,8: 0,38 ml 3 ml 10% SDS Ultrapure (Roth, Karlsruhe): 30 µl Aqua bidest.: 2,1 ml TEMED (Serva, Heidelberg): 3 µl 40% Ammoniumpersulfat (Serva, Heidelberg): 30 µl
TEMED und Ammoniumpersulfat werden jeweils erst nach 5minütigem Entlüften im Ultraschallbad hinzugefügt.
Laemmli-Auftragspuffer (nach LAEMMLI 1970):
50 mM Tris pH 6,8; 2% SDS (w/v); 10% Glycerin;1 Spatelspitze Bromphenolblau
Elektrodenlauf-Puffer:
25 mM Tris; 192 mM Glycin; 0,1% SDS (w/v)
J Anhang___________________________________________________________________
138
Isoelektrische Fokussierung: Rehydrationslsg: 9 M Harnstoff; 2% CHAPS; 0,5% IPG Puffer Äquilibrierlsg a: 6 M Harnstoff; 2% SDS (w/v); 2,5 ml 0,5 M Tris/HCl pH 6,8 30% Glycerin (w/v) Äquilibrierlsg I: a + 65 mM DTT (Dithiothreitol; AppliChem, Darmstadt) Äquilibrierlsg II: a + 0,24 M Jodacetamid (Sigma Aldrich Chemie GmbH, Taufkirchen) Silberfärbung (mod. nach HEUKESHOVEN 1988): Fixierlsg: 12,5% Trichloressigsäure
Inkubationslsg:17,01 g Natriumacetat-3-hydrat; 5 ml Glutaraldehyd 25%; 1,24 g Natriumthiosulfat-5-hydrat ad 250 ml Aqua bidest.
Färbelsg: 0,5 g AgNO3; 0,05% Formaldehyd ad 500 ml
Entwickler: 12,5 g Na2CO3; 0,01% Formaldehyd ad 500 ml, pH 11,5
Stopplsg: 0,05 M Glycin (3,75 g/l)
Blottingpuffer:
0,039 M Glycin; 0,048 M Tris; 0,0375% SDS (w/v); 20% Methanol (v/v)
Ponceaufärbelösung:
0,5% Ponceau Rot (Roth, Karlsruhe) in 1% Essigsäure
TBS/ Tween:
TBS, 1% Tween (v/v)
Androhep-Puffer:
20 mM Hepes pH 7,4; 1,5 mM CaCl2 ; 1 mM MgCl2 ; 95 mM NaCl; 1 mM K2HPO4; 5 mM Glucose; 60 mM Saccharose; 5 mM Natriumpyruvat; 0,5% BSA
Tyrodemedium, mod. (Zusammensetzung nach HARRISON 1993):
96,0 mM NaCl; 3,1 mM KCl; 2,0 mM CaCl2 ; 0,4 mM MgSO4 x 6 H2O; 0,3 mM Na2PO4; 5,0 mM Glucose; 21,6 mM Na-lactat; 1,0 mM Na-pyruvat; 15,0 mM NaHCO3 ; 20,0 mM Hepes; 0,3% BSA; 0,001% Phenolrot; pH 7,4
J Anhang
139
2. Tabellen zur Auswertung der funktionellen Bindungstests
Tab. 9: Parameter der an die ZP gebundenen Spermien
a. ejakulierte Frischspermien an Zona pellucida verschiedenen Reifungsgrades
Parameter Mittelwert (%)
Standard- abw.
Minimum
Maximum
1 min 51,9 27,7 8,00 93,0
10 min 42,6 26,5 9,00 117
Anzahl der an ZP gebundenen Spermien 20 min 44,3 24,1 7,00 89,0
1 min 1,46 2,01 0,00 7,69
10 min 2,24 2,89 0,00 11,1
Spermien an ZP mit abgelöster Kappe (%) 20 min 2,83 2,94 0,00 12,5
1 min 6,45 10,2 0,00 52,6
10 min 20,6 24,9 3,85 122
isolierte PNA-FITC pos. Kappen an ZP (%) 20 min 31,3 49,5 6,74 214
1 min 22,6 7,69 10,9 42,1
10 min 34,2 12,2 11,1 54,5
Spermien an ungereifter ZP von Oozyten im Kernstadium GV I
PNA-FITC pos. Spermien an ZP (%) 20 min 46,5 16,0 25,5 100
1 min 47,7 23,3 9,00 98,0
10 min 41,2 18,8 12,0 81,0
Anzahl der an ZP gebundenen Spermien 20 min 45,7 21,0 6,00 79,0
1 min 2,16 2,84 0,00 11,1
10 min 2,69 2,93 0,00 8,70
Spermien an ZP mit abgelöster Kappe (%) 20 min 2,68 1,96 0,00 7,14
1 min 3,27 2,63 0,00 8,51
10 min 16,5 11,6 2,94 50,0
isolierte PNA-FITC pos. Kappen an ZP (%) 20 min 11,4 6,00 0,00 25,5
1 min 20,2 6,40 5,00 34,0
10 min 42,2 15,1 20,0 83,3
Spermien an gereifter ZP von Oozyten im Kernstadium M II
PNA-FITC pos. Spermien an ZP (%) 20 min 42,3 9,17 24,7 58,3
J Anhang___________________________________________________________________
140
b. aufgetaute Nebenhodenspermien an Zona pellucida unterschiedlichen Reifungsgrades
Parameter
Mittelwert (%)
Standard- abw.
Minimum
Maximum
1 min 23,3 9,28 9,00 49,0
10 min 53,3 46,3 6,00 152
Anzahl der an ZP gebundenen Spermien 20 min 56,6 59,7 13,0 213
1 min 1,04 1,60 0,00 4,17
10 min 2,29 2,79 0,00 10,0
Spermien an ZP mit abgelöstem Kappe (%) 20 min 2,99 3,01 0,00 11,5
1 min 18,2 16,7 0,00 50,0
10 min 23,8 19,3 0,00 100
Isolierte PNA-FITC pos. Kappen an ZP (%) 20 min 27,0 16,0 4,76 61,5
1 min 36,2 11,8 20,0 66,7
10 min 36,7 10,5 15,3 70,0
Spermien an ungereifter ZP von Oozyten im Kernstadium GV I
PNA-FITC pos. Spermien an ZP (%) 20 min 38,4 13,0 6,67 69,3
1 min 17,3 6,50 7,00 32,0
10 min 44,7 53,1 8,00 180
Anzahl der an ZP gebundenen Spermien 20 min 44,1 56,5 7,00 176
1 min 1,21 2,05 0,00 5,26
10 min 2,65 3,37 0,00 9,52
Spermien an ZP mit abgelöstem Kappe (%) 20 min 8,74 15,4 0,00 70,6
1 min 19,0 23,0 0,00 85,7
10 min 19,3 17,6 0,00 61,9
Isolierte PNA-FITC pos. Kappen an ZP (%) 20 min 60,7 81,6 0,00 70,6
1 min 36,6 20,1 13,0 64,6
10 min 45,1 10,5 22,2 62,5
Spermien an gereifter ZP von Oozyten im Kernstadium M II
PNA-FITC pos. Spermien an ZP (%) 20 min 47,7 11,1 28,9 66,7
J Anhang
141
Tab. 10: Parameter der Spermien in der Kontrollsuspension ohne ZP
a. ejakulierte Frischspermien Variable Mittelwert (%) Standardabw. Minimum Maximum
5,04 0,64 4,00 6,00 patholog. Abweichungen (%)
davon Plasmatropfen (%) 1.43 0,84 1,00 3,00
1 min 80,9 2,79 75,0 85,0
10 min 66,4 4,88 60,0 70,0
Motilität (vorwärts- u. orts- beweglich in %) 20 min 62,5 5,87 55,0 70,0
1 min 9,07 5,14 3,00 16,0
10 min 16,8 5,33 11,0 26,0
PI pos. (%) ; PNA-FITC neg. (%)
20 min 19,7 3,97 14,0 28,0
1 min 7,78 3,02 4,00 13,0
10 min 13,3 3,09 8,00 17,0
PNA-FITC pos. (%) 20 min 18,8 3,01 15,0 24,0
b. aufgetaute Nebenhodenspermien Variable Mittelwert (%) Standardabw. Minimum Maximum
36,8 1,89 35,0 40,0 patholog. Abweichungen (%)
davon Plasmatropfen (%) 25,4 1,91 22,0 27,0
1 min 64,4 3,38 60,0 70,0
10 min 54,7 3,62 50,0 60,0
Motilität (vorwärts- u. orts- beweglich in %) 20 min 49,5 3,59 45,0 55,0
1 min 11,8 5,22 7,00 21,0
10 min 10,7 1,68 8,00 12,0
PI pos. (%) ; PNA-FITC neg. (%)
20 min 11,2 2,52 8,00 15,0
1 min 25,2 2,88 22,0 29,0
10 min 32,1 1,62 30,0 34,0
PNA-FITC pos. (%) 20 min 38,9 1,61 37,0 41,0
J Anhang___________________________________________________________________
142
3. Multifaktorielle Varianzanalyse
Erläuterungen zur multifaktoriellen Varianzanalyse der Einflüsse auf den Anteil der PNA-
FITC positiven Spermien:
p entspricht der Irrtumswahrscheinlichkeit und R² dem Bestimmungsmaß
(p mit p≤0,001 = statistisch hoch signifikant = **; p≤0,05 = statistisch signifikant = *; p≤0,1 = statistisch auffallend = (*))
Dreifaktorielle Varianzanalyse
Korrelation von Spermienpopulation, Reifungsstatus der ZP und Beobachtungszeitpunkt
Signifikanz des Modells: 0,0001; R² = 0,31
Einfluss der einzelnen Parameter:
Spermienpopulation p=0,001** Reifungsstatus der ZP p=0,021* Zeitpunkt p=0,0001** Reifungsstatus x Zeitpunkt p=0,106 Spermienpopulation x Zeitpunkt p=0,038* Spermienpopulation x Reifungsstatus x Zeitpunkt p=0,177
Zweifaktorielle Varianzanalyse
Korrelation von Reifungsstatus und Beobachtungszeitpunkt bei einheitlicher
Spermienpopulation
Signifikanz des Modells bei a. ejakuliertes Frischsperma: 0,0001**; R² = 0,42 b. aufgetautem TG-Sperma: 0,0134*; R² = 0,11
Einfluss der einzelnen Parameter:
Reifungsstatus der ZP a. p=0,583 b. p=0,008* Zeitpunkt a. p=0,0001** b. p=0,094(*)
Reifungsstatus x Zeitpunkt a. p=0,028* b. p=0,226
J Anhang
143
Korrelation von Spermienpopulation und Beobachtungszeitpunkt bei einheitlichem Reifungsstatus der Zona pellucida
Signifikanz des Modells bei a. ungereifter ZP: 0,0001**; R² = 0,27 b. gereifter ZP: 0,0001**; R² = 0,34
Einfluss der einzelnen Parameter:
Spermienpopulation a. p=0,152 b. p=0,001** Zeitpunkt a. p=0,0001** b. p=0,0001** Spermienpopulation x Zeitpunkt a. p=0,0001** b. p=0,056(*)
Einfaktorielle Varianzanalyse
einheitliche Parameter in der Beobachtungsgruppe
Einflussparameter auf PNA-FITC pos. Anteil
p
R²
Zeitpunkt 1 min 0,273 0,027
Zeitpunkt 10 min 0,044* 0,082
ejakulierte
Frischspermien Zeitpunkt 20 min
Reifungsstatus
der ZP 0,301 0,024
Zeitpunkt 1 min 0,944 0,0001
Zeitpunkt 10 min 0,013* 0,14
kryokonservierte
Nebenhodenspermien Zeitpunkt 20 min
Reifungsstatus der ZP
0,017* 0,13
Frischspermien 0,0001** 0,39 ungereifte ZP Nebenhodenspermien
Zeitpunkt 0,796 0,0064
Frischspermien 0,0001** 0,47 gereifte ZP Nebenhodenspermien
Zeitpunkt 0,573 0,10
K Danksagung_______________________________________________________________
144
K Danksagung
An dieser Stelle möchte ich mich hiermit herzlichst bei Frau Prof. Dr. Dr. Edda Töpfer-
Petersen für die Überlassung des interessanten Themas, die freundliche Aufnahme im Institut
für Reproduktionsmedizin, die persönliche Betreuung und die motivierende Unterstützung bei
der Anfertigung dieser Arbeit bedanken.
Mein besonderer Dank geht an Frau Dr. Anna M. Petrunkina für ihr freundliches Engagement
und die tatkräftige Unterstützung bei der statistischen Auswertung der entsprechenden
Versuchsteile.
Herrn Prof. Dr. D. Rath danke ich für die Aufnahme in seiner Arbeitsgruppe innerhalb des
Institutes für Tierzucht und Tierverhalten der FAL Mariensee für die Erstellung der in vitro
gereiften Oozyten. Stellvertretend für alle seine Mitarbeiter danke ich Antje Frenzel und Dr.
Sabine Probst für die freundliche und entgegenkommende Hilfeleistung.
Herrn Dr. P. Schwartz und Herrn Prof. Dr. H. W. Michelmann (Georg-August-Universität
Göttingen) sei für die Kooperation bei der REM-Analyse herzlich gedankt.
Bei allen Mitarbeitern des Institutes für Reproduktionsmedizin, insbesondere aus dem Werk
II, möchte ich mich für die gute Zusammenarbeit und die stete Bereitschaft, viele kleine und
große Fragen auch zwischendurch zu beantworten, bedanken.
Mein persönlicher und sehr herzlicher Dank gilt den Mitarbeitern meiner Arbeitsgruppe für
die große Hilfsbereitschaft bei der Durchführung und Fertigstellung der Arbeit.
Dank Christiane Hettel, Dr. Mahnaz Ekhlasi-Hundrieser, Bianca Oldendorf und Christine
Kochel und meinen Mitdoktoranden Dr. Andrea Wagner, Bettina Thomas und Katrin Gohr
konnte ich stets in einer sehr angenehmen Atmosphäre arbeiten. Die mir entgegengebrachte
Freundlichkeit über die reine Zusammenarbeit hinaus und die unterhaltsamen zusammen
verbrachten Stunden werde ich nicht vergessen.
_______________________________________________________________K Danksagung
145
Ein großes Dankeschön geht an Edith Podhajsky und Monika Gümmer für ihre allzeit
vorhandene Hilfsbereitschaft und tatkräftige Unterstützung bei der Zonaisolierung und allen
Fragen rund um die Eizelle.
Den Doktoranden des Schweinelabors danke ich für die jederzeit gewährte Hilfe bei der
Gewinnung der Eberejakulate. Hier sei auch Sven für seine konstante und qualitativ
hochwertige Mitarbeit gedankt.
Ganz herzlich bedanke ich mich bei meiner Familie für die finanzielle Ermöglichung von
Studium und Promotion.
Weiterhin danke ich für das Korrekturlesen diverser von mir verfasster Schriftstücke.
Er sieht die Störche fliegen, sieht sich selbst in ihrem Reigen, frei und schwerelos, durch die eigne Kunst, ins Sonnenlicht aufsteigen!
Du kannst fliegen, ja, Du kannst! Laß den Wind von vorne weh’n, breite die Flügel, Du wirst seh’n: Du kannst fliegen, ja, Du kannst!
(R. Mey, Leuchtfeuer)