Oxidationszahlen: Alkohole & Carbonylverbindungen
description
Transcript of Oxidationszahlen: Alkohole & Carbonylverbindungen

1
Technische Universität München
Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität)
Oxidationszahlen: Alkohole & Carbonylverbindungen
O
OO
H
O
O
O
O O
O
O NH
O
NH
NH
O
NNH
O
OH
OH
O
O
O
CO2
NH
NH
AcetalKeton
NitrilEster
Urethan(Carbamat)
sek. Alkoholprim. Alkohol
Orthoester
Aldehyd
Amid
Harnstoff
+I+I +II
+III+III +III+III +III
+IV+IV+IV+IV
0-I
Amidin
Carbonat
-I und 0: primäre und sekundäre Alkohole (und Derivate):
O
Ether
-I
+I und +II: Aldehyde und Ketone (und Derivate): tert. Alkohole (+I)
O
Ketal
+IIO
+III: Carbonsäuren und Derivate:
OH
O
Säure
+III
+IV: Kohlendioxid und Kohlensäurederivate:
O0
Ether

2
Technische Universität München
Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität)
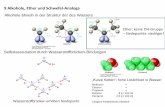
Cr(VI) als Oxidationsmittel
R OH
HR'
R O
HR'
Cr OH
O
OVI R O
R'- "H2CrIVO3"
Cr (VI)
CrO3 (in wässriger Säure: "H2CrO4"), z.B.: CrO3/H2SO4(aq.) (Jones-Reagenz) - sehr starkes Oxidationsmittel (Weiteroxidation zur Säure bei primären Alkoholen) CrO3*2 py (py= Pyridin) (Collins-Reagenz) - deutlich schwächeres Oxidationsmittel (keine Weiteroxidation zur Säure)
"CrO3 * py * HCl" = HCrClO3 * py (Pyridiniumchlorochromat, PCC) - (keine Weiteroxidation zur Säure) H2Cr2O7 * 2 py (Pyridiniumdichromat, PDC) - stärkeres Oxidationsmittel als PCC (Weiteroxidation zur Säure lösungsmittelabhängig)
syn-Eliminierung Disproportionierung in2 Cr(III) und Cr(VI)

3
Technische Universität München
Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität)
„Hypervalentes“ Iod als Oxidationsmittel
IO
O
OHOI
O
O
OAcAcO OAc
IO
O
OHOI
O
O
O
R H
OH
R'
- H2O
RH
O
R'
IO
O
OH
R' R
O
syn-Eliminierung
IBX (Iodoxybenzoesäure) Dess-Martin-Periodinan