Serratierte Läsionen des Kolons - drfalkpharma.de · tierte „Pathway“ etabliert. ... meist...
Transcript of Serratierte Läsionen des Kolons - drfalkpharma.de · tierte „Pathway“ etabliert. ... meist...

1
Fragebeantwortung unter
www.falkfoundation.de
Falk Gastro-Kolleg
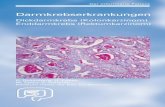
Titelbild: Endoskopisches Bild eines sessilen serratierten Adenoms mit entsprechendem histologischem Befund (histologisches Bild dankenswerterweise zur Verfügung gestellt von Frau Dr. Lisa Lutz, Institut für Pathologie, Universitätsklinikum Freiburg).
Serratierte Läsionen des KolonsZusammenfassung
Das kolorektale Karzinom (KRK) zählt zu den häufigsten soliden Tumoren in Industrie-nationen und ist weltweit die dritthäufigste Tumorerkrankung. Diese entstehen zumeist aus konventionellen Adenomen (Adenom-Karzinom-Sequenz). Durch eine konsequente Früherkennung und Polypabtragung können die Inzidenz und Mortalität des KRK gesenkt werden. Nachdem serratierte Läsionen zunächst als harmlos eingestuft wurden, konnte in den letzten Jahren molekularpathologisch gezeigt werden, dass über den serratierten Weg der Karzinogenese ca. 30% der KRK entstehen. Die Kenntnis über die histologischen, molekularpathologischen und endoskopischen Besonderheiten serratierter Läsionen des Kolons ist essenziell für eine entsprechende Behandlung und Nachsorge.
Schlüsselwörter
Kolonpolypen | Kolonkarzinom | sessiles serratiertes Adenom | serratiertes Polyposis-Syndrom | hyperplastische Polypen | traditionelles serratiertes Adenom
Falk Gastro-Kolleg
Darm
Dr. Jan B. KuhlmannMedizinische Klinik IIUniversitätsklinikum FreiburgHugstetter Str. Freiburg
Dr. J. B. Kuhlmann

2
Serratierte Läsionen des Kolons
Hintergrund
In Deutschland ist das kolorektale Karzinom (KRK) die zweithäufigste Krebserkrankung für beide Geschlechter. Die Zahl der Neuerkrankungen liegt jährlich bei knapp 70.000. Entscheidend für die Prognose ist das Stadium bei Erstdiagnose. Während die 5-Jahres-Überlebensrate im UICC-Stadium I noch über 80% beträgt, sinkt diese bei Lymphknoten-befall bereits auf unter 60% ab. Somit kommt der Früherkennung des KRK eine beson-dere Bedeutung zu. Die Mehrzahl der Karzinome entsteht aus adenomatösen Polypen. Die Entwicklung eines Karzinoms aus einem Adenom dauert im Schnitt 10 Jahre (Ade-nom-Karzinom-Sequenz). Nicht zuletzt durch das Auftreten sogenannter Intervall-karzinome (KRK, die trotz einer vorausgegangenen Koloskopie auftreten) ist hinter-fragt worden, ob wirklich in allen Fällen konventionelle Adenome die Vorläuferläsionen des KRK darstellen.
Noch bis vor einigen Jahren wurden serratierte Polypen im Kolorektum aufgrund feh-lender dysplastischer Epithelveränderungen als nicht-neoplastische Läsionen klassi-fiziert. Entsprechend wurde ihnen auch kein Potenzial zur malignen Progression zuge-schrieben. Allerdings häuften sich Fallberichte über KRK bei Patienten mit dem relativ seltenen „hyperplastischen Polyposis-Syndrom“, welches nach der neuen WHO-Klassi-fikation serratiertes Polyposis-Syndrom (SPS) genannt wird. In einer Arbeit beschrieben Torlakovic & Snover bei 6 Patienten mit SPS, von denen 4 an einem Adenokarzinom erkrankt waren, dass sich die Mehrzahl dieser Polypen histologisch von den hyper-plastischen Polypen (HP) der Kontrollpatienten unterschied. Sie führten für diese Poly-pen den Begriff sessile serratierte Polypen ein [1].
Durch den Fortschritt der Molekularpathologie hat sich neben der traditionellen Ade-nom-Karzinom-Sequenz ein weiterer Weg der Karzinogenese, der sogenannte serra-tierte „Pathway“ etabliert. Ungefähr 20–30% aller KRK entstehen auf diese Weise [2]. Die histomorphologischen Diagnosekriterien für die unterschiedlichen serratierten Läsio-nen werden zum Teil noch kontrovers diskutiert. Die Nomenklatur ist entsprechend un-einheitlich und teilweise verwirrend, da verschiedene Begriffe für die Bezeichnung ein und derselben Veränderung synonym gebraucht werden: sessiles serratiertes Adenom, sessile serratierte Läsion, sessiler serratierter Polyp. Vor diesem Hintergrund wurden und werden die serratierten Vorläuferläsionen bislang häufig unterdiagnostiziert und fehl-klassifiziert. Dies führt möglicherweise zu einer inadäquaten Therapie und Nachsorge.
Histopathologische Kriterien serratierter Läsionen
Allgemein
In der normalen Kolonschleimhaut ist die zelluläre Proliferation auf die Zellen des Kryptenbodens beschränkt. Von dort wandern die Zellen, die ihre Teilungsfähigkeit verlieren, nach oben und werden an der Kryptenspitze in das Darmlumen abgeschil-fert. Während diese Zellen bei den konventionellen Adenomen durch eine Mutation im APC-Gen bei der Migration zur Kryptenspitze ihre Teilungsfähigkeit behalten, kommt es zur typischen tubulären bzw. villösen Adenombildung. Bei den serratierten Läsio-nen hingegen ist die Apoptose gestört. Es kommt zum „Aufstau“ einer erhöhten Zahl retinierter Zellen am Kryptenboden. Aus Platzgründen bleibt den Drüsen an der Basis nur der Weg des seitlichen Wachstums, da die Lamina muscularis mucosae im Allge-meinen ein direktes Einwachsen in die Submukosa verhindert. Dadurch entsteht die typische sägezahnartige Auffaltung des Epithels innerhalb der Drüsenschläuche.
Es werden 3 Gruppen von serratierten Läsionen unterschieden (s. Tab. 1): hyperplas-tischer Polyp (HP), sessiles serratiertes Adenom (SSA) und traditionelles serratiertes Adenom (TSA).
P Serratierte Läsionen lassen sich in hyperplastischen Polyp, sessiles serratiertes Adenom und traditionelles serratiertes Adenom einteilen.

3
Klinische Eigenschaften konventioneller Adenome und serratierter Läsionen [25, 26]
Häufigkeit aller Polypen
Lokalisation Form
Konventionelle Adenome
tubulär
villös
tubulovillös
55%
28%
4%
22%
Gesamtes Kolorektum Meist polypös ins Darmlumen wachsend, gestielt oder sessil
Serratierte Läsionen
HP 25–30% Distales Kolorektum Flach, sessil, meist < 5 mm
SSA 1,7–9% Proximales Kolon Flach, sessil, meist > 5 mm
TSA 0,6–1,9% Distales Kolorektum Sessil oder gestielt
Hyperplastischer Polyp (HP)
Hyperplastische Polypen (HP) sind die mit Abstand häufigsten serratierten Läsionen (80–90%) [3]. Sie sind flach, meist kleiner als 5 mm und überwiegend im Rektum bzw. linksseitigen Kolon lokalisiert. Histomorphologisch sind HP durch elongierte Krypten mit serratierter Architektur in der oberen Kryptenhälfte charakterisiert. Die Prolifera-tion in der basalen Kryptenhälfte ist regulär nicht serratiert. Es werden histologisch 3 Subtypen unterschieden:
– Mikrovesikulärer hyperplastischer Polyp (MVHP) Diese Form ist die häufigste. Das Zytoplasma trägt, wie der Name schon sagt, kleine
Vesikel. MVHP sind meist im rechten Kolon zu finden und häufig ist eine BRAF-Muta-tion nachweisbar, weswegen vermutet wird, dass dieser Typ eine Art Vorstufe des SSA ist.
– Becherzellreicher hyperplastischer Polyp („goblet cell-rich“ GCHP) Dieser Typ zeigt insgesamt weniger Serrationen. Becherzellen dominieren das Epi-
thel. Er findet sich meist im linken Kolon und ist häufiger mit einer KRAS-Mutation vergesellschaftet.
– Muzinarmer hyperplastischer Polyp (MPHP) Diese Art ist die seltenste und zeichnet sich durch das Fehlen von zytoplasmati-
schem Mukus aus.
Da es in der Praxis zum Teil sehr schwierig ist diese Subtypen zu differenzieren und die klinische Bedeutung bislang zweifelhaft ist, wird empfohlen, derzeit in der Routine-diagnostik keine Subklassifikation der HP vorzunehmen. Der HP hat in der Regel kein Potenzial der malignen Entartung. Größere Läsionen (> 5 mm), v. a. im proximalen Ko-lon, sind suspekt und sollten endoskopisch komplett reseziert werden. Bei größerer Anzahl (> 20) oder positiver Familienanamnese für ein KRK sollte auch an ein serratier-tes Polyposis-Syndrom (SPS) gedacht werden (s. u.).
Sessiles serratiertes Adenom (SSA)(Synonyme: sessiler serratierter Polyp oder sessile serratierte Neoplasie/Läsion)
Die zweithäufigste Form der serratierten Läsionen ist das sessile serratierte Adenom (SSA; ca. 10–25% aller serratierten Läsionen) [3]. Es ist meist größer als 5 mm, befindet sich hauptsächlich im proximalen Kolon und trägt häufig eine gelbliche „Schleimmüt-ze“. Die histomorphologischen Charakteristika des SSA sind die Hyperserratierung bis an die Kryptenbasis und die palisadenartig angeordneten dilatierten Krypten. Diese sind häufig an der Basis T- und L-förmig verzweigt. Zudem können invertierte Krypten unterhalb der Lamina muscularis mucosae vorkommen (sog. Pseudoinvasion). Wei-tere Merkmale des SSA sind das Vorkommen reifer Becherzellen an der Kryptenbasis, Verschiebung der Proliferationszone ins mittlere Kryptendrittel und der Nachweis von
Tab. 1
P Der hyperplastische Polyp ist klein und v. a. im Rektum lokalisiert. Er hat kein Potenzial der malignen Entartung.
P SSA haben histomorphologisch häufig verzweigte (T-/L-förmige) und invertierte Krypten (Pseudoinvasion).

4
gering vergrößerten vesikulären Zellkernen mit Nukleolen (s. Tab. 2). Es wird unter-schieden zwischen SSA mit und ohne zytologische Dysplasie, ähnlich wie bei den konventionellen Adenomen. Inzwischen ist unbestritten, dass das SSA eine prämalig-ne Vorläuferläsion auf dem Weg zum Karzinom ist. Molekularpathologisch ist häufig eine BRAF-Mutation nachweisbar. Für die Diagnose des SSA ist die Erfassung basaler Schleimhautanteile essenziell, um sie von HP sicher zu unterscheiden.
Endoskopische und histologische Charakteristika des SSA (modifiziert nach [27])
Endoskopische Kriterien
– Eher rechtskolisch gelegen– Flach-sessil, nicht polypoid– Meist > 5 mm– Häufig „Schleimkappe“– Oft Ränder nicht gut abgrenzbar– Blasse Schleimhautoberfläche
Histologische Kriterien
– Hyperserratierung im unteren Kryptendrittel mit oder ohne Kryptenverzweigung– T- bzw. L-förmige Krypten oberhalb der Lamina muscularis mucosae– Invertierte Krypten (Mikroherniation/Pseudoinvasion) unterhalb der
L. muscularis mucosae– „Säulenförmig“ angeordnete Kryptendilatation im unteren Drittel– Verschiebung der Proliferationszone ins mittlere Kryptendrittel– Vesikuläre Zellkerne mit Nukleolen– Reife Becherzellen an der Kryptenbasis
Traditionelles serratiertes Adenom (TSA)
Das traditionelle serratierte Adenom (TSA) stellt die seltenste Variante der serratierten Veränderungen dar (1–6% aller serratierten Läsionen) [3]. Klinisch treten TSA häufig im linken Kolon bzw. Rektum auf und sind nicht selten gestielt. Sie stellen eine Durch-mischung serratierter Kryptenmorphologie und zytologischer Veränderungen klassi-scher Adenome dar. Das TSA zeigt histologisch definitionsgemäß dysplastische Epi-thelveränderungen im Sinne einer intraepithelialen Neoplasie (IEN) unterschiedlichen Schweregrads. Überdies liegen eine ausgeprägte Serratierung und eine diffuse zyto-plasmatische Eosinophilie vor. Charakteristisch sind sogenannte ektope Krypten („ecto-pic crypt formation“), definiert als seitlich aussprossende Krypten ohne Bezug zur Lamina muscularis mucosae. TSA zeichnen sich durch einen hohen Nachweis von KRAS-Muta-tionen aus.
Gemischte Polypen
Unter dem Begriff „gemischter Polyp“ wurde eine heterogene Gruppe von Läsionen subsummiert, die sowohl Anteile von serratierten Adenomen und hyperplastischen Polypen als auch von klassischen tubulären oder villösen Adenomen enthalten kann. Nach der aktuellen WHO-Klassifikation sollen diese Polypen der Gruppe von Polypen zugeteilt werden, deren Anteil im höheren Maße im Polypen vorliegt, mit dem Ver-merk, dass auch serratierte bzw. adenomatöse Anteile vorliegen.
Die pathologische Einteilung in HP, SSA und TSA ist einheitlich. Dennoch konnten Khalid et al. [4] zeigen, dass eine hohe „Interobserver“-Variabilität besteht. Gerade SSA und HP werden häufig unterschiedlich klassifiziert, was Folgen in Bezug auf die jeweilige Therapie und Nachsorge mit sich bringen kann. Eine bessere Klassifizierung könnte möglicherweise durch die Einbeziehung klinischer Kriterien wie die Polypengröße und ihre Lokalisation sowie molekularpathologische Untersuchungen erzielt werden.
Tab. 2
P TSA sind seltene Polypen (~ 1% aller Kolonpolypen), die des Öfteren gestielt vorkommen. Molekularpathologisch ist häufig eine KRAS-Mutation nachweisbar.

5
Serratierte Karzinogenese
Der traditionelle Pfad der Adenom-Karzinom-Sequenz läuft über den Wnt-Signalweg. Die primäre Schlüsselmutation betrifft das APC-Gen, gefolgt von Onkogenaktivierun-gen (z. B. KRAS), und insbesondere den Verlust von Tumorsuppressorgenen (z. B. p53) mit der Konsequenz einer chromosomalen Instabilität (CIN) bzw. Aneuploidie [5, 6] (s. Abb. 1). Nach aktuellen Erkenntnissen entstehen ca. 60% der sporadischen Karzino-me via Adenom-Karzinom-Sequenz. Die Vorläuferläsionen dieses Mehrschrittkonzepts sind die tubulären und villösen Adenome mit unterschiedlichem Grad einer intra-epithelialen Neoplasie.
Karzinogenese des kolorektalen Karzinoms (modifiziert nach [29])
Normale Mukosa
MGMT
APC
BRAFMGMT
KRAS
KRAS p53
MLH1
Normale Mukosa
Hyper-plastisches
Epithel
MVHP
GCHP
Adenom
SSA
TSA
SSA
KRK – CIN– (KRAS)– CIMP negativ
KRK – BRAF– CIMP-H– MSI-H
KRK – BRAF– CIMP-H– MSS/MSI-L
KRK – KRAS– CIMP-L– MSS/MSI-L
Adenom-Karzinom-Sequenz:
Serratierter „Pathway”:
Die serratierte Karzinogenese ist vielfältig. Am häufigsten beginnt sie mit einer einzel-nen Punktmutation (V600E) im BRAF-Onkogen. Diese führt zu einer konstitutiven Akti-vierung des „mitogen-activated protein kinase“ (MAPK)-Signalwegs „downstream“ von KRAS mit gesteigerter Zellproliferation, längerem Überleben und Inhibition der Apop-tose. Die BRAF-Mutation ist häufig schon bei HP (v. a. bei MVHP) nachweisbar. Ihr folgt im weiteren Verlauf der Karzinogenese eine epigenetische Methylierung von Cytosin-phosphatidyl-Guanin (CpG)-Inseln. Diese Inseln befinden sich v. a. im Bereich von Gen-promotoren. Eine Hypermethylierung führt entsprechend zum Abschalten gewisser Tumorsuppressorgene bzw. DNA-Reparaturgene. Der Phänotyp wird entsprechend CIMP-H (CpG island methylator phenotype „high“ für eine hohe Methylierung) bzw. CIMP-L („low“ für eine niedrige Methylierung), ähnlich wie bei der Testung auf Mikro-satelliteninstabilität (MSI), klassifiziert. Wird durch die Hypermethylierung die Transkrip-tion von MLH1, einem DNA-„Mismatch-Reparatur“ (MMR)-Gen gestört, stellt sich das Karzinom als MSI-H dar. Diese Tumoren dürfen nicht mit MSI-H-Karzinomen des HNPCC verwechselt werden. Beim HNPCC liegt eine Keimbahnmutation in einem MMR-Gen (MLH1, MSH2, MSH6, PMS2 und Epcam) vor. Unterscheiden kann man diese Tumoren molekularpathologisch, z. B. mit der fehlenden BRAF-Mutation bei HNPCC-assoziierten MSI-Tumoren.
Der beschriebene serratierte „Pathway“ ist ursächlich für die Karzinomentstehung, v. a. durch SSA. Eine Variante entsteht durch die Hypermethylierung des Promotors des Methylguanin-DNA-Methyltransferase (MGMT)-Gens, ebenfalls ein DNA-Reparaturgen. Hierdurch entstehen allerdings mikrosatellitenstabile bzw. MSI-L-Karzinome.
P Karzinome, die über die klassische Adenom-Karzinom-Sequenz entstehen, sind molekularpathologisch durch eine chromosomale Instabilität (CIN) gekennzeichnet.
Abb. 1
P MSI-Tumoren mit immunhisto-chemischem Verlust von MLH1 müssen hinsichtlich eines zugrunde liegenden HNPCC weiter untersucht werden. Bei zusätzlichem Nachweis einer BRAF-Mutation ist eine Entstehung über den serratierten „Pathway“ gesichert.

6
Beim sogenannten alternativen serratierten „Pathway“, der vermutlich für die Karzinom-entstehung aus TSA verantwortlich ist, steht eine KRAS-Mutation zu Beginn der Kar-zinogenese. Diese führt zu einer deutlich geringeren Methylierung (CIMP-L). Durch das Ausschalten des MGMT-Promotors kommt es im Verlauf zur Karzinomentstehung. Diese Karzinome sind molekularpathologisch durch eine KRAS-Mutation, CIMP-L und MSS bzw. MSI-L gekennzeichnet.
Die Kenntnis der unterschiedlichen Karzinogenesewege ist zur Prognoseabschätzung wichtig. In einer Studie von Mäkinen et al. [7] lag die kumulative 5-Jahres-Überlebens-rate von Patienten mit proximalem serratiertem KRK bei über 70%, bei Patienten mit distalem serratiertem KRK jedoch nur bei < 30%. Gerade die distalen serratierten KRK sind meist MSI-L oder MSS und zeigten gegenüber nicht-serratierten KRK einen schlechteren Verlauf.
Endoskopie/Nachsorge
Die endoskopische Detektion serratierter Läsionen ist durch ihre besonderen Charak-teristika zum Teil erschwert. SSA wachsen flach, ihre Schleimhaut selbst ist eher blass aufgrund einer geringeren Vaskularisierung im Vergleich zu konventionellen Adenomen und ähnelt dadurch der umliegenden Schleimhaut. Die Grenzen des SSA lassen sich oft nicht genau definieren. Erschwerend kommt noch hinzu, dass SSA aufgrund ver-mehrter Muzinbildung häufig eine durch Gallensäuren gefärbte gelbe Schleimkappe tragen. Zudem befinden sich die SSA oft im proximalen Kolon. Zur Verbesserung der endoskopischen Detektion serratierter Läsionen wurden mehrere Verfahren getestet. Während der Einsatz von NBI („narrow band imaging“) keine statistisch signifikante Bes-serung der Detektionsrate erbrachte [9, 10], konnte diese mithilfe der Chromoendosko-pie (mit Indigokarmin) in einer Studie von 29,5% auf 46,2% gesteigert werden [8]. Dies mag daran liegen, dass beim NBI v. a. Veränderungen oberflächlicher Gefäße besser sicht-bar werden, während die SSA eher weniger ausgeprägt vaskularisiert sind (s. Abb. 2). Un-abhängige Faktoren für einen höheren endoskopischen Nachweis serratierter Läsio-nen sind eine vollständige Koloskopie mit Intubation des Zökalpols, die ausreichende Rückzugszeit und ein erfahrener Untersucher [6, 12]. Eine suffiziente Vorbereitung er-scheint im Gegensatz zu den konventionellen Adenomen bei den serratierten Läsio-nen keinen so großen Einfluss zu haben [11]. Alle endoskopisch endeckten serratierten Läsionen sollten komplett entfernt werden. Im Rektum, wo sich hauptsächlich HP be-finden, können diese, wenn kleiner als 5 mm, belassen werden.
Kleines SSA mit Weißlicht-Endoskopie und im Vergleich mit NBI
P Charakteristisch für die serratierte Karzinogenese ist das Vorhandensein einer CpG-Insel-Hypermethylierung (CIMP).
Abb. 2

7
Untersuchungsintervalle nach kompletter Abtragung sind in Tabelle 3 angegeben. Die kürzeren Untersuchungsintervalle beim SSA/TSA kommen zustande, weil Intervallkar-zinome häufig im rechten Kolon lokalisiert und viermal so häufig mikrosatelliteninstabil und/oder hypermethyliert (CIMP-H) sind [13, 14]. Die Progression serratierter Adenome zum Karzinom kann schneller ablaufen als in der klassischen Adenom-Karzinom-Se-quenz, was einen Teil der Intervallkarzinome erklärt. In einer Arbeit konnte kasuistisch eine Progression eines SSA zum Karzinom im Verlauf von nur 8 Monaten gezeigt werden [15], während andere Untersuchungen eher einen langsameren Progress zum Karzinom vermuten lassen [3]. Möglicherweise ist die höhere Rate der Intervallkarzinome, die über den serratierten „Pathway“ entstanden sind, auch mit der niedrigeren Detektionsrate und der häufiger inkompletten Abtragung serratierter Adenome zu begründen [16].
Kontrollintervalle (modifiziert nach den amerikanischen Empfehlungen der NIH [28])
Histologie Größe Anzahl Lokalisation Kontrollintervall in Jahren
HP < 10 mm Egal* Rektosigmoid 10
HP ≤ 5 mm ≤ 3 Proximal des Sigmas 10
HP Egal ≥ 4 Proximal des Sigmas 5
HP > 5 mm ≥ 1 Proximal des Sigmas 5
SSA/TSA < 10 mm < 3 Gesamtes Kolorektum 5
SSA/TSA ≥ 10 mm 1 Gesamtes Kolorektum 3
SSA/TSA < 10 mm ≥ 3 Gesamtes Kolorektum 3
SSA/TSA ≥ 10 mm ≥ 2 Gesamtes Kolorektum 1–3
SSA/TSA mit Dysplasie Egal Egal Gesamtes Kolorektum 1–3
* > 20 erfüllen die Kriterien eines SPS
Serratiertes Polyposis-Syndrom (SPS)(Synonyme: hyperplastisches Polyposis-Syndrom/Jass-Syndrom)
Das serratierte Polyposis-Syndrom (SPS) ist ein seltenes, bisher schlecht definiertes Krankheitsbild, über dessen genetische Grundlagen noch wenig bekannt ist. Die Inzi-denz wird mit 1 pro 100.000 Einwohner angegeben [17], allerdings zeigten neuere Stu-dien bei Patienten mit positivem fäkalem okkultem Bluttest (FOBT) eine deutlich höhere Inzidenz (1:294 bzw. 1:151) [18, 19].
Das mittlere Alter bei Diagnosestellung liegt zwischen 45 und 60 Jahren. Als diagnos-tische Kriterien (WHO) gelten derzeit viele (> 20) oder große HP (mindestens 2 von 5 Polypen > 1 cm) oberhalb des Sigmas. Ein weiteres Kriterium ist der Nachweis einer serratierten Polyposis bei einem Verwandten ersten Grades (s. Tab. 4). Patienten mit SPS haben ein Lebenszeitrisiko von ca. 35–50% an einem KRK zu erkranken [20]. Häufig ist das SPS mit synchronen Adenomen (ca. 70%) assoziiert [21]. Im Gegensatz zum HNPCC ist keine Erhöhung extraintestinaler Tumoren beschrieben.
Tab. 3

8
Klinische Kriterien der WHO zur Identifikation eines SPS
1. Mindestens 5 serratierte Läsionen proximal des Sigmas, von denen 2 größer als 10 mm sind
oder
2. serratierte Läsionen, egal welcher Anzahl, proximal des Sigmas bei einem Individuum, das Verwandter ersten Grades einer Person mit SPS ist
oder
3. mehr als 20 serratierte Läsionen, egal welcher Lokalisation, im gesamten Kolon verteilt.
Die genetischen Ursachen des SPS sind bis heute unbekannt. Hinweise auf einen klar dominanten oder rezessiven Erbgang ergeben sich nicht. Differenzialdiagnostisch kann eine MUTYH-assoziierte Polyposis (MAP) in Betracht gezogen werden. Bei der auto-somal-rezessiv vererbten MAP liegen typischerweise zwar konventionelle Adenome vor, aber biallelische MUTYH-Keimbahnmutationen führen zu somatischen G:C-zu-A:T-Trans-versionen in APC und KRAS. Hierdurch können vermehrt KRAS-mutierte serratierte Poly-pen auftreten, ähnlich wie beim SPS [22].
Aufgrund eines erhöhten KRK-Risikos bedürfen Patienten mit SPS einer engmaschigen endoskopischen Vorsorge. Zunächst sollten, wenn möglich, alle Polypen endoskopisch reseziert werden. Bei ausgeprägtem Befall ist dies oft nur in mehreren Untersuchungs-schritten machbar [23]. Anschließend ist eine jährliche endoskopische Vorsorge zu emp-fehlen [24]. Sollte bereits initial ein KRK nachgewiesen sein, ist eine totale Kolektomie mit anschließender endoskopischer Kontrolle des Rektums alle 6–12 Monate ratsam. Bei Verwandten ersten Grades sollte eine Vorsorgekoloskopie mit 40 Jahren bzw. 10 Jahre vor der jüngsten Erstdiagnose durchgeführt werden und anschließend in einem Inter-vall von 5 Jahren bzw. entsprechend dem Polypenbefund früher.
Glossar
CIMP engl. CpG island methylator phenotypeCIN Chromosomale InstabilitätFOBT Fäkaler okkulter Bluttest GCHP Becherzellreicher hyperplastischer Polyp
(engl. goblet cell-rich hyperplastic polyp)HNPCC Hereditäres nicht-polypöses kolorektales KarzinomHP Hyperplastischer PolypIEN Intraepitheliale NeoplasieKRK Kolorektales KarzinomMAP MUTYH-assoziierte Polyposis MAPK engl. mitogen-activated protein kinaseMGMT O-6-Methylguanin-DNA-MethyltransferaseMMR Missmatch-ReparaturgenMPHP Muzinarmer hyperplastischer PolypMSI-H Mikrosatelliteninstabilität hoch (high)MSI-L Mikrosatelliteninstabilität niedrig (low)MSS MikrosatellitenstabilitätMVHP Mikrovesikulärer hyperplastischer PolypNBI engl. narrow band imagingSPS Serratiertes Polyposis-SyndromSSA Sessiles serratiertes AdenomTSA Traditionelles serratiertes AdenomUICC frz. Union Internationale Contre le CancerWHO Weltgesundheitsorganisation (engl. World Health Organization)
InteressenkonfliktDer Autor erklärt, dass kein Interessenkonflikt besteht.
Tab. 4
P Die genetischen Grundlagen des SPS sind unbekannt. Die klinischen Diagnosekriterien sind arbiträr.

9
Zu empfehlende Literatur
1 Torlakovic E, Snover DC. Serrated adenomatous polyposis in humans. Gastroenterology. 1996;110(3):748–55.
2 Snover DC. Update on the serrated pathway to colorectal carcinoma. Hum Pathol. 2011;42(1):1–10.
3 Lash RH, Genta RM, Schuler CM. Sessile serrated adenomas: prevalence of dysplasia and carcinoma in 2139 patients. J Clin Pathol. 2010;63(8):681–6.
4 Khalid O, Radaideh S, Cummings OW, O’Brien MJ, Goldblum JR, Rex DK. Reinterpretation of histology of proximal colon polyps called hyperplastic in 2001. World J Gastroenterol. 2009;15(30):3767–70.
5 Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell. 1990;61(5):759–67.
6 Kahi CJ, Hewett DG, Rex DK. Relationship of non-polypoid colorectal neoplasms to quality of colonoscopy. Gastrointest Endosc Clin N Am. 2010;20(3):407–15.
7 Mäkinen MJ. Colorectal serrated adenocarcinoma. Histopathology. 2007;50(1):131–50.
8 Pohl J, Schneider A, Vogell H, Mayer G, Kaiser G, Ell C. Pancolonic chromoendoscopy with indigo carmine versus standard colonoscopy for detection of neoplastic lesions: a randomised two-centre trial. Gut. 2011;60(4):485–90.
9 Adler A, Pohl H, Papanikolaou IS, Abou-Rebyeh H, Schachschal G, Veltzke-Schlieker W, et al. A prospective randomised study on narrow-band imaging versus conventional colonoscopy for adenoma detection: does narrow-band imaging induce a learning effect? Gut. 2008;57(1):59–64.
10 Hazewinkel Y, Tytgat KM, van Leerdam ME, Koornstra JJ, Bastiaansen BA, van Eeden S, et al. Narrow-band imaging for the detection of polyps in patients with serrated polyposis syndrome: a multicenter, randomized, back-to-back trial. Gastrointest Endosc. 2015;81(3):531–8.
11 de Wijkerslooth TR, Stoop EM, Bossuyt PM, Tytgat KM, Dees J, Mathus-Vliegen EM, et al. Differences in proximal serrated polyp detection among endoscopists are associated with variability in withdrawal time. Gastrointest Endosc. 2013;77(4):617–23.
12 Kahi CJ, Hewett DG, Norton DL, Eckert GJ, Rex DK. Prevalence and variable detection of proximal colon serrated polyps during screening colonoscopy. Clin Gastroenterol Hepatol. 2011;9(1):42–6.
13 Sawhney MS, Farrar WD, Gudiseva S, Nelson DB, Lederle FA, Rector TS, et al. Microsatellite instability in interval colon cancers. Gastroenterology. 2006;131(6):1700–5.
Literatur

10
14 Arain MA, Sawhney M, Sheikh S, Anway R, Thyagarajan B, Bond JH, et al. CIMP status of interval colon cancers: another piece to the puzzle. Am J Gastroenterol. 2010;105(5):1189–95.
15 Oono Y, Fu K, Nakamura H, Iriguchi Y, Yamamura A, Tomino Y, et al. Progression of a sessile serrated adenoma to an early invasive cancer within 8 months. Dig Dis Sci. 2009;54(4):906–9.
16 Pohl H, Srivastava A, Bensen SP, Anderson P, Rothstein RI, Gordon SR, et al. Incomplete polyp resection during colonoscopy-results of the complete adenoma resection (CARE) study. Gastroenterology. 2013;144(1):74–80.
17 Regula J, Rupinski M, Kraszewska E, Polkowski M, Pachlewski J, Orlowska J, et al. Colonoscopy in colorectal-cancer screening for detection of advanced neoplasia. N Engl J Med. 2006;355(18):1863–72.
18 Moreira L, Pellisé M, Carballal S, Bessa X, Ocaña T, Serradesanferm A, et al. High prevalence of serrated polyposis syndrome in FIT-based colorectal cancer screening programmes. Gut. 2013;62(3):476–7.
19 Biswas S, Ellis AJ, Guy R, Savage H, Madronal K, East JE. High prevalence of hyperplastic polyposis syndrome (serrated polyposis) in the NHS bowel cancer screening programme. Gut. 2013;62(3):475.
20 Boparai KS, Reitsma JB, Lemmens V, van Os TA, Mathus-Vliegen EM, Koornstra JJ, et al. Increased colorectal cancer risk in first-degree relatives of patients with hyperplastic polyposis syndrome. Gut. 2010;59(9):1222–5.
21 Boparai KS, Mathus-Vliegen EM, Koornstra JJ, Nagengast FM, van Leerdam M, van Noesel CJ, et al. Increased colorectal cancer risk during follow-up in patients with hyperplastic polyposis syndrome: a multicentre cohort study. Gut. 2010;59(8):1094–100.
22 Boparai KS, Dekker E, Van Eeden S, Polak MM, Bartelsman JF, Mathus-Vliegen EM, et al. Hyperplastic polyps and sessile serrated adenomas as a phenotypic expression of MYH-associated polyposis. Gastroenterology. 2008;135(6):2014–8.
23 Knabe M, Behrens A, Ell C, Tannapfel A, Pohl J. Endoscopic management for patients with serrated polyposis syndrome is feasible and effective: a prospective observational study at a tertiary centre. Z Gastroenterol. 2014;52(8):802–6.
24 Hazewinkel Y, Tytgat KM, van Eeden S, Bastiaansen B, Tanis PJ, Boparai KS, et al. Incidence of colonic neoplasia in patients with serrated polyposis syndrome who undergo annual endoscopic surveillance. Gastroenterology. 2014;147(1):88–95.
25 Nusko G, Mansmann U, Partzsch U, Altendorf-Hofmann A, Groitl H, Wittekind C, et al. Invasive carcinoma in colorectal adenomas: multivariate analysis of patient and adenoma characteristics. Endoscopy. 1997;29(7):626–31.
Literatur

11
26 Abdeljawad K, Vemulapalli KC, Kahi CJ, Cummings OW, Snover DC, Rex DK. Sessile serrated polyp prevalence determined by a colonoscopist with a high lesion detection rate and an experienced pathologist. Gastrointest Endosc. 2015;81(3):517–24.
27 Baretton GB, Autschbach F, Baldus S, Bläker H, Faller G, Koch HK, et al. [Histopathological diagnosis and differential diagnosis of colorectal serrated polys: findings of a consensus conference of the working group “gastroenterological pathology of the German Society of Pathology”]. Pathologe. 2011;32(1):76–82.
28 Rex DK, Ahnen DJ, Baron JA, Batts KP, Burke CA, Burt RW, et al. Serrated lesions of the colorectum: review and recommendations from an expert panel. Am J Gastroenterol. 2012;107(9):1315–29.
29 Bettington M, Walker N, Clouston A, Brown I, Leggett B, Whitehall V. The serrated pathway to colorectal carcinoma: current concepts and challenges. Histopathology. 2013;62(3):367–86.
Literatur

12
Bitte beachten Sie:Bei der Beantwortung der Fragen ist immer nur 1 Antwort möglich.
Die Beantwortung der Fragen und Erlangung des Fortbildungszertifikats ist nur online möglich. Bitte gehen Sie dazu auf unsere Homepage www.falkfoundation.de. Unter dem Menüpunkt Falk Gastro-Kolleg können Sie sich anmelden und die Fragen beantworten. Bitte diesen Fragebogen nicht per Post oder Fax schicken!
Wichtig:Fragebeantwortung unter
www.falkfoundation.de
Falk Gastro-Kolleg
Falk Gastro-Kolleg
Darm
Fragen zu serratierten Läsionen des Kolons
Frage 1:Welche Aussage zur Epidemiologie des kolorektalen Karzinoms (KRK) trifft zu?
EE Das KRK ist in Deutschland sowohl bei Frauen als auch bei Männern die dritt-häufigste Krebserkrankung
EE Intervallkarzinome treten extrem selten auf (< 0,01%)EE KRK entstehen zu über 50% aufgrund einer familiären BelastungEE Kleinere hyperplastische Polypen im Rektum haben kein Risiko einer malignen
EntartungEE Das häufigste zum KRK führende Polyposis-Syndrom ist das serratierte
Polyposis-Syndrom
Frage 2:Welcher Kolonpolyp gehört nicht zu den serratierten Läsionen?
EE Hyperplastischer Polyp (HP)EE Sessiles serratiertes Adenom (SSA)EE Traditionelles serratiertes Adenom (TSA)EE Sessiles villöses AdenomEE Mikrovesikulärer hyperplastischer Polyp (MVHP)
Frage 3:Welcher Anteil an KRK entsteht über den serratierten „Pathway“?
EE 5–10%EE < 1%EE > 90%EE 20–30%EE 60–80%
Frage 4:Welche klinische bzw. pathologische Eigenschaft des SSA stimmt nicht?
EE Es ist häufig im proximalen Kolon lokalisiertEE Häufig kann eine BRAF-Mutation nachgewiesen werdenEE Es ist der häufigste KolonpolypEE Es ist meist größer als 5 mmEE Histologisch sind häufig basale Kryptenverzweigungen nachweisbar
Frage :Welche Aussage zum TSA trifft zu?
EE Es ist die häufigste serratierte Läsion im KolonEE Es kann auch gestielt vorkommenEE Intraepitheliale Dysplasien finden sich in der Regel nichtEE Eine BRAF-Mutation ist häufiger als eine KRAS-Mutation nachweisbarEE Histologisch ist die Serratierung häufig nicht sehr ausgeprägt

13
Falk Gastro-Kolleg
Darm
Frage 6:Welches Kriterium spielt bei der Definition der serratierten Polyposis keine Rolle?
EE Positive FamilienanamneseEE Anzahl der serratierten LäsionenEE Größe der serratierten LäsionenEE Lokalisation serratierter LäsionenEE Nachweis einer typischen Mutation im APC-Gen
Frage 7:Welche Antwort ist richtig? Nach der kompletten Abtragung eines ca. 2 cm großen SSA ohne Dysplasiezeichen im Colon ascendens ist eine erneute endoskopische Kontrolle empfohlen in
EE 3 JahrenEE 10 JahrenEE 5 JahrenEE Keine Kontrolle notwendigEE 2–6 Monaten
Frage 8:Welches endoskopische Verfahren ist am besten für den Nachweis serratierter Läsionen im Kolon geeignet?
EE NBI („narrow band imaging“)EE ChromoendoskopieEE EndosonografieEE Konfokale EndomikroskopieEE HD-Endoskopie
Frage 9:Welche endoskopische Eigenschaft serratierter Läsionen trifft zu?
EE SSA können meist gut von der Umgebung abgegrenzt werdenEE SSA sind endoskopisch nicht resezierbarEE SSA haben aufgrund der starken Vaskularisierung eine rötliche OberflächeEE Häufig ist bei SSA endoskopisch eine Schleimkappe nachweisbarEE HP befinden sich am häufigsten im proximalen Kolon
Frage 10:Welche Aussage trifft zu? Verwandte ersten Grades eines Patienten mit SPS
EE haben kein erhöhtes KRK-RisikoEE entwickeln etwa dreimal so häufig Tumoren der harnableitenden Organe
(Harnblase, Niere) als die NormalbevölkerungEE können als Träger des Syndroms durch eine Genanalyse der MMR-Enzyme
(MLH1, MSH2, MSH6, PMS2) getestet werdenEE haben aufgrund der autosomal-dominanten Vererbung zu 50% das Risiko selbst
Träger zu seinEE sollten mit einer endoskopischen Vorsorge mit spätestens 40 Jahren bzw. 10 Jahre
vor der Erstdiagnose des erkrankten Verwandten beginnen
![BACHELORARBEIT - MOnAMi | MOnAMi · gelbe Plaques (Pseudomembranen) [Younus and Steigbigel, 2004] ..... 18 Abbildung 6: Röntgenaufnahme des Abdomens: Dilatation des Kolons [Schunter](https://static.fdokument.com/doc/165x107/5f88be48657f5364e8392766/bachelorarbeit-monami-monami-gelbe-plaques-pseudomembranen-younus-and-steigbigel.jpg)